基因工程期末复习
基因工程期末复习总结

一、单选1、第一个实现DNA重组的实验:1972年,美国斯坦福大学医学中心的P.Berg在世界上第一次成功地实现了DNA的体外重组。
2、第一次实现重组体转化成功的实验:1973年,科恩(Coher)和博耶(Boyer)建立的基因工程基本模式。
3、基因工程研究的主要内容:切接转增检。
4、基因工程研究的基本要素:基因、工具酶、载体、受体细胞。
5、DNA在生物体内的存在状态:染色体DNA、病毒DNA(噬菌体DNA)、质粒DNA、线粒体DNA和叶绿体DNA,有的以线型存在,有的以环状存在。
6、天然DNA提取的步骤:生物材料的准备、裂解细胞、分离抽提DNA。
7、DNA的分离抽提法:酚-氯仿抽提法(常用、经典)。
8、DNA的保存:温度越低越好,同等条件下,温度越低越不容易降解。
9、为了消除在制备RNA过程中RNA酶的污染,应用0.1% DEPC处理过的水配制试剂。
10、人工合成DNA片段的方法有化学合成法和聚合酶链式反应扩增法。
11、紫外分光光度法检测核酸样品的纯度(常用),纯净的核酸溶液的0D260/OD280值应为 1.7~2.0,0D260/OD230值应大于 2.0,如果0D260/OD280小于1.7,可能有蛋白质污染,如果0D260/OD280大于2.0或0D260/OD230小于2.0时,核酸溶液中可能存在其他干扰物质。
12、工具酶就其用途而言可分为三大类:限制性内切酶、连接酶和修饰酶。
13、14、通常提到的限制性核酸内切酶主要指Ⅱ类酶而言,限制性核酸内切酶的命名:属名+种名。
例如:B acillus am ylolique faciens H、H aemophilus in fluenzae dⅠ→Bam H、Hind15、限制性内切核酸酶的本质:细菌细胞的限制—修饰系统。
17、常用的酶切方法:单酶切、双酶切和部分酶切。
18、承载外源DNA的大小排序:质粒(<20kb)<噬菌体(20-30kb)<cosmid载体(40-50kb)<人工染色体载体(100-1000kb)。
基因工程期末试题及答案

基因工程期末试题及答案一、选择题(每题2分,共20分)1. 基因工程是指利用现代生物技术手段对DNA进行操作和控制的一种技术。
2. 基因工程的主要方法包括基因克隆、PCR、DNA测序等。
3. DNA测序是通过测定DNA序列来确定一个基因的具体结构。
4. 在基因工程中,限制性内切酶用于切割DNA分子,产生特定片段。
5. 基因工程可以产生转基因生物,通过对生物基因进行改造,使其具有特定的特性。
6. CRISPR/Cas9是一种常用的基因编辑工具,可以精确地修改基因组中的特定片段。
7. 基因工程在医学领域可以用于基因治疗,通过修复或替换异常基因,治疗遗传性疾病。
8. 在农业领域,基因工程可以用于改良作物,提高产量和抗病虫害能力。
9. PCR是一种常用的基因扩增技术,可以通过复制DNA片段来放大特定基因。
10. DNA梯度离心是基因工程中常用的分离DNA片段的方法。
二、问答题(每题10分,共30分)1. 请简要介绍基因工程的基本原理和主要方法。
基因工程的基本原理是通过对DNA进行操作和控制来改变生物的遗传性状。
其主要方法包括基因克隆、PCR、DNA测序等。
基因克隆是通过将特定DNA片段放入载体中,然后转化到宿主细胞中,使重组DNA在宿主细胞中大量复制。
PCR是一种基因扩增技术,通过在DNA复制过程中加入特定引物,使特定基因片段在体外大量扩增。
DNA测序是通过测定DNA序列来确定一个基因的具体结构。
2. 什么是转基因生物?请举例说明。
转基因生物是指经过基因工程改造,将外源基因导入到目标生物体中,使其具有新的遗传性状的生物。
例如,将耐旱基因导入水稻,使其具有抗旱能力;将Bt毒素基因导入棉花,使其具有抗虫能力。
3. 基因工程在医学领域有哪些应用?举例说明。
基因工程在医学领域可以用于基因治疗、疫苗研发等。
例如,利用基因工程技术可以修复或替换患者体内异常基因,治疗遗传性疾病。
另外,基因工程也可以用于疫苗研发,通过基因工程技术将病原体的基因导入宿主细胞,产生病原体的抗原蛋白,从而刺激免疫系统产生抗体,用于预防传染病。
基因工程期末考试试题及答案

基因工程期末考试试题及答案一、选择题1. 基因工程是指:A. 基因的自然突变B. 基因的人工重组C. 基因的自然选择D. 基因的自然淘汰答案:B2. 下列哪项不是基因工程常用的工具酶?A. 限制性内切酶B. DNA连接酶C. 反转录酶D. 聚合酶链反应酶答案:C3. 基因枪技术主要用于:A. 植物基因转化B. 动物基因转化C. 微生物基因转化D. 病毒基因转化答案:A二、填空题1. 基因工程中,常用的载体有________、________和________。
答案:质粒、病毒、人工染色体2. 基因工程中,________是基因表达的调控元件。
答案:启动子三、简答题1. 请简述基因工程的基本步骤。
答案:基因工程的基本步骤包括:目标基因的获取、目标基因与载体的连接、转化宿主细胞、筛选含有重组DNA的宿主细胞、目的基因的表达和检测。
2. 基因工程在医学领域的应用有哪些?答案:基因工程在医学领域的应用包括:生产重组蛋白质药物、基因治疗、疾病诊断、疫苗开发等。
四、论述题1. 论述基因工程对农业生产的影响。
答案:基因工程对农业生产的影响主要体现在以下几个方面:提高作物的抗病虫能力、增强作物的抗逆性、改善作物的营养价值、提高作物的产量和质量、促进农业可持续发展。
2. 基因工程在环境保护中的应用。
答案:基因工程在环境保护中的应用主要包括:开发生物修复技术,用于污染土壤和水体的净化;利用基因工程改造微生物,用于处理工业废水和废气;通过基因工程改良植物,用于重金属污染土壤的修复等。
五、案例分析题1. 某公司利用基因工程技术成功开发了一种抗虫棉,该抗虫棉能够减少农药的使用,降低农业生产成本。
请分析该技术可能带来的社会、经济和环境效益。
答案:该技术可能带来的社会效益包括提高农民的生活质量,减少因农药使用带来的健康风险。
经济效益包括降低农药成本,提高作物产量,增加农民收入。
环境效益包括减少农药对环境的污染,保护生态平衡,促进农业的可持续发展。
基因工程复习资料(已修改)

基因工程复习资料(已修改)基因工程复习资料一、基因工程:概念:基因工程是指采用类似于工程设计的方法,根据人们事先设计的蓝图,人为地在体外将外源目的基因插入质粒、病毒或其他载体中,构成遗传物质的新组合即重组载体DNA分子,并将这种含有目的基因的重组载体分子转移到原先没有这类目的基因的受体细胞中去扩增和表达,从而使受体或受体细胞获得新的遗传特性,或形成新的基因产物。
基本流程:(1)目的基因的分离、获取与制备(2)目的基因与载体连接构建成为重组载体分子(3)重组DNA分子导入到受体细胞(4)外源目的基因阳性克隆的鉴定和筛选(5)外源目的基因的表达二、基因工程的发展简史1、基因工程诞生的背景:(1)发现了生物的遗传物质DNA而不是蛋白质。
(2)明确了DNA的双螺旋结构和半保留复制机制。
(3)遗传密码子的破译。
2、技术上的三大发明:(1)利用限制性核酸内切酶和DNA连接酶体外切割和连接DNA 片段。
(2)质粒改造成载体以携带DNA片段克隆。
(3)逆转录酶的使用打开真核生物基因工程的一条道路。
3、基因工程的诞生标志(P4)三、工具酶1、限制性核酸内切酶常见的类型:BamHⅠ、EcoRⅠ、HindⅢ、HindⅡ、PstⅠ、SalⅠ、SamⅠ。
2、DNA连接酶常用的类型:大肠杆菌连接酶和T4噬菌体DNA连接酶。
3、DNA聚合酶类4、碱性磷酸酶5、末端脱氧核苷酸转移酶6、其他工具酶四、限制性核酸内切酶依来源分类1、同位酶:即识别相同的序列但切割位点不一样。
2、同尾酶:即识别位点不同但切出的DNA片段具有相同的末端序列。
3、同裂酶:即识别位点和切割位点均相同的酶。
五、影响限制性核酸内切酶酶切的反应条件1、温度:大部分限制性核酸内切酶最适反应温度为37°C,但也有例外,如SamⅠ的反应温度为25°C.降低最适反应温度,会导致只产生切口,而不是切断双链DNA。
2、盐离子浓度:不同的限制性核酸内切酶对盐离子强度有不同的要求,一般按离子浓度不同分为低(0mmol/L)、中(50mmol/L)、高盐(100mmol/L)三类。
基因工程期末考试题及答案

基因工程期末考试题及答案一、选择题(每题2分,共20分)1. 基因工程中常用的工具酶是:A. 纤维素酶B. 限制性内切酶C. 淀粉酶D. 过氧化氢酶答案:B2. 下列哪项不是基因工程的基本步骤?A. 目的基因的获取B. 基因的表达C. 基因的克隆D. 基因的测序答案:D3. 基因枪法是一种:A. 植物转基因方法B. 动物转基因方法C. 微生物转基因方法D. 所有生物的转基因方法答案:A4. 重组DNA技术中,通常使用哪种质粒作为载体?A. 质粒DNAB. 线粒体DNAC. 核糖体RNAD. 染色体DNA答案:A5. 基因工程中,目的基因的表达通常需要:A. 启动子B. 终止子C. 增强子D. 所有选项答案:D二、填空题(每空2分,共20分)1. 基因工程是指按照人们的意愿,将不同来源的基因在体外构建杂合DNA分子,然后导入到活细胞和生物体内,以改变生物的遗传特性并取得新品种或新产品。
2. 基因工程中常用的宿主细胞有大肠杆菌、酵母菌和________。
答案:哺乳动物细胞3. 基因工程中,________是连接目的基因和载体DNA的关键酶。
答案:DNA连接酶4. 目的基因的表达需要________和________的协同作用。
答案:启动子;终止子5. 基因工程产品在医学领域的应用包括生产________、________和基因治疗等。
答案:重组蛋白;单克隆抗体三、简答题(每题10分,共30分)1. 请简述基因工程在农业中的应用。
答案:基因工程在农业中的应用主要包括提高作物的抗病性、抗虫性、抗旱性和提高作物的产量和品质。
例如,通过基因工程培育的抗虫棉可以减少农药的使用,提高棉花的产量和质量。
2. 基因工程在医学领域有哪些应用?答案:基因工程在医学领域的应用包括生产重组蛋白药物、单克隆抗体、基因治疗和疫苗开发等。
例如,利用基因工程技术生产的胰岛素可以治疗糖尿病,单克隆抗体用于治疗癌症和自身免疫性疾病。
3. 请解释什么是转基因生物,并简述其潜在的风险。
第3章 基因工程 期末复习知识点总结【新教材】人教版高中生物选择性必修三

第3章基因工程1、什么是基因工程:基因工程是指按照人们的愿望,进行严格的设计,通过体外DNA重组和转基因技术,赋予生物以新的遗传特性,创造出更符合人们需要的新的生物类型和生物产品。
基因工程是在DNA分子水平上进行设计和施工的,又叫做DNA重组技术。
2、基因工程的诞生(三个理论和三个技术):基因工程是在生物化学、分子生物学和微生物学等学科基础上发展起来的,正是这些学科的基础理论和相关技术的发展催生了基因工程,具体有三大理论发现和三个技术突破。
1)理论基础:DNA是遗传物质;DNA分子的双螺旋结构和半保留复制;遗传密码的通用性和遗传信息传递的方式;2)技术基础:限制性核酸内切酶的发现与DNA的切割;DNA连接酶的发现与DNA片段的连接;基因工程载体的构建与应用●理论上的三大发现⑴、发现了遗传物质——DNA1944年,艾弗里(O.T.Avery)的肺炎双球菌转化实验⑵、揭示了遗传物质的分子机制:DNA分子的双螺旋结构和半保留复制1953年,沃森(J.D.Watson)和克里克(F.Crick)的DNA双螺旋结构模型、半保留复制图,获1958年诺贝尔奖。
⑶、确立了遗传信息的传递方式:以密码形式传递1963年,美国尼伦伯格(M.W.Nirenberg)和马太(H.Matthaei)确立了遗传信息以密码形式传递,破译了编码氨基酸的遗传密码(3个核苷酸=1个密码子=1个aa)。
●技术上的三大突破⑴、世界上第一个重组DNA实验:实现不同来源DNA的体外重组1972年斯坦福大学化学家伯格(P.Berg)借助内切酶和连接酶将猴病毒SV40的DNA 和大肠杆菌λ噬菌体的DNA在试管中连接在了一起,第一次成功地实现了DNA的体外重组。
⑵、第一个基因克隆实验:重组DNA表达实验,是世界上第一个基因工程实验1973年美国斯坦福大学医学院遗传学家科恩(S.Cohen)将体外构建的含有四环素和卡那霉素抗性基因的重组质粒导入大肠杆菌,获得了具有双抗性的大肠杆菌转化子,成功完成了第一个基因克隆实验。
基因工程期末复习资料

基因工程第一章:1.基因工程:在分子水平上进行的遗传操作,指将一种或多种生物体的基因或基因组提取出来,或者人工合成的基因,按照人们的愿望进行严密的设计,经过体外加工重组,转移到另一种生物体的细胞内,使之能在受体细胞遗传并获得新的遗传性状的技术。
供体、受体、载体是重组DNA技术的三大基本元件。
(工具酶也是必备元件)基本用途:大规模生产生物活性物质,设计、构建生物的新性状甚至新物种。
2.基因工程研究的主要内容:目的基因的分离与制备,DNA片段和载体的连接,外源DNA 片段引入受体细胞,选择目的基因,目的基因表达。
3.基因工程的意义:大规模生产生物分子,设计构建新物种,搜寻、分离和鉴定生物体。
发展前景:农林牧渔业中的应用,工业中的应用,在医学中的应用。
第二章:(结合课本划线内容)1.限制性核酸内切酶的发现及其生物功能:识别双链DNA分子中的特定序列,并切割DNA 双链,主要存在于原核细菌中,帮助细菌限制外来DNA的入侵;(发现的现象:寄主细胞的限制和修饰作用。
)hsd R:编码限制性核酸内切酶,hsd M:编码限制性甲基化酶,hsd S:编码限制性酶和甲基化酶的协同表达。
(限制核酸内切酶类型:I型,II型,III型;)2.属名种名株名Haemophilus influenzae d 嗜血流感杆菌d株先后分离出3种限制酶:HindI HindII HindIII,EcoRI在抗药性R质粒上发现的第一个酶。
同尾酶:识别不同的序列,能产生相同的黏性末端的酶;同位酶:不同微生物来源的酶,能识别相同的序列,切割方式相同或不相同。
3.II型限制性核酸内切酶的切割方式:在识别序列的对称轴上同时切割形成平末端如EcoRV;在识别序列的双侧末端进行切割,若于对称轴5‘端突出的末端如EcoRI;反之产生3’端突出的末端如PstI。
限制性核酸内切酶反应的注意事项:限制性核酸内切酶为浓缩酶;浓缩的酶液要用核酸内切酶缓冲液稀释,(不能用水稀释,以免酶变性);核酸内切酶在含有50%甘油的缓冲液中,于-20度稳定保存;反应中尽可能少加水,使反应体积减到最小;延长反应时间,使所需酶量减少。
基因工程期末复习题(含答案)

一、填空题1、基因文库的构建通常采用cDNA 法和鸟枪法两种方法。
2 、限制性内切酶识别序列的结构普通为具有 180 度旋转对称的回文结构。
3、DNA 连接酶主要有两种:T4 噬菌体和大肠杆菌 DAN 连接酶。
4、根据质粒在宿主细胞中所含拷贝数的多少,可以把质粒分为两种类型:密切型质粒和松弛型质粒。
5、原核受体细胞通常包括大肠杆菌、枯草芽孢杆菌和蓝细菌。
6、原核生物或者低等真核生物,将外源重组 DNA 导入受体细胞的方法有借助生物载体的转化、转染、转导。
7、对细菌细胞进行转化的关键是细胞处于感受态。
8、基因工程是_____1970’____年代发展起来的遗传学的一个分支学科。
9、部份酶切可采取的措施有:(1)减少酶量; (2)缩短反应时间; (3)增大反应体积等。
10、第一个分离的限制性内切核酸酶是EcoK;而第一个用于构建重组体的限制性内切核酸酶是EcoRl。
11、DNA 聚合酶 I 的 Klenow 大片段是用枯草杆菌蛋白酶切割 DNA 聚合酶I 得到的份子量为 76kDa 的大片段,具有两种酶活性:(1)5'-3'合成酶的活性; (2)3'-5'外切核酸酶的活性。
12、为了防止 DNA 的自身环化,可用_碱性磷酸酶__去双链 DNA_ 5’端的磷酸基团_。
13、测序酶是修饰了的 T7 DNA 聚合酶,它惟独5'-3'合成酶的活性,而没有 3'-5' 外切酶的活性。
14、切口移位(nick translation)法标记 DNA 的基本原理在于利用 DNA 聚合酶 I 的5'一 3'合成酶和 5'一 3'合成酶的作用。
15、欲将某一具有突出单链末端的双链 DNA 份子转变成平末端的双链形式,通常可采用S1 核酸酶切割或者DNA 聚合酶补平。
16、反转录酶除了催化 DNA 的合成外,还具有核酸水解酶 H 的作用,可以将DNA-RNA 杂种双链中的 RNA 水解掉。
基因工程期末复习整理

动物基因工程名词解释:1、体细胞克隆:以体细胞(包括动物成体体细胞、胎儿成纤维细胞等) 为受体,将目的基因以DNA 转染的方式导入能进展传代培养的动物体细胞,再以这些体细胞为核供体,进展动物克隆。
2、显微注射::在显微操作仪下,将DNA用微吸管注射到处于原核时期受精卵的原核中,外源基因在受精卵繁殖过程过DNA复制而整合到基因组,然后将转化后的胚胎移植到受体子宫中继续发育,得到转基因动物。
3、ES细胞:4、基因打靶:是指外源DNA通过与受体细胞染色体DNA上的同源序列之间发生重组, 整合到预定位点, 从而改变细胞遗传特性的方法。
5、基因敲除:将一个结构但功能不祥的基因去除,从DNA水平上设计实验,彻底破坏该基因的功能或消除表达机制,从而推测该基因的生物学功能。
6、乳腺生物反响器:通过转基因技术将外源基因在动物乳腺中高效表达,在乳汁中生产目的产品。
问题:1、常用动物转基因的方法有哪些?比拟优缺点显微注射法、逆转录病毒法、胚胎干细胞法、基因打靶法、精子载体法体、细胞核移植法、磷酸钙共沉淀法。
其中,常用动物转基因的方法有显微注射法、逆转录病毒法、胚胎干细胞介导法。
〔1〕显微注射法的优点:操作技术性很强显微注射法的缺点:设备昂贵,胚胎死亡率高〔2〕逆转录病毒法的优点:操作简便,可大量感染细胞,形成单拷贝,转化率高逆转录病毒法的缺点:没有包装蛋白,不能形成完整的病毒颗粒2、谈谈如何获得转基因小鼠?显微注射法:书118页逆转录病毒法:书123页胚胎干细胞法:书123页3、转基因动物有哪些重要的应用?〔书138-143页〕〔1〕研究基因的结构与功能,了解动物生命现象的在本质〔2〕建立多种疾病的动物模型,研究发病机理与治疗方法〔3〕改善动物生产性能,提高动物育种效率〔4〕作为医用或食用蛋白的生物反响器,可以通过家畜乳腺分泌大量安全、高效、廉价的人体药用蛋白。
4、比拟在细菌、真核细胞和动物个体中表达外源基因的优缺点?动物:优点:目的基因在哺乳动物细胞中表达的蛋白与天然蛋白的结构、糖基化类型和方式几乎一样且能正确组装成多亚基蛋白,哺乳动物细胞能以悬浮培养或在无血清的培养基中达到高密度且培养体积能达到1000L 以上缺点:A、哺乳动物细胞的表达水平低B、高表达细胞株构建复杂C、细胞大规模培养工艺复杂D、哺乳动物细胞生产的蛋白质类药物的本钱较高第三章基因工程常规技术一、名词解释1.klenow fragment:DNA聚合酶被枯草杆菌蛋白酶水解后产生的大片段,具5’ → 3’聚合酶活性和3’ → 5’外切酶活性,是分子生物学中的重要工具。
基因工程复习(含答案)

基因工程复习题一、名词解释: (10~20%)基因工程基因工程工具酶限制性内切酶限制性内切酶得Star活性PCR引物PCR扩增平台期DNA芯片基因组文库cDNA文库转化限制与修饰系统原位杂交: 将细胞或组织得核酸固定保持在原来得位置上, 然后用探针与之杂交得一种核酸分子杂交技术, 该方法可较好地反映目得基因在细胞或组织中得分布与表达变化。
粘性末端: 双链DNA被限制性内切酶切割后, 形成得两条链错开几个碱基, 而不就是平齐得末端。
Northern印迹杂交: 将RNA进行变性电泳后, 再转移到固相支持物上与探针杂交得一种核酸分子杂交技术, 可用于检测目得基因得转录水平。
转位: 一个或一组基因片段从基因组得一个位置转移到另一个位置得现象。
基因工程: 在体外, 用酶学方法将各种来源得DNA与载体DNA连接成为重组DNA, 继而通过转化与筛选得到含有目得基因得宿主细胞, 最后进行扩增得到大量相同重组DNA分子得过程称为基因工程, 又称基因克隆、DNA克隆与重组DNA等。
目得基因:基因工程中, 那些被感兴趣得、被选作研究对象得基因就叫作目得基因。
连接器: 人工合成得一段含有某些酶切位点寡核苷酸片段, 连接到目得基因得两端, 便于基因重组中得切割与连接。
转化: 受体细胞被导入外源DNA并使其生物性状发生改变得过程。
停滞效应: PCR中后期, 随着目得DNA扩展产物逐渐积累, 酶得催化反应趋于饱与, DNA扩增产物得增加减慢, 进入相对稳定状态, 即为停滞效应, 又称平台期。
逆转录PCR: 以mRNA为原始模板进行得PCR反应。
PCR: 即聚合酶链式反应。
在模板, 引物, 4种dNTP与耐热DNA聚合酶存在得条件下, 特异性地扩增位于两段已知序列之间得DNA区段地酶促合成反应。
α-互补(α-complementation):指在M13噬菌体DNA或PUC质粒序列中, 插入了lac 启动子-操纵子基因序列以及编码β-半乳糖苷酶N-端145个氨基酸得核苷酸序列(又称α-肽), 该序列不能产生有活性得β-半乳糖苷酶。
基因工程期末复习资料

一、基因工程的三大关键要素(元件)基因:目的基因(Vs用途,interesting/targetgene)、外源基因(Vs宿主,foreigngene)载体:能将外源基因带入受体细胞,并能维持的DNA分子。
受体:宿主,能摄取外源DNA、并能使其稳定维持的细胞(组织、器官或个体)二、基因工程的基本过程依据定义,基因工程的整个过程由工程菌(细胞)的设计构建和基因产物的生产两大部分组成,基本过程如下:(1)从供体细胞分离出基因组dna。
用限制性核酸内切酶分别将外源dNA(包括外源基因或目的基因)和载体分子切开(简称“切”):(2)用dna连接酶将含有外源基因的DNA片段接到载体分子上,形成dna重组分子(简称“接”)。
(3)借助细胞转化手段将DNA重组分子导人受体细胞中(简称转”)。
(4)短时间培养转化细胞.以扩增dna重组分子或使其整合到受体细胞的基因组中(简称增”)。
(5)筛选和鉴定经转化处理的细胞。
获得外源基因高效稳定表达的基因工程菌或细胞(简称检)由此此可见.基因工程的上游操作过程可简化为;切、接、转、增、检:三、质粒载体pBR322系列有哪些特征?BR322质粒载体优点主要表现在以下几个方面:第一,具有较小的分子量。
pBR322质粒DNA分子为4363bp。
第二,具有两种抗菌素抗性基因可供作转化子的选择记号。
pBR322DNA分子内具有多个限制酶识别位点,外源DNA的插入某些位点会导致抗菌素抗性基因失活,利用质粒DNA编码的抗菌素抗性基因的插入失活效应(图4-15),可以有效的检测重组体质粒。
第三,具较高的拷贝数,通常有大约15个左右的拷贝,在氯霉素存在下,每个细胞中可累积1000~3000个拷贝。
这就为重组DNA的制备提供了极大的方便四、M13系列载体具有哪些优缺点?答:M13克隆系统具有很多优点:(1)克隆的片段大:M13噬菌体的DNA在包装时不受体积的限制,所以容载能力大。
有报道,有些噬菌体颗粒可以包装比野生型丝状噬菌体DNA长6~7倍的DNA(插入片段可达40kb)。
基因工程期末考试复习题

一、名词基因工程(遗传工程)、基因操作、基因分离、DNA重组、Tm值、分子杂交、探针、Southern印迹杂交、Northern印迹杂交、Western印迹杂交、选择标记基因、报告基因、α-互补、转化、受体细胞、转染、转导、复制子、转基因沉默、启动子、增强子、终止子、绝缘子、反义子、SD序列、外显子、内含子、融合蛋白、包涵体、同裂酶、同尾酶、基因组文库、cDNA文库、载体、多克隆位点(MCS)、基因克隆、亚克隆、cosmid、噬菌粒载体、T-DNA、反式作用因子、顺式作用元件、定位整合克隆载体、基因打靶、穿梭载体、基因芯片、基因治疗、SSH、RDA、DDRT-PCR、ESTs、PCR、RT-PCR、反向PCR、巢式PCR、识别位点、限制性核酸内切酶、限制性(物理)图谱、严紧性质粒、松弛型质粒、结合型质粒、非结合型质粒、质粒不亲和性、迁移作用、显性质粒、隐蔽质粒、RNA干扰(RNAi)、MicroRNA、转化子、重组子、目的基因、目标生物、人工染色体载体、连接酶、T/A克隆、定向克隆、限制修饰系统、杂交探针、复制子、感受态细胞、酵母附加体质粒、酵母复制质粒、酵母整合质粒、DNA聚合酶、蓝白斑筛选二、简答与问答题1 简述乳腺生物反应器的原理。
2 简述基因工程研究发展历史。
3 简述基因工程研究的主要内容。
4 举例说明浓缩DNA或RNA的方法。
5 说明限制性核酸内切酶产生Star活性的原因及其克服措施。
6 DNA修饰酶有哪些?各有何功能?7 按介质分,DNA片段凝胶电泳可分为哪几类?各自的主要分离范围是什么?8 按来源可将基因克隆载体分为哪几类?并说明各自的主要特点。
9 作为克隆载体必须具备的主要条件是什么?10 作为基因工程宿主必须具备的主要条件是什么?11 列举外源基因表达系统中的载体和宿主。
12 特殊用途克隆载体有哪些?13 简要说明目的基因制备的主要方法。
14 特殊用途PCR有哪些?15 简述转基因生物的主要鉴定方法的原理和过程。
基因工程期末考试复习资料

1.1972年,美国Berg和Jackso等人将猿猴病毒SV40基因组DNA,λ噬菌体基因以及大肠杆菌半乳糖操纵子在体外重组获得成功。
1973年,美国斯坦福大学的Cohen和Boyer等人在体外构建出含有四环素和链霉素,两个抗性基因的重组质粒分子,将之导入大肠杆菌后,该重组质粒得以稳定复制,并赋予受体细胞相应的抗生素抗性,由此宣告了基因工程的成立。
2.基因工程的三大要素:供体、受体、载体。
3.基因工程操作的基本步骤:(1)切:从供体细胞中分离出基因组DNA,用限制性核酸内切酶分别将外源DNA(包括外源基因或目的基因)和载体分子切开。
(2)接:用DNA连接酶将含有外源基因的DNA片段接到载体分子上,构成DNA重组分子。
(3)转:借助于细胞转化手段将DNA重组分子导入受体细胞(4)增:短时间培养转化细胞,以扩增DNA重组分子或使其整合到受体细胞的基因组中(5)检:筛选和鉴定经转化处理的细胞,获得外源基因高效稳定表达的基因工程菌或细胞4.基因工程的主体战略思想是外源基因的稳定高效表达5.绝大多数分子克隆实验所使用的载体是DNA双键分子,其功能是:(1)为外源基因提供进入受体细胞的转移能力(2)为外源基因提供在受体细胞中的复制能力或整合能力(3)为外源基因提供在受体细胞中的扩增和表达能力6.野生型质粒具有下列基本特征:自助复制性,可扩增性,可转移性,不相容性7.人工构建的载体质粒根据其功能和用途可分为下列几类:(1)克隆质粒:用于克隆和扩增外源基因(2)测序质粒:高拷贝复制,并含有多酶切口的接头片段,便于各种DNA片段的克隆与扩增(3)整合质粒:含有整合酶编码基因以及整合特异性的位点序列,克隆在这种质粒上的外源基因进入受体细胞后,能准确地重组整合在受体染色体DNA的特定位点上(4)穿梭质粒:能在两种不同种属的受体细胞中复制及检测(5)探针质粒:用来筛选克隆基因的表达调控元件(6)表达质粒:使得克隆在合适位点上的任何外源基因均能在受体细胞中高效表达8.野生型质粒改造的指导思想是:(1)删除不必要的DNA区域(2)灭活某些质粒的编码基因,同时灭活那些对质粒复制产生负调控效应的基因,以提高质粒的拷贝数(3)加入易于识别的选择标记基因,便于检测含有重组质粒的受体细胞(4)在选择性标记基因内引入具有多种限制性内切酶识别及切割位点的DNA 序列,同时删除重复的酶切位点(5)根据外源基因克隆的不同要求,分别加装特殊的基因表达调控元件或用于表达产物亲和层析分离的标签编码序列9.λ噬菌体是大肠杆菌的温和型噬菌体,由外壳蛋白与一个48.5kb长的双链线状DNA分子组成。
基因工程期末复习

第一章基因工程的概念第一节基因工程诞生的理论基础一.确定了遗传信息的携带者是DNA而不是蛋白质。
明确了遗传的物质基础问题1. 肺炎双球菌转化实验1944年 Avery,确定了基因的分子载体是DNA,而不是蛋白质。
2. 噬菌体转染实验1952年Alfred Hershy和Marsha Chase进一步证明遗传物质是DNA二.揭示了DNA分子的双螺旋结构模型和半保留复制机理,解决了基因的自我复制和传递的问题。
1953年James D. Watson和Francis H. C. Crick揭示了DNA分子的双螺旋结构和半保留复制机制。
三.提出了“中心法则”和操纵子学说,并成功地破译了遗传密码,从而阐明了遗传信息的流向和表达问题1958年Crick又提出了遗传信息传递的“中心法则”1964年Marshall Nirenberg和Gobind Khorana等终于破译了64个遗传密码 F.Jacob和J.Monod在1961年提出了操纵子学说/view/225864.htm第二节基因工程诞生的技术基础DNA分子的体外切割与连接1.限制性内切酶(restriction enzymes)Werner Arber 理论预见限制酶1968年H.O. Smith等分离出第一种限制性核酸内切酶Daniel Nathans 用限制酶切得SV40 DNA片断3人于1978年获得Nobel生理或医学奖2. DNA连接酶(ligase) 1967年5个实验室几乎同时发现了DNA连接酶二. DNA分子的核苷酸序列分析1975年F. Sanger、A. Maxam和W. Gilbert发明了DNA快速测序技术, 1980年Nobel化学奖三.载体的构建1972年前后使用小分子量的细菌质粒和 噬菌体作载体。
在细菌细胞里的大量扩增四.转化技术1970年M. Mandel和A. Higa发现经过氯化钙处理的大肠杆菌容易吸收噬菌体DNA。
基因工程期末复习资料.docx
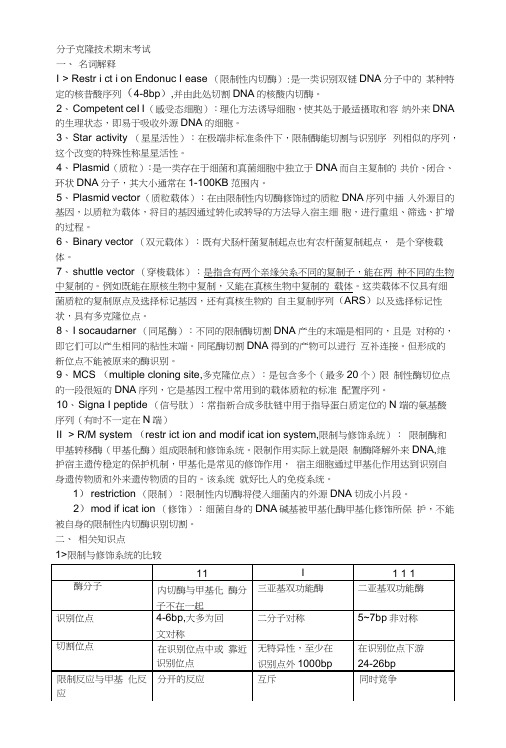
分子克隆技术期末考试一、名词解释I > Restr i ct i on Endonuc I ease (限制性内切酶):是一类识别双链DNA分子中的某种特定的核昔酸序列(4-8bp),并由此处切割DNA的核酸内切酶。
2、Competent ceI I (感受态细胞):理化方法诱导细胞,使其处于最适摄取和容纳外来DNA 的生理状态,即易于吸收外源DNA的细胞。
3、Star activity (星星活性):在极端非标准条件下,限制酶能切割与识别序列相似的序列,这个改变的特殊性称星星活性。
4、Plasmid (质粒):是一类存在于细菌和真菌细胞中独立于DNA而自主复制的共价、闭合、环状DNA分子,其大小通常在1-100KB范围内。
5、Plasmid vector (质粒载体):在由限制性内切酶修饰过的质粒DNA序列中插入外源目的基因,以质粒为载体,将目的基因通过转化或转导的方法导入宿主细胞,进行重组、筛选、扩增的过程。
6、Binary vector (双元载体):既有犬肠杆菌复制起点也有农杆菌复制起点,是个穿梭载体。
7、shuttle vector (穿梭载体):是指含有两个亲缘关系不同的复制子,能在两种不同的生物中复制的。
例如既能在原核生物中复制,又能在真核生物中复制的载体。
这类载体不仅具有细菌质粒的复制原点及选择标记基因,还有真核生物的自主复制序列(ARS)以及选择标记性状,具有多克隆位点。
8、I socaudarner (同尾酶):不同的限制酶切割DNA产生的末端是相同的,且是对称的,即它们可以产生相同的粘性末端。
同尾酶切割DNA得到的产物可以进行互补连接。
但形成的新位点不能被原来的酶识别。
9、MCS (multiple cloning site,多克隆位点):是包含多个(最多20个)限制性酶切位点的一段很短的DNA序列,它是基因工程中常用到的载体质粒的标准配置序列。
10、S igna I peptide (信号肽):常指新合成多肽链中用于指导蛋白质定位的N 端的氨基酸序列(有时不一定在N端)II > R/M system (restr ict ion and modif icat ion system,限制与修饰系统):限制酶和甲基转移酶(甲基化酶)组成限制和修饰系统。
【期末复习】基因工程期末考试重点知识整理

基因工程期末考试重点知识整理基因工程第一章基因工程概述1、基因工程的概念(基因工程基本技术路线PPT)基因工程(Gene Engineering),是指在基因水平上的遗传工程,它是用人为方法将大分子(DNA)提取出来,在离体条件下用适当的工具酶进行切割后,把它与作为载体的DNA分子连接起来,然后与载体一起导入某一更易生长、繁殖的受体细胞中,以让外源遗传物质在其中“安家落户”,进行正常的复制和表达,从而获得新物种的一种崭新的育种技术.2、基因工程的历史基因工程准备阶段:1972,第一个重组DNA分子的构建,构建人:Paul Berg及其同事PPT 基因工程诞生:1973,Cohen & Boyer首次完成重组质粒DNA对大肠杆菌的转化基因工程发展阶段的几个重要事件:一系列新的基因工程操作技术的出现;各种表达克隆载体的成功构建;一系列转基因菌株、转基因植物、转基因动物等的出现3、基因工程的内容(P9)4、基因克隆的通用策略(P12)(基因组文库(鸟枪法)+分子杂交筛选)第二章分子克隆工具酶5、限制性核酸内切酶的概念、特点、命名、分类(问答)概念:一类能识别双链DNA中特殊核苷酸序列,并使每条链的一个磷酸二酯键断开的内脱氧核糖核酸酶,主要存在于细菌体内特点(参加PPT)命名: 依次取宿主属名第一字母,种名头两个字母,菌株号,然后加上序号。
如:从Haemophilus influenze Rd中提取到的第三种限制型核酸内切酶被命名为Hind ?,Hin指来源于流感嗜血杆菌,d表示来菌株Rd,?表示序号。
分类:依据酶的亚单位组成、识别序列的种类以及是否需要辅助因子可分为:?型酶、?型(?s型)酶和?型酶。
真核细胞中有4中DNA聚合酶:α,β,γ,线粒体DNA聚合酶原核生物中3中DNA聚合酶:?,?,?6、几个基本概念粘性末端:两条多聚核苷酸链上磷酸二酯键断开的位置是交错的,对称地分布在识别序列中心位置两侧,这样形成的DNA片段末端称为~。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这是我整理的老师布置的思考题,不一定齐全也不一定正确,不过可以选择性地参考下。
1、DNA提取常见问题,原因分析及其对策问题一:DNA样品不纯,抑制后续酶解和PCR反应。
原因:1.DNA中含有蛋白、多糖、多酚类杂质2.DNA在溶解前,有酒精残留,酒精抑制后续酶解反应3.DNA中残留有金属离子对策:1.重新纯化DNA,去除蛋白、多糖、多酚等杂质(具体方法见前)2.重新沉淀DNA,让酒精充分挥发3.增加70%乙醇洗涤的次数(2-3次)问题二:DNA降解。
原因:1.材料不新鲜或反复冻融2.未很好抑制内源核酸酶的活性3.提取过程操作过于剧烈,DNA被机械打断4.外源核酸酶污染5.反复冻融对策:1.尽量取新鲜材料,低温保存材料避免反复冻融2.液氮研磨或匀浆组织后,应在解冻前加入裂解缓冲液3.在提取内源核酸酶含量丰富的材料的DNA时,可增加裂解液中螯合剂的含量4.细胞裂解后的后续操作应尽量轻柔5.所有试剂用无菌水配制,耗材经高温灭菌6.将DNA分装保存于缓冲液中,避免反复冻融问题三:DNA提取量少。
原因:1.实验材料不佳或量少2.破壁或裂解不充分3.沉淀不完全4.洗涤时DNA丢失对策:1.尽量选用新鲜(幼嫩)的材料2.动植物要匀浆研磨充分;G+菌、酵母裂解前先用生物酶或机械方式破壁 3.高温裂解时,时间适当延长(对于动物细胞、细菌可增加PK的用量)4.低温沉淀,延长沉淀时间5.加辅助物,促进沉淀6.洗涤时,最好用枪头将洗涤液吸出,勿倾倒2、猪肝脏总RNA的提取?RNA提取常见问题,原因分析及其对策问题一:RNA的降解(1)新鲜细胞或组织的RNA降解RNA降解:1.裂解液的质量2.外源RNase的污染3.裂解液的用量不足4.组织裂解不充分5.另外某些富含内源酶的样品 (如脾脏,胸腺等),很难避免RNA 的降解。
建议在液氮条件下将组织碾碎,并且匀浆时使用更多裂解液。
(2)冷冻样品的RNA降解1.样品取材后应立即置于液氮中速冻,然后可以移至-70℃冰箱保存。
样品要相对小一点;2.先用液氮研磨,再加裂解液匀浆;3.样品与裂解液充分接触前避免融化,研磨用具必须预冷,碾磨过程中及时补充液氮。
问题二:OD260 /OD280 比值偏低(1)蛋白质污染;(2)苯酚残留;(3)抽提试剂残留;(4)设备限制。
问题三:电泳带型异常(1)非变性电泳:上样量超过 3ug,电压超过 6V/cm,电泳缓冲液陈旧,均可能导致 28S 和 18S 条带分不开。
(2)变性电泳条带变淡:EB 与单链的结合能力要差一些,故同样的上样量,变性电泳比非变性电泳要淡一些;(3)甲醛的质量不高问题四:下游实验效果不佳(1) RNA 降解;(2)抽提试剂的残留;(3)样品中杂质的残留;(4)DNA 污染。
3、已知单链RNA的序列,分别用sanger和化学裂解法测定其序列,写出操作过程。
Sanger双脱氧链终止法:1.分离待测核酸模板2.在4只试管中加入适当的引物、模板、4种dNTP(包括放射性标记dATP,例如?32 PdATP和DNA聚合酶(如以RNA为模板,则用反转录酶),再在上述4只管中分别加入一种一定浓度的ddNTP(双脱氧核苷酸)。
3.与单链模板(如以双链作模板,要作变性处理)结合的引物,在DNA聚合酶作用下从5’端向3’端进行延伸反应,32P随着引物延长掺入到新合成链中。
当ddNTP掺入时,由于它在3’位置没有羟基,故不与下一个dNTP结合,从而使链延伸终止。
ddNTP在不同位置掺入,因而产生一系列不同长度的新的DNA链。
4.用变性聚丙烯酰胺凝胶电泳同时分离4只反应管中的反应产物,由于每一反应管中只加一种ddNTP(如ddATP),则该管中各种长度的DNA都终止于该种碱基(如A)处。
所以凝胶电泳中该泳道不同带的DNA 3’ 末端都为同一种双脱氧碱基。
5.放射自显影。
根据四泳道的编号和每个泳道中DNA带的位置直接从自显影图谱上读出与模板链互补的新链序列。
化学降解法测序:(1)待测模版DNA分子的制备:一般用限制性内切核酸酶将待测DNA分子切割成250~300bp的片段,然后用碱性磷酸酶除去DNA片段5’端的磷酸根,最后用T4多核苷酸激酶和[r32P]ATP,使DNA片段的5’端带上放射性核酸标记。
(2)化学降解待测模版的DNA分子:纯化并碱变性待测DNA片段,回收其中的一条单链,分装在4支试管中进行上述4组特异性切割反应。
4组反应分别产生大小不同且具有共同标记末端的寡核苷酸片段混合物。
(3)待测模版DNA分子的序列分析:通过聚丙烯酰胶凝胶电泳将上述4组反应的寡核苷酸片段进行分离,经放射自显影后即可从X光片上读出DNA 序列。
4、实验设计:DNA片段之间的连接带有相同末端(平端或粘端)的外源DNA必须克隆到具有匹配末端的线性质粒载体中,但是在连接反应时,外源DNA和质粒都可能发生环化,也有可能形成串联寡聚物。
因此,必须仔细调整连接反应中两个DNA 的浓度,以便使“正确”连接产物的数量达到最佳水平,此外还常常使用碱性磷酸酶去除5’磷酸基团以抑制载体DNA的自身环化。
利用T4 DNA连接酶进行目的DNA和载体的体外连接反应,也就是在双链DNA 5’磷酸和相邻的3’羟基之间形成新的共价键。
如载体的两条链都带有5’磷酸(未脱磷),可形成4个新的磷酸二酯键;如载体DNA已脱磷,则只能形成2个新的磷酸二酯键,此时产生的重组DNA带有两个单链缺口,在导入感受态细胞后可被修复。
1、不对称粘性末端:两种限制酶消化后,需纯化载体以提高连接效率;载体与外源DNA连接处的限制酶切位点常可保留;非重组克隆的背景较低;外源DNA 可以定向插入到载体中。
2、对称性粘性末端;线形载体DNA常需磷酸酶脱磷处理;载体与外源DNA 连接处的限制酶切位点常可保留;重组质粒会带有外源DNA的串联拷贝;外源DNA会以两个方向插入到载体中。
3、平端:要求高浓度的DNA和连接酶;载体与外源DNA连接处的限制酶切位点消失;重组质粒会带有外源DNA的串联拷贝;非重组克隆的背景较高。
粘性末端连接:实验试剂:用适当的限制酶消化质粒和外源DNA。
如有必要,可用凝胶电泳分离片段并(或)用碱性磷酸酶处理质粒DNA。
通过酚:氯仿抽提和乙沉淀来纯化DNA,然后用TE(pH7.6)溶液使其浓度为100/ml。
10×T4DNA连接酶buffer(该缓冲液应分装成小份,贮存于-20℃。
):200mMTris-HCl(pH7.6);50mMMgCl2;50mM二硫苄糖醇;500μl/ml BSA(可用可不用)T4DNA连接酶5mM ATP实验步骤:1、在无菌Eppendorf管中加入以下溶液:1) 10μl体积反应体系中:取载体50-100ng,加入一定比例的外源DNA 分子(一般线性载体DNA分子与外源DNA分子摩尔数为1∶1-1∶5),补足ddH2O 至8μl。
2) 轻轻混匀,稍加离心,于45℃水浴5分钟使重新退火的粘端解链,迅速将混合物转入冰浴。
3) 加入含ATP的10×Buffer 1μl,T4 DNA连接酶合适单位,用ddH2O 补至10μl。
2、盖上管盖,充分混匀,台式离心扣上离心5秒。
3、12℃下过夜连接反应。
4、反应结束后于-20℃保存。
5、再设立两个对照反应,其中含有(1)只有质粒载体;(2)只有外源DNA 片段。
如果外源DNA量不足,每个连接反应可用50-100ng质粒DNA,并尽可能多加外源DNA,同时保持连接反应体积不超过10μl。
可用至少3种不同方法来测定T4噬菌体DNA连接酶的活性。
注意事项:1、连接反应的温度:DNA连接酶的最适反应温度为37℃,但在此温度下,粘性末端的氢键结合很不稳定,折衷方法是12℃过夜。
2、DNA的平未端和粘性末端:由于内切酶产生的DNA末端有平未端和粘性末端,因而连接反应中就有平未端连接和粘性末端连接。
二者连接效率不同。
粘性末端效率高,因而在底物浓度,酶浓度选择上是有差异的。
3、碱性磷酸酶处理质粒载体:为了提高连接效率,一般采取提高DNA的浓度,增加重组子比例。
这样就会出现DNA自生连接问题,为此通常选择对质粒载体用碱性磷酸酶处理,除去其5’末端的磷酸基,防止环化,通过接反应后形成的缺口可在转化细胞后得以修复。
4、连接反应的检测:连接反应成功与否,最后的检测要通过下一步实验,转化宿主菌,阳性克隆的筛选来确定。
5、如果要检验连接酶和连接酶专用的缓冲液是否有效,可重新连接酶切后的λDNA。
若连接成功,则说明有效。
5、在进行DNA重组研究时,如何防止DNA酶Ⅰ的污染。
高温、EDTA、冰上操作6、为了从生物材料中高效提取RNA,如何控制RNA酶活性,消除RNA酶的降解活性?(一)消除生物材料内源性RNA酶的干扰主要是在组织细胞裂解液中介入RNA 酶抑制剂和变性剂,如异硫氰酸胍、盐酸胍、尿素。
由于RNA酶活性的最适PH 接近中性,因此组织细胞裂解液的PH偏碱性或偏酸性可部分抑制RNA酶的活性。
(二)消除制备RNA过程中外源性RNA酶的干扰,可采取以下措施:①对于制备RNA所用的试剂,一般应该用0.1%DEPG处理过的水配制,在37℃处理12小时以上,然后高压灭菌并除去残留的DEPG。
②对于玻璃器皿用180℃干烤3小时以上;对于塑料器皿,用氯仿充分冲洗。
③制备RNA的过程在超净工作台中进行。
④在制备RNA时操作者应戴口罩和一次性手套,且勤换手套。
7、如果已知某基因的一段DNA序列,如何获得该基因?利用染色体歩移的方法以获得与已知序列相邻的未知序列,从而获得该基因8、如果已知某基因的两段DNA序列,如何获得该基因?直接设计引物然后用延伸性好一点的酶直接PCR9、已知蛋白质的部分氨基酸序列,怎样克隆编码该蛋白质的基因?在蛋白数据库搜索同源蛋白,然后对应搜出的基因,设计引物PCR作出全长10、已分离纯化某蛋白质并制备了相应的抗体,如何克隆其编码基因?用抗体纯化出正在翻译的蛋白质,得到其RNA,然后逆转录得到其DNA后设计引物然后进行PCR11、如果已获得某基因的DNA序列,如何研究其结构功能?12、如何选择合适的转化外植体?(1)选择优良的种质及母株无论是离体培养繁殖种苗,还是进行生物技术研究,培养材料的选择都要从主要的植物入手,选取性状优良的种质、特殊的基因型和生长健壮的无病虫害植株。
尤其是进行离体快繁,只有选取优良的种质和基因型,离体快繁出来的种苗才有意义,才能转化成商品;生长健壮无病虫害的植株及器官或组织代谢旺盛,再生能力强,培养后容易成功。
(2)选择适当的时期组织培养选择材料时,要注意植物的生长季节和生长发育阶段,对大多数植物而言,应在其开始生长或生长旺季采样,此时材料内源激素含量高,容易分化,不仅成活率高,而且生长速度快,增殖率高。
