电解MnO2生产方法及工艺流程
自编电解锰生产工艺流程

4、电解锰的作用
(4)剥落:剥落就是将金属锰成品与阴极板分离。按照外观 质量分级剥落。
(5)包装:产品剥落完后,取样送检,然后按产品外观质量 分别装桶、称重、包装。
(6)阴极板处理:将剥离后的阴极板放入阳极液中浸泡,溶 去阴极板上的残锰,然后放入洗液(7%HNO3+3%K2Cr2O7)中浸 泡1分钟,取出后用自来水洗净;表面光亮平整的阴极板返回 使用,表面不整洁的阴极板完全晾干后送抛光室进行抛光处 理。
5、电解锰的用途。
①锰是冶炼工业不可缺少的添加剂。电解锰加工成粉状后是生产四 氧化三锰的主要原料,电子工业广泛使用的磁性材料原件就是四氧化 三锰生产的,市场需求量每年增长15%左右。
②近些年,世界铝工业成为电解锰的主要用户,铝锰合金为现代轻 美型建筑材料、装饰工程材料和地下工程防腐和保护材料,铝锰合 金门窗等已进入普通居民住宅,大大地扩大了金属锰的市场。
四、工艺流程
4、 电解工序
电解:合格液槽中的新液经溜槽进入电解槽进行电解作 业,电解时槽温控制在38~42℃,平均阴极电流密度370~ 380A/m2,同极距68mm,阴极锰析出周期24h。电解时加入少 量二氧化硒添加剂以利于电解作业稳定,加入部分氨水以调 节pH值。为带走电解时电流通过在槽中产生的热量以维持正 常的电解温度,在电解槽内设冷却管,通入冷却水进行冷却, 维持电解槽温在正常范围内。电解时,电解液不断加入,阳 极液流入阳极液溜槽自流到浸出工序。 在电解过程中发生了 如下化学反应。
制备mno2的方法

制备mno2的方法Mno2是一种金属氧化物,具有重要的化学和物理性质,它是一种多功能材料,广泛用于电子、化学、精细化工领域。
自20世纪60年代起,Mno2的制备发生了很大的变化,其技术渐趋成熟。
Mno2可以通过多种方法制备,如水热法、湿法水解法、电解法、化学水解法等。
由于Mno2是金属离子和氧化物,具有很强的抗腐蚀性,所以制备过程必须充分考虑安全因素。
1、水热法水热法是一种常用的Mno2制备方法,主要是将金属(如钼、钔、氧化钴等)与氧化剂(如氧气、氯气等)混合在水中,随后加热,使金属与氧化剂发生反应,形成Mno2沉淀物。
Mno2沉淀的颗粒大小和形状受温度、时间、浓度、pH值等因素的影响。
此外,制备过程中还可以添加氧化剂、碱类或酸类调节剂,调节Mno2颗粒的大小和性质。
2、湿法水解法湿法水解法是Mno2制备中经常采用的方法,具体流程是将金属(如钼、钔、氧化钴等)、氧化剂(如氧气、氯气等)、水和有机溶剂混合,加入碱类、酸类调节剂后反应,形成稳定的Mno2溶液。
3、电解法电解法是一种制备Mno2的高纯度的方法,它的基本原理是,将金属(如钼、钔、氧化钴等)作为负极,氧化剂(如氧气、氯气等)作为阳极,在溶液中通过电解,使金属与氧化剂发生化学反应,形成Mno2溶液,然后用烧结或活性炭活性等工艺将Mno2溶液脱水脱溶剂,室温即可获得Mno2沉淀物。
4、化学水解法化学水解法是利用金属氧化物的水解反应,通过合成金属氧化物及水解反应,将金属(如钼、钔、氧化钴等)与过氧化物(如H2O2、KMnO4等)混合,反应后蒸发去除溶剂,用烧结或活性炭吸附脱水脱溶剂后即可得到Mno2沉淀物。
综上所述,Mno2可以通过水热法、湿法水解法、电解法和化学水解法等方法制备,在制备过程中需要充分考虑安全因素,调节因素,同时要注意合成的Mno2沉淀物的粒径和形状等。
Mno2在电子、化学、精细化工领域都有广泛的应用,高纯度的Mno2至关重要,所以全过程需要严格控制。
电解锰工艺流程

电解锰工艺流程2010/8/10 11:52:47碳酸锰矿是直接利用硫酸与碳酸锰化合反应制取硫酸锰溶液,再通过中和、净化、过滤等一系列工艺制备为电解液,经加入添加剂如二氧化硒、亚硫酸铵等即可进入电解槽进行电解;利用二氧化锰生产电解锰的工艺与用碳酸锰生产工艺有所差别,主要是二氧化锰在一般条件下不与硫酸反应,必须经处理为二价锰后再与硫酸反应制备硫酸锰溶液,其处理方法一般为焙烧法,是将二氧化锰与还原性物质(一般为煤炭)共同混合后密闭加热,在一定温度下C将四价锰还原为二价锰,粉碎后与硫酸反应,这种方法称为焙烧法;另一种方法是称为两矿法的,即是用二氧化锰矿粉和硫铁矿在硫酸作用下发生氧化还原反应来制备硫酸锰。
不过这两种方法由于成本较高,业内基本不与采用,其中,焙烧法较之于两矿法更为普遍,但由于很多的焙烧生产厂使用的焙烧炉是简单易制但能耗较高污染较大的反射炉,前几年,国家发改委已明令取缔反射炉用于生产电解锰生产工艺。
下面是废渣的处理方法:电解锰渣为含CaSO4·2H2O较高的工业废料,如果加以利用,将获得较好的经济效益与社会效益。
将锰渣分别进行105℃低温烘干和300℃高温锻烧处理,然后替代石膏配制水泥试验并按国家标准检测方法进行相关水泥性能试验。
结果表明,电解锰渣的缓凝作用虽差于天然石膏,但可完全替代天然石膏生产水泥;且高温锻烧处理的电解锰渣的缓凝和增强作用,均好于低温烘干料。
锰是一种金属元素,电解金属锰是制造四氧化三锰的主体材料,另外由于纯度高、杂质少,是生产不锈钢、高强度低合金钢、铝锰合金、铜锰合金等的重要合金元素,也是电焊条、铁氧体、永磁合金元素,及许多医药化工用锰盐生产中不可缺少的原料;新开发的减振合金也需用电解金属锰。
近几年来,世界铝工业成为电解金属锰的主要用户。
在钢铁工业中,电解金属锰也用来做脱氧剂和脱硫剂。
据统计,每吨钢消耗电解金属锰平均为 0.06kg 。
随着冶金技术的进步,高效钢材及喷射冶金技术得到了很大的发展,电解金属锰粉在冶金工业中的应用已日益增加,用量扩大,突破了上述指标。
高中化学第8讲 氧化还原反应的配平及计算(教案)

第8课时 关键能力——氧化还原反应的配平及计算近五年,全国理综卷及自主命题省市单科化学卷都重点考查信息型氧化还原方程式的书写、氧化还原滴定及计算等,高考常将离子反应和氧化还原反应融合在一起考查,即书写离子方程式时往往要用到氧化还原反应理论知识,有关氧化还原反应的计算通常是以化工流程或物质制备综合实验为载体,将氧化还原反应原理应用到生产、生活和最新科技成果中,体现《中国高考评价体现》中对学习掌握、实践探索、思维方法等学科核心素养的要求,考生要阅读文本、获取信息、整合知识,并合理运用科学的思维方法,有效地组织整合学科的相关知识,调动运用学科的相关能力,高质量地认识问题、分析问题、解决问题,体现化学学科的本质价值。
考向1 氧化还原反应方程式的配平(理解与辨析能力)配平氧化还原反应方程式要依据“三个守恒规律”:角度1 基本型氧化还原反应方程式的配平基本型氧化还原反应方程式中,各反应物和生成物均提供,要求根据氧化还原方程式配平的基本方法,配平该化学方程式,确定某物质的化学计量数等,体现氧化还原反应原理在化工生产中的具体应用,要求考生在正确思想观念引领下,综合运用多种知识或技能来解决生活、生产实践中的应用性问题。
(2017·全国卷Ⅲ,27题节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr 2O 3,还含有硅、铝等杂质:铬铁矿 ―————————―→①熔融、氧化Na 2CO 3、NaNO 3熔块 。
(1)步骤①的主要反应为:FeO ·Cr 2O 3+Na 2CO 3+NaNO 3――→高温Na 2CrO 4+Fe 2O 3+CO 2+NaNO 2上述反应配平后FeO·Cr 2O 3与NaNO 3的系数比为________。
解析 第一步;标变价第二步:列得失第三步:求总数确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。
第四步:配系数先配平变价元素,再利用原子守恒配平其他元素。
电解二氧化锰的特殊处理方法2
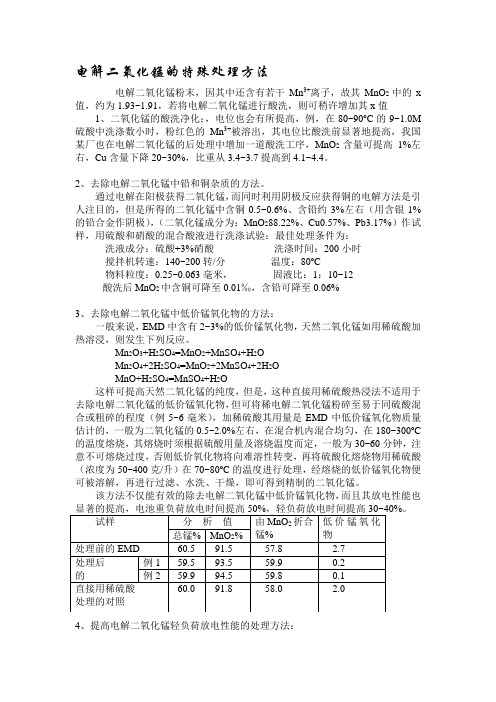
电解二氧化锰的特殊处理方法电解二氧化锰粉末,因其中还含有若干Mn3+离子,故其MnO2中的x 值,约为1.93~1.91,若将电解二氧化锰进行酸洗,则可稍许增加其x值1、二氧化锰的酸洗净化:,电位也会有所提高,例,在80~90o C的9~1.0M 硫酸中洗涤数小时,粉红色的Mn3+被溶出,其电位比酸洗前显著地提高,我国某厂也在电解二氧化锰的后处理中增加一道酸洗工序,MnO2含量可提高1%左右,Cu含量下降20~30%,比重从3.4~3.7提高到4.1~4.4。
2、去除电解二氧化锰中铅和铜杂质的方法。
通过电解在阳极获得二氧化锰,而同时利用阴极反应获得铜的电解方法是引人注目的,但是所得的二氧化锰中含铜0.5~0.6%、含铅约3%左右(用含银1%的铅合金作阴极),(二氧化锰成分为:MnO288.22%、Cu0.57%、Pb3.17%)作试样,用硫酸和硝酸的混合酸液进行洗涤试验:最佳处理条件为:洗液成分:硫酸+3%硝酸洗涤时间:200小时搅拌机转速:140~200转/分温度:80o C物料粒度:0.25~0.063毫米,固液比:1:10~12酸洗后MnO2中含铜可降至0.01‰,含铅可降至0.06%3、去除电解二氧化锰中低价锰氧化物的方法:一般来说,EMD中含有2~3%的低价锰氧化物,天然二氧化锰如用稀硫酸加热溶浸,则发生下列反应。
Mn2O3+H2SO4=MnO2+MnSO4+H2OMn2O4+2H2SO4=MnO2+2MnSO4+2H2OMnO+H2SO4=MnSO4+H2O这样可提高天然二氧化锰的纯度,但是,这种直接用稀硫酸热浸法不适用于去除电解二氧化锰的低价锰氧化物,但可将稀电解二氧化锰粉碎至易于同硫酸混合或粗碎的程度(例5~6毫米),加稀硫酸其用量是EMD中低价锰氧化物质量估计的,一般为二氧化锰的0.5~2.0%左右,在混合机内混合均匀,在180~300o C 的温度熔烧,其熔烧时须根据硫酸用量及溶烧温度而定,一般为30~60分钟,注意不可熔烧过度,否则低价氧化物将向难溶性转变,再将硫酸化熔烧物用稀硫酸(浓度为50~400克/升)在70~80o C的温度进行处理,经熔烧的低价锰氧化物便可被溶解,再进行过滤、水洗、干燥,即可得到精制的二氧化锰。
电解金属锰生产工艺流程主要分两个阶段:

电解金属锰生产工艺流程主要分两个阶段:(1)制备电解溶液。
采用锰矿粉与无机酸反应,加热制取锰盐溶液,同时向溶液中加入铵盐作缓冲剂,用加氧化剂氧化中和的方法除去铁,加硫化净化剂除去重金属,然后过滤分离,在溶液中加入电解添加剂作为电解溶液。
目前工业生产广泛采用硫酸浸锰方法制取电解液,用氯化锰盐溶液电解制取金属锰的方法还未形成规模性生产。
制取硫酸锰所用的锰矿粉分菱锰矿和软锰矿两种。
用菱锰矿粉制取硫酸锰的主要化学反应为:MnCO3+H2SO4→MnSO4+CO2↑+H2O用软锰矿制取硫酸锰,先要对软锰矿进行还原焙烧,还原成一氧化锰,然后用硫酸浸取,其主要化学反应为:MnO+H2SO4→MnSO4+H2O(2)电解操作过程。
向隔模电解槽注入含硫酸铵的硫酸锰水溶电解液,接通直流电,产生电析作用,在阴极板上析出金属锰,阳极板析出氧气;周期性地更换阴极板,对电析产物进行钝化、水洗、烘干、剥离等处理,获得金属锰产品。
阴极板上的反应为:Mn2++2e→Mn↓阳极板上的反应为:生产方法原料技术条件用硫酸锰作原料制取金属锰,所需原料主要有锰矿粉、硫酸、硫酸铵、氧化剂、还原剂、添加剂等。
锰矿粉分菱锰矿和软锰矿两种:(1)菱锰矿(MnCO3),质量要求符合国家标准GB3714-83的1-4级。
(2)软锰矿(MnO2),质量要求符合国家标准GB3714-83的1-4级。
锰矿粉以锰含量高,杂质元素种类少、含量低为佳,特别是铁和重金属元素的含量要求尽可能低。
工业硫酸(H2SO4)质量指标应符合国家标准GB534-82。
硫酸铵[(NH4)2SO4],质量指标应符合国家标准GB535-83。
液氨或氢氧化铵(NH3、NH4OH)质量指标应符合国家标准GB536-82(CO2含量不大于0.05g/L)。
还原剂用无烟煤粉,粒度 2mm以下,灰分小于14%。
净化剂(用于沉淀重金属)有:(1)饱和(NH4)2S溶液;(2)福美钠[(CH3)2NCS2Na]简称SDD,含量大于88%;(3)乙硫氮[(CH3CH2)2NCS2Na·3H2O]。
四氧化三锰的生产方法

图 2 喷雾干燥的典型流程
电解金属锰片
破碎
纯净水
电解金属锰粉
添加剂
调浆
空气
金属锰粉悬浮液
反应
Mn3O4 纯净水 洗涤
上清液
干燥
包装
产品
图 1 金属锰法制备四氧化三锰的简单工艺流程
实际生产中,主要控制的条件有添加剂浓度、初始温度、投料量(料液比)、 吹气量、搅拌强度、反应时间等,有时也因设备、工艺上的差别而有所不同。例 如添加剂浓度在 1.0~20.0g/L 范围内都可以进行,在实际生产中还要根据反应 槽的设计、金属锰片的破碎方式(干磨还是湿磨)、锰粉的粒度、投料量等因素 综合考虑。添加剂浓度偏低反应时间将被拉长或根本无法进行,添加剂浓度过高,
喷雾干燥是一种理想的干燥方式物料干燥时被雾化后比表面积很大所需的干燥时间很短以秒计物料干燥后的温度较低可有效避免产品颗粒间的团聚从而能保证产品的物理指标如比表面积松装密度流动性等图2是喷雾干燥的典型流程喷雾干燥的典型流程金属锰法生产四氧化三锰过程中用水可用ro反渗透水ro反渗透装置与离子交换法相比可节约95以上的酸碱用量环境污染可得到较大改善一般ro反渗透装置的出水可达到cp级纯水要求电导率小于10scmsio2含量小于10mgl
四氧化三锰的生产方法
四氧化三锰的制备方法多种多样,根据工艺特点和反应性质的不同大致可分 为四类:焙烧法、还原法、氧化法和电解法。若以原料来源来分,也可分为四类: 一类是以锰的氧化物或氢氧化物,如 MnO、Mn2O3、MnO2、MnO(OH)等经氧化 或还原制成一类是以锰盐如 MnSO4、MnCO3、Mn(NO3)2、MnCl2、KMnO4、MnC2O4 等经氧化或还原制成 Mn3O4;一类是以金属锰经过氧化制成 Mn3O4;最后一类是 以锰的氧化物和锰盐为原料经氧化还原制成 Mn3O4。以上众多方法中,由于受工 艺条件、原料成本、产品质量等因素的制约,仅有少数几个实现了工业化生产。
MnO2纳米材料的制备及应用 孔祥荣 胡如男 吴延红 叶明富 许立信 陈国昌

凝胶法 采用溶胶制备了锰氧八面体分子筛等材料; 基于高锰酸钾与 甲酸( HCOOH ) 之间的氧化还原反应, 他们又用溶 。 , 胶 凝胶法制备了隧道型氧化锰 此外 该课题组采 用溶胶凝胶法首先制备了四乙铵锰氧层状复合物 , 接着通过离子交换和水热过程处理获得了钡镁锰矿 [20 ] 纳米带。王佳伟等 将一定量分析纯柠檬酸加到 醋酸锰水溶液中, 搅拌溶解均匀后用氨水调节溶液
Preparation and application of MnO2 nanomaterials
KONG Xiangrong1 , HU Runan2 , WU Yanhong3 , YE Mingfu2 , XU Lixin2 , CHEN Guochang2
( 1. National Center for Safety Quality Supervision and Testing of Fireproof Building Products, Beijing Building Materials Academy Sciences Research, Beijing 100141 , China; 2. School of Chemistry and Chemical Engineering, Anhui University of Technology, Maanshan 243002 , China; 3. Shandong Huayu University of Technology, Dezhou 255000 , China)
1550
应用化工
第 45 卷
80 ℃ 水浴保温 磨 30 min,再将混合物转到烧杯中, 10 h, 300 ℃ 马弗炉中煅烧 3 h, 获得了粒径约 20 nm MnO2 颗粒, 的 α电化学测试发现其有较好的电容稳 定性和循环性能。 龚良玉 用固相氧化法制备了 [11 ] 物理掺杂 PbO 的 MnO2 。陈野等 用低温固相反应 法制备了化学掺杂 La2 O3 的 MnO2 。 1. 2 热分解法 经典热分解法研究源于 LaMer 和 Dinegar, 他们 认为在制备单分散纳米晶时需要一短暂 、 不连续的 成核过程, 而后控制晶核的生长 。 在此基础上, [13 ] Chen 等 将不同浓度的 Mn ( NO2 ) 2 溶液通过水热 处理从而得到了不同晶型与形貌的纳米二氧化锰 , 涉及的热分解反应方程式为: Mn( NO2 ) 2 MnO2 + 2NO 4NO + O2 + 2H2 O 4HNO2 柠檬酸为原料制备了前 以乙酸锰、 , 驱体柠檬酸锰 接着将前驱体大气环境下 300 ℃ 煅 罗旭芳等 MnO2 , 烧一定时间获得黑色粉末 γ表征发现其有隧 道结构, 电化学研究表明其比电容高达 109. 76 F / g。 通过调节加热速率分解前驱体乙酰丙 酮锰( III) 制备了球状纳米 MnO x ( 2 /3 < x < 1 ) 。 溶剂热分解法拥有如下优点: ① 因在有机溶剂 Zhang 等 内可以进行温度比较高的反应, 从而使某些无法在 低温下反应的物质可以在有机溶剂中热分解或者发 生反应; ②在溶剂中反应物有可能生成很高反应活 性的中间体, 用它来代替固相反应, 实现某些物质的 软化学合成, 往往该法可以获得具有特殊的光、 电、 磁性能的亚稳相物质
电解锰生产 工艺流程简述

第一章设计要求和原则1.1 概述本项目为俄罗斯CHEK-SU公司建设的年产8万吨电解金属锰项目,生产主原料为公司生产的氧化锰和碳酸锰精矿,采用湿法冶炼工艺,年生产天数330天,年生产产量为80000吨,设计四条电解生产线。
采用有硒电解、无铬钝化环保工艺,生产中产生的粉尘、酸雾回收利用,废水全部回收至污水处理站处理后重复使用,废渣排至尾矿库堆存,电解冷却水闭路循环使用。
1.2设计指导思想和编制原则1.2.1设计指导思想1、设计执行相关的方针、政策,使设计做到切合实际,技术先进,经济合理,安全适用。
2、全面贯彻综合利用俄罗斯CHEK-SU公司锰矿资源的基本方针,有效保护和科学合理开发利用当地资源。
3、优化冶炼工艺流程,在经济合理的条件下,尽量提高金属回收率。
4、遵循可持续发展的观念,严格执行环境保护法规、安全和工业卫生法规,加强综合利用,减少三废排放,完善三废处理设施,控制对环境的污染,做到环境措施与工程建设“三同时”。
5、设计中在各个环节注意节省能源和降低成本。
6、严格按设计程序开展设计工作,确保设计质量。
1.2.2设计原则、产品产量和质量及能源消耗保证值1、建设年产8万吨电解金属锰工厂,工厂一次建成投产;2、项目设计生产的产品为含Mn99.8%的电解金属锰(中华人民共和国黑色冶金行业标准(YB/T051-2003),牌号为DJMnD);3、主原料采用俄罗斯奇克苏福克公司生产的碳酸锰矿、氧化锰矿,湿法冶炼生产工艺;4、本项目采用目前行业最新的设备和工艺,对生产过程中产生的废气、废水、废渣均采取了有效的治理措施,达到清洁生产及环保要求,工艺技术达到目前同行业先进水平;5、本次项目采用的技术经济指标为:(1)每条电解生产线330天生产量为20000吨,设计四条电解生产线,生产规模80000吨/年(产品合格率为100%);(2)电解采用SeO2添加剂,正常生产时,电流效率68~70%,电流密度320~380A/m2,槽电压为4.2~4.6V,每吨锰直流电耗≤6500kWh;(3)项目采用的碳酸锰精矿Mn27%,氧化锰精矿Mn35%,本批次全锰分析结果中,二价锰回收率:85%;(4)电解金属锰产品Mn含量达到99.8%,即产品质量符合中华人民共和国黑色冶金行业标准YB/T051-2003;6、废弃场和排放场的再利用,应符合俄罗斯联邦的卫生和自然保护立法要求。
二氧化锰正极制备

制备二氧化锰(MnO2)正极材料通常有几种方法,以下是其中两种常见的方法:
1.化学合成法:
a. 准备一个适当的锰盐溶液,如锰硫酸盐溶液。
b. 在搅拌下,将还原剂(如氨水、亚硫酸盐等)缓慢加入到锰盐溶液中,此过程会产生沉淀。
c. 沉淀经过过滤、冷却和干燥后,得到二氧化锰粉末。
2.电化学沉积法:
a. 准备一个含有锰离子的电解液,如锰硫酸盐溶液。
b. 将金属锰作为阳极,选择合适的导电材料作为阴极,并将它们浸泡在电解液中。
c. 施加适当的电流和电位,在电极表面上使锰离子发生还原反应,形成二氧化锰沉淀。
d. 经过一定时间的沉积后,将电极取出并清洗,得到结晶良好的二氧化锰正极材料。
无论使用哪种方法,制备二氧化锰正极材料时需要注意控制反应条件,如温度、pH值、电流密度等,以获得所需的纯度和结晶度。
此外,后续的处理步骤可以包括过滤、洗涤、干燥和研磨等,以获得理想的形态和颗粒大小的二氧化锰材料。
电解二氧化锰化学式

电解二氧化锰化学式二氧化锰(英文名:Manganese dioxide,简称MnO2)是一种重要的二价锰化合物,化学式为MnO2。
它是一种黑色结晶固体,在自然界中以矿物锰矾(pyrolusite)的形式存在。
电解二氧化锰是电池行业中常用的材料之一,具有良好的电化学性能和催化活性。
电解二氧化锰的化学式是MnO2,其结构由间隙填充的锰离子和氧离子组成。
锰离子呈二价,氧离子为阴离子。
它的晶体结构有多种形式,最常见的是α-MnO2和β-MnO2。
α-MnO2具有针状晶体结构,而β-MnO2具有层状晶体结构。
电解二氧化锰的制备方法主要有化学法和电化学法两种。
化学法一般是将锰离子与氧离子反应生成二氧化锰。
最常见的方法是将锰离子溶解在酸性溶液中,然后加入过氧化氢或其他氧化剂,使锰离子氧化生成二氧化锰。
电化学法则是利用电流通过电解槽中的电解质溶液,使锰离子氧化析出二氧化锰。
电解二氧化锰在电池行业有广泛的应用。
它通常被用作电池正极材料,例如锂离子电池和碱性电池。
在锂离子电池中,正极材料为LiMnO2,其中的二氧化锰是重要的组成部分。
锂离子在充放电过程中与二氧化锰之间发生化学反应,释放出电荷。
电解二氧化锰在碱性电池中的应用较为广泛,可以用于制造碱性电池的阳极活性物质。
除了电池行业,电解二氧化锰还具有良好的催化活性,可用于氧气还原反应、丙烷氧化反应和醇氧化反应等。
例如,在氧气还原反应中,二氧化锰可以作为催化剂促进反应的进行,提高电池的能量转化效率。
在丙烷氧化反应中,二氧化锰可以将丙烷氧化成丙酮,用于工业合成等。
在醇氧化反应中,二氧化锰可以将醇氧化成酮或醛,用于有机合成过程中。
总之,电解二氧化锰是一种重要的化合物,具有广泛的应用前景。
它在电池行业是一种重要的正极材料,能够提供可靠的电化学性能。
同时,它还具有良好的催化活性,可用于氧气还原反应、丙烷氧化反应和醇氧化反应等。
随着科技的进步和应用领域的拓展,电解二氧化锰的应用前景将会更加广阔。
电解MnO2生产方法及工艺流程
电解MnO2生产方法及工艺流程
电解二氧化锰的生产方法分为高温法和低温法两种。
低温法的主要工艺条件:电解液温度20〜25°C,电解液硫酸浓度120〜200g/L,阳极电流密度500A/m2,电解生成的二氧化锰呈浆状悬浮于电解液中。
高温法的主要工艺条件:电解液温度95〜100C,电解液硫酸浓度30~50g/L,阳极电流密度40~100A/m2。
高温法与低温法相比具有阳极电流密度低、电解槽材质要求低、操作简单及生产连续化等优点,是目前各国生产EMD最主要的方法。
高温法沉积在阳极上的二氧化锰经过剥离、粉碎、漂洗、中和、干燥等处理后即成为电解二氧化锰产品。
电解二氧化锰按原料的不同,生产方法也可以分为碳酸锰矿法、氧化锰还原焙烧法和“两矿”法等工艺。
目前国内多采用矿酸锰矿法,即碳酸锰矿粉用硫酸浸出制得硫酸锰溶液经过滤、净化、电解而成。
国外多采用氧化锰还原焙烧法,即二氧化锰矿经粉碎、还原浸出、净化、电解而成。
“两矿”法即采用MnO2矿与硫铁矿还原浸出、净化、电解而成。
电解法生产的二氧化锰品位为90%〜94%,呈Y晶型,具有密度大、填充密度高等特点。
在电化学生能上还具有放电容量大、放电过电位低等优点。
现在世界上二氧化锰产量中EMD约占90%左右。
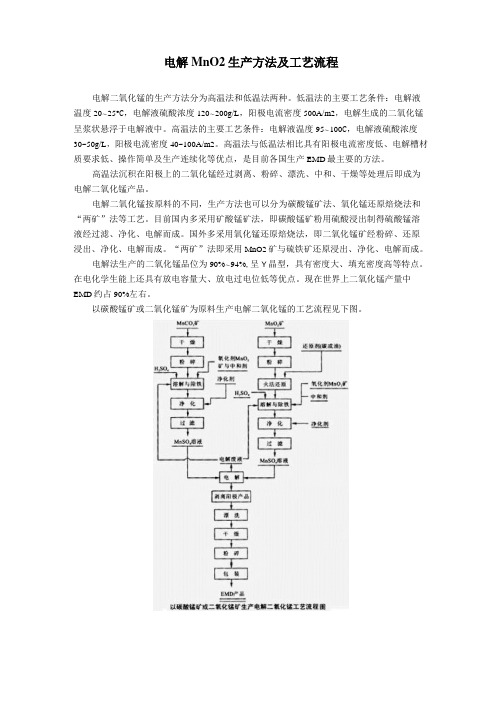
以碳酸锰矿或二氧化锰矿为原料生产电解二氧化锰的工艺流程见下图。
电解二氧化锰的结构与放电性能之间的关系

大家知道,二氧化锰是碱锰电池最主要的正极材料,可是大家知道它有什么性质,是怎样制成的吗?本期我们就给大家介绍一下二氧化锰的知识。
二氧化锰性质二氧化锰,英文名称manganese dioxide,工业用的二氧化锰主要分为三种:天然二氧化锰(NMD)、化学二氧化锰(CMD)、电解二氧化锰(EMD)。
天然二氧化锰矿中含有大量的杂质如SiO2、Al2O3等,最好的二氧化锰矿含二氧化锰量也不超过85%,即使是化学二氧化锰或电解二氧化锰,二氧化锰的含量也在93%以下,剩余成分为低价锰氧化物、吸附水与结合水、硫酸盐以及少量杂质。
电池原材料中二氧化锰的含量对电池的放电性能有着重要的影响,但绝非电解锰中二氧化锰含量高,放电容量就一定高。
二氧化锰主要的晶型有α、β、γ、δ型,它的性质和用途与其晶体结构密切相关。
我们碱性电池用的二氧化锰是属于γ型的,而δ型的主要用于可充碱性电池。
二氧化锰的密度是作为电池活性材料的一种重要性质。
电池有固定的装填体积,密度大,装填的活性物质就多,电池的放电容量就大些。
二氧化锰大多是多孔物质,所以一般用比重法测定密度。
二氧化锰的颗粒大小及粒度分布对电池放电性能也有很大的影响。
有人认为粗颗粒的二氧化锰放电性能要比细颗粒的好;而还有人认为用不同颗粒大小的合理搭配的正极放电容量更高,因为颗粒大小各有自身的特征,颗粒大的,晶粒的晶界电阻小,但晶粒之间电阻大;而颗粒小,反应的面积大,但晶界电阻大。
二氧化锰的表面性质决定着它释放有用功率的能力,而表面性质与二氧化锰的表面积、孔径和孔隙率有关。
天然二氧化锰的表面积在10~20m2/g之间,化学二氧化锰的表面积在50~100m2/g之间,而电解二氧化锰介于30~60m2/g。
表面积与活性的关系,总的说来没有确定的关系,在碱锰电池实际生产中,要求EMD有较小的表面积,约30m2/g,这样正极的空隙较大,电解液吸收更多,而且离子扩散的阻力较小。
这里我们说到孔隙和孔隙率,是因为二氧化锰是一种多孔物质。
高中化学竞赛初赛模拟试卷(13)

中学化学竞赛初赛模拟试卷(13)第一题(4分)有人受中国传统“水烟筒”的启发,利用其工作原理,设计出了一个特别的烟斗。
内盛Cu(NH3)2Ac溶液(专业商店有售),当吸烟时,烟气通过烟斗发生如下反应:Cu(NH3)2Ac+CO+NH 3Cu(NH3)3Ac·CO ΔH<01.物质Cu(NH3)2Ac为协作物,其名称为。
2.用这种特别烟斗除去CO的试验原理为。
3.用久后的Cu(NH3)2Ac又可送专业商店回收再生。
相宜再生的条件是什么?第二题(6分)当邻苯二甲酸氯在苯中用三氯化铝处理时,得到内酯A,而不是邻二苯甲酸苯。
已知邻苯二甲酸氯以另一种形式存在,其中两个氯原子连在一个碳原子上,试向这种酰氯的结构和内酯A的最可能结构。
第三题(8分)关于核的稳定性有以下两条阅历规则:①对于原子序数为20以前的元素而言,最稳定的核是核中的质子数(p)等于中子数(N)的核,即比值N/p=1;对于原子序数为20~83的元素而言,随着质子数增多,稳定核的N/p值随着原子序数的增加而增大,直到约为1.6,超过此值时,核就变得太大,而发生裂变。
这种改变趋势可用稳定核的N/p比值与p 的关系图(右图)表示。
该图的意义是:对某一元素X,其稳定核的N/p将落在曲线上或曲线上下旁边,若N/p 过高或过低,核将不稳定。
②马涛契规则(Mattauch’s rule)指出,两原子序数相连接的元素,如有相同质量的同位素,那么这两个同位素都不会是稳定的。
现已知42Mo的稳定同位素的质量数有:92、94、95、96、97、98、100;44Ru的稳定同位素的质量数有:96、98、99、100、101、102、104。
回答下列问题:1.为什么随着质子数增多,稳定核的N/p值随着原子序数的增加而增大?2.假如43Tc只可能存在两种同位素,那么分别是什么?3.可能存在43Tc的两种核是最稳定的吗?为什么?4.从本题你能得出关于43Tc什么样的结论?第四题(7分)苎烯是存在于橘子、柠檬等水果中的一种化合物,可被KMnO4氧化成等物质的量的和CO2。
电解锰工艺流程

电解锰工艺流程
《电解锰工艺流程》
电解锰是一种重要的工业化学品,广泛应用于冶金、电池、涂料和化工等领域。
其生产工艺主要包括矿石选矿、氧化焙烧、浸出萃取和电解析取等步骤。
首先是矿石选矿,主要利用重选和浮选来提取含锰矿石,然后经过破碎、磨细等工艺处理,得到精矿。
接下来是氧化焙烧,将精矿与氢氧化钠或氢氧化钾混合后,在空气中加热至一定温度进行焙烧,使其中的锰转化为四氧化三锰(MnO2)。
然后进行浸出萃取,将经过氧化焙烧的矿石与稀硫酸混合,使MnO2转化为亚砜锰,再通过萃取装置提取锰。
最后是电解析取,将得到的硫酸锰溶液通过电解槽进行电解,将亚砜锰还原为金属锰,从而得到电解锰产品。
整个工艺流程需要严格控制工艺参数,确保产品质量。
同时,还需要加强环保措施,减少废水产生,提高能源利用率,保护环境。
随着科技的不断进步,电解锰工艺流程也在不断完善,实现了高效、节能、环保的目标。
二氧化锰生产

二氧化锰生产production of manganese dioxide二氧化锰生产(produetion of manganese dioxide)从锰矿或锰中间产物中制取二氧化锰的过程。
在采用锰矿为原料时,先用硫酸使锰矿或锰焙砂中的锰转变成水溶性硫酸锰进入溶液,然后通过电解制得二氧化锰。
当采用锰中间产物为原料时,通过热分解、氧化等方法,使锰中间产物转变为二氧化锰。
用锰矿为原料的生产方法称为电解法,用锰中间产物为原料的生产方法称为化学法。
早在1918年,人们就用电解硫酸锰溶液的方法制得了适于干电池使用的电解二氧化锰(EMD)。
但这种方法直到第二次世界大战末期,才开始用于工业生产。
1944年,日本建立了第一个用电解法生产EMD的小规模工厂,到50年代由于需要高性能的军用干电池,促使日本对EMD生产工艺进行技术改造和扩大生产规模,于是日本便成为世界上EMD产量最多的国家。
60年代以来,电子工业的迅猛发展带动了电池工业的发展,二氧化锰的消耗量逐年增加。
1988年,国外EMD的年生产能力已超过18万t。
自70年代起比利时塞德曼(Sedema)公司致力发展化学二氧化锰(C MD)生产技术,年产CMD已超过4万t。
中国的EMD 工业起步较晚,1965年开始建立百吨级的生产车间,1988年的EMD 年生产能力已达2万t。
电解法主要包括菱锰矿硫酸浸出和溶液电解两个环节(见图)。
电解法生产二氧化锰流程浸出用过量10%的硫酸直接浸出经磨细的菱锰矿。
在浸出过程中,菱锰矿和硫酸作用生成水溶性MnSO4和CO2,MnCO3+H2SO4一MnSO4+H2O+CO2↑,浸出条件为:菱锰矿粒度小于147um,溶液温度353~363K,硫酸浓度100~150g/L。
在浸出过程中,向溶液内加入磨细的二氧化锰矿粉并通入空气,使溶液中的两价铁氧化成三价铁,然后用石灰乳中和,调节溶液至pH4~6,使Fe3+生成Fe(OH)3沉淀。
浸出液冷却后,溶液中的钙绝大部分以CaSO4沉淀,少量其他杂质如Pb2+、Ni2+、Co2+等也与Fe(OH)3一起沉淀。
电解高锰酸钾溶液方程式

电解高锰酸钾溶液方程式高锰酸钾是一种常用的强氧化剂,具有很强的氧化性能。
在水溶液中,高锰酸钾分解为高锰酸离子和氧气。
电解高锰酸钾溶液的方程式可以表示如下:2 KMnO4 + H2O --> 2 KOH + 2 MnO2 + 3[O]在这个方程式中,2 mol的高锰酸钾和1 mol的水反应生成2 mol 的氧气,同时生成2 mol的氢氧化钾和2 mol的二氧化锰。
这个反应是一个氧化还原反应,高锰酸钾被还原成了氧气和氢氧化钾,这是由于高锰酸钾本身具有很强的氧化性能。
电解高锰酸钾溶液是一种常用的水处理方法之一。
在水处理过程中,电解高锰酸钾溶液能够高效地氧化水中的有机物和无机杂质,使其转化为易于沉淀和过滤的物质,从而达到净化水质的目的。
电解高锰酸钾溶液的制备方法是将适量的高锰酸钾溶解在水中,然后通过电解的方式进行反应。
反应过程中,高锰酸钾分解为高锰酸离子和氧气,在溶液中发生氧化反应。
具体的反应方程式如下:2 KMnO4(aq) + H2O(l) --> 2 KOH(aq) + 2 MnO2(s) + 3[O2](g)在这个反应中,高锰酸钾溶于水中,形成高锰酸离子(MnO4-)和钾离子(K+)。
通过电解,高锰酸离子发生还原反应,还原成二氧化锰(MnO2)和氧气(O2)。
同时,溶液中的钾离子结合水中的氢离子形成氢氧化钾(KOH)。
这个反应是一个氧化还原反应,高锰酸钾起到氧化剂的作用,将水中的有机物和无机杂质氧化转化为易于处理的物质。
二氧化锰和氧气的生成也是该反应发生的基本原理。
在实际应用中,根据需要可以调整高锰酸钾的浓度和电解的时间,从而达到不同程度的氧化和净化水质的效果。
电解高锰酸钾溶液的实际应用非常广泛。
除了在水处理过程中被用作氧化剂之外,它还可以用于消毒和杀菌,处理废水和废气,以及其他一些化学工业和环境保护领域。
其具有高效、简便、无毒、无污染等优点,在水处理和环境保护方面得到了广泛的应用。
锰的生产

书山有路勤为径,学海无涯苦作舟锰的生产金属锰的生产采用铝热法、电热法和电解法。
铝热法必须采用优质锰矿作原料,且耗铝多,成本高;电热法工艺流程长,操作比较复杂;电解法则可用贫锰矿作原料获得高纯度的产品,得到广泛应用。
一、铝热法该法采用MnO2、MnO3、Mn3O4 和MnO 作原料,进行还原反应获得金属锰。
以MnO 作原料时,热量不够,需要补充热量;而用MnO2 作原料时,反应又过于激烈,不易控制。
用Mn2O3 和Mn3O4 作原料,能释放足够的热量,且易于控制。
冶炼时要用含杂质低的氧化锰矿,磨细后与约为理论需要量90% 的铝粒和相当于10%~20%铝量的石灰混合均匀后,用上部点火法冶炼。
所得金属锰产品含锰93%~96%,甚至更高,锰含量也因原料而异。
二、电热法先用锰矿配加少量焦炭在电炉中进行控制还原,炼得低铁、低锰的富锰渣(Mn>45%,P<0.03%,Fe<0.80%)。
富锰渣用木炭作还原剂,炼出低磷碳素锰铁,再加硅石、木炭,炼得高硅锰硅合金(Si>30%)。
最后用高硅锰硅合金和富锰渣配加石灰,在电弧炉内进行脱硅精炼,得到含锰93%~97%的金属锰。
三、电解法生产金属锰采用硫酸锰水溶液电解法。
虽然锰的电解电动势达-1.05V,但由于氢在金属锰上的过电压,锰仍然可从中性溶液析出到固体阴极上。
电解的重要条件是溶液中不含其他金属杂质,所以硫酸锰溶液必须在电解前充分净化。
此外在阳极上有Mn2++2H2O-2e→MnO2+4H+反应产生MnO2,所以必须采用隔膜电解槽。
硫酸锰电解的工业生产流程见下图所示。
采用菱锰矿作原料时,可直接溶解于稀硫酸。
如用氧化锰矿则须先经还原焙。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解MnO2生产方法及工艺流程
电解二氧化锰的生产方法分为高温法和低温法两种。
低温法的主要工艺条件:电解液温度20~25℃,电解液硫酸浓度120~200g/L,阳极电流密度500A/m2,电解生成的二氧化锰呈浆状悬浮于电解液中。
高温法的主要工艺条件:电解液温度95~100℃,电解液硫酸浓度30~50g/L,阳极电流密度40~100A/m2。
高温法与低温法相比具有阳极电流密度低、电解槽材质要求低、操作简单及生产连续化等优点,是目前各国生产EMD最主要的方法。
高温法沉积在阳极上的二氧化锰经过剥离、粉碎、漂洗、中和、干燥等处理后即成为电解二氧化锰产品。
电解二氧化锰按原料的不同,生产方法也可以分为碳酸锰矿法、氧化锰还原焙烧法和“两矿”法等工艺。
目前国内多采用矿酸锰矿法,即碳酸锰矿粉用硫酸浸出制得硫酸锰溶液经过滤、净化、电解而成。
国外多采用氧化锰还原焙烧法,即二氧化锰矿经粉碎、还原浸出、净化、电解而成。
“两矿”法即采用MnO2矿与硫铁矿还原浸出、净化、电解而成。
电解法生产的二氧化锰品位为90%~94%,呈γ晶型,具有密度大、填充密度高等特点。
在电化学生能上还具有放电容量大、放电过电位低等优点。
现在世界上二氧化锰产量中EMD 约占90%左右。
以碳酸锰矿或二氧化锰矿为原料生产电解二氧化锰的工艺流程见下图。
