体外诊断试剂综述资料产品校准品赋值资料TG
体外诊断试剂申报资料要求及常见问题

体外诊断试剂注册申报资操作规范的通知(12号)》中对申报资 料的基本要求规定,申报资料格式应当符合下列要求:
(1)申报资料应有所提交资料目录。 (2)申报资料应当按目录顺序排列并装订成册。 (3)申报资料一式一份,其中产品技术要求一式两份,
资料申报前需准备的事项-产品分类
体外诊断试剂类产品在《体外诊断试剂注册管理办法》中对分类的规定如下: 第十七条 根据产品风险程度由低到高,体外诊断试剂分为第一类、第二类、第
三类产品。 (一)第一类产品
1.微生物培养基(不用于微生物鉴别和药敏试验); 2.样本处理用产品,如溶血剂、稀释液、染色液等。 (三)第三类产品 1.与致病性病原体抗原、抗体以及核酸等检测相关的试剂; 2.与血型、组织配型相关的试剂; 3.与人类基因检测相关的试剂; 4.与遗传性疾病相关的试剂; 5.与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂; 6.与治疗药物作用靶点检测相关的试剂; 7.与肿瘤标志物检测相关的试剂; 8.与变态反应(过敏原)相关的试剂。
国家食品药品监督管理总局关于发布医疗器械注册证补办程序等5个相关工作程 序的通告(2015年第91号)
国家食品药品监督管理总局关于发布医疗器械注册指定检验工作管理规定的通告 (2015年第94号)
基本法律法规及知识储备的重要性
食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关 问题的通知(食药监械管〔2015〕247号)
体外诊断试剂综述资料:产品校准品赋值资料-TG

计量学溯源国际参考品(SRM 1951c)企业工作校准品(-80℃保存)产品校准品常规样本厂家选定测量程序厂家常规测量程序用户常规测量程序结果用户物质校准赋值程序实施不确定度企业选定常规实验室甘油三酯产品校准品赋值资料1 溯源链由于甘油三酯具有国际约定校准品,但无国际约定参考测量程序,不能在计量上溯源至SI的情况,依据GB/T 21415-2008/ISO17511:2003 文件5.5条款要求。
溯源链如下:2 产品校准品赋值程序2.1 产品校准品赋值程序2.1.1 MS-880B上赋值程序2.1.1.1系统检测采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV)。
如果测得精密度CV≤5.0%,均值在内部跟踪质控品靶值范围内,则可认为试剂和仪器分析系统符合要求。
2.1.1.2 产品校准品赋值程序采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定本公司产品校准品10瓶,每瓶测1次,计算十个数据的均值X1、标准差S1和变异系数CV1。
再取其中1瓶,检测10次,计算10个数据的均值X2、标准差S2,按照公式S瓶间=2221SS和CV 瓶间=S 瓶间/ X 1×100%计算CV 瓶间。
如果测得精密度CV 1和CV 瓶间≤5.0%,测得的均值X 1即为产品校准品的初步定值。
测定产品校准品10瓶,每瓶测一次取其中一瓶,重复测10次2.1.1.3 产品校准品可靠性验证采用本公司生产的甘油三酯检测试剂盒及美康MS-880B 全自动生化分析仪,以初步定值的产品校准品为标准作校准曲线(3号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV),同时测定40份样本。
(完整版)体外诊断试剂注册申报资料要求和批准证明文件格式的公告2014年9

附件1中华人民共和国医疗器械注册证(体外诊断试剂)(格式)注册证编号:审批部门:批准日期:年月日有效期至:年月日(审批部门盖章)附件2中华人民共和国医疗器械注册变更文件(体外诊断试剂)(格式)注册证编号:审批部门:批准日期:年月日(审批部门盖章)附件3体外诊断试剂注册申报资料要求及说明注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
体外诊断试剂注册资料综述材料编制模板
体外诊断试剂注册资料综述材料编制模板综述资料⼀、产品预期⽤途1.产品预期⽤途本试剂盒⽤于体外检测⼈体⾎清中葡萄糖的浓度,适⽤于xx⽣化分析仪。
本试剂盒的使⽤⼈员为经过医学检验专业学习的⼈员,熟悉并了解⽣化检验和⽣化分析仪的操作。
2.与预期⽤途相关的临床适应证背景情况⾎液中的葡萄糖称为⾎糖,异常⾎糖⽔平说明体内糖代谢异常,常⽤于糖尿病的诊断。
空腹⾎糖升⾼反映了胰岛素分泌能⼒,其增⾼与葡萄糖耐量减低是相平⾏的。
3.相关的临床或实验室诊断⽅法等葡萄糖检测试剂盒⽬前主要通过半⾃动或全⾃动⽣化分析仪来完成,主要⽤于肾脏疾患及糖尿病等的检查和诊断。
⼆、产品描述1.试剂盒的技术原理反应图⽰:xxxxxxxxx在XXnm处⽐⾊,计算出葡萄糖(GLU)的含量。
2.主要原材料的来源及制备⽅法xx:购于xx,分析纯。
xx:购于xx,分析纯。
xx:购于xx,分析纯。
xx:购于xx,分析纯。
3.主要⽣产⼯艺过程1)xx缓冲液配制(10L⼯艺图如下):2) 试剂⼀的配制:缓冲液中苯酚、稳定剂等成份,搅拌10~15分钟。
3)试剂⼆的配制:缓冲液中加⼊xx酶、过xx酶、xx等搅拌x分钟充分溶解,然后加⼊适量防腐剂,搅拌x分钟。
三、有关⽣物安全性⽅⾯的说明1.⼈源性材料须对有关传染病(HIV、HBV、HCV等)予以说明,并提供相关的证明⽂件;试剂盒中⽆⼈源性相关材料2.⽜、⽺源性的材料应当根据《关于含有⽜、⽺源性材料医疗器械注册有关事宜的公告》(国⾷药监械〔2006〕407号)的规定予以说明;试剂盒中⽆⽜、⽺源性的材料3.其他动物源及微⽣物来源的材料,应当提供相应的说明⽂件,证明其在产品运输、使⽤过程中对使⽤者和环境是安全的;试剂盒中⽆其他动物源及微⽣物来源的材料。
4.对于以上情况采取的病毒灭活等保证安全的具体试验⽅法的说明及相关证明⽂件。
试剂盒中⽆以上⼏个⽅⾯材料。
四、产品主要研究结果的总结和评价1.主要研究结果的总结试剂盒通过长期稳定试验、模拟运输试验、破坏试验、开瓶试验、分析性能研究及临床验证等,达到如下要求:1) 测定线性范围:xx~xxmmol/L,判定依据:r2≥x。
体外诊断试剂 校准品溯源报告 量值传递方案依据 GBT21415-2008ISO17511-2003 FT3测定试剂盒

游离三碘甲状腺原氨酸(FT3)测定试剂盒(免疫荧光法)校准品溯源报告1.目的制备性能稳定的工作校准品,用作游离三碘甲状腺原氨酸(FT3)测定试剂盒(免疫荧光法)的质控控制。
2.范围适用于游离三碘甲状腺原氨酸(FT3)(免疫荧光法)校准品的溯源、制备、赋值。
3.制备过程3.1材料(1)高纯度的三碘甲状腺原氨酸(FT3)抗原(纯度≥99%)。
(2)采用标准小牛血清作为基质。
3.2制备方法取适量高纯度的三碘甲状腺原氨酸(FT3)(纯度≥99%),用标准小牛血清将其稀释成约0.7、6.5、15、35、45pmol/L。
4.浓度测定、赋值过程4.1试剂参考测量程序:Biomerieux,SA生产的游离三碘甲状腺原氨酸检测试剂盒(酶联荧光法),注册证号:国械注进20162400887。
常规测量程序:***生物游离三碘甲状腺原氨酸(FT3)(免疫荧光法)测定试剂盒、干式免疫荧光分析仪;有证参考物质:中检所国家标准品150550-201203。
4.2赋值流程按下图的溯源流程对制备的工作校准品进行赋值。
物质程序实施4.2.1操作步骤4.2.1.1制造商选定测量程序(参考测量程序)的校准按《GB/T21415-2008/ISO17511:2003体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》4.2.2f 要求:制造商选定测量程序应是一个或多个现有一级或二级校准品校准的测量系统。
用参考测量程序重复测量中检所国家标准品150550-201203,对测量结果进行t 检验,验证测量值是否与参考物质的理论值存在显著差异。
在δ未知的情况下,单个平均数的显著性检验—t 检验(t-test)统计量计算公式如下:计量学溯源校准赋值国际公认参考测量程序中检所国家标准品150530-0312制造商工作校准品IVD 制造商内部参考测量程序:Biomerieux,SA 生产的游离三碘甲状腺原氨酸检测试剂盒(酶联荧光法)IVD 常设测量程序本公司产品多次测量制造商产品校准品IVD 制造商常规测量程序临床样本临床检测结果中检所或相关组织***IVD 制造商终端用户ns u x t 0-=参考测量程序校准结果如下:中检所国家标准品150550-201203(15.68pmol/L )参考测量程序测量值16.2315.2116.5614.3915.4814.9614.9114.3614.8616.5716.2615.7616.5016.8615.7715.0416.6216.2814.9315.9815.9817.1416.9517.0414.6115.3716.7616.7915.6314.6916.6717.1116.9515.8414.6017.0015.7916.3216.7115.7115.5714.66中检所国家标准品1150550-201203稀释后的理论值为15.68pmol/L ,经计算,统计量t=1.584<t (0.05,双侧)=2.326,参考测量程序检测结果与理论值差异不明显。
体外诊断医疗器械—生物样品中量的测量—校准品和控制物质赋值的计量学溯源性ISO 17511

(ISO 17511:2003, IDT)
(报批稿)
××××-××-××发布
××××-××-××实施
中 华 人 民 共 和 国 国家质量监督检验检疫总局 发布
前言
• 本标准等同采用ISO 17511:2003《体外诊断医疗器械——生物样品 中量的测量——校准品和控制物质赋值的计量学溯源性》。 • 为便于使用,本标准做了下列编辑性修改: • 本“国际标准”一词改为“本标准”; • 用小数点“.”代替作为小数点的逗号“,”; • 删除国际标准的前言。 • 本标准由SAC/TC136全国医用临床检验实验室和体外诊断系统标准 化技术委员会提出。 • 本标准由SAC/TC136全国医用临床检验实验室和体外诊断系统标准 化技术委员会归口。 • 本标准起草单位:北京市医疗器械检验所、罗氏诊断(上海)有限公 司。 • 本标准主要起草人:丛玉隆、冯仁丰、张新梅、胡冬梅、陶源、康娟。
•
b)测量结果不能在计量上溯源至SI的量。 1)有可用的国际约定的参考测量程序(见3.12)(不能称为一级参 考测量程序)和一个或多个由此程序赋值的国际约定校准物(见 3.11)。如HbA1C(糖化血红蛋白)即是符合该情况的量的组 分(见5.3和图3)。 Hb:HbA(97%) HbA2(2.5%) HbF(0.5%) HbA1(快速血红蛋白)即通常说的糖化血红蛋白HbA1a、 HbA1b、 HbA1c HbA1=HbA1a+ HbA1b+ HbA1c 糖尿病时HbA1c显著生高, HbA1同糖 尿病时血液葡萄糖控制程度有关。 HbA1a 0.8% HbA1b 1.0% HbA1c 7.3% 4.1—6% HbA1 9.2% 5—8%
• 常规通常检验医学可提供400~700类量的结果。其中这些量中的大 多数,因为仅由(参考)测量程序组成一个计量上的较高步骤、或因 测量程序和(参考)校准品组成两个较高步骤等,终止了产品校准品 赋值上计量的可追溯性。原因是许多这样的量通常和具有临床上相关 性质的分子种类混合物有关,但是,这些比例各异的分子具有不同的 结构和相对分子量,如:糖蛋白。 • 根据计量学溯源至SI的可能性及测量程序和校准品的不同计量水平的 可获得性,证实了有如下五种典型的计量学溯源链的上端。 • a)测量结果可以在计量上溯源至SI的量。 有可用的一级参考测量程序和一个或多个(经认定的)一级参考物质 (用作校准品)。达到这样水平的有约25~30个类型的量,具有良 好确定的组分,如:一些电解质、代谢物、甾体激素和一些甲状腺激 素。在医学实验室提供的常规结果中,这些量占较大部分(见4.2.2, 5.2,图1和图2)。
体外诊断试剂校准品物、质控品物研究技术指导原则

体外诊断试剂校准品(物)、质控品(物)研究技术指导原则体外诊断试剂校准品(物)(包括真实度控制品)、质控品(物)(简称校准品、质控品)是实现体外诊断试剂临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。
校准品、质控品研究技术资料应包括产品技术要求、试验方法等重要信息,是指导注册申请人(简称申请人)单独申请注册校准品、质控品的重要技术性文件之一。
本研究技术指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》、《医疗器械标准管理方法》的相关规定。
参考国际标准化组织(ISO)、美国食品药品监督管理局(FDA)、临床化学国际联合会(IFCC)等有关体外诊断试剂方面的指南,对编写的格式及各项内容的要求进行了详细的说明。
其目的是为体外诊断试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册管理部门审核体外诊断试剂校准品、质控品提供参考。
由于校准品、质控品种类多、范围广、临床使用重要性强且使用目的差别大,因此,申请人应根据产品特点及临床使用目的编写技术资料,以便于关注者获取准确的信息。
申请人应该提供校准品、质控品产品标准和技术资料,技术资料的要求参见《体外诊断试剂注册管理办法(试行)》。
产品标准格式和具体内容如下(不限于):一、范围应明确陈述本标准规范的对象和所涉及的方面,指明使用的界限。
二、规范性引用文件应包括引导语和规范性引用文件的一览表。
一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。
例如:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2000 标准化工作导则第1部分:标准的结构和编写规则GB/T 191-2000 包装储运图示标志YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号ISO 17511 体外诊断医疗器械生物源性样品中量的测量校准品和质控物质赋值的计量学溯源性ISO 18153 体外诊断医疗器械生物源性样品中量的测量校准品和控制物质中酶催化浓度赋值的计量学溯源性三、分类和组成及其它(一)组成成份应说明主要组成成份及其生物学来源。
关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明.pdf

天津市体外诊断试剂校准品和质控品技术审查要点1范围本文规定了对建立或确认测量正确度为目的的校准品和质控品赋值的计量学溯源性进行确认的方法,校准品和质控品由生产企业提供,作为体外诊断试剂的一部分或与其一起使用。
适用于体外诊断试剂校准品和质控品的技术审查。
2规范性引用文件下列文件中的条款通过本说明的引用而成为本说明的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本说明,然而,鼓励根据本说明达成协议的各方研究是否可以使用这些文件的最新版本。
凡是注日期的引用文件,其最新版本适用于本说明。
GB/T 21415 - 2008/ISO 17511: 2003 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源GB/T 19702 - 2005/ISO 15193: 2002 体外诊断医疗器械生物源性样品中量的测量参考测量程序的说明GB/T 19703 - 2005/ISO 15194: 2002 体外诊断医疗器械生物源性样品中量的测量参考物质的说明3术语与定义下列术语与定义适用于本说明3.1计量学溯源性 metrological traceability通过一条具有规定不确定度的不间断的比较链,使测量标准的值能够与规定的参考标准,通常与国家标准或国际标准联系起来的特性。
3.2国际标准品具有最高的计量学特性,其值不必参考相同量的其他标准,被指定或普遍承认的测量标准。
3.3国家标准品用国际标准品标定的,或我国自行研制的(尚无国际标准品者)用于微生物(或其产物)的定性鉴定或疾病诊断的生物试剂、生物材料或特异性抗血清。
3.4企业标准品通过与相同量的国际(国家)标准品和/或进口(国产)试剂比对而定值的测量标准。
3.5浓储液使用国家标准品和/或企业标准品赋值,作为企业标准品和或校准品配制过程中的母液。
3.6校准品 Calibritaor具有在校准函数中用作独立变量值的参考物质。
体外诊断试剂(医疗器械)验收标准

体外诊断试剂(医疗器械)验收标准第一篇:体外诊断试剂(医疗器械)验收标准附件体外诊断试剂(医疗器械)经营企业验收标准第一章机构与人员第一条体外诊断试剂(医疗器械)经营企业的法定代表人或企业负责人、质量管理人员无《医疗器械监督管理条例》第四十条规定的情形。
企业负责人应具有大专以上学历,熟悉国家有关体外诊断试剂管理的法律、法规、规章和所经营体外诊断试剂的知识。
第二条应有与经营规模相适应的质量管理人员,质量管理人员应行使质量管理职能,对诊断试剂质量具有裁决权。
其中1人为主管检验师,或具有检验学相关专业大学以上学历并从事检验相关工作3年以上工作经历。
质量管理人员应在职在岗,不得兼职。
第三条验收、售后服务人员应具有检验学中专以上学历;企业保管、销售等工作人员,应具有高中或中专以上文化程度。
第四条质量管理、验收、保管、销售等工作岗位的人员,应接受上岗培训,考试合格,方可上岗。
第二章制度与管理第五条应根据医疗器械管理的法律法规和相关文件制定符合企业实际的质量管理文件,包括质量管理制度、职责、工作程序。
(一)质量管理制度应包括:质量管理文件的管理,内部评审的规定,质量否决的规定,诊断试剂购进、验收、储存、销售、出库、运输、售后服务的管理,诊断试剂有效期的管理,不合格诊断试剂的管理,退货诊断试剂的管理,设施设备的管理,人员培训的管理,人员健康状况的管理,计算机信息化管理。
(二)质量管理职责应包括:质量管理、购进、验收、储存、销售、运输、售后服务、信息技术等岗位的职责。
(三)工作程序应包括:质量管理文件管理的程序,诊断试剂购进、验收、储存、销售、出库、运输、售后服务等程序,诊断试剂销后退回的程序,不合格诊断试剂的确认及处理程序。
第六条应建立购进、验收、销售、出库、运输等内容的质量管理记录。
第三章设施与设备第七条应有明亮整洁的办公、营业场所,其面积应与经营规模相适应,但不得少于100平方米。
第八条应设置符合诊断试剂储存要求的仓库,其面积应与经营规模相适应,但不得少于60平方米,且库区环境整洁,无污染源;诊断试剂储存作业区应与经营、办公等其他区域有效隔离;库房内墙、顶和地面应光洁、平整,门窗结构严密。
体外诊断试剂校准品(物),质控品(物)研究技术指导原则(征求意见稿)

附件5:体外诊断试剂生产及质量控制技术指导原则——体外诊断试剂校准品(物)、质控品(物)研究技术指导原则体外诊断试剂校准品(物)(包括真实度控制品)、质控品(物)(简称校准品、质控品)是实现体外诊断试剂临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。
校准品、质控品研究技术资料应包括产品技术要求、试验方法等重要信息,是指导注册申请人(简称申请人)单独申请注册校准品、质控品的重要技术性文件之一。
本研究技术指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》、《医疗器械标准管理方法》的相关规定。
参考国际标准化组织(ISO)、美国食品药品监督管理局(FDA)、临床化学国际联合会(IFCC)等有关体外诊断试剂方面的指南,对编写的格式及各项内容的要求进行了详细的说明。
其目的是为体外诊断试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册管理部门审核体外诊断试剂校准品、质控品提供参考。
由于校准品、质控品种类多、范围广、临床使用重要性强且使用目的差别大,因此,申请人应根据产品特点及临床使用目的编写技术资料,以便于关注者获取准确的信息。
申请人应该提供校准品、质控品产品标准和技术资料,技术资料的要求参见《体外诊断试剂注册管理办法(试行)》。
产品标准格式和具体内容如下(不限于):一、范围应明确陈述本标准规范的对象和所涉及的方面,指明使用的界限。
二、规范性引用文件应包括引导语和规范性引用文件的一览表。
一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。
例如:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2000 标准化工作导则第1部分:标准的结构和编写规则GB/T 191-2000 包装储运图示标志YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号ISO 17511 体外诊断医疗器械生物源性样品中量的测量校准品和质控物质赋值的计量学溯源性ISO 18153 体外诊断医疗器械生物源性样品中量的测量校准品和控制物质中酶催化浓度赋值的计量学溯源性三、分类和组成及其它(一)组成成份应说明主要组成成份及其生物学来源。
(完整版)体外诊断试剂注册申报资料要求及说明

附件3体外诊断试剂注册申报资料要求及说明注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
其他动物源及微生物来源的材料,应当提供相应的说明文件,证明其在产品运输、使用过程中对使用者和环境是安全的,并对上述原材料所采用的灭活等试验方法予以说明。
(四)有关产品主要研究结果的总结和评价。
(五)其他。
包括同类产品在国内外批准上市的情况。
体外诊断试剂注册申报资料要求和批准证明文件格式

附件1中华人民共和国医疗器械注册证(体外诊断试剂)(格式)注册证编号:审批部门:批准日期:年月日有效期至:年月日(审批部门盖章)附件2中华人民共和国医疗器械注册变更文件(体外诊断试剂)(格式)注册证编号:审批部门:批准日期:年月日(审批部门盖章)附件3体外诊断试剂注册申报资料要求及说明注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
体外诊断试剂的相关介绍和分析
体外诊断试剂相关介绍及分析1.体外诊断试剂的简介1.1体外诊断试剂相关概念⏹生物制品是以微生物、寄生虫、动物毒素、生物组织等为起始材料,采用生物学工艺或分离纯化技术制备并以生物学技术和分析技术控制中间产物和成品质量制成的生物活化制剂。
⏹诊断试剂从一般用途来分,可分为体内诊断试剂和体外诊断试剂两大类。
除用于体内诊断的如旧结核菌素、布氏菌素、锡克氏毒素等皮内用的诊断试剂等外,大部分为体外诊断试剂。
⏹体外诊断试剂是指对从人体内提取的样本(包括捐献的血液和组织)在体外进行检查的试剂、组合试剂、校准物品、对照材料等。
体外诊断试剂可单独或与试验工具、仪器、器具、设备或系统组合使用。
1.2体外诊断试剂的原理分类⏹作用原理:体外诊断试剂是化学检测方法中最重要的部分,通过诊断试剂和体内物质在体外的化学反应来判断体内物质的性质和数量,通过和标准品的比较来判断人体的生理状态,主要应用在疾病的诊断上。
1.2.1临床生化试剂临床生化试剂主要有测定酶类、糖类、脂类、蛋白和非蛋白氮类、无机元素类、肝功能、临床化学控制血清等几大类产品,主是用于配合手工、半自动和一般全自动生化分析仪等仪器检测,有单试剂、液体双试剂、干粉双试剂、化学法试剂、标准品等规格,同时各厂家都提供适用于检测室间、室内质控的质控血清系列。
1.2.2免疫诊断试剂免疫诊断试剂在诊断试剂盒中品种最多,根据诊断类别,可分为传染性疾病、内分泌、肿瘤、药物检测、血型鉴定等。
从结果判断的方法学上又可分为EIA、胶体金、化学发光、同位素等不同类型试剂,其中同位素放射免疫的试剂由于对环境污染比较大,目前在国际市场上已经被淘汰,国内还有少量使用。
1.2.3分子诊断试剂分子诊断试剂主要有临床已经使用的核酸扩增技术(PCR)产品和当前国内外正在大力研究开发的基因芯片产品。
PCR产品灵敏度高、特异性强、诊断窗口期短,可进行定性、定量检测,曾广泛用于肝炎、性病、肺感染性疾病、优生优育、遗传病基因、肿瘤等的检测,但由于市场混乱和交叉污染等原因,卫生部严令禁止了荧光电泳定性类PCR试剂在临床的应用,目前国家食品药品监督管理局已经批准了少量已解决了交叉污染的杂交半定量和定量试剂盒。
体外诊断试剂注册申报资料要求

体外诊断试剂注册申报资料要求及说明一、监管信息(一)章节目录应当包括本章的所有标题和小标题,注明目录中各内容的页码。
(二)申请表按照要求填写完整,电子申报申请表在系统中填报完整后自动生成。
(三)术语、缩写词列表如适用,应当根据注册申报资料的实际情况,对其中出现的需要明确含义的术语或缩写词进行定义。
(四)产品列表以表格形式列出拟申报产品的包装规格、主要组成成分,以及每个包装规格的标识(如货号、器械唯一标识等)和描述说明。
(五)关联文件1.企业营业执照副本或事业单位法人证书复印件。
2.通过国家药品监督管理局《创新医疗器械特别审查程序》、江苏省药品监督管理局《江苏省第二类医疗器械创新产品注册程序(试行)》的产品申请注册时,应当提交通过创新医疗器械审查的相关材料。
3.委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议。
4.进口医疗器械注册人通过其在境内设立的外商投资企业按照进口医疗器械产品在中国境内企业生产有关规定申请注册时,应当提交进口医疗器械注册人同意注册申报的声明或授权文件;还应当提供申请人与进口医疗器械注册人关系(包括法律责任)的说明文件,应当附相关协议、质量责任、股权证明等文件。
5.主文档授权信如适用,申请人应当对主文档引用的情况进行说明。
申请人应当提交由主文档所有者或其备案代理机构出具的授权申请人引用主文档信息的授权信。
授权信中应当包括引用主文档的申请人信息、产品名称、已备案的主文档编号、授权引用的主文档页码/章节信息等内容。
(六)申报前与监管机构的联系情况和沟通记录1.在产品申报前,如果申请人与监管机构针对申报产品以会议形式进行了沟通,或者申报产品与既往注册申报相关。
应当提供下列内容(如适用):(1)列出监管机构回复的申报前沟通。
(2)既往注册申报产品的受理号。
(3)既往申报前沟通的相关资料,如既往申报会议前提交的信息、会议议程、演示幻灯片、最终的会议纪要、会议中待办事项的回复,以及所有与申请相关的电子邮件。
2、体外诊断试剂申报资料要求

11.产品风险分析资料
12.产品技术要求
1
1.证明性该文件 境内:企业营业执照副本复印件、组织机构代码证复印件 2.综述资料 产品预期用途:用途、临床背景、相关方法。 产品描述:技术原理、原材料、生产工艺、质控校准溯源 生物安全性方面的说明:人源材料、牛羊源性、其他动物源 及微
生物来源、病毒灭活措施及证明文件。 产品主要研究结果的总结和评价:主要研究结果总结、产品评价。 其他:同类产品上市情况、技术方法及临床应用、与同类产品异
(注册人提供产品没有变化的声明) 四、原医疗器械注册证及其附件的复印件、历次医疗器械注册变
更文件复印件 五、注册证有效期内产品分析报告 六、产品检验报告 七、符合性声明 八、其他
8
延续注册——注册证有效期内产品分析报告 (一)产品临床应用情况,用户投诉情况及采取的措施。 (二)医疗器械不良事件汇总分析评价报告(不良事件列表、
同、新产品预期用途文献。 3.主要原材料 主要原材料的选择、制备及质量标准 质控品、校准品的原料选择、制备、定值过程 校准品的溯源性文件(具体的溯源过程)
2
5.主要生产工艺及反应体系研究资料 主要生产工艺包括: 工作液的配制、分装和冻干;固相载体的包被和组装; 显色/发光系统等的描述及确定依据等。 反应体系包括: 样本采集及处理;样本要求;样本用量;试剂用量;反应条
差异,如存在产品性能差异,需要提交采用变更的包装规 格产品进行分析性能评估的试验资料;如产品性能无差异, 需要提交变更的包装规格与已上市包装规格之间不存在性 能差异的详细说明,具体说明不同包装规格之间的差别及 可能产生的影响。
17
(八)变更适用机型 1.采用新的适用机型进行分析性能评估的试验资料。 2.提供变更前、后的产品技术要求、产品说明书和标签样 稿(如涉及)。
体外诊断试剂综述资料:产品校准品赋值资料-TG
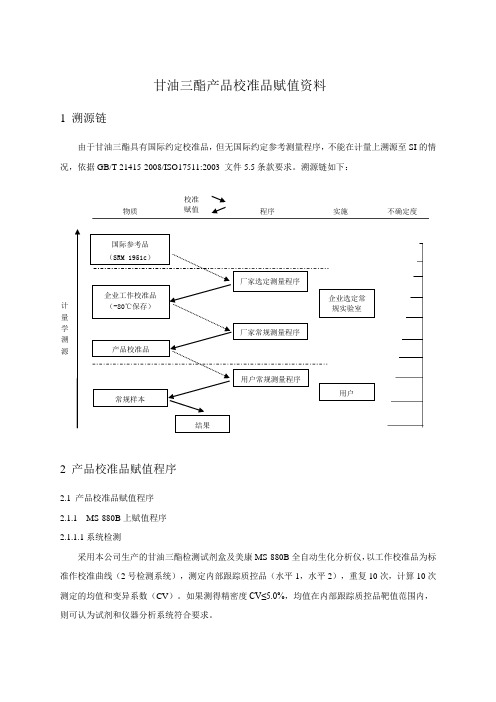
计量学溯源国际参考品(SRM 1951c)企业工作校准品(-80℃保存)产品校准品常规样本厂家选定测量程序厂家常规测量程序用户常规测量程序结果用户物质校准赋值程序实施不确定度企业选定常规实验室甘油三酯产品校准品赋值资料1 溯源链由于甘油三酯具有国际约定校准品,但无国际约定参考测量程序,不能在计量上溯源至SI的情况,依据GB/T 21415-2008/ISO17511:2003 文件5.5条款要求。
溯源链如下:2 产品校准品赋值程序2.1 产品校准品赋值程序2.1.1 MS-880B上赋值程序2.1.1.1系统检测采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV)。
如果测得精密度CV≤5.0%,均值在内部跟踪质控品靶值范围内,则可认为试剂和仪器分析系统符合要求。
2.1.1.2 产品校准品赋值程序采用本公司生产的甘油三酯检测试剂盒及美康MS-880B 全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定本公司产品校准品10瓶,每瓶测1次,计算十个数据的均值X 1、标准差S 1和变异系数CV 1。
再取其中1瓶,检测10次,计算10个数据的均值X 2、标准差S 2,按照公式S瓶间=2221S S 和CV瓶间=S瓶间/ X 1×100%计算CV瓶间。
如果测得精密度CV 1和CV瓶间≤5.0%,测得的均值X 1即为产品校准品的初步定值。
测定产品校准品10瓶,每瓶测一次取其中一瓶,重复测10次2.1.1.3 产品校准品可靠性验证采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以初步定值的产品校准品为标准作校准曲线(3号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV),同时测定40份样本。
体外诊断试剂-质控物or质控品研究资料-不同机型赋值报告

血红蛋白检测试剂盒(SLS-Hb法)质控品研究资料-不同机型赋值报告1.概述本公司血红蛋白检测试剂盒(SLS-Hb法)自带质控品1、质控品2,其测量值的上限是通过系统测量后进行统计学处理修订得来的。
2.赋值程序测量日期重复次数机型1机型2机型3机型4机型5机型6机型7机型8机型9机型10瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2参考《YY/T1709-2020体外诊断试剂用校准品测量不确定度评定》,选择已经通过校准的广东****科技有限公司BD-100干化学生化免疫层析一体机、Agilent Cary60紫外可见分光光度计、岛津紫外可见近红外分光光度计UV-3600Plus、岛津紫外可见分光光度计UV1900、岛津紫外可见分光光度计UV-2600、上海美谱达UV-670紫外可见分光光度计、上海元析双光束紫外可见分光光度计UV-9000S、梅特勒紫外可见分光光度计UV5、尤尼柯UV-4802双光束扫描型紫外可见分光光度计、日立UH-4150紫外可见近红外分光光度计以及经工作校准品(已按要求进行量值溯源)校准的血红蛋白检测试剂盒(SLS-Hb法)分别在不同仪器上对生理盐水进行测试,连续5天,每天五次,每次两瓶,然后对检测结果进行正态性检验及方差齐性检验,若通过检验,则对各组数据进行方差分析,若差异不显著,则不同机型可合并赋值,计算总平均值和总标准差。
以“平均值±2×标准差”为取值的95%置信区间。
3.测试结果3.1质控品1测试结果第1天152.3153.7651.4950.3651.5552.8550.1453.7752.1552.5654.8754.3751.0455.1150.9150.2652.0052.6149.3951.28 250.4954.2350.2949.8851.8749.9350.4752.2951.5252.8151.3551.3950.9450.8955.1452.6451.8950.0451.4554.38 352.3552.6251.3651.9851.1750.1352.2451.2952.1349.7650.7653.5052.2951.2849.9349.6751.4155.5751.4351.08 449.7050.7452.4852.3050.3751.1952.3950.8650.0649.5553.1851.2649.4551.2652.1252.2652.8753.0951.3352.81 550.4451.9951.4652.7652.0651.7851.5252.3551.4650.7451.9452.0751.6454.0651.0951.4252.6050.1550.3051.21第2天150.6951.3551.5152.8652.2452.5551.1552.8352.5348.8952.5252.3552.2249.8953.5651.9451.6153.5352.6953.55 252.1653.0852.4451.7352.1251.5653.1049.7351.4351.6656.0452.6151.4454.0949.2852.5151.9951.8751.4454.09 352.5650.7552.2750.4453.8250.6052.6551.4850.1850.8553.2352.6552.0451.2252.3750.9850.5652.2451.5752.04 450.8350.8454.2053.1551.2752.1454.1651.3452.6352.9652.0052.7348.7849.3950.4152.0750.7752.5052.3051.00 550.0751.2753.2450.1951.3452.6051.8149.6052.7450.4153.0752.6853.0349.7352.1550.5251.0351.2749.5150.87第3天153.5151.2352.3052.5451.5353.7151.3850.7052.5353.4650.5752.6752.0552.5550.9548.9550.3152.9654.1853.52 250.9250.8750.5053.1350.6753.5650.8552.7650.4752.5253.1450.7451.1352.5855.0950.6550.5250.1752.2852.98 353.0550.4952.3050.5150.8550.8852.6152.1750.2153.4354.5852.2951.9752.4452.4352.1450.9850.6552.5252.73 450.9249.8851.4552.8150.4350.6052.3053.6053.2951.7552.7151.0953.1053.6753.8351.6651.6452.5252.7251.53 550.6852.3552.8849.2454.6452.2952.7352.4651.9451.8152.9451.5550.6851.7451.7750.0652.2749.6352.0950.45第4天151.6053.2554.6050.5552.7152.9150.2752.9553.3051.4751.5350.9253.2450.2353.0452.3552.2551.4650.7950.68 252.6250.9653.7351.6951.6052.7150.8352.3851.1451.6951.9852.5649.8952.6852.2850.0750.1052.6253.1151.39 349.4451.1052.4853.5251.4851.3051.8052.6649.1554.7350.6250.5452.0052.2652.3451.5652.6452.2151.8251.15 452.1252.9148.9350.3549.7150.2652.4152.5152.4551.5653.2652.3151.0050.6249.5250.9052.6452.2651.9950.88 551.5251.3051.3352.0152.4353.3753.3351.7151.9552.7351.7350.8850.3151.1750.0349.9051.6349.8252.1852.74第5天153.2250.7754.5352.0649.5051.3952.7951.9252.7751.9152.6353.8951.9554.8451.8752.3053.7650.5850.7551.56 248.5252.6052.4551.4551.8049.9253.2950.6752.5649.0051.7152.3051.7952.8850.1553.6352.3355.3751.0953.82 352.6950.6353.5550.5350.7552.0152.7952.3450.4151.5653.7051.0954.5452.0052.1650.6752.5053.4051.5352.00 450.4953.6651.4452.3454.7651.4054.0952.1451.2651.5251.3452.2553.3451.3353.0652.6551.6453.5152.1651.55552.3252.7451.3150.0253.9253.9051.5350.7852.9353.8452.3850.6751.8151.5051.9050.4051.2253.2550.8750.89 3.2质控品2测试结果测量日期重复次数机型1机型2机型3机型4机型5机型6机型7机型8机型9机型10瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2瓶1瓶2第1天198.3598.5799.8197.92101.1999.5698.69100.17101.08103.4697.69103.9097.5498.33101.89100.4597.22103.2494.52101.98 2100.7095.1698.45100.6595.9596.31101.3099.9499.6496.9496.6798.22100.76102.70101.01103.5899.88102.0099.07103.28 3103.22100.37100.5399.5398.1298.24100.6499.24101.6498.35100.59101.0699.35101.2199.6197.5897.5195.85100.0896.12 4100.36102.1899.9399.2899.89104.3994.9899.76100.4498.5097.9599.25101.2098.22100.8997.5496.1598.5898.2898.44 5102.09100.0997.40103.0198.7898.86101.2299.27105.2098.72103.64102.5499.8197.3199.12100.0099.5899.9999.98102.84第2天1100.0297.6397.0399.1099.41102.05100.70101.91105.4397.1197.7099.7699.46101.41103.45100.9296.55100.78102.62101.56 299.2096.3592.7999.9898.8896.19104.77100.1798.68103.3599.89101.88103.0499.28101.3598.67104.0497.37100.2796.44 394.4599.37102.8198.2497.63100.19102.90101.68102.45102.1399.30106.6199.5799.1197.7899.73100.0697.1394.6999.41 4100.54103.69101.9495.7999.8096.0997.60102.72101.8496.70101.4099.78100.09101.0196.7099.38101.63100.0999.1197.85 5101.8797.9098.95103.26102.9597.1498.81103.67107.58100.6398.8398.18101.7899.0399.1196.5296.4799.2298.8397.72第3天198.9699.63101.14101.4099.49102.63106.1498.2897.95103.2099.75101.7299.3198.27101.8793.7097.33100.85100.7698.92 298.41102.33100.5599.1598.4099.77102.82100.2996.43105.50102.2498.58102.14101.23101.24102.9899.3896.09102.0596.16 397.47102.0599.0898.8096.4498.2796.55100.70100.00101.39100.2799.81102.31104.38100.85101.38100.48101.98101.22105.55 498.9199.0198.38102.01103.95100.9698.5297.58101.3199.2998.9599.5995.5298.4596.81101.67100.3097.9595.0897.24 596.6599.2598.48100.1596.3099.33100.2397.0198.5497.7799.67105.0096.6297.0198.84100.27100.20102.47104.70100.16第4天193.6399.47100.94101.92101.31100.6399.6497.0599.1397.87102.96102.8498.27102.31104.87103.63100.87102.1298.19103.62 294.03105.5796.95100.0294.53102.68101.9997.4597.95100.7098.0398.93102.16100.6798.64101.67103.1496.7196.68101.43 3100.1599.2898.15100.73100.34102.70100.96102.2699.9698.1598.9398.0198.87100.5097.6497.43102.2797.16104.87103.504101.0498.90103.03101.33100.3798.8293.21100.12105.54102.93100.7299.9398.3195.05101.8097.0797.40104.09101.7096.215103.61100.8296.82101.16100.3498.24100.5396.38103.82100.79101.83101.7496.5498.5495.9399.7597.8895.4098.22103.34第5天1101.9899.93100.7399.9599.94107.1694.8494.8595.47100.3597.1098.8099.07103.3697.74100.4399.32103.4999.90100.58297.3299.13100.7497.26101.0796.6697.7498.6299.60102.8099.0099.2897.4397.1498.3799.1998.71101.73100.8098.80395.58105.55100.6396.4799.3698.6897.42101.41100.53101.4898.08101.78101.47102.44100.2199.5498.6594.31101.6799.51498.52101.3998.6497.74100.1398.5999.8399.9499.3495.2197.9598.6096.6598.88100.52100.36101.26103.58102.91102.605101.03104.75101.01101.03100.5798.7898.39100.62100.54105.21103.0798.6897.94101.56100.9796.47101.1998.5593.4493.193.3正态检验结果依据《GBT 4882-2001数据的统计处理和解释正态性检验》质控品1:T EP =0.2158<T p0.05<p=0.467,质控品2:T EP =0.0983<T p0.05<p=0.467统计结果显示数据符合正态分布。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计量学溯源国际参考品
(SRM 1951c)
企业工作校准品
(-80℃保存)
产品校准品
常规样本
厂家选定测量程序
厂家常规测量程序
用户常规测量程序
结果
用户
物质
校准
赋值程序实施不确定度
企业选定常
规实验室
甘油三酯产品校准品赋值资料
1 溯源链
由于甘油三酯具有国际约定校准品,但无国际约定参考测量程序,不能在计量上溯源至SI的情况,依据GB/T 21415-2008/ISO17511:2003 文件5.5条款要求。
溯源链如下:
2 产品校准品赋值程序
2.1 产品校准品赋值程序
2.1.1 MS-880B上赋值程序
2.1.1.1系统检测
采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV)。
如果测得精密度CV≤5.0%,均值在内部跟踪质控品靶值范围内,则可认为试剂和仪器分析系统符合要求。
2.1.1.2 产品校准品赋值程序
采用本公司生产的甘油三酯检测试剂盒及美康MS-880B 全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定本公司产品校准品10瓶,每瓶测1次,计算十个数据的均值X 1、标准差S 1和变异系数CV 1。
再取其中1瓶,检测10次,计算10个数据的均值X 2、标准差S 2,按照公式S 瓶间=2221S S 和CV
瓶间
=S 瓶间/ X 1×100%计算CV
瓶间。
如果测得精密度CV 1和
CV 瓶间≤5.0%,测得的均值X 1即为产品校准品的初步定值。
测定产品校准品10瓶,每瓶测一次
取其中一瓶,重复测10次
2.1.1.3 产品校准品可靠性验证
采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以初步定值的产品校准品为标准作校准曲线(3号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV),同时测定40份样本。
另外采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),同时测定40份样本。
如果测得内部跟踪质控品的精密度CV≤5.0%,40份样本两次测值的相关性分析(Y=aX+b),a与1的相对偏差≤2.0%,b接近于0,相关系数(r)≥0.975, 则可认为产品校准品定值可靠。
如达不到要求,则根据样本比对结果调整产品校准品的值,再次重复与2.1.1.3中2号检测系统的40份样本结果进行比对,直至符合要求。
8 5.40 5.55 28 3.52 3.51 9 0.28 0.31 29 1.23 1.25 10 0.84 0.83 30 0.64 0.69 11 3.52 3.26 31 5.08 4.88 12 0.82 0.83 32 0.96 0.97 13 8.38 8.94 33 8.13 8.88 14 1.36 1.34 34 0.91 0.97 15 8.25 8.26 35 9.47 9.81 16 0.88 0.86 36 1.53 1.53 17 7.45 7.65 37 2.24 2.35 18 0.34 0.35 38 0.60 0.62 19 10.54 10.36 39 5.11 5.18 20
0.83
0.78
40
10.30
10.11
相关性分析 Y=1.0154X-0.0314(r=0.9979) a=1.0154 b=-0.0314 r=0.9979
结论:由实验统计结果可知,该甘油三酯的校准品定值结果:2.13 mmol/L ,定值可靠。
2.1.1.4 不确定度计算
上级校准品工作校准品标准不确定度即为u m-cal 。
通过测定次数(10)、标准差S 2计算均值的标准偏差(10/
2S ),即为多次检测结果平均值的标准不确定度
u char 。
通过S 1和S 2计算S 瓶间,S 瓶间
即为瓶间标准不确定度u bb 。
计算公式如下:
bb
cal m char c u u u u 222++=-
扩展不确定度U=k ×u c =2×u c (k=2表示置信度为95%)
%
100⨯=
校准品定值扩展不确定度
相对扩展不确定度
(1)产品校准品定值:2.13 mmol/L (2)扩展不确定度U= 0.16
(3)相对扩展不确定度=7.51%。
