第七章习题答案
生理学IV——第七章 能量代谢和体温 习题+答案

生理学——第七章能量代谢和体温一、单选题1.在物质代谢的过程中,伴随着能量的释放、转移、贮存和利用称为A.能量代谢B.能量代谢率C.基础状态D.基础代谢E.基础代谢率【答案】A2. 对能量代谢影响最大的因素是A.寒冷B.高温C.肌肉活动D.精神活动E.进食【答案】C3. 营养物质中最主要的供能物质是A.糖B.脂肪C.蛋白质D.维生素E.无机盐【答案】A4. 当外界温度等于或高于机体皮肤温度时,机体的散热方式是A.辐射散热B.传导散热C.对流散热D.蒸发散热E.传导和对流散热【答案】D5. 1克食物氧化进所释放的热量称为A.食物的卡价B.氧热价C.呼吸商D.非蛋白呼吸商E.能量代谢【答案】A6. 进食后,使机体产生额外热量最多的物质是A.糖B.脂肪C.蛋白质D.混合食物E.维生素【答案】C7. 能量代谢率与下列哪项具有比例关系A.体重B.身高C.体表面积D.环境温度E.进食量【答案】C一、问答题1.影响能量代谢的因素。
答:肌肉活动对人体能量代谢的影响最为显著,任何轻微活动都可提高能量代谢率。
剧烈运动或劳动因做功更多,故影响更明显。
环境温度人在安静时的能量代谢,在20℃-30℃的环境中最为稳定。
当环境温度降低人感到寒冷时,机体就会发生寒战和骨骼肌张力增高等现象,使能量代谢率增高;当环境温度升高时,可使体内生化反应速度加快,汗腺分泌旺盛和呼吸循环机能增强,以至产热量升高。
食物的特殊动力效应在进食后1-8小时左右,机体即使处于安静状态,其产热量也会比进食前提高。
这种食物引起机体产生额外热量的作用称为食物的特殊动力效应。
食物的特殊动力作用以蛋白质为最强,一般可以产生30%额外热量。
脂肪和糖类增加的热量约为4-6%。
精神活动当精神紧张或情绪激动时,由于骨骼肌张力增加、交感神经兴奋、促进可产热激素甲状腺激素和肾上腺激素的释放,使能量代谢可显著提高。
2.什么是体温。
体温有哪些的生理变异?答:体温是指体内深部的平均温度。
高等数学第七章 习题答案

习题7-11. 下列向量的终点各构成什么图形?(1)空间中一切单位向量归结为共同的始点;(2)平行于同一平面的一切单位向量归结为共同的始点;(3)平行于同一直线的所有单位向量归结为同一始点;(4)平行于同一直线的所有向量归结为同一始点。
答:(1)单位球面 (2)单位圆 (3)两个点 (4)直线。
2. 设点O 是正六边形ABCDEF 的中心,在向量,,,,,,,,OA OB OC OD OE OF AB BC ,,,CD DE EF FA 中,哪些向量是相等的? 答:,OA EF =,OB FA =,OC AB =,OD BC =,OE CD =.OF DE =3.平面四边形,ABCD 点,,,K L M N 分别是,,,AB BC CD DA 的中点,证明:.KL NM =当四边形ABCD 是空间四边形时,上等式是否仍然成立?证明:连结AC, 则在∆BAC 中,21AC. 与方向相同;在∆DAC 中,21AC. NM 与AC 方向相同,从而KL =NM 且KL 与NM 方向相同,所以KL =NM .当四边形ABCD 是空间四边形时,上等式仍然成立。
4. 解下列各题:(1)化简()()()()2332;x y x y -+-+-a b a b(2)已知12312323,322,=+-=-+a e e e b e e e 求,,32+--a b a b a b.解:(1)()()()()2332x y x y -+-+-a b a b()()()()23322332x y x y x y x y =--++-++⎡⎤⎡⎤⎣⎦⎣⎦a b()()55x y x y --+-=a b;(2)()()123123123233225;+=+-+-+=++a b e e e e e e e e e()()12312312323322;-=+---+=-+a b e e e e e e e +e e()()()()123123123123323232322693644-=+---+=+---+a b e e e e e e e e e e e e 235.=+e e5.四边形ABCD 中,2,568AB CD =-=+-a c a b c,对角线,AC BD 的中点分别是,,E F 求.EF 解:()()111156823352222EF CD AB =+=+-+-=+-a b c a c a b c.6. 设ABC ∆的三条边,,AB BC CA 的中点分别为,,,L M N 另O 为任意一点,证明: .OA OB OC OL OM ON ++=++证明:(1)如果O 在ABC ∆内部(如图1),则O 把ABC ∆分成三个三角形OAB,OAC,OBC 。
普通化学第七章课后习题解答

第七章沉淀反应参考答案P 142【综合性思考题】:给定体系0.02mol/LMnCl 2溶液(含杂质Fe 3+),经下列实验操作解答问题。
(已知K θSPMn(OH)2=2.0×10-13,K θSPMnS =2.5×10-13,K θbNH3=1.8×10-5,K θaHAc =1.8×10-5①与0.20mol/L 的NH 3.H 2O 等体积混合,是否产生Mn(OH)2沉淀?解:等体积混合后浓度减半,[Mn 2+]=0.01mol/L ,c b =[NH 3.H 2O]=0.10mol/L∵是一元弱碱体系,且c b /K b θ>500∴10.0108.1][5⨯⨯=⋅=--b b c K OH θ又∵ 622108.101.0][][--+⨯⨯=⋅=OH Mn Q c=1.8×10-8> K θSPMn(OH)2=2.0×10-13∴ 产生Mn(OH)2沉淀。
②与含0.20mol/L 的NH 3.H 2O 和0.2mol/LNH 4Cl 的溶液等体积混合,是否产生Mn(OH)2沉淀? 解:混合后属于NH 3.H 2O~NH 4Cl 的碱型缓冲液体系此时浓度减半:c b =[NH 3.H 2O]=0.2V/2V=0.1(mol.L -1)c S= [NH 4+]=0.2V/2V=0.1(mol.L -1)[Mn 2+]=0.02V/2V=0.01(mol.L -1)A 、求[OH -] 用碱型缓冲液计算式求算:s b b c c K OH ⋅=-θ][ 55108.11.01.0108.1--⨯=⨯⨯= B 、求Qc 22][][-+⋅=OH Mn Q c=0.01×[1.8×10-5]2=3.24×10-12C 、比较θ2)(,OH Mn SP K ∵13)(,100.22-⨯=>θOH Mn SP C K Q故有Mn(OH)2沉淀产生。
第七章 习题答案
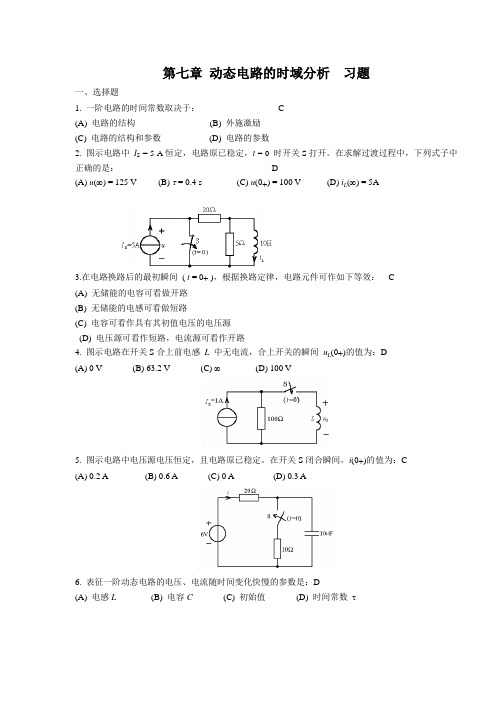
第七章动态电路的时域分析习题一、选择题1. 一阶电路的时间常数取决于: C(A) 电路的结构(B) 外施激励(C) 电路的结构和参数(D) 电路的参数2. 图示电路中I S = 5 A恒定,电路原已稳定,t = 0时开关S打开。
在求解过渡过程中,下列式子中正确的是: D(A) u(∞) = 125 V (B) τ = 0.4 s (C) u(0+) = 100 V (D) i(∞) = 5AL3.在电路换路后的最初瞬间( t = 0+ ),根据换路定律,电路元件可作如下等效: C(A) 无储能的电容可看做开路(B) 无储能的电感可看做短路(C) 电容可看作具有其初值电压的电压源(D) 电压源可看作短路,电流源可看作开路(0+)的值为:D4. 图示电路在开关S合上前电感L中无电流,合上开关的瞬间uL(A) 0 V (B) 63.2 V (C) ∞(D) 100 V5. 图示电路中电压源电压恒定,且电路原已稳定。
在开关S闭合瞬间,i(0+)的值为:C(A) 0.2 A (B) 0.6 A (C) 0 A (D) 0.3 A6. 表征一阶动态电路的电压、电流随时间变化快慢的参数是:D(A) 电感L(B) 电容C(C) 初始值(D) 时间常数τ7. 图示正弦脉冲信号的数学表达式为:B (A) sin ω t ⋅ ε (t ) + sin ω ( t - T ) ⋅ ε ( t - T ) (B) sin ω t ⋅ ε (t ) - sin ω t ⋅ ε ( t - T ) (C) sin ω t ⋅ ε (t ) - sin ω ( t - T ) ⋅ ε ( t - T ) (D) sin ω t ⋅ ε (t ) + sin ω t ⋅ ε ( t - T )8. 图示电路中,原已达稳态, t = 0开关 S 打开,电路的时间常数为:D (A)s 41 (B) s 61(C) s 4 (D)s 69. 示电路中,t = 0 时开关打开,则 u (0+)为:C(A) 0V (B) 3.75V (C) – 6V (D) 6V10.图示电路中,开关打开已久,在 t = 0 时开关闭合,i (0+) 为:D(A) 0A (B) 0.8A(C) 2A (D)1A11.R 、C 串联电路,已知全响应()()10C 83V,0t u t e t -=-≥,其零状态响应为:(A )(A) 1088V te-- (B) 1083V t e -- (C) 103V t e -- (D) 105V t e -12. .一阶电路的全响应()()10C 106V,0tu t et -=-≥若初始状态不变而输入增加一倍,则全响应u C (t)为 ( D ) (A) 20-12e -10t ; (B) 20-6e -10t ; (C) 10-12e -10t ; (D) 20-16 e -10t 。
第七章习题及答案

第七章习题及答案第七章习题及答案1. 如果要设置幻灯片“水平百叶窗”播放效果,应使用菜单“幻灯片放映”中的(b)a. 动作设置b. 自定义动画c. 预设动画2. 列方法中不能启动PowerPoint 2003的是(前提为已正常安装好PowerPoint 2003)( c)a. 选择“开始”—“程序” —“ Microsoft Office 2003 ” —“ Microsoft Office PowerPoi nt 2003 ”命令b. 用鼠标左键双击桌面上的PowerPoint 2003快捷方式图标c. 用鼠标右键双击桌面上的PowerPoint 2003快捷方式图标d. 用鼠标左键双击已建立好的PowerPoint 2003文件3. 显示和隐藏工具栏的操作是(d )a. 隐藏“浮动工具栏”,可双击它b. 通过“工具”菜单的“自定义”命令进行操作c. 用鼠标右键单击此工具栏d. 点击“视图”菜单中的“工具栏”,在弹出的菜单中单击需要显示或隐藏的工具栏名称4. powerPoint 2003 有__d ___ 中显示视图。
a. 5b. 2c. 3d. 45. “文件”菜单中的“打印”命令,其快捷键是(c )a. Ctrl+Nb. Ctrl+Sc. Ctrl+Pd. Ctrl+X6. 在PowerPoint 2003中,“文件”菜单中的“打开”命令的快捷键是(a)a. Ctrl+O b. Ctrl+S c. Ctrl+P d. Ctrl+N7. 计算机没有接打印机,Powerpoint2003将_______a ____ 。
a. 可以进行幻灯片的放映,但不能打印b. 不能进行幻灯片的放映,也不能打印c. 按文件类型,有的能进行幻灯片的放映,有的不能进行幻灯片的放映d. 按文件大小,有的能进行幻灯片的放映,有的不能进行幻灯片的放映8. Powerpoint 2003演示文稿的默认扩展名是(c)a. DOCb. XLSc. PPTd. PTT9. 在用PowerPoint 2003制作的幻灯片中__d ______ 。
第七章练习题及答案(可编辑修改word版)

第七章练习题及答案一.单项选择题1.根据我国《宪法》、《立法法》等的规定,()行使国家立法权。
A.国务院B.全国人民代表大会及其常务委员会C.地方政府 D 地方人民代表大会及其常务委员会2.国务院有权根据宪法和法律制定()。
A.部门规章B.地方性法规C.行政法规D.地方政府规章3.国务院各部门可以根据宪法、法律和行政法规,在本部门的权限范围内,制定()。
A.部门规章B.地方性法规C.行政法规D.地方政府规章4.省、自治区、直辖市的人民代表大会及其常委会根据本行政区域的具体情况和实际需要,在不同宪法、法律和行政法规相抵触的前提下,可以制定()。
A.部门规章B.地方性法规C.行政法规D.地方政府规章5.省、自治区、直辖市、较大的市的人民政府可以根据法律、行政法规和本省、自治区、直辖市的地方性法规,制定()。
A.部门规章B.地方性法规C.行政法规D.地方政府规章6.在广义上,法律执行是指(),在国家和公共事务管理中依照法定职权和程序,贯彻和实施法律的活动。
A.国家公务员B.国家机关及其公职人员C.社会组织D.公民7.法律适用是指()依照法定职权和程序适用法律处理案件的专门活动。
A.国家立法机关及其公职人员B.国家行政机关及其公职人员C.国家司法机关及其公职人员D.国家机关及其公职人员8.依法治国的主体是()。
A.行政机关B.立法机关C.司法机关D.人民群众9.从法律运行的环节来看,法律公正包括()两个方面。
A.守法公正和司法公正B.立法公正和执法公正C.实体公正和程序公正D.权利公正与义务公正10.从法律公正的内涵来看,法律公正包括()两个方面。
A.守法公正和司法公正B.立法公正和执法公正C.实体公正和程序公正 D.权利公正与义务公正11.()是国家安全的支柱与核心。
A.政治安全和国防安全B.经济安全与科技安全C.文化安全与生态安全D.社会公共安全与政治安全12.()是维护国家安全的专门法律,规定了国家安全机关在国家安全工作中的职责以及公民和组织维护国家安全的权利和义务,规律了各类危害国家安全行为所应承担的法律责任。
有机化学课后习题答案7第七章答案
4.
V2O5, O2
一. 命名或写出结构式
1.
2. C2H5
NO2
Br2 Fe
NO2 Br
O
O
O
O
浓H2SO4
AlCl3 O
COOH
O
习题 B 答案
CH3 3.
OH 4.
SO3H
H3C
5.
6.
7. 2-乙基-9,10-蒽醌 8. 2-环丙基萘
9. 1,4-二甲基萘 10. 邻苯二甲酸酐
二.用休克尔规则判断下列化合物是否有芳香性
CHO
CHO
CH3 NBS
O2, V2O5 400-500℃
CH2MgBr 无水乙醚
CH2Br Mg 无水乙醚
CH2MgBr
O
O AlCl3
O
O Zn-Hg HCl
HOOC
H2SO4 HOOC
H3O+
H2/Ni HO CH2
H2SO4 HO CH2
O CH2
5.
O
O
Zn-Hg
浓H2SO4
O AlCl3
第七章 稠环芳香烃
一.写出下列化合物的结构式
习题 A 答案
NO2
Cl
Br
OH
1.
2.
3. NO2
4.
5.
6.
7.
8.
CH3 H3C
9.
10.
二.用系统命名法命名下列化合物 1、8-溴-1-萘甲醚 2、1-萘甲醛(α-萘甲醛) 3、8-氯-1-萘甲酸 4、2-氯-6ˊ-溴联苯 5、9-硝基菲 6、2-甲基蒽 7、2,6-二甲基萘 8、2-萘酚(β-萘酚) 三、选择题 1、C 2、A 3、B 4、AD 5、C 6、D 四.下列化合物有无芳香性,为什么? 解:(1)的π电子数为 4 个,不符合 4n+2 规则,没有芳香性。
(完整版)高等代数(北大版)第7章习题参考答案

第七章 线性变换1. 判别下面所定义的变换那些是线性的,那些不是:判别下面所定义的变换那些是线性的,那些不是:1) 在线性空间V 中,A αξξ+=,其中∈αV 是一固定的向量;是一固定的向量; 2) 在线性空间V 中,A αξ=其中∈αV 是一固定的向量;是一固定的向量;3) 在P 3中,A),,(),,(233221321x x x x x x x +=; 4) 在P 3中,A ),,2(),,(13221321x x x x x x x x +-=; 5) 在P[x ]中,A )1()(+=x f x f ;6) 在P[x ]中,A ),()(0x f x f =其中0x ∈P 是一固定的数;是一固定的数;7) 把复数域上看作复数域上的线性空间,把复数域上看作复数域上的线性空间,A ξξ=。
8) 在P nn ⨯中,A X=BXC 其中B,C∈P nn ⨯是两个固定的矩阵. 解 1)当0=α时,是;当0≠α时,不是。
不是。
2)当0=α时,是;当0≠α时,不是。
不是。
3)不是.例如当)0,0,1(=α,2=k 时,k A )0,0,2()(=α, A )0,0,4()(=αk ,A ≠)(αkk A()α。
4)是.因取),,(),,,(321321y y y x x x ==βα,有A )(βα+= A ),,(332211y x y x y x +++=),,22(1133222211y x y x y x y x y x ++++--+ =),,2(),,2(1322113221y y y y y x x x x x +-++- = A α+ A β, A =)(αk A ),,(321kx kx kx),,2(),,2(1322113221kx kx kx kx kx kx kx kx kx kx +-=+-==k A )(α, 故A 是P 3上的线性变换。
上的线性变换。
5) 是因任取][)(],[)(x P x g x P x f ∈∈,并令并令 )()()(x g x f x u +=则A ))()((x g x f += A )(x u =)1(+x u =)1()1(+++x g x f =A )(x f + A ))((x g , 再令)()(x kf x v =则A =))((x kf A k x kf x v x v =+=+=)1()1())((A ))((x f , 故A 为][x P 上的线性变换。
高等数学第七章习题详细解答

第七章习题答案习题7.01.下列各种情形中,P 为E 的什么点?(1)如果存在点P 的某一邻域()U P ,使得()⊂c U P E (c E 为E 的余集); (2)如果对点P 的任意邻域()U P ,都有, ()(),C U P E U P E φφ≠≠; (3)如果对点P 的任意邻域()U P ,都有. 解 (1)P 为E 的外点;(2)P 为E 的边界点;(3)P 为E 的聚点。
2.判定下列平面点集的特征(说明是开集、闭集、区域、还是有界集、无界集等?)并分别求出它们的导集和边界.(1) (){},0≠x y y ;(2) (){}22,620≤+≤x y x y ; (3) (){}2,≤x y y x ;(4) ()(){}()(){}2222,11,24+-≥⋂+-≤x y x y x y x y .解 (1) 是开集,是半开半闭区域,是无界集,导集为2R ,边界集为(){},0=x y y ;(2)既不是开集也不是闭集,是半开半闭区域,是有界集,导集为(){}22,620≤+≤x y x y ,边界集为(){}2222,=6=20++,x y x y x y ;(3) 是闭集,是半开半闭区域,是无界集,导集为集合本身,边界集为(){}2,=x y y x ;是闭集,是闭区域,是有界集,导集为集合本身,边界集为()()(){}2222,11,24+-=+-=x y x y x y习题7.11. 设求1. 解 令,=-=yu x y v x,解得,11==--u uv x y v v,故()22,11⎛⎫⎛⎫=- ⎪ ⎪--⎝⎭⎝⎭u uv f u v v v ,即()()21+,1=-u v f u v v ,所以,()()21+y ,1=-x f x y y φ≠-}){()(P E P U 22,,y f x y x y x ⎛⎫-=- ⎪⎝⎭(,).f x y2.已知函数()22,cot =+-x f x y x y xy y,试求(),f tx ty .2. 解 因为()22,cot =+-y f x y x y xy x,所以,()2222,cot ,=+-t y f tx ty tx ty txty t x即()()222,cot =+-y f tx ty t x y t xy x.3.求下列各函数的定义域 (1) 25)1(=-+z ln y xy ;(2) =z ;(3) =z(4) )0;=>>u R r(5) =u3. 解 (1)(){}2,510-+>x y yxy ;(2)(){},0->x y x y ;(3)(){}2,≥x y x y ;(4)(){}22222,<++≤x y r x y z R ;(5)(){}222,≤+x y z x y4. 求下列各极限:(1) ()()233,0,31lim →-+x y x yx y ;(2)()(,1,1ln lim→+x x y y e(3)()(,0,0lim→x y(4)()(,0,0lim→x y ;(5)()()(),0,2sin lim→x y xy x ;(6)()()()()222222,0,01cos lim→-++x y x y x y xy e.4. 解 (1)()()2333,0,31101lim 0327→--==++x y x y x y ;(2)()(()1,1,1ln ln 11lim2→+++===x x y y e e e (3)()()()(,0,0,0,0limlim→→=x y x y ()(,0,01lim4→==x y (4)()(()()),0,0,0,01limlim→→=x y x y xy xy()()),0,0=lim1=2→+x y(5)()()()()()(),0,2,0,2sin sin limlim 122→→=⋅=⋅=x y x y xy xy y x xy(6)()()()()()()()()()222222222222222,0,0,0,01cos 1cos limlim→→-+-++=⋅++x y x y x y x y x y x y xy xy eex y()()()()()()()2222222022,0,0,0,01cos 10limlim=02→→-++=⋅⋅=+x y x y x y x y xy e exy5.证明下列极限不存在: (1)()(),0,0lim→-+x y x yx y ;(2)()(),0,0lim→+-x y xyxy x y .5. (1) 解 令=y kx ,有()(),0,001limlim 1→→---==+++x y x x y x kx kx y x kx k ,k 取不同值,极限不同,故()(),0,0lim→-+x y x yx y 不存在.(2) 解令=x y()()22,0,00lim lim 1→→==+-x y x xy x xy x yx ;令2=x y()()()()22,0,02,0,0022lim lim lim 0221→→→===+-++x y y y y xy y y xy x y y y y ;01≠,故()(),0,0lim→+-x y xyxy x y不存在.6.函数=y z a 为常数)在何处间断?6. 解 因为=y z 是二元初等函数,且函数只在点集(){,x y y 上无定义,故函数在点集(){,x y y 上间断.7.用 εδ- 语言证明()(,0,0lim0→=x y .7. 证明 对0∀>ε,要使220-=≤=<ε2<ε,取=2δε<δ0-<ε,所以()(,0,0lim 0→=x y习题7.21. 设()(),sin 1arctan ,π==+-xy xz f x y e y x y 试求()1,1x f 及()1,1y f1. 解()221,sin arctan 1=+++xy x x yf x y ye y xx yyπ22=sin arctan+++xy x xy ye y y x y π.()()222,sin cos 11-=++-+xy xyy x y f x y xe y e y x x yπππ 222sin cos -=+++xyxyx x xe y e y x y πππ()()1,1,1,1∴=-=-x y f e f e2.设(),ln 2⎛⎫=+ ⎪⎝⎭y f x y x x ,求()1,0'x f ,()1,0'y f .2. 解()()222122,22--==++x yx y x f x y y x x y x x()2112,22==++y x f x y yx y x x()()11,011,02∴==,x y f f . 3.求下列函数的偏导数(1) 332=++z x y xy ,(2) ()1=+xz xy , (3) ()222ln =+z y x y ,(4) ln tan=y z x, (5) ()222ln =+z x x y ;(6)=z (7) ()sec =z xy ;(8) ()1=+yz xy ;(9) ()arctan =-zy x y ;(10) .⎛⎫=⎪⎝⎭zx u y 3. 解 (1)2232,32z z x y y x x y ∂∂=+=+∂∂(2)因为 ()ln 1,x xy z e+=所以()()()()ln 1ln 11ln 111x x xy z xy xy e xy xy xy x xy xy +⎛⎫⎛⎫∂=++=+++ ⎪ ⎪∂++⎝⎭⎝⎭()()22ln 1111x x xy z x x e xy y xy xy +⎛⎫⎛⎫∂==+ ⎪ ⎪∂++⎝⎭⎝⎭(3)()2322222222,2ln z xy z y y x y x x y y x y ∂∂==++∂+∂+(4)222222sec sec 111sec ,sec tan tan tantan y yy z y y z y x x y y y y x x x y x x x x x x x x∂∂⎛⎫⎛⎫=-=-== ⎪ ⎪∂∂⎝⎭⎝⎭ (5)()32222222222ln ,z x z x y x x y x x y y x y ∂∂=++=∂+∂+(6)z z x y ∂∂====∂∂(7)()()()()sec tan ,sec tan z z y xy xy x xy xy x y ∂∂==∂∂(8)()()22ln 1111y y xy z y y e xy x xy xy +⎛⎫⎛⎫∂==+ ⎪ ⎪∂++⎝⎭⎝⎭()()()()ln 1ln 11ln 111y y xy z xy xy e xy xy xy y xy xy +⎛⎫⎛⎫∂=++=+++ ⎪ ⎪∂++⎝⎭⎝⎭ (9)()()()()()()()11222ln ,,111z z zz z z z x y z x y x y x y u u u x y z x y x y x y ------∂∂∂==-=∂∂∂+-+-+-(10)因为 ln,x z yu e=所以ln ln ln 21,,ln zzx x x z z z y y y u z x z u z x x z u x e e e x x xy y x y y y y z y y y⎛⎫⎛⎫⎛⎫⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭⎛⎫⎛⎫⎛⎫⎛⎫∂∂∂=⋅==⋅-=-= ⎪ ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭4.设ln=z ,求证: 12∂∂+=∂∂z z xy x y . 4.证明 因为ln,z =所以z zx y∂∂====∂∂从而有12 z zx yx y∂∂+=+=+=∂∂5.求下列函数的二阶偏函数:(1)已知33sin sin=+z x y y x,求2∂∂∂zx y;(2)已知ln=xz y,求2∂∂∂zx y;(3)已知(ln=z x,求22∂∂z x和2∂∂∂z x y;(4)arctan=yzx求22222,,∂∂∂∂∂∂∂z z zx y x y和2∂∂∂zy x.5. 解(1)3323sin sin,3sin coszz x y y x x y y xx∂=+∴=+∂从而有223cos3coszx y y xx y∂=+∂∂(2)ln ln1,lnx xzz y y yx x∂⎛⎫=∴= ⎪∂⎝⎭从而有()()()ln1ln1ln11ln ln ln ln1xx xz yxy y y x yx y x y x--⎛⎫∂=+⋅=+⎪∂∂⎝⎭(3)(()1222 ln,zz x x yx-∂=∴===+∂从而有()()3322222222122zx y x x x yx--∂=-+=-+∂()()332222222122z x y y y x y x y --∂=-+=-+∂∂ (4)22221arctan,1y z y y z x xx x y y x ∂⎛⎫=∴=⋅-=- ⎪∂+⎝⎭⎛⎫+ ⎪⎝⎭ 222111z x yx x y y x ∂⎛⎫=⋅= ⎪∂+⎝⎭⎛⎫+ ⎪⎝⎭从而有()()()()2222222222222222222,x y y z xy z y x x x y x y x y x y -++∂∂-===∂∂∂+++ ()()2222222222222222,z xy z x y xy x y y y x x y x y x y ⎛⎫∂-∂+--=== ⎪∂∂∂+⎝⎭++ 6. 设()ln =z y xy ,求2∂∂∂z x y 及22∂∂zy .6. 解 因为()ln ,z y xy =所以()(),ln ln 1z y y z x y xy y xy x xy x y xy∂∂===+=+∂∂从而有22211,.z z x y x y y∂∂==∂∂∂ 习题7.31. 求下列函数的全微分.(1) 2222+=-s t u s t ;(2) ()2222+=+x y xyz x y e;(3) ()arcsin0=>xz y y;(4) ⎛⎫-+ ⎪⎝⎭=y x x y z e ;1.解 (1)()()222232322222222()()22222∂--+⋅---==∂--u s s t s t s s st s t s s s t s t()()222223232222222()()22222u t s t s t t ts t ts s t s t s t ∂--+---==∂-- ()()2322222244u u st t dz ds dt ds dt s t s t s t ∂∂-∴=+=-∂∂--(2)()()()222222222222++++∂=++⋅∂x y x y xyxyx y x y yzxe x y exxy()2222222244222222+++⎛⎫--=++⋅=+ ⎪⎝⎭x y x y x y xyxyxyx y x y xe x y e x e x y x y()()()22222222222-2+++∂=++⋅∂x y x y xy xyy x x y xzye x y eyxy()()2222222222442222+++-+⎛⎫-=+⋅=+ ⎪⎝⎭x y x y x y xyxyxyy x x y y x yeey e xy xy2244442222x y xyz z x y y x dz dx dy x edx y dy x y x y xy +⎛⎫⎛⎫∂∂--∴=+=+++ ⎪ ⎪∂∂⎝⎭⎝⎭ (3)2222211∂=⋅==∂--⎛⎫yzxyyy x y x x22⎛⎫⎛⎫∂=-=-= ⎪ ⎪∂⎝⎭⎝⎭z x x yy y z zdz dx dy x y∂∂∴=+=∂∂(4)22221y x y x x y x y z y y x e e x x y x y ⎛⎫⎛⎫-+-+ ⎪ ⎪⎝⎭⎝⎭⎛⎫∂-=-= ⎪∂⎝⎭ 22221y x y x x y x y z x x y e e y x y xy ⎛⎫⎛⎫-+-+ ⎪ ⎪⎝⎭⎝⎭⎛⎫∂-=-+= ⎪∂⎝⎭222222y x y x x y x y z z z y x x y dz dx dy e dx e dy x y y x y xy⎛⎫⎛⎫-+-+ ⎪ ⎪⎝⎭⎝⎭∂∂∂--∴=+==+∂∂∂ 2. 求函数2arctan1=+xz y 在1,1==x y 处的全微分.2.解()()()()()()()22222222222222222211111111111++∂++=⋅=⋅=∂++++++++y y z y y x xy y x y y xy()()()()()()22222222222222211222111111+∂-⋅--=⋅=⋅=∂++++++++y z x y xy xyx yy y x y y xy()()21,11125111z x ∂+∴==∂++ , ()()21,12125111∂-⋅==-∂++z y ()1,12255dz dx dy ∴=- 3. 求函数22=-xyz x y 当2,1,0.02,0.01==∆=∆=x y x y 时的全微分和全增量,并求两者之差.3.解 ()()()(),, 2.02,1.011,1z z x x y y z x y z z ∆=+∆+∆-=-()()22222.02 1.0121 2.0420.6670.667021 4.08 1.0232.02 1.01⨯⨯=-=-=-=--- ()()()2223222222222--⋅∂--===-∂---y x y xy x z x y y y x x y x y x y ()()()()22322222222--⋅-∂+==∂--x x y xy y z x xy y x y x y ()2,111413z x ∂∴=-=-∂- ,()()22,182110941z y ∂+⨯==∂- ()2,11100.020.010.070.0110.00439dz ∴=-⨯+⨯=-+=00.0040.004z dz ∴∆-=-=-.*4讨论函数()()()()(),0,0,0,,0,0⎧≠⎪=⎨⎪=⎩xy x y f x y x y 在()0,0点的连续性、可导性、可微性以及其偏导函数在()0,0的连续性.4.解()()()()()(),0,0,0,0lim,lim 00,0x y x y f x y xy f →→===(),f x y ∴在()0,0点连续 又()()()00,00,0000,0limlim 0x x x f x f f x x∆→∆→∆--===∆∆ ()()()000,0,0000,0limlim 0y y y f y f f y y∆→∆→∆--===∆∆ ()()0,00,0,00x y f f ∴==.()(()(,0,0,0,0,0,00limlim limx y x y f x yf z dzρρ→∆∆→∆∆→∆∆--∆-==()()()0,0,0x y<∆∆→∆lim0z dzρρ→∆-∴=故函数(),f x y 在()0,0点可微. 由()(),0,0x y ≠时(),=-x f x yy xy()23222sinx yy xy=-+(),=-y f x y x xy ()23222xy x xy=-+()(),0,0lim 0x y y →= ,()()()()23,0,0222lim→=+x y x yy kx xy()()()33323222=lim11→==+⋅+x kx ky kx k xk ,k 不同值不同()()()23,0,0222lim→∴+x y xy xy 不存在,故()()(),0,0lim ,xx y f x y →不存在.(),x f x y ∴在()0,0点不连续,同理可证(),y f x y 在点()0,0不连续.*5.计算()2.050.99的近似值.5.解 令00,1,2,0.01,0.05yz x x y x y ===∆=∆= 则1,ln y y z z yx x x x y-∂∂==∂∂ ()()1,21,22,0z zx y ∂∂∴==∂∂ ()()()2.0521,21,20.991120.0100.0510.02 1.02∂∂∴≈+∆+∆=+⨯+⨯=+=∂∂z zx y x y*6.设有厚度为,内高为,内半径为的无盖圆柱形容器,求容器外壳体积的近似值(设容器的壁和底的厚度相同).6.解 设容器底面积半径为r ,高为h则容器体积2V r h π=22,V Vrh r r hππ∂∂==∂∂ 22∴=+dV rhdr r dh ππ002,10,0.1,0.1r cm h cm r cm h cm ==∆=∆=()()22,102,1020.10.1400.140.1 4.4∴∆≈=⋅+⋅=⨯+⨯=V dV rh r πππππ*7. 测得直角三角形两直角边的长分别为7±0.1cm 和24±0.1cm ,试求利用上述二值来计算斜边长度时的绝对误差和相对误差.0.1cm 10cm 2cm7.解 设直角三角形的直角边长分别为,x y ,则斜边z =,zz xy∂∂==∂∂由题意007,24,0.1,0.1x y x y δδ====z ∴的绝对误差为()()7,247,247240.10.10.242525∂∂=+=⨯+⨯=∂∂z x y z z x y δδδz 的相对误差()7,240.240.009625=≈zz δ 习题7.41.设,,,求. 1.解 ()3222sin 22cos 23cos 6---∂∂=⋅+⋅=⋅-⋅=-∂∂x y x y t t du z dx z dy e t e t e t t dt x dt y dt2.设,而,,求. 2.解2123∂∂=⋅+⋅=+∂∂dz z dy z dV x dx u dx V dx2341-=x3.设,,,求,. 3.解 ()()222cos 2sin ∂∂∂∂∂=⋅+⋅=-+-∂∂∂∂∂z z u z v uv v y u uv y x u x v x()()2222222cos sin sin cos cos 2cos sin sin x y y x y y x y x y y y =-+-()23sin cos cos sin x y y y y =-()()()222sin 2cos z z u z v uv v x y u uv x y y u y v y∂∂∂∂∂=+=--+-∂∂∂∂∂ ()()()2222222cos sin sin sin cos 2cos sin cos x y y x y x y x y x y y x y =--+-()()3333cos sin 2cos sin sin cos x y y x y y y y =+-+2e x y u -=sin x t =3y t =d d u tarccos()z u v =-34u x =3v x =d d zx22z u v uv =-cos u x y =sin v x y =zx ∂∂z y∂∂4.设,而,,求,. 4.解 222ln 3∂∂∂∂∂⎛⎫=⋅+⋅=⋅+- ⎪∂∂∂∂∂⎝⎭z z u z v u y u v x u x v x v x()()()2322632ln 326ln 3x y y y y x y x y x x x x +⎛⎫=+-=+-- ⎪⎝⎭5.设求5.解 ()()1wf x xy xyz y yz x ∂'=++++∂()()()()1wf x xy xyz x xz x z f x xy xyz y∂''=+++=+++∂ ()()wf x xy xyz xy xyf x xy xyz z ∂''=++=++∂6.求下列函数的一阶偏导数(其中具有一阶连续偏导数):(1);(2);(3);(4).6.解 (1)()()222222∂''=-⋅=-∂z f x y x xf x y x()()()222222∂''=-⋅-=--∂zf x y y yf x y y(2)121110∂'''=+⋅=∂u f f f x y y12122211u x x f f f f y y z y z ⎛⎫∂⎛⎫''''=-+=-+ ⎪ ⎪∂⎝⎭⎝⎭122220∂⎛⎫'''=⋅+-=- ⎪∂⎝⎭u y y f f f z z z (3)1231231∂''''''=⋅+⋅+⋅=++∂uf f y f yz f yf yzf x123230∂'''''=⋅+⋅+⋅=+∂uf f x f xz xf xzf y2ln z u v =32u x y =+y v x =zx ∂∂z y∂∂(),w f x xy xyz =++,,.w w wx y z∂∂∂∂∂∂f 22()z f x y =-,x y u f y z ⎛⎫= ⎪⎝⎭(,,)u f x xy xyz =22(,e ,ln )xy u f x y x =-123300∂''''=⋅+⋅+⋅=∂uf f f xy xyf z (4)1231231122∂''''''=⋅+⋅⋅+⋅=++∂xy xyu f x f e y f xf ye f f x x x()12312202∂'''''=⋅-+⋅+⋅=-+∂xy xy uf y f e x f yf xe f y7.求下列函数的二阶偏导数,,(其中具有二阶连续偏导数):(1),(2). 7.解(1)22121222∂''''=⋅+⋅=+∂zf xy f y xyf y f x22121222∂''''=⋅+⋅=+∂zf x f xy x f xyf y()()222211112212222222∂'''''''''∴=+⋅+⋅+⋅+⋅∂zyf xy f xy f y y f xy f y x233341111221222422yf x y f xy f xy f y f '''''''''=++++ 23341111222244yf x y f xy f y f '''''''=+++()()2222111122212222222∂''''''''''=+⋅+⋅++⋅+⋅∂∂zxf xy f x f xy yf y f x f xy x y322223111122212222422xf x yf x y f yf x y f xy f ''''''''''=+++++ 32231111222222522xf x yf x y f yf xy f ''''''''=++++()2222211122212222222∂'''''''''=+++⋅+⋅∂zx f x x f xy xf xy f x f xy y43221112222424x f x yf xf x y f '''''''=+++(2)()()222222∂''=+⋅=+∂zf x y x xf x y x()()222222∂''=+⋅=+∂zf x y y yf x y y22zx∂∂2z x y ∂∂∂22z y ∂∂f 22(,)z f x y xy =22()z f x y =+()()()()2222222222222224∂''''''∴=+++⋅=+++∂zf x y xf x y x f x y x f x y x()()22222224∂'''=+⋅=+∂∂z xf x y y xyf x y x y()()()()2222222222222224∂''''''=+++⋅=+++∂zf x y yf x y y f x y y f x y y8.设其中F 是可微函数,证明8.解()()()cos sin sin cos cos cos sin sin ux F y x x x xF y x x∂''=+--=--∂ ()sin sin cos uF y x y y∂'=-∂ ()()cos cos cos cos sin sin cos cos sin sin cos u uy x x xF y x y yF y x x x y∂∂''∴+=--+-⎡⎤⎣⎦∂∂ ()()cos cos cos cos sin sin cos cos sin sin cos cos x y x yF y x x yF y x x y ''=--+-=.习题7.51.设,φ⎛⎫= ⎪⎝⎭x y z z 其中为可微函数,求∂∂+∂∂z z x y x y . 1.解 z是,x y函数由方程xx z y φ⎛⎫= ⎪⎝⎭确定。
高等数学课后答案 第七章 习题详细解答

习题7-11.判定下列平面点集中哪些是开集、闭集、区域、有界集、无界集?并指出集合的边界.(1){}(,)0,0x y x y ≠≠;(2){}22(,)14x y x y <+≤;(3){}2(,)x y y x >;(4){}2222(,)(1)1(2)4x y x y x y +-≥+-≤且.解 (1)集合是开集,无界集;边界为{(,)0x y x =或0}y =. (2)集合既非开集,又非闭集,是有界集;边界为2222{(,)1}{(,)4}x y x y x y x y +=+= .(3)集合是开集,区域,无界集;边界为2{(,)}x y y x =. (4)集合是闭集,有界集;边界为2222{(,)(1)1}{(,)(2)4}x y x y x y x y +-=+-=2.已知函数(,)v f u v u =,试求(,)f xy x y +. 解 ()()(,)x y f xy x y xy ++=.3.设(,)2f x y xy =,证明:2(,)(,)f tx ty t f x y =.解)222(,)222f tx ty t xy t t xy t xy ===2(,)t f x y =.4.设y f x ⎛⎫=⎪⎝⎭(0)x >,求()f x . 解由于y f x ⎛⎫==⎪⎝⎭,则()f x =5.求下列各函数的定义域:(1)2222x y z x y+=-; (2)ln()arcsin y z y x x =-+;(3)ln()z xy =; (4)z =;(5)z =(6)u =.解 (1)定义域为{}(,)x y y x ≠±; (2)定义域为{}(,)x y x y x <≤-;(3)定义域为{}(,)0x y xy >,即第一、三象限(不含坐标轴);(4)定义域为2222(,)1x y x y a b ⎧⎫+≤⎨⎬⎩⎭; (5)定义域为{}2(,)0,0,x y x y x y ≥≥≥;(6)定义域为{}22222(,,)0,0x y z x y z x y +-≥+≠.6.求下列各极限:(1)22(,)(2,0)lim x y x xy y x y →+++; (2)(,)(0,0)lim x y →; (3)22(,)(0,0)1lim ()sinx y x y xy →+; (4)(,)(2,0)sin()lim x y xy y→;(5)1(,)(0,1)lim (1)xx y xy →+; (6)22(,)(,)lim()x y x y x y e --→+∞+∞+.解:(1)22(,)(2,0)4lim (2,0)22x y x xy y f x y →++===+;(2)(,)(0,0)00112lim lim 2x y u u u u →→→===;(3)因为22(,)(0,0)lim ()0x y x y →+=,且1s i n1xy≤有界,故22(,)(0,0)1lim ()sin 0x y x y xy →+=; (4)(,)(2,0)(,)(2,0)sin()sin()limlim 212x y x y xy xy x y xy →→==⋅=;(5)111(,)(0,1)(,)(0,1)lim (1)lim (1)y xyxx y x y xy xy e e ⋅→→+=+==;(6)当0x N >>,0y N >>时,有222()()0x y x yx y x y e e ++++<<,而()22(,)(,)22limlim lim lim 0x yu u u x y u u u x y u u e e e e+→+∞+∞→+∞→+∞→+∞+==== 按夹逼定理得22(,)(,)lim()0.x y x y x y e --→+∞+∞+=7.证明下列极限不存在: (1)(,)(0,0)limx y x yx y →+-;(2)设2224222,0,(,)0,0,x yx y x yf x y x y ⎧+≠⎪+=⎨⎪+=⎩(,)(0,0)lim (,)x y f x y →.证明 (1)当(,)x y 沿直线y kx =趋于(0,0)时极限(,)(0,0)01limlim 1x y x y kxx y x kx kx y x kx k →→=+++==--- 与k 有关,上述极限不存在.(2)当(,)x y 沿直线y x =和曲线2y x =趋于(0,0)有2242422(,)(0,0)00lim lim lim 01x y x x y x y xx y x x x x y x x x →→→=====+++, 2222442444(,)(0,0)001lim lim lim 22x y x x y xy xx y x x x x y x x x →→→=====++, 故函数(,)f x y 在点(0,0)处二重极限不存在.8.指出下列函数在何处间断:(1)22ln()z x y =+; (2)212z y x=-. 解(1)函数在(0,0)处无定义,故该点为函数22ln()z x y =+的间断点; (2)函数在抛物线22y x =上无定义,故22y x =上的点均为函数212z y x=-的间断点.9.用二重极限定义证明:(,)lim0x y →=.证22102ρ=≤=(,)P x y ,其中||OP ρ==,于是,0ε∀>,20δε∃=>;当0ρδ<<时,0ε-<成立,由二重极限定义知(,)lim0x y →=.10.设(,)sin f x y x =,证明(,)f x y 是2R 上的连续函数.证 设2000(,)P x y ∈R .0ε∀>,由于sin x 在0x 处连续,故0δ∃>,当0||x x δ-<时,有0|sin sin |x x ε-<.以上述δ作0P 的δ邻域0(,)U P δ,则当0(,)(,)P x y U P δ∈时,显然 00||(,)x x P P ρδ-<<,从而000|(,)(,)||sin sin |f x y f x y x x ε-=-<,即(,)sin f x y x =在点000(,)P x y 连续.由0P 的任意性知,sin x 作为x 、y 的二元函数在2R 上连续.习题7-21.设(,)z f x y =在00(,)x y 处的偏导数分别为00(,)x f x y A =,00(,)y f x y B =,问下列极限是什么?(1)00000(,)(,)limh f x h y f x y h →+-; (2)00000(,)(,)lim h f x y f x y h h→--;(3)00000(,2)(,)lim h f x y h f x y h →+-; (4)00000(,)(,)lim h f x h y f x h y h→+--.解 (1)0000000(,)(,)lim(,)x h f x h y f x y z x y A h→+-==; (2)000000000000(,)(,)(,)(,)limlim (,)y h h f x y f x y h f x y h f x y z x y B h h→→----===-; (3)0000000000(,2)(,)(,2)(,)limlim 222h h f x y h f x y f x y h f x y B h h→→+-+-=⋅=;(4)00000(,)(,)limh f x h y f x h y h→+--[][]0000000000000000000000000000(,)(,)(,)(,)lim(,)(,)(,)(,)lim (,)(,)(,)(,)lim lim 2.h h h h f x h y f x y f x y f x h y hf x h y f x y f x h y f x y h f x h y f x y f x h y f x y h h A A A →→→→+-+--=+----=+---=+-=+= 2.求下列函数的一阶偏导数: (1)x z xy y=+; (2)ln tan x z y =;(3)e xyz =; (4)22x y z xy+=;(5)222ln()z x x y =+; (6)z = (7)sec()z xy =; (8)(1)y z xy =+;(9)arctan()z u x y =- (10)zx u y ⎛⎫= ⎪⎝⎭.解(1)1z y x y ∂=+∂,2z x x y y∂=-∂; (2)12211tan sec cot sec z x x x x x y y y y y y -⎛⎫⎛⎫∂=⋅⋅= ⎪ ⎪∂⎝⎭⎝⎭, 12222tan sec cot sec z x x x x x x y y y y y y y-⎛⎫⎛⎫⎛⎫∂=⋅⋅-=- ⎪ ⎪ ⎪∂⎝⎭⎝⎭⎝⎭; (3)xy xy z e y ye x ∂=⋅=∂,xy xy ze x xe y∂=⋅=∂; (4)()2222222222()2()1z x xy x y y x y x y y y x x y y x xy ∂⋅-+⋅-+⋅===-∂, ()2222222222()2()1z y xy x y x xy x y x x y x y x y xy ∂⋅-+⋅-+⋅===-∂;(5)232222222222ln()22ln()z x x x x y x x x y x x y x y ∂=++⋅=++∂++, 22222222z x x yy y x y x y∂=⋅=∂++; (6)1z y x xy ∂=⋅=∂1z x y xy ∂=⋅=∂ (7)tan()sec()tan()sec()zxy xy y y xy xy x∂=⋅=∂, tan()sec()tan()sec()zxy xy x x xy xy y∂=⋅=∂; (8)121(1)(1)y y zy xy y y xy x--∂=+⋅=+∂, ln(1)(1)ln(1)1y xy z xy e y xy xy y y xy +⎡⎤∂∂⎡⎤==+⋅++⎢⎥⎣⎦∂∂+⎣⎦; (9)11221()()1()1()z z z zu z x y z x y x x y x y --∂-=⋅-=∂+-+-, 11221()()(1)1()1()z z z zu z x y z x y y x y x y --∂-=⋅-⋅-=-∂+-+-, 221()ln()()ln()1()1()z zz zu x y x y x y x y z x y x y ∂--=⋅-⋅-=∂+-+-; (10)111z z ux z x z x y y y y --⎛⎫⎛⎫∂=⋅= ⎪ ⎪∂⎝⎭⎝⎭,12z zux x z x z y y y y y -⎛⎫⎛⎫⎛⎫∂=⋅-=- ⎪ ⎪ ⎪∂⎝⎭⎝⎭⎝⎭, ln z u x x y y y⎛⎫∂=⋅ ⎪∂⎝⎭. 3.设(,)ln 2y f x y x x ⎛⎫=+⎪⎝⎭,求(1,0)x f ,(1,0)y f . 解法一 由于(,0)ln f x x =,所以1(,0)x f x x=,(1,0)1x f =; 由于(1,)ln 12y f y ⎛⎫=+⎪⎝⎭,所以11(1,)212yf y y =⋅+,1(1,0)2y f =.解法二 21(,)122x y f x y y x x x ⎛⎫=⋅- ⎪⎝⎭+,11(,)22y f x y y x x x=⋅+, 10(1,0)110212x f ⎛⎫=⋅-= ⎪⎝⎭+,111(1,0)02212y f =⋅=+. 4.设(,)(f x y x y =+-(,1)x f x . 解法一由于(,1)(11)arcsinf x x x =+-,(,1)()1x f x x '==. 解法二1(,)1x f x y y =,(,1)1x f x =. 5.设2(,)xt yf x y e dt -=⎰,求(,)x f x y ,(,)y f x y .解 2(,)x x f x y e -=,2(,)y f x y e -=-. 6.设yxz xy xe =+,证明z zxy xy z x y∂∂+=+∂∂. 解 由于21y y yx x x z y y y e xe y e x x x ⎛⎫∂⎛⎫=+-⋅=+-⎪ ⎪∂⎝⎭⎝⎭, 1y y x x z x xe x e y x∂=+⋅=+∂, 所以1()yy y yx x x xz z y x y x y e y x e xy e x y xy ye x y x ⎡⎤⎛⎫∂∂⎛⎫+=+-++=+-++ ⎪⎢⎥ ⎪∂∂⎝⎭⎣⎦⎝⎭yxxy xe xy xy z =++=+.7.(1)22,44x y z y ⎧+=⎪⎨⎪=⎩在点(2,4,5)处的切线与x 轴正向所成的倾角是多少? (2)1z x ⎧=⎪⎨=⎪⎩在点(1,1处的切线与y 轴正向所成的倾角是多少?解 (1)按偏导数的几何意义,(2,4)x z 就是曲线在点(2,4,5)处的切线对于x 轴正向所成倾角的斜率,而21(2,4)12x x z x ===,即tan 1k α==,于是倾角4πα=. (2)按偏导数的几何意义,(1,1)y z就是曲线在点(1,1处的切线对于y 轴正向所成倾角的斜率,而11(1,1)3y z ===,即1tan 3k α==,于是倾角6πα=.8.求下列函数的二阶偏函数:(1)已知33sin sin z x y y x =+,求2z x y ∂∂∂; (2)已知ln xz y =,求2z x y∂∂∂;(3)已知ln(z x =+,求22z x ∂∂和2zx y∂∂∂;(4)arctan y z x =求22z x ∂∂、22z y ∂∂、2z x y ∂∂∂和2zy x∂∂∂.解(1)233sin cos z x y y x x ∂=+∂,2223cos 3cos z x y y x x y∂=+∂∂; (2)ln ln 1ln ln x x z y y y y x x x∂=⋅=∂, 2ln ln 1ln 1111ln ln (1ln ln )xx x z y y x y y x y x y x y x--⎛⎫∂=+⋅⋅=+ ⎪∂∂⎝⎭; (3)1z x ⎛⎫∂==∂==,()232222zxx xy∂-==∂+,()23222z yx y xy∂-==∂∂+;(4)222211z y y xx x y y x ∂⎛⎫=⋅-=- ⎪∂+⎝⎭⎛⎫+ ⎪⎝⎭,222111z x y x x y y x ∂=⋅=∂+⎛⎫+ ⎪⎝⎭, ()222222z xy x x y ∂=∂+,()222222z xyy x y ∂-=∂+,()()2222222222222z x y y y x x y x y x y ∂+--=-=∂∂++,()()2222222222222z x y x y x y x x y x y ∂+--==∂∂++. 9.设222(,,)f x y z xy yz zx =++,求(0,0,1xx f ,(1,0,2)xz f ,(0,1,0)yz f -及(2,0,1)zzx f .解 因为22x f y xz =+,2xx f z =,2xz f x =, 22y f xy z =+,2yz f z =,22z f yz x =+,2zz f y =,0zzx f =,所以(0,0,1)2xx f =,(1,0,2)2xz f =,(0,1,0)0yz f -=,(2,0,1)0zzx f =.10.验证: (1)2esin kn ty nx -=满足22y yk t x∂∂=∂∂;(2)r =2222222r r r x y z r∂∂∂++=∂∂∂.证 (1)因为22e sin kn t y kn nx t -∂=-∂,2e cos kn t y n nx x -∂=∂,2222e sin kn ty n nx x-∂=-∂ 所以()2222e sin kn ty y k n nx k t x-∂∂=-=∂∂; (2)因为r x x r ∂==∂,2222231r x x x r x x x r r r r r ∂∂-⎛⎫==-⋅= ⎪∂∂⎝⎭, 由函数关于自变量的对称性,得22223r r y y r ∂-=∂,22223r r z z r ∂-=∂, 所以 2222222222223332r r r r x r y r z x y z r r r r∂∂∂---++=++=∂∂∂. 习题7-31.求下列函数的全微分:(1)2222s tu s t+=-; (2)2222()e x y xyz x y +=+;(3)arcsin(0)xz y y=>; (4)ey x x y z ⎛⎫-+ ⎪⎝⎭=;(5)222ln()u x y z =++; (6)yzu x =.解 (1)()()222222222222()2()4u s s t s s t st s s t s t ∂--+==-∂--, ()()222222222222()2()4u t s t t s t s tt s t s t ∂-++==∂--, ()()()22222222222444d d d (d d )st s tstu s t t s s t ststst=-+=-----;(2)22222222244222222()2()2x y x y x y xyxyxyzx y x y yx y xe x y eex xx y x y +++⎛⎫∂-+-=++=+ ⎪∂⎝⎭,由函数关于自变量的对称性可得224422x y xyzy x e y yxy +⎛⎫∂-=+ ⎪∂⎝⎭, 22444422d 2d 2d x y xyx y y x z ex x y y x y xy +⎡⎤⎛⎫⎛⎫--=+++⎢⎥ ⎪ ⎪⎝⎭⎝⎭⎣⎦; (3)21d d arcsind d x x x z x y y yy y ⎛⎫⎫===- ⎪⎪⎝⎭⎭)d d y x x y =-;(4)d d d y x y x x y x y y x z e e x y ⎛⎫⎛⎫-+-+ ⎪ ⎪⎝⎭⎝⎭⎡⎤⎛⎫⎢⎥==-⋅+ ⎪⎢⎥⎝⎭⎣⎦2211d d y x x y y x ex y y x x y ⎛⎫-+ ⎪⎝⎭⎡⎤⎛⎫⎛⎫=--+-⎢⎥ ⎪ ⎪⎝⎭⎝⎭⎣⎦;(5)()2222222221d d ln()d u x y z x y zx y z ⎡⎤=++=++⎣⎦++2222222d 2d 2d 2(d d d )x x y y z z x x y y z z x y z x y z++==++++++; (6)()1d d d ln d ln d yz yz yz yzu x yzx x x z x y x y x z -==++()1d ln d ln d yz x yz x xz x y xy x z -=++.2.求下列函数的全微分:(1)22ln(1)z x y =++在1x =,2y =处的全微分; (2)2arctan 1xz y=+在1x =,1y =处的全微分. 解 (1)因为2222222211d d ln(1)d(1)(2d 2d )11z x y x y x x y y x y x y ⎡⎤=++=++=+⎣⎦++++ 所以12112d (2d 4d )d d 633x y z x y x y ===+=+; (2)因为22221d d arctand 1111x x z y y x y ⎛⎫⎛⎫== ⎪ ⎪++⎛⎫⎝⎭⎝⎭+ ⎪+⎝⎭()22222222211212d d d d 11111y xy xy x y x y y x y y x y y ⎡⎤⎛⎫+⎢⎥=-=- ⎪⎢⎥++++++⎝⎭+⎣⎦ 所以()1222111121d d d d d 113x y x y xy z x y x y y x y ====⎛⎫=-=- ⎪+++⎝⎭. 3. 求函数23z x y =当2x =,1y =-,0.02x ∆=,0.01y ∆=-时的全微分.解 因为()23322322d d 2d 3d 23z x y xy x x y y xy x x y y ==+=∆+∆所以当2x =,1y =-,0.02x ∆=,0.01y ∆=-时全微分为d 4120.080.120.2z x y =-∆+∆=--=-.4.求函数22xyz x y=-当2x =,1y =,0.01x ∆=,0.03y ∆=时的全微分和全增量,并求两者之差.解 因为()()222222222d()d()d d x y xy xy x y xy z x y x y ---⎛⎫== ⎪-⎝⎭- ()()()()()222332222222(d d )(2d 2d )d d x y y x+x y xy x x y y x y y x+x +xy y xyx y -----==-- 所以当2x =,1y =,0.01x ∆=,0.03y ∆=时全微分的值为()()()2332222(,)(2,1)0.01,0.030.25d 0.0277779x y x y x y y x+x +xy yz x y =∆=∆=--∆∆==≈-, 而当2x =,1y =,0.01x ∆=,0.03y ∆=时的全增量为()()()()2222(,)(2,1)0.010.030.028252x y x y x x y y xy z x y x x y y =∆=∆=⎡⎤+∆+∆∆=-≈⎢⎥-+∆-+∆⎢⎥⎣⎦, 全增量与全微分之差为d 0.0282520.0277770.000475z z ∆-≈-=.习题7-41.设2e x yu -=,sin x t =,3y t =,求d d u t. 解3222sin 22d d d cos 23(cos 6)d d d x y x y t t u u x u ye t e t e t t t x t y t---∂∂=+=-⋅=-∂∂. 2.设arccos()z u v =-,而34u x =,3v x =,求d d z x. 解2d d d 123d d d z z u z v x x u x v x ∂∂=+=+∂∂2314x -=3.设22z u v uv =-,cos u x y =,sin v x y =,求z x ∂∂,z y∂∂. 解()()222cos 2sin z z u z v uv v y u uv y x u x v x∂∂∂∂∂=⋅+⋅=-⋅+-⋅∂∂∂∂∂ 23sin cos (cos sin )x y y y y =-,()()()222sin 2cos z z u z v uv v x y u uv x y y u y v y∂∂∂∂∂=⋅+⋅=-⋅-+-⋅∂∂∂∂∂ 33232(sin 2sin cos cos 2cos sin )x y y y y y y =-+-.4.设2ln z u v =,而32u x y =+,y v x =,求z x ∂∂,z y∂∂. 解 222ln 3z z u z v u y u v x u x v x v x ∂∂∂∂∂⎛⎫=⋅+⋅=⋅+⋅- ⎪∂∂∂∂∂⎝⎭216(32)ln(32)y x y x y x x=+-+, 22112ln 24(32)ln (32)z z u z v u y u v x y x y y u y v y v x x y∂∂∂∂∂=⋅+⋅=⋅+⋅=+++∂∂∂∂∂. 5. 设2(,,)ln(sin )z f u x y u y x ==+,ex yu +=,求z x ∂∂,zy∂∂. 解22112cos sin sin x y z z u f u e y x x u x x u y x u y x+∂∂∂∂=⋅+=⋅⋅+⋅∂∂∂∂++ ()()222cos sin x y x y e y xe y x+++=+, 22112sin sin sin x y z z u f u e x y u y y u y x u y x+∂∂∂∂=⋅+=⋅⋅+⋅∂∂∂∂++ ()()222sin sin x y x y e xe y x+++=+. 6.设222sin()u x y z =++,x r s t =++,y rs st tr =++,z rst =,求u r ∂∂,us∂∂,ut∂∂. 解[]22222()2cos()u u x u y u z x y s t zst x y z r x r y r z r∂∂∂∂∂∂∂=⋅+⋅+⋅=+++++∂∂∂∂∂∂∂ 222222()()cos ()()()r s t rs st tr s t rs t r s t rs st tr rst ⎡⎤⎡⎤=+++++++++++++⎣⎦⎣⎦,[]22222()2cos()u u x u y u zx y r t zrt x y z s x s y s z s∂∂∂∂∂∂∂=⋅+⋅+⋅=+++++∂∂∂∂∂∂∂ 222222()()cos ()()()r s t rs st tr r t r st r s t rs st tr rst ⎡⎤⎡⎤=+++++++++++++⎣⎦⎣⎦,[]22222()2cos()u u x u y u z x y s r zrs x y z t x t y t z t∂∂∂∂∂∂∂=⋅+⋅+⋅=+++++∂∂∂∂∂∂∂ 222222()()cos ()()()r s t rs st tr r s r s t r s t rs st tr rst ⎡⎤⎡⎤=+++++++++++++⎣⎦⎣⎦.7.设arctanxz y=,x u v =+,y u v =-,求z u ∂∂,z v ∂∂,并验证:22z z u vu v u v∂∂-+=∂∂+.解222221111111z z x z y x y xu x u y uy y x y x x y y ⎛⎫∂∂∂∂∂-=⋅+⋅=⋅⋅+⋅-⋅= ⎪∂∂∂∂∂+⎛⎫⎛⎫⎝⎭++ ⎪ ⎪⎝⎭⎝⎭, ()222221111111z z x z yx y xv x v y vy y x y x x y y ⎛⎫∂∂∂∂∂+=⋅+⋅=⋅⋅+⋅-⋅-= ⎪∂∂∂∂∂+⎛⎫⎛⎫⎝⎭++ ⎪ ⎪⎝⎭⎝⎭, 则222222222()()()z z y x y x u v u vu v x y x y u v u v u v ∂∂-+--+=+==∂∂++++-+. 8.设22(,,)z f x y t x y t ==-+,sin x t =,cos y t =,求d d z t. 解d d d 2cos 2(sin )12sin 21d d d z z x z y f x t y t t t x t y t t∂∂∂=⋅+⋅+=--+=+∂∂∂. 9.求下列函数的一阶偏导数(其中f 具有一阶连续偏导数): (1)22()z f x y =-; (2),x y u f y z ⎛⎫=⎪⎝⎭; (3)(,,)u f x xy xyz =; (4)22(,,ln )xy u f x y e x =-. 解(1)222()z xf x y x ∂'=-∂,222()zyf x y y∂'=--∂; (2)111f u f x y y '∂'=⋅=∂,12122211u x x f f f f y y z y z ⎛⎫∂''''=⋅-+⋅=-+ ⎪∂⎝⎭, 2222u y y f f z z z ∂⎛⎫''=⋅-=- ⎪∂⎝⎭; (3)123u f yf yzf x ∂'''=++∂,23uxf xzf y ∂''=+∂,3u xyf z ∂'=∂; (4)12312xy u xf ye f f x x ∂'''=++∂,122xy u yf xe f y∂''=-+∂. 10.设()z xy xF u =+,而yu x=,()F u 为可导函数,证明: z zxy z xy x y∂∂+=+∂∂.证 ()()()z z u u xy x y F u xF u y x xF u x y x y ⎡⎤∂∂∂∂⎡⎤''+=++++⎢⎥⎢⎥∂∂∂∂⎣⎦⎣⎦ []()()()yx y F u F u y x F u x ⎡⎤''=+-++⎢⎥⎣⎦()xy xF u xy z xy =++=+. 11.设[cos()]z y x y ϕ=-,试证:z z zx y y∂∂+=∂∂. 证sin()[cos()]sin()z z y x y x y y x y x yϕϕϕ∂∂''+=--+-+-∂∂ [cos()]z x y yϕ=-=. 12.设,kz y u x F x x ⎛⎫=⎪⎝⎭,且函数,z y F x x ⎛⎫⎪⎝⎭具有一阶连续偏导数,试证: u u uxy z ku x y z∂∂∂++=∂∂∂. 证11222k k u z y kx F x F F x x x -∂⎡⎤⎛⎫⎛⎫''=+-+- ⎪ ⎪⎢⎥∂⎝⎭⎝⎭⎣⎦,1221k k ux F x F y x -∂''=⋅=∂, 1111k k u x F x F z x-∂''=⋅=∂, 11111111k k k k k u u u xy z kx F x zF x yF x yF x zF ku x y z----∂∂∂''''++=--++=∂∂∂. 13.设sin (sin sin )z y f x y =+-,试证:sec sec 1z zxy x y∂∂+=∂∂. 证cos z f x x ∂'=∂,cos (cos )zy y f y∂'=+-∂, sec sec sec cos sec cos sec (cos )1z zxy x xf y y y y f x y∂∂''+=++-=∂∂. 14.求下列函数的二阶偏导数22z x ∂∂,2z x y ∂∂∂,22zy ∂∂(其中f 具有二阶连续偏导数):(1)(,)z f xy y =; (2)22()z f x y =+;(3)22(,)z f x y xy =; (4)(sin ,cos ,)x y z f x y e +=. 解 (1)令s xy =,t y =,则(,)z f xy y =,s 和t 是中间变量.11z s f yf x x ∂∂''=⋅=∂∂,1212d d z s tf f xf f y y y∂∂''''=⋅+⋅=+∂∂. 因为(,)f s t 是s 和t 的函数,所以1f '和2f '也是s 和t 的函数,从而1f '和2f '是以s 和t 为中间变量的x 和y 的函数.故()22111112z z s yf yf y f x x x x x∂∂∂∂∂⎛⎫'''''===⋅= ⎪∂∂∂∂∂⎝⎭, ()211111211112d d z z s t yf f y f f f xyf yf x y y x y y y ⎛⎫∂∂∂∂∂⎛⎫'''''''''''===+⋅+⋅=++ ⎪ ⎪∂∂∂∂∂∂⎝⎭⎝⎭,()212111221222d d d d z z s t s t xf f x f f f f y y y y yy y y ⎛⎫⎛⎫∂∂∂∂∂∂''''''''''==+=+++ ⎪ ⎪∂∂∂∂∂∂⎝⎭⎝⎭ 21112222x f xf f ''''''=++. (2)令22s x y =+,则22()z f x y =+是以s 为中间变量的x 和y 的函数.2z s f xf x x ∂∂''=⋅=∂∂,2z sf yf y y∂∂''=⋅=∂∂. 因为()f s 是s 的函数,所以f '也是s 的函数,从而f '是以s 中间变量的x 和y 的函数.故()()222222224z z xf f xf x f x f x x x x∂∂∂∂⎛⎫'''''''===+⋅=+ ⎪∂∂∂∂⎝⎭, ()()22224z z xf xf y xyf x y y x y∂∂∂∂⎛⎫'''''===⋅= ⎪∂∂∂∂∂⎝⎭, ()()222222224z z yf f yf y f y f y y y y⎛⎫∂∂∂∂'''''''===+⋅=+ ⎪∂∂∂∂⎝⎭. (3)令2s xy =2t x y =,则212122z s t f f y f xyf x x x ∂∂∂''''=⋅+⋅=+∂∂∂,212122z s tf f xyf x f y y y∂∂∂''''=⋅+⋅=+∂∂∂. ()221222z z y f xyf x x x x∂∂∂∂⎛⎫''==+ ⎪∂∂∂∂⎝⎭211122212222s t s t y f f yf xy f f x x x x ∂∂∂∂⎛⎫⎛⎫'''''''''=⋅+⋅++⋅+⋅ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭()()2221112221222222y y f xyf yf xy y f xyf '''''''''=++++ 43222111222244yf y f xy f x y f '''''''=+++, ()22122z z y f xyf x y y x y∂∂∂∂⎛⎫''==+ ⎪∂∂∂∂∂⎝⎭ 21111222122222s t s t yf y f f xf xy f f y y y y ⎛⎫⎛⎫∂∂∂∂''''''''''=+⋅+⋅++⋅+⋅ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭ ()()222111122212222222yf y xyf x f xf xy xyf x f ''''''''''=+++++ 32231211122222252yf xf xy f x y f x yf ''''''''=++++, ()221222z z xyf x f y y y y⎛⎫∂∂∂∂''==+ ⎪∂∂∂∂⎝⎭ 211112212222s t s t xf xy f f x f f y y y y ⎛⎫⎛⎫∂∂∂∂'''''''''=+⋅+⋅+⋅+⋅ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭ ()()2221111221222222xf xy xyf x f x xyf x f '''''''''=++++ 22341111222244xf x y f x yf x f '''''''=+++. (4)令sin u x =,cos v y =,x yw e +=,则1313d cos d x y z u w f f xf e f x x x +∂∂''''=+=+∂∂,2323d sin d x y z v w f f yf e f y y y+∂∂''''=+=-+∂∂. ()2132cos x y z z xf e f x x x x+∂∂∂∂⎛⎫''==+ ⎪∂∂∂∂⎝⎭ 1111333133d d sin cos d d x y x y u w u w xf x f f e f e f f x x xx ++∂∂⎛⎫⎛⎫''''''''''=-+++++ ⎪ ⎪∂∂⎝⎭⎝⎭()()1111333133sin cos cos cos x yx y x y x y xf x xf e f e f e xf e f ++++''''''''''=-+++++ ()2231111333sin cos 2cos x y x yx y ef xf xf e xf e f +++''''''''=-+++, ()213cos x y z z xf e f x y y x y+∂∂∂∂⎛⎫''==+ ⎪∂∂∂∂∂⎝⎭121333233d d cos d d x y x y v w v w x f f e f e f f y y yy ++⎛⎫⎛⎫∂∂'''''''''=++++ ⎪ ⎪∂∂⎝⎭⎝⎭()()121333233cos sin sin x yx y x y x y x yf e f e f e yf e f ++++'''''''''=-+++-+ ()2312133233cos sin cos sin x y x yx y x y ef x yf e xf e yf e f ++++'''''''''=-+-+, ()2232sin x y z z yf e f y y y y+⎛⎫∂∂∂∂''==-+ ⎪∂∂∂∂⎝⎭ 2222333233d d cos sin d d x y x y v w v w yf y f f e f e f f y y yy ++⎛⎫⎛⎫∂∂''''''''''=--++++ ⎪ ⎪∂∂⎝⎭⎝⎭ ()()2222333233cos sin sin sin x yx y x y x y yf y yf e f e f e yf e f ++++''''''''''=---+++-+ ()2232222333cos sin 2sin x y x yx y e f yf yf e yf e f +++''''''''=-+-+.习题7-51.设2cos e 0x y x y +-=,求d d yx. 解 设2(,)cos e x F x y y x y =+-,则22d e 2e 2d sin sin x x x y F y xy xyx F y x y x --=-=-=--+. 2.设ln ln 1xy y x ++=,求1d d x yx =. 解 设(,)ln ln 1F x y xy y x =++-,则221d 1d x y y F y xy y x x F x y x x y++=-=-=-++. 当1x =时,由ln ln 1xy y x ++=知1y =,所以1d 1d x yx ==-. 3.设arctany x =,求d d y x. 解设(,)ln arctan y F x y x=,则2222222222211d11d1xyyx x yyFy x yx y x yxy xx F x yx x y x yyx⎛⎫-⋅- ⎪⎝⎭⎛⎫++ ⎪+++⎝⎭=-=-=-=--⋅-++⎛⎫+ ⎪⎝⎭.4.设222cos cos cos1x y z++=,求zx∂∂,zy∂∂.解设222(,,)cos cos cos1F x y z x y z=++-,则2cos sin sin22cos sin sin2xzFz x x xx F z z z∂-=-=-=-∂-,2cos sin sin22cos sin sin2yzFz y y yy F z z z∂-=-=-=-∂-.5.设方程(,)0F x y z xy yz zx++++=确定了函数(,)z z x y=,其中F存在偏导函数,求zx∂∂,zy∂∂.解1212()()xzF F y z Fzx F F y x F''++∂=-=-∂''++,1212()()yzF F x z Fzy F F y x F''++∂=-=-∂''++.6.设由方程(,,)0F x y z=分别可确定具有连续偏导数的函数(,)x x y z=,(,)y y x z=,(,)z z x y=,证明:1x y zy z x∂∂∂⋅⋅=-∂∂∂.证因为yxFxy F∂=-∂,zyFyz F∂=-∂,xzFzx F∂=-∂,所以1y xzx y zF FFx y zy z x F F F⎛⎫⎛⎫⎛⎫∂∂∂⋅⋅=-⋅-⋅-=-⎪⎪ ⎪⎪∂∂∂⎝⎭⎝⎭⎝⎭.7.设(,)u vϕ具有连续偏导数,证明由方程(,)0cx az cy bzϕ--=所确定的函数(,)z f x y=满足z za b cx y∂∂+=∂∂.证令u cx az=-,v cy bz=-,则x u u u c x ϕϕϕ∂=⋅=∂,y v v vc yϕϕϕ∂=⋅=∂,z u v u v u v a b z z ϕϕϕϕϕ∂∂=⋅+⋅=--∂∂. x u z u v c z x a b ϕϕϕϕϕ∂=-=∂+,y v z u vc zy a b ϕϕϕϕϕ∂=-=∂+. 于是 u v u v u vc c z zab a bc x y a b a b ϕϕϕϕϕϕ∂∂+=⋅+⋅=∂∂++. 8.设0ze xyz -=,求22zx∂∂.解 设(,,)zF x y z e xyz =-,则x F yz =-,z z F e xy =-. 于是x zz F z yzx F e xy ∂=-=∂-, ()222()z z zz z ye xy yz e y z z x x x x x e xy ∂∂⎛⎫--- ⎪∂∂∂∂∂⎛⎫⎝⎭== ⎪∂∂∂⎝⎭-()22z z zyzy z yz e y e xy e xy ⎛⎫-⋅- ⎪-⎝⎭=-()2322322z zzy ze xy z y z e exy --=-.9.设(,)z z x y =是由方程2e 0zxz y --=所确定的隐函数,求2(0,1)zx y∂∂∂.解 设2(,,)e z F x y z xz y =--,则x F z =-,e z z F x =-,2y F y =-. 于是x z z F z z x F e x ∂=-=∂-,2y zz F z yy F e x∂=-=∂-, ()()22z z zz z e x z e z z y yx y y x ex ∂∂--⋅⋅∂∂∂∂∂⎛⎫== ⎪∂∂∂∂⎝⎭-()()222z zz zz y y e x ze e x e x e x ----=-()()322z zzy e x yze ex --=-.由20ze xz y --=,知(0,1)0z =,得2(0,1)2zx y∂=∂∂.10.求由方程xyz +=(,)z z x y =在点(1,0,1)-处的全微分d z .解设(,,)F x y z xyz =x z F zx F xy ∂=-==∂+,y z F zy F xy ∂=-==∂+,d d d z zz x y x y x y ∂∂=+=∂∂,(1,0,1)d d z x y -=.11.求由下列方程组所确定的函数的导数或偏导数:(1)设22222,2320,z x y x y z ⎧=+⎪⎨++=⎪⎩求d d y x ,d d z x; (2)设0,1,xu yv yu xv -=⎧⎨+=⎩求u x ∂∂,u y ∂∂,v x ∂∂,vy ∂∂; (3)设sin ,cos ,uux e u v y e u v ⎧=+⎪⎨=-⎪⎩求u x ∂∂,u y ∂∂,v x ∂∂,vy∂∂. 解 (1)分别在两个方程两端对x 求导,得d d 22,d d d d 2460.d d zy x y x xy z x y z x x ⎧=+⎪⎪⎨⎪++=⎪⎩称项,得d d 22,d d d d 23.d d y z y x x xy z y z x xx ⎧-=-⎪⎪⎨⎪+=-⎪⎩ 在 2162023y D yz y y z-==+≠的条件下,解方程组得213d 6(61)d 622(31)x x z yxz x x z x D yz y y z ------+===++. 222d 2d 6231y xy x z xy xx D yz y z --===++. (2)此方程组确定两个二元隐函数(,)u u x y =,(,)v v x y =,将所给方程的两边对x 求导并移项,得,.uv x y u x xu v y x v xx ∂∂⎧-=-⎪⎪∂∂⎨∂∂⎪+=-⎪∂∂⎩ 在220x yJ x y y x-==+≠的条件下,22u y v x u xu yvx y x x y y x ---∂+==--∂+, 22x uy v v yu xvx y x x yy x--∂-==-∂+. 将所给方程的两边对y 求导,用同样方法在220J x y =+≠的条件下可得22u xv yu y x y∂-=∂+,22v xu yv y x y ∂+=-∂+. (3)此方程组确定两个二元隐函数(,)u u x y =,(,)v v x y =是已知函数的反函数,令(,,,)sin u F x y u v x e u v =--,(,,,)cos u G x y u v y e u v =-+.则 1x F =,0y F =,sin u u F e v =--,cos v F u v =-, 0x G =,1y G =,cos u u G e v =-+,sin v G u v =-.在sin cos (,)(sin cos )0(,)cos sin u u u e v u v F G J ue v v u u v e v u v---∂===-+≠∂-+-的条件下,解方程组得1cos 1(,)1sin 0sin (,)(sin cos )1uu v u F G vu v x J x v J e v v -∂∂=-=-=-∂∂-+, 0cos 1(,)1cos 1sin (,)(sin cos )1uu v u F G vu v y J y v J e v v -∂∂-=-=-=-∂∂-+, sin 11(,)1cos (,)[(sin cos )1]cos 0u uu ue v v F G v e x J u x J u e v v e v --∂∂-=-=-=∂∂-+-+, sin 01(,)1sin (,)[(sin cos )1]cos 1u uu u e v v F G v e x J u x J u e v v e v --∂∂+=-=-=∂∂-+-+.习题7-61.求下列曲线在指定点处的切线方程和法平面方程: (1)2x t =,1y t =-,3z t =在(1,0,1)处; (2)1t x t =+,1t y t+=,2z t =在1t =的对应点处;(3)sin x t t =-,1cos y t =-,4sin2t z =在点2π⎛- ⎝处; (4)2222100,100,x y y z ⎧+-=⎪⎨+-=⎪⎩在点(1,1,3)处. 解 (1)因为2t x t '=,1t y '=-,23t z t '=,而点(1,0,1)所对应的参数1t =,所以(2,1,3)=-T .于是,切线方程为11213x y z --==-. 法平面方程为2(1)3(1)0x y z --+-=,即 2350x y z -+-=.(2)因为2211(1)(1)t t t x t t +-'==++,22(1)1t t t y t t -+'==-,2t z t '=,1t =对应着点1,2,12⎛⎫⎪⎝⎭,所以 1,1,24⎛⎫=- ⎪⎝⎭T .于是,切线方程为 1212148x y z ---==-. 法平面方程为 281610x y z -+-=.(3)因为1cos t x t '=-,sin t y t '=,2cos 2t t z '=,点1,12π⎛- ⎝对应在的参数为2t π=,所以(=T .于是,切线方程为112x y π-+=-=. 法平面方程为402x y π++--=. (4)将2222100,100,x y y z ⎧+-=⎪⎨+-=⎪⎩的两边对x 求导并移项,得 d 22,d d d 220,d d yy x xy z y z xx ⎧=-⎪⎪⎨⎪+=⎪⎩ 由此得 2002d 420d 422x z y xz x y x yz y y z --===-,2220d 420d 422y x y z xy xy x yz z y z-===.(1,1,3)d 1d y x =-,(1,1,3)d 1d 3z x =.从而 1,1,3=- ⎪⎝⎭T . 故所求切线方程为113331x y z ---==-. 法平面方程为 3330x y z -+-=.2.在曲线x t =,2y t =,3z t =上求一点,使此点的切线平行于平面24x y z ++=.解 因为1t x '=,2t y t '=,23t z t '=,设所求点对应的参数为0t ,于是曲线在该点处的切向量可取为200(1,2,3)t t =T .已知平面的法向量为(1,2,1)=n ,由切线与平面平行,得0⋅=T n ,即2001430t t ++=,解得01t =-和13-.于是所求点为(1,1,1)--或111,,3927⎛⎫-- ⎪⎝⎭. 3.求下列曲面在指定点处的切平面和法线方程: (1)222327x y z +-=在点(3,1,1)处; (2)22ln(12)z x y =++在点(1,1,ln 4)处; (3)arctany z x =在点1,1,4π⎛⎫ ⎪⎝⎭处. 解(1)222(,,)327F x y z x y z =+--,(,,)(6,2,2)x y z F F F x y z ==-n ,(3,1,1)(18,2,2)=-n .所以在点(3,1,1)处的切平面方程为9(3)(1)(1)0x y z -+---=,即 9270x y z +--=. 法线方程为311911x y z ---==-. (2)22(,,)ln(12)F x y z x y z =++-,222224(,,),,11212x y z x yF F F x y x y ⎛⎫==- ⎪++++⎝⎭n ,(1,1,ln 4),1,12=- ⎪⎝⎭n .所以在点(1,1,ln 4)处的切平面方程为2234ln 20x y z +--+=.法线方程为 12ln 2122y z x ---==-. (3)(,,)arctanyF x y z z x=-, 2222(,,),,1x y z y xF F F x y x y ⎛⎫-==- ⎪++⎝⎭n , 1,1,411,,122π⎛⎫ ⎪⎝⎭⎛⎫=-- ⎪⎝⎭n . 所以在点1,1,4π⎛⎫⎪⎝⎭处的切平面方程为 202x y z π-+-=. 法线方程为 114112z x y π---==-. 4.求曲面2222321x y z ++=上平行于平面460x y z ++=的切平面方程.解 设222(,,)2321F x y z x y z =++-,则曲面在点(,,)x y z 处的一个法向量(,,)(2,4,6)x y z n F F F x y z ==.已知平面的法向量为(1,4,6),由已知平面与所求切平面平行,得246146x y z ==,即12x z =,y z =. 代入曲面方程得 22223214z z z ++=. 解得 1z =±,则12x =±,1y =±. 所以切点为 1,1,12⎛⎫±±± ⎪⎝⎭. 所求切平面方程为 21462x y z ++=±5.证明:曲面(,)0F x az y bz --=上任意点处的切平面与直线x yz a b==平行(a ,b 为常数,函数(,)F u v 可微).证 曲面(,)0F x az y bz --=的法向量为1212(,,)F F aF bF ''''=--n ,而直线的方向向量(,,1)a b =s ,由0⋅=n s 知⊥n s ,即曲面0F =上任意点的切平面与已知直线x yz a b==平行. 6.求旋转椭球面222316x y z ++=上点(1,2,3)--处的切平面与xOy 面的夹角的余弦.解 令222(,,)316F x y z x y z =++-,曲面的法向量为(,,)(6,2,2)x y z F F F x y z ==n ,曲面在点(1,2,3)--处的法向量为1(1,2,3)(6,4,6)--==--n n ,xOy 面的法向量2(0,0,1)=n ,记1n 与2n 的夹角为θ,则所求的余弦值为1212cos θ⋅===n n n n . 7.证明曲面3xyz a =(0a >,为常数)的任一切平面与三个坐标面所围成的四面体的体积为常数.证 设3(,,)F x y z xyz a =-,曲面上任一点(,,)x y z 的法向量为(,,)n yz xz xy =,该点的切平面方程为()()()0yz X x xz Y y xy Z z -+-+-=,即 33yzX xzY xyZ a ++=.这样,切平面与三个坐标面所围成的四面体体积为33331333962a a a V a yz xz xy =⋅⋅⋅=.习题7-71.求函数22z x y =+在点(1,2)处沿从点(1,2)到点(2,2的方向的方向导数.。
第七章 、货币需求习题答案

第七章货币需求一、填空题1、“1:8”公式的含义是:对于8元钱的零售商品供应,对应的需要1元钱的人民币实现其流通。
2、凯恩斯货币需求理论中,受利率影响的货币需求是投机性需求。
3、弗里德曼认为,影响货币需求的最重要的变量因素是_恒久性收入_ __。
4、在货币需求理论中,提出现金交易说的经济学家是欧文。
费雪。
5、凯恩斯认为影响货币需求的重要因素是利率。
6、实际货币需求则是经济主体的名义货币需求在扣除价格变动因素以后的货币需求。
7、剑桥方程式的公式是Md=KPy。
8、凯恩斯将人们的货币需求动机归结为:交易动机、预防动机和投机动机。
二、单项选择题1、费雪在交易方程式中假定( D )。
A、M和V短期内稳定B、T和P短期内稳定C、P和V短期内稳定D、T和V短期内稳定2、提出现金交易说的经济学家是(C)。
A、凯恩斯B、马歇尔C、费雪D、庇古3、弗里德曼货币需求函数中的收入是指( D )。
A、当期收入B、过去的收入C、未来的收入D、恒久收入4、剑桥方程式中,着重研究的货币职能是( C )。
A、价值尺度B、流通手段C、储藏手段D、支付手段5、凯恩斯货币需求函数M=L1(Y)+ L2(i)中,认为M与收入Y和利率i的关系分别是(D )A、负相关,正相关B、正相关,正相关C、负相关,负相关D、正相关,负相关三、名词解释1、货币需求: 是指社会各部门在既定的收入或财富范围内能够而且愿意以货币形式持有的数量。
四、简答题1、简述影响和决定我国货币需求的因素。
2、简要分析凯恩斯货币需求理论与弗里德曼货币需求理论的区别。
3、简述费雪方程式(现金交易说)与剑桥方程式(现金余额说)的区别。
4、简述凯恩斯关于货币需求动机分析的主要内容。
五、计算题六、论述题1、试述弗里德曼货币需求理论的主要内容,并说明该理论与凯恩斯流动性偏好理论相比有何特色?2、试比较分析现金交易说与现金余额说的主要区别。
1。
第七章 练习题参考答案

V1 V3 V6
7. 对下图所示的有向图
(1) 画出它的邻接表 (2) 根据邻接表写出其拓扑排序序列
解:(1)邻接表为
0
2
5∧
2
3
4∧
2 3∧
4∧
1
2
3
6∧
1
4∧
(2)由邻接表可得拓朴排序序列:
1 5 2 3 64
8.已知n个顶点的有向图用邻接矩阵表示,编 写函数,计算每对顶点之间的最短路径。
4 18 ∧
2
1 12
32
5 22 ∧
3
1 16
22
44∧
4
1 18
34
5 10 ∧
5
2 22
4 10 ∧
解:(1) V1
12 V2
16 2
18
4 V3 22
V4
10 V5
(2)深度优先遍历的结点序列:v1,v2,v3,v4,v5
广度优先搜索的结点序列:v1,v2,v3,v4,v5
(3)最小生成树
CD CA CAB
CD CA CAB
CD CA CABΒιβλιοθήκη CD3DB
DB
DB DBC
DBCA DB DBC
DBCA DB DBC
10.对于如图所示的AOE网,求出各活动可能 的最早开始时间和允许的最晚开始时间, 哪些是关键活动?
a1=4
v2
v1
a3=2
a2=3
v3
a5=6 v4
a4=4
解:
顶点 Ve Vl V1 0 0 V2 4 4 V3 6 6 v4 10 10
if(length[i][k]+length[k][j]<length[i][j]) { length[i][j]=length[i][k]+length[k][j];
第七章习题及答案

第七章习题及答案第七章习题及答案1.如果要设置幻灯片“水平百叶窗”播放效果,应使用菜单“幻灯片放映”中的(b)a. 动作设置b. 自定义动画c. 预设动画2.列方法中不能启动PowerPoint 2003的是(前提为已正常安装好PowerPoint 2003) ( c)a. 选择“开始”→“程序”→“Microsoft Office 2003”→“Microsoft Office PowerPoint 2003”命令b. 用鼠标左键双击桌面上的PowerPoint 2003快捷方式图标c. 用鼠标右键双击桌面上的PowerPoint 2003快捷方式图标d. 用鼠标左键双击已建立好的PowerPoint 2003文件3.显示和隐藏工具栏的操作是 ( d )a. 隐藏“浮动工具栏”,可双击它b. 通过“工具”菜单的“自定义”命令进行操作c. 用鼠标右键单击此工具栏d. 点击“视图”菜单中的“工具栏”,在弹出的菜单中单击需要显示或隐藏的工具栏名称4.powerPoint 2003有__d____种显示视图。
a. 5b. 2c. 3d. 45.“文件”菜单中的“打印”命令,其快捷键是 ( c )a. Ctrl+Nb. Ctrl+Sc. Ctrl+Pd. Ctrl+X6.在PowerPoint 2003中,“文件”菜单中的“打开”命令的快捷键是 (a)a. Ctrl+Ob. Ctrl+Sc. Ctrl+Pd. Ctrl+N7.计算机没有接打印机,Powerpoint2003将_____a_____。
a. 可以进行幻灯片的放映,但不能打印b. 不能进行幻灯片的放映,也不能打印c. 按文件类型,有的能进行幻灯片的放映,有的不能进行幻灯片的放映d. 按文件大小,有的能进行幻灯片的放映,有的不能进行幻灯片的放映8.Powerpoint 2003演示文稿的默认扩展名是 ( c)a. DOCb. XLSc. PPTd. PTT9. 在用PowerPoint 2003制作的幻灯片中__d____。
国家开放大学教育学第七章练习题答案

国家开放大学教育学第七章练习题答案一、单选:教育的根本任务是()。
A、传授知识B、教书育人C、学会做人D、学会认知E、增强技能正确答案是:教书育人教师运用语言连贯系统地向学生传递知识的方法,属于下面哪一种教学法()A、读书指导法B、谈话法C、讲授法D、讨论法E、演示法正确答案是:讲授法把一定数量的学生按年龄与知识程度编成固定的班级,根据周课表和作息时间表,安排教师有计划地向全班学生上课的一种集体教学形式,就是()。
A、现场教学B、小组教学C、个别教学D、班级授课制E、复式教学正确答案是:班级授课制教师和学生在特定的环境和条件下,基于预定的课程教学目标,通过交流与互动所达成的有效果与有效益的教学,属于我国当前推崇的教学新理念中的()新理念。
A、实践教学B、体验教学C、对话教学D、有效教学E、反思性教学正确答案是:有效教学以文本为中介,引发学生对文本中蕴含的思想感情的体味或对自己生活经历的反思,从而获得对文本、内涵和自我人生的一种感受和领悟的教学新理念,属于()新理念。
A、有效教学B、对话教学C、反思性教学D、实践教学E、体验教学二、多选题以语言传递为主的教学方法包括()。
A、讲授法B、参观法C、读书指导法D、谈话法E、讨论法The correct answers are: 讲授法, 谈话法, 讨论法, 读书指导法对于学生的学习方式可以从不同的角度进行划分,根据学习进行的形式,学习的方式可以划分为()。
A、机械学习B、接受式学习C、独立学习D、发现式学习E、意义学习The correct answers are: 发现式学习, 接受式学习对于学生的学习方式可以从不同的角度进行划分,就组织形式而言,学习方式可划分为()。
A、合作学习B、意义学习C、机械学习D、接受式学习E、独立学习The correct answers are: 独立学习, 合作学习学校的教学内容具有如下几个特点()。
选择一项或多项:A、时代性B、发展性C、科学性D、基础性E、地方特色The correct answers are: 科学性, 基础性, 时代性我国当今推崇的教学新理念,除了有效教学、反思性教学外,还包括()新理念。
第07章--基元反应动力学--习题及答案

第七章 基元化学反应动力学习题及答案1. N 2O 5在25℃时分解反应的半衰期为5.7h, 且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应 111216.07.56932.06932.021-===h t kt k y1)11ln(=- h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-=即完成90%所需时间为18.9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1 =5.4×1011exp(-122 474 J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101 325 Pa ,问多长时间后,丙烯酮的分压可达54 kPa ?解:k /S -1=5.4×1011exp[-122474/8.314×(150+273)]=4.055×10-4据题意:kt p p t=0lnt 410005.454000101325101325ln-⨯=-t =1877S3. 双分子反应2A(g)−→−k B(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出 (1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol-1, 573K时的最大反应速率为多少? 解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t, t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.4. 450℃时实验测定气相反应3A + B→2C的速率数据如下;实验初压 / Pa 初速率-dpB/ dt / (Pa/h)PA,0 PB,01. 100 1.00 0.0100 2. 200 1.00 0.0400 3. 400 0.50 0.0800(1)若反应的速率方程为r = kPA x PBy,求x、y及k。
第七章 习题及答案

第七章 相关与回归分析一、单项选题题1、当自变量X 减少时,因变量Y 随之增加,则X 和Y 之间存在着( ) A 、线性相关关系 B 、非线性相关关系 C 、正相关关系 D 、负相关关系2、下列属于函数关系的有( )A 、身高与体重之间B 、广告费用支出与商品销售额之间C 、圆面积与半径之间D 、施肥量与粮食产量之间 3、下列相关程度最高的是( )A 、r=0.89B 、r=-0.93C 、r=0.928D 、r=0.8 4、两变量x 与y 的相关系数为0.8,则其回归直线的判定系数为( ) A 、0.80 B 、0.90 C 、0.64 D 、0.50 5、在线性回归模型中,随机误差项被假定服从( )A 、二项分布B 、t 分布C 、指数分布D 、正态分布6、物价上涨,销售量下降,则物价与销售量之间的相关属于( ) A 、无相关 B 、负相关 C 、正相关 D 、无法判断7、相关分析中所涉及的两个变量( )A 、必须确定哪个是自变量、哪个是因变量B 、都不能为随机变量C 、都可以是随机变量D 、不是对等关系 8、单位产品成本y (元)对产量x (千件)的回归方程为:t t x y 2.0100-=∧,其中“—0.2”的含义是( )A 、产量每增加1件,单位成本下降0.2元B 、产量每增加1件,单位成本下降20%C 、产量每增加1000件,单位成本下降20%D 、产量每增加1000件,单位成本平均下降0.2元E 、产量每增加1000件,单位成本平均下降20% 二、多项选择题1、下列说法正确的有( )A 、相关分析和回归分析是研究现象之间相关关系的两种基本方法B 、相关分析不能指出变量间相互关系的具体形式,也无法从一个变量的变化来推测另一个变量的变化情况 C、回归分析可以不必确定变量中哪个是自变量,哪个是因变量 D、相关分析必须事先研究确定具有相关关系的变量中哪个为自变量,哪个为因变量 E、相关分析中所涉及的变量可以都是随机变量,而回归分析中因变量是随机的,自变量是非随机的2、判定现象之间有无相关关系的方法有()A、计算回归系数B、编制相关表C、绘制相关图D、计算相关系数E、计算中位数3、相关关系按相关的形式可分为()A、正相关B、负相关C、线性相关D、非线性相关E、复相关4、在直线回归方程∧yt=∧β1+∧β2Xt中,回归系数∧β2的数值()A、表明两变量之间的平衡关系B、其正、负号表明两变量之间的相关方向C、表明两变量之间的密切程度D、表明两变量之间的变动比例E、在数学上称为斜率5、下列那些项目属于现象完全相关()A、r=0B、r= —1C、r= +1D、y的数量变化完全由X的数量变化所确定E、r=0.986、在回归分析中,要求所涉及的两个变量x和y()A、必须确定哪个是自变量、哪个是因变量B、不是对等关系C、是对等关系D、一般来说因变量是随机的,自变量是非随机变量E、y对x的回归方程与x对y的回归方程是一回事7、下列有相关关系的是()A、居民家庭的收入与支出B、广告费用与商品销售额C、产量与单位产品成本D、学生学习的时间与学习成绩E、学生的身高与学习成绩8、可决系数2r=86.49%时,意味着()A 、自变量与因变量之间的相关关系密切B 、因变量的总变差中,有80%可通过回归直线来解释 C 、因变量的总变差中,有20%可由回归直线来解释 D 、相关系数绝对值一定是0.93 E 、相关系数绝对值一定是0.8649 三、填空题1、相关系数r 的取值范围为 。
第七章习题及答案

第七章习题及答案一、单选题1、以下哪个选项属于非正式沟通的方式()。
A. 发布文件B. 会议报告C. 工作总结D. 网上聊天2.以下不属于管理沟通要素的是()。
A.编码和解码B.发送者和接收者C.背景D.思想3.以下不属于沟通中个体障碍的是()。
A.选择性知觉B.情绪C.目标差异D.信息操控4. 醒目、准确、可查阅、可保存、正式、方便快捷等,这属于以下哪种沟通技能的优点?()A.倾听B.面谈C.书面语言沟通D.演讲5. 沟通者可信度的因素包括沟通者的()。
A.身份地位B.良好意愿C.专业知识D.以上都是6. 当沟通者认为沟通的目的在于帮助他人或下属认识他们的思想情感和个性问题时,则更适合采用()。
A.告知策略B.咨询性策略C.说服策略D.指导性策略7.以下不是沟通信息策略所要解决的问题是()。
A.激发受众B. 筛选和过滤信息C. 强调信息D. 组织信息8. 在危机处理过程中,应努力避免信息不对称的情况,在对内、对外两个层面上,保持信息管道的双向畅通。
这指的是危机沟通的()。
A.真诚原则B. 信息对称C. 快速反应D. 核心立场9.在冲突沟通中,当争议双方都坚信自己的想法是对的,此时适宜采用()策略。
A.和平共存B. 按兵不动C. 粉饰太平D. 铁令如山10. 以下哪条不属于书面语言沟通的“4C”原则?()A.正确B.清晰C.完整D.理性二、判断题1. 解码是发送者把自己的思想、观点、情感等信息根据一定的语言、语义规则翻译成可以传送的信号。
错2.沟通客体策略突出了沟通者站在对方的立场思考问题和传递信息这个本质。
正确3. 沟通者不但要把信息传递给对方,还需要了解对方的反应,确认信息传递出去之后的效果,这反映了管理沟通的策略性的特点。
错4.管理沟通有利于领导者激励下属,建立良好的人际关系和组织氛围,提高员工的士气。
对5. 现实中,人们往往重视语言沟通,而忽视非语言沟通的重要意义。
事实上,非语言信息往往能够更有力地传达信息。
马克思第七章习题及答案

第七章习题及答案一、单项选择题1.下列提法正确的是: DA只有空想社会主义思想家预见了未来社会 B只有马克思主义经典作家预见了未来社会C只有唯心主义思想家预见了未来社会 D许多思想家都预见了未来社会2.“通过批判旧世界来发现新世界”是: BA空想社会主义预见未来社会的方法 B马克思主义预见未来社会的方法C唯物主义预见未来社会的方法 D唯心主义预见未来社会的方法3. 各尽所能,按需分配是:DA原始社会的分配方式 B阶级社会的分配方式C社会主义社会的分配方式 D共产主义社会的分配方式4.在人的发展和社会发展的关系问题上,马克思主义认为:DA前者是个人的理想,后者是社会的目标 B前者体现了个人价值,后者体现了社会价值C前者和后者是彼此独立的历史发展过程D.前者和后者互为前提和基础5. 马克思主义认为自由是:DA人们选择的主动性 B人能够随心所欲,为所欲为C人类能够摆脱必然性 D人们在对必然认识的基础之上对客观的改造6.“代替那存在着阶级和阶级对立的资产阶级旧社会的,将是这样一个联合体,在那里,每个人的自由发展是一切人的自由发展的条件”。
这是: AA《共产党宣言》中的一段话 B《共产主义原理》中的一段话C《哥达纲领批判》中的一段话 D《资本论》中的一段话7.“人的依赖性关系”是: AA资本主义社会以前的人与人之间的关系 B资本主义社会之中的人与人之间的关系C社会主义社会之中的人与人之间的关系 D共产主义社会之中的人与人之间的关系8.“物的依赖性关系”是: BA资本主义社会以前的人与人之间的关系 B资本主义社会之中的人与人之间的关系C社会主义社会之中的人与人之间的关系 D共产主义社会之中的人与人之间的关系9.实现了人的“自由个性”的发展,是: DA资本主义社会以前的人的生存状态 B资本主义社会之中的人的生存状态C社会主义社会之中的人的生存状态 D共产主义社会之中的人的生存状态10.“必然王国”和“自由王国”是: CA时间性概念 B空间性概念 C历史性概念 D物质性概念11.下列属于自由王国社会状态的是: DA奴隶社会 B封建社会 C资本主义社会 D共产主义社会12.必然王国和自由王国是社会发展的:AA两种不同的状态 B两种不同的选择 C两条不同的道路 D两种不同的理想13.自由王国是指人们:DA处于绝对自由的原始社会状态 B不再受自然规律和社会规律支配的状态C允许自由竞争的资本主义状态D摆脱了自然和社会关系的奴役,成为自己社会关系主人的状态14.马克思主义认为,消灭“三大差别”的关键在于: DA消灭工业与农业的差别 B消灭城市和乡村的差别C消灭脑力劳动和体力劳动的差别 D消灭利益差别15.“两个必然”和“两个决不会”:CA是矛盾的 B是两回事 C是有着内在联系的 D是内容和形式的关系16.江泽民说:“忘记远大理想而只顾眼前,就会失去前进方向,离开现实工作而空谈远大理想,就会脱离实际。
单片机第七章习题参考答案

第七章习题参考答案一、填空题1、在串行通信中,有数据传送方向为单工、半双工和全双工三种方式。
2、要串口为10位UART,工作方式应选为方式1 。
3、用串口扩并口时,串行接口工作方式应选为方式0 。
4、计算机的数据传送有两种方式,即并行数据传送和串行数据传送方式,其中具有成本低特点的是串行数据传送方式。
5、串行通信按同步方式可分为异步通信和同步通信。
6、异步串行数据通信的帧格式由起始位、数据位、奇偶校验位和停止位组成。
7、串行接口电路的主要功能是串行化和反串行化,把帧中格式信息滤除而保留数据位的操作是反串行化。
8、专用寄存器“串行数据缓冲寄存器”,实际上是发送缓冲寄存器和接收缓冲寄存器的总称。
9、MCS-51的串行口在工作方式0下,是把串行口作为同步移位寄存器来使用。
这样,在串入并出移位寄存器的配合下,就可以把串行口作为并行输出口使用,在并入串出移位寄存器的配合下,就可以把串行口作为并行输入口使用。
10、在串行通信中,收发双方对波特率的设定应该是约定的。
11、使用定时器/计数器设置串行通信的波特率时,应把定时器/计数器1设定作方式 2 ,即自动重新加载方式。
12、某8031串行口,传送数据的帧格式为1个起始位(0),7个数据位,1个偶校验位和1个停止位(1)组成。
当该串行口每分钟传送1800个字符时,则波特率应为300b/s 。
解答:串口每秒钟传送的字符为:1800/60=30个字符/秒所以波特率为:30个字符/秒×10位/个字符=300b/s13、8051单片机的串行接口由发送缓冲积存器SBUF、接收缓冲寄存器SBUF 、串行接口控制寄存器SCON、定时器T1构成的波特率发生器等部件组成。
14、当向SBUF发“写”命令时,即执行MOV SBUF,A 指令,即向发送缓冲寄存器SBUF装载并开始由TXD 引脚向外发送一帧数据,发送完后便使发送中断标志位TI 置“1”。
15、在满足串行接口接收中断标志位RI=0 的条件下,置允许接收位REN=1 ,就会接收一帧数据进入移位寄存器,并装载到接收SBUF中,同时使RI=1,当发读SBUF命令时,即指令MOV A,SBUF 指令,便由接收缓冲寄存器SBUF取出信息同过8051内部总线送CPU。
第07章_存储器习题答案

第七章习题答案7.1.1 指出下列存储系统各具有多少个存储单元,至少需要几根地址线和数据线。
(1)64K×1 (2)256K×4 (3)lM×1 (4)128K×8解:求解本题时,只要弄清以下几个关系就能很容易得到结果:存储单元数=字数×位数地址线根数(地址码的位数)n与字数N的关系为:N=2n数据线根数=位数(1)存储单元〓64K×1〓64K(注:lK=1024);因为,64K〓2’。
,即亢〓16,所以地址线为16根;数据线根数等于位数,此处为1根。
同理得:(2)1M个存储单元,18根地址线,4根数据线。
(3)1M个存储单元,18根地址线,1根数据线。
!_(4)lM个存储单元,17根地址线,8根数据线。
7.1.2 设存储器的起始地址为全0,试指出下列存储系统的最高地址为多少?(1)2K×1 (2)16K×4 (3)256K×32解:因为存储系统的最高地址=字数十起始地址一1,所以它们的十六进制地址是:(1)7FFH (2)3FFFH (3)3FFFFH '7,2.4 一个有1M×1位的DRAM,采用地址分时送人的方法,芯片应具有几条地址线?解:由于1M=210×210,即行和列共需20根地址线。
所以,采用地址分时送人的方法,芯片应具有10根地址线。
7.2.5 试用一个具有片选使能CE、输出使能OE、读写控制WE、容量为8 K×8位的sRAM 芯片,设计一个16K×16位的存储器系统,试画出其逻辑图。
解:采用8K×8位的sRAM构成16K×16位的存储器系统,必须同时进行字扩展和位扩展。
用2片8K×8位的芯片,通过位扩展构成8K×16位系统,此时需要增加8根数据线。
要将8K×16位扩展成16K×16位的存储器系统,还必须进行字扩展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章习题答案第7章练习第7章1。
计算氢原子核外的电子从第三能级跃迁到第二能级时产生的谱线H?波长和频率解决方案:?=右侧??1?n2?1??1n2?= 3.289?1015??1?1??1??2232?s??= 4.57?1014s?1??c?2.998?108米?s?1=4.57?1014s?1= 656?10?9m= 656nm2。
基态氢原子的电离能是多少?解决方案:我=?E = h?= 6.626?10?34 J?s?3.289?1015s?1(1/12?1/?)=2.179?10?18J3。
以下哪个量子数是不合理的?为什么?n l m(1)2 1 0(2)229?1(3) 2 3 +2解决方案:(1)合理;(2)L值不合理,应小于N;(3)l和m的值不合理,l应该小于n,m应该为0,?1,?2,??l;4.用合理的量子数表示:(1)三维能级;(2)4s1电子溶液:(1)3d能级:n=3,l = 2;(2)4s1电子:n=4,l=0,m = 0;;5。
分别写出下列元素基态原子的电子分布,并分别指出元素周期表中各元素的位置9f10 ne25 Mn29 Cu24 Cr55 cs71 Lu解决方案:9 F1s 22s 22 p 59第二周期VIIA组10Ne [He]2s22p6第二周期VIIIA组5 2以(1)为例,完成以下(2)?(4)问题1(1)Na(Z = 11)Ne]3s;(2)1s 22s 22p 63s 23p 3;溶液:(1)na(z = 11)[ne]3s 1;26233(3)(Z = 24)[?]3d 4s;(4)[?]3d 104s 24 p 6;(3)铬(Z = 24)[氩]3d 54s 1;102651(2)P(Z = 15)1s 2s 2p 3s 3p;(4)氪(Z = 36)[氩]3d 4s 4p;7。
写出下列离子的最外层电子分布:S?解决方案:S2?3 s3p262K K+3 s3p26+9 Pb2+6s22+6尝试完成下表原子序数价层电子分布11 21 35 48 60 82溶液:原子序数11 21 35 48价层电子分布3 S1 3d 14s 2 254 s4p 4d 105s各层电子数2,8,1 2,8,已知子组元素a的原子和电子最终填充在3d轨道中,最大氧化值为4;对于元素B的原子,个电子最终被填充在最高氧化值为5的4p轨道上:(1)写出元素A和元素B原子的电子分布;根据电子分布,(2)表示它们在周期表中的位置(周期、区域、族)。
解:原子a的最后一个电子填充在3d轨道上,它应该是第四周期d 或ds区域元素;最高氧化值为4,其价电子构型应为3d24s2,22Ti元素;填充在4p轨道中的B原子的最终电子应该是第四周期p区的元素,最高氧化值为5,其价电子构型为4s4p,应该是33As元素。
(1)22Ti:[Ar]3d 24s 2;33As:[Ar]4s24p 3;(2) 22Ti:位于第四周期D区IVB;;第四周期P区的33As:Va;10。
第四阶段有三个要素。
它们的价电子数是1、2和7,它们的原子序数按A、B和C的顺序增加众所周知,外层A和B中的电子数是8,而外层C中的电子数是18。
根据结构,什么是223第7章练习(1) C和A的简单离子?在(2) B和c之间可以形成什么化合物?试着写下化学式解答:根据问题的含义,a应该是19K,b应该是20Ca,c应该是35Br;(1) C和a的简单离子是溴和钾;离子化合物可以在(2) B和c: CaBr2之间形成11。
指出第四周期中具有下列性质的元素:(1)最大原子半径;(2)最大电离能;(3)最强的金属度;(4)非金属性最强;(5)最大电子亲和能;(6)化学性质最不活跃;溶液:(1)最大原子半径:k;(2)最大电离能:氪;(3)最强金属度:k;(4)最强非金属性:br;(5)最大电子亲和力:溴;(6)化学性质最不活跃:KR;12.一种元素的原子在其最外层只有一个电子。
电子的量子数是n = 4,l = 0,m = 0,ms = +1/2,q:(1)有多少元素能满足上述条件?原子序数是多少?(2)写出了相应元素原子的电子分布,并指出它在周期表中的位置溶液:(1)有三种元素满足上述条件:钾、铬、铜;原子序数分别是19、24和29。
(2)对应元素原子的电子分布为:[氩]4s1,[氩]3d54s1,[氩]3d 104 S1;分别位于元素周期表第四周期的S区1A、D区VIB和ds区1B13.在下面的电子构型中,第一电离能最低的原子通常有哪种构型?(1)ns2np 3;(2)ns2np 4;(3)ns2np 5;(4)ns2np 6;溶液:通常,第一电离能最小的原子具有(2) ns2np4构型,失去一个电子后变成np半全稳定构型,因此其电离能较小14。
一种元素的原子序数小于36。
当这个元素的原子失去3个电子时,它的角动量量子数等于2。
轨道中的电子数正好是一半:(1)写出了这个元素原子的电子排列;(2)这个元素属于哪个周期、哪个组和哪个区域?元素符号是什么?溶液:分析:原子序数小于36的应是前四个周期元素;角动量量子数等于2,l = 2,这应该是轨道的D轨道。
只有前四个周期中的第四个周期有D轨道,所以它应该是第四个周期的元素。
在(1)失去3个电子之后,3d轨道中的电子数是半满的,元素应该具有3d64s2构型,并且元素原子的电子排列应该是[氩]3D 4s;(2)此元素属于第四周期VIIIB组d区,元素符号为Fe15。
已知H2O(克)和H2O2(克)?fH?m是?241.8千焦?摩尔。
1 、?136.3千焦?摩尔。
1,H2 (g)和O2(g)的离解能分别为436 kJ?摩尔。
1和493千焦?摩尔。
1.求过氧化氢中氧-氧键的键能?H溶液:氢(克)+1/2氧(克)?f m(H2O)HO(g)22262?+?h?乙(氢-氢)1/2?h?b(O-O) 2?h?b(H-O)2H(g)+O(g)?fH?m(H2O) + 2?h?乙(氢氧基)=?h?b(高-高)+ 1/2?h?b(O-O) 2?h?乙(氢氧基)=?h?b(高-高)+ 1/2?h?b(O-O)??fH?m(H2O) = [436 + (1/2)?493?(?241.8) ] kJ?摩尔。
1 = 924.3千焦?mol?13无机和分析化学学习指南?fH?m(H2O 2)H2(g)+O2(g)H2O 2(g)?h?b(高-高)?h?b(O-O)?rH?m2H(g) + 2O(g)?fH?m(H2O2) +?rH?m =?h?b(H-H) +?h?b(O-O)?rH?m =?h?b(H-H) +?h?b(O-O)??fH?m(H2O2)= [436 + 493?(?136.3)] kJ?摩尔= 1065.3千焦?mol?rH?m = 2?h?乙(氢氧基)+?h?b(-O-O-)?h?b(-O-O-) =?rH?m?2?h?英国(海外)= [1065.3?924.3]千焦?摩尔= 141千焦?摩尔。
1 = e (-o-o-)16。
已知NH3(g)?fH?m=?46kJ?摩尔。
1,H2N-NH2 (G)?fH?m= 95kJ?摩尔。
1,E(H―H)= 436千焦?摩尔,E(N≡N) = 946千焦?Mol计算e (n-h)和e (h2n-NH2)?fH?M(NH3)溶液:1/2 N2(g)+3/2 H2(g)NH3(g)1/2?h?b(N2)3/2?h?b(H2) 3?h?乙(男-女)?1?1?1?1?1N(g) + 3H(g)?fH?m(NH3) + 3?h?b(N-H) = 1/2?h?b(N2) + 3/2?h?(H2)?h?b(N-H) = 1/3[1/2?h?b(N2) + 3/2?h?(H2)??fH?m(NH3)] = 1/3[ (1/2)?946 + (3/2)?436?(?46)] kJ?摩尔。
1 = 391千焦摩尔?1 =东(北――西)?fH?m(N2H 4)N2(g)+2H 2(g)N2H 4(g)?h?b(N2)2?h?(H2)?rH?m2N(g) + 4H(g)?fH?m(N2H4) +?rH?m =?h?b(N2) + 2?h?b(H2)?rH?m =?h?b(N2) + 2?h?(H2)??fH?m(N2H4)= [946 + 2?436?95]千焦?摩尔。
1 = 1723千焦?摩尔。
1?rH?m =?h?b(H2N-NH2) + 4?h?乙(不含乙)?h?b(H2N-NH2) =?rH?m?4?h?乙(北半球)= [1723?4?391]千焦摩尔?1?1= 159 kJ摩尔= E (H2N-NH2)17。
写出O2分子的分子轨道表达式,并据此判断下列双原子分子或离子:O2+,O2,O2?、O22?它们中有多少是单电子,从强到弱排列它们的键的强度,并猜测它们的磁性4第7章练习解:O2分子的分子轨道表达式是O2 [(?1s)2(?*1s)2(?2s)2(?*2s)2(?2px)2(?2py)2(?2pz)2(?*2py)1(?*2pz)1]O2+、O2?、O22?分子轨道表达式为O2 [(?1s)(?1s)(?2s)(?2s)(?2px)(?2py)(?2pz)(?2py)]O2??(?1s)2(?*1s)2(?2s)2(?*2s)2(?2px)2(?2py)2(?2pz)2(?*2py)2(?*2pz)1?O22??(?1s)2(?*1s)2(?2s)2(??2s)2(?2px)2(?2py)2(?2pz)2(?*2py)2(?*2pz)2?+?2?O2、O2、O2和O2的单电子数分别为1、2、1和0,分别具有顺磁、顺磁、顺磁和反磁。
O2+、O2、O2?、O22?的焊接等级为焊接等级(O2+)=(8?3)/2 = 2.5;焊接等级(O2) = (8?4)/2 = 2;粘合水平(O2?)=(8?5)/2 = 1.5;关键级别(O22?)=(8?6)/2 = 1;O2+、O2、O2?、O22?化合物的结合强度依次降低。
18。
根据电负性的不同,确定下列化合物对中键的极性(1) FeO和FeS (2) AsH3和NH3(3) NH3和NF3 (4)四氯化碳和四氯化硅溶液:(1) xO > xS,FeO极性大于FeS;(2) xN > xAs,氮氢极性大于砷氢极性;(3)?x(N-H)=(3.0?2.1)=0.9,?x(N-F)=(4.0?3.0)=1.0,正-反极性大于正-反极性;(4) xC > xSi,硅-氯极性大于碳-氯;19。
用混合轨道理论解释为什么三氯苯酚是一个键角为101的三角锥,而三氯苯酚是一个平面三角几何溶液:p原子的外电子构型为3s23p3。
