化工原理 第8章 吸收作业 传质速率方程
第八章 传质过程导论(化工原理)

第八章 传质过程导论第一节 概述8-1 化工生产中的传质过程均相物系的分离(提纯,回收)1.吸收2.气体的减湿3.液-液萃取4.固-液萃取(浸沥,浸取)5.结晶6.吸附(脱附)7.干燥 8精馏 目的:湿分离或混合8-2 相组成的表示法1. 质量分率和摩尔分率mm a A A =mm a B B =mm a C C =……….......+++=C B A m m m mA,B 两组分 a a -1 nn x A A =nn x B B =nn x C C =…….......+++=C B A n n n n .......1+++=C B A x x x互换 A A AA A m m a m m x ==BB B m m a x =…….∑=++=iii B B A A m a m m m a m m a n ...... ()....,,C B A i =故 ∑==iii AA A A m a m a nn xi iiAA A m xm a a ∑=2.质量比和摩尔比质量比 B A m m a /=摩尔比 B A n n X =()a a a -=1 ()x x X -=1)X X x -=13.浓度质量浓度 V m C A A = 3/m kg摩尔浓度 V n C A A = 3/m k m o l均相混合物的密度ρ即为各组分质量浓度的总和(体积与混合物相等)∑=++=iB A CC C ........ρρA V m a V m C A A A ===C x V n x V n C A A A A ===混合气体 RTp V n C A A A ==RTp MVn M Vm C AAAA A A ===气体总摩尔浓度 RTp Vn C ==摩尔分率与分压分率相等 pp nn y A A A ==气体混合物摩尔比可用分压比表示 BB A A BB A A BA Mp M p Mn M n n n Y ===第二节 扩散原理8-3 基本概念和费克定律分子扩散: 扩散速率与浓度梯度成正比 费克定律: 对双组分物系下表达为: dzdl D J A ABA -=A J —分子A 的扩散通量 s m kmol ⋅2/ 方向与浓度样应相反 AB D —比例系数 组分A 在介质B 中的扩散系数 s m /2A c —组分A 浓度,3/m kmoldz dc A —组分A 的浓度梯度 4/m kmol RTp c A A =得 dzdp RTD J AAB A -=定义A J 通过得截面是“分子对称”得,即有一个A 分子通过某一截面,就有一个B 分子反方向通过这一截面,填补原A 分子得空部位,这种分子对称面为固定时,较为简便。
化工原理

(适用于有机化工、环境工程、 应用化学、精细化工专业)
2020年6月23日
第八章 传质过程概论
第一节 概述 传质定义 分类 四个工具(传质速率方程)
第二节 扩散与单相传质 分子扩散与fick定律 等分子反向扩散、单向扩散 扩散系数 涡流扩散与对流传质
第三节 质量、热量和动量传递的类比
(双膜理论 传质系数) 第四节 吸收设计计算
(操作线方程、最小吸收剂用量、 低浓度气体吸收填料层高度计算) 第五节 传质系数和传质理论 第六节 其他条件下的吸收(非等温、多组分、化学)
第一节 概述
1.1 处理对象 1.2 定义 1.3 吸收剂的选择 1.4 吸收的类型与例子 1.5 吸收与精馏的比较
1.5 吸收与精馏的比较
区别: 精馏操作用加入能量分离剂的方法产生第二相(塔顶冷凝,塔底
再沸加热);吸收操作是用加入质量分离剂的方法直接得到第二相( 吸收剂)。
精馏操作可以直接获得较纯净的轻、重组分;吸收操作得到的是含 有溶质的吸收液,要想得到较纯净的溶质,还需要经过第二个分离操 作(如脱吸)。
精馏操作中,液相部分汽化与汽相部分冷凝同时发生,每层板上的 汽、液相都处于接近饱和的温度下,在相界面两侧轻重组分同时地向 着彼此相反的方向传递,二元精馏接近等分子反向扩散过程。而吸收 操作中,液相温度远远低于沸点,溶剂没有显著的汽化现象,只有溶 质分子由汽相进入液相的单向传递,而汽相中的惰性组分和液相中的 溶剂组分处于“停滞”状态,吸收接近单向扩散过程。
H——溶解度系数,受物系和温度影响,kmol/(kPa·m3)
亨利定律的表达形式:
③ 摩尔分率: y*=mx
式中:y*——每千摩尔气体中所含A组分的摩尔分率; m——相平衡常数,受物系、温度和压力影响,无因次
化工原理B复习资料吸收

第六部分 吸收利用各组分溶解度不同而分离气体混合物的单元操作称为吸收。
一、描述两组分混合物基本物理量1、用物质的量或质量的表示摩尔分率:在混合物中某组分的摩尔数占混合物总摩尔数的分率。
n n y A A =n n x A A =摩尔比:混合物中某组分的摩尔数与惰性组分摩尔数之比。
气相: 液相:B AA n n X =-x x X 1=摩尔浓度:单位体积混合物中某组分的摩尔数。
AA V n c =质量分率:在混合物中某组分的质量占混合物总质量的分率。
m m w A A =质量比:混合物中某组分A 的质量与惰性组分B (不参加传质的组分)的质量之比。
B A m m a A =质量浓度:单位体积混合物中某组分的质量。
AA V m G =偶尔会给质量方面的已知条件,根据定义去推导出所用的摩尔比 2、溶解度定义:平衡状态下气相中溶质分压称为平衡分压或饱和分压,液相中的溶质浓度称为平衡浓度或饱和浓度––––––溶解度。
气体在液体中的饱和浓度*A C 表明一定条件下吸收过程可能达到的极限程度。
BAA n n Y =-yy Y 1=影响因素:在总压不大的情况下,溶解度只与温度和物质气相分压有关。
注意定义,溶解度是用于解释物质平衡状态的物理量。
分析总结:吸收剂、温度T、P 一定时,不同物质的溶解度不同。
温度、溶液的浓度一定时,溶液上方分压越大的物质越难溶。
对于同一种气体,分压一定时,温度T越高,溶解度越小。
温度T一定时,分压P越大,溶解度越大。
加压和降温对吸收操作有利。
二、亨利定律引入下的气液相物理量平衡关系总的来说,亨利定律表征的是平衡状态下,某一组分气相分压(P*)与液相该组分组成的关系。
1、当气相组成用P*表示,由于液相组成的表达形式可以为X摩尔分率、c摩尔浓度,有P*=Ex,P*=c/H注意E、H的意义单位E—亨利常数,单位与压强单位一致。
温度T上升,E值增大;在同一溶剂中,E值越大的气体越难溶。
H—溶解度系数,单位:kmol/m3·Pa或kmol/m3·atm。
化工原理1-2重要公式

Sc1 / 3
1 1 m 1 1 1 , , K x mK y K y ky kx K x k x mk y
G B Y1 Y2 Y G y1 y 2 y 1 2 , 1 2 G B Y1 Y1 Gy 1 y1
(2)全塔衡算: GB Y1 Y2 LS X 1 X 2 , G y1 y 2 Lx1 x 2
(3)操作线方程: Y
LS L L L ,y X Y2 S X 2 x x2 y 2 GB G G G B
GB Y1 Y2 , x1 x2 G y y 2 LS L
(4)出塔富液浓度: X 1 X 2
塔底重组分回收率: 2 (2)全塔衡算: 总物料衡算:
F DW
轻组分物料衡算: Fx F Dx D Wx W 馏出液采出率:
D xF xW F xD xW
(4)塔内气液相负荷(流量) :恒摩尔流假定 精馏段:
L RD V ( R 1) D
, 提馏段:
L RD qF V ( R 1) D (1 q ) F
(2)相对挥发度:
K A yA xA K B yB xB
(3)平衡关系: y
x 1 1x
p A A xA P
3、二元非理想溶液平衡关系: y A 二、传质速率 理论板假设 三、物料衡算 (1)塔顶轻组分回收率: 1
Dx D Fx F W 1 x W F 1 x F
化工原理 1-2 重要公式
第 8 章 吸收
一、气液平衡 1、平衡关系: y f ( x) ;亨利定律: p e Ex , p e Hc , y e mx 2、E 、H、m 的换算: m E / P , E Hc M 二、传质速率 1、分子扩散速率 (1)费克定律: J A DAB
化工原理下3吸收速率方程式

KY K y K G p
式中:KY ——气相总吸收系数,kmol/(m2· s) 。
2.2.7 吸收速率方程
一、膜吸收速率方程式
1.气膜分吸收速率方程
令 则 仿效上式, 得
D P kG RTzG pBm
气膜分传质(吸收)系数, kmol/(m2skPa)。
N A kG ( pA pAi )
N A k y ( yA yAi )
N A kY (YA YAi )
界面组成的确定
8
二、总吸收速率方程式
1. 以(p- p*)表示总推动力的吸收速率方程式 (KG与kG、kL关系) 设吸收系统服从亨利定律或平衡关系在过程 所涉及的浓度范围内为直线,则
cA p H
* A
根据双膜模型,相界面上两相互成平衡
pAi
9
cAi H
二、总吸收速率方程式
由此得 整理得 由
10二、总吸收速率Fra bibliotek程式令
1 1 1 KG HkL kG
总阻力 液膜阻力
* A
气膜阻力
则
N A K G pA p
气相总吸收 速率方程式
s· kPa)。 式中:KG ——气相总吸收系数,kmol/(m2·
11
二、总吸收速率方程式
对于易溶气体,H值很大
1 1 1 KG HkL kG
pA
* cA H
根据双膜模型,相界面上两相互成平衡,则
cAi pAi H
13
二、总吸收速率方程式
由此得 整理得 由
* N A kG pA pAi kG / H cA cAi
NA H * cA cAi kG
化工原理吸收公式总结

化工原理吸收公式总结化工原理中的吸收可是个相当重要的环节,吸收公式更是解决相关问题的关键钥匙。
咱们今儿就来好好唠唠这些公式。
先来说说亨利定律,这可是吸收过程中的基础。
它表明在一定温度和压强下,气液平衡时,溶质在气相中的分压与溶质在液相中的摩尔分数成正比。
用公式表达就是:p = Ex ,这里的 p 是溶质在气相中的平衡分压,E 是亨利系数,x 是溶质在液相中的摩尔分数。
再瞅瞅气膜吸收速率方程:NA = kg(p - pi),这里的 NA 代表溶质 A 的吸收速率,kg 是气膜吸收系数,p 是气相主体中溶质 A 的分压,pi 是相界面处溶质 A 的分压。
液膜吸收速率方程也不能落下:NA = kl(ci - c),NA 同样是溶质A 的吸收速率,kl 是液膜吸收系数,ci 是相界面处溶质 A 的浓度,c是液相主体中溶质 A 的浓度。
还有总吸收速率方程:NA = Ky(y - yi),Ky 是气相总吸收系数,y 是气相主体中溶质 A 的摩尔比,yi 是相界面处溶质 A 的摩尔比。
给您说个我曾经遇到的事儿,就和这吸收公式有关。
有一次在实验室做吸收实验,我们小组想要研究某种气体在特定溶液中的吸收情况。
一开始,大家都信心满满,觉得按照书上的步骤来肯定没问题。
结果呢,实验数据出来一分析,和预期的相差甚远。
我们几个那叫一个着急,赶紧从头开始排查问题。
最后发现,原来是在计算的时候,把气膜和液膜的吸收系数弄混了,导致整个计算结果都错了。
这可给我们上了深刻的一课,让我们明白了,这些公式可不是随便拿来用的,得搞清楚每个参数的含义和适用条件。
说完这些单个的公式,咱们再聊聊它们之间的关系。
在很多实际问题中,需要综合运用这些公式来求解。
比如说,要确定吸收塔的高度,就得先根据物料衡算求出塔底和塔顶的浓度,再结合吸收速率方程计算出传质单元数,最后才能得出塔高。
还有啊,在使用这些公式的时候,一定要注意单位的统一。
不然,一个不小心,就会得出错误的结果。
化工原理8.3 速率关系8.3 吸收过程的速率关系

kX
1 1 1 K X mkY kX
mkY
kX
NA
X X 1 1
N A K X ( X X ) mkY kX
——液相总吸收速率方程
总阻力=气膜阻力+液膜阻力
1 1m
KY kY kX
1 1 1 K X mkY kX
KX mKY
8.3.3 吸收速率方程小结
3、界面浓度
N A kG ( p pi ) kL (ci c)
p pi kL
c ci
kG
p
A
由平衡关系 p* f (c) pi
I
联立上式便可求出 pi , ci
c
ci
8.3.2 总吸收速率方程式
1、以(p-p*)为推动力的总吸收速率方程
吸收系统服从亨利定律 双膜理论:相界面上两相平衡
气膜控制 K y k y
1 1m KY kY k X
气膜控制KY kY
1 1 1 K x mk y kx
液膜控制 Kx kx
1 1 1 K X mkY k X
液膜控制 Kx kx
mKy Kx mKY KX
使用吸收速率方程式应注意以下几点: (1)上述的各种吸收速率方程式是等效的。采用
液膜 控制
示例:水吸收氧
液膜控制示意图
c * c ci c
1 1 1 KG kG HkL
1 H1 KL kG kL
KG HK L
3、以(Y-Y*)为推动力的总吸收速率方程
Y
Y
NA
KG
p总
1Y
p总 1 Y
NA
化工原理实验—吸收

填料吸收塔的操作及吸收传质系数的测定一、实验目的(1)了解填料吸收塔的结构和流程;(2)了解吸收剂进口条件的变化对吸收操作结果的影响;(3)掌握吸收总传质系数的测定方法.二、基本原理1.吸收速率方程式吸收传质速率由吸收速率方程式决定: Na = Ky A Δym式中 Ky 为气相总传质系数,mol/m2*h;A 为填料的有效接触面积,m2;Δym 为塔顶、塔底气相平均推动力。
a 为填料的有效比表面积,m2/m3;V 为填料层堆积体积, m3 ;Kya 为气相总容积吸收传质.系数,mol/m3*h。
从上式可看出,吸收过程传质速率主要由两个参数决定:Δym为过程的传质推动力,Kya的倒数1/Kya表征过程的传质阻力。
2.填料吸收塔的操作吸收操作的结果最终表现在出口气体的组成y2上,或组分的回收率η上。
在低浓度气体吸收时,回收率可近似用下式计算:η = (y1 - y2)/y1吸收塔的气体进口条件是由前一工序决定的,一般认为稳定不变。
控制和调节吸收操作结果的操作变量是吸收剂的进口条件:流率 L 、温度 t 和浓度 x2 这三个要素。
由吸收分析可知,改变吸收剂用量是对吸收过程进行调节的最常用方法,当气体流率 G 不变时,增加吸收剂流率,吸收速率η增加,溶质吸收量增加,出口气体的组成y2随着减小,回收率η增大。
当液相阻力较小时,增加液体的流量,总传质系数变化较小或基本不变,溶质吸收量的增加主要是由于传质平均推动力Δym的增大而引起,即此时吸收过程的调节主要靠传质推动力的变化。
但当液相阻力较大时,增加液体的流量,可明显降低传质阻力,总传质系数大幅度增加,而平均推动力却有可能减小(视调节前操作工况的不同而不同),但总的结果使传质速率增大,溶质吸收量增大。
吸收剂入口温度对吸收过程的影响也甚大,也是控制和调节吸收操作的一个重要因素。
降低吸收剂的温度,使气体的溶解度增大,相平衡常数减小。
对于液膜控制的吸收过程,降低操作温度,吸收过程的阻力随之减小,使吸收效果变好,y2降低,但平均推动力Δym或许会有所减小。
最新化工原理第8章吸收作业传质速率方程

最新化⼯原理第8章吸收作业传质速率⽅程姓名:;学号:;班级:第8章吸收(传质速率⽅程)⼀、填空题:1. 化⼯⽣产中吸收可应⽤在1、______,2、__________,3、_____。
2. 吸收质是指________;⽽吸收剂则是指___________;惰性组分是指____________________。
3. 图所⽰为同⼀温度下A.B.C三种⽓体在⽔中的溶解度曲线。
由图可知,它们溶解度⼤⼩的次序是______;同⼀平衡分压下,它们的液相平衡浓度⼤⼩顺序是________________。
4. 对接近常压的低浓度溶质的⽓液平衡系统,当总压增加时,亨利系数E____,相平衡常数m____,溶解度系数H____。
5. 吸收中,温度不变,压⼒增⼤,可使相平衡常数_______(增⼤,减⼩,不变),传质推动⼒_____(增⼤,减⼩,不变)6.实验室⽤⽔逆流吸收空⽓中的CO2,当⽔量和空⽓量⼀定时,增加CO2,则⼊塔⽓体浓度________,出塔⽓体浓度______,出塔液体浓度________. 2.吸收总推动⼒⽤⽓相浓度差表⽰时,应等于__________________和______________________________之差。
7. 当平衡线为直线时,总传质系数与分传质系数之间的关系可以表⽰为yxy11kkmK+=,m表⽰_____,当_______项可忽略时,表⽰该吸收过程为⽓膜控制。
8.对于难溶⽓体,吸收时属于______控制的吸收,强化吸收的⼿段是_______________________。
⼆、计算题1.某系统温度为10℃,总压101.3kPa ,试求此条件下在与空⽓充分接触后的⽔中,每⽴⽅⽶⽔溶解了多少克氧⽓?(10℃时,氧⽓在⽔中的亨利系数E 为3.31×106kPa 。
)2.在总压101.3kPa ,温度30℃的条件下, SO 2摩尔分率为0.3的混合⽓体与SO 2摩尔分率为0.01的⽔溶液相接触,试问:从液相分析SO 2的传质⽅向;从⽓相分析,其它条件不变,温度降到0℃时SO 2的传质⽅向;其它条件不变,从⽓相分析,总压提⾼到202.6kPa 时SO 2的传质⽅向,并计算以液相摩尔分率差及⽓相摩尔率差表⽰的传质推动⼒。
化工原理吸收知识点页PPT文档

K PK
y
G
K mK
x
y
Kx C0KL
KL HKG
3. 相界面浓度的确定与相际传质速率分析
① 相界面浓度的确定
②相际传质速率分析
● 气相阻力控制----易溶气体 KG kG
● 液膜阻力控制 ----难溶气体 KL kL
● 双膜阻力联合控制,两者均不可忽略
4. 低浓度气体吸收
同理: NOL A1 1ln 11 Ay y1 2 m m2 2x x1 A
式中
A L mG
由上两式可得:
NOGANOL
可见
NO
Gf(A, yy12
m2x) m2x
◆ A一定时
1
e1
1
x2xe2x2
● 吸收因子法:
若平衡关系为直线时, ymxb
NO
G
y1
dy
y2 (ymxb)
依物料衡算 :
xx2 G L(yy2 )
代入以上方程并整理得:
A=1时 A≠1时
NOG
y1 y2 y2 mx2
NOG111ln11 Ayy12 m m22xx1 A A
d(y) 常数 dy
d(y)y1 y2
dy
y1 y2
y1y1ye1
yyy
2
2
e2
△y1
△y2
y1
y2
dy y1y2 d(y) y1 y2
N y1 dy
OG y2 ( y y ) e
y1 dy yy y1 d( y)
y2
N x1 dx
L x2 ( xi x)
1 1m
陈敏恒 化工原理 第八章(吸收)1

解:(1) m
E p
1 .2
1 .2
y
0 .08
x x e x 0.0147
(3)达到极限时气体浓度最低为
y min y e 0.006
8.3 扩散和单向传质 一、相际传质过程 (1)溶质由气体主体扩 散至两相界面 (2)溶质在界面上溶解
y i f ( xi )
N 0
N A J A D
定态时 :
dc A dz
NA C D D p A1 p A 2 N A c A1 c A 2 RT nA pA ( 理想气体 c A ) V RT
(2)单向扩散 NB 0
cA dc A N A 1 D dz cM D cM D p c A1 c A 2 p A1 p A 2 NA c BM RT p BM
8.2.2 相平衡与吸收关系 一、判断过程的方向
y ye 或 x xe
吸收
y ye 或 x xe
解吸
二、指明过程的极限 吸收过程的极限为平衡状态.即 y y e 或 x x e
x1 max x1e
y1 m
y 2 min y 2 e mx 2
三、计算过程推动力 过程推动力为实际状态与平衡状态的偏离程度
cM c A cB c Ai cBi C
c A c Ai 必有 cB cBi
A, B 反向扩散
(1)等分子反向扩散 当液相能以同一速率向界面供应组分 B 时, c Bi 保持恒定: J A J B 或 J A J B 0 通过截面 PQ 的净物量为零. (2)单向扩散 当液相不能向界面提供组分 B 时,发生的是 组分 A 的单向扩散。例如:吸收 在单向扩散中将产生主体流动 扩散流:分子微观运动的宏观结果,纯组分 主体流动:宏观运动,同时带有组分 A 和 B 注意:在单向扩散中依然存在 J A J B
化工原理第八章 气体吸收

平衡关系与上式联立可求解界面浓度 xi 与 yi 。在用作图
3
三、工业吸收过程
工业的吸收过程常在吸收塔中进行。生产中除少部分直 接获得液体产品的吸收操作外,一般的吸收过程都要求 对吸收后的溶剂进行再生,即在另一称之为解析他的设 备中进行于吸收相反的操作-解吸。因此,一个完整地 吸收分离过程一般包括吸收和解吸两部分。
2024/3/25
4
8.2 吸收过程相平衡基础
对于单组分物理吸收,组分数c=3(溶质A、惰性 气体B、溶剂S),相数(气、液),自由度数F应为
F c23223
即在温度、总压和气、液组成共四个变量中,有三个是 自变量,另一个是它们的函数。
2024/3/25
6
在一定的操作温度和压力下,溶质在液相中的溶解 度由其相中的组成决定。在总压不很高的情况下,可以 认为气体在液体中的溶解度只取决于该气体的分压pA , 而与总压无关。于是,cA*与 pA 得函数关系可写成
ky P kG
Ky m Kx KG HKL
13
二、界面浓度的求取
当m随浓度变化时,用分传质速率方程式计算更加方 便,界面浓度 xi 与 yi 存在关系有:
(1)有双膜模型理论,yi 与 xi 在平衡线上。如果平衡线以
y f (x) 表示,则 yi 。 f (xi )
(2)可导出
y yi kx x xi ky
2024/3/25
12
不同的推动力所对应的不同传质系数和速率方程。
浓度组成表示法
表8—1 传质速率方程的各种形式
摩尔分率
物质得量浓度或分压
传质速率方程 总传质系数
2024/3/25
N A ky ( y yi ) kx (xi x) ky (y y*) kx (x* x)
化工原理吸收

说明:1、 p*、x 、E(亨利系数,压强单位 )
推导:1m3:
2、适用于 t 一定,理想溶液。E为该 t 下纯溶质p°;
溶质[kmol/m3]
3、用于难溶、较难溶气体(或易溶稀溶液);
溶剂
4、难溶气体,E为常数;
则
5、E由实验测定,查手册(P78); 6、E=f (T),T E (即T CA* ),
等分子反向扩散:NA=JA 单向扩散: NA=JA+总体流动 2、NA计算式 N-总体流动的通量,[A、B总物质量/m2.s]; 其中,A、B的通量各为:
若扩散在气相:
积分:
z
0
解得:
则:
pB2 pB1
故
式中:
1、2两截面上物质B分压的对数平均值,kpa。
-漂流因数,无因次。
说明:①与(2-16)比较,多P/PBm , ②pA (pB )
(3)kG~ky关系 P总压不高时, p=Py 及pi=Pyi
ky= PkG (2-35)
2、液膜吸收速率方程式
yi-溶质A在相界面处的摩尔分率。
ky-气膜吸收系数 [kmol/(m2.s)] 1/ky为气膜阻力, * 1/ky与(y-yi)相对应。
令
(1)
kL—液膜吸收系数,kmol/(m2.s.kmol/m3)或m/s。
5、 小结 1、两类吸收速率方程式
膜系数相对应的速率式 总系数相对应的速率式
膜吸收速率方程式 总吸收速率方程式
方程式
吸收系数
推动力
膜系数:kG[kmol/(m2.s.kpa)] kL[kmol/(m2.s.kmol/m3)或m/s。]
ky [kmol/(m2.s)] Kx[kmol/(m2.s)]
化工原理 吸收过程的传质速率
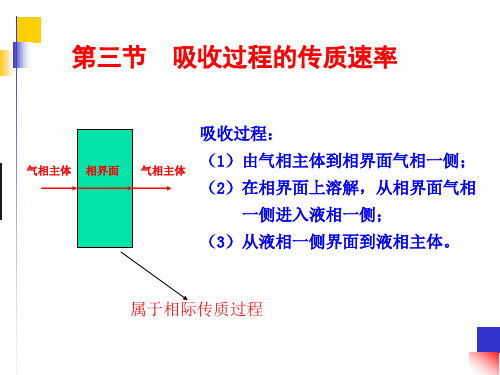
(2)溶质的溶解度很小
1 KX
1 kX
1 mkY
溶质的溶解度 很小,m很大
K X kX
传质阻力集中于液膜中,称为液膜阻力控制或液膜控制 (liquid-film control)
Y
Yi
O
提高传质速率的措施: I 1.提高液体流速;
Y*
液膜推动力
2.加强液相湍流程度。
X
Xi X*
液相总推动力
液相侧:
PV nRT c p RT , cA Dc zcBm pA RT , cBm pBm RT
NA
cBm
(cA1 cA2 )
cB2 cB1 cB2 ln cB1
p pBm
——漂流因子或移动因子(drift factor)
漂流因数意义:
其大小反映了总体流动对传质速率的影响程度,其值 为总体流动的传质速率较单纯分子扩散速率的倍数。
气 相 主 体
B扩散
JB A扩散
pA2
N AM N BM
pA pB
0
JA
Z
图 单向扩散
Z
NAM、NBM—整体移动中组分A、B的传递速 率,kmol/(m2·s); pA、pB—组分A、B的分压力,kPa。
气相侧:
z
0
N A dZ Dp RTZ ln
pA2
Dp
dp A Dp RTZ pB 2 p B1
JA
DAB dpA RT dZ
JB
DBA dpB RT dZ
总压一定
p p A pB 常数
dp dZ dpA dZ dpB dZ 0
因为:JA=-JB
化工原理下册气体吸收
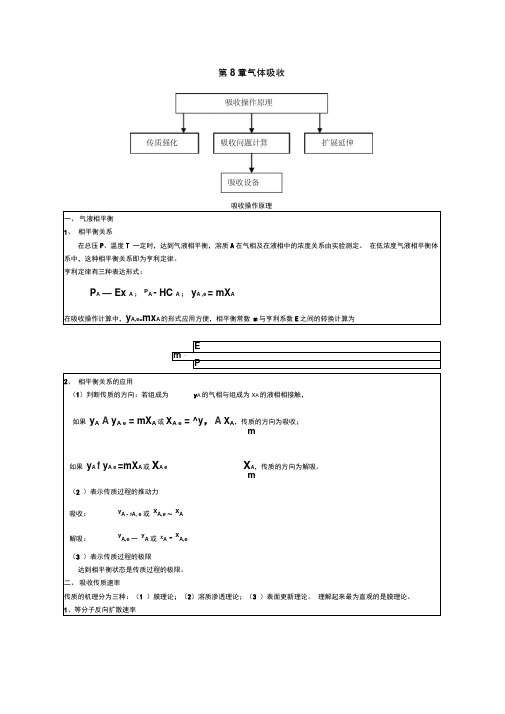
第8章气体吸收dC A dz因为C MD C B2 C M D C A1 —A2N Aln ——CB1 5 C B 2 —'C B1DC :m CA1C A2lnDPln P B2 RT P BIRT P BmP AI -P A2液膜中的传质速率 NA = kx ( X A,iX A)或NA = k l (C A,i - CA )111式中,KxFK y ,K x'x k y m11m------- = ----------------- "T -------------K ykyk xD C Al — C A2D AB ---------- 7 ----------O2、单向扩散和主体流动(分子扩散 +同方向上缓慢的总体流动)速率引起缓慢的总体流动的原因:溶质A 不断在气液相界面上发生溶解,自气相中消失,使得气液相界面附近的气相中产生空穴位,因此,引起缓慢的总体流动来补充所产生的空穴位。
如果是在气相中的传质,组分的浓度可以用分压表示,则3、对流传质 集总参数法表示传质速率气膜中的传质速率N A 二 k y (y A -y A,i )或 N A 二 k G (P A - P A,i )式中,k y =Pk G ,k x = Pk l 包括气膜和液膜的总传质速率N A =K y (y A - y A,e )或 N A = K x (X A,e - X A )解吸操作,包括气膜和液膜的总传质速率N A 二 K y (y A,e 一 Y A )或 N A 二 K X (X A - X A,e )4、传质控制如果m1 ————,则 K y k y ,传质过程为气膜阻力控制,k xk yNM - Nnet,ACB2CB1如果1 1- ,则K x k x,传质过程为液膜阻力控制。
mk y k x塔内任一横截面上气相组成 y 与液相组成x 之间的关系式,即操作线方程式:L八 G xy2- X 2L 和填料层高度H 。
(化工原理)第8章气体吸收

(1)相平衡关系
在总压不高时(p小于 0.51MPa ),溶质在稀溶液中的溶解 曲线通过原点,且为直线, 可表示为:
pe Ex
说明:
E—享利常数,kPa
a)若液相为理想溶液,则在全部浓度范围内,上式均成立。 此时,亨利定律与拉乌尔定律一致,E=p0。
b)不同气体: E 大,难 溶; E 小,易溶。
简化假定:
T=const
① 气、液两相摩尔流率恒定 ( qnG=qnL=const );
② 等温吸收;
③ 传质系数不变。
q nG
q nL
8.2.2 低浓度气体吸收的数学描述
物料衡算 热量衡算 相平衡 化学平衡(化学吸收)
对于低浓度物理吸收过程
稀溶液的气液相平衡
VAPOR MOLEFRAC BENZE-01
对于稀溶液: Yeye, Xx
则:
m = m*
(2)相际传质速率方程
板式塔—逐级接触式设备; 传质设备
填料塔—微分接触式设备。
板式塔
填料塔
NAkyyyi
N Akxxix
N A K yyye
1 1m Ky ky kx
N AK xxex
1 11
Kx mky kx
(3)吸收过程的物料衡算
物料衡算
净化气 贫液
混合气体
去解吸
富液
部分溶剂循环流程
8.1.4 对吸收剂的基本要求
(1)吸收剂的选择原则
◇ 对溶质的溶解度要大;
◇ 对溶质有较高的选择性;
◇ 不易挥发;
◇ 解吸性能好,便于再生;溶解度对温度变化敏感;
◇ 较低的粘度,不易起泡;
◇ 良好的化学稳定性、热稳定性、无毒、无易燃易爆等;
化工原理-第八章-吸收

化工原理-第八章-吸收一、填空题1、用气相浓度△y为推动力的传质速率方程有两种,以传质分系数表达的速率方程为____________________,以传质总系数表达的速率方程为___________________________。
N A = k y (y-y i) N A = K y (y-y e)2、吸收速度取决于_______________,因此,要提高气-液两流体相对运动速率,可以_______________来增大吸收速率。
双膜的扩散速率减少气膜、液膜厚度3、由于吸收过程气相中的溶质分压总_________ 液相中溶质的平衡分压,所以吸收操作线总是在平衡线的_________。
增加吸收剂用量,操作线的斜率_________,则操作线向_________平衡线的方向偏移,吸收过程推动力(y-y e)_________。
大于上方增大远离增大4、用清水吸收空气与A的混合气中的溶质A,物系的相平衡常数m=2,入塔气体浓度y = 0.06,要求出塔气体浓度y2 = 0.006,则最小液气比为_________。
1.805、在气体流量,气相进出口组成和液相进口组成不变时,若减少吸收剂用量,则传质推动力将_________,操作线将_________平衡线。
减少靠近6、某气体用水吸收时,在一定浓度范围内,其气液平衡线和操作线均为直线,其平衡线的斜率可用_________常数表示,而操作线的斜率可用_________表示。
相平衡液气比7、对一定操作条件下的填料吸收塔,如将塔料层增高一些,则塔的H OG将_________,N OG将_________ (增加,减少,不变)。
不变增加8、吸收剂用量增加,操作线斜率_________,吸收推动力_________。
(增大,减小,不变)增大增大9、计算吸收塔的填料层高度,必须运用如下三个方面的知识关联计算:_________、_________、_________。
化工原理课后作业(吸收)

6.吸收一、单选题1.用纯溶剂吸收混合气中的溶质。
逆流操作,平衡关系满足亨利定律。
当入塔气体浓度y1上升,而其它入塔条件不变,则气体出塔浓度y2和吸收率ϕ的变化为:()。
C(A)y2上升,ϕ下降(B)y2下降,ϕ上升(C)y2上升,ϕ不变(D)y2上升,ϕ变化不确定2.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则气相总传质单元数()。
BA 增加 B减少 C不变 D不定3.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则出口气体组成将()。
AA 增加 B减少 C不变 D不定4.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则出口液体组成()。
AA 增加 B减少 C不变 D不定5.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相总传质单元数将()。
CA 增加 B减少 C不变 D不定6.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相总传质单元高度将()。
CA 增加 B减少 C不变 D不定7.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相出口组成将()。
AA 增加 B减少 C不变 D不定8.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则液相出口组成将()。
AA 增加 B减少 C不变 D不定9.正常操作下的逆流吸收塔,若因某种原因使液体量减少以至液气比小于原定的最小液气比时,下列哪些情况将发生? C(A)出塔液体浓度增加,回收率增加(B)出塔气体浓度增加,但出塔液体浓度不变(C)出塔气体浓度与出塔液体浓度均增加(D)在塔下部将发生解吸现象10.最大吸收率与()无关。
DA 液气比 B液体入塔浓度 C相平衡常数 D吸收塔型式11.逆流填料吸收塔,当吸收因数A<1且填料为无穷高时,气液两相将在()达到平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
姓名:;学号:;班级:
第8章吸收(传质速率方程)
一、填空题:
1. 化工生产中吸收可应用在1、______,2、_______
___,3、_____。
2. 吸收质是指________;而吸收剂则是指_______
____;惰性组分是指____________________。
3. 图所示为同一温度下A.B.C三种气体在水中的溶解度曲线。
由图可知,它们溶解度大小的次序是______;同一平衡分压下,它们的液相平衡浓度大小顺序是________________。
4. 对接近常压的低浓度溶质的气液平衡系统,当总压增加时,亨利系数E____,相平衡常数m____,溶解度系数H____。
5. 吸收中, 温度不变,压力增大,可使相平衡常数_______ (增大, 减小,不变),传质推动力_____(增大,减小,不变)
6.实验室用水逆流吸收空气中的CO2,当水量和空气量一定时,增加CO2,则入塔气体浓度________,出塔气体浓度______,出塔液体浓度________. 2.吸收总推动力用气相浓度差表示时,应等于__________________和______________________________之差。
7. 当平衡线为直线时,总传质系数与分传质系数之间的关系可以表示为
y x y 1
1k k m K +
=,x k m 表示_____,当_______项可忽略时,表示该吸收过程为气膜控制。
8.
对于难溶气体,吸收时属于______控制的吸收,强化吸收的手段是_______________________。
二、计算题
1.某系统温度为10℃,总压101.3kPa ,试求此条件下在与空气充分接触后的水中,每立方米水溶解了多少克氧气?(10℃时,氧气在水中的亨利系数E 为3.31×106kPa 。
)
2.在总压101.3kPa ,温度30℃的条件下, SO 2摩尔分率为0.3的混合气体与SO 2摩尔分率为0.01的水溶液相接触,试问:
从液相分析SO 2的传质方向;
从气相分析,其它条件不变,温度降到0℃时SO 2的传质方向;
其它条件不变,从气相分析,总压提高到202.6kPa 时SO 2的传质方向,并计算以液相摩尔分率差及气相摩尔率差表示的传质推动力。
3.在温度为20℃、总压为101.3kPa 的条件下,CO 2与空气混合气缓慢地沿着Na 2CO 3溶液液面流过,空气不溶于Na 2CO 3溶液。
CO 2透过1mm 厚的静止空气层扩散到Na 2CO 3溶液中,混合气体中CO 2的摩尔分率为0.2,CO 2到达Na 2CO 3溶液液面上立即被吸收,故相界面上CO 2的浓度可忽略不计。
已知温度20℃时,CO 2在空气中的扩散系数为0.18cm 2/s 。
试求CO 2的传质速率为多少?
4.在总压为100kPa 、温度为30℃时,用清水吸收混合气体中的氨,气相传质系数G k =3.84×10-6 kmol/(m 2·s ·kPa ),液相传质系数L k =1.83×10-4 m/s ,假设此操作条件下的平衡关系服从亨利定律,测得液相溶质摩尔分率为0.05,其气相平衡分压为6.7kPa 。
求当塔内某截面上气、液组成分别为y =0.05,x =0.01时
以*
A A p p -、A *A
c c -表示的传质总推动力及相应的传质速率、总传质系数; 分析该过程的控制因素。
一、填空题:
1. 制取液体产品, 回收和分离有用组分, 净化气体。
2. 被液体吸收的组分,用于吸收的液体,不被吸收剂吸收的组分。
3. C >B >A ; 在同一平衡分压下液相平衡浓度A >B >C
4. 不变; 减少; 不变
5. 减小 增大 6 1.增加; 增加; 增加
2.气相主体摩尔浓度; 同液相主体浓度相平衡的气相浓度 7. 液膜阻力, 气膜阻力 ,x k m
8. 液膜、 增大液相侧的传质分系数或液流湍动程度。
二、计算题
1.解:空气按理想气体处理,由道尔顿分压定律可知,氧气在气相中的分压为:
py p =*A =101.3×0.21=21.27kPa
∴ S
A
S *
A
EM p c ρ=
故 =⨯⨯⨯=18
1031.327
.2110006
*A
c 3.57×10-4kmol/m 3
m A =3.57×10-4×32×1000=11.42g/m 3
2.解:(1)查得在总压101.3kPa ,温度30℃条件下SO 2在水中的亨利系数
E =4850kPa
所以 ==
p
E m =3.1014850
47.88 从液相分析00627.088
.473.0*
===
m y x
< x =0.01 故SO 2必然从液相转移到气相,进行解吸过程。
(2)查得在总压101.3kPa ,温度0℃的条件下,SO 2在水中的亨利系数E =1670kPa
==
p E m 3
.1011670
=16.49 从气相分析y *=mx=16.49×0.01=0.16<y=0.3 故SO 2必然从气相转移到液相,进行吸收过程。
(3)在总压202.6kPa ,温度30℃条件下,SO 2在水中的亨利系数E =4850kPa
==
p E m 6
.2024850 =23.94 从气相分析
y *=mx=23.94×0.01=0.24<y=0.3
故SO 2必然从气相转移到液相,进行吸收过程。
0125.094
.233.0*===
m y x 以液相摩尔分数表示的吸收推动力为:
∆x=x *-x =0.0125-0.01=0.0025
以气相摩尔分数表示的吸收推动力为:
∆y= y - y *=0.3-0.24=0.06
3.解 : CO 2通过静止空气层扩散到Na 2CO 3溶液液面属单向扩散,可用式(5-42)计算。
已知:CO 2在空气中的扩散系数D =0.18cm 2/s=1.8×10-5m 2/s 扩散距离z =1mm=0.001m , 气相总压p =101.3kPa 气相主体中溶质CO 2的分压
p A1=py A1=101.3×0.2=20.27kPa 气液界面上CO 2的分压p A2=0
所以,气相主体中空气(惰性组分)的分压
p B1=p -p A1=101.3-20.27=81.06kPa 气液界面上的空气(惰性组分)的分压
p B2=p -p A2=101.3-0=101.3kPa
空气在气相主体和界面上分压的对数平均值为:
B1
B2
B1B2Bm ln
p p p p p -=
=
kPa 8.9006.813.101ln 06
.813.101=- )(A2A1Bm
A p p RTzp Dp
N -==
)027.20(8.903.101001.0293314.8108.15-⋅⋅⨯⨯⨯- =1.67×10-4kmol/(m 2·s)
4.解:(1)根据亨利定律kPa 13405
07
6A ==
=..x p E * 相平衡常数34.1100
134
===
p E m 溶解度常数4146.018
1341000
s
s
=⨯=
=
EM H ρ
*
A
A p p -=100×0.05-134×0.01=3.66kPa G L G 1
11k Hk K +==253797240617131801086.3110
83.14146.0164=+=⨯+⨯⨯-- 6G 1094.3-⨯=K kmol/(m 2·s ·kPa )
)(*
A A G A p p K N -==3.94×10-6×3.66=1.44×10-5 kmol/(m 2·s )
56.01000
/1899.001
.0A =⨯=
c kmol/m 3
A *A c c -=0.4146×100×0.05-0.56=1.513 kmol/m 3
m/s 105.94146
.01094.366G L --⨯=⨯==H K K
)(A *
A L A c c K N -==9.5×10-6×1.513=1.438×10-5 kmol/(m 2·s )。
