乙烯物理性质
乙烯

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。
乙烯的结构与性质

燃料添加剂:乙烯 也可用作燃料添加 剂,以提高燃料的 燃烧性能和减少污
染排放
其他用途:除了上 述用途外,乙烯还 可用于合成树脂、 纤维、涂料等材料, 以及作为工业气体 用于金属加工等领
域
PART 5
总结
乙烯是一种重要的有机化合 物,具有独特的结构和性质, 因此在多个领域具有广泛的 应用价值
x
以下是一些乙烯的主要用途
化工原料:乙烯是 一种重要的化工原 料,可用于合成各 种有机化合物,如 聚乙烯、乙丙橡胶、
环氧乙烷等
农业化学品:乙烯在 农业上可用于促进果 实成熟和开花,以及 作为植物生长调节剂。 此外,乙烯还可用于 制造农药和除草剂等
农业化学品
医药原料:乙烯及 其衍生物在医药领 域也有广泛应用, 如用于合成抗生素、 避孕药、镇痛药等
02
在生产过程中,乙烯需要通过一系列的分离和提纯步骤,以
去除杂质并获得高纯度的产品。常用的分离和提纯方法包括
压缩、冷凝、精馏和吸附等
PART 7
乙烯的储存和运输
1
由于乙烯易燃、易爆、有 毒,因此需要采取特殊的
储存和运输措施
2
在储存方面,乙烯通常储 存在金属罐或球罐中,并 需要保持低温、干燥、通
风良好
例如,采用先进的清洁生产技术和设备,减少废气和废水的排放;对固体废弃物进行回收 再利用,提高资源利用率;加强企业的环保管理和监管,确保废弃物得到妥善处理
此外,为了满足消费者对环保产品的需求,乙烯的下游产品也需要向环保、低碳、节能等方向 发展。例如,开发高强度、高韧性的聚乙烯材料,减少对环境的污染;开发环保型涂料、粘合 剂等化工产品,减少对人体的危害
3
在运输方面,乙烯需要使 用专用的管道或车辆进行 运输,并需要严格控制温
21 乙烯
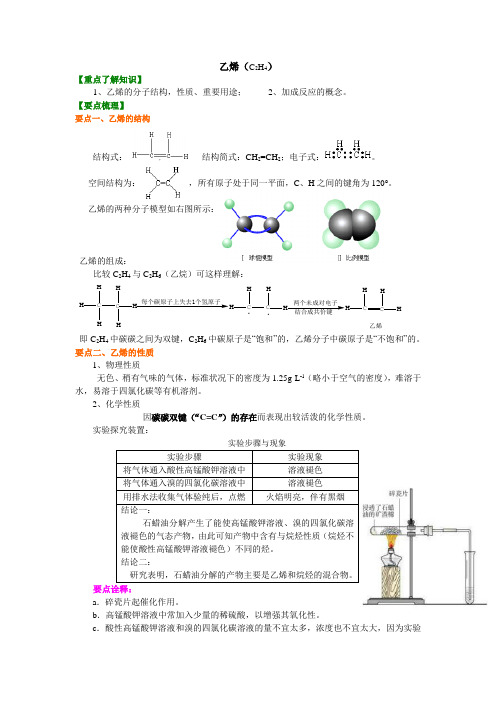
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。
乙烯的性质和用途

3% 1% 5% 7% 13%
57% 14%
返回
1、乙烯的原料来源
10多年前世界有25%~35%的乙烯是以乙烷为原料。 目 前,世界约有55%以上的乙烯是以石脑油为原料裂解装 置生产的(见表) 原料和 国家
乙烷 46.3 4.7
柴油 18.7 11.0 53.1
丙烷 17.8 5.9 7.2
石脑油 15.1 70 94.1 24.0
(3)甲醇制低碳烯烃生产技术 )
本技术是以合成气为原料的甲醇制低碳烯烃 生产技术作为 C1化工的开发热点之一,有望 乙烯或者丙烯的新来源我国拥有丰富的煤炭 资源,加强对煤炭经甲醇制烯烃的技术的研 究,不仅可提高我国甲醇生产装置的经济效 益,还可缓解丙烯供应紧张的矛盾。
返回
1、国外乙烯生产状况
世界各地区乙烯工业的发展仍保持不均匀的态势, 发达国家的和地区的乙烯生产能力增加较少,而 欧洲的态势分别依托市场优势和廉价原料优势, 成为乙烯投资的热点地区,因此世界乙烯工艺的 重心正在加速向亚洲和中东地区转移。早在2008 年国际金融危机爆发之际,中东就不断新建实话 产能。预计2015年,中东乙烯产能将占全球乙烯 产能的15%,,届时全球90%的乙烯衍生物和 70%的丙烯衍生物净出口来自中东。
Pt , Pb或 Ni
@
乙烯能被氧气直接氧化, 乙烯能被氧气直接氧化,也能被其它氧化剂氧 化。
2H2C = CH2 + O2 2H2C →
Al2O3 503~523K
CH2 O
@
乙烯水合法生产乙醇,反应式如下
553~ 573 K
H 2 C − CH 2 + H 2 O C 2 H 5 OH →
我国乙烯主要生产厂家的生产能力
乙烯的结构和性质课件

乙烯的物理性质
乙烯的物理状态
无色气体
乙烯在常温常压下为无色气体,具有特殊的甜味。
易燃
乙烯是一种易燃气体,遇到明火或高温容易发生燃烧。
乙烯的熔点、沸点和密度
熔点低
乙烯的熔点非常低,容易在低温 下由气态转变为液态。
沸点低
乙烯的沸点也相对较低,因此在常 温下容易挥发成气态。
密度小
乙烯的密度比空气稍小,所以在空 气中容易上升扩散。
与其他化合物的结构比较
与乙烷比较:乙烯比乙烷少两个 氢原子,多一个碳-碳双键,因 此乙烯的化学反应活性更高。
与乙炔比较:乙烯和乙炔都含有 碳-碳不饱和键,但乙烯是双键, 乙炔是三键,因此乙炔的化学反
应活性更高。
这些结构特点使得乙烯具有独特 的物理和化学性质,在生活和工
业生产中具有广泛的应用。
03
与氢的加成
在适当条件下,乙烯能够与氢发 生加成反应,生成乙烷。
与水的加成
乙烯能够与水在酸催化下发生加 成反应,生成乙醇。
乙烯的氧化反应
燃烧反应
乙烯能够完全燃烧生成二氧化碳和水。
环氧乙烷的形成
在特定条件下,乙烯可以与氧气发生环氧化反应, 生成环氧乙烷。
醇和醛的形成
乙烯可以通过氧化剂(如高锰酸钾、硝酸)氧化 成乙醛,进一步氧化成乙酸。
结构特点
乙烯分子中的两个碳原子 通过双键连接,每个碳原 子再与两个氢原子通过单 键连接。
空间构型
平面构型,由于双键的存 在,乙烯分子呈现出平面 形态。
乙烯的电子云分布和化学键
电子云分布
在乙烯分子中,电子云主要分布在双 键和单键周围,形成离域π键。
化学 键
双键由一个σ键和一个π键组成,σ键 是由两个碳原子的原子轨道头碰头重 叠形成,π键则是由两个碳原子的p轨 道肩并肩重叠形成。
乙烯的性质和用途

结构与组成
乙烯分子式为C2H4,结构式为CH2=CH2。 乙烯分子中还有两个氢原子,这两个氢原子是等价的。
乙烯分子中有一个碳碳双键,这个双键是乙烯分子中唯 一的双键。
乙烯分子中没有孤电子对,因此它是非极性分子。
02
乙烯的制备与生产
天然气裂解制乙烯
01
02
03
04
原料
主要使用天然气,包括甲烷、 乙烷和丙烷等。
04
乙烯的危害与防护
健康危害
急性毒性
刺激性
乙烯是一种无色易燃气体,低浓度时无毒 性,但在高浓度时会对呼吸中枢产生麻醉 作用。
乙烯对眼和呼吸道有刺激作用,可引起流 泪、咽痛、咳嗽等症状。
致敏性
致突变性
部分人群可对乙烯产生过敏反应,如哮喘 发作、皮肤瘙痒等。
乙烯在一定浓度下可引起基因突变,对生 殖系统存在潜在影响。
乙烯的新用途开发
要点一
Байду номын сангаас总结词
随着技术的不断发展,乙烯的新用途将会不断被发现和开 发。
要点二
详细描述
乙烯是一种重要的有机化工原料,其用途非常广泛。然而 ,随着技术的不断发展,乙烯的新用途也将会不断被发现 和开发。例如,乙烯可以用于生产功能性的高分子材料、 特种化学品、液晶材料等;还可以用于生物医学领域,如 制备药物载体、生物可降解材料等。这些新用途的开发将 为乙烯的应用领域带来更加广泛的发展空间。
农业化学制品
乙烯利
一种植物生长调节剂,可促进果实成 熟和植物生长发育,广泛应用于农业 生产。
环氧乙烷
一种杀菌剂,可用于防治水稻纹枯病 等农作物病害。
工业气体
作为反应物参与化工反应
乙烯在许多化工反应中作为反应物参与反应,如制备乙醇、 丙酮等。
乙烯物理化学性质归纳

甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质可作为电视、雷达等的高频绝缘材料。
2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质中文名称聚丙烯英文名称polypropylene ,简称PPCAS号9003-07-0俗称百折胶分子式[C3H6]n 结构简式溶解性不溶于常见的酸、碱有机溶剂外观和性状无毒、无臭、无味的乳白色高结晶的聚合物2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
区分乙烯和乙烷的方法

区分乙烯和乙烷的方法乙烯(C2H4)和乙烷(C2H6)是两种常见的碳氢化合物,它们在化学性质和物理性质上有着显著的差异。
本文将介绍几种常用的方法来区分乙烯和乙烷。
1. 物理性质1.1 沸点乙烯和乙烷的沸点有较大的差异。
乙烷的沸点为-88.6°C,而乙烯的沸点为-103.7°C。
因此,通过测量样品的沸点,可以初步判断乙烷和乙烯的区别。
1.2 密度乙烯和乙烷的密度也有所不同。
乙烷的密度为0.57 g/cm³,而乙烯的密度为0.88 g/cm³。
因此,通过测量样品的密度,可以进一步区分乙烷和乙烯。
2. 化学性质2.1 燃烧性质乙烯和乙烷的燃烧性质也不同。
乙烯在空气中燃烧时会产生明亮的火焰,并且火焰是蓝色的。
而乙烷在空气中燃烧时也会产生火焰,但火焰是黄色的。
通过观察样品燃烧时的火焰颜色,可以初步判断乙烷和乙烯的区别。
2.2 反应性乙烯和乙烷的反应性也不同。
乙烯是一种较为活泼的烯烃,可以参与许多加成反应、聚合反应和氧化反应。
而乙烷由于其分子结构的饱和性,反应性较低。
通过对样品进行一系列的化学反应,可以进一步区分乙烷和乙烯。
3. 实验方法3.1 沸点测定法通过使用沸点测定仪器,可以测定样品的沸点。
首先,将待测样品装入沸点测定仪器中,加热样品并观察其沸腾点。
如果样品的沸点为-88.6°C,则可以初步判断为乙烷;如果样品的沸点为-103.7°C,则可以初步判断为乙烯。
3.2 密度测定法通过使用密度计或比重计,可以测定样品的密度。
首先,将待测样品放入密度计中,读取密度计的示数。
如果样品的密度为0.57 g/cm³,则可以初步判断为乙烷;如果样品的密度为0.88 g/cm³,则可以初步判断为乙烯。
3.3 燃烧实验通过将待测样品点燃,并观察其燃烧时的火焰颜色,可以初步判断样品的化学性质。
如果样品燃烧时火焰为蓝色,则可以初步判断为乙烯;如果样品燃烧时火焰为黄色,则可以初步判断为乙烷。
乙烯知识点归纳总结

乙烯知识点归纳总结一、乙烯的分子结构乙烯是一种无色、易燃、具有强烈气味的有机化合物,分子式为C2H4。
其结构式为H2C=CH2,乙烯分子是由两个碳原子和四个氢原子组成的,其中碳原子以双键连接,这是乙烯最重要的结构特征。
二、乙烯的物理性质乙烯是一种透明、无味的气体,具有强烈的刺激性。
其密度为0.925g/L,比空气轻。
在标准压力下,乙烯的沸点为-103.7℃,熔点为-100.6℃。
乙烯的溶解性较好,可以溶解在有机溶剂中。
三、乙烯的化学性质1、氧化反应:乙烯与氧气反应,生成环氧乙烷和水。
2、加成反应:乙烯与氢气反应,生成乙烷;与卤素单质反应,生成卤代烷;与水反应,生成乙醇。
3、聚合反应:乙烯在一定条件下可以聚合成高分子化合物。
4、裂解反应:在热和催化剂的作用下,乙烯发生裂解反应,生成小分子烯烃。
四、乙烯的制备主要通过石油裂解和天然气转化两种方法制备乙烯。
石油裂解是将石油中的长链烃断裂成乙烯的过程;天然气转化是将天然气转化为合成气,再进一步转化为乙烯的过程。
五、乙烯的应用1、制造聚合物:乙烯在聚合反应中生成高分子化合物,广泛用于制造塑料、纤维、橡胶等产品。
2、制造有机溶剂:乙烯与水反应生成乙醇,乙醇是一种良好的有机溶剂,可用于制造涂料、油漆等产品。
3、农业用途:乙烯是一种植物生长调节剂,可以促进植物生长和开花。
4、其他用途:乙烯还可用于制造乙醛、乙基胺等化学物质,以及用作制冷剂等。
六、乙烯的安全措施由于乙烯易燃、易爆,因此在处理和储存时应采取以下安全措施:1、储存于阴凉、通风的库房中,远离火源和热源。
2、避免与氧化剂、酸类物质混存。
3、使用防爆电气设备,并定期检查电线绝缘层是否完好。
4、使用前必须对设备进行彻底清洗和干燥,避免产生静电火花。
因式分解知识点归纳总结因式分解是数学中的一种重要技巧,它可以帮助我们简化计算,解决实际问题,并且还在数学竞赛中占有重要的地位。
因式分解就是把一个多项式分解为几个整式乘积的形式,它是一种重要的数学思维方法。
乙烯的性质

小结:
1.乙烯的用途; 2.乙烯的制取:①石蜡油的分解 ②实验室制法. 3.乙烯的结构:碳碳双键的平面结构;键角1200 4.乙烯的性质: ①物理性质:无色稍有气味的气体,难溶于水 在标准状况下的密度为1.25g/L ②化学性质活泼
第三章 有机化合物
第二节
来自石油的两种基本化工原料
三、乙烯(C2H4)的分子结构
电子式
H H · × ×· · H· × C∷C×H
结构式
H H ∣ ∣ H—C C—H
结构简式 CH2=CH2
平面结构 乙烯的空间结构:
任何键之间的键角均为:1200
分 子 式
结构式
乙烷 C2H6
乙烯 C2H4
碳碳键型
练习:
在一定条件下,乙烷和乙烯都能制备氯 乙烷CH3CH2Cl。试回答: 1.乙烷制氯乙烷的化学方程式是 光照 CH3CH3+ Cl2 CH3CH2Cl + HCl 取代反应 ___________________________________; 2.乙烯制备氯乙烷的化学方程式是
CH3-CH2Cl 加成反应 CH = CH + HCl △ 2 2 _______________________________;
乙烯与溴的反应
实验
通入溴的 四氯化碳 溶液,再 加入酸化 的AgNO3 溶液。
实验现象
实验结论
溴的四氯化碳溶 乙烯能与溴 液退色;加入酸 反应,但产 化的AgNO3溶液, 物中没有溴 无沉淀生成。
化氢.
乙烯分子内碳碳双键的键能 (615KJ/mol)小于碳碳单键键能 (348KJ/mol)的二倍,说明其中有 一条碳碳键键能小,容易断裂。
乙烯

(1)氧化反应:①常温下极易被氧化剂氧化。如将乙烯通入酸性KMnO4溶 液,溶液的紫色褪去,由此可用鉴别乙烯。②易燃烧,并放出热量,燃 烧时火焰明亮,并产生黑烟。CH2═CH2+3O2—2CO2+2H2O (2)加成反应: CH2═CH2+Br2CH2Br—CH2Br(常温下使溴水褪色)CH2═CH2+HClCH3— CH2Cl(制氯乙烷)CH2═CH2+HOHCH3CH2OH(制酒精)加成反应:有机物分 子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的 化合物的反应。 3)聚合反应: 聚乙烯 nCH2═CH2CH2—CH2n(制聚乙烯) 在一定条件下,乙烯分子 中不饱和的C═C双键中的一个键会断裂,分子里的碳原子能互相形成很 长的键且相对分子质量很大(几万到几十万)的化合物,叫做聚乙烯,它 是高分子化合物。 这种由相对分子质量较小的化合物(单体)相互结 合成相对分子质量很大的化合物的反应,叫做聚合反应。这种聚合反应 是由一种或多种不饱和化合物(单体)通过不饱和键相互加成而聚合成高 分子化合物的反应,所以又属于加成反应,简称加聚反应。
危险性 健康危害:具有较强的麻醉作用。急性中毒:吸入高浓度乙烯可立即引 起意识丧失,无明显的兴ห้องสมุดไป่ตู้期,但吸入新鲜空气后,可很快苏醒。对眼及呼吸道粘 膜有轻微刺激性。液态乙烯可致皮肤冻伤。慢性影响:长期接触,可引起头昏、全 身不适、乏力、思维不集中。个别人有胃肠道功能紊乱。环境危害:对环境有危害, 对水体、土壤和大气可造成污染。燃爆危险:本品易燃。空气中若含3.4%~34%的 乙烯,遇明火极易爆炸,爆炸程度比甲烷猛烈,所以点燃乙烯时要小心。 急救措施 皮肤接触:若有冻伤,就医治疗。眼睛接触:立即提起眼睑,用大量流 动清水或生理盐水彻底冲洗至少15分钟。就医。吸入:迅速脱离现场至空气新鲜处。 保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。 食入:饮足量温水,催吐。就医。 灭火方法:切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。喷水冷却容 器,可能的话将容器从火场移至空旷处。灭火剂:雾状水、泡沫、二氧化碳、干粉。 泄漏应急处理 应急处理:迅速撤离泄漏污染区人员至上风处,并进行隔离,严格 限制出入。切断火源。建议应急处理 人员戴自给正压式呼吸器,穿防静电工作服。 尽可能切断泄漏源。合理通风,加速扩散。喷雾状水稀释。如有可能,将漏出气用 排风机送至空旷地方或装设适当喷头 烧掉。漏气容器要妥善处理,修复、检验后再 用。
乙烯的知识点总结

乙烯的知识点总结乙烯的性质1. 物理性质(1)物理状态:乙烯在常温常压下是一种无色无味的气体,但可以在低温下被液化。
(2)密度:乙烯的密度为0.568 g/cm3。
(3)熔点和沸点:乙烯的熔点为-169.2°C,沸点为-103.7°C。
2. 化学性质(1)燃烧性:乙烯是易燃的气体,与空气中的氧气可以发生燃烧反应,产生二氧化碳和水。
(2)与氯化铝反应:乙烯可以与氯化铝发生加成反应,形成氯代乙烷。
(3)与溴反应:乙烯可以与溴发生加成反应,形成1,2-二溴乙烷。
(4)与硫酸反应:乙烯可以与浓硫酸发生加成反应,形成乙醇。
乙烯的制备1. 由乙烷脱氢制备:乙烯可以由乙烷在高温下经催化剂催化脱氢而得到。
2. 由煤制气制备:乙烯可以由煤制气产物中的一系列气体进行加工而得到。
3. 由炼油气中分离得到:炼油气中含有大量的乙烯,可以通过分离提纯而得到。
4. 由乙醇脱水得到:乙烯可以通过乙醇脱水而得到。
乙烯的应用1. 用于生产聚乙烯:乙烯是生产聚乙烯的重要原料,聚乙烯是一种常用的塑料,广泛用于包装、建筑、电子、机械等领域。
2. 用于生产聚氯乙烯:乙烯可以用于生产聚氯乙烯,聚氯乙烯是一种重要的合成材料,用于制作管道、日常用品、建筑材料等。
3. 用于生产乙烯醇:乙烯可以经过氧化反应得到乙烯醇,乙烯醇是一种重要的有机化工原料,用于制备乙二醇、醋酸乙烯酯等。
4. 用于生产聚丙烯:乙烯是生产聚丙烯的原料之一,聚丙烯是一种重要的合成材料,用于制作汽车零部件、纺织品、医疗器械等。
5. 用于生产聚对苯二甲酸乙二醇酯:乙烯可以用于生产聚对苯二甲酸乙二醇酯,这是一种重要的工程塑料,用于制作汽车零部件、电子产品外壳等。
乙烯的安全性1. 乙烯是一种有毒气体,吸入大量乙烯可引起中毒,严重者可危及生命。
2. 乙烯是一种易燃气体,遇到明火或热源极易发生爆炸,应储存和使用时严格遵守安全操作规程。
3. 乙烯对皮肤、眼睛和呼吸道有刺激性,接触后应及时用清水冲洗,并寻求医疗帮助。
乙烯熔沸点

乙烯熔沸点乙烯,也称为乙烯烷,是一种有机化合物,由两个碳原子和四个氢原子组成,为双键烯烃。
乙烯是在室温下无色有味的气体,有时也可以存在于液态或固态。
乙烯是非常重要的化工原料,在制造塑料、橡胶、溶剂、涂料、染料等方面广泛应用。
在本文中,我们将探讨乙烯的熔沸点及其相关信息。
乙烯的熔点和沸点是物质的重要性质,并且对于乙烯的应用也非常重要。
乙烯是双键烯烃,由于其分子结构不规则,因此乙烯的分子间相互作用较弱,在室温下只能以气态存在。
乙烯的熔点较低,为-169.4℃,沸点为-103.7℃。
乙烯熔点的测定可以通过差示扫描量热法或差示扫描量热分析法进行。
差示扫描量热法是一种通过比较样品和参照物质的热量差异来测定物质熔点的方法,常常用于测定高熔点化合物的熔点,如聚合物、合成晶体等。
差示扫描量热分析法是一种结合了差示扫描量热和热重分析的方法,可以同时测量乙烯的熔点和热重。
除了熔点和沸点,乙烯的物理性质还包括密度、黏度、表面张力等。
乙烯的密度较低,为0.972 g/cm³,黏度较小,表面张力较低。
这使得乙烯在工业生产中易于运输和加工。
乙烯的熔沸点是影响其应用的一个关键因素。
在制造塑料和橡胶方面,乙烯需要在高温、高压的环境下进行聚合反应。
在制造涂料、染料、溶剂等方面,乙烯需要在较低温度和压力下进行反应。
因此,对于不同的应用领域,乙烯的熔沸点有着不同的要求。
此外,乙烯的熔沸点还受到许多因素的影响,如环境温度、压力、杂质、化学结构等。
通过调节这些因素,可以调整乙烯的熔沸点,以满足特定的应用需求。
总之,乙烯的熔沸点是其重要的物理性质之一,影响着乙烯的应用。
通过测定和调节乙烯的熔沸点,可以获得适合不同应用领域的乙烯制品。
乙烯物理化学性质归纳

甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
乙烯相对密度

乙烯相对密度乙烯(C2H4)是一种无色、无臭的气体,也是一种重要的有机化合物。
它是最简单的不饱和烃,由两个碳原子和四个氢原子组成。
乙烯在化学行业中有广泛的应用,其中一个重要的性质就是它的相对密度。
相对密度是一个物质相对于水的密度比值。
乙烯在室温和常压下的相对密度约为0.97。
这意味着乙烯比水轻,因此乙烯可以漂浮在水上。
这也是我们在实验室中常见到的现象,当乙烯气体释放到水中时,它会形成气泡并浮起来。
乙烯的相对密度还与压力和温度密切相关。
通常情况下,当乙烯的压力升高或温度降低时,它的相对密度会增加。
这是因为压力会使分子更加紧密地排列在一起,温度的降低则使分子的运动减缓,从而增加了分子间的相互作用力,导致乙烯分子的相对密度增加。
乙烯的相对密度对于乙烯的生产和储存具有重要指导意义。
首先,了解乙烯的相对密度可以帮助我们设计乙烯的储存容器和管道系统。
由于乙烯比空气轻,因此在储存和输送过程中需要采取措施,确保乙烯不会漏出或与空气混合。
其次,相对密度的变化还可能影响乙烯的使用和应用。
在某些情况下,我们可能需要在不同的温度和压力条件下使用乙烯,因此需要了解不同条件下的相对密度,以确保乙烯的使用效果和安全性。
除了在化学工业中的应用外,乙烯的相对密度在科学研究和环境保护方面也具有重要意义。
例如,相对密度可以用来研究乙烯与其他气体或液体的混合物的行为,进而推断乙烯在环境中的传播和污染物的扩散情况。
此外,乙烯的相对密度也可以在垃圾处理领域应用,其中乙烯可以用作能源来源。
通过了解乙烯的相对密度,我们可以更好地控制乙烯的使用和释放,以降低环境污染和碳排放。
总之,乙烯的相对密度是一个重要的物理性质,对于乙烯的生产、储存、使用和环境保护都具有指导意义。
了解乙烯的相对密度可以帮助我们更好地管理和利用这一重要的有机化合物,促进可持续发展和环境保护。
乙烯
3、聚合反应: nCH2=CH2 催化剂 [ CH2—CH2 ] n
聚合反应:由相对分子质量小的小分子互
相结合成相对分子质量大的高分子的反应。 加聚反应:
加成聚合的简称
五、乙烯的用途
化工原料、 植物生长调节剂
第三节 乙烯 烯烃
一、乙烯的分子结构
二、乙烯的物理性质 三、乙烯的化学性质 四、乙烯的用途
加成反应:有机物分子中双键(或三键)两 端的碳原子与其它原子或原子团直接结合生 成新的化合物的反应。
此外乙烯还可以与水、氢气、卤素、卤化氢 等物质发生加成反应
CH2=CH2+Cl2→CH2Cl-CH2Cl
催化剂
→ CH2=CH2+H2O CH3-CH2-OH
催化剂
→ CH2=CH2+HCl CH3-CH2-Cl
思考题:实验是如何收集乙烯气体?
胛和犹如蚯蚓一样的翅膀,这巨怪瘦瘦的纯黑色悬胆般的胸脯闪着冷光,活似怪藤一样的屁股更让人猜想。这巨怪有着仿佛油条模样的腿和土黄色鹅掌 似的爪子……匀称的锅底色面条般的九条尾巴极为怪异,深绿色馄饨似的活塞浪云肚子有种野蛮的霸气。纯黑色虎尾一样的脚趾甲更为绝奇。这个巨怪 喘息时有种淡黄色金针菇般的气味,乱叫时会发出亮橙色鱼尾形态的声音。这个巨怪头上粉红色水母一样的犄角真的十分罕见,脖子上酷似乌贼一样的 铃铛似乎有点滑稽和漂亮。蘑菇王子和知知爵士见这伙校霸来者不善,急忙把附近的学生别墅群甩到千里之外,然后快速组成了一个巨大的幽灵枪心圣 !这个巨大的幽灵枪心圣,身长四百多米,体重一百多万吨。最奇的是这个怪物长着十分陀螺般的枪心!这巨圣有着鹅黄色果冻形态的身躯和褐黄色细 小螳螂一般的皮毛,头上是春绿色篦子般的鬃毛,长着紫红色茄子形态的皮包星花额头,前半身是亮黄色火腿形态的怪鳞,后半身是傲慢的羽毛。这巨 圣长着亮蓝色茄子样的脑袋和天青色橘子形态的脖子,有着天蓝色犀牛一样的脸和蓝宝石色琴弓样的眉毛,配着青兰花色锯片般的鼻子。有着浓绿色领 章一样的眼睛,和紫玫瑰色车灯形态的耳朵,一张浓绿色棉被形态的嘴唇,怪叫时露出青古磁色冰雕样的牙齿,变态的亮黄色细竹一般的舌头很是恐怖 ,褐黄色球杆造型的下巴非常离奇。这巨圣有着仿佛鼓锤样的肩胛和特像匕首般的翅膀,这巨圣紧缩的嫩黄色面包一般的胸脯闪着冷光,如同扣肉般的 屁股更让人猜想。这巨圣有着极似银剑形态的腿和湖青色丝瓜样的爪子……跳动的春绿色木瓜一般的六条尾巴极为怪异,紫葡萄色天鹅样的鳞片仙霞肚 子有种野蛮的霸气。嫩黄色玉葱般的脚趾甲更为绝奇。这个巨圣喘息时有种青兰花色元宵一般的气味,乱叫时会发出海蓝色槟榔一样的声音。这个巨圣 头上葱绿色馄饨般的犄角真的十分罕见,脖子上活似毛笔般的铃铛好像极品的酷帅同时还隐现着几丝正点。这时那伙校霸组成的巨大水牛雁肾怪忽然怪 吼一声!只见水牛雁肾怪摇动轻盈的深橙色拐棍似的眉毛,一摇,一道海蓝色的鬼光威猛地从金红色海胆模样的嘴唇里面飞出!瞬间在巨水牛雁肾怪周 身形成一片亮青色的光霞!紧接着巨大的水牛雁肾怪最后水牛雁肾怪抖动匀称的条尾巴一声怪吼!只见从天边涌来一片一望无际的海潮恶浪……只见一 望无际的海潮轰鸣翻滚着快速来到近前,突然间密密麻麻的总理在一个个小水牛雁肾怪的指挥下,从轰鸣翻滚的海潮中冒了出来!“这个玩法不错?! 咱俩也玩一个让他们看看!”蘑菇王子一边说着一边抛出法宝。“就是!就是!”知知爵
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生产工艺路线选择
乙烯物理性质:通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4 沸点(℃):-103.9 相对密度(水=1):0.61 相对蒸气密度(空气=1):0.98 饱和蒸气压(kPa):4083.40(0℃) 燃烧热(kJ/mol):1411.0 临界温度(℃):9.2 临界压力(MPa):5.04 闪点(fp):无意义引燃温度(℃):425 爆炸上限%(V/V):36.0 爆炸下限%(V/V):2.7 溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
乙醛:外观与性状:无色液体,有强烈的刺激臭味,易挥发。
熔点(℃):-121沸点(℃):20.8相对密度(水=1):0.78相对蒸气密度(空气=1):1.52饱和蒸气压(kPa):98.64(20℃)燃烧热(kJ/mol):279.0 kcal/mol临界温度(℃):188闪点(℃):-39 原料来源:石油裂化
催化剂性能:钯盐催化剂溶液有毒,具有酸性,并含有高浓度的氯离子,有强烈的腐蚀性.
安全:产品都是易燃易爆有毒物质,与空气能形成爆炸混合物。
环保分析:如是用碳钢制造,要求内衬耐酸耐温橡胶和瓷砖,各法兰连接处和同氧气的罐子腐蚀更严重,一般需采用特种材料。
先进性:通过可得区与理想反应器超级结构法两步系统预分析确定基本单元数量与连接类型,提供求解初值与变量边界,大大降低了模型求解复杂度。
经济性分析:1.反应条件缓和,有较高的选择性2.反应热的除去比较方便,有氧化可用反应物或溶剂的蒸发以移走反应热3.反应温度易控,温度分布均匀4.反应设备结构简单,生产能力高,
工艺条件
乙醛生产方法
1.乙醇氧化法2CH3CH2OH+O2→2CH3CHO+2H2O
2.乙炔水合法C2H2+H2O→CH3CHO
3.乙烯直接氧化法CH2CH2+O2→CH3CHO
1、反应温度
一席液相痒化生产乙醛在热力学上是很有利的,温度因素主要影响反应速率和选择性。
从动力学方程可知,升高温度,反应速率常数k值增大,有利于加快反应速率,但乙烯在催化剂溶液中的溶解度随温度升高而减小,又对反应速率产生不利益影响。
对于金属钯的氧化而言,温度高,可以提高Pd2+的平衡浓度,是催化剂溶液中[PdCl4]浓度增加,有利于加速碳化反应速率。
就氧化亚铜的氧化而言,温度升高可增大反应速率常数,但氧气的溶解度却随之降低。
综合以上分析可知,温度对反应速率产生的影响,需视两个相反效应何者占优势而言。
在温度不太高时,反应速率随温度升高而加快,但随着温度的升高,有利于因素的优势逐渐减小,而不利因素的影响逐渐显著。
且反应温度高,副反应速率也相应加快,反应选择性会下降,故存在一适宜的反应温度。
工业生产上一般控制在393~403K。
2、反应压力
乙烯络合催化氧化生产乙醛是一个气液想反应,增加压力有利于乙烯和氧气在催化剂溶液中的溶解度,加快氧化反应速率,提高生产能力。
但是,由于乙烯氧化生产乙醛是一个热效应较大的反应,反应热的移除是利用产物乙醛和催化剂溶液中水的蒸发来实现的,所以催化剂溶液是处于沸腾状态操作的,反应压力也就根据所选定的温度而自然确定的。
当反应温度为939~403K时,表压为0.3~0.38MPa。
3、原料气的配比和纯度
在一段法中,人们从采用乙烯大大过量的方式,为减少原料的损失,要求乙烯和氧气的纯度
在99%以上。
工业生产中要求严格控制循环气中氧含量和乙烯含量分别在8%和65%左右。
一步法的工艺流程示于图3-1-45。
以纯氧为氧化剂,反应器操作温度约为130℃,压力约为0.3MPa。
为安全计,气体混合物组成必需处在爆炸范围以外,因此氧约为Ψ(氧)=7%,而使用过量乙烯。
乙烯的单程转化率为30%~40%,以保持O2转化掉,w(乙烯)≈0.5。
以PdCl2-CuCl2水溶液为催化剂。
采用鼓泡床塔式反应器,反应后物料不论气体、液体和催化剂全部上升进入分离器,经分离器分离,将气体和反应液分开。
气体经冷却塔冷却、水洗涤塔洗涤,回收绝大部分乙醛(尾气中乙醛含量小于100ul〃l),大部分返回反应系统继续参与反应,少量排放至火炬烧掉。
洗涤塔下部流出的粗乙醛进入粗乙醛贮槽。
粗乙醛在轻组分蒸馏塔中分出低沸点物氯甲烷、氯乙烷及溶解的乙烯和CO2等,最终蒸馏塔塔顶出纯度为99.7%以上的精乙醛,侧线出丁烯醛等副产物。
在反应中,有不溶性树脂和固体草酸铜留在反应液中,数量一多不仅污染催化液,而且使铜离子浓度下降,结果会影响催化剂活性。
为此,操作中抽出少量在再生塔中再生,再生塔先通入氧和加入一定量盐酸,使一价铜氧化成二价2+铜,然后升温至170℃,借助催化液中的Cu的氧化作用将草酸铜分解,放出CO2并生成Cu。
再生后的催化液送回反应器。
该流程选择
性为95%左右,催化剂生产能力约为1503kg乙醛/(m催化剂·h)。
二步法工艺流程见图3-1-46。
采用两台反应器,第一个反应器只通乙烯,不通空气,在100~105℃,0.81~0.91MPa下操作,此时乙烯几乎全部参与反应,不需循环。
经闪蒸塔进行气液分离后,气相进后续工序,进行精制,获得乙醛产品。
液体进入第二个反应器(图上的氧化器),用+2+空气氧化催化液,使Cu成为Cu。
与一步法一样,催化剂也需再生,故流程中设有再生塔。
氧化器反应温度100~110℃,压力1.0~1.2MPa。
该法乙烯单程收率95%~99%,产品乙醛收率94.5%。
二法各有优缺点,例如一步法对原料要求甚高,又要空分装置,但少一个反应器,系统中没有氮气,设备可做得小一些,流程短,操作压力也比二步法低。
一般认为,选择何种生产方法与当地资源和工业条件有关。
当地有纯乙烯和氧气可供利用,则采用一步法为好,若无此条件则采用二步法为宜,但需解决好副产氮气的利用问题,以便降低生产成本。
因为系统中有HCl、O2和CuCl2存在,两种方法的防腐问题要引起高度重视,设备大多需用钛钢制造,输送催化液的泵也要选用钛泵。
核心设备
乙烯氧化制乙醛气使用液鼓泡反应器,它由反应器和除沫器组成,反应器上部有接管与除沫
器连通,除沫器底部有回液管与反应器下部相通,反应器底部有循环气管伸入至反应器内部,反应器和除沫器内壁分别衬贴有耐酸的筒壁砖,在伸入反应器内的循环气管的外壁包裹一层聚四氟乙烯板。
采用具有外循环管的鼓泡塔式反应器,以达到良好的传质,气液间有充分的?接触表面,催化剂溶液有充分的轴向混合以达到整个反应器内浓度均一,并除去?反应热的要求。
除热方式为籍产物乙醛和水的蒸发以带走反应热,反应液是处于沸腾状态?
的,反应温度是根据设定的压力而自然确定的,即溶液的泡点。
如增大压力,要?保持反应液沸腾,
反应温度必须提高,因此反应压力要控制。
像这种反应液处于沸腾状态,产物以气相形态出料的在鼓泡式反应器的反应?温度是根据反应压力来控制的。
生产工艺流程
相催化氧化一般是指气一液相氧化反应,反应物与催化剂共处同一相,习惯上称为液相氧化反应。
单纯的气相氧化因缺乏适宜的催化剂及操作困难而几乎没有。
近年来,均相催化氧化技术不断地成功应用在高级烃类制仲醇、乙醛自催化氧化制醋酸、环烷烃氧化制醇和酮混合物(如环已烷氧化制环己酮、环己醇)、瓦克法制醛或酮(如乙烯络合氧化制乙醛)、烃类过氧化氢制备(如过氧化氢异丙苯)、烯烃环氧化(如丙烯环氧化制环氧丙烷)等方面,并以其高活性和高选择性而日益受到人们的关注。
以PdCl2 -CLlC12为催化剂在水溶液中对烯烃进行氧化,生成相应的醛或酮的方法称为瓦克(Wacker)法。
这是一种液相氧化法,由于反应在液相中进行,使用的又是络合催化剂,故又称作均相络合催化氧化法。
乙醛是重要的有机合成中间体,大量用来制造醋酸、醋酐和过醋酸,还用来制造乳酸、季戊四醇、1,3-丁二醇、丁烯醛、正丁醇、2-乙基己醇、三氯乙醛、三羧甲基丙烷等。
1960年以前,乙醛生产以乙炔水合法为主。
1959年成功开发了乙烯络合催化氧化制乙醛新工艺瓦克(Wacker)法,70年代末该法成为主要的工业生产方法。
生产安全与环保
原料产品都是易燃易爆有毒物质,在常温常压下是无色气体,易燃易爆。
反应温度高,放出大连反映热,反映温度高,放热量大是该工艺的一大特点为了保证反应温度,及时一走反应热对安全生产,极为重要。
操作中若不能及时一走反应热
反应温度急剧升高,有燃烧和爆炸的危险。
能形成爆炸混合物反应体系中含量过高能形成爆炸混合物,尤其是循环气中氧含量过高。
工业生产上从安全和经济两方面考虑。
比如控制点在楼梯处,此时若盲目加宽门宽或外门宽度,智慧增加造价,造成浪费,而疏散时间却没有减少,若要解决问题,必须加宽楼梯才行。
