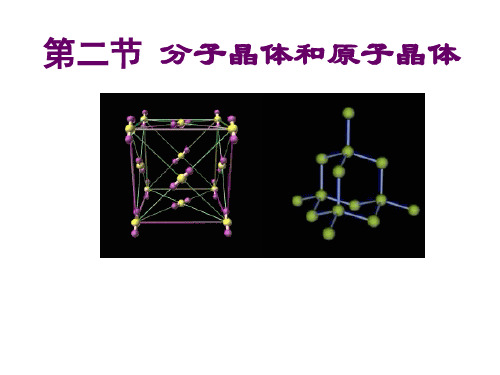
人教版化学选修三第三章第二节《分子晶体与原子晶体》精品课件
合集下载
人教版化学选修三第三章第二节《分子晶体与原子晶体》精品课件

②某些非金属化合物 碳化硅(SiC)晶体、氮化硼(BN)晶体等
③某些氧化物 二氧化硅( SiO2)晶体
原子晶体物理特性
在原子晶体中,由于原子间以较强的共价键( 一般是共价单键)相结合,所以原子晶体有以
下物理性质:
–熔点和沸点很高
–硬度很大(但硬而脆) –一般不导电
如果你有一颗 钻石,千万不
要砸哟!
2.金刚砂(SiC)与金刚石具有相似的晶体结构(如图所 示),在金刚砂的空间网状结构中,碳原子、硅原 子交替以共价单键相结合。试回答:
(1)金刚砂属于原___子_晶体,金刚砂的熔点比金刚石的熔 点_低___。
(2)在金刚砂的结构中,一个硅原子周围结合了__4____ 个碳原子,其中的键角是_1__0_9_°__2__8_′_。
原子晶体熔沸点高低的比较规律
结构相似的原子晶体,原子半径越小, 键长越短,键能越大,晶体熔点越高。
课堂练习
D 1.下列关于原子晶体和分子晶体说法不正确的是( )
A.原子晶体硬度通常比分子晶体大 B.原子晶体的熔沸点较高 C.有些分子晶体的水溶液能导电 D.金刚石、水晶盒干冰属于原子晶体
课堂练习
3、为何干冰的熔沸点比冰低,密度却比冰大? 由于冰中除了范德华力外还有氢键作用,破坏分子
间作用力较难,所以熔沸点比干冰高。 在冰中由于氢键的方向性,导致晶体中有相当大的
空隙,所以相同状况下冰的体积较大,密度比干冰小。
4、为什么冰的密度比水的小,而4℃时的水的密度最大?
①氢键的存在迫使在四面体中心的每个水分子与四面 体顶角方向的4个相邻水分子相互吸引。这一排列使冰 晶体中的水分子的空间利用率不高,留有相当大的空 隙,体积较大,密度比水小 ②当冰刚刚融化为液态水时,热运动使冰的结构部分 解体,水分子间的空隙减小,密度开始增大; ③超过4℃时,由于热运动加剧,分子间距离再次加大 ,密度又逐渐减小
③某些氧化物 二氧化硅( SiO2)晶体
原子晶体物理特性
在原子晶体中,由于原子间以较强的共价键( 一般是共价单键)相结合,所以原子晶体有以
下物理性质:
–熔点和沸点很高
–硬度很大(但硬而脆) –一般不导电
如果你有一颗 钻石,千万不
要砸哟!
2.金刚砂(SiC)与金刚石具有相似的晶体结构(如图所 示),在金刚砂的空间网状结构中,碳原子、硅原 子交替以共价单键相结合。试回答:
(1)金刚砂属于原___子_晶体,金刚砂的熔点比金刚石的熔 点_低___。
(2)在金刚砂的结构中,一个硅原子周围结合了__4____ 个碳原子,其中的键角是_1__0_9_°__2__8_′_。
原子晶体熔沸点高低的比较规律
结构相似的原子晶体,原子半径越小, 键长越短,键能越大,晶体熔点越高。
课堂练习
D 1.下列关于原子晶体和分子晶体说法不正确的是( )
A.原子晶体硬度通常比分子晶体大 B.原子晶体的熔沸点较高 C.有些分子晶体的水溶液能导电 D.金刚石、水晶盒干冰属于原子晶体
课堂练习
3、为何干冰的熔沸点比冰低,密度却比冰大? 由于冰中除了范德华力外还有氢键作用,破坏分子
间作用力较难,所以熔沸点比干冰高。 在冰中由于氢键的方向性,导致晶体中有相当大的
空隙,所以相同状况下冰的体积较大,密度比干冰小。
4、为什么冰的密度比水的小,而4℃时的水的密度最大?
①氢键的存在迫使在四面体中心的每个水分子与四面 体顶角方向的4个相邻水分子相互吸引。这一排列使冰 晶体中的水分子的空间利用率不高,留有相当大的空 隙,体积较大,密度比水小 ②当冰刚刚融化为液态水时,热运动使冰的结构部分 解体,水分子间的空隙减小,密度开始增大; ③超过4℃时,由于热运动加剧,分子间距离再次加大 ,密度又逐渐减小
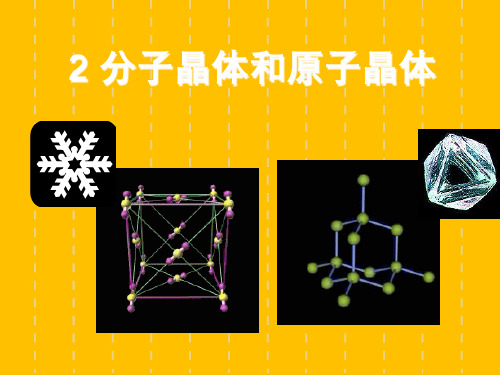
人教版高中化学选修三第三章第2节 分子晶体和原子晶体 课件(共14张PPT)

美丽的晶体
硝酸钾晶体
单晶硅
萘晶体显微结构
明矾晶体
重铬酸钾晶体
一、分子晶体
• 我们学过的一些物质,如H2O、CO2、 NH3、CH4 等,在固态时也以晶体 的形式存在,它们是由分子通过分 子间作用力结合而成的。在这些晶 体中,构成晶体的粒子是分子,像 这样分子间以分子间作用力相结合 的晶体叫做分子晶体。
• (2)部分非金属单质,如 _卤__素__(X_2_)、__氧__(O_2_)_、_硫_ (_S_8)_、__氮_(_N2_)、白磷(P4)、C_60。
• (3)部分非金属氧化物,如_C_O_2、_P_2O6、__P_4O_1_0、__SO__2 等 。
• (4)几乎所有的酸。
• (5)绝大多数有机物。
• 4.构成分子晶体的作用力 • 包括__范_德__华__力____和__氢__键____。
• 5.分子晶体结构特点
(1) 大多数分子晶体的结构有如下特征: 如果分子间作用力只有范德华力,若以一 个分子为中心,其周围通常可以有12个紧 邻的分子,分子晶体的这一特征称为分子 密堆积如O2和C60。
(2)少部分的分子晶体,分子间的主要 作用力是氢键(当然也有范德华力),其 堆积方式不采用密堆积。如HF、H2O、NH3
分子的非密堆积
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
6.分子晶体与化学键
(1)分子晶体中_一__定__存在范德华力, _不__一__定__存在化学键。 (2)除稀有气体分子构成的晶体以外,一 般分子晶体中分子之间存在的作用力是 _范__德__华__力_,分子内部原子之间存在的作 用力是__共__价__键__,范德华力能量_较__小__, 共价键能量__较__大__。
硝酸钾晶体
单晶硅
萘晶体显微结构
明矾晶体
重铬酸钾晶体
一、分子晶体
• 我们学过的一些物质,如H2O、CO2、 NH3、CH4 等,在固态时也以晶体 的形式存在,它们是由分子通过分 子间作用力结合而成的。在这些晶 体中,构成晶体的粒子是分子,像 这样分子间以分子间作用力相结合 的晶体叫做分子晶体。
• (2)部分非金属单质,如 _卤__素__(X_2_)、__氧__(O_2_)_、_硫_ (_S_8)_、__氮_(_N2_)、白磷(P4)、C_60。
• (3)部分非金属氧化物,如_C_O_2、_P_2O6、__P_4O_1_0、__SO__2 等 。
• (4)几乎所有的酸。
• (5)绝大多数有机物。
• 4.构成分子晶体的作用力 • 包括__范_德__华__力____和__氢__键____。
• 5.分子晶体结构特点
(1) 大多数分子晶体的结构有如下特征: 如果分子间作用力只有范德华力,若以一 个分子为中心,其周围通常可以有12个紧 邻的分子,分子晶体的这一特征称为分子 密堆积如O2和C60。
(2)少部分的分子晶体,分子间的主要 作用力是氢键(当然也有范德华力),其 堆积方式不采用密堆积。如HF、H2O、NH3
分子的非密堆积
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
6.分子晶体与化学键
(1)分子晶体中_一__定__存在范德华力, _不__一__定__存在化学键。 (2)除稀有气体分子构成的晶体以外,一 般分子晶体中分子之间存在的作用力是 _范__德__华__力_,分子内部原子之间存在的作 用力是__共__价__键__,范德华力能量_较__小__, 共价键能量__较__大__。
高中化学3.2分子晶体与原子晶体K1 K2优秀课件

干冰晶体中,每个CO2分子周围,离该分子最近且距离相 等的CO2分子有12个CO2分子?
65
87
31
42
〔2〕冰 晶体的结构如以下图所示
构成冰晶体的结构微粒是H2O 分子,微粒间的相互作用力主要 是氢键〔也存在范德华力〕 在冰的晶体中,每个水分子与 四面体顶角方向的4个相邻水分 子相互吸引,这样的排列使冰晶 体中的水分子的空间利用率不高, 留有相当大的空隙。
〔2〕 SiO2
观察SiO2晶体结构
SiO2中每个Si与4个O结合构成 正四面体,同时每个O与2个Si结合。
SiO2晶体中, Si原子与O原子个数比为: 1﹕(4×1/2)=1﹕2 Si原子个数与Si—O键数之比为: 1﹕4 注意:原子晶体中不存在单个分子,它的化学式代表 晶体中各构成粒子的个数比,而不代表真实的分子组成。
二、原子晶体
1.结构特点: (1)构成晶体粒子:原子
晶体熔化 破坏它
(2)晶体里粒子间的作用:共价键。
2.定义:在晶体里,所有相邻原子都以共价键相结合而形成三 维网状结构的晶体。
3.原子晶体性质的共性: 熔点高,硬度大,难溶于一些常见的溶剂
4 .常见原子晶体 〔1〕金刚石 在金刚石晶体中,
每个C与多少个C成键? 4 C采取何种杂化方式? SP3杂化 形成怎样的空间结构? 正四面体的立体网状结构 键角? 109°28′
C. 金刚石和HCl
D. CCl4和KCl
例题2.C60、金刚石和石墨的结构模型如以下图所示〔石墨仅表 示出其中的一层〕
〔1〕C60、金刚石和石墨三者互为 A、同分异构体 C、同系物
B
;
B、同素异形体
D、同位素
〔2〕固态时,C60属于 分子 〔填“离子〞、“原子〞或 “分子〞〕晶体;
人教版化学选修3分子晶体和原子晶体PPT(51页)

冰的结构
(四)、分子晶体结构特征
(1)密堆积 只有范德华力,无分子间氢键——
分子密堆积。这类晶体每个分子周围一 般有12个紧邻的分子,如:C60、干冰 、I2、O2。
(四)、分子晶体结构特征
(2)非密堆积
有分子间氢键——氢键具有方向 性,使晶体中的空间利率不高,留有相当 大的空隙.这种晶体不具有分子密堆积 特征。如:HF 、NH3、冰(每个水分子 周围有4个紧邻的水分子构成四面体结 构)。
二.原子晶体
(一).概念: 相邻原子间以共价键相结合而
形成空间立体网状结构的晶体.
构成原子晶体的粒子是 原子,原子间以 较强的 共价键(极性键、非极性键相)结 合.
金 刚 石
金刚石的晶体结构示意图
109º28´
共价键
金刚石晶体结构特点
在金刚石晶体中,直接相邻的4 个C原子形成一个 正四面体,完全归 属于一个 正四面 体的C原子为 2 个; 共价键为 4 个.
人教版化学选修3分子晶体和原子晶体 PPT(51 页)
分子晶体有哪些物理特性,为什么?
一、分子晶体
(三)分子晶体的物理性质:
具有较低的熔沸点(常温下一般为 气态或液态,少数为固态),硬度较小,固 态和熔融态不导电,溶于水时水溶液有 些可以导电.
分子晶体的溶解性:相似相溶原理
右侧是 常见的分子 晶体—干冰 的晶胞,晶 体中存在的 作用力?晶 体中分子间 的相对位置?
(三)常见的原子晶体 某些非金属单质:
金刚石(C)、晶体硅(Si)、 晶体硼(B)、晶体锗(Ge)等 某些非金属化合物: 碳化硅(SiC)晶体、 氮化硼(BN)晶体 氮化硅(Si3N4)晶体
(三)常见的原子晶体 ▪某些氧化物:
人教版高中化学选修三课件:第三章 第二节 分子晶体与原子晶体(25张PPT)

2.常见的原子晶体 (1)物质类别
(2)金刚石的结构特点:
①在晶体中每个碳原子以4个共价键 与 相邻的4个 碳原子相结 合,成为正四面体。
②晶体中C—C—C夹角为 109°28′,碳原子采取了 sp3杂化。 ③最小环上有 6 个碳原子。 ④晶体中碳原子个数与C—C键数之比为 1∶4×12=1∶2。
1.CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于什么晶体?
提示:分子晶体。 2.某碳氮化合物具有立体网状结构,硬度比金刚石 还硬,不溶于水,也不导电,你认为其属于什么晶体? 提示:原子晶体。
判断原子晶体和分子晶体类型的方法 (1)依据构成晶体的粒子和粒子间的作用力判断 构成原子晶体的粒子是原子,粒子间的作用力是共价键;构 成分子晶体的粒子是分子,粒子间的作用力是分子间作用力。 (2)依据晶体的熔点判断 原子晶体的熔点高,常在1 0析:根据构成晶体的粒子不同,分子晶体仅由分子组 成,原子晶体中无分子。分子晶体有B、C、E、F,其 中晶体氩是单原子分子构成的晶体;原子晶体和单原子 分子晶体都由原子直接构成,原子晶体有A、D,但化 合物只有A;分子晶体熔化时,一般不破坏化学键;原 子晶体熔化时,破坏化学键。
返回
“课时跟踪检测”见“课时跟踪检测(十)” (单击进入电子文档)
(2)相对分子质量相等或相近的极性分子构成的分子晶体, 其熔点一般比非极性分子构成的分子晶体的熔点高,如CO的熔 点比N2的熔点高。
(3)组成和结构相似且不存在氢键的同分异构体所形成的分 子晶体,相对分子质量相同,一般支链越多,分子间相互作用 越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
3.干冰、冰、金刚石的晶体结构图示。
人教化学选修3第三章第二节 分子晶体和原子晶体 课件 (共19张PPT)

109º28´ 共价键
Si
o
104º30´
109º28´ 共价键
SiO2晶体
Si
O
①每个Si原
子与 4个O原
子以共价键
相结合
每个O原子与2 个Si原子以共
价键相结合
SiO2晶体
ห้องสมุดไป่ตู้
Si O
②晶体中Si原 子与O原子个 数比为1:。2
晶体中Si原子与Si-O键数目 之比为 1:。4
SiO2晶体 Si
思考1 原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无小
分子存在。 思考2 以金刚石为例,说明原子晶体的微观结构与分
子晶体有哪些不同?
(1)组成微粒不同,原子晶体中只存在原子,没有
分子。
(2)相互作用不同,原子晶体中存在的是共价键。
交流与研讨
1、怎样从原子结构角度理解金刚石、 硅和锗的熔点和硬度依次下降?
以下是金刚石和晶体硅的
熔、沸点的比较
熔点 沸点
金刚石 3550℃ 4827℃
晶体硅 1410℃ 2355℃
同为结构相同的原子晶体,为什么金刚 石比晶体硅的熔、沸点高?
5、原子晶体熔、沸点的影响因素
原子晶体熔、沸点的高低与共价键的强弱 (即键能的大小)有关。一般说,原子半 径越短,键长越短,共价键的键能越大, 熔、沸点越高。
2、构成粒子: 原子
(大多数为非金属) 3、粒子间作用力: 共价键
4、物理性质
熔、沸点高,硬度大,难压缩,一 般不导电,难溶于水.
问题:为什么原子晶体的熔沸点很高, 硬度很大?
其本质是因为原子晶体中原子通过很强 的共价键连接,由于共价键比较牢固,要拆 开它需要消耗很大的能量,所以原子晶体 一般具有较高的熔沸点和较大的硬度.
【化学】:3.2《分子晶体与原子晶体》ppt课件(新人教版-选修3)

金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体 锗(Ge)等
❖ 某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
❖ 某些氧化物:
二氧化硅( SiO2)晶体、Al2O3
109º28´
共价键
思考:在金刚石晶体中,每个碳与 周围多少个碳原子成键?形成怎样的 空间结构?最小碳环由多少个碳原子 组成?它们是否在同一平面内?
③在金刚石中最小的环是六元环,1个环中平 均含有6×1/12=1/2个C原子,含C-C键数为 6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个 小正四面体,含有C-C键数为16。
Si
180º
109º28´
共价键
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键;
因为结构相似的原子晶体,原子半径越小,键长 越短,键能越大,晶体熔点越高,所以熔点和硬度 有如下关系:金刚石>碳化硅>锗。
分子晶体、原子晶体结构与性质关系的比较
晶体类型
结构、性质
分子晶体
原子晶体
结 构成晶体粒子 构 粒子间的作用力
分子 分子间作用力
原子 共价键
硬度
较小
较大
溶、沸点
性
质
导电
较低
固态和熔融状 态都不导电
〖思考3〗为何干冰的熔沸点比冰低,密 度却比冰大?
由于冰中除了范德华力外还有氢键作用, 破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性, 导致晶体中有相当大的空隙,所以相同状况下 体积较大
由于CO2分子的相对分子质量>H2O,所 以干冰的密度大。
科学视野:笼装化合物 20世纪末,科学家发现海底存在大量天然气 水合物晶体。这种晶体的主要气体成分是甲 烷, 因而又称甲烷水合物。它的外形像冰, 而且在常温常压下会迅速分解释放出可燃的 甲烷,因而又称“可燃冰”………
❖ 某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
❖ 某些氧化物:
二氧化硅( SiO2)晶体、Al2O3
109º28´
共价键
思考:在金刚石晶体中,每个碳与 周围多少个碳原子成键?形成怎样的 空间结构?最小碳环由多少个碳原子 组成?它们是否在同一平面内?
③在金刚石中最小的环是六元环,1个环中平 均含有6×1/12=1/2个C原子,含C-C键数为 6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个 小正四面体,含有C-C键数为16。
Si
180º
109º28´
共价键
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键;
因为结构相似的原子晶体,原子半径越小,键长 越短,键能越大,晶体熔点越高,所以熔点和硬度 有如下关系:金刚石>碳化硅>锗。
分子晶体、原子晶体结构与性质关系的比较
晶体类型
结构、性质
分子晶体
原子晶体
结 构成晶体粒子 构 粒子间的作用力
分子 分子间作用力
原子 共价键
硬度
较小
较大
溶、沸点
性
质
导电
较低
固态和熔融状 态都不导电
〖思考3〗为何干冰的熔沸点比冰低,密 度却比冰大?
由于冰中除了范德华力外还有氢键作用, 破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性, 导致晶体中有相当大的空隙,所以相同状况下 体积较大
由于CO2分子的相对分子质量>H2O,所 以干冰的密度大。
科学视野:笼装化合物 20世纪末,科学家发现海底存在大量天然气 水合物晶体。这种晶体的主要气体成分是甲 烷, 因而又称甲烷水合物。它的外形像冰, 而且在常温常压下会迅速分解释放出可燃的 甲烷,因而又称“可燃冰”………
人教版高中化学选修三分子晶体与原子晶体课件
•
7.很显然,作者的目的不是为了证明 其他生 物比人 类更高 明,也 不只是 为我们 提供生 物交流 技术方 面的有 趣知识 ,更是 以一个 医学家 、生物 学家的 睿智和 敏锐的 洞察力.
•
8.对传统生物学过分强调个体行为和 动物本 能的观 点进行 了反思 ,也对 人类盲 目自大 、不能 充分认 识自身 生存危 机作出 了警示 。
•
9. 人类虽然最终脱颖而出,主宰了这 个世界 ,但人 类的行 为方式 还具有 和其他 社会性 生物相 类似的 特点, 还需要 联合, 需要团 结,才 能源源 不断地 产生智 慧,克 服自身 发展面 临的种 种困境 ,推动 社会进 步。
分子晶体有哪些物理特性,为什么?
3、物理特性:
(1)较低的熔点和沸点,易升华 (2)较小的硬度; (3)一般都是绝缘体,熔融状态也
不导电。
➢原因:分子间作用力较弱
干冰的晶体结构图
数 一 数
分子的密堆积
(与CO2分子距离最近的 CO2分子共有??个 )
分子的非密堆积
氢键具有方向性
冰中1个水分子周围有4个水分子
构成晶体的粒子是原子
• 对比分子晶体和原子晶体的数据,原子 晶体有何物理特性?
2、原子晶体的物理特性
(1)熔点和沸点高;
(2)硬度大;
(3)一般不导电;
(4)且难溶于一些常见的溶剂。 在原子晶体中,由于原子间以较强的 共价键相结合,而且形成空间立体网状结 构,所以原子晶体有特殊的物理性质。
3、常见的原子晶体(课本P69页)
冰的结构
结束
4、晶体结构特征
(1)密堆积 只有范德华力,无分子间氢键——分子
密堆积。这类晶体每个分子周围一般有12 个紧邻的分子,如:C60、干冰 、I2、O2。
人教版化学选修三分子晶体和原子晶体

稀有气体(如氦,氖,氩)氢化物(如氨,氯化氢) 非金属氧化物(如一氧化碳,二氧化硫)
分子晶体的物理性质
①熔点和沸点较低、硬度较小。 ②导电性:固态及熔化时都不导电,溶于水时部分导电。
【分析】分子晶体的构成粒子是分子,在固态及熔化状态时仍以分子形式存在, 不能导电;像HCl这样的共价化合物固态时为分子晶体,溶于水后,在水分子的 作用下共价键被破坏,可电离为自由移动的离子,因而导电。
3 如果水分子间无氢键存在,地球上将会是什么面貌?
水可结冰,CO2也可以形成晶体,食用蔗糖以及I2、H2、H2SO4 等都可以晶体形式存在,这些晶体的形成都是通过分子间作用力结 合在一起的。这些晶体的结构和性质如何呢?
分子晶体
定义:分子间通过分子间作用力结合而成的晶体。 特点:有单个分子存在,化学式就是分子式。 实例:多数非金属单质(如卤素,氧气)
•
9.自信让我们充满激情。有了自信, 我们才 能怀着 坚定的 信心和 希望, 开始伟 大而光 荣的事 业。自 信的人 有勇气 交往与 表达, 有信心 尝试与 坚持, 能够展 现优势 与才华 ,激发 潜能与 活力, 获得更 多的实 践机会 与创造 可能。
感谢观看,欢迎指导!
石墨的性质:熔、沸点高,硬度小,能导电。
练习1. 石墨晶体的层内结构如图 所示,每一层由无数个正六边形 构成,则平均每一个正六边形所占的 碳原子数为 2
每个碳原子为三个正六边形共用, 分属于每个正六边形的碳原子数为1/3个。 每个正六边形的碳原子数为6×1/3 = 2
12克晶体中,正六边形的数目有多少?
分子与分子 间的作用力
相互作用 的强弱
弱(几到几十 kJ/mol)
化学键 相邻原子间 的相互作用
强( 120~ 800 kJ/mol)
分子晶体的物理性质
①熔点和沸点较低、硬度较小。 ②导电性:固态及熔化时都不导电,溶于水时部分导电。
【分析】分子晶体的构成粒子是分子,在固态及熔化状态时仍以分子形式存在, 不能导电;像HCl这样的共价化合物固态时为分子晶体,溶于水后,在水分子的 作用下共价键被破坏,可电离为自由移动的离子,因而导电。
3 如果水分子间无氢键存在,地球上将会是什么面貌?
水可结冰,CO2也可以形成晶体,食用蔗糖以及I2、H2、H2SO4 等都可以晶体形式存在,这些晶体的形成都是通过分子间作用力结 合在一起的。这些晶体的结构和性质如何呢?
分子晶体
定义:分子间通过分子间作用力结合而成的晶体。 特点:有单个分子存在,化学式就是分子式。 实例:多数非金属单质(如卤素,氧气)
•
9.自信让我们充满激情。有了自信, 我们才 能怀着 坚定的 信心和 希望, 开始伟 大而光 荣的事 业。自 信的人 有勇气 交往与 表达, 有信心 尝试与 坚持, 能够展 现优势 与才华 ,激发 潜能与 活力, 获得更 多的实 践机会 与创造 可能。
感谢观看,欢迎指导!
石墨的性质:熔、沸点高,硬度小,能导电。
练习1. 石墨晶体的层内结构如图 所示,每一层由无数个正六边形 构成,则平均每一个正六边形所占的 碳原子数为 2
每个碳原子为三个正六边形共用, 分属于每个正六边形的碳原子数为1/3个。 每个正六边形的碳原子数为6×1/3 = 2
12克晶体中,正六边形的数目有多少?
分子与分子 间的作用力
相互作用 的强弱
弱(几到几十 kJ/mol)
化学键 相邻原子间 的相互作用
强( 120~ 800 kJ/mol)
人教版选修3 第三章 第二节分子晶体与原子晶体 课件(共57张)

新课程学习与测评
P42
例1 下列各组物质中,按沸点由低到高的顺序排列正确的是( ) A.H2O、H2S、H2Se、H2Te B.CF4、CCl4、CBr4、CI4
√C.CH4、C2H6、C4H10、C3H8
D.CO、N2、O2、Cl2
第二节 分子晶体与原子晶体
新课程学习与测评
P42
[针对训练]1.下列物质的熔、沸点高低的比较,正确的是( )
第二节 分子晶体与原子晶体
课本
P66
分子非密堆积
氢键具有方向性
冰中1个水分子周围有4个水 分子
冰的结构
第二节 分子晶体与原子晶体
课本
P66
4.分子晶体的结构特征
(1)密堆积 (每个分子周围有12个紧邻的分子) 只有范德华力,无分子间氢键——分子密堆积。
(2)非密堆积 (每个分子周围紧邻的分子少于12个) 有分子间氢键——不具有分子密堆积特征。
共价键
第二节 分子晶体与原子晶体
课本
P68
二、原子晶体
1.概念:所有的相邻原子间都以共价键相结合而形成空间立体网状结
构的晶体。
注: (1)构成粒子: 原子 (2)粒子间的作用力: 共价键 (3)结构特点: 整块晶体是一个三维的共价键网状结构,是一个“巨分
子”,又称共价晶体。
思考:只由原子形成的晶体一定是原子晶体吗?
最典型的分子晶体(如图 )
(1)干冰
课本
P66
①每个晶胞中有____4____个CO2分子,____1__2_____ 个原子。
第二节 分子晶体与原子晶体
课本
P66
(与CO2分子距离最近的CO2分子共有______个 )
干冰的晶体结构图
高中化学选修3课件-3.2 分子晶体与原子晶体1-人教版

有分子间氢键——氢键具有方向性,使晶体中 的空间利率不高,留有相当大的空隙.这种晶体不 具有分子密堆积特征。如冰(每个水分子周围只 有4个紧邻的水分子)。
氢键具有方向性
练习1
下列说法中正确的是 ①②③⑤⑦ 。 ①干冰晶体中包含的作用力为范德华力和共价键
②SiO2晶体中包含的作用力只有共价键 ③CO2表示一个二个氧氧化原碳子分构子成是的由一个碳原子和两 ④SiO2表示表示和一两个个二氧氧原化子硅构分成子的是由一个硅原子
小结
1、分子晶体和原子晶体
概念 微粒组成 粒间作用 物理性质 物质
2、常见的几种分子晶体和原子晶体
谢谢
练习2
1、共价键、离子键和范德华力是构成物质的粒
子间的不同作用方式,下列物质中,只含有上
述一种作用的是( B )
A、干冰
B、氯化钠
C、氧化钠
D、碘
2、下列有关分子晶体熔沸点的比较中,正确的
是( B )
A、Cl2>I2 B、SiCl4>CCl4 C、NH3<PH3 D、C(CH3)4>CH3(CH2)3CH3
分子
粒间作用
共价键
分子间作用力(氢键)
•物质CSi和O2SCB的iN、同、物Si属S、理i3NB于性、4、第S质AiOlIN却2V、等A相S族iC差、元很熔素大沸大 和,呢点共多而低价非?C、化金O硬合属2度物单和小质,
熔点高、硬度大, 相似相溶,
性质特点
不溶于任何溶剂, 大多不导电(个别
为半导体)
10:30
水晶的结构
Si O
180º 109º28´
共价键
晶体Si
晶体 SiO2
SiO2晶胞
SiO2晶胞
在SiO2晶体中每个Si原子与 4 个O原子成键;每个O原
氢键具有方向性
练习1
下列说法中正确的是 ①②③⑤⑦ 。 ①干冰晶体中包含的作用力为范德华力和共价键
②SiO2晶体中包含的作用力只有共价键 ③CO2表示一个二个氧氧化原碳子分构子成是的由一个碳原子和两 ④SiO2表示表示和一两个个二氧氧原化子硅构分成子的是由一个硅原子
小结
1、分子晶体和原子晶体
概念 微粒组成 粒间作用 物理性质 物质
2、常见的几种分子晶体和原子晶体
谢谢
练习2
1、共价键、离子键和范德华力是构成物质的粒
子间的不同作用方式,下列物质中,只含有上
述一种作用的是( B )
A、干冰
B、氯化钠
C、氧化钠
D、碘
2、下列有关分子晶体熔沸点的比较中,正确的
是( B )
A、Cl2>I2 B、SiCl4>CCl4 C、NH3<PH3 D、C(CH3)4>CH3(CH2)3CH3
分子
粒间作用
共价键
分子间作用力(氢键)
•物质CSi和O2SCB的iN、同、物Si属S、理i3NB于性、4、第S质AiOlIN却2V、等A相S族iC差、元很熔素大沸大 和,呢点共多而低价非?C、化金O硬合属2度物单和小质,
熔点高、硬度大, 相似相溶,
性质特点
不溶于任何溶剂, 大多不导电(个别
为半导体)
10:30
水晶的结构
Si O
180º 109º28´
共价键
晶体Si
晶体 SiO2
SiO2晶胞
SiO2晶胞
在SiO2晶体中每个Si原子与 4 个O原子成键;每个O原
高中人教版化学选修3课件:第3章第2节 分子晶体与原子晶体课件(32张ppt)_最新修正版

金刚石、晶体 硅、碳化硅、 二氧化硅等少 数非金属单质 及共价化合物
分子间作用力(氢 共价键(极性键、 键、范德华力) 非极性键)
较弱的分子间作 用力
很强的共价键
最新修正版
11
晶体类型 熔、沸点 硬度
物
理 性
导电性
质Leabharlann 分子晶体 较低 较小原子晶体 很高 很大
固态和熔化时都不导电,但某些 分子晶体溶于水能导电,如HCl
最新修正版
5
2.属于分子晶体的物质
(1)所有__非__金__属__氢__化__物________,如H2O、NH3、 CH4等。 (2)部分非金属单质,如卤素(X2)、O2、N2、白磷 (P4)、硫(S8)、稀有气体等。 (3)部分__非__金__属__氧__化__物_____,如CO2、P4O6、 P4O10、SO2等。 (4)几乎所有的__酸_____,如HNO3、H2SO4、 H3PO4、H2SiO3等。 (5)绝大多数有机物的晶体,如苯、乙醇。
最新修正版
17
【规律方法】 判断非金属元素组成的晶体是分 子晶体还是原子晶体的方法有: (1)依据构成晶体的粒子和粒子间的作用判断:原 子晶体的构成粒子是原子,质点间的作用是共价 键;分子晶体的构成粒子是分子,质点间的作用 是范德华力。 (2)记忆常见的、典型的原子晶体。常见的原子晶 体有:某些非金属单质如硼、硅、锗等;某些非 金属化合物如碳化硅、氮化硼、二氧化硅等。
范德华力,但主要作用力 是氢键。
②由于氢键的存在迫使在 四面体中心的每个水分子 与四面体顶点的4个相邻的
水分子相互吸引。
①在晶体中每个硅原子和4个氧原子形成4个 共价键;每个氧原子与2个硅原子相结合。故 SiO2晶体中硅原子与氧原子按1∶2的比例组
人教版 高中化学 选修三 第三章 第2节《分子晶体和原子晶体》 (共31张PPT)
• 碳元素和硅元素处于元素周期表中同一主族, 为什么CO2晶体的熔、沸点很低,而SiO2晶体 的熔沸点很高?
二氧化硅晶体结构示意图
Si
O
180º
109º28´
共价键
金刚石的晶体结构示意图
109º28´
共价键
二.原子晶体(共价晶体)
金 刚
• 概念: 石
– 相邻原子间以共价键相结合而形成 空间立体网状结构的晶体。
晶体熔沸点高低比较规律
▪ 首先判断物质是那种晶体, 1不同类型晶体熔沸点高低一般规律为:
原子晶体>离子晶体>分子晶体. 2同类型晶体熔沸点高低为:
晶体微粒间的作用力越大,熔沸点越高. (1)原子晶体:比较共价键的强弱, 例 :熔沸点 :金刚石(c)>金刚砂(sic)> 晶体硅 (si) (2)离子晶体:比较离子键的强弱. 例:熔沸: MgO>MgCl2>NaCl>CsCl (3)分子晶体:比较分子间作用力的强弱. 例:熔沸点: H2O>H2Te>H2Se>H2S
练习1下列物质中,含有非极性共价键的离子晶体是( B )
A 氯化钾
B 过氧化钠
C 氢氧化钠
D 乙炔
练习2 共价键,离子键,分子间作用力是构成物质粒子
的不同作用方式,下列物质中,只含有上述一种作用的
是( B )
A 干冰 B 氖 C 氢氧化钠 D 碘
▪ 练习3 有关晶体的说法中正确的是( ) A 晶体中分子间作用力越大,分子越稳 定.B
2 分子晶体和原子晶体
哲语共勉
学习是一次独立的行 动,需要探索、琢磨、积 极应战、顽强奋战,艰辛 由你独自承担,胜利由你 独立争取。
观察与思考: 下列两种晶体有什么共同点?
二氧化硅晶体结构示意图
Si
O
180º
109º28´
共价键
金刚石的晶体结构示意图
109º28´
共价键
二.原子晶体(共价晶体)
金 刚
• 概念: 石
– 相邻原子间以共价键相结合而形成 空间立体网状结构的晶体。
晶体熔沸点高低比较规律
▪ 首先判断物质是那种晶体, 1不同类型晶体熔沸点高低一般规律为:
原子晶体>离子晶体>分子晶体. 2同类型晶体熔沸点高低为:
晶体微粒间的作用力越大,熔沸点越高. (1)原子晶体:比较共价键的强弱, 例 :熔沸点 :金刚石(c)>金刚砂(sic)> 晶体硅 (si) (2)离子晶体:比较离子键的强弱. 例:熔沸: MgO>MgCl2>NaCl>CsCl (3)分子晶体:比较分子间作用力的强弱. 例:熔沸点: H2O>H2Te>H2Se>H2S
练习1下列物质中,含有非极性共价键的离子晶体是( B )
A 氯化钾
B 过氧化钠
C 氢氧化钠
D 乙炔
练习2 共价键,离子键,分子间作用力是构成物质粒子
的不同作用方式,下列物质中,只含有上述一种作用的
是( B )
A 干冰 B 氖 C 氢氧化钠 D 碘
▪ 练习3 有关晶体的说法中正确的是( ) A 晶体中分子间作用力越大,分子越稳 定.B
2 分子晶体和原子晶体
哲语共勉
学习是一次独立的行 动,需要探索、琢磨、积 极应战、顽强奋战,艰辛 由你独自承担,胜利由你 独立争取。
观察与思考: 下列两种晶体有什么共同点?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子晶体物理特性
在原子晶体中,由于原子间以较强的共价键( 一般是共价单键)相结合,所以原子晶体有以 下物理性质:
–熔点和沸点很高 –硬度很大(但硬而脆) –一般不导电 –难溶于一些常见的溶剂
如果你有一颗 钻石,千万不 要砸哟!
典型的原子晶体——金刚石、二氧化硅
109º 28´
共价键
【碳正四面体】
①密堆积:如果分子间作用力只有范德华力,无分子间 氢键-分子采用密堆积,如:C60、干冰 、I2、O2。
思考:与CO2分子距离最近的CO2分子共有多少个?
重要结论:与CO2分子距离最近的CO2分子共有12个
②非密堆积:如果分子间作用力还有氢键,则采用非 密堆积(如:HF 、冰、NH3 )
冰的结构
第二节 分子晶体与原子晶体
第一课时 分子晶体
观察下列两种晶体的晶胞找出两种晶体的共同点?
碘晶胞
二氧化碳晶胞
结论:构成微粒都是分子。 都是面心立方晶胞。
分子晶体的定义、组成微粒和作用力 定义:分子间以分子间作用力相结合形成
的晶体。
分子晶体中存在的微粒: 分子
粒子间的作用力:分子间作用力
分子晶体的两种堆积方式:
金刚石的晶体结构
与金刚石有关的重要问题和结论 1:在金刚石的晶体中每个碳原子的价层轨道
杂化方式? 单键? 4个 1: 2 sp3
2:在金刚石晶体中每个碳原子形成几个共价
3:在金刚石晶体中碳原子个数与C-C共价键
个数之比是多少? 组成? 6个
4: 在金刚石晶体中,最小碳环由几个碳原子来
5.在金刚石晶胞中含有的碳原子数?
重要结论:1个水分子周围距离最近有4个水分子
常见的分子晶体
①所有非金属氢化物: H2O、H2S、NH3、CH4、HX ②几乎所有的酸: H2SO4、HNO3、H3PO4(碱和盐则是离子晶体) ③部分非金属单质: X2、O2、H2、 S8、P4、C60 、稀有气体 ④部分非金属氧化物: CO2、SO2、NO2、 P4O6、 P4O10 ⑤绝大多数有机物的晶体: 乙醇、冰醋酸、蔗糖、 苯、萘、蒽、苯甲酸等
12
1.56
镁粉在干冰中燃烧 天然气水合物 — 一种潜在的能源
第二节 分子晶体与原子晶体
第二课时 原子晶体
原子晶体的定义、组成微粒和作用力 定义:相邻原子间以共价键相结合而形成
空间立体网状结构的晶体。
分子晶体中存在的微粒: 原子
粒子间的作用力: 共价键
常见的原子晶体
①某些非金属或金属单质 金刚石(C)、晶体硅(Si)、晶体硼(B)、金属锗( Ge)等 ②某些非金属化合物 碳化硅(SiC)晶体、氮化硼(BN)晶体等 ③某些氧化物 二氧化硅( SiO2)晶体
在金刚石晶胞中含有 的碳原子数:
8×1/8+6×1/2+4=8 金刚石晶胞
Si O
联想水分子 的立体构型
104º 30´
109º 28´
共价键 【硅氧正四面体】
SiO2的晶体结构
与SiO2有关的重要问题和结论
1:在SiO2晶体中,每个硅原子与 4 个氧原子 结合;每个氧原子与 2 个硅原子结合;在SiO2
5、如何比较分子晶体熔沸点的高低? ①一般来说,分子晶体中范德华力越大,物质的熔、 沸点越高。 ②分子间氢键的形成使物质的熔、沸点升高;分子内 氢键的形成使物质的熔、沸点降低。
课堂练习
1.下列性质适合于分子晶体的是( BC ) A.熔点1070℃,易溶于水,水溶液导电 B.熔点10.31 ℃,液态不导电、水溶液能导电 C.能溶于CS2,熔点112.8 ℃,沸点444.6℃ D.熔点97.81℃,质软、导电、密度0.97 g/cm3 2.下列物质不存在氢键的是( D ) A.冰醋酸中醋酸分子之间 B.液态氟化氢中氟化氢分子之间 C.一水合氨分子中的氨分子和水分子之间 D.可燃冰(CH4 ·8H2O)中甲烷分子与水分子之间
结构相似的原子晶体,原子半径越小, 键长越短,键能越大,晶体熔点越高。
课堂练习
1.下列关于原子晶体和分子晶体说法不正确的是( D ) A.原子晶体硬度通常比分子晶体大 B.原子晶体的熔沸点较高 C.有些分子晶体的水溶液能导电 D.金刚石、水晶盒干冰属于原子晶体
课堂练习
2.金刚砂(SiC)与金刚石具有相似的晶体结构(如图所 示),在金刚砂的空间网状结构中,碳原子、硅原 子交替以共价单键相结合。试回答: (1)金刚砂属于原子 ____晶体,金刚砂的熔点比金刚石的熔 低。 点____ 4 (2)在金刚砂的结构中,一个硅原子周围结合了______ 109°28′ 。 个碳原子,其中的键角是___________ (3)金刚砂的结构中含有共价键形成的原子环,其中最 3 个硅原子。 小的环上有____
2、为何分子晶体的硬度小,熔沸点低?
①构成晶体的微粒是分子 ②分子之间以分子间作用力(主要是范德华力)相结 合,范德华力远小于化学键的作用
3、为何干冰的熔沸点比冰低,密度却比冰大? 由于冰中除了范德华力外还有氢键作用,破坏分子 间作用力较难,所以熔沸点比干冰高。 在冰中由于氢键的方向性,导致晶体中有相当大的 空隙,所以相同状况下冰的体积较大,密度比干冰小。
3.干冰的外观和冰相像,可由二氧化碳气体压缩成液 态后再急剧膨胀而制得。右图为干冰晶体结构示意 图。通过观察分析,可知每个CO2分子周围与之相邻 等距的CO2分子有_______个。在一定温度下,已测 得干冰晶胞(即图示)的边长a=5.72×10-8cm,则 该温度下干冰的密度为____________g/cm3。
4、为什么冰的密度比水的小,而4℃时的水的密度最大? ①氢键的存在迫使在四面体中心的每个水分子与四面 体顶角方向的4个相邻水分子相互吸引。这一排列使冰 晶体中的水分子的空间利用率不高,留有相当大的空 隙,体积较大,密度比水小 ②当冰刚刚融化为液态水时,热运动使冰的结构部分 解体,水分子间的空隙减小,密度开始增大; ③超过4℃时,由于热运动加剧,分子间距离再次加大 ,密度又逐渐减小
分子ቤተ መጻሕፍቲ ባይዱ体物理特性
①较低的熔点和沸点(易升华或易挥发) ②较小的硬度 ③只存在分子,不存在离子,一般都是绝缘体, 固态及熔融状态也不导电。溶于水时部分导电
④多数能溶于适当的溶剂(相似相溶)。
深入探究
1、分子晶体是否导电?什么条件下可以导电? 由于构成分子晶体的粒子是分子,不管是晶体 或晶体熔化成的液体,都没有带电荷的离子存在,因 此,分子晶体以及它熔化成的液体都不导电。 分子晶体溶于水时,水溶液有的能导电,如 HCl溶于水,有的不导电,如C2H5OH溶于水。
3.硅晶体的结构跟金刚石相似,1mol硅晶体中含有硅 硅单键的数目约是_______N 2 A个。二氧化硅的结构相 当于在硅晶体结构中每个硅硅单键之间插入1个氧原 子。二氧化硅的空间网状结构中,硅、氧原子形成 的最小环上氧原子数目是_______ 6 。
晶体中硅原子与氧原子个数之比是 1:2 。 2:在SiO2 晶体中,每个硅原子形成 4 个共 价键;每个氧原子形成 2 个共价键;硅原子 个数与Si-O 共价键个数之比是 1:4 ;氧原 子个数与Si-O 共价键个数之比是 1:2 。 3:在SiO2晶体中,最小环为 12 元环。
原子晶体熔沸点高低的比较规律
