化工原理讲稿(下册)-应化第八章传质过程概论
化工原理下册

其中的溶质浓度由上而下连续地增高。
• 在吸收过程中,如果溶质与溶剂之间不发 生显著的化学反应,则称为物理吸收。如 用水吸收CO2、用甲醇吸收硫化氢等都属于 物理吸收。
三、道尔顿定律
道尔顿定律是表示理想气体混合物的总压和分压的关系的定律。 总压——气体混合物分子对器壁施加压力的总和; 分压——混合气体中某一组分对器壁所施加的压力; 其在数值上等于同一温度下该气体单独存在并占有混合气体的容积时所 表现出来的压力,分压是总压的一部分。 道尔顿指出:理想气体混合物的总压,等于各个组分气体分压之和。此定 律又称为气体分压定律。
化工原理下册
• 第八章 吸收 • 第九章 精馏
第八章 气体吸收
• 概述
化工生产中所处理的原料、中间产物、粗产品等几乎都是混合 物。而且大部分是均相物系。对于均相物系,必须要造成一个 两相物系,利用原物系中各组分间某种物性的差异,而使其中 某个组分(或某些组分)从一相转移到另一相,以达到分离的目 的。物质在相间的转移过程称为物质传递过程(简称为传质过程) 或分离操作。
3、什么是全回流?
在精馏操作中,把停止塔进料、塔釜出料,将塔顶冷凝液 全部作为回流液的操作,称为全回流。
全回流操作,多半用在精馏塔的开车初期,或用在生产不正常 的自身循环操作中。
4、最适宜回流比是怎样确定的?
对于固定分离要求的过程来说,当减小回流比时,运转费 用(主要表现在塔釜加热量和塔顶冷量)将减少,但所需塔板 数增多,塔的投资费用增大;反之,当增加回流比时,可减少 塔板数,却增加了运转费用。因此,要选择一个最适宜的回流 比,以使投资费用和经常运转的操作费用之总和在特定的条件 下为最少。一般情况下,最适宜的回流比取为最小回流比的1.3 -2倍。
n1
第八章 传质过程导论(化工原理)

第八章 传质过程导论第一节 概述8-1 化工生产中的传质过程均相物系的分离(提纯,回收)1.吸收2.气体的减湿3.液-液萃取4.固-液萃取(浸沥,浸取)5.结晶6.吸附(脱附)7.干燥 8精馏 目的:湿分离或混合8-2 相组成的表示法1. 质量分率和摩尔分率mm a A A =mm a B B =mm a C C =……….......+++=C B A m m m mA,B 两组分 a a -1 nn x A A =nn x B B =nn x C C =…….......+++=C B A n n n n .......1+++=C B A x x x互换 A A AA A m m a m m x ==BB B m m a x =…….∑=++=iii B B A A m a m m m a m m a n ...... ()....,,C B A i =故 ∑==iii AA A A m a m a nn xi iiAA A m xm a a ∑=2.质量比和摩尔比质量比 B A m m a /=摩尔比 B A n n X =()a a a -=1 ()x x X -=1)X X x -=13.浓度质量浓度 V m C A A = 3/m kg摩尔浓度 V n C A A = 3/m k m o l均相混合物的密度ρ即为各组分质量浓度的总和(体积与混合物相等)∑=++=iB A CC C ........ρρA V m a V m C A A A ===C x V n x V n C A A A A ===混合气体 RTp V n C A A A ==RTp MVn M Vm C AAAA A A ===气体总摩尔浓度 RTp Vn C ==摩尔分率与分压分率相等 pp nn y A A A ==气体混合物摩尔比可用分压比表示 BB A A BB A A BA Mp M p Mn M n n n Y ===第二节 扩散原理8-3 基本概念和费克定律分子扩散: 扩散速率与浓度梯度成正比 费克定律: 对双组分物系下表达为: dzdl D J A ABA -=A J —分子A 的扩散通量 s m kmol ⋅2/ 方向与浓度样应相反 AB D —比例系数 组分A 在介质B 中的扩散系数 s m /2A c —组分A 浓度,3/m kmoldz dc A —组分A 的浓度梯度 4/m kmol RTp c A A =得 dzdp RTD J AAB A -=定义A J 通过得截面是“分子对称”得,即有一个A 分子通过某一截面,就有一个B 分子反方向通过这一截面,填补原A 分子得空部位,这种分子对称面为固定时,较为简便。
化工原理,第8-9章

第八章 传质过程导论第一节 概述8-1 化工生产中的传质过程均相物系的分离(提纯,回收)1.吸收2.气体的减湿3.液-液萃取4.固-液萃取(浸沥,浸取)5.结晶6.吸附(脱附)7.干燥 8精馏 目的:湿分离或混合8-2 相组成的表示法1. 质量分率和摩尔分率m m a A A =m ma B B = mm a C C = ………. ......+++=C B A m m m mA,B 两组分 a a -1 n n x A A =n nx B B = nn x C C = ……. ......+++=C B A n n n n .......1+++=C B A x x x互换 A A A A A m m a m m x ==BB B m ma x = ……. ∑=++=i i i B B A A m a m m m a m m a n ...... ()....,,C B A i = 故 ∑==i iiAAA A m a m a n n x iiiA A A m x m a a ∑=2.质量比和摩尔比质量比 B A m m a /=摩尔比 B A n n X =()a a a -=1 ()x x X -=1()X X x -=13.浓度质量浓度 V m C A A = 3/m kg摩尔浓度 V n C A A = 3/m k m o l均相混合物的密度ρ即为各组分质量浓度的总和(体积与混合物相等)∑=++=i B A C C C ........ρρA V ma V m C A A A ===C x V n x V n C A A A A ===混合气体 RTp V n C A A A ==RTp M V n M V m C AA A A A A ===气体总摩尔浓度 RTpV n C ==摩尔分率与分压分率相等 pp n n y AA A ==气体混合物摩尔比可用分压比表示 BB AA B B A A B A M p M p M n M n n n Y ===第二节 扩散原理8-3 基本概念和费克定律分子扩散: 扩散速率与浓度梯度成正比 费克定律: 对双组分物系下表达为: dzdl D J AABA -= A J —分子A 的扩散通量 s m kmol ⋅2/ 方向与浓度样应相反 AB D —比例系数 组分A 在介质B 中的扩散系数 s m /2A c —组分A 浓度,3/m kmoldz dc A —组分A 的浓度梯度 4/m kmol RT p c A A =得 dzdp RT D J AAB A -= 定义A J 通过得截面是“分子对称”得,即有一个A 分子通过某一截面,就有一个B 分子反方向通过这一截面,填补原A 分子得空部位,这种分子对称面为固定时,较为简便。
《化工原理》8传质过程导论2

统为单向扩散时(B为停滞组分), J A = J B
NA >NBຫໍສະໝຸດ 传质通量(总通量)等于扩散通量的条件是:等摩尔相互扩散
双组分气体混合物中,组分A的扩散系数是:
(A)系统的物质属性
(B)组分A的物质属性
(C)只取决于系统的状态 (D) 以上三者都不是
College of Power Engineering NNU WANG Yanhua
pB1
p pA2 p pA1 ln p pA2 p pA1
p A1
ln p
p pA1
ln
2 101.3
100.5kPa
101.3 2
D N ART(z2 z1) pBm P( pA1 pA2 )
7.7 107 8.314 293 (0.022 0.01) 100.5
101.3 (2 0) 1.12105 m2 / s
D2
D1
p1 p2
T2 T1
1.75
二、液体中的D 约10-5cm2/s
分子密集 D液<D气
计算:经验公式,p11式(8-23) 或表8-4
【例】: 在一直立的毛细玻璃管内装有乙醇,初始液面距离管 口10mm,如图所示。管内乙醇保持为293K(乙醇饱和蒸汽压为 1.9998kPa),大气压为101.3kPa。当有一空气始终平缓吹过管 口时,经100小时后,管内乙醇液面下降至距管口21.98mm处。
D RTZ
P pBm
( pA1
pA2 )
气相
NAL
D z
L
c csm
cAq
cA2
L
液相
与等摩尔相互扩散相比多了一个因子p/pBm——漂流因数。 漂流因数反映总体流动对传质速率的影响。 p/pBm>1 传质速率较大。 若pA p/pBm;反之pA p/pBm≈1
化工原理(下册)教学课件

2.再沸器的热负荷
QB V IVW WI LW LI Lm QL
ILW ILW, V L W
QB V IVW ILW QL
Wh
QB I B1 I B2
精馏过程的节能:
热泵精馏 多效精馏
间歇精馏
特点:①非稳态过程。釜液随时间变 化,塔内操作参数也随位置和时间变 化。②只有精馏段。
CD cSml
(Re
L
)0.67
(
ScL
)0.33
(Ga
)0.33
式中:特征尺寸l为填料直径m。
㈣ 经验公式
⑴ 用水吸收氨:主要阻力在气膜,气膜吸收经验式为:
kG a 6.07 10 4 G 0.9W 0.39
( kmol /(m3 h kPa) )
式中:G__气相空塔质量速度,kg /(m2 h)
基本操作方式:①馏出液组成恒定, 回流比不断加大。②回流比恒定,馏 出液浓度不断变小。
回流比恒定时的间歇精馏计算
1.理论板层数
①先计算最小回流比,最确定R
Rm in
xD1 yF yF xF
R 1.1 ~ 2Rmin
②图解理论板层数
2.操作每一瞬间如下图所示 3.各参数关系式
ln F xF dxW
kLa cW 0.82
1/ h
kmol /(m3 h kPa)
式中:c为常数,
温度 10℃ 15℃ 20℃ 25℃ 30℃
c
0.0093 0.0102 0.0116 0.0128 0.0143
适用条伴:①气体的空塔质量速率G为320-4150kg/(m2.h) ,液体的 空塔质量速率W为4400-58500kg/(m2.h) ;②直径为25mm的环形 填料。
化工原理-第八章-第八章

组成
pG pi
又 根 据 膜 模 型 的 假 定 , 可 知
Ci
气相主体
传质方向 液相主体
ci Hpi
CL
dG
dL
z
距离
双膜模型
NA
pG pi 1
ci
cL 1
kG
kL
pi
p
L
1
Hk L
pG
p
L
11
k G Hk L
pG
1
p
* L
总推动力 总传质阻力
KG
--------以分压差为推动力的气相总吸收速率方程
CA HpA
亨利定律
溶 解 度 系 数 , k m o l/( m 3 P a )
是物性,通常由实验测定。可从有关手册中查得。 H 越大,表明溶解度越大,越易溶 H 随温度变化而变化,一般地,T,H
第二节 吸收过程相平衡
亨利定律的其他形式:
CA HpA
pA
C H
CA C
ExA
E越大,表明溶解度越小; E随温度变化而变化, T,E
根 据 相 律 可 知 ,
自 由 度 数FC2
3223
A
A+B
S
(气体) (液体)
所 有 独 立 变 量 : 温 度 、 总 压 、 气 相 组 成 、 溶 解 度 等
C A fT,P ,pA
在 几 个 大 气 压 以 内 、 温 度 一 定 条 件 下 ,
CA fpA 或 p AgCA
第二节 吸收过程相平衡
mk y k x K x
x y m
第三节 吸收过程模型和传质速率方程
吸 收 速 率 方 程 的 分 析 :
化工原理09-传质概论共32页

(质量分率与比质量分率) 3、摩尔分率xA与摩尔浓度cA
4、质量分率aA与摩尔浓度cA
例:8—1(P4)
浓度 换 算
aA
xA aA
MA aB
MA
MB
Y A 1 yA yA ;
yA 1 Y Y A A ;
CACmxA
CA MA aA
实验室测得在 1at总 m及压温2度0C下1, 00g水中含1g氨 时, 液面上氨的平衡6m分m压 H。为 g求气、液相组摩成皆 尔浓度表示时的关相系平。衡
化工原理
(下册)
第八章:传质过 程导论
化工原理下册——传质过程导论
第八章 传 质 过 程 导 论 第一节 概述 一、传质过程(Mass transfer process) 物质从一相(转移到) 另一相的传递过程
气体的吸收(absorption):分离气体混合物 气—液
气
空气
水
吸收
液
NH3 解吸 NH3
律)
牛顿粘性定律 t - m dur
dr
在一定的T、P及CM下,均相
混合物的分子扩散通量为:
JA - DAB
化工原理 第八章 传质过程导论.doc
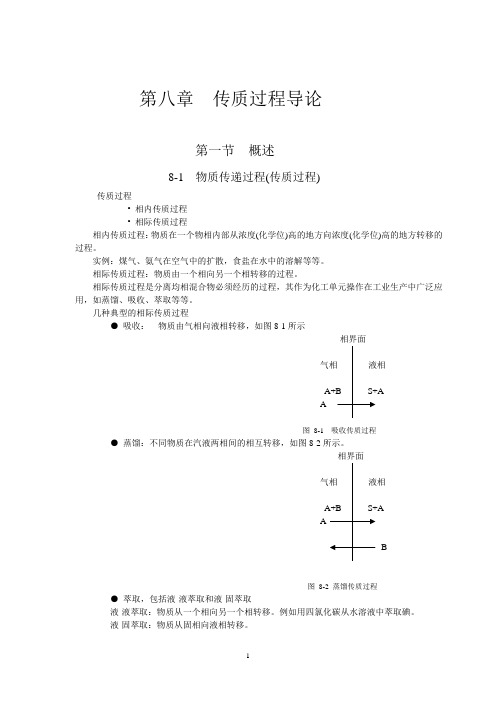
第八章传质过程导论第一节概述8-1 物质传递过程(传质过程)传质过程• 相内传质过程• 相际传质过程相内传质过程:物质在一个物相内部从浓度(化学位)高的地方向浓度(化学位)高的地方转移的过程。
实例:煤气、氨气在空气中的扩散,食盐在水中的溶解等等。
相际传质过程:物质由一个相向另一个相转移的过程。
相际传质过程是分离均相混合物必须经历的过程,其作为化工单元操作在工业生产中广泛应用,如蒸馏、吸收、萃取等等。
几种典型的相际传质过程●吸收:物质由气相向液相转移,如图8-1所示A图8-1 吸收传质过程●蒸馏:不同物质在汽液两相间的相互转移,如图8-2所示。
相界面AB图8-2 蒸馏传质过程●萃取,包括液-液萃取和液-固萃取液-液萃取:物质从一个相向另一个相转移。
例如用四氯化碳从水溶液中萃取碘。
液-固萃取:物质从固相向液相转移。
●干燥:液体(通常为水)由固相向气相转移其它相际传质过程:如结晶、吸附、气体的增湿、减湿等等。
传质过程与动量传递、热量传递过程比较有相似之处,但比后二者复杂。
例如与传热过程比较,主要差别为: (1)平衡差别传热过程的推动力为两物体(或流体)的温度差,平衡时两物体的温度相等;传质过程的推动力为两相的浓度差,平衡时两相的浓度不相等。
例如1atm,20ºC 下用水吸收空气中的氨,平衡时液相的浓度为0.582 kmol/m3 ,气相的浓度为3.28×10 - 4kmol/m3 ,两者相差5个数量级。
(2)推动力差别传热推动力为温度差,单位为ºC ,推动力的数值和单位单一;而传质过程推动力浓度有多种表示方法无(例如可用气相分压、摩尔浓度、摩尔分数等等表示),不同的表示方法推动力的数值和单位均不相同。
8-2浓度及相组成的表示方法1. 质量分数和摩尔分数● 质量分数:用w 表示。
以A 、B 二组分混合物为例,有w A = (8-1)● 质量分数:用x 或y 表示。
以A 、B 二组分混合物为例,有x A = (8-2)2. 质量比与摩尔比 ● 质量比:混合物中一个组分的质量对另一个组分的质量之比,用w 表示。
化工原理第八章

N A dz D
0
C A2
C A1
dC A CA 1 CM
D CM 积分后 N A C (C A1 C A 2 ) BM
C BM
C B 2 C B1 CB2 ln C B1
CM C M 1 , 低浓度吸收 漂流因子 1 C BM C BM
例题:在一个大气压和0℃的条件下CO2沿某一方
y yi x i x y yi m ( x i x ) NA 1 1 1 m ky kx k y kx y ye NA K y ( y ye ) 1 m k y kx
总传质系数
Ky
1 1 m k y kx
同样 NA=KX (xe-x)
2 4
4 N K ( y y ) 2 . 2 10 0.03 传质速率 A y e 6 2 6.6 10 kmol / m s
N A K x ( xe x ) 4.4 10 0.015 6.6 10 kmol / m s
2
4
6
E ②总压增加后,由 m 可知 P P 101.3 m' m 2 1.25 P' 162
Kx
1 1 1 mk y k x
mK y
Ky
1 1 m k y kx
有什么条件?
y mx b
4.2 阻力控制
总阻力
当
1 1 m K y k y kx
气相阻力控制
1 m ky kx
Ky≈ky , Kx≈mky , yi≈ye 条件: m很小(溶解度很大), 例如:水吸收 NH3 ,HCl 等易溶气体
1.388104 (44 28) 2.221103 kg /(m2 .h)
化工原理课后答案(中国石化出版社) 第8章 传质过程导论

本文由tiger2100贡献doc文档可能在WAP端浏览体验不佳。
建议您优先选择TXT,或下载源文件到本机查看。
第八章传质过程导论第八章传质过程导论1.含有 CCl 4 蒸汽的空气,由 101.3kPa(绝)、293K 压缩到 l013kPa(绝)后,进行冷却冷凝,测出 313K 下开始有 CCl 4 冷凝,混合气出冷凝器时的温度为 300K 求: (l)压缩前、压缩后开始冷凝前与出冷凝器时,CCl 4 蒸汽的质量分率、质量比和摩尔浓度。
(2)出冷凝器时 CCl 4 蒸汽冷凝的百分率。
四氯化碳的饱和蒸汽压数据如下: 273 283 288 T /K 293 89.8 300 123 313 210p / mmHg 33.7 注:1mmHg = 133.3 p a55.671.1解:(1)l013kPa(绝),313K 下开始有 CCl 4 冷凝,则210 × 101.3 760 y= = 0.0276 1013 0.0276 × 154 压缩前: a = = 0.131 0.0276 ×154 + (1 0.0276) × 29 0.0276 × 154 a= = 0.15 (1 0.0276) × 29 yp 0.0276 × 101.3 C= = = 1.15 × 10 3 kmol / m 3 RT 8.314 × 293 压缩后开始冷凝前: a = 0.131 , a = 0.15 yp 0.0276 × 1013 C= = = 1.07 × 10 2 kmol / m 3 RT 8.314 × 313 123 × 101.3 760 出冷凝器时: y ' = = 0.0162 1013 0.0162 × 154 a' = = 0.080 0.0162 × 154 + (1 0.0162) × 29 0.0162 × 154 a'= = 0.087 (1 0.0162) × 29第 1 页第八章传质过程导论yp 0.0162 × 1013 = = 6.58 × 10 3 kmol / m 3 RT 8.314 × 300 a a' 0.15 0.087 × 100% = 42% (2) × 100% = a 0.15 C=2.二氧化硫与水在 30℃下的平衡关系为: a (kgSO2 / 100kgH 2 O) 0.1 0.2 0.3 0.5 0.7 52 1.0 79 1.5 1254.7 11.8 19.5 36 试求总压为 101.3kPa(绝)下的 x y 关系,并作图。
《化工原理》8传质过程导论1.

D RT
dpA dz
将上式中的p、z 对应积分,整理得:
D
NA RTz (pA1 pA2 )
同理,组分B有
D
NB
JB
RTz
pB1 pB2
若为液相,则有
D
N A z cA1 cA2
D
NB z cB1 cB2
例1. 氨气(A)与氮气(B)在一等径管两端相互扩散,管 子各处的温度均为298K,总压均为1.013×105Pa。在端点 1处,氨气的摩尔分数yA1=0.15;在端点2处,yA2=0.06, 点1、2间的距离为1m。已知此时扩散系数DAB=2.3×105m2/s。试求A组分的传质通量。
§8-1-2 相组成的表示方法
1、质量分数和摩尔分数
质量分数
wA
mA m
wB
mB m
wi 1
摩尔分数
xA
nA n
xB
nB n
xi 1
相互换算关系:
wA
xA M A
wi
i Mi
(一般液相用x,气相用y)
wA xAM A
xi M i
i
2、质量比和摩尔比(常见于双组分物系)
扩散:物质在单一相内的传递过程
流体中物质扩散的基本方式:
扩散方式 分子扩散 涡流扩散
作用物 流体分子 流体质点
作用方式 热运动 湍动和旋涡
作用对象 静止、滞流
湍流
分子扩散:
推动力 浓度差 物质传递 简称为扩散
终点: 浓度差为〇
扩散快慢?
College of Power Engineering NNU WANG Yanhua
化工原理(第八章传质基础)

3、生物物质的扩散系数 化 工 原 理 对于水溶液中生物溶质扩散系数的估算,当溶质的分子量 小于1000或其分子体积小于500 cm3/mol 时,可用下式计 算:
DAB
1/ T (φM B )T2 −15 = 7.4 ×10 µVA0.6
m2 / s
吉 首 大 学
吉 首 大 学
JA pA1 pB1 JB pA2 pB2
由于总压p=pA+pB为常数,微分则有:0=dpA+dpB DAB=DBA=D
二、扩散系数 化 工 原 理 扩散系数是衡量物质扩散能力的物理性质,单位:m2/s 1、气体中的扩散系数 气体中的扩散系数与其系统、温度和压力有关,其数量级为 10-5m2/s 对于二元气体扩散系数的估算,通常使用富勒(Fuller)公 式:
固相 C
固相 B+A
气相 C+A
液相 A
汽相 精 馏
干 燥
B+A A+B B
三、相组成的表示方法 化 工 原 理 1.质量分率和摩尔分率 混合物中某组分A的质量mA占混合物总重量m的分率,称为 组分A的质量分率 。即: wA= mA/m 混合物中某组分A的摩尔数nA占混合物总摩尔数n的分率,称 为组分A的质量分率 。即: xA= nA/n 2.质量比和摩尔比 以B为参照组分,则质量比:w = mA/mB,摩尔比:X = nA/nB 3.质量浓度和摩尔浓度 单位体积溶液中溶质的质量,称为质量浓度,即: CA=mA/V 单位体积溶液中溶质的摩尔数,称为摩尔浓度,即: cA=nA/V
C (C -C ) A Ai CBm
CA CAi CAi’
δ δ’
’ D’ C (C’ C ) Ai- ’ A C’ δ’ Bm
化工原理讲稿 传质系数和传质理论

适用条件: (1)气体的空塔质量流速G为 320-4150kg/(m2h) (2)液体的空塔质量流速W为 4400-58500 kg/(m2h); (3)直径为25mm的环形填料。
第五节 传质系数和传质理论
3.传质系数的准数关联式 (1) 计算气相传质系数的准数关联式
m2/m3,为填料层的空隙率m3/m3);
U0 -─气体在填料空隙中的实际流速,u0=u/(u为空塔气速m/s);
第五节 传质系数和传质理论
(2)计算液相传质系数的准数关联式
Sh L 0.000595 Re L 0.67 Sc L 0.33 Ga 0.33
液相舍伍德准数
Sh L
kL
cSm c
传质系数和传质理论
一、传质系数 二、 传质理论
第五节 传质系数和传质理论
一、传质系数 传质系数的影响因素 ➢物系的性质 ➢填料的结构 ➢操作条件 传质系数的来源
➢实验测定 ➢经验公式 ➢准数关联式
第五节 传质系数和传质理论
1.传质系数的实验测定 由填料层高度计算式:
h V Yb Ya KY a Ym
➢ 由此理论所得的传质系数计算式形式简单,但等效膜层厚度 1 和 2 以及界面上浓度 pi 和 Ci 都难以确定;
➢ 双膜理论存在着很大的局限性,例如对具有自由相界面或高度湍动 的两流体间的传质体系,相界面是不稳定的,因此界面两侧存在稳 定的等效膜层以及物质以分子扩散方式通过此两膜层的假设都难以 成立;
➢ 该理论提出的双阻力概念,即认为传质阻力集中在相接触的两流体 相中,而界面阻力可忽略不计的概念,在传质过程的计算中得到了 广泛承认,仍是传质过程及设备设计的依据;
第五节 传质系数和传质理论
化工原理第8章

化学反应工程导论
“化学反应工程”主要解决下列问题: • 反应过程解析 • 反应技术开发 • 反应器设计 它涉及诸多有关学科理论,是一门多科性 的交叉学科。
化学反应工程涉及学科:
• 化学(化学热力学,化学动力学) • 化工传递过程(反应器中流体流动,混合传热与 质) • 化学工艺学(反应工艺路线及设备) • 工程控制论(反应过程动态特性,反应过程的测 量与反应过程最佳化)
• 选择性
生成目的产物消耗关键组分的量 v A nP 已转化的关键组分量 v P n A,o n A
转化率x、收率φ、选择性β三者之间的关系
φ=βX
§3 流动系统的反应动力学
3-1 流动系统的反应动力学和反应时间
• 设物料的总体积流量为qv,0,反应物的起始浓度为: cA,0,当物料通过微元体积dVR时,反应物的转化 率由xA → xA+dxA
混流;当N=∞时,类似于活塞流反应器。
• 之所以要引入多釜串联模型,是因为釜数本身可 以反映出实际流动情况偏离活塞流或偏离全混流 的程度。
§5 反应器内物料的停留时间分布
“分布”的概念:
工程数学的分支之一——概率论与数理统计,
是一门研究偶然现象规律性的学科。由于物料微
团在反应器中的停留时间,也是一种偶然现象。
§4 反应器内物料的流动模型 4-1 全混流模型
在连续搅拌釜内,可视为理想混合反应 器,或称为全混流反应器。在这种釜内,可 以认为进入反应器的物料瞬间混合均匀,立 即均匀分散在整个反应器里。由于连续进料 也连续出料,致使物料微团在反应期内的停 留时间长短不一,从0~∞都有。是一种极端流 动模型之一。
例如,公园入口处一下子进来了100名学生(红色运动服者), 公园出口处的人流量为200人/分钟,10分钟后,公园出口走出 了五名学生,学生在出口人流中所占的分率为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
❖组分在液体中的扩散系数比在气体中的小得多 ; ❖与温度成正比,与粘度成反比; ❖一般为10-9m2/s。
第二节 扩散与单相传质
四、涡流扩散与对流传质
1.涡流扩散(Eddy Diffusion) 流体质点在浓度梯度方向上的脉动所造成的物质向浓度降 低方向的传递称为涡流扩散。
涡流扩散通量可借用费克定律的形式来表达,即
)(C A1
CA2 )L
CSm
CS 2 ln
CS1 CS 2
CS1
C
──扩散初、终截面处溶剂浓度的对数平均值,mol/m3;
Sm
C ──漂流因子,无因次。 CSm
第二节 扩散与单相传质
讨论: ❖漂流因子大于1; ❖单向扩散速率大于分子扩散速率; ❖A的浓度很低时,单向扩散速率近似等于分子扩散速率。
RT
pB2 pB1 ln pB2
pB1
第二节 扩散与单相传质
令
pBm
pB2 pB1 ln pB2
pB1
NA
D
RT
(
p pBm
)( pA1
pA2 )
p Bm ──扩散初、终截面处组分B分压的对数平均值,kpa;
p ──漂流因子,无因次。
pBm
第二节 扩散与单相传质
对液相,同理可得:
N AL
D
( CM CSm
结晶:溶质的过饱和溶液与溶质固体相接触。
第一节 概 述 (Introduction)
和传热速率一样,传质速率也可表示成
传
质
速
率
传质推动力 传质阻力
或
传质速率=传质系数×浓度差
传质过程的进行: 物质由一相内部扩散至两相界面; 物质穿过相界面; 物质由相界面扩散至另一相的内部主体
第一节 概 述 (Introduction)
(三)摩尔浓度和质量浓度
1.摩尔浓度
指单位体积内的物质的量,对A组分
CA
nA V
mol / m3
对于气体混合物(在总压不太高时),若其中组分A的分
压为PA,则可由理想气体定律计算其摩尔浓度
CA
nA V
pA RT
第一节 概 述 (Introduction)
2.质量浓度
指单位体积内的物质的质量,对A组分
J AE
DE
dcA dZ
DE ──涡流扩散系数,m2/s
❖涡流扩散系数不是物性常数;
❖涡流扩散系数与流体的湍动程度有关;
❖涡流扩散系数随位置(离稳定界面的距离)等条件而变。
第二节 扩散与单相传质
湍流流体中在进行涡流扩散的同时、也存在分子扩
散,总扩散通量应为两者之和,即
J AT
(D
DE
)
dcA dZ
N AL
J AL
D
L
(C
A1
CA2 )L
N BL
J BL
D
L
(CB1
CB2)L
摩尔汽化潜热接近相等的二元混合物进行精馏操作时, 在汽、液两相的接触过程中,易挥发的A组分由液相进入 汽相的速率与难挥发的B组分从汽相进入液相的速率大体 相同。因此,无论在汽相中,或者在液相中进行的传质过 程都可视为等分子反向扩散
2.对流传质(Convection Mass Transfer)
流动的流体与壁面(或相界面)之间的物质传递称为对流传 质。当流体是湍流流动时,对流传质是涡流扩散与分子扩散 共同作用的结果。对流传质是相间物质传递的基础。
第二节 扩散与单相传质
对流传质过程分析:
层流底层 分子扩散 过渡区 分子扩散和涡流扩散 湍流主体 分子扩散和涡流扩散
质量比和质量分率的换算关系如下
a a 1 a
a a 1 a
第一节 概 述 (Introduction)
2.摩尔比
X nA nB
摩尔比和摩尔分率的换算关系如下
X x 1 x
x X 1 X
Y y 1 y
x Y 1 Y
本书中用X表示液相组成,Y表示气相组成。
第一节 概 述 (Introduction)
JA
DAB RT
dpA dZ
JB
DBA RT
dpB dZ
这两个通量方向相反,大小相等,若以A的传递方向(Z) 为正方向,则可写出下式:
JA JB
由于总压是常数,所以
dpA dpB
因此
DAB DBA D
第二节 扩散与单相传质
JA
D RT
dpA dZ
传质速率的定义:在任一固定的空间位置上,A在单位时间
p p
pA2 p A1
令
(Z2 Z1)
则
NA
pD
RT
ln
pB2 pB1
第二节 扩散与单相传质
因为截面11 ',22'上的总压相等,即
pA1 pB1 pA2 pB2 p
故 pA1 pA2 pB2 pB1
则
NA
pD
RT
ln
pB2 pB1
( pA1 pA2 ) pB2 pB1
pD( pA1 pA2 )
2.传质过程的应用 主要用于均相物系的分离,根据分离的物系不同,有不 同的单元操作,如常见的蒸馏,吸收,萃取等等,是石油和 化学工业最常用的工业过程。 例如乙烯及汽、煤、柴油的制备; SO2、H2S的吸收等。
第一节 概 述 (Introduction)
3.分类 (1)气(汽)-液接触传质过程
精馏:利用液体混合物中各组分饱和蒸汽压或沸点或挥发 性的差异而将各组分分离开来;
单相内传质机理
分子扩散 对流传质
一、分子扩散与费克定律 1.分子扩散(molecular diffusion)
定义:单一相内、在有浓度差异存在的条件下,分子的 无规则运动造成的物质传递现象。
第二节 扩散与单相传质
2.扩散通量
扩散通量:是指在单位时间内单位面积上扩散传递的物质的 量,其单位为kmol/(m2·S),以J表示。
❖组成的变化对其影响也很小;
❖一般为10-5-10-4m2/s;
❖与压力成反比,与温度的1.75次方成正比。
第二节 扩散与单相传质
2.组分在液体中的扩散系数
第二节 扩散与单相传质
Wilke-Chomg公式估算
DAS
7.4 108 (aM s )0.5T
0.6 A
适用于低分子量的非电解质在很稀溶液中的扩散系数的计算。
界面与液相间的传质 界面与气相间的传质
❖经验或半经验的公式进行估算。
第二节 扩散与单相传质
1.组分在气体中的扩散系数
第二节 扩散与单相传质
福勒(Fuller)半经验公式估算
1.00 107 T 1.75 ( 1 1 )1/ 2
D
MA MB
p[(
)1/ 3 A
(
) ] 1/ 3 2 B
❖误差一般不超过10%;
❖可用于常温及高温,但不适用于低温;
nA n
, xB
nB n
, xC
nC n
,
xA xB xC 1
3.质量分率与摩尔分率的换算
aAm
aA
xA
MA
m ai
MA
ai
Mi
Mi
aA
xAM A xi M i
第一节 概 述 (Introduction)
(二)质量比和摩尔比
若双组分物系由A、B两组分组成,则
1.质量比
a mA mB
第二节 扩散与单相传质
三、扩散系数
❖物质的扩散系数是物质的一种传递属性; ❖同一种物质在不同的混合物中其扩散系数不同; ❖扩散系数受温度、压力及混合物中组分的浓度的影响。
气体中的扩散,浓度的影响可以忽略; 液体中的扩散,浓度的影响不可忽略,压力的影响不 显著。 来源: ❖实验测定;
❖资料及手册中查得;
dCA dZ
对于气体,在总压不太高的条件下
CM
p RT
,CA
pA RT
所以
NA
(
p
pD )(
pA RT
dpA ) dZ
第二节 扩散与单相传质
在稳定状况下,NA=常数,D、P、T也均为常数。对 上式进行积分:
NA
Z2 dZ
Z1
pD RT
dp p A2
A
p A1 p pA
NA
pD ln
RT (Z2 Z1)
第八章 传质过程概论
(Introduction to Mass Transfer )
中国石油大学(华东)
2007年3月
第八章 传质过程概论
主要内容:
第一节 概述 第二节 扩散与单相传质 第三节 质量、热量和动量传递类比
第一节 概 述 (Introduction)
一、传质过程及其分类
1.什么是传质? 当不平衡的两相进行接触时,就会有一个或多个组分从一 个相传入另一个相中,物质从一相传递到另一相中的过程称 为相间质量传递,简称传质。
二、相组成的表示方法
(一)质量分率和摩尔分率 1.质量分率
质量分率为混合物中某组分的质量占总质量的分率或百分率。
aA
mA m
, aB
mB m
, aC
mC m
,
aA aB aC 1
第一节 概 述 (Introduction)
2.摩尔分率
指混合物中某组分的摩尔数占总摩尔数的分率或百分率。
xA
pA1 pB1 1 P
A B
F F’
pA2
pB2 2
P
第二节 扩散与单相传质
2.一组分通过另一停滞组分的扩散 (单向扩散)
❖可溶组分(溶质)A;
❖惰性组分B;
❖平面22'为气液界面;
