高中化学 第二章4 化学反应进行的方向练习(含解析)新人教版选修4
人教版高中化学选修四同步练习(有解析)2.4化学反应进行的方向.docx

高中化学学习材料鼎尚图文收集整理第四节化学反应进行的方向1.下列过程属于熵增加的是()A.固体物质的溶解 B.冰的熔化C.水蒸气变为液态水 D.碘蒸气的凝华2.下列说法中,正确的是()A.化学反应总是伴随着能量变化的B.只有放热反应才能够自发进行C.能够自发进行的反应不一定都是放热反应D.能够自发进行的反应就一定能够发生并完成3.水的三态的熵值的大小关系正确的是( )A.S(g) < S(1) < S(s) B.S(g) > S(1) > S(s) C.S(g) > S(1) = S(s) D.S(g) > S(s) > S(1) 4.判断反应过程自发性的目的是 ( )A.判断反应的方向B.确定反应是否一定发生C.判断反应过程发生的速率D.判断反应过程的热效应5.下列组合中在任何温度下反应均能自发进行的是()A.△H>0 △S>0 B.△H <0 △S<0C.△H>0 △S<0 D.△H <0 △S>06.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨,s)+ O2(g)= CO2(g);△H = -393.51kJ/molC(金刚石,s)+ O2(g)= CO2(g);△H = -395.41kJ/mol据此判断,下列说法正确的是 ( ) A.石墨的能量比金刚石的低B.石墨的能量比金刚石的高C.石墨转化成金刚石是自发进行的过程D.金刚石转化成石墨是自发进行的过程7.已知反应2A(g)=2B(s)+C(g) △H= +122 kJ·mol-1,△S= -231 J·mol-1·K-1,则下列判断正确的是( )A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行C.仅在高温下自发进行 D.仅在低温下自发进行8.判断下列反应的熵值变化,在每个方程式后面的横线上填上“增大”、“减小”或“不变”。
人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题

绝密★启用前人教版高二化学选修4 第二章 第四节化学反应进行的方向练习题试卷副标题注意事项:1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上第I 卷(选择题)请点击修改第I 卷的文字说明 一、单选题1.下列过程为自发过程的是①铵盐溶解②烧碱与盐酸的反应③锌与稀硫酸的反应④氢气在氧气中燃烧⑤镁在空气中燃烧⑥铝热反应⑦墨水在水中扩散⑧电解熔融氯化钠A . ①②③④B . ⑤⑥⑦⑧C . ②④⑥⑧D . ①②③④⑤⑥⑦ 2.能用焓判据判断下列过程方向的是( ) A . 湿的衣服经过晾晒变干 B . 硝酸铵溶于水C . 100℃时水蒸气凝结成水D . 25℃、101kPa 时,2N 2O 5(g )=4NO 2(g )+O 2(g )△H=+56.76kJ/mol 能自发进行 3.下列说法不正确的是( )A . 根据化学反应速率可以判断反应物转变为生成物的难易B . 根据△H 可以判断此反应是放热反应还是吸热反应C . 根据熵变这一个量不可以判断所有化学反应能否自发进行D . 根据化学平衡常数可以判断化学反应进行的程度4.金属锡的冶炼常用焦炭作还原剂,反应方程式为SnO 2(s )+2C(s)=Sn(s)+2CO(g)↑反应过程中能量的变化如图所示。
下列有关该反应的ΔH 、ΔS 的说法中正确的是( )…线…………○………线…………○……A.ΔH<0 ΔS<0B.ΔH>0 ΔS<0C.ΔH>0 ΔS>0D.ΔH<0 ΔS>05.25℃、101kPa时,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol自发进行的原因是()A.是吸热反应B.是放热反应C.是熵减小的反应D.熵增大效应大于能量效应6.下列各项判断完全正确的是()A.A B.B C.C D.D7.下列反应为吸热反应且能自发进行的是()A.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)B.NH4HCO3(s)+CH3 COOH( aq)=CH3 COONH4( aq)+ CO2(g)+H2O(l)C.2H2(g)+O2(g)=2H2O(l)D.2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)8.在图(1)中的A、B两容器中,分别收集着两种互不作用的理想气体。
化学人教版选修4素材:教材习题点拨第二章第四节化学反应进行的方向含解析

教材习题点拨
学与问
由熵判据:自发过程的体系趋向于由有序转变为无序,导致体系的熵增大,ΔS>0体系的混乱度增大,有利于反应自发进行;当离子反应生成气体时,反应后体系的熵显著增加,从而使得反应能自发进行。
体现出理论对实践的指导作用。
教材习题答案与点拨
1.铵盐溶解常常是吸热的,但它们都能在水中自发地溶解。
把两种或两种以上彼此不发生反应的气体依次通入到同一个密闭容器中,它们能自发地混合均匀。
2.凡能够使体系能量降低、熵增大的反应方向,就是化学反应容易进行的方向。
但对具体反应,需应用综合判据ΔG=ΔH-TΔS进行分析,不要片面地做出结论。
1。
人教版高中化学选修42.4化学反应进行的方向练习题word版试题含解析
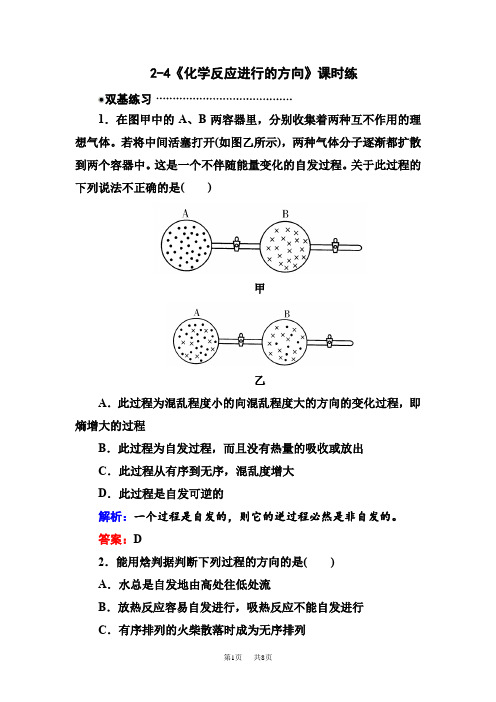
2-4《化学反应进行的方向》课时练双基练习1.在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。
若将中间活塞打开(如图乙所示),两种气体分子逐渐都扩散到两个容器中。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是()甲乙A.此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的解析:一个过程是自发的,则它的逆过程必然是非自发的。
答案:D2.能用焓判据判断下列过程的方向的是()A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大解析:水总是自发地由高处往低处流,有趋向于最低能量状态的倾向。
有些吸热反应也可以自发进行,例如,在25℃和1.01×105Pa 时,2N2O5(g)===4NO2(g)+O2(g)ΔH=+56.7kJ/mol,(NH4)2CO3===NH4HCO3(s)+NH3(g)ΔH=+74.9kJ/mol,不难看出,上述两个反应都是吸热反应,又都是熵增加的反应,显然只根据焓变来判断反应进行的方向是不全面的。
有序排列的火柴散落时成为无序排列,有趋向于最大混乱度的倾向,属于熵判据。
扑克牌的无序排列也属于熵判据。
答案:A3.在298 K时,NaCl在水中的溶解度为26 g。
如将1 mol NaCl 溶解在1 L水中,此溶解过程中体系的ΔH-TΔS和熵如何变化() A.ΔH-TΔS>0,ΔS<0B.ΔH-TΔS<0,ΔS>0C.ΔH-TΔS>0,ΔS>0D.ΔH-TΔS<0,ΔS<0解析:NaCl(s)溶解于水中是自发进行的过程,故ΔH-TΔS<0;NaCl(s)===NaCl(aq),体系的混乱度增大,ΔS>0。
答案:B4.(潮州高二检测)水的三态的熵值的大小关系正确的是(S m表示1 mol物质的熵值)()A.S m(s)>S m(l)>S m(g) B.S m(l)>S m(s)>S m(g)C.S m(g)>S m(l)>S m(s) D.S m(s)=S m(l)=S m(g)解析:同一种物质处于气态时熵值最大,液态次之,固态时熵值最小。
2019版化学人教版选修4训练:第2章 第4节 化学反应进行的方向 Word版含解析.pdf

第四节 化学反应进行的方向课时过关·能力提升一、基础巩固1.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解正确的是( )A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一个重要因素D.焓变是决定反应是否具有自发性的唯一判据2.下列关于化学反应熵变的叙述正确的是( )A.化学反应的熵变与反应的方向无关B.化学反应的熵变直接决定了反应的方向C.熵值增大的反应都是混乱度增大的反应D.熵值增大的反应都能自发进行,即ΔS>0的反应容易自发进行,所以熵变与反应的方向有关;熵变是反应能否自发进行的一个因素,但不是唯一因素,所以B错误;自发反应不一定ΔS>0,故D错误。
3.下列关于自发过程的叙述中,正确的是( )A.只有不需要任何条件就能够自动进行的过程才是自发过程B.需要加热才能够进行的过程肯定不是自发过程C.同一可逆反应的正逆反应在不同条件下都有自发的可能D.非自发过程在任何条件下都不可能变为自发过程ΔH-TΔS<0,它是受温度这一外界条件影响的,不是一成不变的。
4.金属锡的冶炼常用焦炭作还原剂:SnO 2(s)+2C(s)Sn(s)+2CO(g),反应过程中能量的变化如图所示。
下列有关该反应的ΔH、ΔS的说法中正确的是( )A.ΔH<0,ΔS<0B.ΔH>0,ΔS<0C.ΔH<0,ΔS>0D.ΔH>0,ΔS>0(s)+2C(s)Sn(s)+2CO(g),该反应是体积增大的反应,所以是熵增加的反应,故ΔS>0;从图中可知,反应物能量低,生成物能量高,该反应是吸热反应,故ΔH>0。
5.能用焓判据判断下列过程方向的是( )A.湿的衣服经过晾晒变干B.硝酸铵溶于水C.100 ℃时的水蒸气凝结成水D.25 ℃、101 kPa时2N 2O5(g)4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行,该过程虽然吸收热量,但熵值增大,不能用焓判据解释;B项,硝酸铵溶于水是熵增大的过程,不能用焓判据解释。
高中化学 2.4化学反应进行的方向习题 新人教版选修4-新人教版高二选修4化学试题

2.4化学反应进行的方向一、选择题(本题包括12小题,每小题5分,共60分)1.下列说法正确的是( )A.放热反应的焓变小于零,熵变大于零B.放热及熵增加的反应,一定能自发进行C.放热反应的焓变大于零,熵变小于零D.放热及熵减小的反应,一定能自发进行【答案】B2.下列关于判断过程的方向的说法正确的是 ( )A.所有自发进行的化学反应都是放热的反应B.高温高压下使石墨转化为金刚石的反应是自发的化学反应C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程D.同一物质的固、液、气三种状态的熵值相同【答案】C3.下列变化过程中,ΔS<0的是( )A.氯化钠溶于水B.NH3(g)与HCl(g)反应生成NH4Cl(s)C.干冰(CO2)的升华D.CaCO3(s)分解为CaO(s)和CO2(g)【答案】B4.(双选)已知石墨、金刚石燃烧的热化学方程式分别为C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1关于金刚石和石墨的相互转化,下列说法正确的是( )A.石墨转化成金刚石是自发进行的过程B.石墨比金刚石能量低C.金刚石转化成石墨是自发进行的过程D.金刚石比石墨能量低【答案】BC【解析】由热化学方程式可知,石墨比金刚石能量低,1 mol石墨转化为1 mol金刚石吸收1.91 kJ 的热量,金刚石转化为石墨是放热反应,根据化学反应的能量判据可知此反应是自发进行的反应。
所以B 、C 正确。
5.在如图所示图1中A 、B 两容器里,分别收集着两种互不作用的气体。
若将中间活塞打开,两种气体分子立即都分布在两个容器中(见图2)。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法中不正确的是 ( )A .此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程B .此过程为自发过程,而且没有热量的吸收或放出C .此过程从有序到无序,混乱度增大D .此过程是自发可逆的【答案】 D【解析】 由题意知ΔH =0,ΔS>0,由ΔH -T ΔS 知该过程的逆过程不能自发进行,所以D 错。
2.4 化学反应进行的方向 同步练习(人教版选修4)

基础演练1.下列说法正确的是()A.凡是放热反应都是自发的,凡是吸热反应都是非自发的B.自发反应一定是放热反应,非自发反应一定是吸热反应C.自发反应在恰当条件下才能实现D.自发反应在任何条件下都能实现解析:放热反应常常是容易进行的过程,吸热反应有些也是自发反应;过程的自发性只能用于判断过程的方向,是否能实现还要看具体的条件。
答案:C2.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法正确的是()A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大B.碳酸铵分解是因为外界给予了能量C.碳酸铵分解是吸热反应,根据焓判据不能自发分解D.碳酸盐都不稳定,都能自发分解解析:碳酸铵自发分解,是因为由于氨气的生成而使体系熵增大;有的碳酸盐很稳定,不能自发分解。
答案:A3.在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。
若将中间活塞打开(如图乙所示),两种气体分子逐渐都扩散到两个容器中。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是()A.此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程B .此过程为自发过程,而且没有热量的吸收或放出C .此过程从有序到无序,混乱度增大D .此过程是自发可逆的解析:一个过程是自发的,则它的逆过程是非自发的。
答案:D4.水的三态的熵值关系是( )A .固态>液态>气态B .液态>固态>气态C .气态>液态>固态D .气态>固态>液态解析:同种物质在不同状态下的熵值为气态>液态>固态。
答案:C5.下列反应可能是自发进行的吸热反应的是( )A .NaOH(aq)+HCl(aq)===NaCl(aq)+H 2O(l)B .(NH 4)2CO 3(s)===NH 4HCO 3(g)+NH 3(g)C .2CO(g)+O 2(g)=====点燃2CO 2(g)D .2Al +Fe 2O 3=====高温Al 2O 3+2Fe解析:A 、C 、D 均为放热反应。
高二化学上学期人教版选修4课时作业:第二章第四节化学反应进行的方向【有答案】

高二化学上学期人教版选修4第二章第四节化学反应进行的方向一、单选题1.下列说法中错误的是()A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的△H<0B.加入合适的催化剂能降低反应活化能,从而改变反应的焓变C.若△H<0,△S>0,化学反应在任何温度下都能自发进行D.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H>02.工业上生产环氧乙烷的反应为:2 CH2=CH2 (g) + O2 (g) = 2 (g) ∆H = -106 kJ • mol−1,其反应机理如下:①Ag + O2=AgO2慢②CH2=CH2+ AgO2 = + AgO 快③CH2= CH2 + 6AgO =2CO2 + 2H2O + 6Ag 快下列有关该反应的说法正确的是()A.反应的活化能等于106 kJ·mol−1B.工业上生产环氧乙烷的反应是一个焓减熵增的反应,所以能自发进行C.增大乙烯浓度能显著提高环氧乙烷的生成速率D.理论上0.7 mol 乙烯参与反应最多可得到0.6 mol 环氧乙烷3.已知,凡是气体分子总数增多的反应一定是熵增大的反应。
根据所学知识判断,下列反应中,在较高温度下才能自发进行的是()A .322O (g)=3O (g) ∆H <0B .22CO(g)=2C(s)O (g)+ ∆H >0C .223N (g)3H (g)2NH (g)+ ∆H <0D .32CaCO (s)=CaO(s)CO (g)+ ∆H >0 4.下列过程中熵变为负值的是( )A .液态溴蒸发变成气态溴B .SnO 2(s)+2H 2(g)=Sn(s)+2H 2O(l)C .电解水生成H 2和O 2D .公路上撒盐加快冰融化5.下列叙述正确的是( )A .其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大B .体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律C .判断过程的自发性能确定过程能否发生和过程发生的速率D .催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡6.下列说法中正确的是( )A .合成氨反应选择在400~500℃进行的重要原因是催化剂在500℃左右时的活性最大B .在工业生产条件优化时,只考虑经济性就行,不用考虑环保C .工业合成氨的反应是∆H<0、∆S<0的反应,在任何温度下都可自发进行D .在合成氨中,为增加H 2的转化率,充入的N 2越多越好7.下列说法正确的是( )A .凡是放热反应都是自发的,吸热反应都是非自发的B .自发反应一定是熵增大,非自发反应一定是熵减少或不变C .自发反应在任何条件下都能实现D .自发反应在恰当条件下才能实现8.下列关于化学反应的自发性和进行方向的说法正确的是()A.非自发反应在任何条件下都不能发生B.—定温度下,反应Mg(l) +Cl2(g)==MgCl2(l)的△H<0,△S<0C.由∆G=△H – T△S可知,所有放热反应都能自发进行D.只有不需要任何条件就能够自动进行的过程才是自发过程9.下列有关说法不正确...的是()A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0B.反应CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应ΔH<0C.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0,ΔS>0D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>010.在两个固定体积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H;CO2的平衡转化率a(CO2)与温度的关系如图所示。
高中化学人教版选修4第2章第4节 化学反应进行的方向 例题分析

《化学反应进行的方向》例题分析1.可用于判断化学反应的自发与否的是()A.仅用焓变B.仅用熵变C.仅用焓变与熵变的和D.用ΔH-TΔS【解析】判断一个化学反应的自发与否,仅从焓变或熵变分析是不全面的,用焓变与熵变的和是不正确的,要利用复合判据:ΔH-TΔS,若差为小于零的,则为自发;若差大于零,则为非自发。
【答案】D2.下列对熵的理解不正确的是()A.同种物质气态时熵值最大,固态时熵值最小B.体系越有序,熵值越小;越混乱,熵值越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25℃、1.01×105 Pa时,2N2O5(g)=4NO2(g)+O2(g)是熵增的反应【解析】熵指的是混乱程度,越混乱其熵值越大;对于同一物质,由固→液→气三态熵值逐渐增大,故A、B正确;自发过程是熵增的过程,故C错误;对于D选项中的反应,由于反应后分子数增多,故熵值逐渐增大。
【答案】C3.在298 K及101.325 kPa下发生下列反应:(1)2H2(g)+O2(g)=2H2O(l) (2)CaO(s)+CO2(g)=CaCO3(s) 其熵变分别为ΔS(1)和ΔS(2),则下列情况中正确的是()A.ΔS(1)>0,ΔS(2)>0 B.ΔS(1)<0,ΔS(2)<0C.ΔS(1)<0,ΔS(2)>0 D.ΔS(1)>0,ΔS(2)<0【解析】当反应的气体分子数增多时,熵增加,反之,则减小。
由反应方程式(1)和(2)的各物质的状态分析,上述反应均为熵减小的反应,即ΔS(1)<0,ΔS(2)<0。
【答案】B4.下列说法正确的是()A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向【解析】正确解答本题,首先要明确焓判据和熵判据对化学反应方向的影响,然后利用自由能变化(复合判据)进行综合分析判断,同时要注意催化剂在化学反应中的作用。
20192020学年高中化学第2章第4节化学反应进行的方向练习含解析新人教版选修4

第四节化学反应进行的方向课后篇巩固提升基础巩固1.下列说法不正确的是( )A.铁生锈和氢气燃烧均为自发放热过程B.冰融化的过程中,嫡值增大C.无热效应的自发过程是不存在的D.同一物质固态时爛值最小解析铁生锈和氢气燃烧均为放出热量的自发过程,A项正确;冰融化时有序性减弱,混乱度增加,即嫡值增大,B项正确;物质由有序转化为无序时,不一定发生热效应,如分子的扩散现象,C项错误;同一物质在固态时有序性最高,爛值最小,D项正确。
答案C2.在图1屮A、B两容器里,分别收集着一种理想气体(二者不反应)。
若将中间活塞打开,两种气体分子立即都分布在两个容器中(如图2所示)。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是( )A.此过程是自发可逆的B.此过程从有序到无序,混乱度增大C.此过程为自发过程,而且没有热量的吸收或放出D.此过程是向混乱程度增大的方向变化的过程,即嫡增加的过程解析气体扩散过程中,混乱度增大,即S>O,B项、D项正确;该变化过程自发进行,且没有能量变化,即H=O,C项正确;气体的扩散为自发过程,其逆过程不能自发进行小项错误。
答案A3.下列变化屮,SvO的是()A.-10 °C液态水结冰B.金属钠与水反应C.干冰(CO2)的升华D.CaCO3(s)分解为CaO(s)和CO2(g)解析气体液化、液体凝固是体系混乱度减小的过程,故A项SvO;固体溶解、气体扩散和固体熔化、升华均为体系混乱度增加的过程,故C项S>O;B项中有H2生成,D项中CaCO3固体分解有CO2气体生成,均为爛增过程,S>0o答案A4.能用能量判据判断下列过程方向的是( )A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌毫无规律的混乱排列的几率大解析水总是自发地由高处往低处流,有趋向于最低能量状态的倾向;吸热反应也可以自发进行,例如,在25 °C、1.01 X 105 Pa 时,(NH4)2CO3(s)NH4HCO3(s)+NH3(g) H=+74.9 kJ • moH,不难看出,上述反应是吸热反应,又是爛增的反应,显然只根据焙变來判断反应进行的方向是不全面的;有序排列的火柴散落时成为无序排列,有趋向于最大混乱度的倾向,属于爛判据;扑克牌答案A5.下列关于化学反应的自发性叙述中正确的是( )A.焙变小于0而爛变大于0的反应肯定是自发的B.恰变和爛变都小于0的反应肯定是自发的C.焙变和爛变都大于0的反应肯定是自发的D.爛变小于0而焙变大于0的反应肯定是自发的解析HvO, S>0的反应一定能自发进行;H>0, SvO的反应一定不能自发进行;H>0,S>0的反应,高温下能自发进行,低温下不能自发进行;HvO, SvO的反应,低温下能自发进行,高温下不能自发进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应进行的方向一、选择题1.知道了某过程有自发性之后,则下列说法正确的是( )A.可判断过程的方向B.可确定过程是否一定会发生C.可预测过程发生完成的快慢D.可判断过程的热效应解析:选A。
判断某反应是否自发,只是判断反应的方向,与反应是否一定会发生、反应的快慢、反应的热效应无关。
2.下列关于化学反应焓变的叙述中,正确的是( )A.化学反应的焓变与反应的方向无关B.化学反应的焓变直接决定了反应的方向C.焓变为正的反应都是吸热反应D.焓变为正的反应都能自发进行解析:选C。
反应能否自发进行(反应进行的方向)是由ΔH-TΔS决定的,与ΔH、ΔS和T 都有关。
焓变只表达化学反应是释放能量还是吸收能量,不能用来独立判断反应的自发性。
3.(2019·宜昌高二月考)“熵”表示体系的混乱度,它的符号是“S”。
下列变化中,ΔS<0的是( )A.3Fe(s)+4H2O(g)===Fe3O4(s)+4H2(g)B.2NO2(g)===N2O4(l)C.2IBr(l)===I2(s)+Br2(g)D.(NH4)2CO3(s)===2NH3(g)+CO2(g)+H2O(g)解析:选B。
选项B中的反应是由气体转化为液体,混乱度减小,ΔS<0。
4.下列对熵的理解不正确的是( )A.同种物质气态时熵值最大,固态时熵值最小B.体系越有序,熵值越小;越混乱,熵值越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应解析:选C。
对于同一物质,由固→液→气三态熵值逐渐增大,故A正确;熵指的是体系混乱程度,越混乱其熵值越大,故B正确;自发过程有熵增的倾向,故C错误;对于D选项中的反应,由于反应后气体分子数增多,熵值增大,故D正确。
5.下列反应过程中,ΔH>0且ΔS>0的是( )A.NH3(g)+HCl(g)===NH4Cl(s)B.CaCO3(s)===CaO(s)+CO2(g)C.4Al(s)+3O2(g)===2Al2O3(s)D.HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)解析:选B。
A是熵减的放热反应;C是熵减的放热反应;D是放热反应。
6.25 ℃、1.01×105 Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.76 kJ/mol自发进行的原因是( )A.是吸热反应B.是放热反应C.是熵减反应D.熵增效应大于能量效应解析:选D。
由所给的热化学方程式可知,该反应为熵增加的吸热反应,其中熵的变化是自发进行的原因。
7.下列反应在常温下均为非自发反应,在高温下仍为非自发的是( )A.2Ag2O(s)===4Ag(s)+O2(g)B.2Fe2O3(s)+3C(s)===4Fe(s)+3CO2(g)C.N2O4(g)===2NO2(g)D.6C(s)+6H2O(l)===C6H12O6(s)解析:选D。
A.2Ag2O(s)===4Ag(s)+O2(g)是吸热的熵增反应,在高温下能自发进行,故A不选;B.2Fe2O3(s)+3C(s)===4Fe(s)+3CO2(g)是吸热的熵增反应,在高温下能自发进行,故B 不选;C.N2O4(g)===2NO2(g)是吸热的熵增反应,在高温下能自发进行,故C不选;D.6C(s)+6H2O(l)===C6H12O6(s)是吸热的熵减反应,无论在低温还是高温下均为非自发反应,故D选。
8.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。
目前工业上有一种方法是用CO2来生产燃料甲醇。
一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ·mol-1)的变化。
下列关于该反应的说法中,正确的是( )A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0解析:选C。
根据反应过程中能量变化的情况可知反应物的总能量高于生成物的总能量,反应放热,ΔH<0;该反应发生后气体的物质的量减小,ΔS<0。
9.已知吸热反应2CO(g)===2C(s)+O2(g),设ΔH和ΔS不随温度而变化,下列说法中正确的是( )A.低温下能自发进行B.高温下能自发进行C.任何温度下都能自发进行D.任何温度下都不能自发进行解析:选D。
已知反应2CO(g)===2C(s)+O2(g)的ΔH>0,ΔS<0,所以ΔH-TΔS>0,反应在任何温度下都不能自发进行,A、B、C错误,D正确。
10.反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度下自发向右进行,若反应的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列正确的是( )A.ΔH>0,ΔH-TΔS<0B.ΔH<0,ΔH-TΔS>0C.ΔH>0,ΔH-TΔS>0D.ΔH<0,ΔH-TΔS<0解析:选A。
该反应在一定温度下能够自发的向右进行,这说明ΔH-TΔS一定是小于0,根据方程式可知该反应的ΔS>0,所以如果ΔH<0,则该反应在任何温度下都是自发进行的,而该反应在一定温度下才能自发的向右进行,因此该反应的反应热ΔH>0,故选A。
11.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)===N2(g)+2CO2(g)。
由此可知,下列说法中正确的是( )A.该反应是熵增大的反应B.该反应不能自发进行,因此需要合适的催化剂C.该反应常温下能自发进行,催化剂条件只是加快反应的速率D.该反应常温下能自发进行,因为正反应是吸热反应解析:选C。
只使用催化剂便可使尾气发生转化,故此反应能自发进行。
因反应是气体物质的量减小的反应,故熵减小。
因熵减小不利于反应自发进行,故自发进行的原因是反应放热。
12.下列内容与结论不相对应的是( )以自发进行,A错误;B.硝酸铵溶于水为熵增的过程,B正确;C.对于同一种物质气态时熵值最大,其次是液体、固态,因此H2O(g)变成H2O(l),熵变小于0,C正确;D.由于该反应是放热的熵增反应,因此ΔG=ΔH-TΔS<0,反应在任意温度下都能自发进行,D正确。
二、非选择题13.在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1发生的过程中,能量变化如图所示,回答下列问题。
(1)Q________(填“>”“<”或“=”)0。
(2)熵变ΔS________(填“>”“<”或“=”)0。
(3)该反应________(填“能”或“不能”)自发进行。
(4)升高温度,平衡常数K________(填“增大”“减小”或“不变”),平衡向________方向移动。
解析:(1)根据图像可知,该反应是放热反应,故Q<0。
(2)根据反应特点可知,该反应是熵值增大的反应。
(3)根据ΔG=ΔH-TΔS<0可知,该反应能自发进行。
(4)升高温度,平衡向逆反应方向移动,平衡常数减小。
答案:(1)<(2)>(3)能(4)减小逆反应14.根据所学的知识和经验,判断下列变化在常温下的焓变、熵变及方向性,填表。
变化ΔHΔS方向性H2O(l)―→H2O(g)CaO(s)+SO2(g)===CaSO3(s)2Fe3+(aq)+Cu(s)===2Fe2+(aq)+Cu2+(aq)NH4Cl(s)===HCl(g)+NH3(g)根据常温(298 K)判断ΔH-TΔS的“+”“-”。
答案:变化ΔHΔS方向性H2O(l)―→H2O(g) >0 >0 不能自发CaO(s)+SO2(g)===CaSO3(s) <0 <0 自发2Fe3+(aq)+Cu(s)===2Fe2+(aq)+Cu2+(aq)<0 >0 自发NH4Cl(s)===HCl(g)+NH3(g) >0 >0 不能自发15.32ΔH=+178.3 kJ/mol ΔS =+160.4 J/(mol·K)。
回答下列问题:(1)该反应________(填“能”或“不能”)自发进行。
(2)根据本题反应数据分析,温度________(填“能”或“不能”)成为反应方向的决定因素。
(3)若温度能决定反应方向,则该反应自发进行的最低温度是________(保留一位小数)。
解析:(1)ΔG =ΔH -T ΔS =+178.3 kJ/mol -298.15 K×(+160.4×10-3) kJ/(mol·K)≈+130.5 kJ/mol >0,所以该反应不能自发进行。
(2)因为该反应ΔH >0、ΔS >0,所以根据ΔG =ΔH -T ΔS 可知,在温度较高的时候,ΔG 可能小于0。
(3)根据ΔH -T ΔS <0时,反应可自发进行,则反应自发进行的最低温度T =ΔHΔS ≈1 111.6 K 。
答案:(1)不能 (2)能 (3)1 111.6 K。
