金纳米棒有毒吗
水溶性金纳米棒

金纳米材料是纳米材料的一类,就目前而言,其种类虽然没有磁性纳米材料的丰富,但也有越来越多的金纳米材料开始被广泛应用,本次就分享其中的一种—水溶性金纳米棒。
金纳米棒由于其独特的表面等离子共振(surface plasmon resonance, SPR)性质及良好的生物相容性被广泛地应用于生物医学领域。
相比于其他金纳米结构,金纳米棒的SPR峰随长径比的增高向近红外区红移。
根据长径比不同,金纳米棒的水溶液呈现出蓝色、棕色、棕红色等颜色。
由于可见光不容易穿透生物组织,而高长径比的金纳米棒在近红外区对光的吸收和散射能力都很强,因此对于皮下组织的癌症治疗是很好的选择。
金纳米棒在药物载体、肿瘤诊断、激光热疗、光声成像、计算机断层扫描(CT)成像等研究有广泛的应用。
水溶性金纳米棒的制备方式一般有三种。
第一种是模板法,即在表面活性剂水溶液中,采用电化学和光化学还原法可在多孔氧化铝、聚碳酸酯膜或碳纳米管模板制备金纳米棒,然后通过溶解模板可释放出其中的纳米棒。
这种方式制备的金纳米棒其纳米林的直径会受模板孔径的限制,比较均匀,缺点则是纳米棒的长度难以精确控制。
第二种是电化学合成法,即在一个双电极电化学反应池中,以Au片作为阳极提供金原子,不同链长的阳离子表面活性剂提供棒生长所需的模板,整个反应体系处于超声状态。
以该法合成的金纳米棒,其长径比(AR)可通过调节电流密度进行调控,在电极表面上生成的金纳米棒是在超声作用下进入溶液的。
第三种是种子生长法是在金纳米棒的合成方法中较为常用方法。
一般主分为两步:首先制备小粒径(3 ~4 nm)的球形金纳米颗粒种子,然后在棒状胶束溶液中让制备的金纳米颗粒生长成棒状。
种子生长法使整体的反应速率及生长速率均得以提高;并且其产物的粒径能够通过改变生长液中金盐与纳米颗粒种子的摩尔比例进行控制。
上述是对水溶性金纳米棒的相关介绍,下面介绍一家研发生产纳米材料的公司。
南京东纳生物科技有限公司是一家集产学研于一体的高新技术型企业,主要从事纳米材料及生物医学纳米技术,功能微球、体外诊断试剂与仪器等研发与生产。
纳米金材料的卫生应用

纳米金材料的卫生应用近年来,纳米技术的应用越来越普及,而其中纳米金材料的应用也越来越受到关注。
纳米金材料具有较高的表面积和独特的性质,因此在卫生领域中有着广泛的应用,如医学、食品、卫生用品等。
本文将从不同领域介绍纳米金材料的卫生应用。
一、医学领域纳米金材料在医学领域中已有多种应用。
首先,纳米金材料被用于药物输送系统。
纳米金颗粒具有小的大小和高比表面积,便于药物分子的穿透和传递,因此纳米金材料可以作为药物输送系统的载体,用于治疗癌症、糖尿病等疾病。
其次,纳米金材料也被用于医学影像学。
纳米金颗粒可以强烈吸收X射线,因此可以作为CT扫描剂和X射线对比剂使用。
纳米金颗粒还可以用于MRI成像,因为它们可以产生磁化信号,增强图像的对比度。
另外,纳米金材料还可以用于免疫检测。
纳米金颗粒可以与生物分子如抗体结合,因此可以检测出癌症标志物、病毒和菌类等。
纳米金颗粒的检测灵敏度高、快速和精确,因此被认为是一种有前途的免疫检测方法。
二、食品领域纳米金材料在食品领域中也有广泛的应用。
由于纳米金材料本身不含有毒物质,因此可以用于饮料、糖果、饼干等食品的包装材料中,保持食物的新鲜度和质量。
此外,纳米金材料还可以用于食品质量检测。
例如,纳米金颗粒可以与细菌、病毒结合,实现快速检测食品中的细菌、病毒等有害物质。
三、卫生用品领域纳米金材料还可以用于卫生用品领域。
例如,纳米金颗粒可以用于制造口罩和空气净化器滤网,能够有效地过滤空气中的病毒、细菌、PM2.5等。
而在纺织品上加入纳米金材料可以实现抗菌和抗臭的作用,因此可以用于制造衣物,尤其是运动衣物和内衣物。
总结纳米金材料在卫生领域中有着广泛的应用,不仅在医学、食品、卫生用品领域有着重要的作用,还可以用于环境治理、水处理、能源等方面。
但是需要注意的是,纳米金材料的安全性和环境影响还需要进一步研究和探索。
因此,在纳米金材料的应用过程中,必须重视其安全性和环境影响,以确保其在卫生领域中得到安全、有用和可持续的应用。
金纳米粒子的细胞毒性(一):尺寸的影响

金纳米粒子的细胞毒性(一):尺寸的影响2016-08-16 12:45来源:内江洛伯尔材料科技有限公司作者:研发部AuNPs查阅文献时,在AuNPs的尺寸对细胞作用方面可以看到许多相互矛盾的报道。
例如Pan 等制备了4种1.4nm左右和15 nm多种粒径的金颗粒(AuNPs),他们提出:AuNPs的毒性是尺寸依赖的,1.4 nm时表现最强毒性,尺寸小于或大于1.4 nm时毒性逐渐减弱。
并且提出1.4 nm颗粒的明显毒性主要是因为它可以立体选择性地连接到B-DNA的大沟,从而造成对细胞的损伤。
但是在他们的实验中,在尺寸1.4 nm之外的几个AuNPs(0.8,1.2和1.8 nm)都具有相似毒性,不具有特异性,解释难以令人信服。
他们的实验还表明,当纳米颗粒大于15 nm时,是贴在细胞膜上而无害的,而Connor等则报告18 nm以下的含有各种表面修饰物(如半胱氨酸、柠檬酸钠、生物素和葡萄糖)的AuNPs对于人体细胞是无毒的,其毒性是由于所用的保护剂溴化十六烷基三甲基溴化铵(CTAB)造成的。
如果将CTAB去除干净,那么AuNPs对细胞是无毒的。
Shukla等报道了由赖氨酸加上聚赖氨酸共同修饰的3.5 nm AuNPs不具有毒性和免疫原性。
Soenen等指出AuNPs浓度对细胞毒性的影响。
他们发现4 nm的聚甲基丙烯酸保护的AuNPs在浓度10 nM时,对于多种敏感细胞系没有观察到明显的细胞参数改变,但是当浓度高于200 nM 时则引起明显的细胞毒性,他们认为这是由于增加了活性氧的原因。
Wang等研究了不同形状、作用时间和表面活性剂等与尺寸小于70 nm AuNPs细胞毒性的关系,认为圆形无毒,棒型有毒,而棒型的毒性主要是其保护剂CTAB所造成。
Yen等比较了金和银纳米颗粒对于巨噬细胞(macrophages)的作用,认为带负电的金纳米颗粒比银纳米颗粒毒性更大。
Gu等将24 nm金颗粒通过半胱胺连接到金膜上,然后将此薄膜与猪的肝细胞共培养,发现细胞可以快速增殖,并且很好的保持了其生物代谢功能。
金纳米棒光热效应杀菌

金纳米棒光热效应在杀菌领域的应用是一项备受关注的新兴技术。
这种技术利用金纳米棒对光的局部表面等离子共振现象,产生强热效应,从而实现对微生物的精准热灭活。
以下将深入探讨金纳米棒光热效应杀菌的原理、方法、应用领域以及未来发展趋势。
### **金纳米棒光热效应原理**金纳米棒的光热效应基于表面等离子共振现象。
当金纳米棒暴露在适当波长的光下时,金纳米棒的自由电子与光场耦合,导致电子被激发至高能级。
这个激发状态下的电子会与周围的原子和分子发生碰撞,产生局部升温效应。
由于金纳米棒的形状和尺寸可以调控,可以使其在特定波长范围内表现出明显的等离子共振峰,即光吸收的峰值。
这种局部表面等离子共振效应使金纳米棒在吸收光能的同时,产生局部高温,从而形成光热效应。
### **金纳米棒光热效应杀菌方法**1. **金纳米棒制备:** 首先,通过合成方法制备具有特定形状和尺寸的金纳米棒。
这可以通过溶液法、溶胶-凝胶法等合成技术实现。
2. **表面功能化:** 为了提高金纳米棒在生物体内的稳定性和生物相容性,通常需要对其进行表面功能化处理,例如涂覆生物相容性的聚合物。
3. **光照射:** 将经过功能化处理的金纳米棒添加到杀菌区域,然后利用激光或可见光源照射样品。
由于金纳米棒对特定波长的光吸收强,会发生局部表面等离子共振效应,产生强热效应。
4. **光热效应杀菌:** 金纳米棒的光热效应导致杀菌区域温度升高,微生物在高温下会受到损伤,从而实现光热效应杀菌。
### **金纳米棒光热效应杀菌的应用领域**1. **医学领域:** 金纳米棒光热效应杀菌被广泛应用于医学领域,特别是用于感染性疾病的治疗。
通过调节金纳米棒的形状和尺寸,可以实现对不同病原体的高效灭活。
2. **食品工业:** 在食品工业中,金纳米棒光热效应杀菌可以用于食品的无害化处理,提高食品的贮存期和安全性。
3. **水处理:** 金纳米棒光热效应也可以应用于水处理领域,通过对水中微生物的杀灭,提高水质的安全性。
金纳米粒子的细胞毒性(二):表面电荷及保护剂的影响
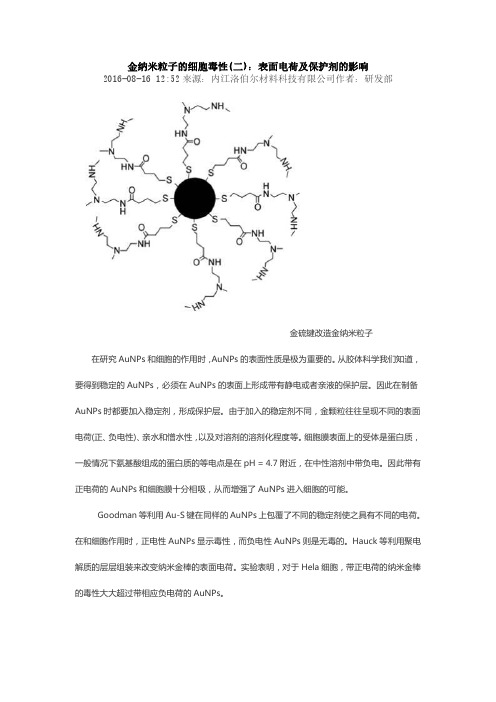
金纳米粒子的细胞毒性(二):表面电荷及保护剂的影响2016-08-16 12:52来源:内江洛伯尔材料科技有限公司作者:研发部金硫键改造金纳米粒子在研究AuNPs和细胞的作用时,AuNPs的表面性质是极为重要的。
从胶体科学我们知道,要得到稳定的AuNPs,必须在AuNPs的表面上形成带有静电或者亲液的保护层。
因此在制备AuNPs时都要加入稳定剂,形成保护层。
由于加入的稳定剂不同,金颗粒往往呈现不同的表面电荷(正、负电性)、亲水和憎水性,以及对溶剂的溶剂化程度等。
细胞膜表面上的受体是蛋白质,一般情况下氨基酸组成的蛋白质的等电点是在pH = 4.7附近,在中性溶剂中带负电。
因此带有正电荷的AuNPs和细胞膜十分相吸,从而增强了AuNPs进入细胞的可能。
Goodman等利用Au-S键在同样的AuNPs上包覆了不同的稳定剂使之具有不同的电荷。
在和细胞作用时,正电性AuNPs显示毒性,而负电性AuNPs则是无毒的。
Hauck等利用聚电解质的层层组装来改变纳米金棒的表面电荷。
实验表明,对于Hela细胞,带正电荷的纳米金棒的毒性大大超过带相应负电荷的AuNPs。
Chompoosor等的工作表明正电荷的金颗粒具有明显的细胞毒性和基因毒性,这种毒性随所用表面活性剂的憎水链长度增加而降低。
Lin等认为正负电性的金颗粒毒性差异主要有两个原因引起,一方面正电荷颗粒相对负电荷颗粒对于细胞膜有更大的黏附力,因此细胞胞吞效率更高,如果正电性AuNPs尺寸大时,则会在细胞膜上产生一个空洞或者损坏。
这属于破坏性胞吞(necrotic endocytosis)机制引起的细胞毒性。
Pernodet等认为由于细胞内金颗粒的存在,肌动蛋白应力纤维消失,因而对细胞活力产生不利反应,导致细胞外基质的性质发生强烈改变,如细胞伸展、黏附、生长及蛋白合成等。
利用高分子作为稳定剂的AuNPs,由于具有更厚的保护层,而且不容易聚集,因此对细胞作用极慢,表现出是无毒的。
金纳米棒

展望与挑战
金纳米棒由于其具有的独特的光学性质,使其在生物标记、生物检测、生物 成像、疾病的治疗以及信息存储等领域有着广阔的应用前景。 如何在一些实验条件包括纳米微粒的吸收和散射截面,以及纳米微粒和靶向 抗体的结合,纳米生物分子结合体对细胞的靶向标记等都还需进一步优化。 近红外光传输到不同癌症病变细胞的最有效方法及金纳米棒光热作用机理还 有待进一步研究。 基于纳米微粒对细胞的光热损伤机制还不能很好地阐述,需要更深层次的研 究。 金纳米棒颗粒的生物无毒化修饰方面还存在着有待解决的困难。
金纳米棒(GNRs)
简介
1971年,Faulk和Taylor首先将胶体金作为标记物引入免疫学研究中。从此, 金纳米粒子引起了许多科学家的关注和世界性的研究热潮。 近年来, 人们对金纳米材料的研究取得了长足的进步, 不但可以制备出不同尺 寸的球形粒子, 还可以对其形貌加以控制, 并且发现了一些特殊的实验现象和 物理性质 。 其中研究最为广泛、最具应用潜力的是金纳米棒( NRs) , 其制备过程中采用 不同的实验参数, 可实现对其比率( 长比宽) 的精确调控。更为重要的是, 金纳 米棒有着独特的光学性质[ 棒状粒子具有横向和纵向表面等离子体共振( SPR) 双谱峰], 且纵向SPR 峰位( 从可见区到近红外区) 取决于棒状粒子的比率, 通 过控制不同比率, 可以实现纵向SPR 峰位置的人为调控。
应用——医疗诊断
纳米金由于体积小,可以被多种基团修饰和其光学特性,成为疾病诊断新的 研究对象。纳米金可以被多种物质修饰获得对肿瘤细胞的靶向性。 其诊断原理如下:①不同直径的纳米金具有特定的吸收光谱,可以对特定长 度的红外线产生吸收的峰值。②由于EGFR抗体修饰的纳米金可以选择性的聚 集于肿瘤细胞中,从而使肿瘤细胞中高浓度的纳米金之间互相作用产生等离 子共振现象,导致其吸光谱发生红移,而正常细胞中由于不存在纳米金或者 纳米金浓度过低难以产生等离子共振现象,因此应用光声和超声波谱诊断法 可以明显的区别肿瘤细胞与正常细胞,使肿瘤细胞清晰地被诊断出。
金纳米棒的制备和应用

金纳米棒的制备及其在生命科学上的应用第一章研究背景金属纳米微粒的研究,尤其是对其形貌可控制备及其相关应用的性质和应用研究一直是材料科学以及相关领域的前沿热点。
非球形的金纳米颗粒如棒、线、管及核壳结构相继被成功合成,其各种性质不仅仅依赖于尺寸而且还依赖于拓扑结构,其中金纳米棒(gold nanorods,GNRs)是最受关注的一类。
金纳米棒是一种尺度从几纳米到上百纳米的棒状金纳米颗粒。
金是一种贵金属材料,化学性质非常稳定,金纳米颗粒沿袭了其体相材料的这个性质,因此具有相对稳定,却非常丰富的化学物理性质。
金纳米棒拥有随长宽比变化,从可见到近红外连续可调的表面等离子体共振波长,极高的表面电场强度增强效应(高至107倍),极大的光学吸收、散射截面,以及从50%到100%连续可调的光热转换效率。
由于它独特的光学、光电、光热、光化学、以及分子生物学性质,金纳米棒在材料科学界正受到强烈的关注,并引发众多材料学家、生物化学家、医学家、物理学家、微电子工程师等科研工作者对之进行广泛和深入的研究。
第二章GNRs的制备及修饰2.1 GNRs的制备近年来,对于金纳米棒的合成已经研究出来许多有效的方法。
主要分为晶种生长法,模板法,电化学法和光化学法等不同方法制备出分散性好颗粒均匀的金纳米棒。
2.1.1 晶种法晶种法研究的时间最长,因此研究的最深入。
晶种可以是球型金纳米粒子,或者是短的金纳米棒。
晶种法合成金纳米棒可以分为三个步骤:晶种的制备、生长液的配置、金纳米棒的生成。
①种子制备:将5mL 0.50 mM氯金酸(HAuCl4)溶液与5 mL 0.2M十六烷基溴化铵(CTAB)混合,加入0.6 mL 冰冻的0.01 M 硼氢化钠(NaBH4)溶液,搅拌2 min 后25℃静置2h。
②生长溶液制备:向反应容器中依次加入5mL 0.20 M CTAB,5 mL 1 mM HAuCl4,0.5 mL硝酸银(AgNO3),0.07 mL 0.10 M抗坏血酸(AA),搅拌2 min。
金纳米棒的光学性质及其在生物医学成像和光热疗法中的应用

激光与光电子学进展47,071702(2010)Las er&Op t oelectronics ProgressΖ2010《中国激光》杂志社doi:10.3788/LOP47.071702金纳米棒的光学性质及其在生物医学成像和光热疗法中的应用杨玉东1,2 徐菁华1 杨林梅1 潘卫三2(1沈阳工业大学理学院,辽宁沈阳110178;2沈阳药科大学药学院,辽宁沈阳110023)摘要 与球形金颗粒相比,棒状金颗粒具有更为特殊的表面等离子体共振(SPR)特性,通过控制不同长短轴比可以实现纵向SPR峰位置的人为调控(从可见光区到近红外光区)。
由于金纳米棒表面SPR的强吸收导致的发光特性,使其在生物组织成像,癌症的诊断和治疗中存在着巨大的应用前景。
结合配体的金纳米棒能够特异性地标记癌症细胞上的受体,并提供特定分子的特有信息,进行生物成像和癌症检测。
另外,金纳米棒能够有效地吸收红外光能量进行局部加热,导致蛋白质变性,并致细胞死亡。
主要回顾各种不同尺寸和形状的金纳米棒的光学特性,综述选择性标记的金纳米棒在生物成像、癌症诊断和光热疗法中的研究进展。
关键词 医用光学与生物技术;金纳米棒;生物成像;光热疗法;癌症中图分类号 R318.51;R392.1 OCIS 170.3880160.4236 文献标识码 AOp t ical P r op e r t ies of Gol d N a n or od a n d It s App lica t i o ni n B i ol ogical I m a gi n g a n d P h ot ot he r m al The r ap yY ang Yudong1,2 Xu J inghua1 Y ang Linmei1 Pa Weisan21College of Scie nce,S he nya ng U niversit y of Tech nology,S he nya ng,Li aoni ng110178,Chi n a2School of Pha r m acy,S he nya ng Pha r m aceutical U niversit y,S he nya ng,Li aoni ng110023,Chi n aAbs t r act Compared with sp herical gold particles,rod2shaped ones exhibit more unique p roperties of surface plasma resonance(SPR).Gold nanorods have two SPR peaks.The lengitudinal suface plasma resonances position depends on rods′aspect ratio.Thus,the LSPR′s position can be cont rolled f rom the visible region to the near inf rared by adjusting the aspect ratio of gold nanorods.Gold nanorods have great potential use in biological tissue imaging,cancer diagnosis and therap y because of it′s SPR and st rong absorption induced luminescence.Au2ligand conjugates can specifically target the receptor on cancer cells,p rovide specific information about specific molecules,and allow molecular2specific imaging and cancer detection.Gold nanorods can efficiently absorb optical energy into localized heat,and induce p rotein denaturation and cells death.The optical p roperties of kinds of gold nanorods are summarized,and the research p rogress of selective targeting of gold nanorods in biological imaging,cancer diagnoses and photothermal therapy is reviewed.Key w or ds medical optics and biotechnology;gold nanorods;biological images;antibody;cancer1 引 言近年来,人们对金纳米材料的研究取得了长足的进步,不但可以制备出不同尺寸的球形粒子,还可以对其形貌加以控制[1],并且发现了一些特殊的实验现象和物理性质[2]。
金纳米簇和金纳米棒

金纳米簇和金纳米棒
金纳米簇和金纳米棒是近年来研究热点,它们具有许多特殊的物理和化学性质,因此在生物医学、光电子学、催化剂等领域具有广泛的应用前景。
金纳米簇是由几个金原子组成的微小团簇,通常直径不超过2纳米。
它们具有高度可控的结构和光学性质,可以用于生物成像、药物传递和光催化等应用。
金纳米棒是细长的金纳米结构,其直径通常在10到50纳米之间,长度可以从几十至几百纳米不等。
金纳米棒的形状和大小对其光学性质和表面等离子体共振效应具有重要的影响,因此可以用于生物成像、肿瘤治疗和光电子学等领域。
近年来,人们还研究了将金纳米簇和金纳米棒结合起来的复合纳米材料,以期能够发挥它们各自的优势,实现更广泛的应用。
总之,金纳米簇和金纳米棒是纳米材料领域中的重要代表,它们为许多领域的研究和应用提供了新的思路和方法。
- 1 -。
金纳米棒在生化分析及癌症治疗中的应用

金纳米棒在生化分析及癌症治疗中的应用摘要:金纳米棒作为一种新型的各向异性纳米材料,由于其独特的光学和光热性能,近几年受到科研人员的大力关注。
与球形纳米颗粒不同,金纳米棒显示出两个特征的横向和纵向表面等离子体吸收峰。
它能够在荧光共振能量转移测定中用作能量受体或将光转化为热能用于光热治疗。
特别地,金纳米棒的可控组装能引起其光学性质发生改变,使其特别适用于检测各种分析物。
金纳米棒在细胞成像和癌症治疗领域的应用,吸引了科学家们强烈的兴趣。
从而推动了金纳米棒的进一步发展,本篇文章总结了近年来金纳米棒及其组装体在生化分析及癌症治疗中的应用。
关键词:金纳米棒;组装;生化分析;光热治疗。
0 前言从上世纪到现在,金纳米粒子一直是纳米科学领域的研究热点。
1990年马丁集团通过电化学还原与棒状“硬模板”法合成了金纳米棒,这为我们研究金纳米棒提供了机会[1]。
1997年,王小组采用十六烷基三甲基溴化铵作为表面活性剂采用电化学方法合成了高分散性的金纳米棒溶液[2]。
直到2001年,Murphy和他的同事们发明了种子介导湿化学合成技术,这种合成方法简单方便,极大地促进了高纵横比金棒的合成[3]。
随后,El-Sayed组使用CTAB-包被的单晶种子代替了柠檬酸盐包被的双晶晶种,这大大提高了合成金纳米棒实验的重现性和产量(产率超过95%)[4]。
到目前为止,金纳米棒的合成技术已经相当成熟,但合成机制仍然存在争议[5]。
已经提出了使用混合表面活性剂为软模板采用电化学还原法合成金棒的机制。
还有一些研究人员认为在金棒的合成过程中,CTAB 胶束本质上是棒状的,使得金棒以此为软模板生长。
尽管已知CTAB在特定的条件下能形成棒状胶束,但不清楚棒状胶束在合成条件下是否也形成了[6]。
然而,Murphy 及其合作者认为CTAB分子偏向于优先物理吸附到金棒的长轴上。
因此,目前关于其生长机制存在许多争议[7]。
1现在,对金棒的研究兴趣主要集中在组装和应用方面(包括传感,成像和治疗癌症)[8]。
金纳米棒的合成及应用研究

金纳米棒的合成及应用研究刘丹丹;刘山虎;祁志冲;田淑芳;周朵;邢瑞敏;SEKAR Karthi;PERIYASAMY Velusamy;KRISHNAN Srinivasan;侯亚彬【摘要】金纳米棒具有独特的物理化学性质和良好的生物相容性,在众多的各向异性金纳米结构中引起了研究者的关注.本文综述了金纳米棒的各种制备方法,详尽评价了种子法制备金纳米棒过程的影响因素,介绍了金纳米棒用作药物载体和癌症的光热治疗方面的应用进展,并对金纳米棒的研究前景进行了展望.【期刊名称】《化学研究》【年(卷),期】2018(029)004【总页数】7页(P415-421)【关键词】金纳米棒;制备;药物载体;光热治疗【作者】刘丹丹;刘山虎;祁志冲;田淑芳;周朵;邢瑞敏;SEKAR Karthi;PERIYASAMY Velusamy;KRISHNAN Srinivasan;侯亚彬【作者单位】河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学化学化工学院,河南开封 475004;河南大学实验室与设备管理处,河南开封 475004【正文语种】中文【中图分类】O613;TB33纳米材料已经成为当代材料科学研究中的热门领域,给化学、生物、光电、物理、化学、医药和材料等学科带来了深远的影响[1-7]. 贵金属纳米粒子具有特殊的物理化学性质,目前在信息存储、光电子学、光催化、生物标记和表面增强拉曼散射等领域得到了长足的进展[8-12]. 其等离子体共振峰(surface plasmon resonance, SPR)的峰位、数目以及表面增强的拉曼散射的有效光谱范围等特征决定了其能否用于生物医学领域与药物载体及癌症的热治疗;这些特征都可以通过控制金属纳米结构的尺寸和形状进行调控 [13-14]. 金纳米棒由于其表面周围的电磁场而呈现出非常有趣的非线性光学性能,该特征可以作为使用超短激光脉冲的生物成像的替代技术;经近红外激光照射后,金纳米棒具有从可见区到近红外区的吸收特性使得光能可以高效地转换为热能,可以进行激光选择性局部加热. 据此原理可以对癌细胞进行选择性破坏,而不损坏正常细胞.图1 不同pH条件下各种形状的金纳米棒Fig.1 Various shapes of gold nanorods under different pH在光学性能上,金纳米棒具有两个共振峰SPRL峰和 SPRT峰,分别对应于纵向和横向SPR. 金纳米棒的 SPRT在~520 nm,而其SPRL峰的可调性很强,可以根据需要,通过改变金纳米棒长径比(AR),使其SPRL峰在近红外光区附近的较大范围内调制[15]. 金纳米棒的形状有各种各样,通过改变反应条件,可以得到的,如亚铃形、端头圆形、狗骨头形、长方形以及尖头形等[16],如图1所示.金纳米棒的合成方法包括电化学方法、模板法、晶种生长法,本文对其合成方法进行了简要综述,详细介绍了种子法制备金纳米棒过程的影响因素,介绍了金纳米棒药物输运和光热治疗方面的应用进展.1 金纳米棒的制备1.1 电化学方法电化学方法的主要原理是:在电解池中以金片作阳极、铂片作阴极,放入由阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)和助表面活性剂四辛基溴化胺(TC8AB)组成的电解质溶液,并在控温和超声的辅助下电解. 另外,电解液中可以加入适量的丙酮和环己烷,环己烷的作用是协助形成较长的棒状CTAB胶束,有利于纳米棒的生长. 在阳极溶出的金在阴极-电解质溶液界面被还原,从而形成金纳米颗粒,在此过程中通常会出现球状颗粒. CTAB不仅有支撑电解质的作用,条状的胶束模板也可有效避免金颗粒的团聚;TC8AB的作用是可以促使金纳米棒的形成,二者的比例共同决定着金纳米棒的纵横比. 较早提出并使用电化学法合成金纳米棒的是CHANG等[17-18],他们发现银离子的存在对于棒的形成十分重要,但其生长机理和银离子的作用目前仍不太清楚.1.2 模板法模板法分为软模板法和硬模板法两种. 软模板法主要是用各式各样的还原方法使金的晶粒沉积在胶体团簇的核上或DNA链的表层上从而构建成金纳米棒;硬模板法主要是以多孔氧化铝薄膜为模板,用电化学沉积的方法在薄膜上的孔道内把金离子还原构建成金纳米棒,溶解氧化铝就可以得到单分散的金纳米棒,图2为合成方法示意图[19-21]. MARTIN等较早使用模板法来制备金纳米棒[22-23]. 此方法不仅可以制备金纳米棒,也可以广泛应用于金纳米管和其他管状的纳米结构及其复合材料的制备中[24-25],但是产量较低,且操作步骤较繁琐.图2 (a)Au NRs 的模板制备法流程图;氧化铝模板(b)和金纳米棒阵列(c)的扫描电镜(SEM)图Fig.2 (a) AuNRs template preparation method flow chart; Alumina template(b) and gold nanorod array(c)1.3 种子生长法晶种生长法主要是在MURPHY[26]、EL-SAYED[27]和CHAN等 [28]的研究基础上发展起来的. 种子生长法包括种子溶液的制备和生长步骤,图3为晶种生长合成金纳米棒的示意图[29]. 种子溶液的制备:将氯金酸(HAuCl4)溶解到CTAB水溶液中搅拌均匀,然后将冰冻的硼氢化钠(NaBH4)溶液迅速加入上述混合溶液中,剧烈搅拌,所得种子溶液老化30 min左右备用. 生长溶液由CTAB、HAuCl4和硝酸银(AgNO3)溶液配成,并向溶液中加入抗坏血酸(AA)作为中间还原剂. 最后,将一定量的种子溶液加入到先前制备的生长溶液中,在30 ℃下的水浴锅静置12 h. 图3 晶种生长合成金纳米棒的示意图Fig.3 Schematic illustration of the seed-mediated method for the growth of Au nanorods晶种在表面活性剂分子的辅助下完成了定向生长,通过改变加入晶种的多少、各种反应物的量、Ag离子和溶液pH等参数可以调节金纳米棒的横纵比. YE等[30]通过向生长液中加入一定量的芳香族添加剂,将传统实验中使用CTAB的浓度由0.1 mol/L降至约0.05 mol/L. 他们研究了11种芳香族添加剂,获得SPRL峰可在627 nm到1 246 nm区间内变化的且分散性较高的金纳米棒胶体. 若添加一定量的有机酸,可以得到SPR峰大于700 nm的金纳米棒. 如图4所示,YE等[31]又在添加芳香族分子的基础上改用CTAB和油酸钠(NaOL)二元表面保护剂,合成出的金纳米棒的产率有了很大的改进, 二元表面保护剂方法可以解决单一表面保护剂时很难合成形貌均匀且大直径的金纳米棒的问题.图4 CTAB和油酸钠双表面活性剂体系中制备的金纳米棒的TEM图Fig.4 TEM maps of gold nanorods prepared in CTAB and sodium oleate double surfactant systems种子生长法因其成本低、反应时间可控性好、产量较高、实验条件要求低适合大量制备等优点而成为一种主要的制备方法. 本文第三部分将对种子生长法的反应条件对纳米棒结构的影响一一阐述.2 种子生长法的反应条件对金纳米棒的影响2.1 种子浓度的影响当生长液中金Au(I)离子的浓度一定时,随种子的浓度增加金纳米棒的横向和纵向尺寸同时减小,球状的金颗粒也逐渐增多,这是由颗粒之间的碰撞概率增大而引起的. 而相应减少种子的量时,金纳米棒在长度和宽度上都会增大[30,32]. 在AgNO3的存在下,当种子浓度增加时,纵向等离子体吸收峰值位置发生红移. 2.2 AgNO3浓度的影响生长液中无Ag离子也能制备出金纳米棒,不过产率低而且无法调节种子与金盐的比率控制长径比. 生长液中Ag离子的相对含量会显著地影响金纳米棒的长径宽比及均一度. 在保持其他条件不变时,生长液中的AgNO3量存在一个临界值,低于这个临界值时,SPRL峰随着Ag+浓度的增加而红移,超过某一数值,SPRL峰会蓝移,即得到金纳米棒的尺寸不但不增反而减小[33]. 如图5是改变反应试剂AgNO3的量所获得的金纳米棒胶体的吸收谱[34].图5 改变反应试剂AgNO3的量所获得的金纳米棒胶体的吸收谱Fig.5 Absorption spectra of the gold nanorod colloid Varied by the amount of the reaction reagent AgNO32.3 pH和温度的影响溶液的pH也影响金纳米棒的生长[35-37]. YE等[30-31,34]在实验中发现,随着溶液中pH的降低,金纳米棒AR增大,SPRL出现红移. 金纳米棒的形貌还与环境温度有关系,反应体系的温度一般都不高于30 ℃. JANA[38]研究发现升高温度SPR峰会蓝移,温度达到60 ℃时,金纳米棒就不再均匀,就会出现骨头状和哑铃状;当温度为80 ℃,几乎检测不到SPRL 峰,棒的产率很低. 反应温度的升高可加快溶液中Au(III)被还原的速率,同时由于Au(0)随机成核的几率也会增大,以至于易形成球形的纳米颗粒.2.4 CTAB 浓度的影响CTAB 的浓度对于金纳米棒的制备也是至关重要的. 金纳米棒形状的生长方向主要由表面活性剂CTAB双分子层来限制,当增加CTAB浓度时,金纳米棒的纯度和产率也相应增加,CTAB形成双吸附层,选择性地吸附在金纳米棒的侧面上,使得还原出来得Au原子更多地沉积在头部,慢慢地形成了棒状[39]. 有报道称表面活性剂中的溴离子起到了关键作用,溴离子有利于金纳米棒的合成,如GARG等[40]在反应中添加了溴化钠来恢复溴离子的浓度就可以得到金纳米棒.3 金纳米棒的应用随着科技的发展,人们对金纳米棒的不断深入,基于其良好的稳定性以及表现出各向异性的SPR特性,所以在生物检测、生物成像、疾病的治疗以及信息储存、基因和药物载体、癌症的热治疗等领域获得了广泛关注,如图6所示. 下面我们简单介绍金纳米棒在基因和药物载体、癌症的热治疗领域的应用.图6 金纳米棒的应用Fig.6 Application of gold nanorods3.1 在基因和药物载体方面的应用药物可以通过物理吸附或者化学共轭联接在金纳米棒的表面,利用波长与LSPR吸收峰一致的激光照射金纳米棒产生等离子激元共振,金纳米棒发生光学吸收并转变成热释放到局部环境中[29],如图7所示. 利用这一特点,金纳米棒可作为药物传输和生物分子控制释放的载体. PARK等[41]将金纳米棒用于肿瘤的纳米材料联合治疗法,他们将金纳米棒作为激活剂和光热剂,并植入肿瘤毛细血管中,并通过对肿瘤进行近红外光预加热,从而增加肿瘤磁性纳米蠕虫或者脂质体的吸收. 吴晓春和陈春英两个课题组近几年在纳米材料的光热逆转肿瘤细胞耐药性、光控释药、增强肿瘤细胞光热响应的敏感性及多种策略联合治疗等方面取得一系列新的发现[42-44];他们针对金纳米棒表面积较小和不利于药物携带的缺点,设计并利用GNRs@mSiO2纳米核-壳结构的高比表面积的优点,成功实现了可抗癌药物—阿霉素—的高效载带.图7 AuNRs @ SiO2 @ CXCR4装载人iPS细胞用于靶向递送和肿瘤内AuNRs 均匀分布和增强光热治疗Fig.7 AuNRs@SiO2@CXCR4 loaded human iPS cells for target delivery and intratumoral homogeneous distribution of AuNRs and enhanced photothermal therapy尽管金纳米棒在肿瘤及热治疗应用上有广阔的前景,但是单纯使用金纳米棒还是存在以下缺点:1)金纳米棒保护层的毒性及其稳定性的问题:表面活性剂CTAB的不稳定容易引起金纳米棒的团聚,研究表明CTAB具有一定强的毒性. 2)金纳米棒负载药物的能力不佳:由于金纳米棒是无孔结构的棒状材料,载药容量很低,只有少量的药物可以负载在表面上,所以较难开展联合治疗. 3)肿瘤内的金纳米棒受激光照射能量衰减可能会影响热疗效果.研究表明,在CTAB负载的金纳米棒表面修饰多孔二氧化硅(GNRs@mSiO2)有望解决上述问题,既可以降低金纳米棒的生物毒性,又可以利用二氧化硅孔道载药实现化疗一热疗的联合治疗. 此外,采用巯基化的聚乙二醇(m-SH-PEG)替代包裹金纳米棒的稳定活性剂双分子层,可以保证金纳米棒在非表面活性剂缓冲液中能够稳定存在. 聚乙二醇修(PEG)饰的金纳米棒不仅可以提高细胞对铂药物的摄取量,而且增加了顺铂对肿瘤细胞的杀伤作用. MIN等[45]将Pt (IV) 药物前体联接在氨基PEG化的金纳米棒上构建一个药物递送系统,该系统在生理环境下十分稳定. 在近红外激光的照射下可以有效地释放Pt药物,相比单独的药物,它对癌细胞具有更好治疗效果. HUANG等[46]利用生物来标记的金纳米棒可以识别癌变细胞. 使用抗表面生长因子蛋白抗体标记的金纳米棒与细胞孵育后,抗体修饰的金纳米棒就会在抗原-抗体的特异性作用下大量地聚集在癌细胞表面.3.2 金纳米棒在光热治疗方面的应用金纳米棒作为一种优良的纳米材料,已经广泛应用于光热治疗[47]. 由于作为保护剂的CTAB的存在,金纳米棒的表面呈现正电,可以通过物理吸附的方式在其表面连接带负电荷的物质,如光敏试剂被静电吸附到表面,使金纳米棒具有多重功能,其中一部分功能用于光热治疗方面. 金纳米棒用于体外的光热治疗的主要有两种方式:第一,通过金纳米棒的SPR效应产生的热可以直接杀死肿瘤细胞;第二,通过热诱导的方法释放装载在金纳米棒表面的药物便可以杀死肿瘤细胞. KANG等[48]通过将抗癌药装载在基于聚丙烯酰胺包覆的金纳米棒的溶胶-凝胶系统构建了一个NIR光响应的药物递送系统,在NIR 激光照射下,金纳米棒产生的热将凝胶壳溶解然后将药物释放出来,同时达到抑制癌细胞生长的目的. 综上所述金纳米棒在纳米生物医学领域有很好的发展前景,解决人类的疑难病,并造福于人类.4 结论和展望由于金纳米棒易于制备,而且在可见光到近红外光区,具有连续可调的特殊的表面等离子共振特性,使得金纳米棒既可作为某些药物和生物分子的载体,又可作为细胞成像和光热治疗的活性试剂. 这方面的研究虽然才刚刚开始,但已经取得了令人鼓舞的研究成果,引起人们的广泛关注. 然而,金纳米棒的生长机理还没有完全清楚,只有对于金纳米棒生长机理有了明确的认识,金纳米棒的制备工作才能更加有效地开展. 此外,还要进一步研究金纳米棒的表面修饰,以便更好地扩充其在信息存储及生物医学领域的应用.参考文献:【相关文献】[1] JIN R, CAO Y W, MIRKIN C A, et al. Photoinduced conversion of silver nanospheres to nanoprisms [J]. Science, 2001, 294(5548): 1901-1903.[2] TIAN N, ZHOU Z Y, SUN S G, et al. Synthesis of tetrahexahedral platinum nanocrystals with high-index facets and high electro-oxidation activity [J]. Science, 2007, 316(31): 732-735.[3] SANVICENS N, MARCO M P. Multifunctional nanoparticles-properties and prospects for their use in human medicine [J]. Trends in Biotechnology, 2008, 26(8): 425-433.[4] ZIJSTRA P, CHON J W M, GU M. Five-dimensional optical recording mediated by surface plasmons in gold nanorods [J]. Nature, 2009, 459(7245): 410-413.[5] ZHENG J S, CHANG H N, WANG F L, et al. Fmoc synthesis of peptide thioesters without post-chain-assembly manipulation [J]. Journal of the American Chemical Society, 2011, 133(29): 11080-11083.[6] 刘勇, 王一涛, 李西营, 等. 苏丹红I号在纳米金/碳球修饰硼掺杂金刚石电极上的电化学行为[J]. 化学研究, 2014, 25(2): 124-127.LIU Y, WANG Y T, LI X Y, et al. Electrochemical behavior of Sudan Red I on nanoscale gold/carbon ball modified boron-doped diamond electrode [J]. Chemical Research, 2014, 25(2): 124-127.[7] 杨敬贺, 杨朵, 李亚敏. 纳米金/碳催化剂的合成及其在多巴胺电化学检测中的应用化学研究[J]. 化学研究, 2014, 25(4): 331-334.YANG J H, YANG D, LI Y M. Synthesis of nano-gold/carbon catalyst and its application in electrochemical detection of dopamine [J]. Chemical Research, 2014, 25(4): 331-334. [8] DUBERTRET B, CALAME M, LIBCHABER A J. Single-mismatch detection using gold-quenched fluorescent oligonucleotides [J]. Nature Biotechnology, 2001, 19(4): 365-370. [9] IMAHORI H, FUKUZUMI S, LUO C, et al. Modulating charge separation and charge recombination dynamics in porphyrin-fullerene linked dyads and triads: marcus-normal versus inverted region [J]. Journal of the American Chemical Society, 2001, 123(11): 2607-2617.[10] NEPAL D,PARK K,ONSES M S, et al. Control over position, orientation, and spacing of arrays of gold nanorods using chemically nanopatterned surfaces and tailored particle-particle-surface interactions [J]. ACS Nano, 2012, 6(6): 5693-5701.[11] NIE S, ENIORY S R. Probing single molecules and single nanoparticles by surface-enhanced raman scattering [J]. Science, 1997, 275(5303): 1102-1106.[12] ZHANG J, DU J. Sonochemical formation of single-crystalline gold nanobelts [J]. Angewandte Chemie, 2006, 118(7): 1134-1137.[13] LINK S, EL-SAYED M A. Spectral properties and relaxation dynamics of surface plasmon electronic oscillations in gold and silver nanodots and nanorods [J]. The Journal of Physical Chemistry B, 1999, 103(40): 8410-8426.[14] LINK S, EL-SAYED M A. Shape and size dependence of radiative, non-radiative and photothermal properties of gold nanocrystals [J]. International Reviews in Physical Chemistry, 2000, 19(3): 409-453.[15] MURPHY C J, THOMPSON L B, ALKILANY A M, et al. The many faces of gold nanorods [J]. The Journal of Physical Chemistry Letters, 2010, 1(19): 2867-2875.[16] WANG C, WANG T, Ma Z. pH-tuned synthesis of gold nanostructures from nanorods with different aspect ratios [J]. Nanotechnology, 2005, 16(11): 2555-2560[17] CHANG S S, SHIH C W, CHEN C D, et al. The shape transition of gold nanorods [J]. Langmuir 1999, 15(3): 701-709.[18] YU Y Y, CHANG S S, LEE C L, et al. Gold nanorods: electrochemical synthesis and optical properties [J]. The Journal of Physical Chemistry B, 1997, 101(34): 6661-6664. [19] DICKSON W, EVANS P R, WURTZ G A, et al. Towards nonlinear plasmonic devices based on metallic nanorods [J]. Journal of Microscopy, 2008, 229(3): 415-420.[20] ZANDE B M I, BOHMER M R, FOKKINK L G J, et al. Colloidal dispersions of gold rods: synthesis and optical properties [J]. Langmuir, 2000, 16(2): 451-458.[21] WURTZ G A, POLLARD R, HENDREN W, et al. Designed ultrafast optical nonlinearity ina plasmonic nanorod metamaterial enhanced by nonlocality [J]. Nature Nanotechnology, 2011, 6(2): 107-111.[22] MARTIN C R. Nanomaterials: a membrane-based synthetic approach [J]. Science, 1994, 266(5193): 1961-1966.[23] MARTIN C R. Membrane-based synthesis of nanomaterials [J]. Chemistry of Materials, 1996, 8(8): 1739-1746.[24] SUN Y, WILEY B, LI Z Y, et al. Synthesis and optical properties of nanorattles and multiple-walled nanoshells/nanotubes made of metal alloys [J]. Journal of the American Chemical Society, 2004, 126(30): 9399-9406.[25] HOU Z, ABBOTT N L, STROEVE P. Self-assembled monolayers on electroless gold impart pH-responsive transport of ions in porous membranes [J]. Langmuir, 2000, 16(5): 2401-2404.[26] JANA N R, GEARHEART L, MURPHY C J. Seed-mediated growth approach for shape-controlled synthesis of spheroidal and rod-like gold nanoparticles using a surfactant template [J]. Advanced Materials, 2001, 13(18): 1389-1393.[27] NIKOOBAKHT B N, EL-SAYED M A. Preparation and growth mechanism of gold nanorods (NRs) using seed-mediated growth method [J]. Chemistry of Materials, 2003,15(10): 1957-1962.[28] CHAN D Y C, CARNIE S, MLVANEY P, et al. Electric-field-directed growth of gold nanorods in aqueous surfactant solutions [J]. Advanced Functional Materials, 2004, 14(6): 571-579.[29] LIU Y, YANG M, ZHANG J, et al. Human induced pluripotent stem cells for tumor targeted delivery of gold nanorods and enhanced photothermal therapy [J]. ACS Nano, 2016, 10(2): 2375-2385.[30] YE X, JIN L, CAGLAYAN H, et al. Improved size-tunable synthesis of monodisperse gold nanorods through the use of aromatic additives [J]. ACS Nano, 2012, 6(3): 2804-2817.[31] YE X, GAO Y, CHEN J, et al. Seeded growth of monodisperse gold nanorods using bromide-free surfactant mixtures [J]. Nano Letters, 2013, 13(5): 2163-2171.[32] YE X, ZHENG C, CHEN J, et al. Using binary surfactant mixtures to simultaneously improve the dimensional tunability and monodispersity in the seeded growth of gold nanorods [J]. Nano Letters, 2013, 13(2): 765-771.[33] LIU J, KAN C, LI Y, et al. End-to-end and side-by-side assemblies of gold nanorods induced by dithiol poly(ethylene glycol) [J]. Applied Physics Letter, 2014, 104(25): 253105.[34] MURPHY C J, SAU T K, GOLE A M, et al. Anisotropic metal nanoparticles: synthesis, assembly, and optical applications [J]. The Journal of Physical Chemistry B, 2005, 109(29): 13857-13870.[35] ZHU J, YONG K T, ROY I, et al. Additive controlled synthesis of gold nanorods (GNRs) for two-photon luminescence imaging of cancer cells [J]. Nanotechnology, 2010, 21(28): 285106-285114.[36] BUSBEE B D, OBARE S O, MURPHY C J. An improved synthesis of high-aspect-ratio gold nanorods [J]. Advanced Materials, 2003, 15(5): 414-416.[37] KIM F, SOHN K, WU J S, et al. Chemical synthesis of gold nanowires in acidic solutions [J]. Journal of the American Chemical Society, 2008, 130(44): 14442-14443.[38] JANA N R. Gram-scale synthesis of soluble, near-monodisperse gold nanorods and other anisotropic nanoparticles [J]. Small, 2005, 1(8/9): 875-882.[39] JANA N R, GEARHEART L, MURHPY C J. Wet chemical synthesis of high aspect ratio cylindrical gold nanorods [J] The Journal of Physical Chemistry B, 2001, 105(19): 4065-4067.[40] GARG N, JIN R, MOHANTY A, et al. The role of bromide ions in seeding growth of Au nanorod [J]. Langmuir, 2010, 26(12): 10271-10276.[41] PARK K, DRUMMY L F, WADAMS R C, et al. Growth mechanism of gold nanorods [J]. Chemistry of Materials, 2013, 25(4): 555-563.[42] ZHANG Z, WANG J, NIE X, et al. Near infrared laser-induced targeted cancer therapy using thermoresponsive polymer encapsulated gold nanorods [J]. Journal of the American Chemical Society, 2014, 136(20): 7317-7326.[43] ZHANG Z, WANG L, WANG J, et al. Mesoporous silica-coated gold nanorods as a light-mediated multifunctional theranostic platform for cancer treatment [J]. Advanced Materials, 2012, 24(11): 1418-1423.[44] WANG L, LIN X, WANG J, et al. Novel insights into combating cancer chemotherapy resistance using a plasmonic nanocarrier: enhancing drug sensitiveness and accumulation simultaneously with localized mild photothermal stimulus of femtosecond pulsed laser [J]. Advanced Functional Materials, 2014, 24(27): 4229-4239.[45] MIN Y, MAO C, XU D, et al. Gold nanorods for platinum based prodrug delivery [J].Chemical Communications, 2010, 46(44): 8424-8426.[46] HUANG Y F, SEFAH K, CHANG H T, et al. Selective photothermal therapy for mixed cancer cells using aptamer-conjugated nanorods [J]. Langmuir, 2008, 24(20): 11860-11865.[47] LI J L, DAY D, GU M. Ultra-low energy threshold for cancer photothermal therapy using transferrin-conjugated gold nanorods [J]. Advanced Materials, 2008, 20(20): 3866-3871.[48] KANG H, TRONDOLI A C, ZHU G, et al. Near-infrared light-responsive core-shell nanogels for targeted drug delivery [J]. ACS Nano, 2011, 5(6): 5094-5099.。
纳米金属对生物体的毒性作用研究

纳米金属对生物体的毒性作用研究随着纳米技术的发展和应用,纳米金属越来越多地出现在我们的生活中,包括医疗、电子、化妆品等领域。
然而,也有越来越多的研究表明,纳米金属对生物体的毒性作用需要引起我们的关注和研究。
首先,我们来了解一下什么是纳米金属。
纳米材料是指一种尺寸在1-100纳米(1纳米=10^-9米)的材料。
纳米金属是指金属元素被制成的纳米颗粒,如纳米银、纳米铜、纳米铁等。
在这个尺寸下,金属颗粒的表面积相对于体积变得非常大,因此纳米金属具有独特的物理和化学性质,例如高比表面积、高活性、较小的粒径等。
许多研究已经表明,纳米金属可以造成针对生物体的不良影响。
这些影响可能包括细胞毒性、细胞内过氧化物水平的提高、线粒体结构的损害、氧化应激等。
这些影响可能会对整个生物系统产生一系列的生理和神经学的影响,从而影响我们的健康。
在研究纳米金属的毒性过程中,体外和体内实验都是不可缺少的。
体外实验是指使用单个或多个细胞系或低一级的模型-例如蠕虫或果蝇-进行的实验。
相比之下,体内实验涉及到真实的生物体系实验,例如使用小鼠。
这些实验可以在许多不同的模型中进行,包括细胞系、组织和生物体。
有趣的是,不同纳米金属的毒性可以有很大的区别。
例如,纳米银引起的细胞毒性可能比纳米铜略微更强,但纳米铜对人体的影响可能更大,因为在人体内,铜比银更容易进行离子化。
此外,纳米金属的形状和结构也可能改变其毒性。
纳米金属可以呈现出球状、棒状、片状等形态,不同形态和尺寸的纳米金属对生物体的毒性有很大的差异。
然而,纳米金属的毒性影响可能并不都是负面的。
许多研究表明,纳米金属的抗菌性可能对医疗领域有巨大的潜力,因为它们可以用于预防和治疗感染病情。
此外,纳米金属的应用也可以在制备生物传感器和临床诊断领域中发挥重要作用。
总的来说,纳米金属对生物体的毒性作用需要引起我们的更多关注和研究。
未来的研究还应当深入了解纳米金属的毒性机制以及控制其毒性的技术。
只有这样,我们才能在纳米技术的应用中确保其对人类和自然环境的不负面影响。
金纳米棒的表面改性及生物相容性

金纳米棒的表面改性及生物相容性余金妹;高斌;贺克武;程继新;鲍乐;黄永翠;李劲松;任子甲;肖卫华【摘要】10.3969/j.issn.2095-4344.2012.38.008% 背景:金纳米棒制备过程中加入的十六烷基三甲基溴化铵可促进棒状金纳米颗粒的形成,保证金纳米棒良好的分散性,但也会产生一定毒性。
目的:评价表面修饰后金纳米棒的生物相容性。
方法:运用种子介导生长法制备金纳米棒,以改良后的奥伯法对其表面进行二氧化硅修饰,采用紫外分光光度计和透射电子显微镜对其进行表征,将修饰后的金纳米棒配制成不同浓度(60,45,30,15μmol/L),分别与肝癌bel-7402细胞及胃癌MGC-803细胞孵育,采用CCK-8法检测细胞相对增殖率,细胞毒性级别。
结果与结论:表面修饰后的金纳米棒分散性好,其特殊的光学性质未有改变,分别在500,825 nm处有强吸收峰。
不同浓度金纳米棒处理后,肝癌bel-7402细胞的相对增殖率在95%-100%之间,胃癌MGC-803细胞的相对增殖率在99%-103%之间,两组细胞的毒性评级均为0级或1级,无细胞毒性。
表明经二氧化硅表面修饰后的金纳米棒具有良好的生物相容性。
【期刊名称】《中国组织工程研究》【年(卷),期】2012(000)038【总页数】5页(P7068-7072)【关键词】金纳米棒;表面修饰;二氧化硅;生物相容性;肝癌;胃癌;改性;生物材料【作者】余金妹;高斌;贺克武;程继新;鲍乐;黄永翠;李劲松;任子甲;肖卫华【作者单位】安徽医科大学第三附属医院,安徽省合肥市230061;安徽医科大学第三附属医院,安徽省合肥市230061;安徽医科大学第三附属医院,安徽省合肥市230061;安徽医科大学第三附属医院,安徽省合肥市230061;徐州医学院,影像学院,江苏省徐州市221004;安徽医科大学第三附属医院,安徽省合肥市230061;安徽医科大学第三附属医院,安徽省合肥市230061;中国科学技术大学生命科学学院,安徽省合肥市 230027;中国科学技术大学生命科学学院,安徽省合肥市 230027【正文语种】中文【中图分类】R3180 引言金纳米棒是一种具有一定长宽比的棒状金纳米颗粒,具有独特的光学性质—表面等离子共振效应,这种效应来源于入射光与金纳米颗粒表面自由电子的相互,当两者的频率发生共振耦合时,就会在紫外可见吸收光谱上显示强的吸收峰,即表面等离子效应[1-2]。
金纳米粒子的细胞毒性

金纳米粒子的细胞毒性
李铸衡;马立娜;刘殿骏;王振新
【期刊名称】《应用化学》
【年(卷),期】2016(33)9
【摘要】金纳米粒子(AuNVs)是构建用于诊断和治疗的纳米药物/探针的理想纳米材料之一,因此研究AuNPs与细胞的相互作用具有重要意义.本文详细分析了金纳米簇(AuNCs)、球形金纳米粒子A(AuNPss)、金纳米球壳(AuNSs)和金纳米棒(AuNRs)等不同形貌的Au NPs对不同细胞模型的细胞毒性;讨论了AuNPs的理化性质(大小、形状、化学功能和表面电荷)对其细胞毒性的影响.总结了AuNP细胞毒性研究遇到的挑战并提出相应解决方法.
【总页数】8页(P1009-1016)
【作者】李铸衡;马立娜;刘殿骏;王振新
【作者单位】吉林省教育学院长春130022;中国科学院长春应用化学研究所长春130022;中国科学院长春应用化学研究所长春130022;中国科学院长春应用化学研究所长春130022;中国科学院长春应用化学研究所长春130022
【正文语种】中文
【中图分类】O652
【相关文献】
1.生物医学新材料金纳米粒子的细胞毒性研究进展 [J], 刘肇彧;丁娅;吴迪;张灿
2.金纳米粒子对CHO-K1细胞毒性的谷胱甘肽作用机制 [J], 李武珊;陈丽君
3.细胞毒性与非细胞毒性抗肿瘤药固体制剂生产区设计差异性探讨 [J], 温艳华
4.细胞毒性与非细胞毒性抗肿瘤药固体制剂生产区设计差异性探讨 [J], 温艳华;
5.大面积多元化表面等离激元金纳米粒子结构的制备大面积多元化表面等离激元金纳米粒子结构的制备 [J], 李东; 孙迎辉; 王中舜; 黄晶; 吕男; 江林
因版权原因,仅展示原文概要,查看原文内容请购买。
如何给金纳米棒解毒

如何给金纳米棒解毒2016-05-07 12:55来源:内江洛伯尔材料科技有限公司作者:研发部卵磷脂修饰金纳米棒的示意图美国科学家Murphy小组曾详细研究金纳米棒的毒性,发现常用的以CTAB(十六烷基三甲基溴化铵)为保护剂的金纳米棒不能直接使用,因为CTAB动态吸附在金纳米棒表面,一旦脱附成游离状态,会对正常细胞也有毒性。
因此金纳米棒使用之前都需要修饰,增加官能团进行功能化,即解毒。
目前主流的功能化方式有两种。
1、生物适应性分子包裹法为了阻止吸附在金纳米棒表面的CTAB分子脱附进入介质环境,Yamada等用含卵磷脂的氯仿萃取金纳米棒溶液中的CTAB,萃取3次后棒溶液中CTAB量几乎可忽略。
卵磷脂使得金纳米棒表面钝化,从而阻止了棒的团聚。
最终得到的金纳米棒毒性大大降低。
图为卵磷脂包裹示意图。
Niidome等用聚乙二醇修饰金纳米棒。
聚乙二醇是一种亲水聚合物,能增强金纳米棒的生物适应性,有利于抗体结合,他们还用聚异丙基丙烯酰胺胶体包裹金纳米棒,并研究了棒在近红外激光辐射下的反应。
Wei等利用静电作用,用聚苯乙烯磺酸盐(PSS)包裹金纳米棒,改变了棒表面的电荷,由此抗体与PSS层之间无需特殊反应就能结合。
2、生物适应性分子取代法降低CTAB包裹金纳米棒毒性的另一条途径是用生物适应性分子取代CTAB。
由于金亲硫,所以大部分取代分子都含巯基或硫。
最常见的是甲基巯基聚乙二醇。
Bhatia等研究了甲基巯基聚乙二醇保护金纳米棒的毒性和稳定性(如图),发现mPEG-SH-NRs在生物介质中稳定性更好(>1000 h),而相同情况下CTAB-NRs已经沉淀了。
Stephen小组利用可逆加成-链断裂转移(RAFT)手段处理聚(2-(二甲基氨基)甲基丙烯酸乙脂),聚丙烯酸和聚苯乙烯均聚合物,然后将其修饰到金纳米棒上。
Joseph等用含双硫的胱胺化合物修饰金纳米棒,得到终端为氨基的棒很容易与抗体结合。
Cheng利用原位生成二硫代氨基甲酸盐反应将叶酸修饰到金纳米棒上,发现金纳米棒在近红外光的辐射性温度升高,能破坏肿瘤细胞膜的完整性,从而诱导肿瘤细胞死亡。
一种金纳米棒的应用[发明专利]
![一种金纳米棒的应用[发明专利]](https://img.taocdn.com/s3/m/90bcd91df61fb7360a4c6566.png)
专利名称:一种金纳米棒的应用
专利类型:发明专利
发明人:蔡红星,靳美会,张天幕,郭沫然申请号:CN201210321464.3
申请日:20120904
公开号:CN102793932A
公开日:
20121128
专利内容由知识产权出版社提供
摘要:本发明提供了一种金纳米棒的应用,用金纳米棒制备X光成像设备的造影剂。
金纳米棒是棒形的金纳米颗粒,具有生物兼容性好,低毒性、高稳定性、化学性质稳定以及对X光吸收强等优点,因而可以应用于人体的各个部位。
利用肿瘤细胞对金纳米棒极强的吸收特性,通过静脉注射,使得金纳米棒在肿瘤组织中富集起来,利用金纳米棒对于X射线吸收系数大的特点,当X光穿透人体时,富集起来的金纳米棒就显现出阴影,成为一种新型的造影剂。
在注射72小时后,循环系统中的金纳米棒可以通过尿液或体液完全排出,大脑、膀胱、肌肉、心脏、肺、肾中几乎无残留,肿瘤、肝脏、脾脏中有少量的残留,经过实验证明,其毒副作用较小,安全可靠。
申请人:长春鸿特生物科技有限公司
地址:130022 吉林省长春市卫星路7186号长春理工大学科技大厦B座1310室
国籍:CN
代理机构:长春科宇专利代理有限责任公司
代理人:马守忠
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金纳米棒有毒吗
2016-04-23 13:03来源:内江洛伯尔材料科技有限公司作者:研发部
检测金纳米棒是否有毒思路图
金纳米棒的光学性质独特,是近年来人们研究的热点。
特别是在生物医学领域,如光热治疗、癌症检测、生物成像、药物运输释放等,展示出极好的应用前景。
于是,另一个关键的问题进入人们的视野,即金纳米棒有毒吗?会不会对正常的生物细胞造成损伤?
金纳米棒合成领域的开拓者Murphy小组对此问题进行了深入研究。
早期他们研究CTAB分子稳定金纳米球的毒性时发现,金纳米粒子无毒性,但金纳米粒子前驱体HAuCl4和CTAB都有细胞毒性。
毒性是由溶液中游离的CTAB
分子而不是连接到金纳米粒子上的CTAB造成的。
但随后许多其他小组研究都表明,CTAB双分子层包裹的金纳米棒是具有细胞毒性的。
这与Murphy小组前期的结论似乎矛盾。
为弄清金纳米棒毒性的来源,Murphy小组设计了对比试验,即比较原始金纳米棒溶液和离心除去棒后上清液的细胞毒性,发现两者细胞毒性接近,证明了细胞毒性来源于CTAB,而不是金纳米棒本身。
所以合理的解释是,CTAB在金纳米棒表面是动态吸附,总有一定量的CTAB会脱附进入周围的介质环境,造成整体的细胞毒性。
那是否能完全除掉CTAB呢?遗憾的是,在没有其他稳定剂存在时,完全除去吸附到金纳米棒表面的CTAB又会造成纳米棒的团聚。
所以CTAB包裹金纳米棒在用于体内研究之前,功能化是至关重要的一步。
