化工原理精馏.pptx
合集下载
化工原理课件 9.4 精馏

q [rF cP (tb tF )] rF
b. 饱和液体进料(泡点进料) 饱和液体温度等于泡点
iF i
q 1
V V
0 q 1
L LF
c.汽液混合物进料 汽液混合物的温度介于泡点和露点之间
i iF I
V V
LL
q=x(液相分率) 已知进料中汽相与液相的摩尔数之比为2:1,轻组分的摩尔分 数为0.55,则q=_____. A. 1/3 B. 0.55 C.不能确定
传质单元高度
精 馏
实 际 塔 板 数
理论板数
反映分离任务的难易, 与设备型式无关
反映设备效能的高低
全塔效率
④塔板物料、热量衡算及传递速率的最终简化 引入理论板的概念及恒摩尔流假设使塔板过程的物料衡 算、热量衡算及传递速率最终简化为 物料衡算式
Vy n1 Lxn1 Vy n Lxn
相平衡方程
LL q F 以1kmol/h进料为基准,提馏段中的液体流量较精馏段的液 体流量增大的kmol/h数即为q值
L L qF
V V (1 q)F
I iF q I i
iF i I
q 1
L L qF
V V, L L
V V (1 q)F
a. 过冷液体进料 过冷液体温度低于泡点
I iF q I i
L L qF
V V (1 q)F
d.饱和蒸汽进料(露点进料) 饱和蒸汽的温度等于露点
iF I
q0
V V F
LL
e.过热蒸汽进料(过热蒸汽的温度高于露点)
iF I
q0
V V, L L
q cP (tF td ) rF
精馏优秀课件

25
1. 连续精馏操作流程
2. 间歇精馏操作流程
26
3. 精馏塔旳操作情况
tn-1
塔板上: yn+1<xn-1, tn+1>tn-1 两者互不平衡
即:存在温度差和浓度差
tn+1
成果:传质和传热
yn >xn
理论(理想)板
若: ① 气液两相接触时间足够长
② 板上混合足够均匀
即:
则:离开第n块板时旳汽-液二相 构成构成平衡关系
3. 塔釜产品屡次部分汽化
t1
t1
t1’
t1'
t2’
t
' 2
操作流程
操作在相图上旳反应
成果:对初级混合液部分汽化后得到旳液相在塔底经屡次部分汽化 20 最终可得液相浓度为x2`(较低)旳塔底产品构成。
4. 过程进行旳必要条件及存在问题讨论 ① 由2、3可知:欲使混合液得到有效分离,必须同步分别对 塔顶汽相和塔釜液相进行屡次部分泠凝和屡次部分汽化。
双组分 —— 要点讨论 多组分 —— 简要简介
蒸馏操作实例:石油炼制中使用旳 250 万吨常减压装置幻灯片 5 5
§6.1 双组分溶液旳汽-液相平衡
汽液相平衡是分析精馏原理和进行设备计算旳理论基础,过程 以两相到达平衡为极限。
§6.1.1 溶液旳蒸汽压和拉乌尔定律(Raoult’s law)
一. 纯组分饱和蒸汽压 在密闭容器内,在一定温度下,纯组分液体旳汽液两相到达平 衡状态,称为饱和状态,其蒸汽为饱和蒸汽,其压力为饱和蒸 汽压。
16
泡点线
0
xA xf
yA 1.0
x(y)
§ 6.3.2 精馏原理和流程
精馏流程(熟悉有关旳概念)
1. 连续精馏操作流程
2. 间歇精馏操作流程
26
3. 精馏塔旳操作情况
tn-1
塔板上: yn+1<xn-1, tn+1>tn-1 两者互不平衡
即:存在温度差和浓度差
tn+1
成果:传质和传热
yn >xn
理论(理想)板
若: ① 气液两相接触时间足够长
② 板上混合足够均匀
即:
则:离开第n块板时旳汽-液二相 构成构成平衡关系
3. 塔釜产品屡次部分汽化
t1
t1
t1’
t1'
t2’
t
' 2
操作流程
操作在相图上旳反应
成果:对初级混合液部分汽化后得到旳液相在塔底经屡次部分汽化 20 最终可得液相浓度为x2`(较低)旳塔底产品构成。
4. 过程进行旳必要条件及存在问题讨论 ① 由2、3可知:欲使混合液得到有效分离,必须同步分别对 塔顶汽相和塔釜液相进行屡次部分泠凝和屡次部分汽化。
双组分 —— 要点讨论 多组分 —— 简要简介
蒸馏操作实例:石油炼制中使用旳 250 万吨常减压装置幻灯片 5 5
§6.1 双组分溶液旳汽-液相平衡
汽液相平衡是分析精馏原理和进行设备计算旳理论基础,过程 以两相到达平衡为极限。
§6.1.1 溶液旳蒸汽压和拉乌尔定律(Raoult’s law)
一. 纯组分饱和蒸汽压 在密闭容器内,在一定温度下,纯组分液体旳汽液两相到达平 衡状态,称为饱和状态,其蒸汽为饱和蒸汽,其压力为饱和蒸 汽压。
16
泡点线
0
xA xf
yA 1.0
x(y)
§ 6.3.2 精馏原理和流程
精馏流程(熟悉有关旳概念)
化工原理精馏PPT课件

D,xD
•
(xD,xD)
3
(二) 提馏段操作线方程
总物料衡算:L=V+W
m Lxm V ym+1
m+1
易挥发组分衡算 :Lxm= Vym+1+ WxW
yN
ym 1LL Wxm LW WxW 或 ym 1V Lxm V WxW
N xN
V
LxN
W,xw
提馏段操作 线方程
•(xW,xW)
4
【例1】在连续精馏塔中分离某理想二元混合物。已知原料液流量 为100kmol/h,组成为0.5(易挥发组分的摩尔分率,下同),提馏 段下降液体量与精馏段相等,馏出液组成为0.98,回流比为2.6。若 要求易挥发组分回收率为96%,试计算: (1) 釜残液的摩尔流量; (2) 提馏段操作线方程。
IV IL
(1)饱和液体进料——泡点进料
LV F
此时,IF=IL
q=1
原料液全部与精馏段下降液体汇合进入 提馏段。
L V
饱和液体
L =L+F
V =V
11
(2)饱和蒸汽进料
IF=IV
q=0
q IV IF IV IL
原料全部与提馏段上升气体汇合进入 精馏段。
L =L V=V +F
(3)冷液进料
内容回顾
一、精馏原理
(1)无中间加热及冷凝器的多次部分气化和多次部分冷凝 (2)顶部回流及底部气化是保证精馏过程稳定操作的必不可 缺少的条件。 (3)精馏操作流程 (4)相邻塔板温度及浓度的关系
tn1tntn1 xn1xnxn1 yn1ynyn1
1
二、理论塔板
三、恒摩尔流假定 四、全塔物料衡算
化工原理课件14精馏

例题2
用一连续精馏塔分离乙醇-水混合液。原 料液中含乙醇摩尔分数为0.4,于40℃ 加入塔中。塔顶设全凝器,泡点回流, 所用回流比为3。塔顶馏出液含乙醇摩 尔分数为0.78,釜液含乙醇摩尔分数为 0.02。试以1kmol/s加料为基准计算塔 内气液两相的流量。
(1)L=1.5kmol/s,V=2.0kmol/s (2)L’=2.6kmol/s,V’=2.1kmol/s
i>1
如:乙醇-水,正丙醇-水
负偏差溶液 最高恒沸点
如:硝酸-水,氯仿-丙酮
i<1
蒸馏方式1简单蒸馏
简单蒸馏( Simple distillation)
简单蒸馏是一个 非稳态过程, 并不简单! 又名微分蒸馏 (differential distillation)
蒸馏方式1简单蒸馏
设:F、W ——釜内的料液量和残液量,kmol; x1、x2——料液和残液中易挥发组分组成(摩尔分率) L——某一瞬间釜内的液量,kmol; x、y——某一瞬间的液气组成,(摩尔分率); 经过微分时间dt后,残液量减少dL,液相组成减少dx。 以蒸馏釜为衡算系统 对易挥发组分,dt前后的微分物料衡算为:
离开加热器的温度 :
r T te (1 q) cP
蒸馏方式2平衡蒸馏
气液平衡关系
x y 1 ( 1) x
t e f x
已知原料液流量F,组成xF,温度tF及汽化率q, 即可求得平衡的汽液相组成及温度。
蒸馏方式3特点
简单蒸馏:间歇不稳定、分离程度不高 平衡蒸馏:连续稳定、分离程度不高 为什么利用多次简单蒸馏或多次平衡蒸馏操作实现 物系的高纯度分离?
vi
pA po xA vA A po 对于理想溶液: A xA xA
1.3化工原理精馏单元PPT

返回
(下标1、2··表示自上而下的塔板序号。) ·· ·· 返回
1.5.2物料衡算和操作线方程
1 全塔物料衡算
设计目标: 1)根据分离任务,确定产品流量D,W; 2)选择操作条件R、进料状态; 3)确定塔板数及加料位置; 4)选择塔型,确定塔径,塔内结构尺寸, 流体力学验算;
5)冷凝器及再沸器热负荷及设计计算。
(下标1、2··表示自上而下的塔板序号。) ·· ·· 返回
(2)恒摩尔溢流 精馏段内,每层塔板下降的液体摩尔流量都相等, 提馏段也一样。
即:
L1=L2= ·· L=常数 ·· ··
L1′=L2′= ·· L′=常数 ·· ··
式中
L ——精馏段下降液体的摩尔流量,kmol/h;
L′——提馏段下降液体的摩尔流量,kmol/h。
返回
求:馏出液流量D,釜液的流量W及塔顶易挥发组分的回收 率 A和采出率D/F 解: xF = 0.4 , xD = 0.85,xW = 0.02 F=5000/(0.478+18 0.6) =119.05kmol/h
D xF xW 0.4 0.02 0.458 F xD xW 0.85 0.02 D 0.458 119.05 54.51kmol / h
塔底难挥发组分回收率
W (1 x W ) B 100% F (1 xF )
返回
例6-1 将5000kg/h含乙醇0.4(摩尔分数,下同) 和水0.6的混合液在常压连续精馏塔中分离。要
求馏出液含乙醇0.85,釜液含乙醇不高于0.02,
求馏出液,釜液的流量及塔顶易挥发组分的回 收率和采出率。
W=F-D=119.05-54.5=65kmol/h
化工原理-9章液体精馏-课件PPT

27
两相区特点:当两相温度相同时 y > x 当组成相同,t露点>t泡点
t/C
在总压一定的条件下,将组成为 xf
的溶液加热至该溶液的泡点 TA,产
2
9.1 概 述
工业乙醇的蒸馏(有机化学实验)
3
思考:混合物的分类? 均相混物:物系内部各处物料性质均匀而且不存在相界面的
混合物。 化工生产过程中所遇到的物料有许多是两个或两个以上 组分的均相混合物。
如:石油、空气、粗甲醇
4
蒸馏操作在工业生产中的应用
5
世界六大蒸馏酒的制备 白兰地(Brandy)、威士忌(Whisky)、伏特加(Vodka)、
N ——组分数 φ ——相数
一定压力下: 组成xA(yA)与温度t存在一一对应关系; 气液组成之间xA~yA存在一一对应关系。
21
二、 拉乌尔定律( Raoult’s Law)
法国物理学家拉乌尔在1887年研究含有非挥发性溶质的 稀溶液的行为时发现的,可表述为:“在某一温度下,稀溶 液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数”。
填料塔
规整填料 塑料丝网波纹填料
散装填料 塑料鲍尔环填料
19
9.2 双组分溶液的气液相平衡
9.2.1 双组分理想物系的气液相平衡
理想物系:液相为理想溶液,气相为理想气体且服从 道尔顿分压定律的物系。
理想液体:没有黏性、不可压缩的液体。 理想气体:严格遵从气体状态方程的气体 。 道尔顿分压定律:理想气体混合物的总压力为各组元
原料液 加热器 减压阀 Q
塔顶产品
yA
闪 蒸 罐 xA
特点:闪蒸是连续、稳定的单级蒸 馏程,生产能力大,不能得 到高纯产物,常用于只需粗 略分离的物料。
两相区特点:当两相温度相同时 y > x 当组成相同,t露点>t泡点
t/C
在总压一定的条件下,将组成为 xf
的溶液加热至该溶液的泡点 TA,产
2
9.1 概 述
工业乙醇的蒸馏(有机化学实验)
3
思考:混合物的分类? 均相混物:物系内部各处物料性质均匀而且不存在相界面的
混合物。 化工生产过程中所遇到的物料有许多是两个或两个以上 组分的均相混合物。
如:石油、空气、粗甲醇
4
蒸馏操作在工业生产中的应用
5
世界六大蒸馏酒的制备 白兰地(Brandy)、威士忌(Whisky)、伏特加(Vodka)、
N ——组分数 φ ——相数
一定压力下: 组成xA(yA)与温度t存在一一对应关系; 气液组成之间xA~yA存在一一对应关系。
21
二、 拉乌尔定律( Raoult’s Law)
法国物理学家拉乌尔在1887年研究含有非挥发性溶质的 稀溶液的行为时发现的,可表述为:“在某一温度下,稀溶 液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数”。
填料塔
规整填料 塑料丝网波纹填料
散装填料 塑料鲍尔环填料
19
9.2 双组分溶液的气液相平衡
9.2.1 双组分理想物系的气液相平衡
理想物系:液相为理想溶液,气相为理想气体且服从 道尔顿分压定律的物系。
理想液体:没有黏性、不可压缩的液体。 理想气体:严格遵从气体状态方程的气体 。 道尔顿分压定律:理想气体混合物的总压力为各组元
原料液 加热器 减压阀 Q
塔顶产品
yA
闪 蒸 罐 xA
特点:闪蒸是连续、稳定的单级蒸 馏程,生产能力大,不能得 到高纯产物,常用于只需粗 略分离的物料。
化工原理精馏PPT课件全

用饱和蒸气压表示的气液平衡关系
2)用相对挥发度表示 ☆挥发度定义
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
pA pyA
pB pyB p(1 yA )
p
o A
xA
pyA
yA
p
o A
xA
p
pBo xB pyB
yB
pBo xB p
yA
p
o A
x
A
p
xA
p pBo pAo pBo
yA
pAo p
p pBo pAo pBo
xA
p pBo pAo pBo
,
yA
pAo p
p pBo pAo pBo
解 (1)利用拉乌尔定律计算气液平衡数据
xA
p pBo pAo pBo
yA
p
o A
x
A
p
t/℃ x y
80.1 84 88 92 96 100 104 108 110.8 1.000 0.822 0.639 0.508 0.376 0.256 0.155 0.058 0.000 1.000 0.922 0.819 0.720 0.595 0.453 0.305 0.127 0.000
xF,y,x---原料液、气相、液相产品的组成,摩尔分数
y
1
F D
x
《化工原理精馏》课件

精馏流程图
• 流程图:精馏流程图展示了精馏 操作的全过程,包括原料的预处 理、加热、蒸发、冷凝、回流等 步骤。通过流程图可以直观地了 解精馏操作的过程和原理,有助 于更好地理解和掌握精馏技术。
02 精馏塔设备
精馏塔类型
板式塔
塔内装有多层塔板,液体在塔板上完成汽化与回流,实现分 离。
填料塔
塔内装有填料,液体沿填料表面流下,与上升气体进行接触 传质。
低温余热利用
利用低温余热驱动精馏过程,减少对新鲜能源的依赖 。
废气处理技术
采用吸附、吸收、催化燃烧等方法处理废气,降低污 染物排放。
新型精馏技术
分子蒸馏
利用高蒸气压下分子间的平均自由程大于蒸馏 器结构尺寸的特点,实现高效分离。
反应精馏
在精馏过程中进行化学反应,实现产物的高效 分离和转化。
膜分离技术
据具体工艺要求进行选择和控制。
苯精馏案例
总结词
苯精馏是石油化工中重要的分离过程,其工 艺流程和操作条件较为复杂。
详细描述
苯精馏的目的是从石油裂解气中分离高纯度 的苯产品。原料经过预处理后进入精馏塔, 在塔内通过多次汽化和冷凝操作,将苯与其 他组分分离。操作过程中需严格控制温度、 压力、进料位置和回流比等参数,以保证苯 产品的质量和收率。
精馏操作优化
04
操作参数优化
01
塔板数优化
根据物料性质和分离要求,合理选择塔板数,以提高分 离效率和产品质量。
02
进料位置优化
通过调整进料位置,改善物料在塔内的分布,提高传热 和传质效率。
03
回流比优化
根据操作条件和分离要求,合理调整回流比,以平衡能 耗和分离效果。
节能减排技术
热集成精馏
精馏与精馏塔资料讲解ppt

精馏与精馏塔
1.精馏的基本介绍
1.1 精馏的定义
精馏是化工生产中分离互溶液体混合物的典型单元 操作,其实质是多级蒸馏,即在一定压力下,利用 互溶液体混合物各组分的沸点或饱和蒸汽压不同, 使轻组分(沸点较低或饱和蒸汽压较高的组分)汽 化,经多次部分液相汽化和部分气相冷凝,使气相 中的轻组分和液相中的重组分浓度逐渐升高,从而 实现分离。
1-2-2 精馏原理
① 回流
塔顶液相回流和塔底汽相回流,为偏离平衡的气液相 在塔内各板上提供了接触条件,实现了气液相间的质 量传递。
L0
V2与L0是偏离平衡的气
液相,在塔板上接触,
进行质量传递,浓度变
化趋向于平衡组成。
V2
②传质推动力 y x
③ 传质方向 易挥发组分:液相→汽相; 难挥发组分:汽相→液相。 易挥发组分沿塔高方向增加,而温度沿塔高方向降低。 ④ 热量传递过程
1.2 精馏原理
1-2-1 精馏基本原理 精馏是将液体混合物多次部分气化和部分冷
凝,利用其中各组份挥发度不同(相对挥发度,α) 的特性,实现分离目的的单元操作。
精馏中的两个重要概念: 轻组分:挥发性高的组分(沸点低的组分) 重组分:挥发性低的组分(沸点高的组分) 液体混合物经过多次部份汽化后可变为高纯度的 难挥发组分 。 气体混和物经过多次部分泠凝后可变为高纯度的 易挥发组分。
液体汽化所需热量由蒸汽冷凝提供。 ⑤ 过程控制
精馏过程速率由传质过程控制。
2.精馏操作流程
再沸器
冷凝器
精 馏 塔
根据精馏原理可知,单有精馏塔还不能完成精馏 操作,而必须同时有塔底再沸器和塔顶冷凝器,有 时还要配有原料液预热器、回流液泵等附属设备, 才能实现整个操作。
再沸器的作用是提供一定量的上升蒸汽流,冷凝 器的作用是提供塔顶液相产品及保证有适宜的液相 回流,因而精馏能稳定的进行。
1.精馏的基本介绍
1.1 精馏的定义
精馏是化工生产中分离互溶液体混合物的典型单元 操作,其实质是多级蒸馏,即在一定压力下,利用 互溶液体混合物各组分的沸点或饱和蒸汽压不同, 使轻组分(沸点较低或饱和蒸汽压较高的组分)汽 化,经多次部分液相汽化和部分气相冷凝,使气相 中的轻组分和液相中的重组分浓度逐渐升高,从而 实现分离。
1-2-2 精馏原理
① 回流
塔顶液相回流和塔底汽相回流,为偏离平衡的气液相 在塔内各板上提供了接触条件,实现了气液相间的质 量传递。
L0
V2与L0是偏离平衡的气
液相,在塔板上接触,
进行质量传递,浓度变
化趋向于平衡组成。
V2
②传质推动力 y x
③ 传质方向 易挥发组分:液相→汽相; 难挥发组分:汽相→液相。 易挥发组分沿塔高方向增加,而温度沿塔高方向降低。 ④ 热量传递过程
1.2 精馏原理
1-2-1 精馏基本原理 精馏是将液体混合物多次部分气化和部分冷
凝,利用其中各组份挥发度不同(相对挥发度,α) 的特性,实现分离目的的单元操作。
精馏中的两个重要概念: 轻组分:挥发性高的组分(沸点低的组分) 重组分:挥发性低的组分(沸点高的组分) 液体混合物经过多次部份汽化后可变为高纯度的 难挥发组分 。 气体混和物经过多次部分泠凝后可变为高纯度的 易挥发组分。
液体汽化所需热量由蒸汽冷凝提供。 ⑤ 过程控制
精馏过程速率由传质过程控制。
2.精馏操作流程
再沸器
冷凝器
精 馏 塔
根据精馏原理可知,单有精馏塔还不能完成精馏 操作,而必须同时有塔底再沸器和塔顶冷凝器,有 时还要配有原料液预热器、回流液泵等附属设备, 才能实现整个操作。
再沸器的作用是提供一定量的上升蒸汽流,冷凝 器的作用是提供塔顶液相产品及保证有适宜的液相 回流,因而精馏能稳定的进行。
《化工原理精馏》课件

反应反馈机制
汽提过程和混合过程
探讨汽提和混合等反应反馈机制在精馏中的应用 和原理。
反应器基础
介绍异构反应器和精馏剂的重要性以及它们在反 应反馈中的角色。
塔内传热方式
讲解塔内传热方式对精馏反应效率的影响和优化 方法。
温度和压力对反应的影响
探索温度和压力对精馏反应效果的影响和调节方 法。
装置的优化
1
解析卡曼方程、速度梯度等物理原理在精馏中的应用和影响。
塔设计
精馏塔的分类
详述不同类型的精馏 塔及其特点和应用领 域。
塔的结构和内 部组成
探讨精馏塔的结构构 造和内部组件在精馏 过程中的作用。
塔的操作流程
介绍精馏塔的运行流 程和操作步骤,为高 效运行提供指导。
塔的设计准则
阐述精馏塔设计的关 键准则和参数,确保 塔的安全和性能。
《化工原理精馏》PPT课 件
本PPT课件介绍了化工原理精馏的理论基础、塔设计、反应反馈机制、装置优 化和案例分析等内容,展望了精馏技术的未来发展趋势。
理论基础
1
精馏的定义和分类
介绍精馏的概念及其在化工领域中的不同应用分类。
2
热与精馏相关的热力学概念。
3
物理基础
化学工业中的应用
介绍精馏在化学工业中的成功案例和广泛应用。
环保领域中的应用
分析精馏在环保领域中的应用和对环境保护的贡献。
食品工业中的应用
探讨精馏在食品工业中的创新应用和效果。
结束语
总结课程内容并展望精馏技术在未来的发展趋势,鼓励学习者继续深入研究该领域。
精馏技术的优化方法
介绍精馏技术的优化策略和实践,提高
节能技术
2
效率和生产力。
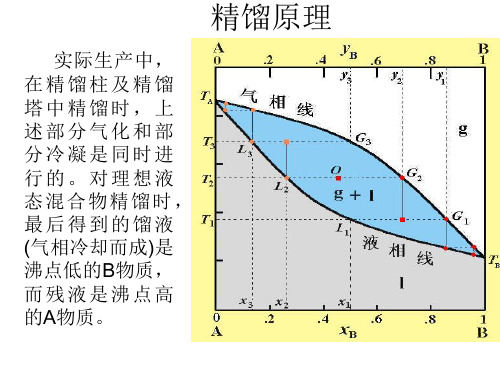
精馏原理 精馏原理.ppt
会溶温度的高低反映了一对液体间的互溶能力, 可以用来选择合适的萃取剂。
(2) 具有最低 会溶温度
(3)同时具有最高 、最低会溶温度
水和烟碱
(4)不具有 会溶温度
乙醚与水
2. 部分互溶系统气-液平衡的 T-x 相图
tg
p=const.
Q
a’ b’ c’
P
g+ l1 l1 L1
l1+l2 a
g+ l2
(c) 相图分析
帽形区外,溶液为单一液相; 帽形区内,溶液分为两相。
在373 K时,两层的组成分别 为A’和A”,称为共轭层(conjugate layers),A’和A”称为共轭配对点。
是共A轭n层组成的平均值。
共轭溶液的组成可由与之 对应的两个相点(A’,A”)读出。 相点间的联线称为结线(A’ A”), 在结线上可用杠杆规则计算两相 的相对量。
对于 H2O - C2H5OH 体系,若乙醇的含量小于 95.57,无论如何精馏,都得不到无水乙醇。只有 加入 CaCl 2 ,分子筛等吸水剂,使乙醇含量超过 95.57,再精馏可得无水乙醇。
非理想的完全互溶双液系
(3) 对拉乌尔定律发生负偏差
CHCl3 (A)- (CH3)2O (B)系统
pl
t=const.
对于一般正、负偏差的情况,对于易挥发组分始 终有气相组成大于液相中的组成,但存在最大正、负 偏差时不成立。
[例] 在50℃时两种液体A与B的饱和蒸汽压分 别为255与470mmHg,当A与B形成完全互 溶的溶液时,xA=0.3,A与B的平衡分压分 别是182mmHg与433mmHg,则此二元溶液 在常压下的T-x图应该是
即:
p
p* A
(2) 具有最低 会溶温度
(3)同时具有最高 、最低会溶温度
水和烟碱
(4)不具有 会溶温度
乙醚与水
2. 部分互溶系统气-液平衡的 T-x 相图
tg
p=const.
Q
a’ b’ c’
P
g+ l1 l1 L1
l1+l2 a
g+ l2
(c) 相图分析
帽形区外,溶液为单一液相; 帽形区内,溶液分为两相。
在373 K时,两层的组成分别 为A’和A”,称为共轭层(conjugate layers),A’和A”称为共轭配对点。
是共A轭n层组成的平均值。
共轭溶液的组成可由与之 对应的两个相点(A’,A”)读出。 相点间的联线称为结线(A’ A”), 在结线上可用杠杆规则计算两相 的相对量。
对于 H2O - C2H5OH 体系,若乙醇的含量小于 95.57,无论如何精馏,都得不到无水乙醇。只有 加入 CaCl 2 ,分子筛等吸水剂,使乙醇含量超过 95.57,再精馏可得无水乙醇。
非理想的完全互溶双液系
(3) 对拉乌尔定律发生负偏差
CHCl3 (A)- (CH3)2O (B)系统
pl
t=const.
对于一般正、负偏差的情况,对于易挥发组分始 终有气相组成大于液相中的组成,但存在最大正、负 偏差时不成立。
[例] 在50℃时两种液体A与B的饱和蒸汽压分 别为255与470mmHg,当A与B形成完全互 溶的溶液时,xA=0.3,A与B的平衡分压分 别是182mmHg与433mmHg,则此二元溶液 在常压下的T-x图应该是
即:
p
p* A
化工原理第一节 精馏1.概述、相平衡(课堂PPT)

1.相律:求气液平衡时物系的自由度
F = N(组分)-φ(相数)+2
= 2-2+2=2
参数:P、t、y A、x A,物系中只有2个自由度;如果再固定P一定 F=1,x (y)~ t 或 y ~ x 一一对应
讨论气液平衡的工程目的:
即找出一定压力下的 t~y(x) 和 y~x 关系
2
13
2. 理想物系(虽实际不存在,但处理简单) 理想溶液,服从拉乌尔定律
2
9
三. 特 点
1.流程简单,无溶剂加入,可直接获得产品; 2.分离程度高,应用广泛; 3.发生相变(须造成两相),故能耗大。
精馏塔设计容量范围比其它过程设备大得多 单塔直径:0.3~10米,高度:3~75米
2
10
四.蒸馏费用和操作压强
1. 操作费用:
汽化:需提供热量 冷凝:需提供冷量 操作费用为加热费、冷却费、料液输送费用之和。
(1)正偏差溶液: (实际的相平衡线总是位于理想线上方☺)
a AB(吸引力)<< a AA (吸引力)或 a BB (吸引力)
P A > p A o x A p A、p B比拉乌尔定律预 计的要高
2
28
回忆:理想物系(pA~xA; pB~xB/xA呈线性关 系)
理想溶液,服从拉乌尔定律
两个含义
理想气体,服从道尔顿分压定律 p o A x A 或p o A x A理想气体定律
大小是混合液分离难易程度的标志
2
21
4.双组分相图(以图表示的相平衡)
(1)x(y)~ t 图
2
两线
气相线
液相线
三区:
过热蒸气
Superheat Vapour 过冷液体
精馏原理介绍PPT精选文档

0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
x
5
例应用下表的苯和甲苯的蒸汽压数据,求平均相对挥发度 m和体系 的y~x 曲线。
解:此物系可以视为理想物系
p0A/ pB0
t/℃
80.1 84 88 92 96 100 104 108 110.6
pA0/kPa 101.3 114 128.4 144.1 161.3 180.0 200.2 222.4 237.7
F
85
80
75 0 .0
x' m 0 .2
x F
0 .4
0 .6
x or y
A
y n
0 .8
1 .0
12
多次部分汽化和多次部分冷凝示意图
缺点:产品量少、能量损失
Vn
Vn-1
feed s te a m
V0 w ater
V1
L1 V '1
water
water Ln
Ln-1
V 'm-1
s te a m
V 'm
组分进行衡算,得
FDW
F,
D , xD
xF
FF xDDx WW x
一般,F、xF、xD、xW为已知量;
W、D为未知量。求解方程组可得
W,
xw
D F xF xW W F xD xF
xD xW
xD xW
精馏过程经常用回收率表示:
易挥发组分回收率
1=DFxxFD 100%
难挥发组分回收率
2=W F((11xxW F))10% 0
0 .4
0 .6
0 .8
1 .0
化工基础6精馏.pptx

分子间作用力FAA或纯组分B
的分子间作用力FBB大。 ❖蒸汽压偏低。
y
x( y)
❖液相线上移。
❖一定条件下具有最高恒沸点。
❖不能得到某一组分的纯物质。
水-硫酸,氯化氢-水,溴化氢-水, 水-过氯酸,丙酮-氯仿等体系。
x
硝酸-水(负偏差)
2021/3/5
第六章 精 馏
18
化工基础
College of Chemistry & Materials
2021/3/5
第六章 精 馏
22
化工基础
College of Chemistry & Materials
(2) 压力显著减小
相对挥发度增加,x-y相图上平衡线上移。 恒沸点组成发生变化。 压力降低到一定程度,原来的恒沸点消失。 组分的相对分子质量越大,沸点降低的趋势越大。
乙醇-水体系的恒沸组成随系统压力的变化
2021/3/5
第六章 精 馏
3
2、基本概念
化工基础
College of Chemistry & Materials
易挥发组分:通常将沸点低的组分称为易挥发组分。
难挥发组分:通常将沸点高的组分称为难挥发组分。
x 表示液相中易挥发组分的摩尔分率, (1-x)表示难挥发组分的摩尔分率; y表示气相中易挥发组分的摩尔分率, (1-y)表示难挥发组分的摩尔分率。
College of Chemistry & Materials
pB pB* xB pB* 1 xA
P pA pB p*AxA pB* 1 xA
xA
P pB* p*A pB*
yA
pA P
p*A xA P
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p
0 A
pB0
上式为一定总压下汽相组成与温度的关系式。该温度又称为露点 (dew-point),上式又称为露点方程。
严格地说没有完全理想的物系。对那些性质相近、结构相似的组分 所组成的溶液,如苯-甲苯,甲醇-乙醇等,可视为理想溶液;若汽相 压力不太高(<10Mpa),可视为理想气体,则物系可视为理想物系。
1.3 汽液平衡关系式的表示方法 汽液两相平衡组成常用相平衡常数 K 或相对挥发 的关系式来表达。
1.3.1相平衡常数
Ki 表示 i 组分的相平衡常数,其定义为
Ki
yi xi
=f(物系 , T,P )
式中: yi 和 xi 分别表示 i 组分在互为平衡的汽、液两相中的摩尔分数。 对于易挥发组分,Ki >1,即 yi > xi。
溶液沸腾时,溶液上方的总压应等于各组分分压之和,即
P
pA
pB
p
0 A
xA
pB0 1
xA
xA
P pB0
p
0 A
pB0
泡点方程(bubble-point equation)
poA、poB 取决于溶液沸腾温度,上式表达一定总压下液相组成与溶液泡
点温度关系。已知溶液的泡点可由上式计算液相组成;反之,已知溶液
多组分精馏:例如原油的分离。 双组分精馏:如正异构丁醛,苯-甲苯体系等。
简单蒸馏或平衡蒸馏:用在分离要求不高的情况下。 精馏:分离纯度要求很高时采用。 特殊精馏:混合物中各组分挥发性相差很小,难以用普通精馏分离,
借助某些特殊手段进行的精馏。
1 双组分溶液的气液相平衡关系
蒸馏分离的物系由加热至沸腾的液相和产生的蒸汽相构成。相平衡 关系是蒸馏过程分析的重要理论基础。
若液相也为理想溶液,液相的活度系数就等于1,则
Ki
pi0 P
此式即为拉乌尔定律表达式。
对多组分物系汽液平衡关系的计算,应用相平衡常数比较方便。
1 双组分溶液的气液相平衡关系
1.3.2 相对挥发度 α
溶液中各组分的挥发性由挥发度来量衡,定义为组分在汽相中的 平衡蒸汽压与在液相中的摩尔分数的比值。对双组分物系
继续加热,随温度升高,物系变为 互成平衡的汽液两相,两相温度相 同组成分别为 yA 和 xA 。
t/C
气相区
露点 两相区
露点线
泡点
泡点线
液相区
0
xA
xf
yA 1.0
x(y)
当温度达到该溶液的露点,溶液全部汽化成为组成为 yA= xf 的气相, 最后一滴液相的组成为 xA。
1.2.2汽液平衡相图:x-y 图
Ki 值越大,组分在汽、液两相中的摩尔分数相差越大,分离也越容易。
对多组分物系汽液平衡关系的计算,应用相平衡常数比较方便。
气(汽)液相平衡时,两相的温度和压强相等,每个组分在两相中的逸 度(fugacity)相等,即
fˆiG fˆi L
对非理想物系,气(汽)、液相的逸度服从下列方程:
fˆiG Pyii
组成也可算出溶液泡点。
纯组分 饱和蒸汽压与温度的关系,用安托因(Antoine)方程表示:
log p0 A B tC
A、B、C 为安托因常数,可由相关的手册查到。
6.1 双组分溶液的气液相平衡关系
当汽相为理想气体时
yA
pA Pp0 A来自xAPxA
P pB0
p
0 A
pB0
yA
p
0 A
P
P pB0
fˆi L fi L xi i
式中:i — 气(汽)相 i 组分的逸度系数; i — 液相 i 组分的活度系数;
fiL — 纯液体 i 在系统温度、压力下的逸度,可由下式计算
fiL
pi0i0 expViL
P pi0 RT
式中: pio — 纯组分i 的饱和蒸汽压;
io — 纯组分 i 的逸度系数;
对非理想物系不能简单地使用上述定律。汽液相平衡数据更多地依靠 实验测定。
1 双组分溶液的气液相平衡关系
1.2.1 汽液平衡相图: T-x(y) 图
T-x(y) 图代表的是在总压 P 一定的条 件下,相平衡时汽(液)相组成与 温度的关系。
在总压一定的条件下,将组成为 xf 的溶液加热至该溶液的泡点 tA,产 生第一个气泡的组成为 yA。
ViL — 纯液体 i 的摩尔体积。
根据相平衡常数的定义
Ki
yi xi
fiL i Pi
式中 i,i 的计算与气(汽)相组成和液相组成有关,相平衡常数 K 不
仅与系统温度、压强有关,也与组成有关。
当系统压力较低,气相近似为理想气体时,气相逸度系数 i 接近于1,
有
Ki
pi0 P
i
液相为非理想溶液,汽相为理想 气体的相平衡常数计算式
1.1 理想物系的汽液平衡
理想物系:
液相为理想溶液、汽相为理想气体的物系。理想溶液服从拉乌尔 (Raoult)定律,理想气体服从 道尔顿分压定律。 根据拉乌尔定律,两组分物系理想溶液上方的平衡蒸汽压为
pA
p
A
x
A
pB pB xB
式中:poA、poB ——溶液温度下纯组分饱和蒸汽压。
6.1 双组分溶液的气液相平衡关系
•平衡线位于对角线的上方,平衡线偏离对角线愈远,表示该溶液愈易 分离。
2020/9/29
1.2.2汽液平衡相图:x-y 图 ➢x-y 图代表在总压一定下,液相组成和与之成平衡的汽相组成的关系。 ➢x-y 图可通过 T-x(y) 图作出,图中对角线 (y=x) 为一参考线。 ➢大多数溶液,两相平衡时,y 总是大于 x,平衡线位于对角线上方。 ➢平衡线偏离对角线越远,该溶液越易分离。
蒸馏操作实例:石油炼制中使用的 250 万吨常减压装置
概述
3. 蒸馏的分类
间歇精馏:多用于小批量生产或某些有特殊要求的场合。 连续精馏:多用于大批量工业生产中。
常压蒸馏:蒸馏在常压下进行。 减压蒸馏:常压下物系沸点较高或热敏性物质不能承受高温的情况 加压蒸馏:常压下为气体的物系精馏分离,加压提高混合物的沸点.
A
pA xA
B
pB xB
对纯组分液体,其挥发度就等于该温度下液体的饱和蒸汽压。
蒸馏
概述
1.工作原理: 利用液体混合物中各组分挥发性差异,以热能为媒介 使其部分汽化从而在汽相富集轻组分液相富集重组分而使混合液 分离。
原料液 加热器 减压阀 Q
塔顶产品
yA
闪 蒸 罐 xA
yA xA 或
yA xA yB xB
塔底产品
2. 蒸馏操作的用途
许多生产工艺常常涉及到互溶液体混合物的分离问题,如石油炼制 品的切割,有机合成产品的提纯,溶剂回收和废液排放前的达标处 理等等。分离的方法有多种,工业上最常用的是蒸馏或精馏。
