细胞爬片免疫组化
细胞爬片染色步骤

免疫组化法:
1 胰酶消化细胞,收集至离心管;调整样本细胞数为1×106/ml;
2 将单细胞悬液滴加至平皿内无菌载玻片表面,置于37℃ 5%的加湿CO2孵箱中过夜,使细胞爬片。
3 吸弃平皿内培养上清,加入新鲜培养基,用无菌培养基洗3次;
4 PBS冲洗相应方案的载玻片3次;
5 将载玻片置于95%乙醇中固定约1h;
6 倒置相差显微镜下观察,并划定载玻片上细胞爬片密集区;
7 在相应区域滴加按一定比例稀释后一抗,4℃冰箱内过夜湿孵。
阴性对照以PBS缓冲液代替一抗。
8 先暂复温30min,后PBS冲洗载玻片3次;
9 滴加二抗,室温湿孵30min;后PBS冲洗载玻片3次;
10 DAB显色:将配置好的DAB溶液滴加至载玻片上,室温下孵育3min至载玻片略显黄色;
11 清水充分冲洗载玻片,苏木素复染核3-5min,清水冲洗,盐酸酒精分化20s,清水冲洗,氨水返蓝3min,清水冲洗,后置于75%-80%-95%-无水酒精中脱水,每步骤约2min;
12 将载玻片置于1、2、3道二甲苯中,各约15min,中性树脂封片,置于阴凉通风处风干。
免疫组化基本步骤

细胞免疫组化染色步骤1.细胞爬片,取出后,PBS洗三遍,每次3分钟。
4℃冷丙酮固定10分钟,(或用4%多聚甲醛固定30分钟),干燥30分钟。
2. 用PBS洗三次,每次5分钟,加3%过氧化氢30μl,室温孵育10分钟,(以消除内源性过氧化物酶的活性)蒸馏水冲洗,PBS洗三次,每次5分钟。
3.加1%的Triton X-100 30μl,室温孵育10分钟,增加细胞膜的通透性。
蒸馏水冲洗,PBS洗三次,每次5分钟。
4.滴加正常山羊血清30μl,封闭非特异性结合位点,以消除非特异性染色,室温孵育30分钟,倾去勿洗。
5.滴加适当稀释度的一抗,空白对照组以PBS代替一抗,4℃湿盒孵育过夜。
PBS洗三次,每次5分钟。
6.滴加生物素标记的二抗工作液30μl,室温孵育30分钟。
PBS洗三次,每次5分钟。
7.滴加辣根酶标记链酶卵白素30μl,室温孵育30分钟。
PBS洗三次,每次5分钟。
8.滴加DAB显色剂30μl,显微镜下观察显色,自来水冲洗。
9. 将处理好的玻片细胞核衬染:浸入苏木精染液染色2min,自来水洗,迅速过盐酸酒精溶液,自来水洗,过氨水溶液,自来水洗。
10.梯度酒精脱水,过70%酒精1次,95%酒精2次,无水乙醇3次,每次1min11.二甲苯透明,过二甲苯溶液3次,每次1min。
12.中性树胶封片将有细胞的一面向下,用中性树脂封片。
稀盐酸酒精溶液:用75%酒精配制1%盐酸。
淡氨水溶液:在400ml自来水中滴2滴浓氨水(使细胞核蓝化)另外:需1%TritonX-100增加细胞膜通透性。
苏木素复染时间和盐酸酒精脱色时间需自己摸索,我是染5-6秒脱色1-2秒。
盐酸酒精还可用70%乙醇配制1%盐酸。
我没用淡氨水溶液。
若为悬浮细胞则需涂片,20µl即可。
细胞免疫组织化学实验流程及注意事项

九、细胞免疫组化实验
1. 细胞爬片的制作
(1) 细胞用消化液消化后,用完全培养基重悬细胞,调整细胞浓度为2-5×10^5ml ;
(2) 在无菌培养皿中铺上3 块细胞爬片(圆片),圆片间不要重叠;
(3) 取细胞悬液分别滴到圆片或载玻片上,注意不要滴到片外,让细胞贴片30min 左右;
(4) 30min后,在培养皿中补加完全培养液(轻微的加入,以免冲力将贴壁的细胞打下来),放于37°C,5%CO2培养箱中培养3h左右(让其贴壁更牢)
2. 组化前处理
(1) 取出培养皿,用PBS 漂洗3 次×2min (PBS 可以不灭菌);
(2) 4%多聚甲醛处理(室温)10-30min ;
(3) PBS 漂洗,3 次×2min ;
(4) 0.2%Txiton X-100 处理(室温)10-15min ;
(5) PBS 漂洗,3×2min;
(6) 3%H2 O2 处理(室温)10min ,以消除过氧化物酶;
(7) PBS 漂洗,3 次×2min ;
3. 组化(同免疫组化)。
贴壁细胞需要做免疫组化时,可以在培养皿里放入盖玻片,让细胞长在上面后,在取出来进行实验。
需要注意的是:取出培养好细胞的盖玻片后,PBS洗两次后,室温晾干用PFA或丙酮室温或4度固定都可以,10~15分钟。
之后可按组化常规方法进行。
封片时将有细胞的面向下盖在载玻片上即可。
另外,用丙酮固定细胞的同时即对细胞膜进行了打孔的步骤,如果用PFA进行固定,则需要再使用打孔剂打孔(细胞内表达)。
使用过氧化氢去除内源性过氧化物酶时,细胞要比石蜡切片的组织反应强烈,偶尔会掉片。
免疫细胞化学步骤及说明

1. 细胞爬片制备盖玻片在75%酒精浸泡24h以上,超净台内酒精灯上烤干。
六孔板内分别滴入一滴培养液,盖上盖玻片。
分别加入等量细胞,常规培养至细胞70%左右融合。
关于盖玻片的准备,有很多种说法,但我的做法比较简单,这样做不会脱片,也不影响观察。
2. 细胞固定6孔板置冰上冷却,吸尽培养液。
4℃PBS,洗5min×3次。
吸去残留PBS,空气干燥,细胞面微潮湿时,加入预冷95%酒精固定液,浸没细胞面,更换预冷95%酒精2次,第三次在-20℃静置20min。
这一步用4%多聚甲醛可能更省时省事。
3. SP法免疫组化染色步骤(1)细胞爬片蒸馏水洗5min×1次,PBS浸泡5min。
固定之后的细胞一般不会脱落,可以放在摇床上洗。
(2)滴加3%H2O2去离子水,室温孵育30min。
PBS洗5min×3次。
(3)滴加0.3%Triton X-100(全液用蒸馏水稀释)通透30min。
PBS洗5min×3次。
细胞通透很重要,因为蛋白在胞内,我第一次做时没有通透,结果什么都没有。
(4)BSA封闭,室温10min。
倾去,勿洗。
(5)滴加一抗(a-actin l:300),4℃过夜。
PBS洗5min×3次。
抗体的浓度是自己摸索出来的,还有听说4℃过夜是比较合适的做法。
(6)滴加二抗(聚合HRP标记抗小鼠IgG),室温30min。
PBS洗5min×3次。
(7)按1mL蒸馏水+A、B、C(DAB试剂盒,要按顺序滴加)各一滴,混匀,镜下显色观察,注意避光。
蒸馏水充分冲洗。
(8)苏木素染2min。
自来水充分冲洗。
(9)依次在75%→85%→95%→100%浓度酒精中浸泡2min脱水。
封片之前常规有二甲苯透明的,但我滴加了二甲苯之后,片子变得很脏,不知什么原因。
后来就不加了,直接脱水后封片,现在看来片子还不错啊。
而且二甲苯太呛人了。
(10)中性树胶封片。
爬片和组化的实验步骤

爬片和组化的实验步骤实验九组织切片与细胞爬片/涂片的HE染色【实验目的】1.掌握细胞涂片的HE染色方法2.熟悉细胞涂片及爬片的制备方法【实验原理】苏木素-伊红染色又称HE染色,是目前应用最广泛的染色方法。
苏木精染液为碱性,主要使细胞核内的染色质与胞质内的核糖体着紫蓝色;伊红为酸性染料,主要使细胞质和细胞外基质中的成分着红色。
HE染色主要用于显示各种组织的正常成分和病变组织的一般形态结构,各种组织或细胞的一般形态、结构特点和病变的发生、发展及修复的全过程,在质量较佳的HE染色切片上,基本上都可以观察到,从而进行判定或研究。
HE 染色适用于各种固定、包埋方法制作的石蜡切片、冰冻切片和细胞涂片,且切片不易褪色,可以长期保存。
HE染色在病理诊断、教学和科研中具有重要的价值。
【实验方法】1.细胞爬片的制备(1)将灭菌的载玻片放入培养板内。
(2)将培养好的贴壁细胞消化后离心,计数,按照一定的细胞密度加入孔板中,根据实验目的选择培养基或加入药物。
(3)将孔板放入37℃二氧化碳孵箱中孵育数小时或过夜,待细胞的贴壁密度符合实验要求时,吸去孔板内的培养基或药物,用37℃预温的0.1mol/LPBS漂洗一次。
(4)吸去孔板内的PBS液,加入4%多聚甲醛室温固定15~30min。
(5)吸去4%多聚甲醛,用PBS漂洗3次,每次间隔3min。
(6)取出细胞爬片,晾干后存放于-20℃或直接进行染色。
2.细胞爬片的制备备选方法将培养好的贴壁细胞消化后离心,计数,按照一定的细胞密度加入孔板中(24孔),根据实验目的选择培养基或加入药物,培养到预定时间点。
取出培养板,1000rpm离心5min后,弃上清。
每孔加入PBS2ml,1000rpm离心5min,弃上清;重复1次,共进行2次洗涤。
3.细胞涂片的制备收集处理的细胞,PBS洗2次后,调细胞密度为0.3~0.5某106/ml,按照每片0.1ml,用涂片离心机制备涂片;或者调细胞密度为0.3~0.5某107/ml,取0.005ml涂于载玻片上。
细胞爬片免疫组化步骤

1.转染48小时后,弃去旧液,1ml PBS洗两遍用BD公司的固定透膜液400ul (Fixation and Permeabilization Solution)于4度冰箱内固定透膜20分钟后,PBS洗两遍
2.用弯曲的针头挑起爬片,镊子夹出置于载玻片上,内源性过氧化物酶阻断剂室温(无色液体)孵育10分钟
3.吸水纸吸去阻断剂后将玻片在摇床上PBS中洗3次,每次5分钟。
(若洗的次数多则细胞脱片程度也有可能加大,摇洗的力度也不宜过高)
4.滴加试剂A(蓝色液体)室温孵育10分钟,用吸水纸从一侧吸去,勿洗。
5滴加20倍稀释的单抗,800倍稀释的感染血清,于湿盒内37度孵育2小时。
6.吸水纸吸去稀释后的一抗,在摇床上PBS洗3次,每次5分钟。
7.滴加试剂B(黄色液体)室温孵育10分钟。
8.吸水纸吸去试剂B后,于摇床上PBS洗3次,每次5分钟。
9.滴加试剂C(橙色液体)室温孵育10分钟。
10.吸水纸吸去试剂C后,于摇床上PBS洗3次,每次5分钟。
11.显色剂DAB显色。
细胞免疫组化

步骤(SP三步法,也可选择其它方法):1、固定:4%PFA或丙酮甲醇1:1固定细胞爬片室温20min,然后用PBS洗3遍,3min/次;2、细胞通透:用终浓度为0.3%的triton(溶于PBS)通透细胞,约室温半小时;但丙酮可以省略这一步。
3、浸洗:PBS 3*3min/次;4、封闭:一般用5%羊血清(与二抗来源一致,但也可用BSA)室温封闭10-30min;5、一抗孵育:用合适的一抗浓度先4℃过夜,然后37度或室温复温45min;6、浸洗:PBS 5*5min/次;7、二抗孵育:用生物素标记的二抗孵育37度0.5-1h,或室温1-2h;8、浸洗:PBS 5*5min/次;9、SP反应:孵育37度0.5-1h;10、浸洗:PBS 5*5min/次;11、DAB显色:一般3-10min,具体时间由镜下看到背景来控制;12、苏木素复染、封片、镜下观察。
PBS 3*5 min/次,镜下观察细胞免疫组化的具体步骤:1.载玻片经防脱片剂处理(Poly-L-Lysine)。
2.培养细胞也可涂片或贴片生长。
3.固定方案首选4%多聚甲醛或10%福尔马林固定30分钟;对不能耐受甲醛固定的抗原,纯丙酮室温固定30分钟。
蒸馏水洗。
(干燥后可冰冻保存)4. 30%H2O2 1份+纯甲醇50份混合,室温浸泡30分钟,以灭活内源性过氧化物酶,蒸馏水洗3次。
5.滴加5%BSA封闭液,室温20分钟。
甩去多余液体, 不洗。
6.滴加适当稀释的一抗(小鼠或兔IgG),37 ℃ 1小时左右或20℃时2小时左右。
也可4℃过夜。
PBS(pH7.2-7.6)洗2分钟×3次。
(一抗的稀释度、孵育时间和温度与染色强度、背景有直接关系。
一般来说,阳性染色强度不够时,可提高一抗浓度和延长孵育时间;背景过高时,可降低一抗浓度和缩短孵育时间。
)7.滴加生物素化山羊抗小鼠IgG(或兔、人IgG),20-37℃ 20分钟。
PBS(pH7.2-7.6)洗2分钟×3次。
免疫组化(总结)

免疫组化免疫组织化学的概念:免疫组化是利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素) 显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学。
免疫组化实验所用的组织和细胞标本:实验所用主要为组织标本和细胞标本两大类,前者包括石蜡切片(病理大片和组织芯片)和冰冻切片,后者包括组织印片、细胞爬片和细胞涂片。
其中石蜡切片是制作组织标本最常用、最基本的方法,对于组织形态保存好,且能作连续切片,有利于各种染色对照观察;还能长期存档,供回顾性研究;石蜡切片制作过程对组织内抗原暴露有一定的影响,但可进行抗原修复,是免疫组化中首选的组织标本制作方法抗原修复——原因:常规的石蜡切片标本均用甲醛固定,结果使得:-抗原性物质形成醛键、羧甲键而被封闭了部分抗原决定簇;-蛋白之间发生交联而使抗原决定簇隐蔽。
*要求:在染色时,需要先进行抗原修复或暴露,即将固定时分子之间所形成的交联破坏,而恢复抗原的原有空间形态。
进行抗原暴露和修复的原则:1、寻找抗体说明的有关信息2、如无信息可先不经处理做免疫组化3、如染色结果呈阴性或阳性结果不理想,可用酶消化4、如还不理想用高温办法处理5、如再不理想可用酶和高温相结合处理6、如仍然是阴性结果,可能该抗体质量有问题。
常用的抗原修复方法:微波修复法,高压加热法,酶消化法,水煮加热法1.柠檬酸缓冲液高温高压抗原修复法(1)适用范围:适用于大量中性福尔马林固定、石蜡包埋组织切片的抗原修复,其效果优于微波修复法和直接煮沸修复法。
(2)仪器设备:普通家用压力锅、电炉、不锈钢或耐高温塑料切片架。
(3)试剂:0.01M 柠檬酸型缓冲液,pH6.0。
(3)操作步骤:①常规组织切片经二甲苯脱蜡、梯度酒精水化至水,待用;②取一定量0.01M柠檬酸盐缓冲液pH6.0(800~1000ml)于压力锅中,加热直至沸腾;将脱蜡水化后的组织切片置于不锈钢或耐高温塑料切片架上,放入已沸腾的缓冲液中,盖上锅盖,扣上压力阀,继续加热至喷气,开始计时1-2分钟后,压力锅离开热源,冷却至室温(稍冷后,可在自来水龙头下加速冷却),取出切片,先用蒸馏水冲洗两次,之后用PBS(pH7.2-7.4)冲洗两次,每次3分钟。
细胞爬片的固定和免疫组化

【细胞爬片的固定】细胞爬片取出后,一般用PBS洗2遍,然后再做固定。
当然,根据研究目的,PBS洗也不是一定要做的,比如做凋亡的TUNEL染色时就避免洗,因为凋亡的细胞在洗的过程中有可能会脱落。
另外在保存细胞爬片的时候,我一般用培养皿或板,先在皿底放一层面巾纸,然后再放爬片,这样方便做实验时取片。
然后盖上盖子,并在盖子上做标记,为避免混淆,可用透明胶带将盖子和皿连在一起。
一般-20℃保存2-3个月的片子做免疫组化是没有问题的。
以下为常用的固定液1. 冷丙酮可用于一般的免疫组化染色。
将纯的丙酮预先放入冰箱-20℃后便为冷丙酮(放心,丙酮在此温度不会为固体的)细胞爬片取出后,PBS洗2遍,便可加入冷丙酮于-20℃(丙酮有很强的挥发性,注意将含有丙酮和爬片的器皿盖严,防止其挥发)固定10分钟。
取出后,室温吹干,然后放入-20℃保存。
2. 多聚甲醛(常用4%):可用于免疫电镜;也可用于免疫荧光以及TUNEL染色。
主要检测组织内一些性能娇弱的抗原特别是细胞表面抗原,例如各类淋巴细胸分化决定簇(CD)、主要组织相容性抗原等室温固定15分钟后,将表面液体吹干,入-20℃保存3. 95%乙醇,可用于免疫组化。
优点:穿透性强、抗原性保存较好。
缺点:但醇类对低分子蛋白质、多肽及胞浆内蛋白质保存效果较差,使蛋白变性的作用轻,固定后可再溶解;染色过程中,温育时间长,抗原可流失而减弱反应强度室温固定15分钟后,将表面液体吹干,入-20℃保存4. 甲醛(福尔马林)应用最广优点:形态结构保存好,且穿透性强,缺点:甲醛放置过久可氧化为甲酸,使溶液pH降低,影响染色;分子间交联形成的网格结构可能部分或完全掩盖某些抗原决定簇,使之不能充分暴露。
可造成假阴性的染色结果。
实验步骤简介:1. 细胞爬片:冷丙酮或4%的多聚甲醛固定的细胞爬片,置0.1mol PBS 室温10分钟复水。
2. 修复:滴加复合消化液(0.125胰蛋白酶% +0.1胃蛋白酶%+0.01 EDTA% )(0.1molPBS 配制)4度30-40分钟0.1mol PBS 洗三次,每次一分钟3. 血清封闭:(试剂1)室温10分钟,倾去。
免疫组化实验步骤

免疫组化操作步骤一、实验原理与意义免疫组织化学又称免疫细胞化学,是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项新技术。
它把免疫反应的特异性、组织化学的可见性巧妙地结合起来,借助显微镜(包括荧光显微镜、电子显微镜)的显像和放大作用,在细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以及受体等)。
(一)、仪器设备1. 18cm不锈钢高压锅或电炉或用微波炉.2. 水浴锅(二)、试剂1. PBS缓冲液(ph7.2―7.4):NaC137mmol/L,KCl2.7mmol/L ,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L. 2.0.01mol/L柠檬酸钠缓冲液(CB,ph6.0,1000ml):柠檬酸三钠3g,柠檬酸0.4g。
3.0.5mol/L EDTA缓冲液(ph8.0):700ml水中溶解186.1g EDTA& 8226;2H2O,用10mmol/L NaOH调至ph8.0,加水至1000ml.4. 1mol/L的TBS缓冲液(ph8.0):在800ml水中溶解121gTris碱,用1N的HCl调至pH8.0, 加水1000ml。
5. 酶消化液:a.0.1%胰蛋白酶:用0.1%CaCl 12(ph7.8)配制。
b.0.4%胃蛋白酶液:用0.1N的HCl配制。
6. 3%甲醇―H2O2溶液:用30%H2O2和80%甲醇溶液配制7. 风裱剂:a.甘油和0.5mmol/L碳酸盐缓冲液(pH9.0–9.5)等量混合 b 油和TBS(PBS)配制8.TBS/PBS PH9.0–9.5,适用于荧光纤维镜标本;ph7.0-7.4适合光学纤维标本(三)、操作流程1、脱蜡和水化:脱蜡前应将组织芯片在室温中放置60分钟或60℃恒温箱中烘烤20分钟。
a 组织芯片置于二甲苯中浸泡10分钟,更换二甲苯后在浸泡10分钟b 无水乙醇中浸泡五分钟c 95%乙醇中浸泡五分钟d 75%乙醇中浸泡五分钟2、抗原修复:用于福尔马林固定的石蜡包埋组织芯片:A 抗原热修复a 高压热修复在沸水中加入EDTA(ph8.0)或0.01m枸橼酸钠缓冲溶液(ph6.0).盖上不锈钢锅盖,但不能锁定。
细胞爬片的免疫组化

细胞爬片的免疫组化(05-9-25)
实验目的:
1、通过免疫组化的方法观察C6细胞GFAP和MAP2的表达情况;
2、进一步熟悉和完善免疫组化的方法;
3、进一步检测现有一抗是否起作用。
实验准备:
1、接种两天、生长状态良好的细胞爬片;
2、免疫组化/荧光公共实验平台;
3、一抗,SP试剂盒,DAB显色剂等。
主要过程:
1、爬片弃废液,PBS洗3min×3遍;
2、4%PFA室温固定10min;
3、PBS洗3min×3遍;
4、加SP试剂盒中的A(过氧化物酶阻断剂),室温作用10min;
5、PBS洗3min×3遍;
6、加B(正常非免疫动物血清封闭液),室温作用10min;
7、加一抗:mouse anti GFAP 1:50,MAP2 1:50各50μl对照加等量PBS,4℃
保湿8h;
8、PBS洗3min×遍;
9、加C(生物素化二抗),室温作用10min;
10、PBS洗3min×3遍;
11、加D,室温作用10min;
12、PBS洗3min×3遍;
13、新鲜配制的DAB显色,显微镜下观察,适时终止(5min左右,PBS洗
掉);
14、PBS洗3min×3遍;
15、苏木素复染胞核1min,自来水小心冲洗至玻片呈蓝色;
16、梯度酒精脱水(70%、80%、90%、95%、100%)各5min;
17、二甲苯/无水乙醇1:1 10min;
18、二甲苯透明:15min×2;
中性树胶封片,观察、拍照。
免疫组化实验步骤

免疫组化实验步骤免疫组化操作步骤一、实验原理与意义免疫组织化学又称免疫细胞化学,是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项新技术。
它把免疫反应的特异性、组织化学的可见性巧妙地结合起来,借助显微镜(包括荧光显微镜、电子显微镜)的显像和放大作用,在细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以及受体等)。
(一)、仪器设备1. 18cm不锈钢高压锅或电炉或用微波炉.2.水浴锅(二)、试剂1. PBS缓冲液(ph7."2―7."4):NaC137mmol/L,KCl2."7mmol/L ,Na2HPO44."3mmol/L, KH2PO41."4mmol/L.2."0.01mol/L柠檬酸钠缓冲液(CB,ph6."0,1000ml):柠檬酸三钠3g,柠檬酸0."4g。
3.0."5mol/L EDTA缓冲液(ph8."0):700ml水中溶解186."1g EDTA& 8226;2H2O,用10mmol/L NaOH调至ph 8."0,加水至1000ml.4. 1mol/L的TBS缓冲液(ph8."0):在800ml水中溶解121gTris碱,用1N的HCl调至pH 8."0,加水1000ml。
5.酶消化液:a.0."1%胰蛋白酶:用0."1%CaCl 12(ph7."8)配制。
b.0."4%胃蛋白酶液:用0."1N的HCl配制。
6. 3%甲醇―H2O2溶液:用30%H2O2和80%甲醇溶液配制7.风裱剂:a.甘油和0."5mmol/L碳酸盐缓冲液(pH9."0–9."5)等量混合b油和TBS(PBS)配制8."TBS/PBS PH9."0–9."5,适用于荧光纤维镜标本;ph7."0-7."4适合光学纤维标本(三)、操作流程1、脱蜡和水化:脱蜡前应将组织芯片在室温中放置60分钟或60℃恒温箱中烘烤20分钟。
免疫组化基本步骤

细胞免疫组化染色步骤1.细胞爬片,取出后,PBS洗三遍,每次3分钟。
4℃冷丙酮固定10分钟,(或用4%多聚甲醛固定30分钟),干燥30分钟。
2. 用PBS洗三次,每次5分钟,加3%过氧化氢30μl,室温孵育10分钟,(以消除内源性过氧化物酶的活性)蒸馏水冲洗,PBS洗三次,每次5分钟。
3.加1%的Triton X-100 30μl,室温孵育10分钟,增加细胞膜的通透性。
蒸馏水冲洗,PBS洗三次,每次5分钟。
4.滴加正常山羊血清30μl,封闭非特异性结合位点,以消除非特异性染色,室温孵育30分钟,倾去勿洗。
5.滴加适当稀释度的一抗,空白对照组以PBS代替一抗,4℃湿盒孵育过夜。
PBS洗三次,每次5分钟。
6.滴加生物素标记的二抗工作液30μl,室温孵育30分钟。
PBS洗三次,每次5分钟。
7.滴加辣根酶标记链酶卵白素30μl,室温孵育30分钟。
PBS洗三次,每次5分钟。
8.滴加DAB显色剂30μl,显微镜下观察显色,自来水冲洗。
9. 将处理好的玻片细胞核衬染:浸入苏木精染液染色2min,自来水洗,迅速过盐酸酒精溶液,自来水洗,过氨水溶液,自来水洗。
10.梯度酒精脱水,过70%酒精1次,95%酒精2次,无水乙醇3次,每次1min11.二甲苯透明,过二甲苯溶液3次,每次1min。
12.中性树胶封片将有细胞的一面向下,用中性树脂封片。
稀盐酸酒精溶液:用75%酒精配制1%盐酸。
淡氨水溶液:在400ml自来水中滴2滴浓氨水(使细胞核蓝化)另外:需1%TritonX-100增加细胞膜通透性。
苏木素复染时间和盐酸酒精脱色时间需自己摸索,我是染5-6秒脱色1-2秒。
盐酸酒精还可用70%乙醇配制1%盐酸。
我没用淡氨水溶液。
若为悬浮细胞则需涂片,20µl即可。
心肌细胞和成纤维细胞免疫组化步骤

心肌细胞和成纤维细胞免疫组化步骤准备:1.心肌细胞培养常规准备(加洗盖玻片),六孔板2.免疫组化前的准备:溶液配制:1000mlPBS (0.02M,ph值为7.2-7.6),配法:1000ml蒸馏水中加氯化钠8.5g,磷酸氢二钠2.8g,磷酸二氢钠0.4g0.6%H2O2:30%H2O2一份加纯甲醇50份混合4%多聚甲醛一抗:抗体稀释成1:800、1:700、1:600 用抗体稀释液稀释成各1ml,装EP管中。
以上溶液在做免疫组化前配制苏木素染液, SABC, 5%BSA封闭液, DAB湿盒平皿10对实验步骤:1.细胞爬片心肌细胞:差速贴壁后,将心肌细胞以5×106的密度接种至含盖玻片的六孔板中(6个孔),48小时内加BRDU后换液,换成无血清培养基培养24小时后进行实验。
成纤维细胞:48小时后将贴壁的成纤维细胞用0.25%的胰酶消化后重悬细胞于含有盖玻片的小平皿中,24小时后进行实验。
2.ABC免疫酶染色A. 已经爬好的盖玻片,使其浸泡PBS5分钟,两次。
再将玻片浸泡入4%的多聚甲醛中,固定30分钟,风干,-20度保存。
B. 过蒸馏水两次,1-3分钟。
C. 30%H2O2一份加纯甲醇50份混合,室温浸泡30分钟。
蒸馏水洗3次,一次约一钟D. 滴加5%BSA封闭液,室温20分钟,甩去多余液体,不洗。
E. 滴加1:800、1:700、1:600的一抗,放入湿盒中4度过夜或37度1小时。
如4度过夜,拿出后在室温下复温20分钟,再水浴30分钟,37度。
F. 加二抗37度20分钟,用PBS冲3次,每次2分钟。
G. 滴加试剂SABC,37度,20分钟。
PBS洗4次,每次5分钟。
H. DAB显色: 取1ml蒸馏水,加试剂盒中的A,B,C试剂个一滴,混匀后加至切片。
室温显色,镜下控制反应时间,一般再5到30分钟,水中中止。
I.冲蒸馏水,苏木素复染2分钟,自来水冲5分钟J. 烤干,封片。
细胞爬片免疫组织化学染色注意事项

2.PBS洗 3.0.3%双氧水封闭10分钟。 4.PBS洗 5.滴加一抗37℃孵育2小时。 6.PBS洗 7.滴加通用二抗。 8.PBS洗 9.DAB显色
二、实验过程中应注意的一些问题
细胞载体的处理: 盖片和载片在接种细胞前一定要处理好, 不要怕麻烦。盖片和载片入酸前要将所附 着的脏东西洗干净。过蒸馏水和酒精时要 用镊子一片一片的过,平放在干净滤纸上 自然干燥。包装好后经烤箱干烤消毒保存。
2.细胞种植时应注意的一些问题:
选用何种载体:细胞在盖片和载片上一般4小时就 可以贴壁并开始生长,如果细胞贴壁后不需再进 一步处理,则可以将细胞爬在载片上,载片不用 消毒,也可以用DAKO笔在载片上画圈。用 DAKO笔划过圈的载片最好不要干烤消毒。细胞 帖壁后还要加药继续培养若干时间的则应选用盖 片爬片,这时盖片最好选用160度干烤消毒。
不要放在木制的片盒里,尤其是新的木 制片盒,木制品里的甲醛会影响抗原的表 达。如果放在新的木制片盒,要做恢复抗原. 细胞爬片制好后最好马上染片.
细胞的亚建康对实验结果的影响
当我们培养细胞时,细胞长得很差时我 们会把它们扔掉,不会用它们做进一步 的实验.但长得不太好,我们观察细胞时 有时分辨不出来,就可能使我们白做工, 既浪费了时间又浪费了 经费.这是一个 值得我们注意的问题.
此爬片由于该盖片 处理得不好,虽爬上 细胞但细胞的形态 很差,表现在细胞膜 和细胞器边界不清 晰
U251MG培养细 胞 (10hr)扫描电镜图
FN
LN
GFAP免疫组化

GFAP的免疫组化要点:要注意与石蜡切片、冰冻切片的不同!!1、细胞爬片的制备与HE相同,不再赘述;2、爬片的组化很关键的是不能让细胞干在片子上!!!!!3、本人认为细胞爬片的免疫组化,通透细胞膜是必须的:此细胞用0.3%的Triton-X-100作用10分钟(曲拉通不宜溶解,先是配制30%储存液:Triton-X-100 28.2ml加0.1mol/LPBS(pH7.3) 72.8ml混合置37℃到40℃水浴2到3个小时,充分溶解,用前稀释),也见相关资料介绍把曲拉通加入一抗中;4、关于降低非特异性染色,有如下几点需要注意:a、3%H2O2去离子水封闭,以消除内源性过氧化物酶的活性,可考虑延长作用时间,或者加大H2O2的浓度;b、抗体的孵育时间不宜过长,一抗37℃1小时(不可超过2个小时;有人主张4℃过夜,反应会充分,本人未做);其他为20min左右(可先参考说明书进行);c、孵育后的PBS洗涤一定要彻底,最好是5分钟×3次;还要注意不是直接冲细胞,而是从侧面洗细胞;d、可考虑响应的稀释一抗的浓度(即使是工作液);e、DAB的显色时间要把握好,镜下细胞着色适当即应终止,自来水冲洗;具体的反应时间各种细胞也不尽相同,爬片和石蜡、冰冻切片差别也很大,大体是5~20分钟,本细胞约10分钟,有资料显示有1~2即着色充分的情况,所以要自己摸索一下;f、本细胞用4%的多聚甲醛固定20分钟,且应用通透;甲醛易和细胞成分形成铰链,影响抗原的表达,故固定时间不要过长;有文献用95%的酒精固定,且未说明有通透的过程,考虑酒精的影响不大;还有文献用丙酮固定,但据说对细胞形态影响很大;g、可适当延长非免疫血清的封闭时间到1小时;减少二抗的反应时间;h、尽量使用单克隆抗体,必要时进行抗原修复(热修复、酶修复等)!。
实验报告-细胞爬片

细胞生物学实验报告实验三细胞爬片1引言1.1 实验目的1.巩固细胞传代技术。
2.掌握细胞爬片的方法。
3. 为细胞骨架的观察提供实验材料。
1.2 实验原理细胞爬片:细胞爬片就是让玻片浸在细胞培养基内,细胞在玻片上生长,主要用于组织学,免疫组织化学,切片,细胞涂片,原位杂交等。
细胞爬片采用的玻片可以是普通的盖玻片也可以用细胞爬片专用玻片。
使用普通盖玻片时,要按照玻璃器皿的清洗方法进行清洗,并进行高压灭菌。
专用玻片通常已经过处理可直接使用。
2实验仪器、试剂及操作步骤2.1 实验仪器超净工作台、倒置相差显微镜、CO2培养箱、酒精灯、75%酒精棉球、酒精喷壶、试管架、滴管筒(头)、废液缸、镊子、玻璃平皿、盖玻片(无菌)、35mm细胞培养皿(六孔板)、培养瓶等2.2 实验试剂DMEM培养基、血清、抗生素、胰蛋白酶消化液等2.3 实验材料鼠胚成纤维细胞、鸡胚成纤维细胞2.4 实验步骤1.实验室和超净工作台消毒,紫外照射20Min左右。
2.穿好实验服,进无菌室前穿鞋套、洗手。
3.关闭紫外灯,开日光灯和开风机,超净工作台台面应整洁,用75%酒精擦双手消毒,擦拭台面。
4.在显微镜下观察细胞生长状况。
5.用灭菌小镊子将处理好盖玻片轻轻放入35mm培养皿中。
6.打开细胞瓶盖并在酒精灯上轻轻烧口消毒,倒掉或吸出培养基。
7.加一滴管胰酶轻轻漂洗一下细胞,使其湿润整个细胞层,弃胰酶,再加入一滴管胰酶,盖好瓶盖。
8.显微镜下观察细胞的消化状态,待细胞大部分收缩、突起、变圆,细胞边界清晰时,即可竖立或翻转培养瓶停止消化,在超净台内靠近火焰处弃胰酶。
9.加两滴管的DMEM培养基反复冲瓶壁上的细胞层,至全部冲下,滴管轻轻吹打,混匀,成细胞悬液,进行细胞计数。
取少量细胞悬液与EP试管里,检查计数板并清洗,先将盖玻片安放在计数室上面,然后摇匀样品取悬液,从盖玻片边缘滴加细胞悬液,连续2-3次,直至充满计数板和盖玻片间的空隙。
将加好样品的计数板置于显微镜载物台的中央,然后按下列步骤操作:1)找计数室,先在低倍镜下寻找计数板上的大方格位置。
细胞爬片免疫组化
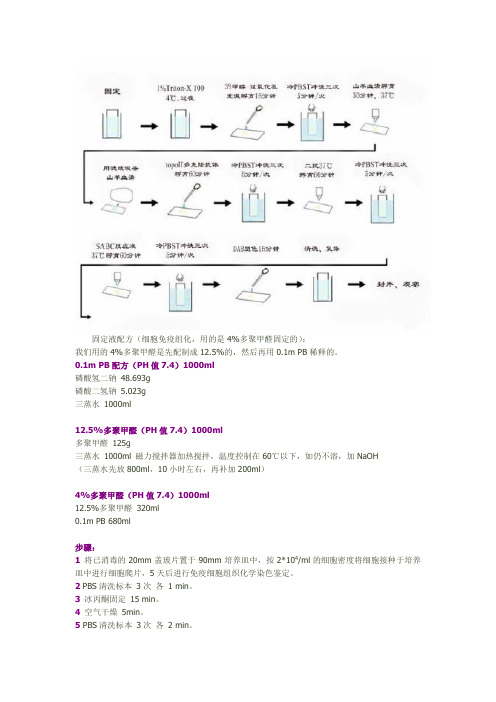
固定液配方(细胞免疫组化,用的是4%多聚甲醛固定的):我们用的4%多聚甲醛是先配制成12.5%的,然后再用0.1m PB稀释的。
0.1m PB配方(PH值7.4)1000ml磷酸氢二钠48.693g磷酸二氢钠 5.023g三蒸水1000ml12.5%多聚甲醛(PH值7.4)1000ml多聚甲醛125g三蒸水1000ml 磁力搅拌器加热搅拌,温度控制在60℃以下,如仍不溶,加NaOH(三蒸水先放800ml,10小时左右,再补加200ml)4%多聚甲醛(PH值7.4)1000ml12.5%多聚甲醛320ml0.1m PB 680ml步骤:1 将已消毒的20mm盖玻片置于90mm培养皿中,按2*104/ml的细胞密度将细胞接种于培养皿中进行细胞爬片,5天后进行免疫细胞组织化学染色鉴定。
2 PBS清洗标本3次各1 min。
3 冰丙酮固定15 min。
4 空气干燥5min。
5 PBS清洗标本3次各2 min。
6 0.5%Triton X-100( DPBS配) 孵育1次20 min。
7 PBS清洗标本3次各2 min。
8 3%H2O2孵育15 min。
9 DPBS清洗标本3次各2 min。
10 封闭血清孵育(5%正常二抗血清DPBS液)20min。
11一抗孵育(PBS配,滴度1:200,湿盒)4OC 过夜或37OC 60 min。
阴性对照最好用一抗来源血清,否则用PBS液12 PBS清洗标本3次各5 min。
13 二抗工作液孵育(湿盒)37OC 30 min。
14 PBS清洗标本3次各5 min。
15 C液(湿盒)37O C30 min。
16PBS清洗标本3次各5 min。
17DAB显色(避光,镜下观察至棕色)约3~10min。
18蒸馏水洗2次1 min。
19苏木素复染0.5~1min。
20自来水洗30min。
21树胶封片。
注意事项:1、良好的细胞爬片是进行免疫组织细胞的基础,要获得良好细胞爬片须注意以下:(1)对于粘附分子较少的细胞爬片时间要达5天以上,这样细胞爬片才较牢固,冲洗时不易脱片;(2)接种的细胞密度适中,以2*104/ml为宜,若细胞密度太高,5天后细胞连接成片冲洗时易脱片;2、冰丙酮固定后玻片可密闭保存于4O C冰箱,冰丙酮固定时会使细胞收缩,可用80%冰丙酮或2%多聚甲醛固定。
免疫组化 HE染色 FISH ISH

HE染色
苏木精 — 伊红染色法 ( hematoxylin-eosin staining ,HE)是石蜡 切片技术里常用的染色法之一 。HE染色法是组织学、胚胎学、病理 学教学与科研中最基本、使用最广泛的技术方法。 HE染色的原理:脱氧核糖核酸(DNA)两条链上的磷酸基向外,带 负电荷,呈酸性,很容易与带正电荷的苏木精碱性染料以离子键结合 而被染色。伊红是一种化学合成的酸性染料,在水中离解成带负电荷 的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染成红色或粉 红色,与蓝色的细胞核形成鲜明对比。
• 3、5-10% 正常山羊血清封闭,室温孵育10-30min。倾去血清,勿洗。 • 4、滴加适当比例稀释的一抗或一抗工作液,37℃孵育1-2小时或4℃
过夜。 • 5、PBS冲洗,5min×3次。 • 6、滴加适当比例稀释的生物素标记二抗,37℃孵育10-30min;或滴
加第二代生物素标记二抗工作液,37℃或室温孵育10-20min。 • 7、PBS冲洗,5min×3次。 • 8、滴加SABC-FITC,37℃孵育10-30min,PBS冲洗5min×3次。 • 9、抗荧光萃灭封片液 封片,荧光显微镜观察。
4、组织的固定:4%多聚甲醛固定一般1-2小时。固定后经充分的流水冲 洗后进行脱水包埋。
5、组织脱水:主要用不同梯度的酒精进行脱水。一般情况下,组织经过 70%,80%,90%,95%,以至无水酒精的脱水程序,即可达到脱 水的要求。但是为了能使大量的组织块同时进行脱水,则要求保持液 体的浓度以保证脱水的作用,最好是以两次95%酒精,两次100%酒 精重复进行脱水,以保证组织的水分脱净。
免疫组化切片组织前期处理
1、组织块大小应限于2cm×1.5cm×0.2cm 。 2、应用于光镜的免疫组织化学染色的切片厚度一般要求5μm左右,神经
细胞爬片、固定及免疫荧光的操作步骤

细胞爬片、固定及免疫荧光的操作步骤细胞爬片、固定及免疫荧光的操作步骤1.爬片的准备1)爬片可用一般的盖玻片,也可用专用爬片;用盖玻片时,可根据自己的需要用小砂轮或玻璃刀剪裁成合适的大小,以备置于6孔板、12孔板或24孔板;2)将剪裁好的爬片,置于浓硫酸中浸泡过夜,第二天先用自来水冲洗20遍,然后置于无水酒清中浸泡6小时,再用三蒸水冲洗3遍,放在饭盒或者玻璃培养皿中烘干后高压消毒。
高压消毒后取出放入烘箱中烘干,烘干后可放入超净台中备用。
3)可将爬片用多聚赖氨酸处理,以使细胞与爬片结合更牢固。
1mg/ml的多聚赖氨酸用0.22um的滤器过滤除菌后分装于经过无菌处理的1ml 细胞冻存管内保存在4℃里,三个月内仍然可以使用。
用时将高压灭菌过的爬片放到0.1mg/ml的多聚赖氨酸溶液内浸泡5min,无菌晾干即可(放入培养板孔内注意爬片的正反面)。
或将爬片铺于培养皿中,将多聚赖氨酸溶液滴于爬片上,室温10分钟后,吸除玻片上的溶液,在超静台内晾干后使用。
储存、稀释和吸取多聚赖氨酸要使用塑料制品。
2.细胞爬片1)胰酶消化细胞后重悬细胞于完全培养基中,充分吹打,使之成单细胞悬液,计数。
2)根据自己的需要选择合适的细胞密度种入培养板内。
滴加细胞悬液时,根据爬片的大小,先在每个孔里准备放爬片的位置滴少量培养基,然后将爬片置于液滴上,压紧,使爬片与培养皿靠培养基的张力粘合到一起,防止加细胞悬液时爬片漂起,造成双层细胞贴片。
若细胞贴壁能力不强,爬片可经多聚赖氨酸浸片后放入。
3.细胞的固定及免疫荧光1)在培养板中培养好细胞后,吸除培养基,一般先使用PBS轻洗细胞2×3 min,然后再做固定(凋亡的TUNEL染色等可以不清洗)。
2)固定:加入4%多聚甲醛(PBS配制)固定20分钟。
如果暂时不能立即做组化检测,使用含0.4%多聚甲醛的PBS PH7.4浸泡细胞(注意在免疫组化检测完成前不要让细胞变干,否则细胞收缩形态不好)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
固定液配方(细胞免疫组化,用的是4%多聚甲醛固定的):
我们用的4%多聚甲醛是先配制成12.5%的,然后再用0.1m PB稀释的。
0.1m PB配方(PH值7.4)1000ml
磷酸氢二钠48.693g
磷酸二氢钠 5.023g
三蒸水1000ml
12.5%多聚甲醛(PH值7.4)1000ml
多聚甲醛125g
三蒸水1000ml 磁力搅拌器加热搅拌,温度控制在60℃以下,如仍不溶,加NaOH
(三蒸水先放800ml,10小时左右,再补加200ml)
4%多聚甲醛(PH值7.4)1000ml
12.5%多聚甲醛320ml
0.1m PB 680ml
步骤:
1 将已消毒的20mm盖玻片置于90mm培养皿中,按2*104/ml的细胞密度将细胞接种于培养皿中进行细胞爬片,5天后进行免疫细胞组织化学染色鉴定。
2 PBS清洗标本3次各1 min。
3 冰丙酮固定15 min。
4 空气干燥5min。
5 PBS清洗标本3次各2 min。
6 0.5%Triton X-100( DPBS配) 孵育1次20 min。
7 PBS清洗标本3次各2 min。
8 3%H2O2孵育15 min。
9 DPBS清洗标本3次各2 min。
10 封闭血清孵育(5%正常二抗血清DPBS液)20min。
11一抗孵育(PBS配,滴度1:200,湿盒)4OC 过夜或37OC 60 min。
阴性对照最好用一抗来源血清,否则用PBS液
12 PBS清洗标本3次各5 min。
13 二抗工作液孵育(湿盒)37OC 30 min。
14 PBS清洗标本3次各5 min。
15 C液(湿盒)37O C30 min。
16PBS清洗标本3次各5 min。
17DAB显色(避光,镜下观察至棕色)约3~10min。
18蒸馏水洗2次1 min。
19苏木素复染0.5~1min。
20自来水洗30min。
21树胶封片。
注意事项:
1、良好的细胞爬片是进行免疫组织细胞的基础,要获得良好细胞爬片须注意以下:
(1)对于粘附分子较少的细胞爬片时间要达5天以上,这样细胞爬片才较牢固,冲洗时不易脱片;
(2)接种的细胞密度适中,以2*104/ml为宜,若细胞密度太高,5天后细胞连接成片冲洗时易脱片;
2、冰丙酮固定后玻片可密闭保存于4O C冰箱,冰丙酮固定时会使细胞收缩,可用80%冰丙酮或2%多聚甲醛固定。
3、冲洗时只须轻轻振荡培养皿,(不可用吸管太用力吹,易脱片)
4、加一抗、二抗后冲洗时第一次须将玻片倾斜
5、Triton X-100(屈立通)表面活性剂,脱去细胞膜中最主要的成分脂质,对于抗原表达在胞浆或胞核者方使用,对于抗原表达在胞浆者时间要控制好,使其破坏细胞膜而核膜破坏较少。
