第二节 化学平衡和化学反应进行的方向
人教版高中化学选修第二章《化学反应速率和化学平衡》知识点归纳

第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L?s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1.定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据②在单位时间内消耗了n m olB同时消耗了p但(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小, V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。
大学无机化学第四章试题及答案

第四章化学平衡本章总目标:1:了解化学平衡的概念,理解平衡常数的意义;2:掌握有关化学平衡的计算;3:熟悉有关化学平衡移动原理.各小节目标:第一节:化学平衡状态1:熟悉可逆反应达到平衡的特征——反应体系中各种物质的生成速率分别等于其消耗的速率,各种物质的浓度将不再改变。
2:了解平衡常数、平衡转化率这两个概念的意义.第二节:化学反应进行的方向学会运用标准平衡常数判断化学反应的方向:时,反应向逆向进行。
向正反应方向进行。
时体系达到平衡状态.第三节;标准平衡常数与的关系1:掌握化学反应等温式(),当体系处于平衡状态的时候。
2:重点掌握运用公式进行热力学数据之间的计算。
第四节:化学平衡的移动1:熟悉温度、浓度、压强对化学平衡的影响,2:熟练地根据条件的改变判断平衡移动的方向。
习题一选择题1。
可逆反应达平衡后,若反应速率常数k发生变化,则标准平衡常数()(《无机化学例题与习题》吉大版)A。
一定发生变化B。
一定不变C. 不一定变化D。
与k无关2.反应:2CO(g)+O2(g)2CO2(g)在300K时的Kc与Kp的比值约为()A。
25 B。
2500 C。
2。
2 D.0.04 3。
反应的温度一定,则下列的陈述中正确的是()(《无机化学例题与习题》吉大版)A.平衡常数能准确代表反应进行的完全程度B。
转化率能准确代表反应进行的完全程度C. 平衡常数和转化率都能准确代表反应进行的完全程度D。
平衡常数和转化率都不能代表反应进行的完全程度4.相同温度下:2H2(g)+S2(g)2H2S(g)Kp12Br2(g)+2H2S(g)4HBr+S2(g)Kp2H2(g)+Br2(g)2HBr(g)Kp3则Kp2等于( )A. Kp1· Kp3B.(Kp3)2/ Kp1C. 2Kp1· Kp3D. Kp3/ Kp15.下列反应中,K˚的值小于Kp值的是()(《无机化学例题与习题》吉大版)A. H2(g)+Cl2(g)== 2HCl(g)B。
《无机化学》第三章 化学反应的方向和化学平衡

f Gθm(稳定单质) 0
4.标准摩尔吉布斯自由能变
r
G
θ m
:
KJmol-1
⑴定义:标准状态下,反应进度为1mol时反
应的吉布斯自由能变称为该反应 的标
准摩尔吉布斯自由能变。
通式:mA + nB pC + qD
rGm i f Gm (生成物) i f Gm (反应物)
p f Gm (C) q f Gm (D) m f Gm ( A) n f Gm (B)
5.694 213.8 197.7
r
H
m
2 (110.5)
(393.5)
172.5(kJ
mol1)
r
S
m
2 197.7
213.8
5.694
175.9(J
mol1
K
1 )
r
G
θ m
r Hθm
TrSθm
172 .5 (900 273 .15) 175 .910 3
33.86(KJ mol 1)
恒温恒压只做体积功条件下:
△rGm < 0 △rGm = 0 △rGm >0
反应自发进行 反应处于平衡状态 正反应不能自发进行,但逆反 应能自发进行
3.标准摩尔生成吉布斯自由能 f Gθm : KJmol-1
⑴定义:标态下,由稳定单质生成1mol某物质时 反应的标准摩尔吉布斯自由能变称为 该物 质的标准摩尔生成吉布斯自由能。
1.反应前后气体分子数不相等的反应△n≠0
例:N2O4(g)
2NO2(g)
一定温度下达平衡时:
K
( pNO2 p N 2O4
p )2 p
增加压力到原来的2倍:
高考化学一轮复习 第1课时 化学平衡状态 化学平衡常数课件

(1)化学平衡研究的对象:封闭体系的可逆反应。只有可逆反应才有可能存在化学 平衡状态。 (2)“v(正)=v(逆)”,是化学平衡状态微观本质的条件,其含义可简单地理解为:对 反应物或生成物中同一物质而言,其生成速率等于消耗速率。“反应混合物中各 组分的浓度不变”是平衡状态的宏观表现,是v(正)=v(逆)的必然结果。 (3)平衡状态直接规定了在一定条件下可逆反应进行的程度大小,也是可逆反应进 行到最大限度的结果。 (4)从化学平衡的特征判断可逆反应是否达到化学平衡时,要特别注意外界条件 的限制及反应本身的特点,如“恒温、恒容”、“体积可变”、“体积不变”、 “全是气体参加”等。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温 度下达到平衡,试比较平衡时NH3的浓度:(1)________(2)(填“>”、“<”或 “=”)。
解析:①由反应:N2(g)+3H2(g) 起始物质的量
2NH3(g)
(mol)
2
4
0
转化物质的量
(mol)
x
正反应进行的程度 越高 。
3.平衡常数的应用和注意事项 (1)在不同条件下进行的同一可逆反应,K值越大,反应物的转化率 越大 , 正反应进行的程度 越高 。
(2)平衡常数只与 温度 有关,与其他因素无关。 (3)固体 和纯液体 的浓度通常看作常数“1”,不计入平衡常数表达式中。
思考:
反应:①3H2+N2
1.应用 (1)判断、比较可逆反应进行程度的大小。 K值越大,反应进行的程度越大; K值越小,反应进行的程度越小。 (2)判断可逆反应是否达到化学平衡状态 对于可逆反应aA(g)+bB(g) cC(g)+dD(g), 在一定温度下的任意时刻, 反应物与生成物浓度有如下关系: 浓度商Q=
2014届高三化学一轮复习讲义课件第二章化学平衡常数《化学反应进行的方向》(人教版选修4)

B.x值等于3
C.A的转化率为20%
2aD=.0B.的4 平mo均l,反a应=速0.率2 为mo0l.。4 mol·L-1·min-1
平衡时解混析合:气设体转的化总的物A的质物的质量的为量3.为4 am。ol,1-a+3- xa+2a=3.4 mol,x=4,BA错(g;)+平x衡B(时g)A、B、2CC(的g)物质 的4∶量1起分1∶始别2物为,质0A错.的8;量mAo(l的m、o转l2)化.2率m为o1l、0.02.4m3omlo/l1,mo所l以×0比10值0%为= 20%,转C化对物;质B的的平量均(m反ol应)速率a为0.8 xmaol/(10 L2×a2 min)
mA(g)+nB(g) pC(g)+qD(g)
起始(mol/L) a
b
0
0
变化(mol/L) mx nx
px qx
平衡(mol/L)a-mx b-nx
px qx
【名师提醒】(1)反应物:c(平)=c(始)-c(变)
(1)求平衡常数 生成(物2):求c转(平化)率=c(始)+c(变)
(2)各物质的转化量之比等于化学方程式中化学计量 数之比。
=0.平04衡m物ol质·的L-量1·(moiln)-1,1-D错a。 3-xa
2a
《金版新学案》
返回导航页
结束放映
栏目导引
思维建模:化学平衡计算的模型——“三段式”法
[名师归纳] 解题模型
可按下列模式进行计算:如mA(g)+nB(g) pC(g) +qD(g),令A、B起始物质的量浓度分别为a mol/L、b mol/L,在到平衡后消耗A的物质的量浓度为mxmol/L。
化学平衡常数 化学反应进行的方向
课件4:2.4化学反应进行的方向

5.熵判据的应用
(1)许多熵增加的反应在常温、常压下可以自发进行。 产生气体的反应,气体物质的物质的量增大的反应, 熵变通常都是正值,为熵增加反应。 例如:C(石墨,s)+H2O(g) = CO(g)+H2(g) (2)吸热的自发过程应为熵增加的过程 如冰的融化、硝酸铵溶于水等。 (3)无热效应的自发过程是熵增加的过程 如两种理想气体的混合等。 (4)放热的自发过程可能是熵减小的过程 。如铁生锈、 氢气燃烧、铝热反应等;也可能是熵无明显变化或增 加的过程。如金刚石和石墨的互变熵不变;活泼金属 与酸的置换反应熵增等……
事实证明,熵变是与反应能否自发进行有关的又 一个因素,但也不能作为唯一判据。
练习2
碳铵[(NH4)2CO3]在室温下就能自发地分解产
生氨气,对其说法中正确的是( AC )
A.碳铵分解是因为生成了易挥发的气体,使体 系的熵增大
B.碳铵分解是因为外界给予了能量 C.碳铵分解是吸热反应,根据焓判据不能自发
二、焓判据
放热反应使体系能 量降低,能量越低 越稳定, △H < O 有利于反应自发进 行。
1.焓判据:自发过程的体系取向于从高能状态 转变为低能状态(这时体系会对外部做功或释放 热量),这一经验规律就是焓判据,是判断化学 反应进行方向的判据之一。
2.焓判据的应用
(1)多数能自发进行的化学反应是放热反应。 例如:4Fe(OH)2(s)+2H2O(l)+O2(g) =
能自发进行
B. 温度、压力一定时,焓因素和熵因素共同决定
一个化学反应的方向
C. 反应焓变是决定反应能否进行的惟一因素
D. 固体的溶解过程与熵变无关
本节内容结束
更多精彩内容请登录:
分解 D反应中,在高温下不能自发进行的是( D )
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡

第二章化学反应速率和化学平衡一、化学反应速率(1)化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:式中——某物质A的浓度变化,常用单位为mol·L-1。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律①同一反应中不同物质的化学反应速率间的关系同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
(4)化学反应速率的特点①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。
②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。
③化学反应速率是指时间内的“平均”反应速率。
小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。
②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
其化学反应速率与其表面积大小有关,而与其物质的量的多少无关。
通常是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加快反应速率。
③对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。
因此,表示化学反应的速率时,必须指明是用反应体系中的哪种物质做标准。
第七章 第二讲 化学反应进行的方向和化学平衡状态

第二讲化学反应进行的方向和化学平衡状态一、选择题1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是( )A.反应混合物的浓度B.反应体系的压强C.正、逆反应的速率D.反应物的转化率解析对于“等体反应”,缩小反应容器,压强增大,平衡不移动,但反应混合物的浓度增大,正逆反应速率增大,可知A、B、C错误。
答案 D2.分析下列反应在任何温度下均能自发进行的是()。
A.2N2(g)+O2(g)===2N2O(g)ΔH=+163 kJ·mol-1B.Ag(s)+12Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1C.HgO(s)===Hg(l)+12O2(g)ΔH=+91 kJ·mol-1D.H2O2(l)===12O2(g)+H2O(l)ΔH=-98 kJ·mol-1解析反应自发进行的前提条件是反应的ΔH-TΔS<0,温度的变化可能使ΔH-TΔS 的符号发生变化。
对于A项,ΔH>0,ΔS<0,在任何温度下,ΔH-TΔS>0,即任何温度下,反应都不能自发进行;对于B项,ΔH<0,ΔS<0,在较低温度下,ΔH-TΔS<0,即反应温度不能过高;对于C项,ΔH>0,ΔS>0,若使反应自发进行,即ΔH-TΔS<0,必须提高温度,即反应只有在较高温度时能自发进行;对于D项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下反应均能自发进行。
答案 D2.某温度下,对于反应N2(g)+3H23(g)ΔH=-92.4kJ/mol。
N2的平衡转化率(α)与体系总压强(p)的关系如图所示。
下列说法正确的是()A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJB.平衡状态由A变到B时,平衡常数K(A)<K(B)C.上述反应在达到平衡后,增大压强,H2的转化率增大D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小解析因为该反应为可逆反应,加入1 mol N2、3 mol H2,两者不可能完全反应生成NH3,所以放出的热量小于92.4 kJ,A错;从状态A到状态B的过程中,改变的是压强,温度没有改变,所以平衡常数不变,B错;因为该反应是气体体积减小的反应,增大压强平衡向正反应方向移动,H2的转化率增大,C对;升高温度,正、逆反应速率都增大,D错。
化学平衡的移动,化学反应进行的方向

【重点内容】化学平衡的移动,化学反应进行的方向。
2【内容讲解】一、化学平衡的移动1、含义:可逆反应达到平衡状态后,反应条件(如浓度、压强、温度)改变,使正和逆不再相等,原平衡被破坏;一段时间后,在新的条件下,正、逆反应速率又重新相等,即V正'=V逆',此时达到了新的平衡状态,称为化学平衡的移动。
应注意:v正'≠v正,v逆'≠v逆。
2、影响因素:(1)浓度:其它条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
在下列反应速率(v)对时间(t)的关系图象中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:①增大反应物浓度;②减小生成物浓度;③增大生成物浓度;④减小反应物浓度注:①由于纯固体或纯液体的浓度为常数,所以改变纯固体或纯液体的量,不影响化学反应速率,因此平衡不发生移动。
②增大(或减小)一种反应物A的浓度,可以使另一种反应物B的转化率增大(或减小),而反应物A的转化率减小(或增大)。
(2)压强:其它条件不变时,对于有气体参加的可逆反应,且反应前后气体分子数即气体体积数不相等,则当缩小体积以增大平衡混合物的压强时,平衡向气体体积数减小的方向移动;反之当增大体积来减小平衡混合物的压强时,平衡向气体体积数增大的方向移动;若反应前后气体分子数即气体体积数相等的可逆反应,达到平衡后改变压强,则平衡不移动。
对于反应mA(g)+nB(g)pC(g)+qD(g),在下列v-t图中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:①m +n >p +q,增大压强;②m +n >p +q,减小压强;③m +n <p +q,增大压强;④m +n <p +q,减小压强;⑤m +n =p +q,增大压强;⑥m +n =p +q,减小压强。
(3)温度:其它条件不变时,升高温度,平衡向吸热反应(△H>0)方向移动;降低温度,平衡向放热反应(△H<0)方向移动。
化学平衡的移动,化学反应进行的方向

【重点内容】化学平衡的移动,化学反应进行的方向。
2【内容讲解】一、化学平衡的移动1、含义:可逆反应达到平衡状态后,反应条件(如浓度、压强、温度)改变,使正和逆不再相等,原平衡被破坏;一段时间后,在新的条件下,正、逆反应速率又重新相等,即V正'=V逆',此时达到了新的平衡状态,称为化学平衡的移动。
应注意:v正'≠v正,v逆'≠v逆。
2、影响因素:(1)浓度:其它条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
在下列反应速率(v)对时间(t)的关系图象中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:①增大反应物浓度;②减小生成物浓度;③增大生成物浓度;④减小反应物浓度注:①由于纯固体或纯液体的浓度为常数,所以改变纯固体或纯液体的量,不影响化学反应速率,因此平衡不发生移动。
②增大(或减小)一种反应物A的浓度,可以使另一种反应物B的转化率增大(或减小),而反应物A 的转化率减小(或增大)。
(2)压强:其它条件不变时,对于有气体参加的可逆反应,且反应前后气体分子数即气体体积数不相等,则当缩小体积以增大平衡混合物的压强时,平衡向气体体积数减小的方向移动;反之当增大体积来减小平衡混合物的压强时,平衡向气体体积数增大的方向移动;若反应前后气体分子数即气体体积数相等的可逆反应,达到平衡后改变压强,则平衡不移动。
对于反应mA(g)+nB(g)pC(g)+qD(g),在下列v-t图中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:①m +n >p +q,增大压强;②m +n >p +q,减小压强;③m +n <p +q,增大压强;④m +n <p +q,减小压强;⑤m +n =p +q,增大压强;⑥m +n =p +q,减小压强。
(3)温度:其它条件不变时,升高温度,平衡向吸热反应(△H>0)方向移动;降低温度,平衡向放热反应(△H<0)方向移动。
化学平衡及化学反应进行的方向

化学平衡及化学反应进行的方向2、化学平衡的特征以及判断依据(1)化学平衡状态具有“等”、“定”、“动”、“变”四个基本特征。
(2)判断可逆反应达到平衡状态的根本依据是:①正反应速率等于逆反应速率。
②各组分的的浓度保持不变。
(3)化学平衡的移动①概念:可逆反应中,旧化学平衡被破坏,新化学平衡建立的过程叫做化学平衡的移动。
化学平衡移动的实质是外界因素改变了反应速率,使正、逆反应速率不再相等,通过反应,在新的条件下达到正、逆反应速率相等。
可用下图表示:平衡移动的方向与v(正)、v(逆)的相对大小有关,化学平衡向着反应速率大的方向移动。
②外界条件与化学平衡移动的关系● 浓度:在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,平衡向逆反应方向移动。
● 压强:在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使化学平衡向着气体体积增大的方向移动。
● 温度:在其它条件不变的情况下,温度升高,会使化学平衡向着吸热反应方向移动;温度降低,会使化学平衡向着放热反应方向移动。
注意:A、固体及纯液体物质的浓度是一定值,反应速率不因其量的改变而改变,所以增加或减少固体及纯液体物质的量,不影响化学平衡。
B、改变压强是通过改变容器体积,进而改变气态物质浓度,进而改变反应速率影响化学平衡的。
所以,压强对化学平衡的影响实质是浓度对化学平衡的影响。
下列情况改变压强平衡不移动:(a).平衡体系中没有气体物质,改变压强不会改变浓度,平衡不移动。
(b).反应前后气体体积不变(即气态反应物和生成物的化学计量数之和相等)的可逆反应。
如:H2(g)+I2(g)2HI(g)改变压强同等程度改变反应速率,平衡不移动。
(c).向固定容积的容器中充入不参加反应的气体(如惰性气体He、Ar),压强虽然增大了,但气态物质的浓度不变,平衡不移动。
C、只要是升高温度,平衡一定移动,且新平衡状态的速率一定大于原平衡状态的速率。
人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳
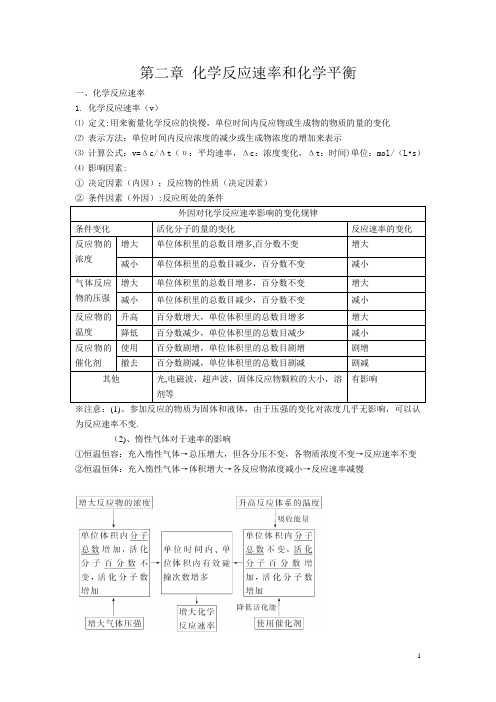
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L•s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件外因对化学反应速率影响的变化规律条件变化活化分子的量的变化反应速率的变化反应物的浓度增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小气体反应物的压强增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小反应物的温度升高百分数增大,单位体积里的总数目增多增大降低百分数减少,单位体积里的总数目减少减小反应物的催化剂使用百分数剧增,单位体积里的总数目剧增剧增撤去百分数剧减,单位体积里的总数目剧减剧减其他光,电磁波,超声波,固体反应物颗粒的大小,溶剂等有影响※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变.(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1。
定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定) ;变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据例举反应mA(g)+nB(g)C(g)+qD(g)混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量的分数一定平衡②各物质的质量或各物质质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压力、总物质的量一定不一定平衡正、逆反应速率的关系①在单位时间内消耗了mmolA同时生成m molA,即V(正)=V(逆)平衡②在单位时间内消耗了n m olB同时消耗了p molC,则V(正)=V(逆)平衡③V(A):V(B):V(C):V(D)=m:n:p:q,V(正)不一定等于V(逆)不一定平衡④在单位时间内生成n molB,同时消耗了q molD,因均指V(逆)不一定平衡压强①m+n≠p+q时,总压力一定(其他条件一定)平衡②m+n=p+q时,总压力一定(其他条件一定) 不一定平衡混合气体平均相对分子质量Mr ①Mr一定时,只有当m+n≠p+q时平衡②Mr一定时,但m+n=p+q时不一定平衡温度任何反应都伴随着能量变化,当体系温度一定时(其他不变)平衡体系的密度密度一定不一定平衡其他如体系颜色不再变化等平衡(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
《化学反应原理》复习之《化学平衡常数与化学反应的方向》知识要点

《化学平衡常数与化学反应的方向》知识要点一、化学平衡常数1、化学平衡常数(1)定义:在一定温度下,达到平衡的可逆反应,其平衡常数用生成物平衡浓度(气体平衡分压)的方次之积与反应物平衡浓度(气体平衡分压)的方次之积的比值来表示,这时的平衡常数称为浓度平衡常数(压强平衡常数)(2)表达式用Kc(K p)表示、对:aA(g)+bB(g)cC(g)+dD(g),(3)影响因素:平衡常数K与温度有关,与浓度和压强无关。
(4)平衡常数的意义:①K的大小,可推断反应进行的程度。
K越大,表示反应进行的程度越大,反应物的转化率越大;K越小,表示反应进行的程度越小,反应物的转化率越小②平衡常数表达式表明在一定温度条件下达成平衡的条件。
在某温度下,某时刻反应是否达平衡,可用该时刻产物的浓度商Q c与Kc比较大小来判断。
当Q c>kc,υ(正)〈υ(逆),未达平衡,反应逆向进行;ﻩ当Qc〈kc,υ(正)>υ(逆),未达平衡,反应正向进行;ﻩ当Qc=kc,υ(正)=υ(逆),达到平衡,平衡不移动。
ﻩ③平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。
如2SO2(g)+O22SO3(g) 298K时Kp=3。
6×1024特别大,但由于速度太慢,常温时,几乎不发生反应。
二、化学反应进行的方向。
1。
自发过程含义:在一定条件下,不需要借助外力作用就能自发进行的过程、2、化学反应方向进行的判据(1)焓判据放热过程中体系能量降低,△H<0,具有自发进行的倾向,但有些吸热反应也能够自发进行,故只用焓变判断反应的方向不全面、(2)熵判据①熵:量度体系混乱(或有序)的程度的物理量,符号S(同一物质,三种状态下熵值:气态>液态>固态)②熵增原理:在与外界隔离的体系中,自发过程将导致体系的熵增大、即熵变(△S)大于零。
③熵判据体系的混乱度增大(既熵增),△S>0,反应有自发进行的倾向,但有些熵减反应也能够自发进行,故只用熵变判断反应的方向也不全面。
化学平衡ppt课件

定
等
动
变
动态平衡
条件改变,原平衡状态被破坏,在新的条件下建立新的平衡
υ(正)= υ(逆)
改变影响化学反应速率的因素,如浓度、压强、温度,就有可能改变化学平衡
研究的对象是可逆反应
逆
υ(正)= υ(逆)≠0
各组分的含量保持一定,各组分的浓度保持一定。
3.化学平衡状态的特征:
二、化学平衡状态
0.7
0.7
......
从反应开始起,B、C的体积分数均为1/2,始终没有改变,不是变量,不能作为判断平衡状态的依据。
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
9.733×10-4
1.486×10-2
49.54
0
0
1.520×10-2
1.696×10-3
1.696×10-3
1.181×10-2
48.49
0
0
1.287×10-2
1.433×10-3
1.433×10-3
1.000×10-2
48.70
0
0
3.777×10-2
4.213×10-3
4.213×10-3
c (HI)
c (H2)
c(I2)
c (HI)
1.135×10-2
9.04×10-3
0
4.56×10-3
1.95×10-3
8.59×10-3
8.298
0
0
1.655×10-2
3.39×10-3
3.39×10-3
9.77×10-3
8.306
化学反应进行的方向和化学平衡状态

选择合适的化学反应
选择一个可逆反应,以便观察化学平衡状态。
控制反应条件
确保反应在恒温、恒压条件下进行,并保持反应混合物浓度不变。
实验操作步骤
按照实验操作规程,逐步进行实验操作,确保实验过程安全可靠。
数据收集与分析
记录实验数据
详细记录反应过程中各物 质浓度的变化,以及温度、 压力等反应条件的变化。
数据整理
化学反应进行的方向和化学平衡状 态
目录
• 化学反应进行的方向 • 化学平衡状态 • 化学平衡的移动 • 化学平衡的应用 • 实验研究与观察
01 化学反应进行的方向
反应焓变对反应方向的影响
焓变是反应过程中能量的变化,当反应的焓变小 于零时,反应能够自发进行。
焓变大于零时,反应不能自发进行,需要外界提 供能量才能进行。
生成A和B的方向移动。
在反应过程中,如果反应物的浓度大于 生成物的浓度,平衡会向正反应方向移 动;反之,平衡会向逆反应方向移动。
在一定温度下,增加反应物的浓度或减 小生成物的浓度,平衡常数Kc会增大; 反之,减小反应物的浓度或增加生成物
的浓度,平衡常数Kc会减小。
压力对化学平衡的影响
压力的变化会影响气体的分压,进而影响化学平衡。对于 反应 A + B → C,如果增加压力,平衡会向气体体积减小 的方向移动,即向生成C的方向移动。
焓变等于零时,反应处于平衡状态,反应不会自 发进行或逆向进行。
熵变对反应方向的影响
熵变表示反应过程中混乱度的 变化,混乱度增加有利于反应
自发进行。
当熵变小于零时,反应可能 无法自发进行,需要外界提 供能量或降低温度才能进行。
熵变大于零时,反应能够自发 进行,因为混乱度的增加有助
专题2化学反应速率和化学平衡 第二单元 化学反应的方向和限度知识点归纳

专题2 化学反应速率与化学平衡第二单元化学反应的方向和限度知识点复习一、化学反应方向(一)自发过程和自发反应自发过程具有的特点:①能量角度体系趋向于从高能状态转变为低能状态(体系对外部做功或者释放热量)。
②混乱度角度体系趋向于从有序状态转变为无序状态。
(二)化学反应进行的方向与焓变、熵变的关系1.自发反应与焓变的关系多数自发进行的化学反应是放热反应,但也有很多吸热反应能自发进行,因此,反应焓变是与反应进行的方向有关的焓判据放热反应过程中体系能量降低,具有自发进行的倾向焓变与反应自发性的关系若该反应为放热反应,即ΔH<0,一般能自发进行;若该反应为吸热反应,即ΔH>0,一般不能自发进行局限性有些吸热反应也能自发进行,所以焓变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素因素之一,但不是决定反应能否自发进行的唯一因素。
2.化学反应进行的方向与熵变的关系(1)熵的概念自发过程的体系趋向于由有序转变为无序,体系的混乱度增大。
体系的混乱度常用熵来描述,熵的概念是表示体系的混乱或无序程度的物理量,其符号为S。
熵值越大,体系的混乱度越大。
(2)影响熵大小的因素①同一条件下,不同的物质熵值不同。
②同一物质的熵与其聚集状态及外界条件有关,如同一种物质不同状态时熵值大小为S(g)>S(l)>S(s)。
③气态物质的物质的量越大,分子数越多,熵值越大。
(3)熵判据在与外界隔离的体系中,自发过程将导致体系的熵增大,即熵变(符号ΔS)大于零,这个原理叫做熵增原理。
在用熵变来判断过程的方向时,就称为熵判据。
①当ΔS>0时,反应为熵增反应,在一定条件下能自发进行。
如2H2O2(aq)===2H2O(l)+O2(g)在常温下能自发进行。
②当ΔS<0时,反应为熵减反应,在一定条件下不能自发进行。
但如NH3(g)+HCl(g)===NH4Cl(s)也能自发进行。
(4)反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 第二节 化学平衡和化学反应进行的方向
1.了解化学反应的可逆性。
2.结合图像考查化学平衡建立的过程。
3.化学平衡状态的分析、判断与比较。
4.理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算,并判断
反应进行的方向。
5.理解外界条件(温度、压强、浓度、催化剂)对化学反应平衡的影响,认识其一
般规律。
6.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
7.以图像题综合考查勒夏特列原理的应用以及速率与平衡之间的关系。
8.利用焓变、熵变判断化学反应进行的方向。
基础自查(理一理)
1.自发反应
在一定条件下 就能自发进行的反应称为自发反应。
2.判断化学反应方向的依据
(1)焓变与反应方向
研究表明,对于化学反应而言,绝大多数 都能自发进行,且反
应放出的热量 ,体系能量 得也 ,反应越 。
可见, 是制约化学反应能否自发进行的因素之一。
(2)熵变与反应方向
①研究表明,除了热效应外,决定化学反应能否自发进行的另一个因素是体系
的 。
大多数自发反应有趋向于体系 增大的倾向。
a .熵的含义
熵是衡量一个体系 的物理量。
用符号S 表示。
同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一
般规律是:S (g)>S (l)>S (s)
b .熵变的含义
熵变是反应前后体系 ,用 表示,化学反应的ΔS 越大,越有利
于反应 。
(3)综合判断反应方向的依据
因此,要正确判断一个化学反应是否能自发进行,必须综合考虑反应的 与。
在恒温、恒压时,①如果反应的 ,则该反应一定
能自发进
行;②如果反应的 ,则该反应一定不能自发进行;③如
果反应的 或 ,反应是否能自
发进行与反应的 有关。
化学反应进行的方向及判断依据
1.“放热过程都可以自发进行,但吸热过程都不能自发进行。
”这句话对吗?应如何理解?
1.化学平衡状态
(1)概念
一定条件下的可逆反应中,正反应速率与逆反应速率 ,反应体系中所有参 加反应的物质的 保持不变的状态。
(2)平衡特点
2.化学平衡常数
(1)概念
在一定温度下,当一个可逆反应达到 时,生成物 与 反应物 的比值是一个常数,用符号 表示。
(2)表达式
对于反应m A(g)+n B(g) p C(g)+q D(g),
K =c p (C )·c q (D )c m (A )·c n (B )
(固体和纯液体的浓度为常数,通常不计入平衡常数表达式中)。
(3)意义
①K 值越大,反应物的转化率 ,正反应进行的程度 。
②K 只受 影响,与反应物或生成物的浓度及压强变化无关。
③化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数改变。
若方程式中各物质的系数等倍扩大或减小,尽管是同一反应,平衡常数也会改变。
化学平衡状态与化学平衡常数
2.如何从“由微观到宏观,由本质到现象”的角度理解化学平衡状态?
3.怎样理解化学平衡常数的含义?
1.过程
2.平衡移动方向与反应速率的关系
(1)v 正 v 逆,平衡向正反应方向移动。
(2)v 正 v 逆,平衡不移动。
(3)v 正 v 逆,平衡向逆反应方向移动。
3.平衡移动会伴随着哪些变化
(1)反应速率的变化(引起平衡移动的本质,但反应速率变化也可能平衡不移 动),主要看v 正与v 逆是否相等,如果v 正≠v 逆,则平衡必然要发生移动,如 v 正、v 逆同时改变相同倍数,则平衡不移动。
(2)浓度的变化。
平衡移动会使浓度变化,但是浓度的变化不一定使平衡移动。
(3)各组分百分含量的变化。
(4)平均相对分子质量的变化。
(5)颜色的变化(颜色变化,平衡不一定发生移动)
(6)混合气体密度的变化。
(7)转化率的变化。
(8)温度变化。
4.外界条件对化学平衡的影响
在一定条件下,a A(g)+b B(g) m C(g) ΔH <0达到了平衡状态,若其他条件不变, 改变下列条件对平衡的影响如下:
(1)浓度
①增大A 的浓度或缩小C 的浓度,平衡向 方向移动;
②增大C 的浓度或减小A 的浓度,平衡向 方向移动。
(2)压强
①若a +b ≠m
化学平衡移动
增大压强,平衡向的方向移动;
减小压强,平衡向的方向移动;
②若a+b=m
改变压强,平衡移动。
(3)温度
升高温度,平衡向方向移动;
降低温度,平衡向方向移动。
(4)催化剂
使用催化剂,因其能同等倍数地改变正、逆反应速率,平衡移动。
联动思考(想一想)
4.某一可逆反应,一定条件下达到了平衡,①若化学反应速率改变,平衡一定发生移动吗?②若平衡发生移动,化学反应速率一定改变吗?
提示:①不一定,如反应前后气体体积不变的反应改变压强或使用催化剂,
速率发生变化,但平衡不移动。
②一定,化学平衡移动的根本原因就是外界条件改变,使v(正)≠v(逆)才发生
移动的。
一定条件下可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是() ①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是() A.单位时间生成n mol的A2同时生成n mol的AB
B.容器内的总压强不随时间变化
C.单位时间生成2n mol的AB同时生成n mol的B2
D.单位时间生成n mol的A2同时生成n mol的B2。
