氨基酸的性质
有机化学基础知识点氨基酸的结构和性质

有机化学基础知识点氨基酸的结构和性质氨基酸是有机化合物中的一类重要分子,它具有特殊的分子结构和多种性质。
本文将围绕氨基酸的结构和性质展开相关探讨。
一、氨基酸的结构氨基酸的基本结构由一个氨基(NH2)、一个羧基(COOH)、一个带有特定侧链的碳原子组成。
其中,碳原子与氨基和羧基相连,形成一个称为α-碳的中心原子。
氨基酸的侧链(R基团)可以是疏水性的烃基、亲水性的羟基或带电离子的酸基等,这些不同的侧链决定了氨基酸的特性和功能。
二、氨基酸的分类根据氨基酸的侧链特征,可以将其分为以下几类:1. 脂溶性氨基酸:侧链为非极性的疏水性基团,如甲基(Alanine),苯基(Phenylalanine)等;2. 极性氨基酸:侧链含有氢键形成原子,具有一定的亲水性,如羟基(Serine),酸基(Aspartic acid)等;3. 硫氨基酸:侧链含有硫原子,具有特殊的性质,如半胱氨酸(Cysteine);4. 离子型氨基酸:侧链带有正电荷或负电荷,如精氨酸(Arginine),谷氨酸(Glutamic acid)等。
三、氨基酸的性质氨基酸具有以下几种重要的性质:1. 生理性质:氨基酸是构成生物体内蛋白质的基本组成单元,参与细胞代谢和生命活动的调控。
其中人体无法自行合成的氨基酸称为必需氨基酸,必须从外部食物中摄入。
2. 光学性质:氨基酸的α-碳上存在手性中心,可以分为D-型和L-型两种异构体。
天然氨基酸大部分为L-型,而工业合成的氨基酸多为D-型。
3. 缔合性质:氨基酸能够通过脱羧和脱氨反应与其他分子发生缔合,形成肽键和蛋白质。
这个过程称为蛋白质的合成。
4. 缓冲性质:氨基酸中的羧基和氨基可以接受或释放质子,并能维持生物体内pH的稳定。
5. 亲水性和疏水性:由于氨基酸的不同侧链,其溶解度和溶液中的行为也会不同,包括溶解度、水合作用等。
四、应用举例1. 蛋白质合成:氨基酸是构成蛋白质的基本单元,了解氨基酸的结构和性质对研究蛋白质的合成机制和调控具有重要意义。
氨基酸的化学性质
Ⅱ、多 肽 >二、多肽结构的测定 例:某八肽 A 、完全水解后,经分析氨基酸的组成为:丙、亮、
赖、苯丙、脯、丝、酪、缬。
B 、端基分析: N- 端 丙 …………………… 亮 C- 端。 C 、胰蛋白酶催化水解:分离得到酪氨酸,一种三
肽和一种四肽。
D、用Edman降解分别测定三肽、四肽的顺序,结果 为:丙-脯-苯丙;赖-丝-缬-亮。 E、由上述信息得知,八肽的顺序为:
反应是定量完成的,衡量的放出N2,测定N2的体积便可 计算出氨基酸只氨基的含量。 3、与甲醛作用 甲醛能与氨基酸中的氨基作用,使氨基酸的碱性消失, 这样就可以用碱来滴定羧基的含量。
Ⅰ、氨基酸 > 三、氨基酸的化学性质 2、与亚硝酸反应
R CH COOH + HNO 2 NH2
R CH COOH + N2 + H2O OH
甘氨酸
丙氨酸 缬氨酸
-氨基乙酸
-氨基丙酸 3-甲基-2-氨基丁酸
NH 2 CH3 H3C CH CH2 CH COOH
亮氨酸
4-甲基-2-氨基戊酸
Ⅰ、氨基酸 >一、氨基酸的构型 氨基酸除甘氨酸外,其它氨基酸分子中碳原子均为 手性碳原子,因此都具有旋光性。 大多数-氨基酸都只有一个手性碳原子,其构型一
中性氨基酸
酸性氨基酸 碱性氨基酸
pI = 4.8~6.3
pI = 2.7~3.2 pI = 7.6~10.8
2°等电点时,偶极离子在水中的溶解度最 小,易结晶析出。
Ⅰ、氨基酸 > 三、氨基酸的化学性质 2、与亚硝酸反应
R CH COOH + HNO 2 NH2
R CH COOH + N2 + H2O OH
氨基酸结构与性质

氨基酸结构与性质氨基酸是构成蛋白质的基本组成单位,它们由一个氨基官能团(NH2)和一个羧酸官能团(COOH)组成。
此外,每个氨基酸还含有一个侧链,侧链的结构和性质决定了氨基酸的特点。
氨基酸可以根据它们在侧链上的不同结构被分类为以下几类:非极性氨基酸、极性氨基酸、酸性氨基酸和碱性氨基酸。
非极性氨基酸的侧链通常是由碳和氢原子组成的,不带有电荷。
例如,甘氨酸、丙氨酸和亮氨酸等。
这些氨基酸在水中溶解度较低,更倾向于在蛋白质的内部区域存在,与周围水分隔开。
极性氨基酸的侧链含有带电或极性基团。
其中,含有氧原子的侧链通常具有弱酸性或弱碱性。
例如,谷氨酸、天冬氨酸和天门冬氨酸等。
这些氨基酸通常在水中溶解度较高,并且可以与周围的水分子形成氢键。
酸性氨基酸的特点是其侧链含有一个或多个离子化的羧酸基团。
例如,天门冬氨酸和谷氨酸等。
这些氨基酸可以在生物体内释放出氢离子,并能够参与维持酸碱平衡的生理过程。
碱性氨基酸的侧链通常富含氮原子,并带有一个或多个氨基基团。
例如,赖氨酸和组氨酸等。
这些氨基酸可以在生物体内接受氢离子,并与其结合形成阳离子。
氨基酸的侧链结构和性质也决定了它们在生物体内的功能和作用。
例如,一些具有较大的侧链的氨基酸,如酪氨酸和色氨酸,可以用于合成激素和神经递质。
一些具有硫原子的氨基酸,如半胱氨酸和甲硫氨酸,可以用于形成二硫键,从而稳定蛋白质的结构。
还有一些特殊的氨基酸,如脯氨酸和异亮氨酸,只存在于一些特定的维生素中。
此外,不同的氨基酸结合在一起,通过肽键形成肽链,进而构成蛋白质的结构。
氨基酸之间的肽键是由氨基酸的羧酸组分中的一个碳原子上的羟基与另一个氨基酸的氨基组分中的一个氮原子形成的。
蛋白质的结构由氨基酸序列和侧链的空间排列决定,而这种结构决定了蛋白质的功能。
总结起来,氨基酸是构成蛋白质的基本组成单位,它们的结构和性质多样,决定了氨基酸的功能和特点。
通过了解氨基酸的结构和性质,我们可以更好地理解蛋白质的组成和功能,并为进一步研究和应用蛋白质提供基础。
氨基酸的性质名词解释

氨基酸的性质名词解释氨基酸是构成蛋白质的基本组成部分,其中包含了许多重要的性质名词需要进行解释。
本文将详细介绍氨基酸的性质及其相关名词解释,以帮助读者更好地理解这一重要生物分子。
1. 构成氨基酸的元素氨基酸由4种元素组成:碳(C)、氢(H)、氧(O)和氮(N)。
这些元素的排列和数量的不同会导致氨基酸的种类差异。
2. 构成氨基酸的结构氨基酸的结构分为三部分:氨基基团(NH2)、羧基(COOH)和侧链(R基团)。
氨基基团和羧基通过共价键连接在同一个碳原子上,而侧链则与此碳原子连接在一起。
不同氨基酸的侧链具有不同的性质和功能。
3. 构成氨基酸的胺基酸氨基酸中的氨基基团是由一个氮原子和三个氢原子组成的胺基酸。
胺基酸是组成蛋白质的重要成分,也是合成其他重要生物分子的基础。
4. 构成氨基酸的羧基氨基酸中的羧基是一个碳原子与一个氧原子和一个羟基(OH)相连接的羧酸。
羧基通过脱去一个氧和一个氢原子,形成羧酸根离子,从而使氨基酸以阴离子的形式存在。
5. 构成氨基酸的侧链氨基酸的侧链是与氨基基团和羧基连接在一起的部分。
不同氨基酸的侧链具有不同的大小、形状和化学性质,因此决定了氨基酸的性质和功能。
例如,赖氨酸的侧链富含氨基基团,而苏氨酸的侧链则含有羟基。
6. 构成氨基酸的官能团氨基酸的官能团是指氨基基团和羧基的化学活性部分。
氨基基团具有碱性,而羧基则具有酸性。
它们的共存使得氨基酸在生物体内可以发挥重要的生理功能。
7. 构成氨基酸的立体异构体氨基酸可以存在多种立体异构体,具体取决于氨基基团和羧基的空间排布。
其中最常见的是L型和D型氨基酸。
在自然界中,绝大多数氨基酸都是以L型存在,而D型氨基酸主要存在于细菌和某些植物中。
8. 构成氨基酸的化学性质氨基酸的化学性质主要体现在其官能团的反应性上。
例如,它们可以通过与其他分子发生酯化、酰化、酰胺化等反应形成新的化合物。
此外,氨基酸还可以参与氧化还原、加成和消除等反应。
9. 构成氨基酸的生理功能氨基酸不仅是蛋白质的构成单元,还具有许多重要的生理功能。
氨基酸的分类特点和理化性质

氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。
有机化学氨基酸
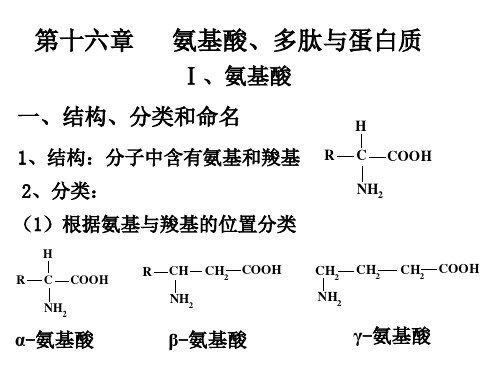
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
氨基酸的化学性质

以电中性的偶极离子形式存在,和水的亲和力比正离子或负离子小得多,因此溶解度最小, 最易沉淀。所以可用调节等电点的方法来分离氨基酸的混合物。 对于丙氨酸等一氨基一羧基的中性型氨基酸来说,由于羧基电离度略大于氨基电离度, 所以溶于水时,其负离子数将多于正离子数,因而在纯水中显微酸性。根据化学平衡原理, 就要加入适量的酸,以使-COO 变为-COOH,-NH2 变为-N+H3,氨基酸才能主要以偶极离
R CH NH 2 COOH + 2 HCHO R CH COOH H 2COH N C成,生成 N,N-二羟甲基氨基酸。由于 羟基是吸电子基团,氮原子上的电子云密度降低,削弱了接受质子的能力,使氨基的碱性消 失,这样就可以用碱来滴定氨基酸的羧基,从而测定氨基酸的含量。这称为氨基酸的甲醛滴 定法。 c.氧化脱氨反应。氨基酸分子的氨基被氧化剂(如过氧化氢、高锰酸钾)氧 化后, 首先生成α-亚氨基酸, 然后经过水解、 脱氨生成α-酮酸。 在生物体的蛋白质代谢中,
在醇溶液中α-氨基酸乙酯与氨反应,生成氨基酸酰胺。
O R CH C NH2 OC2 H5 NH3 乙醇 O R CH C NH2 NH2 + C2 H5OH
动植物体内的天冬酰胺和谷氨酰胺就是按此反应方式进行的。 (4)氨基酸中氨基和羧基共同参与的反应。 a.与水合茚三酮的反应。α-氨基酸与水合茚三酮在弱酸性溶液中共热,会发生氧化、 脱氨、脱羧等一系列复杂反应,最后生成蓝紫色物质。此显色反应称为茚三酮反应。这个反 应可用于α-氨基酸的定性和定量分析。其反应过程可能如下:
14.1.3 氨基酸的化学性质
Chemical Properties of Amino Acids
(1)氨基酸的两性性质和等电点。氨基酸既含有碱性基团(—NH2) ,又含有酸性基团 (—COOH) 。它们具有两性,与强酸或强碱作用都能生成盐。
氨基酸的结构与性质

氨基酸的结构与性质氨基酸是生命中的基本分子之一,它是构成生物体内蛋白质的组成单元,同时还在许多代谢反应中发挥重要作用。
氨基酸的结构与性质涉及到它的化学组成、空间结构以及在生物体内的功能。
以下将详细介绍氨基酸的结构与性质。
一、氨基酸的化学结构:氨基酸由中心碳原子(α-C)和与之相连的四个基团组成:氨基(-NH2)、羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R)。
1.氨基:-NH2,和一个氢原子连接,是氨基酸的一个常见特点。
2.羧基:-COOH,和一个氢原子连接,为氨基酸的另一个特点。
3.氢原子:-H,连接在中心碳原子上,可以与侧链基团相互作用。
4.侧链基团:R是氨基酸的特异性标志,不同的R导致了不同的氨基酸种类。
二、氨基酸的分类:氨基酸可以根据其侧链基团的性质被分为极性、非极性、酸性和碱性氨基酸。
1.极性氨基酸:侧链中含有氢键供体或受体,可以与其他极性物质相互作用。
酪氨酸、赖氨酸、组氨酸等就是极性氨基酸的代表。
2.非极性氨基酸:侧链中没有明显的极性基团,通常是脂溶性的。
丙氨酸、丝氨酸、亮氨酸等都属于非极性氨基酸。
3.酸性氨基酸:侧链中含有羧基,可以失去质子。
谷氨酸、门冬氨酸是常见的酸性氨基酸。
4.碱性氨基酸:侧链中含有氨基,在适当的条件下可以接受质子。
赖氨酸、精氨酸等属于碱性氨基酸。
三、氨基酸的空间结构:氨基酸通常以L型存在,这是由于侧链基团的位置而决定的。
在L型氨基酸中,羧基位于左侧,而氨基位于右侧。
D型氨基酸存在于一些细菌细胞壁中,而在自然界中D型氨基酸几乎不见。
氨基酸的侧链基团的位置和性质决定了氨基酸的生物功能和化学反应。
侧链基团的大小、电荷、极性、亲水性等属性对蛋白质的结构和功能起着重要的影响。
四、氨基酸的性质:1.酸碱性:氨基酸可以通过羧基中的羟基(-OH),羟基的质子(H+),以及氨基中的氨基质子(NH3+)与其他分子发生酸碱反应。
2.缔合特性:在生物体内,通过形成酯、肽和烷基缔合等化学反应,氨基酸可以与其他分子形成化学连接。
氨基酸的结构及性质

氨基酸的结构及性质氨基酸是生物体内重要的有机分子,它们包含一个氨基(NH2)基团和一个酸基(COOH)基团。
我们常常会将它们简写为“R-氨基酸”,其中“R”代表一个不同的侧链基团。
氨基酸是构成蛋白质的基本组成单位,也是生物体内许多重要分子的前体。
氨基酸的性质与其侧链基团的差异有关。
氨基酸可以分为两类:极性和非极性的。
极性氨基酸的侧链含有亲水基团,例如酪氨酸(tyrosine)和丝氨酸(serine)。
非极性氨基酸的侧链则不含有亲水基团,例如丙氨酸(alanine)和异亮氨酸(isoleucine)。
氨基酸还可以根据其侧链的不同特点进一步分类。
以下是几种常见的氨基酸及其性质:1. 酸性氨基酸:这些氨基酸的侧链中含有一个可解离的羧基(COOH),因此它们在溶液中具有酸性。
酸性氨基酸包括谷氨酸(glutamic acid)和天冬氨酸(aspartic acid)。
2. 碱性氨基酸:这些氨基酸的侧链中含有一个或多个可离子化的氨基基团(NH2)。
碱性氨基酸包括赖氨酸(lysine)和精氨酸(arginine)。
这些氨基酸在溶液中具有碱性。
3. 非极性氨基酸:这些氨基酸的侧链基团不带有电荷,因此它们在溶液中是非极性的。
非极性氨基酸包括甲硫氨酸(methionine)和苯丙氨酸(phenylalanine)。
4.极性氨基酸:这些氨基酸的侧链中含有亲水基团,因此它们在溶液中具有亲水性。
极性氨基酸可以进一步分为两类:带有极性非带电侧链的和带有偏极性侧链的。
• 带有极性非带电侧链的氨基酸包括色氨酸(tryptophan)和酪氨酸(tyrosine)。
它们在溶液中与水分子进行氢键形成稳定的结构。
• 带有偏极性侧链的氨基酸包括苏氨酸(threonine)和丝氨酸(serine)。
它们的侧链含有可以与水分子形成氢键的羟基基团。
此外,氨基酸还具有缔合成蛋白质的能力。
在蛋白质合成中,氨基酸通过肽键连接形成多肽链。
肽键是氨基酸之间的共价键,连接氨基酸的α-氨基与α-酸基。
氨基酸的结构及性质

主要内容
氨基酸的分析 蛋白质的分析 核酸的分析 两个实验
第一章、氨基酸的结构及性质 —— 组成蛋白质的基本单位
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸〔甘氨酸除外〕.
第一节 氨基酸的分类
一、氨基酸的结构通式
氨基酸是蛋白质水解的最终产物,是组成蛋白质的基本单位.从蛋白质水解物中分 离出来的氨基酸有二十种,除脯氨酸和羟脯氨酸外,这些天然氨基酸在结构上的共 同特点为:
脯氨酸
饼干写亮一本谱 proline Pro P
6.30
4. 极性中性氨基酸
色氨酸 tryptophan Trp W 5.89
丝氨酸 serine
Ser S 5.68
酪氨酸 tyrosine Tyr Y 5.66 半胱氨酸 cysteine Cys C 5.07
蛋氨酸 methionine Met M 5.74
〔1〕按R基团的酸碱性分
中性AA 酸性AA 碱性AA
〔2〕按R基团的电性质分
疏水性R基团AA 电荷极性R基团的AA 带电荷R基团的AA
〔3〕按R基团的化学结构分 芳香族AA 杂环族AA
〔一〕按R基的化学结构分类 可分为三类:脂肪族、芳香族和杂环族
1、脂肪族氨基酸
● 含一氨基一羧基的中性氨基酸
甘氨酸 Gly, G
+NH3
-HH
+NH3
-O O C -C H -C H 2-SS-C H 2-C H -C O O -
+ N H 3
+ N H 3
二硫键
胱氨酸
人体所需的八种必需氨基酸 赖氨酸<Lys> 缬氨酸<Val> 蛋氨酸<Met> 色氨酸<Trp > 亮氨酸<Leu> 异亮氨酸<Ile> 苏氨酸<Thr> 苯丙氨酸<Phe>
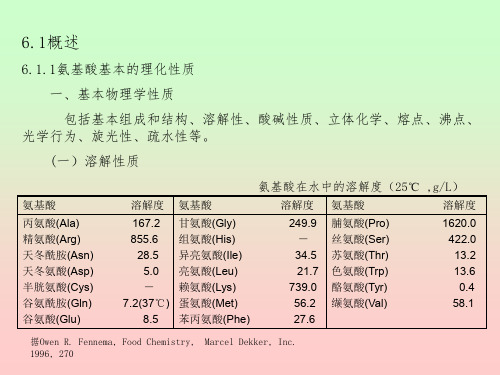
氨基酸基本的理化性质
活性类型
抗菌肽 枯草菌素 乳酸链球菌素 Lactocin S 橡胶素 神经肽 脑啡肽 α -内啡肽 强啡肽 韩蛙皮素 激素肽及激素调节肽 催产素 促肾上腺皮质激素 加压素 Amylin 免疫活性肽 α -干扰素 白细胞介素-2 抗癌多肽 肿瘤坏死因子 环己肽
氨基酸数
未知 34 33 43
5 16 17 14
739.0 56.2 27.6
脯氨酸(Pro) 丝氨酸(Ser) 苏氨酸(Thr) 色氨酸(Trp) 酪氨酸(Tyr) 缬氨酸(Val)
1620.0 422.0 13.2 13.6 0.4 58.1
据Owen R. Fennema, Food Chemistry, Marcel Dekker, Inc. 1996, 270
(二)氨基酸的疏水性
氨基酸的疏水性,是影响氨基酸溶解行为的重要因素,也是影响蛋白 质和肽的物理化学性质(如结构、溶解度、结合脂肪的能力等)的重要因 素。
按照物理化学的原理,疏水性可被定义为:在相同的条件下,一种溶 于水中的溶质的自由能与溶于有机溶剂的相同溶质的自由能相比所超过的 数值。估计氨基酸侧链的相对疏水性的最直接、最简单的方法就是实验测 定氨基酸溶于水和溶于一种有机溶剂的自由能变化。
RCH2SCH2COOH
避免巯基氧 同上
苹果酸酐*****
R CH2 S CHCOOH CH2COOH
(250nm)
对汞代苯甲酸
R CH2SHg
COOH
测定巯基含量
官能团及反应
试剂和条件
产物
评价
含量
D.羟基 酯化
E.-SCH3(Met) 1.烷烃化
2.β -丙醇酸
N-乙基马来亚胺 DTNB******
氨基酸的理化性质

氨基酸的理化性质
一、两性解离及等电点
➢定义:氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。
➢等电点(pI):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH 值称为该氨基酸的等电点。
➢等电点计算:
➢备注:pI值等于两性离子两边pK值之和的平均值。
➢溶液的pH偏离pI越远,氨基酸带净电荷越多,在电场中越容易分离。
➢pI时氨基酸溶解度最小,容易聚集沉淀。
二、光学性质
1.旋光性:除甘氨酸外,其他氨基酸有不对称C原子,可以用旋光仪测定其旋光性。
➢左旋:Ser、Leu、Pro、Trp、Phe等。
➢右旋:Ala、Ile、Glu、Asp、Val、Lys、Arg等。
2.光吸收:R基团含有芳香环共轭双键系统的色氨酸、酪氨酸、苯丙氨酸,在近紫外区(220—300nm)有光吸收,其最大光吸收(λmax)分别为279nm,278nm和259nm。
蛋白质由于含有这些氨基酸,一般最大光吸收在280nm波长处,因此能利用紫外分光光度法很方便的测定蛋白质含量。
三、重要化学反应
1.茚三酮反应:在ph5-7和80—100°条件下,氨基酸与茚三酮可生成蓝紫色化合物,其最大吸收峰在570nm处。
常作为氨基酸定量分析方法。
脯氨酸或羟脯氨酸与茚三酮生成黄色化合物。
此反应经常用于氨基酸的定性和定量分析。
氨基酸的化学性质

m.p
Ⅰ、氨基酸 > 三、氨基酸的化学性质 1.氨基酸的酸-碱性
氨基酸在一般情况下不是以游离的羧基或氨基存 在的,而是两性电离,在固态或水溶液中形成内盐。
R CH COOH NH2
R CH COO NH3
Ⅰ、氨基酸 > 三、氨基酸的化学性质
由于-氨基酸分子中既含有-NH2又有-COOH,因此,
L-苏氨酸
自然界存在的氨基酸大多为L-型。动物体内的酶只 对L-氨基酸代谢,而对D氨基酸不起作用。
Ⅰ、氨基酸 >一、氨基酸的构型 存在形式:
氨基酸都以偶极离子的形式存在。
CH3-CH-COO NH3
+
丙氨酸
-
HO2C(CH 2)2-CH-COO
谷氨酸
-
NH3
+
Ⅰ、氨基酸 >二、氨基酸的物理性质
(1)溶解性
大多数氨基酸为无色晶体,除胱氨酸、酪氨酸外,都 可溶于水;除脯氨酸、半胱氨酸外,都难溶于有机溶剂。 (2)旋光性 除甘氨酸外,其它氨基酸都具有旋光性。
(3)熔点
氨基酸的熔点远高于其异构体羟基酰胺,这是因为氨基酸是以内盐形式存在。
H2N CH2 COOH
H3N CH2 COO
232℃
O HOCH 2 C NH 2
中性氨基酸
酸性氨基酸 碱性氨基酸
pI = 4.8~6.3
pI = 2.7~3.2 pI = 7.6~10.8
2°等电点时,偶极离子在水中的溶解度最 小,易结晶析出。
Ⅰ、氨基酸 > 三、氨基酸的化学性质 2、与亚硝酸反应
R CH COOH + HNO 2 NH2
R CH COOH + N2 + H2O OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C3H7NO3 C4H7NO4
C4H8N2O3 C4H9NO3 C5H9NO2 C5H9NO4 C5H11NO2 C6H9N3O2 C6H13NO2
C6H13NO2 C6H14N2O2 C6H14N4O2 C9H11NO2 C9H11NO3 C11H12N2O2
cr
-732.7
cr
-973.3
cr
-789.4
溶解度——在25℃时100克水中溶解的氨基酸克数,单位为g/100g。
名称
(Name) 丙胺酸 精氨酸 天冬氨酸 天冬酰胺
酸 半胱氨酸
谷氨酸 谷氨酸盐 氨基乙酸
组氨酸 异亮氨酸
亮氨酸 赖氨酸 蛋氨酸 苯基丙氨
酸 脯氨酸 丝氨酸 苏氨酸 色氨酸 酪氨酸 缬氨酸
符号(Symbol)
Ala,A Arg,R Asp,D
Glu
E
2-氨基戊二酸
6.26
Gly
G
氨基乙酸
7.1
His
H
2-氨基-3-(1’-氢-咪唑 基-4’)丙酸
2.23
Ile
I
2-氨基-3-甲基戊酸
5.45
Leu
L
2-氨基-4-甲基戊酸
9.06
Lys
K
2,6-二氨基己酸
5.82
Met
M
2-氨基-4-甲硫基丁酸
2.27
Phe
F
2-氨基-3-苯基丙酸
3.91
CH2(NH2)-COOH
C2H5-CH(CH3)-CH(NH2)-COOH (CH3)2CH-CH2-CH(NH2)-COOH
H2N-[CH2]4-CH(NH2)-COOH CH3-S-[CH2]2-CH(NH2)-COOH
C6H5-CH2-CH(NH2)-COOH
HO-CH2-CH(NH2)-COOH CH3-CH(OH)-CH(NH2)-COOH
Amino Acid Fundamental Properties
体积(Volume)
pK a (支链)
/(10-10m) 3
(Side chain)
88.6
-
173.4
-12
111.1
4.5
114.1
-
108.5 138.4 143.8 60.1 153.2 166.7 166.7 168.6 162.9
(CH3)2CH-CH(NH2)-COOH
物质为基准的。物质状态表示符号为:g——气态,l——液态,cr——晶体。
氨基酸的标准热力学数据
dard Thermodynamic Data of Amino Acids
△G
Θ f
/(kJ/mol)
SΘ /[J/(mol•K)]
-
-
-
-
-
-
-
-
-
-
-
-
CpΘ /[J/(mol•K)]
1.401 1.1 1.66
1.54
1.46
1.607
1.191 1.34
-
1.537
1.456 1.23
ofAmino Acids
氨基酸的系统名称、出现率与分子式 mes、Occurrences and Formulae of Amino Acids
结构式 ( Structure formula)
Pro
P
2-吡咯烷羧酸
5.12
Ser
S
2-氨基-3-羟基丙酸
7.34
Thr
T
2-氨基-3-羟基丁酸
5.96
Trp
W
2-氨基-3-(3’-吲哚基) 丙酸
1.32
Tyr
Y
2-氨基-3-(对羟苯基) 丙酸
3.25
Val
V
2-氨基-3-甲基丁酸
6.48
(3) 氨基酸的标准热力学数据 Standard Thermodynamic Data of Amino Acids
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
200.1
-
-
-
-
-
-
-
-
-
-
250.6
232
-
213.6
203
-
-
-
-
214
216.4
-
251
238.1
名称 (Name)
甘氨酸
分子式 (Molecular formula)
C2H5NO2
l -丙氨酸
d -丙氨酸 l -半胱氨
酸
C3H7NO2 C3H7NO2 C3H7NO2S
状态 (State)
cr g cr g cr
cr
氨基酸的标准热力学数据
Standard Thermodynamic Data of Amino A
下表中的标准热力学数据是以温度25.0℃(298.15K)处于标准状态的1摩尔纯物质为基准的。物质状态表示符号为:g——气
△H Θ ——物质的标准生成焓( 298.15K),单位为kJ/mol; f C p Θ——物质的常压热容(298.15K),单位为J/(mol•K)。 △G Θ ——物质的标准生成 Gibbs自由能(298.15K),单位为kJ/mol; f S Θ——物质的标准熵(298.15K),单位为J/(mol•K);
9.1~9.5 4.6 6.2 10.4 -
189.9
-
112.7
-
89
-
116.1
-
227.8
-
193.6
9.7
140
-
ห้องสมุดไป่ตู้
pI
(25 ºC) 6.107 10.76 2.98
-
5.02 3.08
6.064 7.64 6.038 6.036 9.47 5.74
5.91
6.3 5.68
5.88 5.63 6.002
溶解度(Solubility)
/(g/100g) 16.65 15 0.778
3.53
很大 0.864
2.5 24.99 4.19 4.117 2.426 很大 3.381
2.965
162.3 5.023 很大 1.136 0.0453 8.85
晶体密度 (Crystal density) /(g/ml)
cr
-807.2
cr
-512.2
g
-366.2
cr
-1009.7
cr
-617.9
g
-455.1
cr
-466.7
cr
-637.4
g
-486.8
cr
-637.9
cr
-678.7
cr
-623.5
cr
-466.9
g
-312.9
cr
-685.1
cr
-415.3
氨基酸的性质
所带正电 氨基酸的等电点;
g。
氨基酸的基本性质
147.18
97.12 87.08 101.11 186.12 163.18 99.14
氨基酸的基本性质 Amino Acid Fundamental Properties
表面积(Surface)
/(10-10m) 2 115 225 150
160
135 190 180 75 195 175 170 200 185
CH3-CH(NH2)-COOH H2N-C(=NH)-NH-[CH2]3-CH(NH2)-
COOH H2N-CO-CH2-CH(NH2)-COOH HOOC-CH2-CH(NH2)-COOH
HS-CH2-CH(NH2)-COOH H2N-CO-[CH2]2-CH(NH2)-COOH HOOC-[CH2]2-CH(NH2)-COOH
210
145 115 140 255 230 155
(2)
氨基酸的系统名称、出现频率与分子式 Systematic Names、Occurrences and Formulae ofAmino Acids
符号(Symbols)
氨基酸的系统名称、出现率与分子式
Systematic Names、Occurrences and Formulae of
氨基酸的性质 (1) 氨基酸的基本性质
Amino AcidFundamental Properties
M r(-H2O)——减去1分子水之后的相对分子质量; pK a——氨基酸的支链解离常数; pI ——在25℃时氨基酸的等电点,即当其在某一pH值时,氨基酸所带正电
荷与负电荷相等,此时净电荷为零,此pH值就称为氨基酸的等电点;
Asn,N
Cys,C Glu,E Gln,Q Gly,G His,H Ile,I Leu,L Lys,K Met,M
Phe,F
Pro,P Ser,S Thr,T Trp,W Tyr,Y Val,V
M r(-H2O)
71.09 156.19 114.11
115.09
103.15 129.12 128.14 57.05 137.14 113.16 113.16 128.17 131.19
系统名称
出现频率
(Systematic name)
(Occurrence) /%
Ala
A
2-氨基丙酸
7.49
Arg
R
