2020高中化学 课时作业23 硫的氧化物 新人教版必修1
人教版高中化学必修一课时作业:4-3-1硫的氧化物含解析

个帅哥帅哥的 ffff课时作业 23硫的氧化物时间: 45 分钟满分:100分一、选择题 (每题 4 分,共 48 分)1.以下说法正确的选项是 ()A.SO2能使 FeCl3、KMnO 4水溶液颜色变化B.能够用澄清石灰水鉴识 SO2和 CO 2C.硫粉在过度的纯氧中焚烧能够生成SO3D.少许 SO2经过浓的 CaCl2溶液能生成白色积淀分析: SO2中硫为+ 4 价,拥有较强复原性。
在水溶液中,SO2能够将氧化剂FeCl3、KMnO 4等快速复原而使溶液颜色变化;SO2通入澄清石灰水跟CO 2通入澄清石灰水反响现象近似;往常状况下,SO2很难被氧气氧化,只有在必定温度和催化剂存在的条件下才反响生成 SO3,且是可逆反响; SO2的水化物是 H 2SO3,H2SO3的酸性比盐酸弱,不可以生成白色积淀。
答案: A2.以下说法不正确的选项是 ()A.因为地壳的岩层里含硫及其化合物,所以火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接焚烧会产生对大气有严重污染的SO2气体C.硫在空气中焚烧的产物是SO2,在氧气中焚烧的产物是SO3 D.硫是一种淡黄色晶体,不溶于水,微溶于酒精分析:SO2转变为 SO3的条件是催化剂、加热,而 S 在氧气中焚烧只好生成 SO2,不具备 SO2转变为 SO3的条件。
答案: C3.能与 SO2气体发生反响,但无积淀产生的是()①溴水②Ba(OH) 2溶液③石灰水④Na2CO3⑤稀 H 2SO4⑥Na2SO3A.只有①B.①③④C.④⑤⑥D.①④⑥分析:相关反响为:①S O2+ Br2+2H2O===H 2SO4+2HBr( 无积淀生成 );②SO2+Ba(OH) 2===BaSO3↓+H 2O(有积淀生成);③SO2+Ca(OH) 2===CaSO3↓+H2O(有积淀生成);④SO2+ Na2CO 3===Na2SO3+CO 2(无积淀生成 );⑤SO2与稀 H2SO4不反响;⑥S O2+ Na2SO3+H 2O===2NaHSO 3(无积淀生成 )。
人教版化学必修一《4-3-1硫的氧化物》课后作业及答案

课后作业限时:45分钟满分:100分一、选择题(每小题3分,共39分。
)1.高温下硫酸亚铁发生如下反应:2FeSO4高温,Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )A.BaSO3和BaSO4B.BaSC.BaSO3D.BaSO42.酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防治酸雨形成的措施中可行的是( )①对燃煤进行脱硫②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中③人工收集雷电作用所产生的氮的氧化物④飞机、汽车等交通工具采用清洁燃料,如采用天然气、甲醇等A.①②③④ B.①②③C.①②④ D.①③④3.(双选)下列有关亚硫酸的叙述中,不正确的是( )A.亚硫酸是SO2的水溶液,显酸性B.亚硫酸不稳定,容易分解为水和SO2C.亚硫酸具有漂白性,能够使品红溶液褪色D.亚硫酸对人体有害,所以用SO2漂白过的食品不能食用4.下列溶液中能够区别SO2和CO2气体的是( )①石灰水②H2S溶液③酸性KMnO4溶液④氯水⑤品红溶液A.①②③ B.②③④C.②③④⑤ D.全部5.(双选)下列对SO2和SO3的叙述正确的是( )A.都能使紫色石蕊溶液变红B.通常条件下都易溶于水C.都是酸性氧化物,与水的反应都是可逆反应,所得溶液都是强酸D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫6.Cl2和SO2都具有漂白作用,能使品红溶液褪色。
若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是( )①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀A.①② B.①③C.②③ D.②④7.下列反应属于可逆反应的是( )A.碘加热升华成碘蒸气,冷却后碘蒸气凝结成固态碘B.NH4Cl加热分解成NH3和HCl气体,NH3和HCl气体在试管中凝结成NH4ClC.CaO溶于水生成Ca(OH)2,Ca(OH)2受热分解成CaO和H2OD.在密闭容器中充入NO2发生反应2NO22O48.一定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3∶5,则参加反应的SO2与NaOH的物质的量之比为( )A.1∶2 B.3∶5C.8∶11 D.18∶89.下列实验,一定不会出现沉淀现象的是( )A.CO2气体通入Na2SiO3溶液中B.CO2气体通入饱和Na2CO3溶液中C.SO2气体通入BaCl2溶液中D.SO2气体通入Ba(OH)2溶液中10.下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )①品红溶液②酸性KMnO4溶液③溴水④滴有酚酞的NaOH溶液⑤碘和淀粉的混合物A.①④ B.①②③C.②③④ D.②③⑤11.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )①饱和Na2CO3溶液②饱和NaHCO3溶液③浓H2SO4溶液④灼热的铜⑤碱石灰A.①③④ B.③④⑤C.②④③ D.②③④课后作业1.D。
2020届人教版高一化学必修1练习:第四章 第三节 第1课时 硫及其氧化物含答案

第三节硫和氮的氧化物第1课时硫及其氧化物课后篇巩固提升基础巩固1.下列反应中,SO2表现出氧化性的是( )A.2SO2+O22SO3B.SO2+H2O H2SO3C.2H2S+SO23S↓+2H2OD.SO2+2H2O+Cl2H2SO4+2HCl、D两项,SO2中硫元素的化合价均由+4价升高到+6价,表现了还原性;B项,SO2中硫元素的化合价未发生变化,SO2表现的是酸性氧化物的性质;C项,SO2中硫元素的化合价降低,表现出了氧化性。
2.化学与生活密切相关。
下列说法错误的是( )A.SO2可用于漂白纸浆和草帽B.Fe2O3可用作红色油漆和涂料C.活性炭可用于去除冰箱中的异味D.碳酸钡可用于胃肠X射线造影检查,能够溶解BaCO3,产生重金属离子Ba2+,D项错误。
3.下列说法中错误的是( )A.二氧化硫能漂白某些物质,说明它具有氧化性B.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性D.二氧化硫漂白过的草帽过一段时间后又会恢复到原来的颜色2的漂白作用不同于HClO,不是利用其强氧化性,而是与有色物质化合生成无色不稳定物质,A错,D正确;二氧化硫水溶液显酸性,但不具有漂白石蕊溶液的能力,B正确;SO2具有还原性,能被酸性KMnO4溶液氧化,C正确。
4.下列有关三氧化硫的说法中正确的是( )A.SO3极易溶于水,且与水反应生成H2SO4B.SO2、SO3均具有漂白性,均能使石蕊溶液变红色C.SO3可与碱反应,但不与碱性氧化物反应D.SO2在空气中易被氧化为SO33不具有漂白性,SO2不能漂白指示剂,两者均可使石蕊溶液变红色,B项错误;SO3既可与碱反应,也可与碱性氧化物反应,故C项错误;SO2不易被空气中的氧气氧化,只有在催化剂存在并加热时才能被氧化为SO3,故D项错误。
5.下列所给物质的性质和用途不正确的是( )A.Na2O2淡黄色固体、供氧剂B.Fe2O3红棕色粉末、炼铁原料C.Cl2浅绿色气体、自来水消毒D.SO2无色气体、工业制硫酸2O2为淡黄色固体,可与二氧化碳和水反应生成氧气,常用于供氧剂,A项正确;Fe2O3不溶于水,性质稳定,是红色固体,可用于炼铁,B项正确;常温下氯气是一种黄绿色气体,氯气与水反应生成的HClO,具有强氧化性,则Cl2可用于自来水的消毒,C项不正确;二氧化硫为无色具有刺激性气味的气体,工业上二氧化硫通过催化氧化生成三氧化硫,三氧化硫与水反应生成硫酸,D项正确。
高中化学必修一课时作业22二氧化硫和三氧化硫+Word版含解析

课时作业22二氧化硫和三氧化硫一、选择题1.下列关于硫的说法不正确的是()A.试管内壁附着的硫可用二硫化碳溶解除去B.游离态的硫存在于火山喷口附近或地壳的岩层里C.单质硫既有氧化性,又有还原性D.硫在过量纯氧中的燃烧产物是三氧化硫【解析】硫燃烧时只能生成SO2,SO3可由SO2催化氧化制取,D项错误。
【答案】 D2.下列溶液中通入SO2一定不会产生沉淀的是()A.Ba(OH)2B.Ba(NO3)2C.Na2S D.BaCl2【解析】SO2是酸性氧化物,能与Ba(OH)2溶液反应生成BaSO3沉淀;H2SO3属于中强酸,不能与BaCl2溶液反应;H2SO3中S元素呈+4价,因此H2SO3在反应中既可表现酸性,又可表现还原性与氧化性,SO2与Ba(NO3)2、Na2S反应的方程式分别为3SO2+2H2O+Ba(NO3)2===BaSO4↓+2NO↑+2H2SO4,3SO2+2Na2S===3S↓+2Na2SO3。
【答案】 D3.下列气体中,有毒、能污染大气,但可以用碱液吸收的是() A.CO B.CO2C.SO2D.N2【解析】CO和SO2是大气污染物,但CO不能和碱液反应,SO2是酸性氧化物,能与碱反应生成盐和水。
【答案】 C4.为了除去SO2中少量的HCl气体,应将混合气体通入() A.溴水B.NaHSO3饱和溶液C.NaOH溶液D.NaHCO3饱和溶液【解析】除杂的原则“不增不减”。
即不能引入杂质离子,不能减少要保留的物质。
【答案】 B5.对于反应2SO2+O22SO3的叙述不正确的是()A.该反应是可逆反应B.反应方程式中“ƒ”表示在相同条件下,反应可以同时向两个方向进行C.1 mol O2与2 mol SO2混合反应,可生成2 mol SO3D.在该反应中SO2作还原剂【解析】根据可逆反应的特点,1 mol O2和2 mol SO2反应,不可能生成2 mol SO3。
【答案】 C6.SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是()①KMnO4(H+,aq)②溴水③碘水④氯水⑤Fe3+(aq)A.①⑤B.②③C.全部D.都不是【解析】SO2能使酸性高锰酸钾溶液褪色,是由于酸性高锰酸钾溶液将SO2氧化为H2SO4,自身被还原成无色的Mn2+;SO2能使卤水褪色,是由于X2(不包括F2)将SO2氧化为H2SO4,本身被还原为无色X-;SO2能使棕黄色的Fe3+(aq)变浅,是由于Fe3+将SO2氧化为H2SO4,本身被还原为浅绿色Fe2+。
高中化学 课时作业23 硫的氧化物 新人教版必修1

课时作业23 硫的氧化物时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.下列说法正确的是( )A.SO2能使FeCl3、KMnO4水溶液颜色变化B.可以用澄清石灰水鉴别SO2和CO2C.硫粉在过量的纯氧中燃烧可以生成SO3D.少量SO2通过浓的CaCl2溶液能生成白色沉淀解析:SO2中硫为+4价,具有较强还原性。
在水溶液中,SO2可以将氧化剂FeCl3、KMnO4等迅速还原而使溶液颜色变化;SO2通入澄清石灰水跟CO2通入澄清石灰水反应现象类似;通常情况下,SO2很难被氧气氧化,只有在一定温度和催化剂存在的条件下才反应生成SO3,且是可逆反应;SO2的水化物是H2SO3,H2SO3的酸性比盐酸弱,不能生成白色沉淀。
答案:A2.下列说法不正确的是( )A.由于地壳的岩层里含硫及其化合物,因此火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体C.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3D.硫是一种淡黄色晶体,不溶于水,微溶于酒精解析:SO2转化成SO3的条件是催化剂、加热,而S在氧气中燃烧只能生成SO2,不具备SO2转化成SO3的条件。
答案:C3.能与SO2气体发生反应,但无沉淀产生的是( )①溴水②Ba(OH)2溶液③石灰水④Na2CO3⑤稀H2SO4⑥Na2SO3A.只有① B.①③④C.④⑤⑥ D.①④⑥解析:有关反应为:①SO2+Br2+2H2O===H2SO4+2HBr(无沉淀生成);②SO2+Ba(OH)2===BaSO3↓+H2O(有沉淀生成);③SO2+Ca(OH)2===CaSO3↓+H2O(有沉淀生成);④SO2+Na2CO3===Na2SO3+CO2(无沉淀生成);⑤SO2与稀H2SO4不反应;⑥SO2+Na2SO3+H2O===2NaHSO3(无沉淀生成)。
对照题意,符合条件的有①④⑥。
答案:D4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )①饱和Na2CO3溶液②饱和NaHCO3溶液③浓H2SO4溶液④灼热的铜网⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④答案:D5.如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
高中 化学 必修 第二册 课时作业(一) 硫和二氧化硫

课时作业(一) 硫和二氧化硫姓名:______________ 班级:________________ 学号:_______________(本栏目内容,在学生用书中以独立形式分册装订!)一、基础巩固1.(2020·原创题)下列说法中正确的是( )A .S 在过量的O 2中充分燃烧,可得SO 3B .单质硫不溶于水,易溶于酒精和四氯化碳C .铁与过量单质硫加热时反应生成Fe 2S 3D .硫在O 2中燃烧发出明亮的蓝紫色火焰,产生无色有刺激性气味的气体D [A 错,S 与O 2反应时,无论氧气是否足量,充分燃烧都生成SO 2。
B 错,单质硫不溶于水,微溶于酒精,易溶于四氯化碳。
C 错,单质S 的氧化性较弱,与Fe 加热时反应生成FeS 。
D 对,硫在纯氧中燃烧发出明亮的蓝紫色火焰,产生无色有刺激性气味的气体SO 2。
]2.(2020·山西平遥中学检测)下列关于单质硫的性质的说法正确的是( )A .单质硫跟金属单质的反应中硫都是氧化剂B .单质硫跟金属单质的反应都需要加热或点燃C .单质硫跟非金属单质的反应中硫都是还原剂D .单质硫跟非金属单质的反应中硫都是氧化剂A [金属元素的化合价只有正价,在金属硫化物中硫元素的化合价一定是负价,单质硫在跟金属单质的反应中硫都是氧化剂;在硫单质跟金属单质反应的条件中,“S +Hg ”特殊,反应不需要加热;如果单质硫跟氧化性弱的非金属单质反应,如与H 2反应,硫显氧化性;如果单质硫跟氧化性强的非金属单质反应,如与O 2反应,硫显还原性。
]3.(2020·山东泰安第一中学检测)0.05 mol 某单质与0.8 g 硫在一定条件下完全反应,该单质可能是( )①H 2 ②O 2 ③K ④Zn ⑤Fe ⑥CuA .①②B .③④C .③⑤D .③⑥D [n (S)=0.8 g 32 g ·mol -1=0.025 mol ,该单质与硫的物质的量之比是2∶1,所以该单质为K 或Cu 。
新教材2023版高中化学课时作业1硫和二氧化硫新人教版必修第二册

课时作业1 硫和二氧化硫[学业达标]1.[2022·合肥高一检测]下列劳动项目与对应化学知识无关联的是( )2.下列说法错误的是( )A.残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶液除去B.硫单质与变价金属反应时一般生成低价态金属硫化物C.汞蒸气有毒,实验室不慎洒落一些汞,可撒上硫粉进行处理D.单质硫燃烧时,氧气少量时生成SO2,氧气足量时生成SO33.(双选)北京时间2022年1月15日,汤加火山喷发产生大量SO2进入大气。
下列有关SO2说法正确的是( )A.大气中的SO2主要来源于化石燃料的燃烧B.SO2是无色、无味、有毒的气体C.SO2与NaOH溶液反应生成Na2SO4D.SO2能使紫色的酸性KMnO4溶液褪色4.下列溶液中通入SO2一定不会产生沉淀的是( )A.Ba(OH)2B.Ba(NO3)2C.Na2S D.BaCl25.为了除去SO2中少量的HCl气体,应将混合气体通入( )A.溴水B.NaHSO3饱和溶液C.NaOH溶液D.NaHCO3饱和溶液6.用某溶液浸湿滤纸后,将滤纸置于集气瓶口,以检验瓶中是否收集满SO2气体,则该溶液是( )A.BaCl2溶液B.酸性KMnO4溶液C.淀粉KI溶液D.澄清石灰水7.下列有关三氧化硫的说法中,正确的是( )A.SO3极易溶于水,且与水反应生成H2SO4B.SO2、SO3均具有漂白性,均能使石蕊溶液变红色C.标准状况下,1 mol SO3的体积约为22.4 LD.SO2在空气中易被氧化为SO38.如图所示装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )[等级突破]9.将等体积的SO2和Cl2充分混合后,通入加有品红的氯化钡溶液,可观察到的现象是( )A.溶液快速褪色 B.溶液缓慢褪色C.生成白色沉淀 D.生成浅黄色沉淀10.下列实验报告记录的实验现象正确的是( )11.如图是研究二氧化硫性质的微型实验装置。
2020高考化学一轮复习精品:第五讲硫和硫的氧化物(课时作业有答案)

1 2 3 4 5 6 7 8 9 10 11 12 2020高考化学一轮复习精品:第五讲硫和硫的氧化物(课时作业有答案)班级姓名学号等第1.空气是人类生存所必需的重要资源。
为改善空气质量而启动的〝蓝天工程〞得到了全民的支持。
以下措施不属于...〝蓝天工程〞建设的是A.推广使用燃煤脱硫技术,防治SO2污染 B.实施绿化工程,防治扬尘污染C.研制开发燃料电池汽车,排除机动车尾气污染D.加高工厂的烟囱,使烟尘和废气远离地表2.以下变化属于漂白性的是A.SO2使酸性高锰酸钾溶液褪色 B.乙烯使溴水褪色C.Na2O2使无色酚酞先变红,又褪色 D.SO2使NaOH酚酞溶液褪色3.向三氯化铁和氯化钡的酸性混合液中通入二氧化硫气体,有白色沉淀生成,此沉淀是A、BaSO4B、FeSC、BaSO3D、S4.以下实验能证明SO2存在的是①能使澄清石灰水变浑浊;②能使潮湿的蓝色石蕊试纸变红;③能使品红溶液褪色;④通入足量的NaOH 溶液中,再滴加BaCl2溶液,有白色沉淀生成;⑤通入溴水可使溴水褪色,再滴入含有稀HNO3的BaCl2溶液,有白色沉淀生成。
A、都能证明B、都不能证明C、③④⑤能证明D、只有⑤能证明5.以下讲法错误的选项是A.Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀硝酸后沉淀消逝B.将SO2气体通入Ba(OH)2溶液中有白色沉淀生成C.将SO2气体通入BaCl2溶液中有白色沉淀生成D.将SO2气体通入硝酸酸化的BaCl2溶液中有白色沉淀生成6.以下表达中,正确的选项是A、SO2在空气中易被氧化为SO3B、在标况下,1molSO3的体积约为22.4LC、SO2、SO3都能与水剧烈反应D、SO2可用于漂白纸浆,SO3不能7.有关二氧化硫的表达正确的选项是A、二氧化硫能使溴水、高锰酸钾溶液迅速褪色B、常温常压下,饱和二氧化硫水溶液的物质的量浓度约为1.7mol/L左右C、实验室可用启普发生器来制二氧化硫D、用石灰水专门容易区分二氧化硫和二氧化碳8.等体积的硫化纳和亚硫酸钠溶液混合,并加入适量的硫酸,有淡黄色沉淀生成,微热有刺激性酸性气体放出,这讲明硫化纳和亚硫酸钠溶液的物质的量浓度之比A大于2:1 B小于2:1 C大于2:3 D小于2:39.在常温常压下,以下各组气体不能共存的是A.SO2与O2B.NO2与NO C.O2与N2D.NO与O210.以下气体溶解于水,没有发生氧化还原反应的是A.SO2溶解于水B.NO2溶解于水C.CO2溶解于水D.Cl2溶解于水11.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。
【创新方案】高中化学 教师用书 硫和硫的氧化物推荐作业 新人教版必修1

一、选择题1.银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪,其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫黄熔化并燃烧,两天左右雪耳就制成了.雪耳炖不烂,且对人有害,制作雪耳利用的是( ) A.硫的还原性B.二氧化硫的漂白性C.二氧化硫的还原性D.硫的漂白性2.下列说法正确的是( )A.进行SO2性质探究实验时,多余的SO2应排到实验室外B.硫的化合物常存在于火山喷出的气体中C.SO2气体通入BaCl2溶液中会产生白色沉淀D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫3.将SO2通入显红色的酚酞试液中,发现红色消失,主要原因是因为SO2( )A.有漂白性B.有还原性C.溶于水后显酸性D.有氧化性4.下列化学反应表示SO2作还原剂的是( )A.SO2+NaOH===NaHSO3B.SO2+H2O H2SO3C.SO2+2H2S===3S↓+2H2OD.Cl2+SO2+2H2O===2HCl+H2SO45.下列有关三氧化硫的说法中,正确的是( )A.三氧化硫极易溶于水,且与水反应生成H2SO4B.标准状况下,1 mol SO3的体积约为22.4 LC.硫粉在过量的纯氧中燃烧可以生成SO3D.SO2、SO3均具有漂白性,能使石蕊试液褪色6.下列实验中能证明某一气体为SO2的是( )①使澄清石灰水变浑浊②使湿润的蓝色石蕊试纸变红③使品红褪色④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生A.都能证明B.都不能证明C.③④⑤能证明D.只有⑤能证明7.下列说法正确的是( )A.SO2能使品红溶液、溴水和酸性高锰酸钾溶液褪色,是因为SO2具有氧化性B.SO2和Cl2都有漂白作用,但若将等物质的量的两种气体同时作用于潮湿的有色物质时,没有漂白作用C.活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应D.SO2和Cl2使品红溶液褪色后,将褪色的溶液加热,溶液重新变为红色二、非选择题8.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.(1)要证明Na2SO3具有还原性,应选用的试剂有____________,看到的现象是________________________________________________________________________,反应的化学方程式为_______________________________________________________.(2)要证明Na2SO3具有氧化性,应选用的试剂有____________,看到的现象是________________________________________________________________________,反应的方程式为__________________________________________________________.9.A、B是两种有刺激性气味的气体.试根据下列实验事实回答问题:(1)写出A~F各物质的化学式:A____________,B____________,C____________,D____________,E____________,F____________.(2)写出A、B与水反应的离子方程式:____________________________________.10.某同学用如图所示的装置来探究SO2的性质.(1)实验前首先应做的操作是______________________________________________.(2)实验室用亚硫酸钠固体与较浓硫酸反应制取SO2气体,写出该反应的化学方程式:________________________________________________________________________.(3)分别将SO2气体通入下列C溶液中,请回答下列问题:①若C为紫色石蕊试液操作现象通入少量SO2继续通入过量SO2②若C为品红溶液操作现象通入足量SO2将试管加热③若C为酸性KMnO4溶液,通入足量SO2,现象:______________,体现SO2的________性.④若C为澄清石灰水,将SO2慢慢通入直至过量,现象为________________________,写出相应的离子方程式____________________________________________________.11.(2010·广东高考)某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH===_____________.(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为________.(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO2-4,请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO 2的影响).①提出合理假设.假设1:只存在SO 2-3;假设2:既不存在SO 2-3,也不存在ClO -;假设3:_______________________________________________________________. ②设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.限选实验试剂:3 mol·L -1 H 2SO 4、1 mol·L -1 NaOH 、0.01 mol·L -1 KMnO 4、淀粉KI溶液、紫色石蕊试液.详解答案1.B2.选B A 项应用NaOH 溶液吸收处理,C 项由于H 2SO 3为弱酸,不会产生沉淀,D 项SO 2转化为SO 3需用催化剂、高温,硫在纯氧中燃烧不会产生SO 3.3.选C 酚酞在酸性溶液中没有颜色.4.选D A 、B 两项中的反应不是氧化还原反应,C 项中SO 2作氧化剂,D 项中SO 2作还原剂.5.选A B 项标准状况下SO 3为固体,C 项不可能产生SO 3,D 项二者均能使石蕊变红,而不会使其褪色.6.选D CO 2也具有①②④的性质,Cl 2也具有③的性质,D 项为SO 2独有的性质,即SO 2――→溴水SO 2-4――→Ba 2+BaSO 4↓.7.选B A 项利用了SO 2的还原性,B 项两物质等物质的量反应会生成HCl 和H 2SO 4,从而不再具有漂白性,C 项利用了活性炭的吸附性,D 项中通Cl 2的溶液不能再变为红色.8.解析:(1)+4价硫元素具有还原性,可被氧化剂氧化,在指定的试剂中只有溴水具有强氧化性,由此应选溴水.(2)+4价的硫元素具有氧化性,与其还原性相比,氧化性较弱,只有在特定条件下才表现出氧化性,如在酸性条件下,+4价的硫才较易还原成单质硫,因此要证明其氧化性,应选用的试剂是稀硫酸和Na 2S 溶液.答案:(1)溴水,Na 2SO 3溶液 溴水褪色 Br 2+H 2O +Na 2SO 3===Na 2SO 4+2HBr (2)稀硫酸,Na 2SO 3溶液,Na 2S 溶液 产生淡黄色沉淀 2Na 2S +Na 2SO 3+3H 2SO 4===3Na 2SO 4+3S↓+3H 2O9.解析:沉淀E 为BaSO 3,则气体B 为SO 2,沉淀G 为AgCl ,则气体A 为Cl 2,A 与B 的反应为Cl 2+SO 2+2H 2O===2HCl +H 2SO 4可知C 为H 2SO 4,D 为HCl ,F 为BaSO 4.答案:(1)Cl 2 SO 2 H 2SO 4 HCl BaSO 3 BaSO 4(2)Cl 2+SO 2+2H 2O===4H ++2Cl -+SO 2-410.(1)检查装置的气密性(2)Na 2SO 3+H 2SO 4(浓)===Na 2SO 4+SO 2↑+H 2O(3)①紫色溶液变红色 红色不褪去(或溶液颜色无变化) ②品红溶液颜色褪去 品红溶液恢复原来颜色③溶液褪色还原④首先有白色沉淀生成,然后白色沉淀消失SO2+Ca2++2OH-===CaSO3↓+H2O,CaSO3+SO2+H2O===Ca2++2HSO-311.解析:本题主要考查实验设计与评价能力,背景知识为氧化还原反应,意在考查考生的实验设计能力,分析与解决问题的能力,本题在对考生实验评价能力的考查上具有特别的价值,是一个既具有新颖性,又不失经典性的好题.(1)SO2与过量NaOH反应的产物为Na2SO3与H2O;(2)在反应中,硫元素的化合价升高,所以Na2SO3为还原剂;(3)SO2-3具有较强的还原性,而ClO-具有极强的氧化性,ClO-与SO2-3是不能共存的,所以假设3为:只存在ClO-,实验设计只要求证实酸化后的溶液是具有氧化性,还是具有还原性,还是既不具有氧化性,也不具有还原性,若加入淀粉KI溶液会出现蓝色,证明存在ClO-,若加入KMnO4溶液时,KMnO4溶液褪色,证明存在SO2-3,若两种现象均无,则假设2成立.答案:(1)Na2SO3+H2O(2)Na2SO3-。
高中化学 431 二氧化硫和三氧化硫课时作业 新人教版必修1

二氧化硫和三氧化硫一、选择题1.关于SO2的说法中,正确的是( )①使某些有色物质褪色②无色,有刺激性气味,无毒③既有氧化性,又有还原性④既可溶于水,又可与水反应A.①②B.②③C.②④ D.①③④解析:SO2能使品红溶液褪色;SO2是无色,有刺激性气味的有毒气体;SO2中硫元素为+4价,既具有氧化性,又具有还原性;SO2易溶于水,并与H2O发生反应SO2+H22SO3。
答案: D2.下列有关三氧化硫的说法中,正确的是( )A.三氧化硫极易溶于水,且与水反应生成H2SO4B.标准状况下,1 mol SO3的体积约为22.4 LC.硫粉在过量的纯氧中燃烧可以生成SO3D.SO2、SO3均具有漂白性,能使石蕊试液褪色解析:标准状况下,SO3处于固态,故1 mol SO3的体积远小于22.4 L,B错误;硫粉在纯氧中燃烧只生成SO2,C错误;SO3不具有漂白性,SO3溶于水生成H2SO4会使石蕊试液变红,SO2不能漂白酸碱指示剂,D错误。
答案: A3.下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是( )①品红溶液②酸性高锰酸钾溶液③溴水④滴有酚酞的氢氧化钠溶液A.①④ B.②④C.①③ D.②③解析:①品红溶液褪色,体现二氧化硫的漂白性;②酸性高锰酸钾溶液褪色,体现二氧化硫的还原性;③溴水褪色,体现二氧化硫的还原性;④滴有酚酞的氢氧化钠溶液褪色,体现二氧化硫的酸性氧化物的性质,故选D。
答案: D4.CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是( )A.(1)NaOH (2)浓H2SO4 B.(1)浓H2SO4(2)NaOHC.(1)饱和NaHCO3(2)浓H2SO4 D.(1)浓H2SO4(2)Na2CO3解析:要得到干燥纯净的CO2,应将干燥放在后面。
SO2、CO2都与NaOH反应,所以除CO2中的SO2应用饱和NaHCO3溶液。
人教版必修一《硫和氮的氧化物》精品习题及答案(20201124211842)

硫和氮的氧化物精品习题及答案A卷:1最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况, 缓解病情。
病毒学研究同时证实,NO对SARS病毒有直接抑制作用。
下列关于NO的叙述正确的是()A. NO是一种红棕色的气体B .常温常压下,NO不能与空气氧气直接化合C .含等质量的氧元素的NO和CO的物质的量相等D. NO易溶于水,不能用排水法收集2. 2010年2月10日中国经济网发布的《第一次全国污染源普查公报》一文中有如下一组数据:下列有关说法中错误的是()A. SO2、NO x的大量排放会导致酸雨的发生B .煤与石油的大量燃烧是造成SO2、NO x大量排放的主要因素C .烟尘、粉尘属于固体污染物D.人类活动产生的气态污染物能全部进入大气中3. 常温常压下,下列各组气体不能共存的是()A. SO2 与O2B. NO2 与NOC. O2与N2D. NO 与O24. 下列关于NO和NO2的叙述正确的是()A . NO是一种红棕色气体B .常温常压下,NO不能与空气中的氧气直接化合C .含等质量的氧元素的NO和CO的物质的量相等D.NO 2可用排水法收集5.下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )①N2 T NO2 ② N02—NO ③ NO2—HNO3④ N2 T NO ⑤ N2T NH3A .①B .②⑤C .④D .③④6. 某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。
若测得氮气和二氧化碳的物质的量之比为 1 : 2,则该氮的氧化物是()A. N2OB. NOC. NO2D. N2O57. 将a mL NO、b mL NO 2和c mL O 2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则 a : b:c不可能是()A. 1 : 1 : 1B. 2: 1 : 1C. 3: 7: 4D. 1: 5: 28. —定条件下,将等体积的N02和02的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )A. 1/4B. 3/4C. 1/8D. 3/89. 氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。
高中化学第四章第三节第1课时二氧化硫和三氧化硫课时作业新人教版必修1
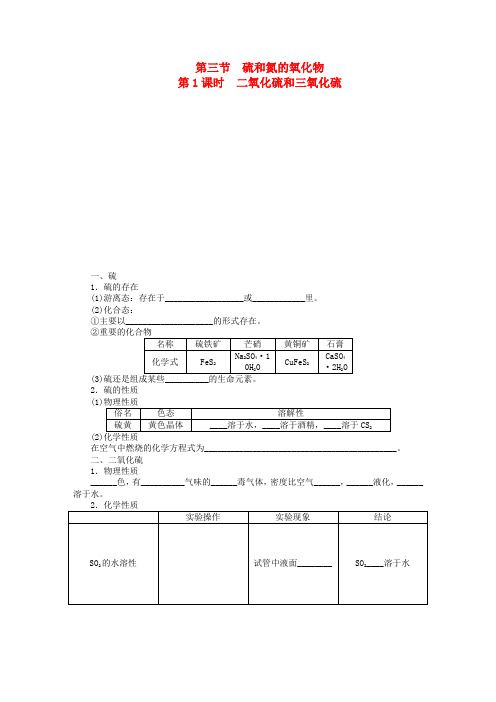
第三节硫和氮的氧化物第1课时二氧化硫和三氧化硫一、硫1.硫的存在(1)游离态:存在于__________________或____________里。
(2)化合态:①主要以____________________的形式存在。
(3)2.硫的性质(1)(2)在空气中燃烧的化学方程式为____________________________________________。
二、二氧化硫1.物理性质______色,有__________气味的______毒气体,密度比空气______,______液化,______溶于水。
①与水反应:______________________________。
②与碱反应:与NaOH 溶液反应__________________________________________或 ____________________________________________。
③与碱性氧化物反应:CaO +SO 2=====△CaSO 3(2)漂白性SO 2与某些有色物质生成__________的无色物质,但这种无色物质易________而使有色物质恢复到原来的颜色。
(3)还原性SO 2中的硫元素为______价,处于硫元素的中间价态,既有________性又有________,一般表现为________性。
3.用途(1)用于________纸浆、毛、丝、草帽辫等。
(2)用于____________。
三、三氧化硫SO 3是一种酸性氧化物,具有酸性氧化物的通性。
1.与水反应生成硫酸________________________________________________________________________2.与碱性氧化物反应生成盐SO 3+CaO===___________________3.与碱反应生成盐和水SO 3+Ba(OH)2===______________________________知识点1 硫的存在与性质1.关于硫的叙述正确的是( )A.硫的非金属性较强,所以只以化合态存在于自然界中B.分离黑火药中的硝酸钾、木炭和硫黄要用到二硫化碳、水及过滤操作C.硫与金属或非金属反应时均作氧化剂D.硫的两种单质之间的转化属于物理变化2.下列说法,不正确的是( )A.硫是一种淡黄色的能溶于水的固体B.硫在自然界中既有化合态又有游离态C.硫与铁反应生成硫化亚铁D.硫在空气中燃烧产物是二氧化硫知识点2 二氧化硫的氧化性与还原性3.下列反应中,SO2表现氧化性的是( )A.2SO2+O22SO3B.SO2+H2O===H2SO3C.2H2S+SO2===3S↓+2H2OD.SO2+2H2O+Cl2===H2SO4+2HCl4.SO2溶于水后,所得溶液的性质是( )A.有氧化性,无还原性,无酸性B.有氧化性,有还原性,有酸性C.有还原性,无氧化性,无酸性D.有还原性,无氧化性,有酸性知识点3 二氧化硫的漂白性5.二氧化硫能使下列溶液褪色,是利用二氧化硫漂白性的是( )A.氯水 B.溴水C.品红溶液 D.酸性KMnO4溶液6.下列说法,正确的是( )A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色均是因为SO2具有漂白性B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质,可增强漂白效果C.活性炭也能使有色物质褪色,是利用了碳单质具有还原性,使有色物质发生了还原反应D.SO2使品红溶液褪色,将褪色后的溶液加热,溶液又重新变为红色知识点4 二氧化硫的酸性氧化物的性质7.能够用于鉴别SO2和CO2的溶液是( )A.澄清的石灰水 B.品红溶液C.紫色石蕊试液 D.氯化钡溶液知识点5 三氧化硫的性质8.下列对于SO2和SO3的叙述,正确的是( )A.都是既有氧化性,又有还原性B.都是酸性氧化物,其水溶液都是强酸C.都可使品红溶液褪色,加热时红色又能再现D.都能与碱溶液反应练基础落实1.下列实验能证明SO2存在的是( )①能使澄清石灰水变浑浊②能使湿润的蓝色石蕊试纸变红③能使品红溶液褪色④通入足量的NaOH溶液中,再滴加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸⑤通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成A.都能证明 B.只有⑤能证明C.③④⑤能证明 D.都不能证明2.下列四种有色溶液与SO2作用,均能使其褪色,其实质相同的是( )①品红溶液②酸性KMnO4溶液③溴水④滴有酚酞的NaOH溶液A①④ B.①② C.②③ D.③④3.下列有关三氧化硫的说法中,正确的是( )A.三氧化硫极易溶于水,且与水反应生成H2SO4B.标准状况下,1 mol SO3的体积约为22.4 LC.硫粉在过量的纯氧中燃烧可以生成SO3D.SO2、SO3均具有漂白性,能使石蕊试液褪色4.检验SO2中是否混有CO2气体,可采用的方法是( )A.通过品红溶液B.先通过NaOH溶液,再通过澄清石灰水C.通过澄清石灰水D.先通过酸性KMnO4溶液,再通过澄清石灰水5.二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )A.都能使品红试液褪色B.都能和氢氧化钠溶液反应生成盐和水C.都有刺激性气味D.常温下都是气体练方法技巧6.长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。
2020届人教版高中化学必修一课时训练23硫和硫的氧化物含答案

课时训练23硫和硫的氧化物一、硫单质的存在和性质1.下列说法中不正确的是()A.硫是一种黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫解析:硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物也是SO2,只是反应产生的火焰颜色不同。
答案:D二、SO2的性质2.下列反应中,能说明SO2是酸性氧化物的是()A.SO2+Na2O Na2SO3B.SO2+2H2S3S↓+2H2OC.2Fe3++SO2+2H2O2Fe2++4H++SD.SO2+H2O2H2SO4解析:酸性氧化物的通性是可与碱反应生成盐和水,可与碱性氧化物反应生成盐等。
Na2O是碱性氧化物,与SO2反应生成Na2SO3,说明SO2是酸性氧化物,A项正确;B、C、D项是氧化还原反应,其中B项中SO2被还原,说明SO2具有氧化性,C、D项中SO2被氧化,说明SO2具有还原性,与题意不符。
答案:A3.能证明SO2具有漂白性的是()A.酸性KMnO4溶液中通入SO2气体,溶液紫红色消失B.滴有酚酞的NaOH溶液中通入SO2气体,溶液红色消失C.品红溶液中通入SO2气体,溶液红色消失D.溴水中通入SO2气体,溶液橙色消失解析:酸性KMnO4溶液中通入SO2气体,溶液紫红色消失,溴水中通入SO2气体,溶液橙色消失,都是利用了SO2的还原性;滴有酚酞的NaOH溶液通入SO2气体,溶液红色消失是因为通入的SO2气体与NaOH反应,使溶液碱性减弱;品红溶液中通入SO2气体,溶液红色消失证明SO2具有漂白性。
答案:C4.往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由黄色变成浅绿色,同时有白色沉淀产生。
下列说法正确的是()A.该实验表明FeCl3有还原性B.白色沉淀为BaSO3C.该实验表明SO2有漂白性D.反应后溶液酸性增强解析:该实验表明FeCl3有氧化性;上述过程中发生的氧化还原反应的离子方程式为2Fe3++SO2+2H2O2Fe2++S+4H+,发生的复分解反应的离子方程式为S+Ba2+BaSO4↓,白色沉淀为BaSO4,反应后有盐酸生成,溶液酸性增强。
新人教版高中化学必修一 课时训练 第三节 第1课时 二氧化硫和三氧化硫

第三节硫和氮的氧化物第1课时二氧化硫和三氧化硫1.关于SO2的叙述中,正确的是()A.在有的反应中显示氧化性,有的反应中显示还原性B.是酸性氧化物,溶于水得稳定的亚硫酸C.SO2气体通入NaOH溶液一定得到Na2SO3D.SO2气体通入BaCl2溶液中,能生成白色沉淀2.下列说法正确的是()A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色B.能使品红溶液褪色的物质不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好3.体现二氧化硫还原性的反应是 ()A.SO2+Na2CO3Na2SO3+CO2B.SO2+2H2S2H2O+3S↓C.SO2+2NaOH Na2SO3+H2OD.SO2+2H2O+Cl2H2SO4+2HCl4.下列四种有色溶液与SO2作用,均能褪色,其实质相同的是()①品红溶液②酸性KMnO4溶液③溴水④滴有酚酞的NaOH溶液A.①④B.②③C.②③④D.①②③5.大约4000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。
在古罗马著名诗人荷马的著作里也讲到硫燃烧有消毒和漂白作用。
下列物质漂白原理相同的是()①潮湿的氯气②二氧化硫③活性炭④过氧化钠A.①③B.②③C.①④D.②④6.下列溶液中能够区别SO2和CO2气体的是()①澄清石灰水②H2S溶液③KMnO4酸性溶液④氯水⑤品红溶液A.①②③B.②③④C.除①以外D.全部7.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是()①饱和Na2CO3溶液②饱和NaHCO3溶液③浓硫酸④灼热的铜网⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④8.下列离子方程式正确的是 ()A.向NaOH溶液中通入少量SO2:SO2+OH-HS O3-B.向氯水中通入少量SO2:Cl2+SO2+2H2O4H++2Cl-+S O42-C.将过量SO2通入到饱和NaHCO3溶液中:2H++C O32-H2O+CO2↑D.将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+BaSO3↓+2H+9.下列变化中,不属于化学变化的是()A.氯水使有色布条褪色B.漂白粉使某些染料褪色C.SO2使品红溶液褪色D.活性炭使红墨水褪色10.将足量的SO2通入BaCl2溶液中,无明显现象,当加入(或通入)某试剂(或气体)X后有沉淀生成。
高中化学课时分层作业硫的氧化物SO2和SO3含解析新人教版必修1

2021-4-29 20XX年复习资料教学复习资料班级:科目:课时分层作业(二十二)(建议用时:40分钟)[合格基础练]1.下列关于硫的说法不正确的是( )A.试管内壁附着的硫可用二硫化碳溶解除去B.游离态的硫存在于火山喷口附近或地壳的岩层里C.单质硫既有氧化性,又有还原性D.硫在过量纯氧中的燃烧产物是三氧化硫D[S的燃烧产物是SO2,与O2的量无关。
]2.下列物质在一定条件下能够与硫黄发生反应,且硫作还原剂的是( )A.O2 B.Fe C.H2D.Zn[答案] A3.常温下单质硫主要以S8形式存在。
加热时,S8会转化为S6、S4、S2等。
当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。
下列说法中正确的是( ) A.S8转化为S6、S4、S2属于物理变化B.不论哪种硫分子,完全燃烧时都生成二氧化硫C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质D.把硫单质在空气中加热到750 ℃即得S2B[A项,S单质间转化为化学变化;C项,S2、S4、S6、S8为不同单质;D项,S在空气中加热时燃烧生成SO2。
]4.下列关于物质性质与应用的说法正确的是 ( )A.二氧化碳有氧化性,在点燃条件下能将碳氧化B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用C.二氧化硫具有还原性,可使高锰酸钾溶液褪色D.二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂C[A项,CO2与C反应条件是高温加热,不是点燃;B项,SO2有毒,在食品加工中不能大量使用;D项,MnO2作H2O2分解的催化剂。
]5.下列五种有色溶液与SO2作用,均能褪色,其实质相同的是 ( )①品红溶液②酸性KMnO4溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉碘溶液A.①④B.①②③C.②③④D.②③⑤D[①体现SO2的漂白性,②③⑤体现SO2的还原性,④体现SO2酸性氧化物的性质。
] 6.银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪,其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫黄熔化并燃烧,两天左右雪耳就制成了。
高中化学第四章非金属及其化合物4.3硫和氮的氧化物课时作业1新人教版必修1

4.3.1硫和硫的氧化物1.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是( )A.S B.Na2S C.SO2 D.H2SO42.(2016·淄博高一检测)下列说法不正确的是( )A.从性质的角度分类,SO2属于酸性氧化物B.从元素化合价的角度分类,SO2既可作氧化剂又可作还原剂C.从在水中是否发生电离的角度分类,SO2属于电解质D.从对大气及环境影响的角度分类,SO2是一种大气污染物3.下列对SO2和SO3的叙述正确的是( )A.标准状况下,都是无色气体,都易溶于水B.都是酸性氧化物,其水溶液都是强酸C.都可使品红溶液褪色,加热时红色又能再现D.都能跟碱液反应4.下列实验报告记录的实验现象正确的是( )5.下列离子方程式正确的是( )A.向NaOH溶液中通入少量SO2:SO2+OH-===HSO-3B.向氯水中通入少量SO2:Cl2+SO2+2H2O===4H++2Cl-+SO2-4C.将SO2通入到饱和NaHCO3溶液中:2H++CO2-3===H2O+CO2↑D.将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+===BaSO3↓+2H+6.(2016·石家庄高一检测)下列溶液:①石灰水,②H2S溶液,③KMnO4溶液,④氯水,⑤品红溶液。
能够区别SO2和CO2气体的是( )A.①②③B.②③④C.②③④⑤D.全部7.下列说法正确的是( )A.SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂B.活性炭、胶体、H2O2、O3等都有漂白性C.次氯酸盐只有在酸性环境中才有漂白性D.Na2O2也有漂白性,其漂白原理和SO2相似8.CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )A.(1)NaOH (2)浓H2SO4B.(1)浓H2SO4(2)NaOHC.(1)饱和NaHCO3(2)浓H2SO4D.(1)浓H2SO4(2)Na2CO39.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
【K12小初高学习】人教版高中化学必修一课时作业:4-3-1硫的氧化物含解析

课时作业23硫的氧化物时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.下列说法正确的是()A.SO2能使FeCl3、KMnO4水溶液颜色变化B.可以用澄清石灰水鉴别SO2和CO2C.硫粉在过量的纯氧中燃烧可以生成SO3D.少量SO2通过浓的CaCl2溶液能生成白色沉淀解析:SO2中硫为+4价,具有较强还原性。
在水溶液中,SO2可以将氧化剂FeCl3、KMnO4等迅速还原而使溶液颜色变化;SO2通入澄清石灰水跟CO2通入澄清石灰水反应现象类似;通常情况下,SO2很难被氧气氧化,只有在一定温度和催化剂存在的条件下才反应生成SO3,且是可逆反应;SO2的水化物是H2SO3,H2SO3的酸性比盐酸弱,不能生成白色沉淀。
答案:A2.下列说法不正确的是()A.由于地壳的岩层里含硫及其化合物,因此火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体C.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3 D.硫是一种淡黄色晶体,不溶于水,微溶于酒精解析:SO2转化成SO3的条件是催化剂、加热,而S在氧气中燃烧只能生成SO2,不具备SO2转化成SO3的条件。
答案:C3.能与SO2气体发生反应,但无沉淀产生的是()①溴水②Ba(OH)2溶液③石灰水④Na2CO3⑤稀H2SO4⑥Na2SO3A.只有①B.①③④C.④⑤⑥D.①④⑥解析:有关反应为:①SO2+Br2+2H2O===H2SO4+2HBr(无沉淀生成);②SO2+Ba(OH)2===BaSO3↓+H2O(有沉淀生成);③SO2+Ca(OH)2===CaSO3↓+H2O(有沉淀生成);④SO2+Na2CO3===Na2SO3+CO2(无沉淀生成);⑤SO2与稀H2SO4不反应;⑥SO2+Na2SO3+H2O===2NaHSO3(无沉淀生成)。
对照题意,符合条件的有①④⑥。
答案:D4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是()①饱和Na2CO3溶液②饱和NaHCO3溶液③浓H2SO4溶液④灼热的铜网⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④答案:D5.如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时作业23 硫的氧化物时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.下列说法正确的是( )A.SO2能使FeCl3、KMnO4水溶液颜色变化B.可以用澄清石灰水鉴别SO2和CO2C.硫粉在过量的纯氧中燃烧可以生成SO3D.少量SO2通过浓的CaCl2溶液能生成白色沉淀解析:SO2中硫为+4价,具有较强还原性。
在水溶液中,SO2可以将氧化剂FeCl3、KMnO4等迅速还原而使溶液颜色变化;SO2通入澄清石灰水跟CO2通入澄清石灰水反应现象类似;通常情况下,SO2很难被氧气氧化,只有在一定温度和催化剂存在的条件下才反应生成SO3,且是可逆反应;SO2的水化物是H2SO3,H2SO3的酸性比盐酸弱,不能生成白色沉淀。
答案:A2.下列说法不正确的是( )A.由于地壳的岩层里含硫及其化合物,因此火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体C.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3D.硫是一种淡黄色晶体,不溶于水,微溶于酒精解析:SO2转化成SO3的条件是催化剂、加热,而S在氧气中燃烧只能生成SO2,不具备SO2转化成SO3的条件。
答案:C3.能与SO2气体发生反应,但无沉淀产生的是( )①溴水②Ba(OH)2溶液③石灰水④Na2CO3⑤稀H2SO4⑥Na2SO3A.只有① B.①③④C.④⑤⑥ D.①④⑥解析:有关反应为:①SO2+Br2+2H2O===H2SO4+2HBr(无沉淀生成);②SO2+Ba(OH)2===BaSO3↓+H2O(有沉淀生成);③SO2+Ca(OH)2===CaSO3↓+H2O(有沉淀生成);④SO2+Na2CO3===Na2SO3+CO2(无沉淀生成);⑤SO2与稀H2SO4不反应;⑥SO2+Na2SO3+H2O===2NaHSO3(无沉淀生成)。
对照题意,符合条件的有①④⑥。
答案:D4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )①饱和Na2CO3溶液②饱和NaHCO3溶液③浓H2SO4溶液④灼热的铜网⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④答案:D5.如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
则下列有关说法正确的是( )A.湿润的蓝色石蕊试纸先变红后褪色B.湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性C.湿润的碘化钾淀粉试纸变蓝说明SO2将I-还原为I2D.实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染解析:吸入的浓硫酸与Na2SO3反应,生成SO2气体。
A项中,SO2为酸性气体,能使湿润蓝色石蕊试纸变红,但SO2不能漂白酸碱指示剂,错误;B项中,SO2的漂白性使品红褪色,SO2的还原性能使KMnO4酸性溶液褪色,错误。
C项中,I-转化成I2是氧化过程,不是还原过程,说法错误。
答案:D6.往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。
下列说法正确的是( )A.该实验表明FeCl3有还原性B.白色沉淀为BaSO3C.该实验表明SO2有漂白性D.反应后溶液酸性增强解析:该实验表明FeCl3有氧化性;上述过程发生了氧化还原反应:2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+和复分解反应:SO2-4+Ba2+===BaSO4↓,白色沉淀为BaSO4;反应后有盐酸生成,溶液酸性增强。
答案:D7.下列说法正确的是( )A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好解析:本题是对漂白性物质的漂白原理的综合考查。
A项中,SO2使溴水、KMnO4(H+)褪色是因为SO2具有还原性,能使品红褪色是漂白性,SO2不能使指示剂褪色;能使品红褪色的物质很多,不仅仅是SO2;C项的这些漂白剂的漂白原理不都相同;SO2和Cl2等物质的量混合后在溶液中发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
答案:B8.下列有关硫的化合物说法正确的是( )A.向品红、酸性高锰酸钾溶液中通入SO2都会褪色,证明了SO2具有漂白性B.SO2、Cl2都具有漂白性,但若把两种气体按11混合,其漂白性很差C.把SO2通入含有酚酞的NaOH溶液中,红色褪去,原因是SO2具有漂白性D.某气体能使品红褪色,该气体是SO2解析:SO2使品红褪色是因为SO2的漂白性,但是使酸性高锰酸钾溶液褪色是因为SO2具有还原性,能和具有强氧化性的酸性高锰酸钾发生氧化还原反应导致其褪色,而由于SO2是加合型漂白剂,故不能漂白酸碱指示剂。
答案:B9.将SO2通入BaCl2溶液至饱和未见沉淀生成,继续通入某种气体仍无沉淀生成,则该气体可能是( )A.CO2B.NH3C.Cl2D.H2S解析:向所得溶液中通入某种气体产生沉淀可能有如下几种情况:碱性气体、氧化性气体、还原性气体(如H2S)。
答案:A10.下列有关SO2气体的实验现象中不正确的是( )A.装满SO2气体的试管倒立在滴有紫色石蕊的水槽中,进入试管的液体呈红色B.将SO2气体通入装有品红溶液的试管里,红色逐渐褪去,给试管加热无明显变化C.打开盛有SO2气体的集气瓶口的玻璃片,可闻到刺激性气味D.将SO2气体通入装有溴水溶液的试管里,橙红色逐渐褪去解析:SO2气体使品红褪色,加热后颜色又恢复。
答案:B11.已知①2H2S+SO2===3S↓+2H2O②S+2H2SO4(浓)===3SO2↑+2H2O③3S+6KOH===2K2S+K2SO3+3H2O。
则下列说法正确的是( )A.①说明SO2能与酸反应,故SO2具有碱性氧化物的通性B.②若改用稀硫酸,则放出H2C.②和③说明硫具有两性元素的性质D.上述反应说明硫既有氧化性又有还原性解析:①反应为氧化还原反应,SO2表现氧化性,A错;S能与浓硫酸反应,但不能与稀硫酸反应,B错;单质硫既可以发生氧化反应使化合价升高,也可以发生还原反应使化合价降低,即硫处于中间价态,既有氧化性又有还原性,C错。
答案:D12.强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4△,Fe2O3+SO2↑+SO3↑。
如果将生成的气体通入浓BaCl2溶液中,产生的现象是( )A.生成BaSO4和BaSO3混合沉淀B.生成BaSO4沉淀,有SO2气体逸出C.生成BaSO4沉淀,有SO3气体逸出D.有SO2和SO3两种气体同时逸出答案:B二、非选择题(共52分)13.(10分)向BaCl2溶液中通入SO2后,将溶液分置于两支试管中。
向一份中加入NaOH 溶液,出现白色沉淀A;另一份通入少量Cl2,产生白色沉淀B。
试回答下列问题:(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”。
此处应为________,原因是__________________________________。
(2)沉淀A的化学式为________,该沉淀能否溶于稀盐酸?________。
(3)写出生成沉淀B的离子方程式:__________________________________________________。
(4)生成2.33 g沉淀B,需要消耗标准状况下的Cl2________mL。
解析:加入NaOH溶液发生的反应为Ba2++SO2+2OH-===BsSO3↓+H2O;①通入Cl2发生的反应为Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+。
②由方程式②:BaSO4~Cl2233 g 22 400 mL2.33 g V(Cl2)故V(Cl2)=224 mL。
答案:(1)不反应弱酸不能制强酸(2)BaSO3能(3)Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+(4)22414.(10分)有一瓶无色气体,可能含有CO2、HBr、SO2、Cl2中的一种或几种。
将其通入稀氯水中得到无色透明溶液,将溶液分成两份,向其中一份加入用稀HNO3酸酸化的AgNO3溶液,生成白色沉淀;向另一份中加入用稀盐酸酸化的BaCl2溶液,也生成白色沉淀。
(1)原气体中肯定含有______________________,可能含有____________________。
(2)对可能含有的成分的确定,有以下几种实验方案,合理的是________。
A.过量酸性KMnO4溶液→澄清石灰水B.品红试液→澄清石灰水C.过量酸性KMnO4溶液→品红溶液→澄清石灰水你所选的方案中各试剂的作用是__________。
解析:(1)因是无色气体,故先排除有颜色的气体Cl2;又由于将其通入稀氯水中得无色透明溶液,故与之能反应的HBr不符合此条件。
而将溶液分两份,一份可与稀HNO3酸化的AgNO3溶液反应生成白色沉淀,证明是AgCl白色沉淀;另一份与稀盐酸酸化的BaCl2溶液反应也生成白色沉淀,证明是BaSO4白色沉淀。
所以原混合气体中肯定有SO2,发生的反应为SO2+Cl2+2H2O===H2SO4+2HCl,而CO2的有无不能确定。
(2)SO2与CO2的某些性质较相似,例如都能使澄清石灰水变浑浊,且生成的沉淀均能溶于酸,但SO2具有还原性,能被强氧化剂氧化,且SO2可使品红溶液褪色,而CO2不具备这些性质,所以可利用这些差异性鉴别CO2的存在与否。
答案:(1)SO2CO2(2)C 用酸性KMnO4溶液除去SO2,用品红溶液验证SO2是否被除尽,用澄清石灰水验证CO2是否存在15.(10分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
(已知:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O)请回答下列问题:(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。
(2)反应后,装置B中发生的现象是________________________________,反应的离子方程式为__________________________;装置C中的现象是____________________,表现了SO2的________;装置D中现象是____________________________________,发生反应的化学方程式为________________________。
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象______________________。
