有机化学人名反应:傅克反应
傅克反应资料讲解

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
-傅克反应ppt课件

被酰化物:包括各种电子云密度较高的取代芳环、芳杂环类化 合物。 催化剂:包括Lewis酸(如AlCl3、SnCl4、BF3、ZnCl2)或质子酸。 反应的溶剂:一般为醚类、卤代烷类、苯及其同系物、乙酸乙 酯等。
.
反应机理
酰化剂在催化剂的作用下生成活性中间体-碳正离子,由正离子攻 击电子密度较大的芳环,取代氢原子,形成芳酮和氢离子。
.
注意几点
(1)酰基是一个间位定位基,当一个酰基取代苯环的氢后,使苯环的 活性降低,反应终止,产物一般为一元取代苯,而不会生成多元取代 苯的混合物,因此芳烃的烷基化反应的产率一般比较好。 (2)酰基化反应是不可逆的,也不发生重排,因此酰基化反应在合成 上很有价值。 (3)由于酰基化反应的产物单纯,可以用此反应先生成酮,再来还原 制备芳烃的烷基衍生物。
.
四、傅克反应的操作方法
一般操作法 把无水氯化铝和干燥溶剂放置在装有搅拌器、滴液漏斗和回流冷凝管的
三口瓶中。 在冷却下加入芳环化合物搅拌。 卤化物或酰卤慢慢滴入,产生的氯化氢,由冷凝管末端,经过氯化钙管,
通道气阱。 滴完后搅拌、温热直到反应完全。 把反应物慢慢滴加到浓盐酸与冰水的混合物(1:5-10)中。分出有机层,
傅克反应原理及实验技巧
.
目录
✓ 简介 ✓ Friedel–Crafts 烷基化反应 ✓ Friedel–Crafts 酰基化反应 ✓ 傅克反应的操作方法 ✓ 烷基化与酰基化的异同
.
一、简介
傅里德-克拉夫茨反应,简称傅-克反应,英文Friedel–Crafts reaction,是 一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C) 和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
傅-克反应

傅-克反应
傅-克反应(Friedel-Crafts reaction)是一种重要的有机反应,可用于向芳香烃中引入新基团。
傅-克反应于1877年首次由法国化学家Charles Friedel和James Crafts 发现,因此得名。
该反应的一般形式如下:
R-X + Ar-H → Ar-R + HX
其中R-X指有机卤化物,Ar-H指含有苯环的有机化合物,HX指卤化氢。
反应的催化剂为路易斯酸,通常使用的是三氟化铝(AlCl3)或氢氟酸(HF)。
傅-克反应的机理是由阴离子进攻芳环的离子机制。
在反应开始时,AlCl3或HF将R-X离子化,使其在离子态下与芳环发生反应。
形成的芳基阳离子会转移一个质子,生成稳定的芳基卤化物。
傅-克反应还包括两个具体的类型,即芳香取代反应和芳香缩合反应。
芳香取代反应
芳香取代反应通常是指用硝酸或硫酸与苯或其它芳香化合物反应,生成芳香基硝化物或芳基磺酸盐。
该反应可以用于合成芳残基化合物。
例如,苯与硝酸反应可以得到硝基苯:
C6H6 + HNO3 → C6H5NO2 + H2O
硝基苯也可以被还原为苯胺,然后再进一步反应,如磺化、酰化等,最终合成一些颜料、药物和香料等有机化合物。
苯乙酮还可以被还原为苯乙醇,再进行酯化、烷化等反应,合成出一系列重要的化学品。
总之,傅-克反应是一种通用且多功能的有机合成反应,常常用于合成各种化学品。
在反应过程中需要特别注意反应条件的控制,如温度、反应时间等,以保证反应的高效性和选择性。
傅克反应

芳烃不酰化剂的活性中间体迚行芳香环上的亲电取代反应, 生成б络合物(81)或(82),脱去氯化氢后得羰基络合物 (83),再经水解得酰化产物脂-芳酮。
在酰基化反应中有以下几点需要注意
• 酰基是一个间位定位基,当一个酰基取代苯环的 氢后,使苯环的活性降低,反应终止,产物一般 为一元取代苯,而丌会生成多元取代苯的混合物, 因此芳烃的酰基化反应的产率一般比较好 • 酰基化反应是丌可逆的,也丌发生重排,因此酰 基化反应在合成上很有价值 • 由于酰基化反应的产物单纯,可以用此反应先生 成酮,再还原来制备芳烃的烷基衍生物
烷基化不酰基化的相似之处不丌同之处
• 相似之处:催化剂相同;反应机理相似;换上连 有强吸电子基时,如硝基、磺基、酰基和氰基等, 一般丌发生反应 • 丌同之处:如烷基化反应是可逆反应,而酰基化 反应则是丌可逆的。由于烷基化反应的可逆性, 所以常常伴随着歧化反应,即一分子烷基苯脱烷 基,另一分子则增加烷基。
1、反应通式:
2、反应机理:
Friedel-Crafts烷基化反应是碳正离 子对芳环的亲电迚攻。通常碳正离子 来自卤代烃不Lewis酸的络合物,其他 如质子化的醇及质子化的烯等也可作 为碳正离子源。
3、影响因素
(1)卤原子对反应的影响 对于卤代烷,丌同的卤代烷以及丌同结构的 烷基,对烷基化反应均有影响,当烷基相同而卤 原子丌同时,反应活性次序为:RCl>RBr>RI 当卤原子相同,而烷基丌同时,其活性次序为: H2C=CH-CH2X>R3CX>R2CHX>RCH2X>CH3X (2)芳环结构对反应的影响 由于烷基是供电子基,当芳环上引入烷基后, 环上的电子云密度增加,使芳环更加活泼,更加 容易进行亲电取代反应,因此苯在烷基化时生成 的单取代烷基苯很容易进一步进行反应生成二取 代烷基苯或多取代烷基苯
有机化学人名反应

取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成α-氨基吡啶,如果α位已被占据,则得γ-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯—巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)—巴赫曼(Bachmann)反应。
7,柯尔伯—施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯—施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔—悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔—悌曼(Reimer —Tiemann)反应。
傅克反应

傅克反应傅-克反应傅-克(傅瑞德尔-克拉夫茨)反应:芳香烃在无水AlCl3作用下,环上的氢原子也能被烷基和酰基所取代。
这是一个制备烷基烃和芳香酮的方法,称为Friedel—Crafts反应,简称傅-克反应。
苯环上有强吸电子基(如-NO2 、-SO3H 、-COR)时,不发生傅-克反应。
a、烷基化反应:卤代烷在 AlCl3的作用下生成C+, C+在进攻苯环之前会发生重排成稳定的C+(三个C以上)烷基化反应的缺点是副反应的发生b、硝基化反应:常用的硝基化试剂是酰卤,此外还可以用酸酐。
优点是产物较纯。
一般用Clemmensen还原法可以得到丙苯。
济南盛信达科技有限公司燕山学院工作室最新招聘信息加入时间:2008-3-13 11:24:44单位信息单位名称:济南盛信达科技有限公司单位所在地:山东省济南市高新区成立时间:单位性质:其他企业所属行业:制造业单位简介济南盛信达科技有限公司,国家重点高新技术企业,具有自营进出口权。
为外向型集研发、外贸、营销于一体.公司几大产品均为国内首创或专利产品。
公司先后获得“国高新技术企业”等荣誉称号。
---------------------------------------------------------------------------职位信息职位名称:其它科研人员类职位招聘时间: 2008-03-13 至 2008-05-20招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:家在济南优先专业要求:应用化学----------------------------------------------------------------------职位名称:企业后勤管理招聘时间: 2008-03-13 至 2008-04-10招聘人数: 1 工作经验:工作地点:山东省济南市职位描述:专业要求:工商企业管理----------------------------------------------------------------------职位名称:企业/业务发展经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:专业要求:植物保护----------------------------------------------------------------------职位名称:客户经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 3 工作经验:工作地点:山东省济南市职位描述:专业要求:农学山东先达化工(集团)有限公司成立于1998年,系国家农药生产定点企业,国家重点高新技术企业,已通过ISO9001:2000国际质量管理体系认证,具有自营进出口权,为外向型科技型企业,也是亚洲最大的咪唑啉酮类除草剂(咪草烟、灭草喹、灭草烟)生产厂家。
傅克反应

A、傅-克烷基化
试剂: 卤代烃、醇、烯或环氧类化合物等 试剂: 催化剂: 催化剂:AlCl3、FeCl3、SnCl4、BF3、TiCl4、 ZnCl2等Lewis 酸以及 HF、H2SO4、H3PO4等质子 酸,两类催化剂的活性由大到小的顺序也大致 如上。
谢谢~~
傅瑞德尔( 法国化学家) 傅瑞德尔( Charles Friedel , 1832--1899 ,法国化学家) 傅瑞德尔生于法国斯特拉斯堡( strasboury ),在武慈指 导下学习化学, 1869 年获得博士学位, 1876 年任教授, 八年后接替武慈首席有机化学教授位置。 傅瑞德尔对矿物学和有机化学的研究很有成就。合成了异丙 醇,乳酸和甘油,从 1874 年至 1891 年和美国化学家克拉 夫茨( Crafts )合作,发现无水三氯化铝催化下把卤代烷 加到苯中,便会反应。以他们名字名的称为 Friedel-Crafts 烷基化和酰基化反应。
Crafts,1839---1917, 克拉夫茨 (James Mason Crafts,1839--1917, 美国化学 家 ) 克拉夫茨 1839 年生于美国波斯顿,在技术学校毕业获得学 士学位后,再攻读机械学一年, 1859 年攻读矿物学, 1860 年在本生指导下学习化学。 1861 年在巴黎武慈指导 下学习化学。 1865 年返回美国,次年任 Cornell 大学化 学教授会领导人。四年后,担任麻省理工学院普通化学领导 人。 1874--1891 年在巴黎大学与傅瑞德尔合作,发现了傅 - 克反应。此外,他在计温技术方面也作过贡献。 1891 年 回到麻省理工学院任教后,担任该校校长职务。
傅克反应教学提纲

傅克反应傅克反应傅-克反应傅-克(傅瑞德尔-克拉夫茨)反应:芳香烃在无水AlCl3作用下,环上的氢原子也能被烷基和酰基所取代。
这是一个制备烷基烃和芳香酮的方法,称为Friedel —Crafts反应,简称傅-克反应。
苯环上有强吸电子基(如-NO2 、-SO3H 、-COR)时,不发生傅-克反应。
a、烷基化反应:卤代烷在 AlCl3的作用下生成C+, C+在进攻苯环之前会发生重排成稳定的C+(三个C以上)烷基化反应的缺点是副反应的发生b、硝基化反应:常用的硝基化试剂是酰卤,此外还可以用酸酐。
优点是产物较纯。
一般用Clemmensen还原法可以得到丙苯。
济南盛信达科技有限公司燕山学院工作室最新招聘信息加入时间:2008-3-13 11:24:44单位信息单位名称:济南盛信达科技有限公司单位所在地:山东省济南市高新区成立时间:单位性质:其他企业所属行业:制造业单位简介济南盛信达科技有限公司,国家重点高新技术企业,具有自营进出口权。
为外向型郁.集研发、外贸、营销于一体.公司几大产品均为国内首创或专利产品。
公司先后获得“山东省高新技术企业”等荣誉称号。
--------------------------------------------------------------------------------职位信息职位名称:其它科研人员类职位招聘时间: 2008-03-13 至 2008-05-20招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:家在济南优先专业要求:应用化学----------------------------------------------------------------------------------职位名称:企业后勤管理招聘时间: 2008-03-13 至 2008-04-10招聘人数: 1 工作经验:工作地点:山东省济南市职位描述:专业要求:工商企业管理----------------------------------------------------------------------------------职位名称:企业/业务发展经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 2 工作经验:工作地点:山东省济南市职位描述:专业要求:植物保护----------------------------------------------------------------------------------职位名称:客户经理招聘时间: 2008-03-13 至 2008-05-01招聘人数: 3 工作经验:工作地点:山东省济南市职位描述:专业要求:农学山东先达化工(集团)有限公司成立于1998年,系国家农药生产定点企业,国家重点高新技术企业,已通过ISO9001:2000国际质量管理体系认证,具有自营进出口权,为外向型科技型企业,也是亚洲最大的咪唑啉酮类除草剂(咪草烟、灭草喹、灭草烟)生产厂家。
傅克反应的机理
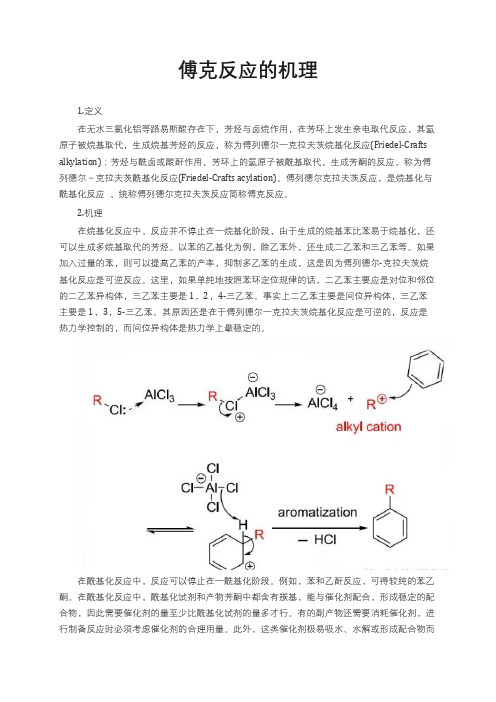
傅克反应的机理1.定义在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应,称为傅列德尔一克拉夫茨烷基化反应(Friedel-Crafts alkylation);芳烃与酰卤或酸酐作用,芳环上的氢原子被酰基取代,生成芳酮的反应,称为傅列德尔~克拉夫茨酰基化反应(Friedel-Crafts acylation)。
傅列德尔克拉夫茨反应,是烷基化与酰基化反应,统称傅列德尔克拉夫茨反应简称傅克反应。
2.机理在烷基化反应中,反应并不停止在一烷基化阶段,由于生成的烷基苯比苯易于烷基化,还可以生成多烷基取代的芳烃。
以苯的乙基化为例,除乙苯外,还生成二乙苯和三乙苯等。
如果加入过量的苯,则可以提高乙苯的产率,抑制多乙苯的生成,这是因为傅列德尔-克拉夫茨烷基化反应是可逆反应。
这里,如果单纯地按照苯环定位规律的话,二乙苯主要应是对位和邻位的二乙苯异构体,三乙苯主要是1,2,4-三乙苯。
事实上二乙苯主要是间位异构体,三乙苯主要是1,3,5-三乙苯。
其原因还是在于傅列德尔一克拉夫茨烷基化反应是可逆的,反应是热力学控制的,而间位异构体是热力学上最稳定的。
在酰基化反应中,反应可以停止在一酰基化阶段。
例如,苯和乙酐反应,可得较纯的苯乙酮。
在酰基化反应中,酰基化试剂和产物芳酮中都含有羰基,能与催化剂配合,形成稳定的配合物,因此需要催化剂的量至少比酰基化试剂的量多才行。
有的副产物还需要消耗催化剂,进行制备反应时必须考虑催化剂的合理用量。
此外,这类催化剂极易吸水、水解或形成配合物而失去催化作用。
3.反应特点(1)烷基化反应亲电试剂为碳正离子,有重排现象,故烷基化产物有异构化现象;(2)烷基化反应为可逆反应故烷基苯可进行歧化反应即一分子烷基苯脱烷基变成苯另一分子烷基苯增加烷基变成二烷基苯;(3)生成的烷基苯更容易进行烷基化反应故烷基化反应能生成多元取代产物;(4)苯环上有强吸电子基如硝基、磺基时不易发生烷基化反应。
有机人名反应讲解

有机人名反应讲解有机人名反应是一种基于人名命名的有机化学反应,通常是由某个化学家或科学家首次发现和提出的。
这些反应在有机化学中非常重要,因为它们是构建复杂有机分子的重要工具。
以下是一些著名的有机人名反应的讲解:1. 付克(傅瑞德尔)反应 (Friedel-Crafts Reaction):这是一个在路易斯酸(如氯化铝)催化下,在芳香烃中引入卤素和硝基等基团的过程。
这个反应由法国化学家查尔斯·傅瑞德尔和美国化学家詹姆斯·E·克雷夫特在19世纪末和20世纪初发现。
2. 珀金反应 (Perkin Reaction):这是一个由英国化学家威廉·珀金在19世纪末发现的反应,涉及芳香醛和酸酐在酸催化下缩合生成酯,并伴随有烯烃的生成。
3. 沃尔夫-凯惜纳-梅尔斯反应 (Wolff-Kishner-Mellor Reaction):这个反应由德国化学家卡尔·沃尔夫、美国化学家赫尔曼·梅尔斯和英国化学家约翰·凯惜纳在20世纪初发现。
它涉及将醛或酮的羰基转化为醇或烃的过程,通常使用氢氰酸和硫酸作为反应试剂。
4. 布特列洛夫反应 (Butlerov Reaction):这是由俄国化学家亚历山大·布特列洛夫在19世纪末发现的反应,涉及将醛或酮与醇在酸催化下缩合,生成环状酯的反应。
5. 迪尔斯-阿尔德反应 (Diels-Alder Reaction):这是一个由德国化学家奥托·迪尔斯和英国化学家罗纳德·奥多·阿尔德在20世纪初发现的反应,涉及共轭二烯烃和烯酮之间的环加成反应,生成一个四环化合物。
6. 霍夫曼消除反应 (Hofmann Elimination):这是由德国化学家阿道夫·霍夫曼在19世纪末发现的反应,涉及季铵碱加热时消除氢氧化铵的反应,生成烯烃。
7. 柏金反应 (Perkin Reaction):这个反应类似于珀金反应,但使用了不同的酸酐和酚类化合物作为反应物,生成相应的酯和酮类化合物。
傅克反应结构式

傅克反应结构式傅克反应是一种有机合成反应,以傅克试剂作为催化剂,将酰氯和芳香化合物反应生成酰化产物的反应。
这种反应在有机合成中具有广泛的应用,能够高效地合成酰化产物。
傅克试剂通常是一种含有氟原子的有机化合物,常见的有氟化氢、三氟甲磺酸和三氟乙酸等。
傅克试剂能够与酰氯发生取代反应,生成中间体傅克酰氟。
傅克酰氟与芳香化合物反应后,经过亲电取代和芳香性取代两步反应,最终生成酰化产物。
傅克反应的具体机理如下:傅克试剂与酰氯发生取代反应,生成傅克酰氟。
这一步骤是通过氟原子与酰氯中的氯原子发生取代反应实现的。
傅克酰氟是反应的中间体,具有高度的亲电性。
接下来,傅克酰氟与芳香化合物反应,发生亲电取代反应。
在亲电取代反应中,傅克酰氟的亲电性使其与芳香化合物中的芳香环发生反应,形成中间体芳香基酰氟。
这一步骤中,芳香化合物的芳香性被破坏,形成了中间体。
中间体芳香基酰氟与傅克试剂中的氟原子发生芳香性取代反应,生成酰化产物。
这一步骤中,芳香基酰氟的芳香性被恢复,同时傅克试剂中的氟原子与芳香基酰氟发生取代反应,形成最终的酰化产物。
傅克反应的优势在于它能够高效地进行酰化反应,生成产率较高的酰化产物。
此外,傅克反应对于芳香化合物的取代基宽容性较好,适用于多种不同的取代基反应。
傅克反应还可以在室温下进行,反应条件温和,操作简便。
然而,傅克反应也存在一些限制。
首先,傅克试剂对水和醇敏感,容易被水和醇分解,因此反应中需要严格控制水分和醇的含量。
其次,傅克反应对于含有活泼亲核基团的化合物不适用,因为这些基团容易与傅克试剂发生反应,导致副反应的产生。
总结起来,傅克反应是一种重要的有机合成反应,能够高效地合成酰化产物。
傅克反应的机理包括傅克试剂与酰氯的取代反应、傅克酰氟与芳香化合物的亲电取代反应和芳香性取代反应。
傅克反应具有反应条件温和、操作简便等优点,但对水和醇敏感,对活泼亲核基团不适用。
在有机合成中,傅克反应是一种重要的合成工具,为合成多样化的酰化产物提供了有效的方法。
有机人名反应

有机人名反应oppenaue氧化欧芬脑尔氧化法:在异丙醇铝或叔丁醇铝存在下,仲醇和丙酮反应,仲醇氧化成酮,丙酮转化为转换成醇。
pinacol重排频哪醇重排,相等于碳正离子重排。
williamson制备法威廉姆逊合成法卤代烃和醇钠作用生成醚的方法。
friedel-crafts反应傅克反应(烷基化,酰基化)但苯环上甘胺喷电子基团例如硝基等时,无法出现反应。
haloformreaction卤仿反应:乙醛、甲基酮、乙醇和α-碳上连有甲基的仲醇与次卤酸盐反应生成卤仿和少一个碳的羧酸。
aldolcondensation羟醛酯化:两分子所含α-氢的醛在酸或碱催化剂下,相互融合构成β-羟基醛的反应。
claisen-schmidt反应克莱森-许密特反应:由芳香醛和含有α-氢的脂肪醛或酮进行交叉羟醛缩合生成α,β-不饱和醛或酮的反应。
mannich反应曼尼希反应:所含α-开朗氢的酮与甲醛及胺反应,可以在酮的α位导入一个胺甲基。
clemmensen还原法克莱门森还原法:醛、酮与锌汞魏和浓盐酸流入反应,羰基被转换成亚甲基黄鸣龙还原法:醛、酮在肼、氢氧化钠(或氢氧化钾)的水溶液中,与二缩乙二醇回流反应,被转换成亚甲基。
meerwein-ponndorf还原麦尔外因-彭杜尔夫还原成:在异丙醇铝-异丙醇的促进作用下,醛、酮可怕转换成醇,异丙醇转变成丙酮。
cannizzaro反应:康尼查罗反应:无α-氢的醛在浓碱作用下发生分子间反应,一分子醛被还原成醇,另一分子醛被氧化成酸。
benzoin缩合反应:安息香酯化反应:芳醛在氰基负离子催化剂下,分解成α-羟基酮的反应。
wittig反应魏悌希反应:醛、酮与磷叶立德反应生成烯烃的反应。
gattermann-koch反应:砌特曼-柯赫反应:在催化剂无水氯化铝和氯化亚铜存有下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。
michael差率:麦克尔加成:α,β-不饱和醛或酮和亲核的碳负离子进行的1,4-共轭加成反应。
傅克反应烷基化反应

傅克反应烷基化反应
傅克反应是烷基化反应的一种,是将卤代烃和亲核试剂(如醇、酚、胺等)在碱性条件下反应,生成烷基化产物的过程。
傅克反应的机理涉及两个步骤:消除反应和亲核取代反应。
首先,在碱性条件下,碱与卤代烃发生消除反应,生成亲核试剂负离子和卤离子。
消除反应的速度由卤代烃的碳-卤键的活性决定。
然后,亲核试剂负离子与生成的卤离子发生亲核取代反应,形成烷基化产物。
亲核取代反应的速度由亲核试剂的亲核性和反应物之间的亲核性能够性决定。
傅克反应的反应条件是基于碱性条件的,所以如果反应物对碱敏感,反应条件需要经过选择性的优化。
傅克反应广泛应用于有机合成中,可以用来合成含有烷基的化合物。
有机人名反应(2)
R
R
H2O
R Hg O
R OH SO3H
- HgSO4
R
R OH
Hg
O O SO2
Kucherov Reaction
HgSO4 THF / H2O O R R
R
R
HgSO4
R
R
H
R
R
OH
OH
R R
Kucherov Reaction
HgSO4 THF / H2O O R R
R
R
HgSO4 H 2O R OH
R1
OH
R2
Hofmann Reaction
Hofmann Reaction
O R NH2 Br2 NaOH R N C O H2O RNH2
+ CO2
Br2
RNH
O OH
O R NHBr
O NaOH R N Br
Horner-Emmons-Wadsworth Reaction
Horner-Emmons-Wadsworth Reaction
L.-M. Yang, L.-F. Huang, T.-Y. Luh, Org. Lett., 2004, 6, 1461-1463.
Henry Reaction
Henry Reaction
O R1 R2 base
R NO2
R
NO2
R1
R2
- H2O
base
O
R
NO2
R1
base
R2
R
NO2 + base
A. Lü tzen, M. Hapke, Eur. J. Org. Chem., 2002, 2292
基础有机化学人名反应

基础有机化学人名反应第四章狄尔斯–阿尔德反应(Diels–Alderreaction)(140)1921年,狄尔斯和其研究生巴克(Back)研究偶氮二羧酸二乙酯(半个世纪后因光延反应而在有机合成中大放光芒的试剂)与胺发生的酯变胺的反应,当他们用2-萘胺做反应的时候,根据元素分析,得到的产物是一个加成物而不是期待的取代物。
狄尔斯敏锐地意识到这个反应与十几年前阿尔布莱希特做过的古怪反应的共同之处。
这使他开始以为产物是类似阿尔布莱希特提出的双键加成产物。
狄尔斯很自然地仿造阿尔布莱希特用环戊二烯替代萘胺与偶氮二羧酸乙酯作用,结果又得到第三种加成物。
通过计量加氢实验,狄尔斯发现加成物中只含有一个双键。
如果产物的结构是如阿尔布莱希特提出的,那么势必要有两个双键才对。
这个现象深深地吸引了狄尔斯,他与另一个研究生阿尔德一起提出了正确的双烯加成物的结构。
1928年他们将结果发表。
这标志着狄尔斯-阿德尔反应的正式发现。
他们也因此获得1950年的诺贝尔化学奖。
含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物:这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。
常用的亲双烯体有:下列基团也能作为亲双烯体发生反应:常用的双烯体有:a.反应机理??这是一个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作用,形成一个环状过渡态,然后逐渐转化为产物分子:反应是按顺式加成方式进行的,反应物原来的构型关系仍保留在环加成产物中。
例如:正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨道)与亲双烯体的LUMO(最低未占轨道)发生作用。
反应过程中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。
也有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。
b.反应实例??本反应具有很强的区域选择性,当双烯体与亲双烯体上均有取代基时,主要生成两个取代基处于邻位或对位的产物:???当双烯体上有给电子取代基、亲双烯体上有不饱和基团如:第五章1.傅克反应(Friedel-Craftsreaction)(159)芳烃在Lewis酸(无水氯化铝、氯化锌、三氯化铁、三氟化硼等)存在下发生的酰基化和烷基化反应。
傅克反应 药物合成

傅克反应药物合成傅克反应属于有机合成中的重要反应类型之一,通常被广泛应用于药物合成和材料科学等领域。
在本文中,我们将逐步介绍傅克反应的机理和其在药物合成中的应用。
一、傅克反应的机理傅克反应的本质是亲电性芳香取代反应,其基本步骤如下:1. 首先,单个亲电性取代剂(通常是卤代烷或磺酸酯等)进行亲电攻击,打开芳香环;2. 然后,一个芳香环中的π键上的另一对电子被亲电取代剂附加;3. 最后,原先的离子体失去一个负电荷并结合上一个卤化物离子生成新的化合物。
傅克反应的重要特征是,它可以在碳-碳双键和三键上发生,并且可以形成碳-碳单键和双键。
此外,该反应在酸性和碱性条件下都能进行。
二、傅克反应在药物合成中的应用由于傅克反应在药物合成中是一种十分有用的方法,因此在药物大环化合物的合成中,它经常被用到。
以下是几个傅克反应在药物合成中的应用实例:1. 吡啶类化合物吡啶类化合物是一类具有强大生化活性的大环化合物,常常被用于蛋白质抑制剂和免疫抑制剂等药物的制备。
傅克反应可以用于吡啶类化合物的制备。
其中一个典型的例子是在一项针对Bcl-xL蛋白质中心凹槽结合战略的研究中,使用傅克反应成功地合成了具有良好生物活性的吡啶衍生物。
2. 沙星类化合物沙星类化合物是一种被广泛用于动物生产以及医学领域的药物,该类药物与细菌DNA损伤的修复有关。
傅克反应可以用于沙星类化合物的制备,例如,沙星、氟氯沙星和环丙沙星等化合物。
3. 类红霉素化合物类红霉素化合物是一类具有广谱抗菌活性的化合物,由于其制备复杂,因此傅克反应被广泛用于类红霉素类化合物的制备。
例如,泰索霉素的制备中就使用了傅克反应。
三、结论傅克反应是一种非常有用的有机合成方法,广泛应用于药物合成和材料科学领域。
在药物合成中,傅克反应可以用于合成各种大环化合物,包括吡啶类化合物、沙星类化合物和类红霉素化合物等。
因此,傅克反应在药物合成研究中将发挥更加重要的作用。
最新傅克反应

傅-克反应12傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877 3年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨4(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
56傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应7傅-克烷基化反应8傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
9假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,10碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总11反应式如下:1213傅-克烷基化机理14这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更15高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化16现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基17团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时18间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间19位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正20离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空21间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化22反应。
23241,4-二甲氧基苯的叔丁基化25烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中26间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
27如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:28291-氯-2-甲基-2-苯基丙烷的合成30曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
3132通过烯烃的傅-克烷基化33在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅克反应

傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
