第23届全国高中学生化学竞赛理论试题全
第23届全国高中学生化学竞赛理论试题
() a ● P r OP( OR) 2 () b ・O
() 1 2图的 R不 同 , R 为 C 和 C , 出 若 H。 2 写 H5
( ) b 的化学 式 。 a 和( )
锰和锌 的浸 出率 只有 ~8 , 0 为了提高 浸 出率 , 在实
际工 艺 中 , 将过 滤后 的滤 渣用 四氯 乙烷 处 理 后再 须
分 数 叫( O。 一0 2 l和 锌 精 矿 [ 量 分 数 Mn ) .o 质 (n ) .0 Z S 一O 7]的工艺方 法提取 锰和锌 获得成 功 , 对 资源 综合利 用 、 能减 排 和 清 洁生 产 都有 重 要 的实 节
际意 义 。已知 E ( e F )一O 7 ( e / e F。 e / . 7V, F
一
高 纯稀土 产 品 占世 界产 量 的 9 以上 。 0
2 目前在稀土分离工业中广泛应用国产萃 —1 取剂 P57 它的化 学 名 称 为 (一 基 己基 ) 酸 (一 一0 , 2乙 膦 2
乙基 己基 ) , 出其 化 学结 构 简 式 , 出萃 取 三价 酯 画 写 稀土 离子 的化 学 反 应 方 程 式 ( 萃取 剂 用 HA 表 示 ,
1 —1 锰 结核矿 和锌精 矿单 独酸浸 结果很 不理 想 。请 通过 热力学 计 算 , 明锰 结 核矿 和 锌 精矿 同 说
槽 酸 浸时发 生化学 反应 的可行 眭。 1 —2 模 拟实 验 发 现 , 氧化 锰 和硫 化 锌 同槽 二 酸浸 时反应 速率很 慢 , 在 酸溶 液 中加入 少 量 的铁 若 屑则 能明显使 反应 速率加 快 。写 出铁 进入溶 液后分 别与 二氧化 锰 和硫 化 锌 发 生 化 学 反 应 的离 子 方 程 式 , 简述反 应速率 加快 的原 因 。 并 1 —3 研 究发 现 , 2种矿 物 同槽 酸 浸 4小 时后 ,
中国化学会第23届全国高中生化学竞赛(省级赛区)试题及答案

1-1 Lewis 酸和Lewis 碱可以形成酸碱复合物。
根据下列两个反应式判断反应中所涉及Lewis酸的酸性强弱,并由强到弱排序。
F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ;F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1) 分别画出BF 3和N(CH 3)3的分子构型,指出中心原子的杂化轨道类型。
BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分)sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分)sp 3(0.5分)(2) 分别画出F 3B -N(CH 3)3 和F 4Si -N(CH 3)3的分子构型,并指出分子中Si 和B 的杂化轨道类型。
CH 3H 3C H 3CFB FF B :sp3 CH 3H 3CH 3C FFF FSi ,sp 3d将BCl 3分别通入吡啶和水中,会发生两种不同类型的反应。
写出这两种反应的化学方程式。
BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3BN(1分)1-4 BeCl 2是共价分子,可以以单体、二聚体和多聚体形式存在。
分别画出它们的结构简式,并指出Be 的杂化轨道类型。
Be Cl Cl sp 结构简式和杂化轨道各0.5分 (1分)BeClBeClClClsp 2结构简式1.5分Cl BeClCl BeClsp 3画成Cl BeCln 也得分1-5 高氧化态Cr 的过氧化物大多不稳定,容易分解,但Cr(O 2)2[NH(C 2H 4NH 2)2] 却是稳定的。
这种配合物仍保持Cr 的过氧化物的结构特点。
2023高中化学竞赛试卷

2023高中化学竞赛试卷一、选择题(每题3分,共30分)1. 下列物质在常温下为液态的是()A. 碘B. 镁C. 溴D. 碳。
2. 下列化学用语正确的是()A. 乙烯的结构简式:CH_2CH_2B. 氯离子的结构示意图:C. 质子数为6、中子数为8的碳原子:^14_6CD. 氯化氢的电子式:H^+[:Cl:]^-3. 设N_A为阿伏伽德罗常数的值。
下列说法正确的是()A. 1mol/L的NaCl溶液中含有的Na^+数目为N_AB. 标准状况下,22.4LH_2O含有的分子数为N_AC. 16gO_2和O_3的混合气体中含有的氧原子数为N_AD. 1molFe与足量的Cl_2反应,转移的电子数为2N_A4. 下列反应中,属于氧化还原反应的是()A. CaCO_3+2HCl = CaCl_2+H_2O + CO_2↑B. CaO + H_2O = Ca(OH)_2C. 2KMnO_4{}{===}K_2MnO_4+MnO_2+O_2↑D. Na_2CO_3+Ca(OH)_2=CaCO_3↓ + 2NaOH5. 下列关于元素周期表的说法正确的是()A. 元素周期表有7个周期,8个主族。
B. 同一周期从左到右,元素的金属性逐渐增强。
C. 同一主族从上到下,元素的原子半径逐渐减小。
D. 短周期元素是指第一、二、三周期的元素。
6. 下列离子方程式书写正确的是()A. 铁与稀硫酸反应:2Fe + 6H^+=2Fe^3 + +3H_2↑B. 碳酸钙与稀盐酸反应:CaCO_3+2H^+=Ca^2 + +H_2O + CO_2↑C. 氢氧化钡溶液与稀硫酸反应:Ba^2 + +OH^-+H^++SO_4^2 - =BaSO_4↓ +H_2OD. 铜与硝酸银溶液反应:Cu + Ag^+=Cu^2 + +Ag7. 下列物质的分类正确的是()A. SO_2、CO_2为酸性氧化物。
B. NaOH、KOH为弱碱。
C. HCl、H_2SO_4为非电解质。
2023年全国高中学生化学竞赛省级赛区试题

中国化学会2023年国初化竞试题(2023年10月13日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第1题(4分)今年5月底6月初,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。
据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。
根据你的化学知识作出如下判断(这一判断的对的性有待证明):当事人使用的液态洁污剂之一必然含氯,最也许的存在形式是和。
当另一种具有(性质)的液态洁污剂与之混合,也许发生如下反映而产生氯气:第2题(2分)目然界中,碳除了有2种稳定同位素12C和13C外,尚有一种半衰期很长的放射性同位素14C,丰度也十分稳定,如下表所示(注:数据后括号里的数字是最后一位或两位的精确度,14C只提供了大气丰度,地壳中的含量小于表中数据):试问:为什么通常碳的相对原子质量只是其稳定同位素的加权平均值而不将14C也加入取平均值?答:第3题(4分)最近报道在-100℃的低温下合成了化合物X,元素分析得出其分子式为C5H4,红外光谱和核磁共振表白其分子中的氢原子的化学环境没有区别,而碳的化学环境却有2种,并且,分子中既有C-C单键,又有C=C双键。
温度升高将迅速分解。
X的结构式是:第4题(10分)去年报道,在-55℃令XeF4(A)和C6F5BF2(B)化合,得一离子化合物(C),测得Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中有B的苯环。
C是首例有机氙(IV)化合物,-20℃以下稳定。
C为强氟化剂和强氧化剂,如与碘反映得到五氟化碘,放出氙,同时得到B。
第23届全国高中学生化学竞赛省级赛区模拟试题

第23届全国高中学生化学竞赛(省级赛区)模拟试题及答案和评分标准●竞赛时间3小时。
迟到超过半小时者不能进考场。
开场考试后1小时内不得离场。
时间到,把试卷(反面朝上)放在桌面上,马上起立撤离考场。
●试卷装订成册,不得拆散。
全部解答必需写在指定的方框内,不得用铅笔填写。
草稿纸在最终一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必需写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许运用非编程计算器以及直尺等文具。
第1题(4分)1. 很多放射性反响并非一次衰变就到达稳定,而是由于一次衰变得到的产物仍具有放射性而接二连三地衰变,直到稳定核素而终止,这就是级联衰变。
自然界存在4个级联衰变链,其中之一是由232Th经过屡次α和β衰变得到稳定的208Pb的链。
请答复:这个链中包含多少次α衰变和β衰变?(Th为90号元素)2. 人们很早就信任,原子核有可能自发地放射出重粒子(所谓重粒子一般指比氦核,即α射线粒子重的粒子)。
1984年,英国牛津高校的探讨人员第一次在试验中发觉,223Ra 放射14C的现象。
请写出这个衰变反响方程式。
第2题(12分)硼酸是一种很弱的无机酸。
构造式如右。
1.请给出化学方程式以说明硼酸呈酸性的缘由。
2.在硼酸中参加甘油后硼酸的酸性会增加,请给出缘由,可用文字或者方程式。
(提示:硼和氧的亲和力很强)3.(1)20世纪50年头,人们利用甲基硼酸酯和氢化钠的反响,得到了大量制备某种重要复原剂的反响。
这个反响同时还得到一种醇的钠盐。
请写出这个方程式。
这种复原剂又可以用于制备硼的最简洁的氢化物(留意,是可以实际存在的):将其及三氟化硼反响,得到硼的氢化物;产物中还有一种离子化合物,他的阴离子构型及第3小题中的复原剂阴离子一样。
(2)请写出该氢化物的分子式。
(3)写出这个反响方程式。
(4)这种氢化物又可用如下的方式制取:运用氧化硼及铝单质,氢气,在AlCl3的催化下得到。
产物中还又一种氧化物,它是多种矿物的主要成分。
中国化学会第23届全国高中学生化学竞赛(省级赛区) 全国通用

中国化学会第23届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (20分)1-1 Lewis 酸和Lewis 碱可以形成酸碱复合物。
根据下列两个反应式判断反应中所涉及Lewis 酸的酸性强弱,并由强到弱排序。
F4Si -N(CH3)3 + BF3 → F3B -N(CH3)3 + SiF4 ; F3B -N(CH3)3 + BCl3 → Cl3B -N(CH3)3 + BF3BCl3 > BF3 > SiF4 顺序错误不给分 (2分) 1-2 (1) 分别画出BF3和N(CH3)3的分子构型,指出中心原子的杂化轨道类型。
BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分) sp2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分) sp3(0.5分)(2) 分别画出F3B -N(CH3)3 和F4Si -N(CH3)3的分子构型,并指出分子中Si 和B 的杂化轨道类型。
CH 3H 3C H 3CFB FF B :sp3 (1分)+ (1分)CH 3H 3C H 3CFSi FFSi ,sp3d (1分)+ (1分)将BCl3分别通入吡啶和水中,会发生两种不同类型的反应。
写出这两种反应的化学方程式。
BCl3 + 3H2O = B(OH)3+ 3HCl 不配平不给分 (1分)BCl3 + C5H5N = Cl3B-NC5H5 或BCl3 + N= Cl 3N(1分)1-4 BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。
有效数字及其计算规则

nFEӨ =RTlnK,EӨ表示反应的标准电动势,n为该反应
得失电子数。计算25C下硫离子和铜离子反应得到铜的 反应平衡常数,写出平衡常数表达式。
28.1093g 28.1g
第24届全国高中学生化学竞赛(省级赛区)(2009年)
第2题 (5 分)
最近我国有人报道,将0.1 mol/L的硫化钠溶液装进一只 掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有 0.1 mol/L的氯化铜溶液的烧杯中,在静置一周的过程中, 蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪 色,并变得混浊。
相对偏差 ±0.02% ±0.2% ±2% ±20%
有效数字位数 4 3 2 1
读 取 同 一 滴 定 管 刻 度 : 甲 —24.55mL , 乙 — 24.54 mL,丙—24.53 mL。
分析天平称取试样质量时应记录为0.2100g。它
表示实际质量是0.21000.0001g范围内的某一值。
无机及分析 第三章
13
3、容量分析中常用仪器的准确度与有效数字
仪器
准确度
有效数字记录示例
滴定管 *
0.01mL
25.01mL
移液管 *
0.01mL
25.00mL
容量瓶 *
0.01mL
50.00mL
量筒
0.1mL
25.0 mL
万分之一的分析天
平*
托盘天平(感量为
0.1g)
0.0001g 0.1g
Ka=1.8×10-5 (2位) pKa=4.74 (2位)
中国化学会第23届全国高中学生化学竞赛(省级赛区)答案

中国化学会第23届全国⾼中学⽣化学竞赛(省级赛区)答案1-1 BCl 3 > BF 3 > SiF 4 顺序错误不给分(2分)1-2BFFF分⼦构型为平⾯三⾓形,不画成平⾯形不给分 (0.5分)sp 2 (0.5分)H 3C33分⼦构型为三⾓锥形,不画成三⾓锥形不给分 (0.5分)sp 3 (0.5分)CH 3H 3C H 3CFB FF B :sp 3CH 3H 3C H 3CFFF FSi ,sp 3d1-3 BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5 或BCl 3 +N=Cl 3N(1分)1-4BeCl Clsp 结构简式和杂化轨道各0.5分 (1分)BeClBeClClCl结构简式1.5分sp 2 杂化轨道0.5分 (2分)ClBeCl Cl BeCl结构简式1.5分sp 3杂化轨道0.5分画成 Cl BeCln 也得分1-5只有画出7配位的结构简式才能得满分,端基氮不配位得0分,⼆级氮不配位得1分 (2分) Cr 的氧化态为+4 (1分)1-6MnOC CCH 3CO CO O3不要求配体的位置 Mn 的氧化态为+1 (1分)2-1 SnCl 2 + 2HCl = SnCl 42- + 2H + 不配平不给分 (1分)浓HCl 的作⽤是形成SnCl 42-,可防⽌Sn(OH)Cl 的形成,抑制SnCl 2⽔解。
(1分)也得分2分 2-2 MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2O 不配平不给分 (1分)加浓HCl 利于升⾼MnO 2的氧化电位,降低Cl -的还原电位,使反应正向进⾏。
表述为提⾼MnO 2 氧化性,同时提⾼HCl 还原性,也可以。
⼆个理由各0.5分 2-3 Au + HNO 3 + 4HCl = HAuCl 4 + NO + 2H 2O (1分) 加浓HCl 利于形成AuCl 4-,降低Au 的还原电位,提⾼硝酸的氧化电位,使反应正向进⾏。
中国化学会第23届全国高中学生化学竞赛(新疆赛区)试卷

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题(12分)许多小溪流经煤矿和金属矿。
由于含硫矿床暴露在空气中或暴露在含氧的水中,使这些小溪变成酸性,溪水中含有溶解的铁和硫酸盐。
最常见的含硫铁矿是黄铁矿(FeS2),其中铁的氧化态是+2。
富含铁的溪水流入大面积的池塘中后,溶于水的铁以[FeO(OH)]的形式沉淀出来,覆盖于池塘底部,而水仍然保持酸性。
1-1画出S22—的路易斯结构式,标出全部价电子。
1-2写出黄铁矿在小溪中被空气氧化生成硫酸亚铁的离子方程式。
1-3写出Fe 2+ 离子被空气氧化生成FeO(OH)沉淀的离子方程式。
1-4假设黄铁矿全部转化为FeO(OH) ,计算:需要多少摩尔FeS2发生如上转化反应才能使1.0 L纯水的pH降到3.0?(提示:此条件下可认为HSO4-完全电离。
)1-5 含Fe2+ 离子0.00835 mol/L的溪水以20.0 L/min的流速流入一个很大的池塘后75%的Fe2+离子被氧化为Fe(III)。
因池水pH > 7,Fe (III) 完全沉淀,最后转化为Fe2O3。
计算一年可生成多少克Fe2O3。
沉淀出的Fe2O3的质量m(Fe2O3) = 1/2 M(Fe2O3)×n(Fe)×75%= 1/2×159.7 g/mol ×8.8×104 mol ×0.75 = 5.5×106 g (3分)第2题(13分)碳酸钙是自然界中分布最广的一种碳酸盐,碳酸钙难溶于水,但能溶于CO2的水溶液中。
碳酸钙矿床的地下水流出地面后,由于压强减小而放出CO2,年深日久可形成石笋或钟乳石。
2023年全国中学生化学竞赛试卷(附答案详解)

2023年全国中学生化学竞赛试卷(附答案
详解)
本文档为2023年全国中学生化学竞赛试卷的详细解答,旨在帮助参赛学生加深对试题的理解,并提供参考答案。
第一题
题目:请说明物质的化学元素符号以及其对应的原子序数。
参考答案:物质的化学元素符号用来标识元素,原子序数表示元素的原子核中所含质子的数量。
举例来说,氢元素的化学元素符号为"H",原子序数为1。
第二题
题目:根据给定的化学反应方程式,推导出反应的平衡常数表达式。
参考答案:根据化学反应方程式,可以利用反应物和生成物的浓度或压力来构建反应的平衡常数表达式。
具体的推导方法请参考教材第X章节。
......
第三题
题目:请解释什么是化学键的形成及其种类。
参考答案:化学键是由原子之间的相互作用产生的连接。
它可以通过电子的共享或转移来形成。
常见的化学键种类有离子键、共价键和金属键。
......
此文档仅为试卷的解答,不涉及具体的试题内容。
如需了解更多,请参考相关教材和研究资料。
尊重知识产权,请勿转载或引用未经确认的内容。
第23届全国高中学生化学竞赛理论试题(全)

第23届全国高中学生化学竞赛理论试题第1题用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。
2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数20.0)(2=MnO ϖ]和锌精矿[质量分数70.0)(=ZnS ϖ]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产生有重要的实际意义。
已知44.0)/(,77.0)/(223-==+++Fe Fe E V Fe Fe E θθ V ZnS S E V Mn MnO E V 265.0)/(,23.1)/(.22==+θθ。
1-1 锰结核矿和锌精矿单独酸浸结果很不理想。
请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性。
1-2 模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。
写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式,并简述反应速率加快的原因。
1-3 研究发现,2种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四氯乙烷的作用。
1-4 锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式。
第2题我国的稀土资源约占世界总量的80%,居世界第一位。
稀土元素的化学性质极其相似,分离十分困难,仅从1794年发现钇到1945年从铀裂变产物中得到钷就花了150年。
稀土萃取化学的研究为大规模分离和提纯稀土元素带来了新飞跃。
2008年国家最高科学技术奖授予化学家徐光宪,以表彰他在创立稀土 串级萃取理论及其工艺方面的杰出贡献,该项成就使我国高纯稀土产品成本下降3/4,单一高纯稀土产品占世界产量的90%以上。
2-1 目前在稀土分离工业中广泛应用国产萃取剂P 507,它的化学名称为(2 乙基己基)膦酸(2 乙基己基)酯,画出其化学结构简式,写出萃取三价稀土离子的化学反应方程式(萃取剂用HA 表示,稀土离子用RE3+表示)。
第23届全国高中学生化学竞赛理论试题答案

( ) M n + 2 + 4 十一 M n++ 2 。 1 Oz Fe H Fe十+
2 2 H O
() (){[ ( 。 O)P 1 a C H 。 oolP } 。r ( ){[( H。 )P O 。 r b c O O lP } ( )( )结构 。 2 a 空间位 阻 增大 ,网状 结构 难 以形成 或答 链状 结 构 可减 小烷 基链 间 的斥 力 。 ()萃取剂过量 ,萃合 物相对分子质量下降 , 3 从而避免了有机相乳化现象的发生 ,有利于萃取作 业 连续 进行 。
3— 1
Pb O4 4 C1 Na P Cl+ Na S S + Na 一 2b 4 2 O4
或 P S 4 C 一= P C  ̄ b O +4 1 = b l 一+S O 第 2题
2 1 —
( ) 图为 实验 1 b 的滴 定 曲线 ;应 该选 择 溴 甲酚 绿为 指 示 剂 。因 为 计 量 点 的组 成 是 NH C ,溶 液 1
x 一
叮
E = 一E; 1 2 。= = 一 . 3V一 0 2 5V一 0 9 5V . 6 . 6 或 △ =一 F一一2 . 6 ×9 5 0 G 二 = ×0 9 5 6 0
= 一 1 6 2k = = 8 . J・mo 一 l
将分子、分母同乘 以 [ 一 } ・ [ A] A ] ∽ H } 和 w [ E 3( ,则有 : . A]) R w K H+ { ] ] ; / 一E ] [ w v [ HA } ] \ w A w E E 3() R A] \ w /
将 2个 2乙 基 己 基 写 成 C H。 H ( 2 ) 一 C C H5 CH。 等形 式也 可 。 3 HA ( + R }) " E ( +3 w ( ) ) E 志  ̄ R A3 ) H+) o
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第23届全国高中学生化学竞赛理论试题第1题用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。
2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数20.0)(2=MnO ϖ]和锌精矿[质量分数70.0)(=ZnS ϖ]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产生有重要的实际意义。
已知44.0)/(,77.0)/(223-==+++Fe Fe E V Fe Fe E θθ V ZnS S E V Mn MnO E V 265.0)/(,23.1)/(.22==+θθ。
1-1 锰结核矿和锌精矿单独酸浸结果很不理想。
请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性。
1-2 模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。
写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式,并简述反应速率加快的原因。
1-3 研究发现,2种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四氯乙烷的作用。
1-4 锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式。
第2题我国的稀土资源约占世界总量的80%,居世界第一位。
稀土元素的化学性质极其相似,分离十分困难,仅从1794年发现钇到1945年从铀裂变产物中得到钷就花了150年。
稀土萃取化学的研究为大规模分离和提纯稀土元素带来了新飞跃。
2008年国家最高科学技术奖授予化学家徐光宪,以表彰他在创立稀土 串级萃取理论及其工艺方面的杰出贡献,该项成就使我国高纯稀土产品成本下降3/4,单一高纯稀土产品占世界产量的90%以上。
2-1 目前在稀土分离工业中广泛应用国产萃取剂P 507,它的化学名称为(2 乙基己基)膦酸(2 乙基己基)酯,画出其化学结构简式,写出萃取三价稀土离子的化学反应方程式(萃取剂用HA 表示,稀土离子用RE3+表示)。
2-2 设萃取反应平衡常数为Kex,HA 的解离常数为Ka,配合物在水相中的稳定常数为 n,配合物和萃取剂在有机相和水相间的分配常数分别为Dm 和Pn,试推导用诸常数表达Kex 的关系式。
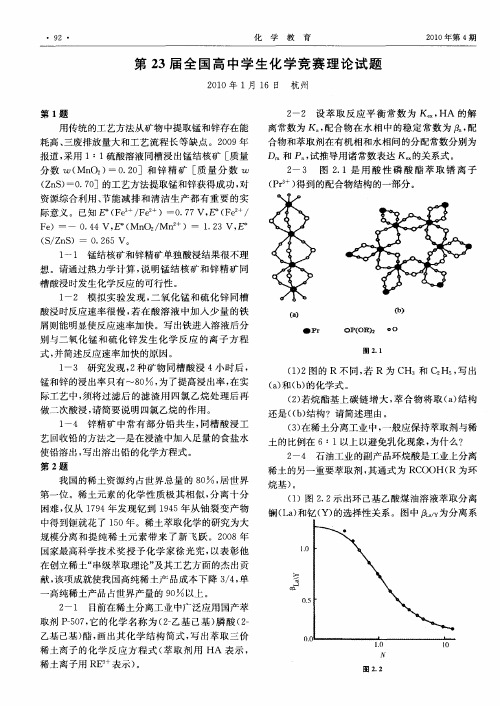
2-3 图2.1是用酸性磷酸酯萃取镨离子(Pr3+)得到的配合物结构的一部分。
(1)2图的R 不同,若R 为CH3和C2H5,写出(a)和(b)的化学式。
(2)若烷酯基上碳链增大,萃合物将取(a)结构还是((b)结构?请简述理由。
(3)在稀土分离工业中,一般应保持萃取剂与稀土的比例在6:1以上以避免乳化现象,为什么?2-4 石油工业的副产品环烷酸是工业上分离稀土的另一重要萃取剂,其通式为RCOOH(R 为环烷基)。
(1)图2.2 示出环己基乙酸煤油溶液萃取分离镧(La)和钇(Y)的选择性关系。
图中Y la /β为分离系数,即镧的萃取分配比和钇的萃取分配比的比值,N 为平衡水相中镧和钇的物质的量之比。
请回答,当N 值增大或减小时何种元素容易被萃取(注:分配比D=c(O)/c(W),c 为被萃取物总浓度)(2)高纯氧化钇是彩色电视和三基色荧光灯的红色荧光粉基质材料,过去用两步萃取技术获得,后徐光宪等用环烷酸体系经一步萃取分离就可获得99 99%的高纯氧化钇,创立了国际领先水平的新工艺。
该工艺需在煤油中添加15%~20%(体积分数)的混合醇,如正庚醇和正癸醇,请简要说明混合醇对改善萃取剂结构性能和萃取作业所起的作用。
第3题钒在生物医学、机械、催化等领域具有广泛的应用。
多钒酸盐阴离子具有生物活性。
溶液中五价钒的存在形体与溶液酸度和浓度有关,在弱酸性溶液中易形成多钒酸根阴离子,如十钒酸根-62810O V 、-52810O HV 和-428102O V H 等。
将34VO NH 溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体O nH O xV xH NH 2281046)(⋅-(用A 表示)。
元素分析结果表明,A 中氢的质量分数为3.13%。
用下述实验对该化合物进行分析,以确定其组成。
[实验1]准确称取0.9291gA 于三颈瓶中,加入100mL 蒸馏水和150mL20%NaOH 溶液,加热煮沸,生成的氨气用50.00mL0.1000mol/LHCl 标准溶液吸收。
加入酸碱指示剂,用0.1000mol/LNaOH 标准溶液滴定剩余的HCl 标准溶液,终点时消耗19.88mLNaOH 标准溶液。
[实验2]准确称取0.3097gA 于锥形瓶中,加入40mL1.5mol/LH2SO4,微热使之溶解。
加入50mL 蒸馏水和1gNaHSO3,搅拌5分钟,使反应完全,五价钒被还原成四价。
加热煮沸15分钟,然后用0.02005mol/LKMnO4标准溶液滴定,终点时消耗25.10mLKMnO4标准溶液。
3-1 图3.1为滴定曲线图,请回答哪一个图为实验1的滴定曲线;请根据此滴定曲线选择一种最佳酸碱指示剂,并简述做出选择的理由。
有关指示剂的变色范围如下:甲基橙(pH3.1~4.4),溴甲酚绿(pH3.8~5.4),酚酞(pH8.0~10.0)。
3-2 在实验2中,加NaHSO3还原-62810O V ,反应完全后需要加热煮沸15分钟。
煮沸的目的是什么?写出KMnO4滴定反应的离子方程式。
3-3 根据实验结果,计算试样A 中+4NH (和-62810O V 的质量分数,确定A 的化学式(x 和n 取整数)。
第4题磁性材料广泛应用于航空航天高科技领域及电视、电脑、手机等日常生活用品。
据报道,苯并[18]冠-6(以X 表示,图4.1)与铯离子可形成一种夹心型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y 表示,图4.2)结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能,是铁磁性和反铁磁性共存于同一晶体中的成功范例。
图4.3是X 、Y 与Cs+形成的复合物的晶体结构。
在此晶体结构图中,a)为沿b 轴看晶胞,b)为沿a 轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的 二聚体链。
4-1 给出该晶体晶胞的组成,并写出该晶体结构基元的化学式(苯并[18]冠6用X表示,镍配合物用Y表示)。
4-2 指出镍离子的杂化轨道类型;图4.4是平面正方形晶体场d轨道能级分裂图,把基态镍离子的d电子填入该图。
4-3 已知该晶体的晶胞参数a(1278.99pm,b(1305.39pm,c=2717.03pm,=78.3394º, = 77.0109º, =70.6358º,试计算该晶体的密度(g·cm-3)。
(相对分子质量:X 312.4;Y 451.4)4-4 (1)写出镍配合物Y的对称元素。
(2)指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因。
第5题水是最常用的溶剂。
水分子间形成很强的氢键,与一般液体物质相比,常态水具有较大的密度、比热、蒸发热、表面张力和介电常数。
水的三相点温度0 01∃、压强610Pa;临界温度374 2∃、临界压强22 1MPa 。
近年发现,近(超)临界水具备许多特有性质,以其为介质,可以有效实现许多重要的化学反应,应用前景广阔。
5-1 画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域。
5-2 计算液态水在90℃和0.1MPa 时的θw pK (θm r H ∆和θm r S ∆可视为常数,相关数据见表1)。
5-3 有人研究了乙酸乙酯在23~30MPa 、250~400∃和没有任何其他外加物的条件下的水解动力学,并提出2种可能的机理。
请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。
为什么?相关热力学数据如下:请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。
为什么?相关热力学数据如下:5-4 乙酸乙酯水解反应速率可表示为:其中k为速率常数,c0,CH3COOC2H5为乙酸乙酯的初始浓度。
请通过推导说明水解反应按哪种机理进行。
5-5 实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。
请通过机理1分析原因。
第6题木犀草素(Luteolin)是有良好抗菌活性和抗氧化能力的黄酮类化合物,以从植物中提取的芦丁(Rutin)为原料制取木犀草素是比较实用的一条工艺路线:在微波辅助下,芦丁与Na2S2O4在NaOH溶液中回流1.5小时生成木犀草素,产率83%。
6-1 实验测得,40℃时木犀草素在乙醇(EtOH)中的溶解度(以物质的量分数x计)为2.68×10-3。
已知20~60℃木犀草素在乙醇中的溶解焓为20.28kJ·mol-1。
请估算25∃时木犀草素在乙醇中的溶解度。
6-2 40℃时,芦丁和木犀草素在乙醇&水混合溶剂中的溶解度曲线如图6.1。
根据图示,设计提纯木犀草素的具体方案。
6-3 木犀草素有和两种晶相,在热力学上,相比相稳定。
在恒压下,液态、相和相的摩尔Gibbs自由能Gm随温度T的变化关系如图6.2所示。
(1)请回答哪条线对应a相、β相,说明理由。
(2)在相同温度下,a相和β相哪个熵更大?简述理由。
第7题2005年诺贝尔化学奖授予在烯烃复分解反应研究方面做出杰出贡献的Chauvin、Grubbs 和Schrock3位化学家。
烯烃复分解反应已被广泛用于有机合成和化学工业,特别是药物和塑料的研发。
最近,这一反应在天然产物(+)-Angelmarin的全合成中得到应用。
(+)-Angelmarin 是中草药独活中的有效成分之一。
1971年Franke小组报道了它的关键中间体E的合成(见合成路线1)。
最近,Coster小组用廉价易得的烯丙基溴代替Franke方法中较贵的-3-甲基-3-氯-1-丁炔,合成出中间体G,再经烯烃复分解反应得到D,继而通过对映选择性环氧化等4步反应得到光学纯的(+)-An-gelmarin(见合成路线2)。
7-1 画出中间体B、C和F的结构式。
7-2 试为合成路线1中第二、三步反应和合成路线2中的第二步反应提出合理的反应条件和试剂。
7-3 试解释合成路线1中从D到E转化(即第四步反应)的历程(用反应式表示)。
7-4 在合成路线2的第二步反应(从F到G的转化)中还观察到了一种副产物,它是G的同分异构体,试画出这个副产物的结构式。
7-5 3-甲基-3-氯-1-丁炔是合成路线1中使用的原料之一。
用乙炔和必要的有机或无机试剂,用不超过3步反应的合成路线合成该化合物,写出反应式。
第8题20世纪70年代我国科学家从民间治疗疟疾草药黄花蒿中分离出一种含有过氧桥结构的倍半萜内酯化合物,称为青蒿素,它是我国自主研发并在国际上注册的药物,也是目前世界上最有效的抗疟疾药物之一。
