第5章 蛋白质结构解析
05第五章大豆蛋白质

(6)组织化作用
(7)面团作用 (8)黏着性、附着性和弹性
第三节、大豆蛋白的提取工艺
现在提取的蛋白质有浓缩大豆蛋白和分离大豆蛋白。 (一)浓缩大豆蛋白的生产 脱脂后的豆粕含有的成分:蛋白质、可溶性糖类、灰份、其 他微量成分、纤维素、半纤维素等。 浓缩大豆蛋白含义: 经低温脱溶后的豆粕,如除去其中的可溶性糖、灰分及 微量元素,所得的产品为浓缩大豆蛋白,其中蛋白含量为 70%,还有一些纤维和半纤维。 生产方法:乙醇萃取法、酸洗法(等电点法)。
消泡剂
在制浆的过程中,会产生大量的气泡,对后续加工影响较大, 煮浆容易造成假沸,点脑时影响凝固剂分散.以前使用过的消泡剂有: 油脚﹑油脚膏﹑硅有机树脂﹑脂肪酸甘油酯等,目前国标(GB2760-
只有高碳醇脂肪酸 酯复合物(DSA-5),最大使用量为1.6g/kg。
1996)允许在豆制品中的消泡剂
其他
2.蛋白质分散法(PDI) PDI(蛋白质分散度指数)=(水分散蛋白质/样品中总 蛋白质)×100% 热处理对大豆蛋白变性的影响
酸碱变性:大豆蛋白在PH为1或14的极端情况下引起变 性。
酒精有促进蛋白质变性的作用
(四)、大豆蛋白的功能特性
(1)凝胶化 (2)乳化性 (3)发泡性 (4)吸收脂肪 (5)吸收水分
大豆蛋白质的浓度及组成是凝胶能否形成的决定性因素。含量 8.0-16.0%的大豆蛋白质溶胶,经过一定的加热过程,冷却后即可 形成凝胶;低于8.0%时,紧用加热的方法是不能形成凝胶的,只有 在加热后及时调节pH或离子强度,才能形成凝胶。
(五)蛋白质与油、水关系
1.蛋白质与脂质的相互作用
形成脂络合物(豆浆加热时所形成的浆膜)
3 制浆
(2)滤浆 目的是把豆糊中的豆渣除去
第五章-核磁共振方法解析蛋白质结构

核磁共振的原理
• 自旋量子数(I)
原子序数和原子质量都为偶数:I=0(12C,
16O)
原子序数为奇数,原子质量为偶数: I=整数(14N, 2H, 10B)
原子质量为奇数: I=半整数(1H,
13C, 15N, 31P)
• 自旋状态(M)
M =I,(I-1),(I-2),…,-I
对于1H,
13C, 15N, 31P
2.
3.
耦合常数
• 自旋耦合
共价键(1-4个键)相连核之间的特性张量的相互作用
1
H
C
1
H
1
H
13
three-bond one-bond
• 自旋裂分
由于被测核与相邻核自旋耦合引起的谱线裂分, 裂分的 大小称为耦合常数 bb S ba S I aa
J (Hz)
I
ab
I
S
• • • • •
耦合常数不随磁场的变化而变化 两核耦合引起对方谱线裂分的大小相等 相距越远、所隔键数越多,耦合越弱 重原子比轻原子耦合强 耦合常数的大小与耦合核的二面角有关
核磁共振谱仪的组成
•Magnet
•Probe
•Console •Computer
对磁体的要求
• 高磁场强度
• 高稳定性
• 高均匀性
高磁场强度:高分辨率高灵敏度
• 信噪比的完全方程
Oestradiol-acetate
900 MHz
1450
1400
1350
1300
1250
1200
1150
1100
• • • • • •
NOE—5Å 化学位移—二级结构 偶极常数—二面角 氢氘交换—氢键 顺磁驰豫增强(PRE)—远距离(30Å) 残余偶极耦合(RDC)—空间定向
蛋白质的结构和功能

蛋白质的结构和功能蛋白质是生物体内重要的有机物质,其在细胞功能和生物体机体过程中发挥着关键作用。
蛋白质的结构和功能密不可分,下面将从蛋白质的结构以及其所承担的功能两个方面进行探讨。
一、蛋白质的结构蛋白质的结构可分为四个层次,分别是一级结构、二级结构、三级结构和四级结构。
1. 一级结构蛋白质的一级结构指由氨基酸残基的线性排列方式所决定的序列。
氨基酸的种类和顺序决定了蛋白质的特定功能和结构。
在水溶液中,氨基酸残基以离子形式存在,通过胺基和羧基之间的肽键连接起来形成多肽链。
2. 二级结构蛋白质的二级结构是指蛋白质中局部区域的空间构象,主要包括α-螺旋和β-折叠两种常见的结构。
α-螺旋是由多肽链的螺旋形状而成,通过氢键的形成保持稳定。
β-折叠则是由多个β折叠片段组合而成,也是通过氢键的形成维持稳定。
3. 三级结构蛋白质的三级结构是指蛋白质中整个多肽链的立体构象。
多肽链在二级结构的基础上进一步折叠和组装,形成复杂的三维结构。
这个结构的形成主要由各个氨基酸残基之间的相互作用所决定,包括疏水相互作用、氢键、电离相互作用、范德华力和二硫键等。
4. 四级结构蛋白质的四级结构是指由多个多肽链通过相互作用而形成的功能完整的蛋白质分子。
这些多肽链可以是相同的或不同的,它们之间通过各种各样的键连接在一起,形成复杂的结构。
二、蛋白质的功能蛋白质的结构决定了其功能。
蛋白质在生物体内扮演着多种重要的角色,包括酶、结构蛋白、运输蛋白和抗体等。
1. 酶酶是一类催化生物化学反应的蛋白质,可以加速化学反应发生的速率。
酶的活性与其结构密切相关,酶的活性位点具有与底物相互作用的特定结构。
2. 结构蛋白结构蛋白是细胞中的主要组成部分,为细胞提供了稳定的支持和形状。
它们形成了细胞的骨架,维持细胞的稳定性和形态。
3. 运输蛋白运输蛋白可以将物质从细胞内部输送到细胞外部,或者从细胞外部运输到细胞内部。
例如,血红蛋白可以运输氧气到全身各个组织和器官。
生物化学蛋白质结构与功能

生物化学蛋白质结构与功能蛋白质是生物体中必不可少的一类有机分子,它们在生命活动中担当着关键的角色。
蛋白质的结构与功能密不可分,只有了解其结构,才能深入理解其功能。
本文将介绍蛋白质的结构层次和功能,并探讨二者之间的关系。
一、一级结构——氨基酸序列蛋白质的结构层次可以从氨基酸序列开始。
氨基酸是构成蛋白质的基本单位,通过肽键连接在一起。
不同的氨基酸组合而成的序列决定了蛋白质的结构和功能。
在蛋白质家族中,氨基酸序列可以有很大的变化,导致不同结构和功能的蛋白质的形成。
二、二级结构——α-螺旋和β-折叠在氨基酸序列中存在着两种常见的二级结构:α-螺旋和β-折叠。
α-螺旋是由氢键相互作用形成的螺旋形结构,具有稳定性和韧性。
β-折叠是由氢键相互作用形成的平行或反平行的链状结构,具有稳定性和刚性。
不同氨基酸序列所形成的二级结构会决定蛋白质在空间立体结构中的排列方式。
三、三级结构——立体构象蛋白质的三级结构是指氨基酸序列在空间中的立体构象。
它的形成受到氢键、离子键、范德华力等多种相互作用力的调控。
蛋白质的三级结构决定了其最终的立体构象,从而影响其功能的表现。
不同的蛋白质通过三级结构的差异来实现其特定的功能,如酶的催化作用、抗体的识别能力等。
四、四级结构——多肽链聚合体在某些情况下,多个蛋白质可以相互结合形成一个更大的功能单位,这种现象被称为四级结构。
例如,红血球中的血红蛋白就是由四个亚单位组成的。
四级结构的形成使得蛋白质的功能更加多样化和复杂化。
蛋白质的结构与功能之间存在着密切的关系。
蛋白质的特定结构决定了其特定的功能,而功能的表现也要依赖于蛋白质的特定结构。
举例来说,酶作为一类具有催化作用的蛋白质,其特定的结构使得它可以与底物结合,并通过催化反应来转化底物。
同样,抗体作为一种免疫分子,其特定的结构允许它与抗原结合,并发挥识别和中和作用。
总结起来,蛋白质的结构与功能密不可分。
深入了解蛋白质的结构层次,有助于我们更好地理解其功能的表现。
5第五章 蛋白质的三维结构

第5章蛋白质的三维结构§1.8 蛋白质的三维结构蛋白质三维结构由氨基酸序列决定,且符合热力学能量最低要求,与溶剂和环境有关。
①主链基团之间形成氢键。
②暴露在溶剂中(水)的疏水基团最少。
③多肽链与环境水(必须水)形成氢键。
(一)研究蛋白质构象的方法(1)X-射线衍射法:是目前最明确揭示蛋白质大多数原子空间位置的方法,为研究蛋白质三维结构最主要的方法。
步骤为:蛋白质分离、提纯→单晶培养→晶体学初步鉴定→衍生数据收集→结晶解析→结构精修→结构表达。
(2)其他方法:NMR、紫外差光谱、荧光和荧光偏振、圆二色性、二维结晶三维重构。
(二)稳定蛋白质三维结构的作用力(1)弱相互作用(或称非共价键,或次级键)1. 氢键2. 疏水作用(熵效应)3. 范德华力4. 离子键(盐键)(2)共价二硫键(三)酰胺平面和二面角(1)酰胺平面(肽平面):肽键上的四个原子和相连的Cα1和Cα2所在的平面。
(2)两面角:每个氨基酸有三个键参与多肽主链,一个肽键具有双键性质不易旋转,另两个键一个为Cα1与羰基形成的单键,可自由旋转,角度称为ψ,另一个为NH与Cα2形成的单键也可自由旋转,角度称为φ,ψ和φ称为二面角或构象角,原则上可取-1800~+1800之间任意值(实际受立体化学和热力学因素所限制),肽链构象可用两面角ψ和φ来描述,由ψ和φ值可确定多肽主链构象。
(四)二级结构多肽链折叠的规则方式,是能量平衡和熵效应的结果。
主链折叠由氢键维持(主要),疏水基团在分子内,亲水基团在分子表面。
常见的二级结构元件:α-螺旋,β-折叠片,β-转角和无规卷曲。
(1)α-helix:蛋白质含量最丰富的二级结构。
肽链主链围绕中心轴盘绕成螺旋状紧密卷曲的棒状结构,称为α-螺旋。
1.两面角ψ和φ分别在-570和-470附近(φ:从Cα向N看,顺时针旋转为正,逆时针为负;ψ:从Cα向羰基看,顺时针为正,逆时针为负。
)2.每圈螺旋含约3.6个氨基酸残基,由H键封闭的环中原子数为13,此种α-螺旋又称3.613-螺旋,每周螺距为0.54nm,R基均在螺旋外侧。
高中人教版生物必修二:第5章 第1节 基因突变和基因重组 Word版含解析

第1节基因突变和基因重组[学习导航] 1.结合镰刀型细胞贫血症的发病原因,说出基因突变的概念和方式。
2.结合具体实例,简述基因突变的原因、特点及意义。
3.结合减数分裂的过程,简述基因重组的概念、方式及意义。
[重难点击]基因突变和基因重组的比较。
【课堂导入】图中的情景用英语表达为:THE CAT SAT ON THE MAT(猫坐在草席上),几位同学抄写时出现了不同的错误,如下:(1)THE KAT SAT ON THE MAT(2)THE HAT SAT ON THE MAT(3)THE CAT ON THE MA T将其翻译成中文,和原句相比意思是否改变了?据此可知,个别字母的替换或者缺少,句子的意思都可能改变。
如果是DNA分子中的遗传信息——脱氧核苷酸的排列顺序也发生了类似的变化,生物体的性状会发生怎样的改变呢?这些变化可能对生物体产生什么影响?解决学生疑难点一、基因突变的实例1.镰刀型细胞贫血症(1)致病机理①直接原因:谷氨酸――→替换为缬氨酸。
②根本原因:基因中碱基对=====T A ――→替换为 =====A T。
(2)结论:镰刀型细胞贫血症是由于基因的一个碱基对改变而产生的一种遗传病。
2.基因突变的概念:DNA 分子中发生碱基对的替换、增添和缺失,而引起的基因结构的改变。
3.基因突变对后代的影响(1)若发生在配子中,将遵循遗传规律传递给后代。
(2)若发生在体细胞中,一般不能遗传。
但有些植物的体细胞发生基因突变,可通过无性繁殖传递。
合作探究1.生物变异的类型分析(1)在北京培育的优质北京甘蓝品种,叶球最大的有3.5 kg ,当引种到拉萨后,由于昼夜温差大、日照时间长、光照强,叶球可重达7 kg 左右。
但再引回北京后,叶球又只有3.5 kg 。
上述甘蓝品种的引种过程中,有没有变异现象的发生?如果有,这种变异性状能稳定地遗传给子代吗?为什么?答案 有变异。
但是这种变异性状不能稳定地遗传给子代,因为遗传物质没有变化。
第五章 蛋白质结构解析

血红蛋白分子就是由二个由141个氨基酸残基组成的α亚基和二个由146个氨基酸 残基组成的β亚基按特定的接触和排列组成的一个球状蛋白质分子,每个亚基中 各有一个含亚铁离子的血红素辅基。四个亚基间靠氢键和八个盐键维系着血红蛋 白分子严密的空间构象。
NMR基本原理
核 磁 共 振 ( Nuclear Magnetic Resonance),
就是处于某个静磁场中的 自旋核系统受到相应频率 的射频磁场作用时 ,共振 吸收某一特定频率的射频 辐射的物理过程。
核磁共振波谱是测量原子核对 射频辐射(约4600MHz)的吸收, 这种吸收只有在高磁场中才能 产生。 核磁共振波谱仪
电镜三维重构、各种光谱技术、显微
技术和计算机模拟
蛋白质三维结构解析过程
第一节 X-射线衍射测定蛋白质结构
1895年11月8日 ,德国物 理学家,50岁的伦琴在 自己的实验室中偶然发 现 一种从阴极射线管 中辐射出的新型射线, 由于对管子发出的“东 西”性质不确定,伦琴 就把这种射线命名为 “X射线” 。
3、衍射数据收集和处理
第三代同步辐射光源的应用使得用20-40 um大小的晶体解析高分辨率结构已经成为 现实 目前世界上比较著名的同步辐射工作站有 多个: APS(USA); ESRF(France); SPring-8 (Japan)
4、位相求解
1. 分子置换法(MR) 2. 多对同晶型置换法(MIR) 3. 多波长反常散射法(MAD)
核磁共振可以方便地在溶液中研究分子结构并且是唯一 可以使试样不经受任何破坏的结构分析方法。 目前核磁共振成象技术已能以活人为观察对象,扫描身 体中任何器官或组织的任何一个断面的核磁共振参数,成 为一种引人注目的癌症早期诊断技木。
巧解高中生物第5章细胞的能量供应和利用带答案考点大全笔记

(名师选题)巧解高中生物第5章细胞的能量供应和利用带答案考点大全笔记单选题1、在“绿叶中色素的提取和分离”实验中得到的色素带颜色较浅,分析其原因可能是()①加入的提取液太多②用体积分数为95%的乙醇加入无水碳酸钠代替无水乙醇③研磨时没有加入碳酸钙④研磨时没有加入二氧化硅⑤取的叶片叶脉过多,叶肉细胞过少⑥画滤液细线的次数少⑦使用放置数天的菠菜叶A.①③⑦B.②④⑤C.①③④⑤⑥⑦D.②③④⑤⑥2、光反应在叶绿体类囊体上进行。
在适宜条件下,向类囊体悬液中加入氧化还原指示剂DCIP,照光后DCIP 由蓝色逐渐变为无色。
该反应过程中A.需要ATP提供能量B.DCIP被氧化C.不需要光合色素参与D.会产生氧气3、下图为酵母菌和人体细胞呼吸流程图,下列叙述不正确的是()A.条件X下酵母菌细胞呼吸时,葡萄糖中能量的去向有3处B.条件Y下,葡萄糖被酵母菌代谢并产生CO2和水C.氧气不足时,人体肌细胞产生的CO2量大于O2的消耗量D.人体细胞和酵母菌都能在X或Y条件下呼吸,但人不属于兼性厌氧型生物4、下列关于绿叶中色素的提取与分离实验的叙述中,错误的是()A.加入CaCO3是为了防止色素被破坏B.加入SiO2有利于破坏叶肉细胞C.分离色素时塞紧试管口是为了防止乙醇和层析液的挥发D.滤纸条上的滤液细线中色素越少越利于色素分离5、ATP可将蛋白质磷酸化,磷酸化的蛋白质会改变形状做功,从而推动细胞内系列反应的进行(机理如图所示)。
下列说法错误的是 ( )A.ATP推动细胞做功,存在吸能反应与放能反应过程B.磷酸化的蛋白质做功,失去的能量主要用于ATPC.ATP水解与磷酸化的蛋白质做功均属于放能反应D.肌肉在收缩过程中,肌肉中的能量先增加后减少多选题6、图一是某绿色植物细胞内生命活动示意图:其中1 .2 .3 .4 .5表示生理过程:A、B、C、D表示生命活动产生的物质。
图二为将生长状况相同的等量花生叶片分成4等份,在不同温度下分别暗处理1h,再光照1h(光照强度相同),测其有机物变化,得到如下数据,下列相关叙述正确的是()A.图一中在生物膜上发生的生理过程有③和④B.该细胞中CO2由2过程产生到5过程利用,至少穿过8层磷脂双分子层C.当花生叶片所处温度为29℃时,CO2固定速率最大D.如果昼夜恒温,在白天光照10小时,最适合花生生长的温度是27℃7、下图表示人体内某种酶促反应的反应物浓度对反应速度的影响曲线。
蛋白质的结构与功能

蛋白质的结构与功能蛋白质是生物体中最重要的宏观分子之一,是维持生命活动的基础。
它们在细胞结构、代谢调节、免疫和信号传递等方面发挥着重要作用。
蛋白质的结构与功能是相互关联的,不同的蛋白质结构决定了它们的功能。
一级结构是指蛋白质中氨基酸的线性排列方式。
氨基酸通过肽键连接形成多肽链,组成了蛋白质的一级结构。
一级结构对蛋白质的性质和功能起着决定性作用。
二级结构是指多肽链上相邻的氨基酸通过氢键形成的局部空间排列方式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种右旋的螺旋结构,其中氢键固定螺旋的形成。
β-折叠是由平行或反平行的β链排列而成,通过氢键连接起来形成稳定的结构。
三级结构是指蛋白质中氨基酸侧链的相互作用所形成的立体结构。
它由非共价键和共价键相互作用而形成。
非共价键主要包括氢键、疏水作用、电荷作用等。
这些相互作用使蛋白质折叠成特定的立体结构。
四级结构是指多个多肽链相互作用而形成的复合物。
蛋白质可以由单个多肽链组成,也可以由多个多肽链组成。
四级结构对于蛋白质的功能起着重要作用,它决定了多肽链之间的相互作用和空间结构。
蛋白质的功能与其结构密切相关。
蛋白质的结构决定了它们的功能。
不同的蛋白质具有不同的功能,包括催化反应、传输物质、结构支持、免疫调节等。
催化反应是蛋白质最常见的功能之一、酶是一类具有催化反应的蛋白质,它们能够加速生物体内化学反应的速率。
酶通过与底物结合形成酶底物复合物,使底物分子转变为产物,然后释放产物,完成催化反应。
传输物质是蛋白质的另一个重要功能。
例如,血红蛋白是一种负责将氧气从肺部运输到全身组织的蛋白质。
血红蛋白通过与氧气结合形成氧合血红蛋白,然后将氧气释放给组织细胞。
蛋白质还担负着结构支持的功能。
例如,胶原蛋白是一种主要存在于结缔组织中的蛋白质,它能够提供组织的结构框架,并增加组织的强度和柔韧性。
免疫调节是蛋白质的另一个重要功能。
抗体是一类能够与抗原特异性结合的蛋白质,它们能够识别并结合入侵病原体或异常细胞,并协助免疫系统清除它们。
高中生物第5章细胞的能量供应和利用笔记重点大全(带答案)

高中生物第5章细胞的能量供应和利用笔记重点大全单选题1、某种酶P由RNA和蛋白质组成,可催化底物转化为相应的产物。
为探究该酶不同组分催化反应所需的条件。
某同学进行了下列5组实验(表中“+”表示有,“-”表示无)。
B.蛋白质组分的催化活性随Mg2+浓度升高而升高C.在高浓度Mg2+条件下RNA组分具有催化活性D.在高浓度Mg2+条件下蛋白质组分具有催化活性答案:C分析:分析:由表格数据可知,该实验的自变量是酶的组分、Mg2+的浓度,因变量是有没有产物生成,底物为无关变量。
第①组为正常组作为空白对照,其余组均为实验组。
A、第①组中,酶P在低浓度Mg2+条件,有产物生成,说明酶P在该条件下具有催化活性,A错误;BD、第③组和第⑤组对照,无关变量是底物和蛋白质组分,自变量是Mg2+浓度,无论是高浓度Mg2+条件下还是低浓度Mg2+条件下,两组均没有产物生成,说明蛋白质组分无催化活性,BD错误;C、第②组和第④组对照,无关变量是底物和RNA组分,自变量是Mg2+浓度,第④组在高浓度Mg2+条件下有产物生成,第②组在低浓度Mg2+条件下,没有产物生成,说明在高浓度Mg2+条件下RNA组分具有催化活性,C正确。
故选C。
2、农业生产中,农民会采取一些措施来提高农作物的产量。
下列措施不能达到增产目的的是()A.对温室中的作物,白天适当升高温度,夜间适当降低温度B.种植玉米时,尽量缩小株距和行距,以增加玉米植株的数量C.油菜植株发育过程中,及时去掉油菜下部衰老变黄的叶片D.在初夏晴天中午,对温室大棚通风或施放干冰答案:B分析:植植物的光合作用原理是在叶绿体里利用光能把二氧化碳和水合成有机物并放出氧气,同时把光能转变成化学能储存在制造的有机物里。
呼吸作用的原理是在线粒体里在氧气的作用下把有机物分解成二氧化碳和水,同时释放能量。
可见要想提高作物的产量就要想办法促进光合作用,并抑制呼吸作用。
依据光合作用的原理可知促进光合作用的措施有:增加光照、增加原料二氧化碳和水、适当提高昼夜温差,因为适当提高白天的温度可以促进光合作用的进行,而夜晚适当降温则可以抑制其呼吸作用。
烹饪化学第五章烹饪食品中的蛋白质

➢ 乳清蛋白 -乳清蛋白,25%
-乳球蛋白,50% 牛奶加热产生的气味
2020/10/27
7
5.1 Introduction
二、食品中蛋白质来源及种类
肉中的蛋白质
➢ 肌浆中的蛋白质 占20%-30%
肌溶蛋白,球蛋白X,肌红蛋白
➢ 肌原纤维蛋白质 ➢ 基质蛋白质
占51%-53% 肌球蛋白,肌动蛋白 肌动球蛋白,肌原球蛋白
按生物功能分为酶、运输蛋白、营养和贮存蛋白、
收缩蛋白或运动蛋白、结构蛋白和防御蛋白。
2020/10/27
26
5.2 蛋白质功能性质 Functional Properties of Proteins
脂肪 糖 蛋白质
相互作用
食品色泽 食品风味 食品外形
构成
食品 品质
其他成分
食品质构
2020/10/27
2020/10/27
带电的氨基酸残基数目越大, 水合能力越大。
35
各种蛋白质的水合能力
概念:
蛋白质分子中带电基团、主链肽基团、Asn、 Gln的酰胺基、Ser、The和非极性残基团与水 分子相互结合的性质。
蛋白质水合性质与食品的功能性:
如分散性、湿润性、溶解性、黏度、胶凝作
用、乳化和起泡性等,都取决于水-蛋白质的相
互作用。
2020/10/27
31
作用方式:
2020/10/27
3 . 核 蛋 白 (Nucleoproteins) : 由 核 酸 与 蛋 白 质结合而成的复合物。存在细胞核及核糖体中。
2020/10/27
23
4.磷蛋白(Phosphoproteins):为许多主要食物中一 种很重要的蛋白质。磷酸基团是与丝氨酸或苏氨酸中 的羟基结合,如牛乳中的酪蛋白和鸡蛋黄中的磷蛋白、 胃蛋白酶等即是。
第5章-蛋白质翻译后修饰

Chapter VChapter VPost‐translational ModificationOf ProteinsOne gene more proteinsOne gene, more proteins•蛋白质翻译后修饰(PTM)是指蛋白质在翻译中或翻译后经历的个共价加工过程,即通过1个或几个氨基酸残基加上修饰的一个基团或通过蛋白质水解剪去基团而改变蛋白质的性质。
•从定义的角度,可以如下理解蛋白质翻译后修饰:1. 对某氨基酸的修饰包括共价连接简单的官能团(如乙酰基或磷酸基)1对某一氨基酸的修饰包括和引入一些复杂结构,如脂类和糖类。
2. 将已经结束翻译的转录本产物切割成成熟的形式,如信号肽或活性肽的加工等。
3. 氨基酸的交联,如丝氨酸和酪氨酸。
•可以说,蛋白质组中任一蛋白质都能在翻译时或翻译后进行修饰。
不同类型的修饰都会影响蛋白质的电荷状态、疏水性、构饰不同类型的修饰都会影响蛋白质的象和(或)稳定性,最终影响其功能。
•诸多实例表明蛋白质的修饰都采取一种可逆模式‐“开”或“关”的状态行或者调节蛋白质的功能或者作为个真实的分的状态进行,或者调节蛋白质的功能,或者作为一个真实的分子开关。
•目前已发现300多种不同的翻译后修饰,主要形式包括磷酸化、糖基化、乙酰化、泛素化、羧基化、核糖基化以及二硫键的配对等。
等•加入官能团乙酰化—通常于蛋白质的N末端加入乙酰。
磷酸化—加入磷酸根至Ser、Tyr、Thr或His。
糖化—将糖基加入Asn、羟离氨酸、Ser或Thr,形成糖蛋白。
烷基化加入如甲基或乙基等烷基。
—甲基化—烷基化中常见的一种,在Lys、Arg等的侧链氨基上加入甲基。
生物素化—主要有组蛋白的生物素酰化修饰,由羧化全酶合成酶与组蛋白直接相互作用完成,以及生物素附加物令赖氨酸残基酰化。
以及生物素附加物令赖氨酸残基酰化谷氨酸化—谷氨酸与导管素及其他蛋白质之间建立共价键。
甘氨酸化—一个至超过40种甘氨酸与导管素的C末端建立共价键。
蛋白质结构导论pdf

蛋白质结构导论pdf
蛋白质是生命的核心组成部分,是生物体的基本功能单元。
其结构不仅决定了蛋白质的形状和性质,而且还决定了其在生物体内的功能。
理解蛋白质的结构是理解生命的基础,也是生物科学和医学研究的重要领域。
蛋白质的结构可以从多个层次来理解。
最基本的层次是氨基酸序列,这是由生物体内的基因编码决定的。
氨基酸按照特定的序列串联起来,形成了蛋白质的一级结构。
这一结构决定了蛋白质的基本性质,如它的形状、大小以及与其他分子的相互作用。
在氨基酸序列的基础上,蛋白质通过肽键形成二级结构。
这些二级结构单元包括螺旋(alpha-helix)、折叠(beta-sheet)和无规卷曲(random coil)等。
这些二级结构单元进一步组合,形成了蛋白质的三级结构。
三级结构决定了蛋白质的形状和大小,也决定了蛋白质在生物体内的功能。
然而,蛋白质的结构并不止于此。
有些蛋白质由多个亚基组成,这些亚基以一定的方式组装在一起,形成了蛋白质的四级结构。
四级结构决定了蛋白质的整体形态和功能。
理解蛋白质的结构需要借助于多种研究方法,如X射线晶体学、核磁共振(NMR)
和电子显微镜等。
这些技术使我们能够观察到蛋白质的精细结构,从而更好地理解其功能。
蛋白质的结构是一个复杂而精致的系统,它既包含了静态的形状,也包含了动态的过程。
通过理解蛋白质的结构,我们可以更深入地理解生命的本质,为生物科学、医学和其他相关领域的研究提供基础。
细胞生物学题库第5章(含答案)

《细胞生物学》题库第五章物质运输1. 试述协助扩散与简单扩散的区别。
2. 试述Na-K泵及钙泵的工作原理。
3. 质子泵的主要类型。
4. 离子通道蛋白与载体蛋白的区别,以及离子通道蛋白作用特点以及主要类型。
5. 论述协同运输的机制。
6. 试述胞饮作用与吞噬作用的区别;胞饮小泡形成的机理。
7. 说明组成型胞吐与调节型胞吐的区别。
《细胞生物学》题库参考答案第五章物质运输1. 试述协助扩散与简单扩散的区别。
⑴简单扩散(自由扩散)和协助扩散是被动运输的两种形式。
二者转运的动力都来自物质的浓度梯度,不需要细胞提供代谢能量。
⑵二者的主要区别:简单扩散,只有小分子量的不带电或疏水分子以简单扩散的方式跨膜。
不依赖于膜蛋白,所以不具有特异性。
扩散的速度正比于膜两侧该离子的浓度梯度。
协助扩散,与简单扩散不同,分子的协助扩散依赖于特定的内在膜蛋白,常称之为单向转运蛋白质。
分子结合到膜一侧的蛋白质上,该蛋白质发生构象变化将该分子转运到膜的另一侧并释放。
转运蛋白对于某特定分子或一组结构相似分子具有专一性。
2. 试述Na-K泵及钙泵的工作原理。
⑴Na-K泵即Na+-K+ATP酶,一般认为是由2个大亚基、2个小亚基组成的4聚体。
Na+-K+ATP酶通过磷酸化和去磷酸化过程发生构象的变化,导致与Na+、K+的亲和力发生变化。
在膜内侧Na+与酶结合,激活ATP酶活性,使ATP分解,酶被磷酸化,构象发生变化,于是与Na+结合的部位转向膜外侧;这种磷酸化的酶对Na+的亲和力低,对K+的亲和力高,因而在膜外侧释放Na+、而与K+结合。
K+与磷酸化酶结合后促使酶去磷酸化,酶的构象恢复原状,于是与K+结合的部位转向膜内侧,K+与酶的亲和力降低,使K+在膜内被释放,而又与Na+结合。
其总的结果是每一循环消耗一个ATP;转运出三个Na+,转进两个K+。
⑵钙离子泵对于细胞是非常重要的,因为钙离子通常与信号转导有关,钙离子浓度的变化会引起细胞内信号途径的反应,导致一系列的生理变化。
分子生物学基础第五章遗传信息的翻译—从mRNA到蛋白质第二节蛋白质生物合成的过程

第二节 蛋白质生物合成的过程
图5-8 原核生物蛋白质合成起始复合体的形成
第二节 蛋白质生物合成的过程
2.真核生物蛋白质合成的起始 真核生物蛋白质合成的起始需要更多的蛋白质因子 eIF参与,目前至少发现有9种,其中有些因子含有多达11 种不同的亚基。但对它们的功能了解甚少,主要过程如图 5-9所示。与原核系统类似,eIF-3使40S的小亚基与大亚 基分开,但其间的反应不同。Met-tRNAiMet首先与小亚基 结合,同时与eIF-2及GTP形成起始四元复合体,该复合体 再 在 多 个 因 子 的 帮 助 下 开 始 与 mRNA 的 5 ′ 端 结 合 。 其 中 eIF-4因子含有1个特殊的亚基,能特异性地结合在mRNA的 5′端帽子结构上。结合在mRNA上后,核糖体小亚基就开 始向3′端移动至第一个AUG,这种移动由ATP水解为ADP及 磷酸来提供能量。
图5-11 细菌中肽链延伸的 第一步反应:进位
第二节 蛋白质生物合成的过程
图5-12 转肽
第二节 蛋白质生物合成的过程
图5-13 细菌中肽链延伸的第 三步反应:移位
第二节 蛋白质生物合成的过程
四、翻译的终止 翻译的最后一步涉及到肽酰-tRNA中连接tRNA和C端氨 基酸酯键的切断,这一过程需要终止和释放因子(RFs)。 核糖体与mRNA的解离还需要核糖体释放因子(RRF)的参 与。细胞中通常不含能识别3个终止密码子的tRNA。在大 肠杆菌中,当终止密码子进入核糖体上的A位点后,即被 释放因子识别。RF-1可识别UAA和UAG,RF-2识别UAA和UGA, RF-3有助于RF-1和RF-2的活性。释放因子使肽酰转移酶将 多肽链转至H2O分子而不是通常的氨酰-tRNA,释放出mRNA 并与核糖体亚基完全解离。当释放因子识别在A位点上的 终止密码子后,存在于大亚基上的肽酰转移酶专一活性转 变成了酯酶活性,以水解新生合成的肽链。原核生物蛋白 质合成中新生肽链的释放如图5-14所示。
第五章氨基酸、蛋白质提取工艺特性

逆流分配色谱
8.根据蛋白质受物理、化学等作用因素的 影响来纯化蛋白质。
固相化金属亲和层析IMAC是新发展的一种亲和层 析技术。蛋白质分子中的咪唑基和巯基可与一些金属 元素(如Cu2+,Zn2+)形成配位结合,使蛋白质得到分 离纯化。
6.根据蛋白质疏水基团与相应的载体基团结合来纯 化蛋白质
蛋白质上有疏水区,它们主要由酪氨酸、 亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸等非极 性的侧链密集在一起,并暴露于分子表面。这 些疏水区能够与吸附剂上的疏水性基团结合, 在通过降低介质的离子强度和极性等方法将蛋 白质洗脱下来。如疏水相互作用层析
(1)盐浓度:提取蛋白质的盐的浓度,一般 在0.02~0.2M的范围内。常用稀溶液和缓 冲液有0.02~0.05M磷酸缓冲液,0.09~ 0.15M氯化钠溶液。
(2)pH值:蛋白质和酶所用的提取液pH值 一般选择在被提取的蛋白质等电点两侧的 稳定区内。
(3)温度:蛋白质和酶一般都不耐热,所以 提取时通常要求低温操作。
二、蛋白质及酶的一般提取方法
1.水溶液提取 凡能溶于水、稀盐、稀酸或稀碱的 蛋白质或酶,一般都可用稀盐溶液或缓冲溶液进行 提取。稀盐溶液有利于稳定蛋白质结构和增加蛋白 质溶解度。加入的提取液的量要适当,加入量太少 提取不完全,加的量太多,则不利于浓缩,一般用 量为原材料3~6倍体积左右,可一次提取或分次提 取。提取时常缓慢搅拌,以提高提取效率。以盐溶 液或缓冲液提取蛋白质和酶时,常综合考虑下列因 素:
(1)浓盐或尿素等溶液提取 如NaClO4、尿素、肌 盐酸等溶液均有人应用于提取膜蛋白,当以上溶液 浓度达到2mol/L时,可提取27%以上的膜蛋白, 但使用这样条件易引起蛋白质和酶的变性。
高中生物第5章细胞的能量供应和利用考点大全笔记(带答案)

高中生物第5章细胞的能量供应和利用考点大全笔记单选题1、酵母菌以葡萄糖作为呼吸底物,放出的CO2体积随O2体积的变化曲线如下图所示。
下列叙述错误的是()A.a点有酒精和CO2的生成B.a、b、c三点均有CO2和水的生成C.b点酵母菌既进行了厌氧呼吸,又进行了需氧呼吸D.若c点酵母菌消耗O2的体积等于放出的CO2体积,则其只进行需氧呼吸答案:B分析:1 .酵母菌有氧呼吸的过程:①C6H12O6→2丙酮酸+4[H]+能量(细胞质基质)②2丙酮酸+6H2O→6CO2+ 20[H]+能量(线粒体基质)③24[H]+6O2→12H2O+能量(线粒体内膜)2 .酵母菌无氧呼吸的过程:①C6H12O6→2丙酮酸+4[H]+能量(细胞质基质)②2丙酮酸酶→酒精+2CO2(细胞质基质)A、a点时没有氧气,酵母菌只进行无氧呼吸,所以有酒精、CO2生成,A正确;B、a点酵母菌只进行无氧呼吸,所以没有水生成,B错误;C、b点时氧气浓度较低,此时酵母菌既进行了无氧呼吸又进行了有氧呼吸,C正确;D、因为酵母菌的无氧呼吸产生二氧化碳,若c点酵母菌消耗O2体积等于放出的CO2体积,则其只进行有氧呼吸,D正确。
故选B。
2、如图为植物光合作用强度随光照强度变化的坐标图,下列叙述中不正确的是()A.a点叶肉细胞产生ATP的细胞器只有线粒体B.b点植物的光合作用强度与细胞呼吸强度相等C.当植物缺镁时,b点将右移D.已知某植物光合作用和细胞呼吸的最适温度分别为25℃和30℃,如果该图表示该植物处于25℃环境中,则将温度提高到30℃时,a点上移,b点左移答案:Da点时光照强度为0,植物叶肉细胞只进行细胞呼吸,故产生ATP的细胞器只有线粒体,A项正确;b点时O2释放量为0,说明此时植物的光合作用强度和呼吸作用强度相等,B项正确;当植物缺镁时,叶绿素的合成受到影响,光合作用减弱,b点要增加光照强度,才能保证此时的光合作用强度等于细胞呼吸强度,故b点将向右移,C项正确;已知植物在25℃时光合作用强度最强,如果将温度提高到30℃,呼吸强度增加,光合作用强度下降,则a点将上移,b点将右移,D项错误。
2021年高中生物新教材人教版(2019)必修二教案:第5章 第1节 基因突变和基因重组 (含解析)
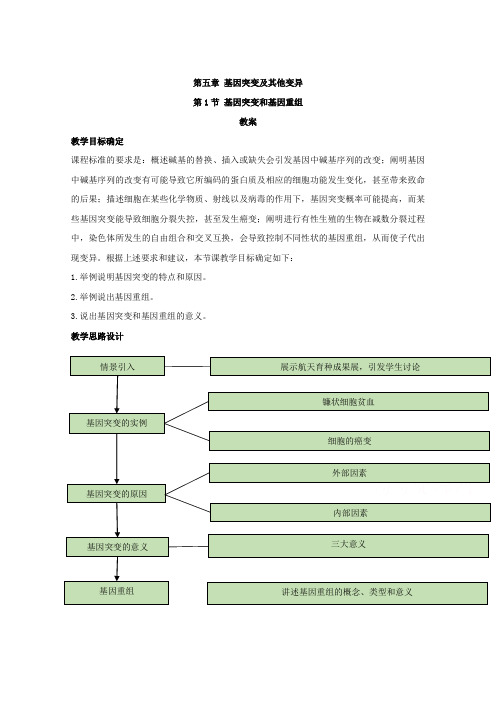
第五章 基因突变及其他变异第1节 基因突变和基因重组教案教学目标确定课程标准的要求是:概述碱基的替换、插入或缺失会引发基因中碱基序列的改变;阐明基因中碱基序列的改变有可能导致它所编码的蛋白质及相应的细胞功能发生变化,甚至带来致命的后果;描述细胞在某些化学物质、射线以及病毒的作用下,基因突变概率可能提高,而某些基因突变能导致细胞分裂失控,甚至发生癌变;阐明进行有性生殖的生物在减数分裂过程中,染色体所发生的自由组合和交叉互换,会导致控制不同性状的基因重组,从而使子代出现变异。
根据上述要求和建议,本节课教学目标确定如下:1.举例说明基因突变的特点和原因。
2.举例说出基因重组。
3.说出基因突变和基因重组的意义。
教学思路设计情景引入 基因突变的实例基因突变的原因 展示航天育种成果展,引发学生讨论 镰状细胞贫血基因突变的意义 三大意义 基因重组 讲述基因重组的概念、类型和意义 细胞的癌变 外部因素 内部因素基因(a)。
但是,每一个基因的突变,都不是没有任何限制的。
例如,小鼠毛色基因的突变能不能突变成毛的长短呢?(答:不能,只限定在色素的范围内,不会超出这个范围。
)基因突变的特点:①普遍性②随机性③低频性(突变率低)④多数有害性⑤不定向性四、基因突变的意义三大意义:新基因产生的途径,是生物变异的根本来源,是生物进化的原材料。
五、基因重组(一)基因重组的概念基因重组( gene recombination )就是指在生物体进行有性生殖的过程中,控制不同性状的基因的重新组合。
(二)基因重组的原因基因重组产生的根本原因主要有两方面,一方面是由于基因的自由组合,即控制两对或两对以上相对性状的等位基因,位于两对或两对以上同源染色体上,该生物个体在减数分裂形成配子时,非同源染色体上的非等位基因间的自由组合。
另一方面是由于位于同源染色体上的原来连锁在一条染色体的非等位基因,在减数分裂第一次分裂的前期,复制后的同源染色体联会后,非姐妹染色单体之间由于交叉而交换,基因也随着交换。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5) 结晶新方法
Nucleant 生物玻璃
晶体初步鉴定
偏光显微镜观察、染色、电泳等
3、衍射数据收集和处理
第三代同步辐射光源的应用使得用20-40 um大小的晶体解析高分辨率结构已经成为 现实 目前世界上比较著名的同步辐射工作站有 多个:APS(USA); ESRF(France); SPring-8(Japan)
第五章 蛋白质结构解析
测定蛋白质结构的意义
• 人体基因数目仅比低等生物线虫多两倍。 如此少的基因是如何创造出人体如此复杂 的生命活动? • 人体基因的主要功能是通过蛋白质来实现 的,蛋白质扮演着构筑生命大厦的主要角 色。人体中大约有10万种蛋白质。
蛋白质三维结构解析方法
X-射线晶体衍射法:85.3% 核磁共振波谱:14.7%
X射线本质
X射线是一种短波长(0.005~10nm)、 高能量(2.5×105 ~1.2×102eV)的电磁波。 它是原子内层电子在高速运动电子流冲 击下,产生跃迁而发射的电磁辐射。
A
一般由高速电子撞击金属产生。如图所示,是一种产生X 射线的真空管,K是发射电子的热阴极,A是由钼、钨或 铜等金属制成的阳极。两极之间加有数万伏特的高电压, 使电子流加速,向阳极A撞击而产生X射线。
图片出处: http://www.drg.de/data/wuerdig ungen/Nobelpreise/RoenNobel .htm
图片出处: /arc hive/gal/source/kendrew.html
肌红蛋白的三维结构模型
图片出处: http:// / archive/Kendrew62.html
同步辐射光源
上海同步辐射中心
晶体收集和储存
液氮气冷技术
4、位相求解
1. 分子置换法(MR) 2. 多对同晶型置换法(MIR) 3. 多波长反常散射法(MAD) 实验中经常联合使用
分子置换法(MR)
分子置换法就是把已知结构的蛋白质分子 放到待测蛋白质晶体的晶胞中建立起初始 结构模型并借助此模型计算待测蛋白质晶 体各个衍射点的相角的方法。
通过在待测结晶蛋白质溶液的体积、浓度 和组成固定的条件下,直接将不同量的饱 和沉淀剂加入未饱和的蛋白质溶液以产生 一个浓度梯度而使蛋白质在不同的过饱和 溶液中结晶。
(2)透析法( Dialysis )
利用半透膜允许小分子透过而大分子不能 透过的性质来调节蛋白质溶液的沉淀剂浓 度、pH或离子强度,从而使蛋白质溶液缓 慢形成过饱和状态以形成晶核。该法是培 养蛋白质晶体的常用方法。
血红蛋白的四级结构 模型
图片出处/structure/proteinstructure10.asp
血红蛋白分子就是由二个由141个氨基酸残基组成的α亚基和二个由146个氨基酸 残基组成的β亚基按特定的接触和排列组成的一个球状蛋白质分子,每个亚基中 各有一个含亚铁离子的血红素辅基。四个亚基间靠氢键和八个盐键维系着血红蛋 白分子严密的空间构象。
肌红蛋白的三维结构
图片出处: /Article/UploadFil es/200411121548876.jpg
1959年佩鲁茨 (Perute)完成血 红蛋白0.55分辨 率的晶体结构
图片出处:/webinfo/jiaoyanzujianshe/hua xue/zhuye/minrentang/1962.htm (1962)
由于测定出蛋白质的精细结构,两位英国科 学家M.F.佩鲁茨和J.C.肯德鲁获得1962年的诺 贝尔化学奖。
图片出处:/nobel/micro/46132.html
1997年,核小体八组蛋白结构
2004年,菠菜捕光复合物LHC-II
2005年,线粒体膜蛋白复合物2精细结构
X射线衍射测定蛋白和核酸精细结构,为新药设计提供了全新方向
中国科学家研制抗癌新药首获瑞典爱明诺夫奖
施一公抗癌抗乙肝病毒新药Birinapant,进入临床二期
蛋白质X射线晶体结构测定程序
1、样品制备 2、蛋白质结晶和晶体生长
3、衍射数据收集和处理
4、位相求解 5、模型建立和修正
核磁共振可以方便地在溶液中研究分子结构并且是唯一 可以使试样不经受任何破坏的结构分析方法。 目前核磁共振成象技术已能以活人为观察对象,扫描身 体中任何器官或组织的任何一个断面的核磁共振参数,成 为一种引人注目的癌症早期诊断技术。
核磁共振技术(NMR)
1 9 4 6 年 美 国 斯 坦 福 大 学 的 F.Bloch 和 哈 佛 大 学 的 E.M.Purcell两个研究小组首次独立观察到核磁共振现象, 为此他们两人获1952年诺贝尔物理奖。 1983 年,瑞士科学家 Kurt Wü thrich 教授实验室首次运用 核磁共振方法解析了胰高血糖素(glucagon)多肽的溶液构 象. 发明了利用核磁共振 (NMR) 技术测定溶液中生物大分子三维 结构的方法获得了2002年度诺贝尔化学奖 74岁的美国科学家保罗· 劳特布尔和70岁的英国科学家彼 得· 曼斯菲尔德为2003诺贝尔医学奖的得主
蛋白质结晶方法
(1)批量结晶法(Batch crystallization) (2)透析法( Dialysis ) (3) 液相扩散法(Liquid diffusion) (4) 气相扩散法(Vapour diffusion) (5) 蛋白质结晶新方法
(1)批量结晶法(Batch crystallization)
威廉· 康拉德· 伦琴 Wilhelm Conrad Rö ntgen
1901年第一届诺贝尔物理学奖评选时, 29封推荐信中就有17封集中推荐他。伦 琴最终获得了第一次诺贝尔物理学奖金
诺贝尔物理奖奖章
图片出处/gxxyd/sjet/jingdian/nobel/medal01.htm
一个重原子衍生物作为母体,用一个晶体
就可以收集到重原子反常散射吸收边两侧
的多套数据,并解出结构。
5、模型建立和修正
晶体学R因子一般要求达到0.2以下
键长偏差大约为0.015Å
键角偏差约为3°
二面角构象分布要求除了甘氨酸的二面角 构象是随机的外,其他残基的二面角构象 分布受到立体化学的限制
(3) 液相扩散法(Liquid diffusion)
利用液相平衡原理而设计的。由于蛋白质在 不同溶液中的溶解度不同,把待结晶蛋白质 溶液缓慢加入溶解性差异大的溶剂中,在界
面处形成沉淀剂浓度梯度在局部达到瞬间过
饱和,从而促使晶核形成。
(4) 气相扩散法(Vapour diffusion)
把待结晶蛋白质、高于此蛋白质结晶所需盐 浓度的溶液和低于这种浓度的盐溶液放在一 个密闭体系内,两种浓度不同的溶液由于发 生蒸汽扩散最后达到平衡,随着溶液中沉淀 剂浓度的增加蛋白质溶解性降低,从而蛋白 质达到过饱和而析出晶体。
亨利· 布拉格(Henry Bragg) 劳伦斯· 布拉格( Lawrence Bragg)
图片出处http://202.202.4.150/nobel/nobel1.htm
图片出处
/physics/laureates/1915/wl-braggbio.html
伦琴实验室
图片出处: /viewthread.php?tid=4758
人类第一张X光照片
伦琴妻子之手
图片出处:/yxxt/jindai/xgjsy/xgjsy.htm
1896年1月23日伦 琴将这一重大发现在维 尔兹堡物理医学会上报 告。Kolliker教授提议 将该射线命名为“伦琴 射线”,但伦琴却说: “我还没有彻底解释这 种射线的发生现象,还 是称它为X射线最恰 当。”
X-射线晶体结构分析基本原理
X射线衍射分析所依赖的基本原理是X射线衍射现象 X射线衍射现象利用X射线的波长和晶体中原子的大小及
原子间距同数量级的特性来分析晶体结构。
当X射线入射到样品晶体分子上时,分子上的每个原子使 X射线发生散射,这些散射波之间相互叠加形成衍射图形。 衍射图形能给出样品内部结构的许多资料,如原子间的 距离、键角,分子的立体结构、绝对构型、原子和分子
X射线衍射
1912年Max von Laue发现X射线具有衍 射的现象。(1914年的诺贝尔物理学奖)
图片出处:
/nobel/netshow/nobelscience/phys ics/physics03.htm
劳厄的实验装置
图片出处:/wuli/optics/ch2/page/ch51.htm
电镜三维重构、各种光谱技术、显微
技术和计算机模拟
蛋白质三维结构解析过程
第一节 X-射线衍射测定蛋白质结构
1895年11月8日 ,德国物 理学家,50岁的伦琴在 自己的实验室中偶然发 现 一种从阴极射线管 中辐射出的新型射线, 由于对管子发出的“东 西”性质不确定,伦琴 就把这种射线命名为 “X射线” 。
的堆积、有序或无序的排列等。
X射线通过红宝石晶体(a)和硅单晶体(b)所拍摄的劳厄斑
图片出处:/wuli/optics/ch2/page/ch51.htm
因在用X射线研究晶体结构方面所作出的杰出贡 献 ,亨利· 布拉格(William Henry Bragg)和劳伦 斯· 布拉格(William Lawrence Bragg)父子分享了 1915年的诺贝尔物理学奖。
多对同晶型置换法(MIR)
在蛋白质晶体中引入散射能力强的重金属 原子如Pb和Hg等作为标志原子,制备出重 原子的衍生物,然后求出这些重原子在晶 胞中的坐标,根据坐标计算出重原子散射 波在各个衍射点的相角,最后推测出蛋白 质分子在各个衍射中的位相。
多波长反常散射法(MAD)
利用同步辐射波长连续可变的特点,使用
X-Ray晶体衍射目前仍然是蛋白质三维结构测定的 主要方法 优点:分辨率高,能精确确定生物大分子中各原子 的坐标、键长、键角,给出生物大分子的分子结构和 构型,确定活性中心的位置和结构 缺点:只能测定单晶,反映静态结构信息,无法测 定溶液中的信息
