肿瘤坏死因子受体抗体融合蛋白说明书
重组人二型肿瘤坏死因子受体抗体融合蛋白

重组人二型肿瘤坏死因子受体抗体融合蛋白《重组人二型肿瘤坏死因子受体抗体融合蛋白的全面评估与应用》一、引言重组人二型肿瘤坏死因子受体抗体融合蛋白是一种具有重要生物学功能和临床应用前景的蛋白质。
它能够调节免疫系统、抑制炎症反应、治疗自身免疫性疾病及恶性肿瘤等。
二、重组人二型肿瘤坏死因子受体抗体融合蛋白的基本概念1. 重组蛋白的定义和特点重组蛋白是指通过基因工程技术在细菌、酵母、哺乳动物细胞或植物等表达系统中合成的人工蛋白质。
重组蛋白具有高纯度、规模化制备和定制化修改等特点,可用于医疗、制药和科研领域。
2. 二型肿瘤坏死因子受体抗体及其生物学功能二型肿瘤坏死因子(TNF)是一种重要的炎症介质,在免疫应答和炎症过程中发挥重要作用。
抑制TNF的生物学效应对于治疗炎症性疾病具有重要意义。
二型肿瘤坏死因子受体抗体融合蛋白即是通过将TNF 受体与抗体片段融合而成的蛋白,能够充分发挥抗TNF生物活性。
三、重组人二型肿瘤坏死因子受体抗体融合蛋白的研究进展1. 临床应用进展通过对重组人二型肿瘤坏死因子受体抗体融合蛋白临床试验和治疗研究的回顾和总结,可以了解其在治疗类风湿性关节炎、克罗恩病和银屑病等疾病中的疗效和安全性。
2. 机制研究进展通过深入探讨重组人二型肿瘤坏死因子受体抗体融合蛋白对炎症反应的调节机制、信号转导途径和抗肿瘤作用等方面的研究,可以更好地理解其作用机制和生物学效应。
四、重组人二型肿瘤坏死因子受体抗体融合蛋白的应用前景在这一部分,我想结合重组人二型肿瘤坏死因子受体抗体融合蛋白的研究进展,对其在免疫调节、炎症治疗和抗肿瘤治疗等方面的应用前景进行探讨。
五、结语通过本文对重组人二型肿瘤坏死因子受体抗体融合蛋白的全面评估和应用前景的讨论,相信能够更好地促进其在临床医学和科研领域的应用,为疾病治疗和健康保障做出更大的贡献。
个人观点:重组人二型肿瘤坏死因子受体抗体融合蛋白作为一种新型生物药物,具有巨大的应用潜力和市场前景。
注射用重组人ⅱ型肿瘤坏死因子受体-抗体融合蛋白生产流程-概述说明以及解释

注射用重组人ⅱ型肿瘤坏死因子受体-抗体融合蛋白生产流程-概述说明以及解释1.引言1.1 概述概述部分的内容可以如下所写:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一种新型生物药物,它是人工合成的蛋白质,结合了Ⅱ型肿瘤坏死因子受体和特定抗体的功能。
该融合蛋白具有双重作用机制,既能够诱导肿瘤细胞凋亡,又能够抑制炎症反应,因此具有广泛的应用前景。
本文将介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程。
通过详细描述该生产流程,我们可以了解到如何在实验室中利用细胞工程技术和基因重组技术制备该融合蛋白。
这些技术的应用为注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的大规模生产提供了有力的支持。
在接下来的章节中,我们将详细介绍该蛋白的生产流程,并探讨其优势和应用前景。
通过阐明生产流程的具体步骤和技术要点,希望能够为相关领域的科研人员提供帮助和启示。
最后,我们将对注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的展望进行展开,探讨其未来的发展方向和潜在的临床应用前景。
总之,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程是一个复杂且精密的过程,其中涉及到细胞培养、基因重组、蛋白纯化等多个环节。
对于了解该蛋白的生产方式和相关技术具有重要的意义,这也为该蛋白的研究和应用提供了一定的指导和依据。
希望本文的介绍能够为读者提供清晰的概述,引起广大科研人员对此领域的关注和兴趣。
1.2文章结构文章结构:本文将从以下几个方面介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程。
首先,我们将简要概述本文的研究内容和目的。
接着,我们将详细介绍重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的基础知识和其在医学领域中的重要性。
随后,我们将着重介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程,包括关键技术和操作步骤。
最后,我们将总结该生产流程的优势和应用前景,展望注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白在未来的发展方向和应用领域。
注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白 说明书

注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白商品名注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白 25mg 通用名注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白规格25mg批准文号S2*******成分每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(rhTNFR:Fc)1 2.5毫克或25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
性状本品为白色冻干粉针剂,加水溶解后溶液为无色或微带黄色的澄清、透明液体。
适应症用于治疗:1. 中度及重度活动性类风湿关节炎;2. 18岁及18岁以上成人中度至重度斑块状银屑病;3. 活动性强直性脊柱炎。
用法用量成人推荐剂量为每次25mg,皮下注射,每周二次。
注射前用1毫升注射用水溶解,溶解后可冷藏72小时。
不良反应常见不良反应是注射部位局部反应,包括轻至中度红斑、搔痒、疼痛和肿胀等,注射部位反应通常发生在开始治疗的第一个月内,在随后的治疗中发生频率降低。
注射部位反应平均持续3-5天。
在临床试验出现的其它不良事件包括头痛、眩晕、皮疹、咳嗽、腹痛、淋巴细胞增多白细胞减少、中性粒细胞减少、鼻炎、发热、关节酸痛、肌肉酸痛、困倦、面部肿胀、面部过敏、肝功能异常、肾结石、左肺纤维化等。
据国外文献报道,同类产品的不良反应还有如下报道,这些不良反应在本品的使用中也可能发生:感染最常见的感染是上呼吸道感染。
在安慰剂对照试验中,没有观察到严重感染的发生率有显著升高(安慰剂和重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组的发生率都约为1%)。
在所有临床试验中,RA患者中发生的严重感染有:肾盂肾炎,支气管炎,化脓性关节炎,腹部脓肿,蜂窝组织炎,骨髓炎,伤口感染,肺炎,足脓肿,腿部溃疡,腹泻,鼻窦炎和败血症。
开放性试验中严重感染的发生率和对照试验中的发生率比较也基本相似。
在上市后的应用中,严重感染包括败血症和死亡都有报道。
有些发生在开始使用后几周内。
人肿瘤坏死因子α(TNF-α)说明书
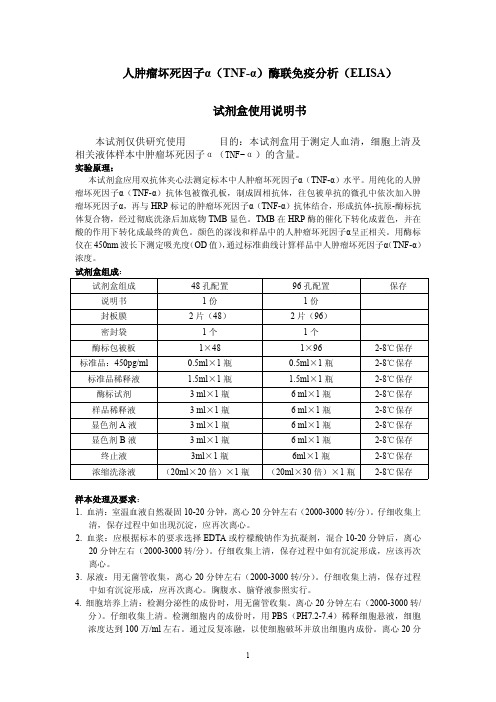
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
几种特殊注射用制剂的配制及注射方法

几种特殊注射用制剂的配制及注射方法郝明非(北医三院门诊注射室)有些注射用制剂在配制和给药时有特殊要求,如操作不当,可对患者造成损害或导致经济损失(这些药物单价均较高)。
现将我院使用的几种特殊注射剂型的用法进行介绍,供参考。
1.注射用重组人II型肿瘤坏死因子受体抗体融合蛋白(益赛普)为白色冻干粉针剂,注射前用1ml灭菌注射用水溶解。
配制时药瓶放置于桌面,瓶口朝上。
使用1ml注射器,垂直于桌面进针,注入灭菌注射用水。
药瓶不离开桌面,轻轻地顺时针画圆(始终朝一个方向),不可以用力摇震药液。
待药粉全部溶解,瓶中为清亮溶液。
倒转瓶口向下,抽吸药液。
于上臂45°进针,皮下注射。
2. 注射用曲普瑞林(达菲林)白色冻干物或粉末。
本品仅可肌内注射,用药盒内提供的溶剂复溶药物粉末,复溶后立即注射。
复溶后得到的悬浮液不得与其它药品混合。
复溶操作:药瓶放置于桌面,瓶口始终朝上,垂直于桌面进针,注入药液,药瓶不离开桌面,轻轻地顺时针画圆(始终朝一个方向),不可以用力摇震药液(破坏颗粒,不能起到缓释作用),瓶口继续朝上,不可以反转药瓶抽吸药液(药液会剩余),针头向下垂直抽药,药物剂量要精确,不得有剩余药物,更换针头后,肌肉注射,快推药液。
药物剂量如不精确(未抽吸干净药液),要及时记录。
3. 那屈肝素钙注射液(速碧林)患者取卧位,注射部位为前外侧或后外侧腹壁的皮下脂肪组织内,左右侧交替。
注射时,不用排气,一手持续捏起皮肤形成皱褶,不要松手;另一手持针,注射针垂直刺入皮肤皱褶。
不用抽回血,直接推药。
注射结束后,方可松手。
4. 醋酸戈舍瑞林缓释植入剂(诺雷德)预充于一次性注射器中,脐下腹前壁皮下注射。
用时打开包装,将红色安全卡拉出,丢弃。
去除针帽。
不需排气,一手持续捏起皮肤,不要松手;另一手持针,针头斜面向上,30-45。
进针。
不用抽回血,直接推药,完全推入会听到“咔哒”一声,针头会自动弹出并进入防护套中。
压迫5分钟。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(强克)说明书(完整版)

注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白使用说明书【药品名称】通用名:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白商品名:强克英文名:Recombinant Human TNF Receptor-Ig Fusion Protein for Injection汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti -Kangti Ronghedanbai【性状】本品为无菌白色冻干粉针剂。
【主要成分】每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
【药理毒理】1.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包含人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部分与人IgG1的Fc片段,包含934个氨基酸,表观分子量约为150K道尔顿(KDa)。
TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反应。
在强直性脊柱炎关节病变的炎症反应中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
2.毒理小鼠急性毒性试验结果显示,静脉注射1.09g/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反应。
猴长期毒性试验结果显示,每周2次连续皮下注射180天15.0 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
【药代动力学】32名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时间曲线在12.5mg、25mg、37.5 mg、50mg剂量范围内与剂量呈正比例增高。
注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白(强克)说明书

注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白利用说明书【药品名称】通用名:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白商品名:强克英文名:Recombinant Human TNF Receptor-Ig Fusion Protein for Injection汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti -Kangti Ronghedanbai【性状】本品为无菌白色冻干粉针剂。
【要紧成份】每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷毫克。
用1毫升灭菌注射用水溶解。
【药理毒理】1.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包括人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部份与人IgG1的Fc片段,包括934个氨基酸,表观分子量约为150K道尔顿(KDa)。
TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反映。
在强直性脊柱炎关节病变的炎症反映中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
2.毒理小鼠急性毒性实验结果显示,静脉注射kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反映。
猴长期毒性实验结果显示,每周2次持续皮下注射180天 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
【药代动力学】32名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时刻曲线在、25mg、 mg、50mg剂量范围内与剂量呈正比例增高。
肿瘤坏死因子受体-抗体融合蛋白对佐剂性关节炎大鼠滑膜中TNF-α、TG

重组人二型肿瘤坏死因子受体抗体融合蛋白

【重组人二型肿瘤坏死因子受体抗体融合蛋白的深度与广度】一、引言在当下医学领域,重组人二型肿瘤坏死因子受体抗体融合蛋白备受关注。
它是一种以融合蛋白形式存在的生物制剂,具有独特的生物学特性和药理学效应,对于一些自身免疫性疾病的治疗发挥着重要作用。
本文将从深度与广度两方面对重组人二型肿瘤坏死因子受体抗体融合蛋白进行全面评估,并撰写一篇有价值的文章。
二、深度探讨1. 重组人二型肿瘤坏死因子受体抗体融合蛋白的定义和结构重组人二型肿瘤坏死因子受体抗体融合蛋白,是一种由人类肿瘤坏死因子受体(TNFR)结合部分和人类IgG1型Fc段组成的融合蛋白,在体外表现出对肿瘤坏死因子α(TNF-α)的高亲和力和中和效应。
其独特的结构决定了其在临床应用中的独特效应。
2. 重组人二型肿瘤坏死因子受体抗体融合蛋白的药理学作用重组人二型肿瘤坏死因子受体抗体融合蛋白能够与游离态和细胞膜结合型TNF-α结合,从而中和其生物活性,对于多种自身免疫性疾病如类风湿关节炎、克罗恩病等具有显著的治疗作用。
其独特的药理学作用机制值得我们深入了解和探讨。
3. 重组人二型肿瘤坏死因子受体抗体融合蛋白在临床应用中的研究和进展近年来,针对重组人二型肿瘤坏死因子受体抗体融合蛋白的临床应用逐渐扩展,不仅在自身免疫性疾病领域取得了显著成效,同时在其他疾病的治疗中也表现出潜在的效果,对于其临床应用的进展我们需要更全面地了解。
三、广度分析1. 重组人二型肿瘤坏死因子受体抗体融合蛋白与自身免疫性疾病作为一种新型生物制剂,重组人二型肿瘤坏死因子受体抗体融合蛋白在自身免疫性疾病的治疗中具有独特的优势,并在类风湿关节炎、克罗恩病等疾病的治疗中表现出良好的疗效。
对其在自身免疫性疾病治疗中的应用我们可以进行更广泛的探讨和分析。
2. 重组人二型肿瘤坏死因子受体抗体融合蛋白在其他疾病中的应用前景除了自身免疫性疾病外,重组人二型肿瘤坏死因子受体抗体融合蛋白在一些其他疾病的治疗中也展现出了积极的作用。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗强直性脊柱炎的减量探索

so dli A ) Me o s I -ers d , r -i t ai t wt c v Sw r i ddit A adB pn yis( S . t d na1 a t y f t eg t ns i at eA eedv e o n t h y u oy h p e h i i n
益赛 普重新调 回前一个剂量 , 并于下次复查时评估 以确定益赛普的剂量 。A组患者 同时接受柳氮磺吡 啶 (s) s z 口服治疗 , 初始剂量为 0 2 d 第 2周增 至 05bd 第 3周增至 0 7 i, 4周增至 10bd维持 . 5t , i . i , . 5bd 第 . i 至第 2 4周 。结果 两组患者前 2个月均使用推荐剂量 的益赛 普即 2 g每周 2次皮下注 射 , 取得令 5m 均 人满意的疗效 , 起效快 , 缓解 率高 , 间差别无统 计学 意义。病情获 得缓解 的病例从 第 3个 月起减 量 至 组
m r hu ao g ,h it o i l t ce i e nvrt, i e 6 0 0 C i etfR em to y TeFr s t t hdt Xa nU i sy Xa n3 10 , hn io l sH p a A a o m ei m a
【 b rc】 O jcv T p r aeooi adeeter i e o prh o g o r A s at t bet e o xl e c mc n fcv e m no hwt t e t ds e fe i e o n i g f oa e a -
go p n o i d A l f h m rc i dtet a e t f ne t gr T F - c I ial to 5 mg ̄T F - c ru sr d m z . l o e e e e t n jc n N R F . n i y ok 2 a e t e v h r m oi i h tl N R F
人肿瘤坏死因子α(TNF-α)英文说明书

Human TNF-αFOR RESEARCH USE ONLYAssay range::::20 ng/L -400 ng/L 96determinationsPurposeThis kit allows for the determination of TNF-α concentrations in Human serum, cell culture supernates and other biological fluidsPrinciple of the assayThe kit assay Human TNF-α level in the sample, use Purified Human TNF-α antibody to coat microtiter plate wells, make solid-phase antibody, then add TNF-α to wells, Combined TNF-α antibody which With HRP labeled, become antibody - antigen - enzyme-antibody complex, after washing Completely, Add TMB substrate solution, TMB substrate becomes blue color At HRP enzyme-catalyzed, reaction is terminated by the addition of a sulphuric acid solution and the color change is measured spectrophotometrically at a wavelength of 450 nm. The concentration of Human TNF-α in the samples is then determined by comparing the O.D. of the samples to the standard curve.Materials provided with the kit1 wash solution 20ml×1bottle 7 Stop Solution 6ml×1 bottle2 HRP-Conjugate reagent 6ml×1 bottle 8 Standard(800ng/L)0.5ml×1 bottle3 Microelisa stripplate 12well×8strips 9 Standard diluent 1.5ml×1bottle4 Sample diluent 6ml×1 bottle 10 Instruction 15 Chromogen Solution A 6ml×1 bottle 11 Closure plate membrane26 Chromogen Solution B 6ml×1 bottle 12 Sealed bags 1Specimen requirements1. extract as soon as possible after Specimen collection,and according to the relevantliterature, and should be experiment as soon as possible after the extraction. If it can’t,specimen can be kept in -20 ℃to preserve, Avoid repeated freeze-thaw cycles.2. Can’t detect the sample which contain NaN3, because NaN3 inhibits HRP active.Assay procedure1. Dilute and add sample:Dilute Original density Standard as follow table:400 ng/L 5 Standard 150µl Original density Standard+150µl Standard diluent200 ng/L 4 Standard 150µl 5 Standard+150µl Standard diluent100 ng/L 3 Standard 150µl 4 Standard+150µl Standard diluent50 ng/L 2 Standard 150µl 3 Standard +150µl Standard diluent25 ng/L 1 Standard 150µl 2 Standard +150µl Standard diluent2.add sample: Set blank wells separately (blank comparison wells don’t add sample andHRP-Conjugate reagent, other each step operation is same). testing sample well. add Sample dilution 40µl to testing sample well, then add testing sample 10µl (sample final dilution is5-fold), add sample to wells , don’t touch the well wall as far as possible, and Gently mix.3.Incubate: After closing plate with Closure plate membrane ,incubate for 30 min at 37℃.4.Configurate liquid: 30-fold(or 20-fold) wash solution diluted 30-fold (or 20-fold) with distilled water and reserve.5.Washing: Uncover Closure plate membrane, discard Liquid, dry by swing, add washing buffer to every well, still for 30s then drain, repeat 5 times, dry by pat.6. Add enzyme: Add HRP-Conjugate reagent 50µl to each well, except blank well.7. Incubate: Operation with 3.8. Washing: Operation with 5.9.Color: Add Chromogen Solution A 50ul and Chromogen Solution B to each well, evade the light preservation for 15 min at 37℃10.Stop the reaction:Add Stop Solution50µl to each well, Stop the reaction(the blue colorchange to yellow color).11. Assay:take blank well as zero , Read absorbance at 450nm after Adding Stop Solution andwithin 15min.。
益赛普
C(ng/ml)
2000 1500 1000 500 0 0 500 T(h) 1000 1500
特殊人群的药代动力学
• 儿童: – 血清浓度曲线特性与成年患者相似 • 老人: – 年龄在65 至87 岁病人的清除率及数量,与年龄低 于65 岁的病人相近。
• 肝肾功能损害者: – 15例肾功衰,9例肝衰,药代动力学无改变
关节病和脑血管病是我国肢体致残的两大主要原因
关节病中类风湿关节炎的致残率高居首位
巨大的医疗及社会负担并未在国内引起足够的重视
《类风湿关节炎在我国的低认知度和高致残率不容忽视》 中华医学杂志2009年89卷第27期
RA治疗目标
完全缓解
临床缓解
影像学缓解
RA治疗理念和方法
病情完全缓解 生活质量改善
疾病活动度
• DAS28 ≤ 3.2 --- 低活动度 • DAS28 > 3.2 - 5.1 --- 中活动度 • DAS28 > 5.1 --- 高活动度
RA预后不良的主要因素
• 功能障碍 (HAQ残疾指数)
•
关节外表现
-- 血管炎、干燥综合征、RA肺部病变等
• •
类风湿因子/抗CCP抗体阳性 影像学骨侵蚀
Etanercept • 结构:Ⅱ型TNF受体P75的细胞外部分和 人IgG1的Fc段形成的融合蛋白 • 特征:肿瘤坏死因子(TNF)拮抗剂 – 可溶性TNF受体
– 全人化
可溶性TNF受体
• 可溶性受体和TNF结合后,不会产生信号传递作用
• 与免疫细胞表面的跨膜受体竞争,是TNF的强抑制剂
• 天然的可溶性受体在体内的半衰期很短
注射部位
• 大腿、腹部(肚脐周围)、上臂是经常注射用部位
牛肿瘤坏死因子β(TNFβ)ELISA kit试剂盒说明书

牛肿瘤坏死因子β(TNFβ)ELISA kit试剂盒说明书试剂盒:ELISA试剂盒、检测试剂盒、免疫组化试剂盒、放免试剂盒、分子生物学试剂盒、金标检测试剂盒、Omega试剂盒、细胞凋亡试剂盒、生化试剂盒。
各种动物血清:内皮细胞专用血清、Hyclone、GIBCO胎牛血清。
抗体:进口原装抗体、进口分装抗体、单克隆抗体、多克隆抗体、单标抗体、双标抗体、多标抗体、一抗、二抗;免疫组化抗体、免疫荧光抗体、流式细胞抗体、免疫细胞化学抗体。
细胞:原装进口细胞、肿瘤细胞、正常细胞、肿瘤耐药细胞。
耗材:细胞培养耗材、普通实验耗材。
生化试剂:原装进口生化试剂、进口分装生化试剂。
牛肿瘤坏死因子β(TNFβ)ELISA kit试剂盒说明书规格型号:96T/48T,来源:elisa酶联免疫试剂盒(进口分装),产品别名:人内分泌腺来源的血管内皮生长因子酶联免疫试剂盒、人内分泌腺来源的血管内皮生长因子elisa酶联免疫试剂盒用途:用于测定兔血清、血浆、组织及相关液体样本中的含量或活性。
种属:人、大鼠、小鼠、豚鼠、兔子、猪犬、牛羊、鸡鸭、植物ELISA试剂盒等试剂盒操作:牛肿瘤坏死因子β(TNFβ)ELISA kit试剂盒说明书测定的血清标本宜为新鲜采集;如不能立即测定,5天内测定的血清标本可存放于4℃,1周后测定的血清标本应低温冻存;冻存后融解的标本,蛋白质局部浓缩,分布不均,应充分混合后再测定,但混匀时应轻柔,不可强烈振荡。
标本凝集不全在没有促凝剂和抗凝剂存在的情况下,正常血液采集后1/2~2h开始凝固,18~24h完全凝固。
临床检验工作中,有时为了争取时间快速检测,常在血液还未开始凝固时即强行离心分离血清,此时的血清中仍残留部分纤维蛋白原,在牛肿瘤坏死因子β(TNFβ)ELISA kit试剂盒说明书测定过程中可以形成肉眼可见的纤维蛋白块,易造成假阳性结果;这类情况于次日复查时因血凝已完全,血清中不再有纤维蛋白原存在,故复查结果变为阴性。
免疫科用药说明书

风湿免疫疾病常用药物1.非甾体抗炎药双氯芬酸钠(扶他林)75mg/片,75mg,po,qd~bid美洛昔康(莫比可)7.5mg/片,7.5mg~15mg,po,qd~bid塞来昔布(西乐葆)100mg/粒,100mg~200mg,po,qd~bid洛索洛芬(乐松)60mg/片,60mg,po,qd~bid2.慢作用抗风湿药2.1甲氨蝶呤(MTX)2.5mg/片用法:5~15mg,口服,每周1次,最大剂量不超过20mg/w,用药3~12w起效。
药理作用:本药为二氢叶酸还原酶抑制剂,可抑制细胞增殖和复制,修复骨破坏,是目前治疗RA的首选药物之一。
MTX具有抑制白细胞趋化作用,因而有直接抗炎作用。
小剂量叶酸或亚叶酸与MTX同时使用,可减少MTX的毒副作用而不影响疗效。
2.2柳氮磺吡啶(维柳芬)(SSZ/SASP)0.25g/片,0.25g,po,qd2.3来氟米特(爱若华、妥抒)(LEF)10mg/片,10mg~20mg,po,qd2.4羟氯喹(纷乐)(HCQ)0.1g/片,0.1g~0.2g,po,bid2.5沙利度胺(反应停)25mg/片用法:自身免疫性疾病:75mg~100mg,po,qn,从小剂量开始;用于其嗜睡的副作用,可用于改善患者由于使用激素后导致的兴奋失眠。
2.6硫唑嘌呤(依木兰)(AZA)50mg/片用法:起始剂量2~2.5mg/(kg。
d),起效后减至50mg,qd维持。
2.7环磷酰胺(CTX)50mg/片用法:一般50mg~100mg,po,qd;针剂根据具体情况使用,静脉冲击疗法0.75~1.0g/m2体表面积。
2.8环孢素A(新赛斯平)(CSA)25mg/粒用法:剂量依病人情况而定,一般可按照2.5~5mg/(kg.d)2.9吗替麦考酚酯(骁悉、赛可平)(MMF)0.25g/片适应证:主要用于狼疮性肾炎的治疗。
用法:诱导期:1.5~2.0g/d,东方人耐受量较西方人低,一般选用小剂量,使用至少3个月;维持期:0.5g/d,使用3年。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(强克)说明书

注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白使用说明书【药品名称】通用名:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白商品名:强克英文名:Recombinant Human TNF Receptor-Ig Fusion Protein for Injection汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti -Kangti Ronghedanbai【性状】本品为无菌白色冻干粉针剂。
【主要成分】每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
【药理毒理】1.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包含人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部分与人IgG1的Fc片段,包含934个氨基酸,表观分子量约为150K道尔顿(KDa)。
TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反应。
在强直性脊柱炎关节病变的炎症反应中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
2.毒理小鼠急性毒性试验结果显示,静脉注射1.09g/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反应。
猴长期毒性试验结果显示,每周2次连续皮下注射180天15.0 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
【药代动力学】32名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时间曲线在12.5mg、25mg、37.5 mg、50mg剂量范围内与剂量呈正比例增高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肿瘤坏死因子受体抗体融合蛋白说明书
一、产品概述
肿瘤坏死因子受体抗体融合蛋白(Tumor Necrosis Factor Receptor Antibody Fusion Protein,简称TNFR-Ab)是一种由人源化的单克
隆抗体和人TNF受体Ⅱ结合部分融合而成的重组蛋白。
该产品具有高亲和力、高特异性和高效力,可用于治疗多种炎症性疾病。
二、性能特点
1. 高亲和力:TNFR-Ab与人TNF受体Ⅱ结合部分具有极高的亲和力,能够有效地中和TNF-α。
2. 高特异性:TNFR-Ab仅与人TNF受体Ⅱ结合部分相互作用,不与
其他细胞或蛋白质发生反应。
3. 高效力:TNFR-Ab可迅速中和过量的TNF-α,从而减轻炎症反应
并促进组织修复。
4. 安全性好:经过严格的质量控制和安全性评估,无明显毒副作用。
三、适用范围
1. 适用于风湿性关节炎、强直性脊柱炎、系统性红斑狼疮等自身免疫性疾病的治疗。
2. 适用于严重感染、急性肝衰竭、急性胰腺炎等临床情况中的细胞因子风暴治疗。
3. 适用于肿瘤、心肌梗死、脑卒中等组织缺血再灌注损伤的治疗。
四、使用方法
1. TNFR-Ab为注射剂,仅限医务人员使用。
2. 治疗剂量和时间应根据患者的具体情况和临床需要进行调整,建议在医生指导下使用。
3. TNFR-Ab可通过静脉注射或皮下注射进行给药,建议采用静脉注射方式。
4. TNFR-Ab应在无菌条件下制备和使用,避免受到污染和交叉感染。
五、注意事项
1. 本品为生物制品,需存放在2-8℃的冰箱内保存,并避免震动和光线直接照射。
2. 使用前请检查包装是否完整,如有损坏请勿使用。
3. 使用过程中应注意消毒和防护措施,避免交叉感染。
4. TNFR-Ab可能会引起过敏反应,如出现过敏症状应立即停止使用并进行相应的处理。
5. TNFR-Ab可能会影响免疫系统的功能,使用前请咨询医生并进行必要的检查。
六、不良反应
1. 可能引起过敏反应,表现为皮肤瘙痒、红斑、荨麻疹等。
2. 可能影响免疫系统的功能,表现为发热、淋巴结肿大等。
3. 长期使用可能会导致感染和其他不良反应,如恶心、呕吐等。
七、贮存期限
本品贮存期限为24个月。
开封后请尽快使用,并在2-8℃的冰箱内保存。
开封后不可重复使用。
八、包装规格
TNFR-Ab提供1ml/支或5ml/支注射剂。
每支注射剂均配有单次使用的注射器和针头。
