肿瘤坏死因子α
小鼠肿瘤坏死因子α(TNF-α)说明书
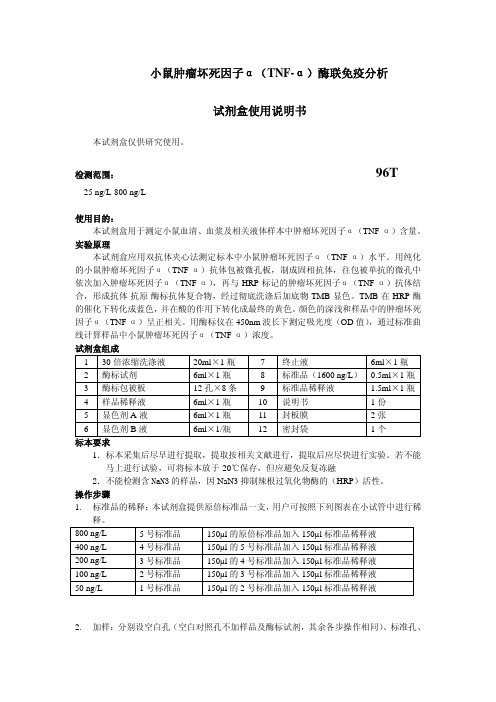
200 ng/L
3 号标准品
150µl 的 4 号标准品加入 150µl 标准品稀释液
100 ng/L
2 号标准品
150µl 的 3 号标准品加入 150µl 标准品稀释液
50 ng/L
1 号标准品
150µl 的 2 号标准品加入 150µl 标准品稀释液
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
计算 以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的
OD 值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与 OD 值计算出标
准曲线的直线回归方程式,将样品的 OD 值代入方程式,计算出样品浓度,再乘以稀释倍数, 即为样品的实际浓度。 注意事项 1.试剂盒从冷藏环境中取出应在室温平衡 15-30 分钟后方可使用,酶标包被板开封后如未
用完,板条应装入密封袋中保存。 2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。 3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
控制在 5 分钟内,如标本数量多,推荐使用排枪加样。 4. 请每次测定的同时做标准曲线,最好做复孔。如标本中待测物质含量过高(样本 OD 值
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计 算时请最后乘以总稀释倍数(×n×5)。 5. 封板膜只限一次性使用,以避免交叉污染。 6.底物请避光保存。 7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准. 8.所有样品,洗涤液和各种废弃物都应按传染物处理。 9.本试剂不同批号组分不得混用。 10. 如与英文说明书有异,以英文说明书为准。 保存条件及有效期 1.试剂盒保存:;2-8℃。 2.有效期:6 个月
肿瘤坏死因子—α在帕金森发病中作用

肿瘤坏死因子—α在帕金森发病中作用作者:徐秀芝宁海波林黎明来源:《中国保健营养·中旬刊》2013年第11期【中图分类号】R542 【文献标识码】A 【文章编号】1004—7484(2013)11—0137—01近年肿瘤坏死因子( TNF) -α 越来越被人们认识和重视,证据表明,肿瘤坏死因子( TNF)–α通过诱导核转录因子-κB ( NF-κB)参与帕金森的发病过程。
本文就 TNF-α在帕金森发病中的机制和作用进行综述。
1 TNF 作用TNF 是一种效性多样,调节细胞的增殖、凋亡的单核细胞因子,参与免疫反应、病毒复制、过敏反应和自身免疫等过程。
人的TNF-α基因长约2.76kb,均有4个外显子和3个内含子组成1。
TNF分为TNF-α和TNF-β,TNF受体分两型Ⅰ型TNF-R和Ⅱ型TNF-R。
Ⅰ型TNF-R参与溶细胞活性Ⅱ型TNF-R 参与信号传递和T细胞增殖。
TNF-α 主要由单核巨噬细胞产生,淋巴细胞、枯否氏细胞也能产生,通过特异性细胞膜连接受体发挥作用,具有促进炎症反应和细胞凋亡的作用2。
其作用机制不清可能有以下几方面 1直接杀伤作用:TNF-α与受体结合,靶细胞对其识别后进入细胞内,细胞内溶酶体摄取后导致溶酶体稳定性被破坏细胞破坏。
2 TNF-α与受体结合激活磷脂酶释放超氧化物引起DNA断裂。
3改变靶细胞糖代谢导致细胞死亡。
4提高中性粒细胞的吞噬能力,刺激炎症反应发生。
5促进细胞增殖和分化:通过T细胞抗原表达,增强细胞增殖能力。
2 NF-κB 作用NF-κB 是多肽亚单位组成的存在真核生物中的转录因子。
NF-κB 是1986年首次被发现。
证据证实NF-κB在细胞因子诱导的基因表达中起关键性的调控作用,它调控的基因编码能免疫调节分子、病毒瘤基因、生长因子、转录和生长调控因子等。
通过调控多种基因的表达,NF-κB 参与免疫反应、炎症反应、细胞凋亡等多种生物进程。
NF-κB 由P50、P52、P65( RelA)、C-Rel 和 RelB组成, P50/P65 是最常见异源二聚体,也是最主要的存在形式,P50/P65与IκB结合表现为无活性。
肿瘤坏死因子α及其抑制剂的研究进展

肿瘤坏死因子α及其抑制剂的研究进展肿瘤坏死因子(TNF)α是一种在多种生物效应中起作用的细胞因子,主要由单核细胞、巨噬细胞和胸腺依赖淋巴细胞产生,分为溶解型和膜结合型。
TNFα通过与其受体(TNFR)特异性结合引起一系列细胞因子改变,进而实现促细胞生长和程序性细胞死亡并促进牙周炎、种植体周围炎以及局限性肠炎和类风湿性关节炎等疾病发展的作用。
TNFα抑制剂分为大分子抑制剂和活性小分子抑制剂,种类繁多,作用机制复杂,已大量应用于临床治疗并取得了优异的疗效;而新型TNFα抑制剂TNFR1前配体结合序列复合物对于TNFα引起的程序性细胞死亡、关节炎破骨活动有明显的抑制作用,具有治疗TNFα参与的炎性疾病的潜能。
标签:肿瘤坏死因子;肿瘤坏死因子受体;抑制剂;作用机制[文献标志码]A在牙周炎和种植体周围炎等炎性疾病中,肿瘤坏死因子(tumor necrosis factor,TNF)α是释放最早并起枢纽作用的炎性因子,其下游的核因子(nuclear factor,NF)-κB会改变破骨细胞NF-κB受体活化因子配基和骨保护因子的表达,而RANKL与OPG间的比例变化可以参与破骨细胞的形成,导致骨的吸收。
TN Fα达到一定质量浓度时还可以直接抑制成骨细胞的增殖和分化。
TNFα不仅在种植体周围炎及其所引起的失败种植体周高表达,而且其表达水平与炎症和骨吸收的严重程度呈正相关。
在许多TNFα相关疾病的治疗过程中,TNFα抑制剂收到了明显的疗效;但是,随着有关TNFα的作用机制逐渐清晰,人们对TNFα抑制剂有着更高的期盼,希望其可以更精确地作用到疾病产生的核心步骤,更少的不良反应,又不影响TNFα在宿主防御中可能起到的有利的生物学功能。
1 TNFαTNFα是一种在多种生物效应中起作用的细胞因子,属于TNF超家族成员。
TNFα主要由单核细胞、巨噬细胞和胸腺依赖淋巴细胞(简称T细胞或T淋巴细胞)产生,其主要作用是促炎症反应发生发展和调节自身免疫,譬如炎性骨吸收、程序性细胞死亡和自身免疫疾病等。
tnf-a名词解释

tnf-a名词解释TNF-α是肿瘤坏死因子-α(Tumor Necrosis Factor-alpha)的简称。
它是一种由人体免疫系统产生的细胞因子,也是一种炎症性蛋白质。
TNF-α可参与多种生理和病理过程,包括免疫调节、细胞增殖和凋亡、发炎反应以及免疫细胞的激活等。
1. Elevated levels of TNF-α have been observed in patients with rheumatoid arthritis.(风湿性关节炎患者体内TNF-α的水平升高)。
2. Inflammatory bowel disease is characterized by an excessive release of TNF-α in the intestinal mucosa.(肠道炎症疾病的特征之一是肠道黏膜释放过多的TNF-α)。
3. TNF-α plays a crucial role in the pathogenesis of sepsis, a systemic inflammatory response to infection.(TNF-α在败血症(一种全身性感染引起的炎症反应)发病机制中起着关键作用)。
4. Anti-TNF-α therapies have shown promising results in the treatment of inflammatory diseases such as psoriasis and Crohn's disease.(抗TNF-α治疗在银屑病和克罗恩病等炎症性疾病的治疗中展现了良好的疗效)。
5. Increased TNF-α production has been linked to the development of insulin resistance and type 2 diabetes.(增加的TNF-α产生与胰岛素抵抗和2型糖尿病的发展相关)。
肿瘤坏死因子TNFα

人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
心力衰竭中肿瘤坏死因子-α的作用机制及抗细胞因子治疗概要

心力衰竭中肿瘤坏死因子-α的作用机制及抗细胞因子治疗北京大学医学部基础医学院04级临床一班90401123 王茜婷90401124 王天昱90401125 王玮90401126 王玺90401127 王琰90401128 王燕磊[摘要]心力衰竭是常见的临床综合征,是多数原发性心血管疾病的严重或终末阶段。
近年来,越来越多的研究证实肿瘤坏死因子-α(TNF-α) 等细胞因子在充血性心力衰竭的发展中起重要的作用。
其通过抑制心肌收缩力、促进心肌细胞凋亡及介导心肌重构等作用引发或加重心力衰竭。
鉴于目前对细胞因子生物效应的认识及其在心力衰竭中病理、生理发生机制的作用,抗细胞因子治疗心力衰竭已成为近年来研究治疗心力衰竭的热点。
本文将TNF-α在心力衰竭时对心脏的作用机制, 及抗细胞因子治疗心力衰竭的现状做一综述。
[关键词]心力衰竭发病机制细胞因子肿瘤坏死因子-α抗细胞因子治疗1.引言心力衰竭( heart failure, HF)是指由各种心脏疾病导致心功能不全的一种综合征,绝大多数情况下是指心肌收缩力下降使心排出量不能满足机体代谢需要,器官、组织灌流不足,同时出现体循环和(或)肺循环淤血表现。
心力衰竭为各种心脏疾病的终末期表现,是导致心脏病患者死亡重要原因。
心力衰竭发病机制复杂,神经体液机制、氧化应激和心肌细胞凋亡在心力衰竭中扮演不同角色。
肿瘤坏死因子-α(TNF-α)是由激活的单核/巨噬细胞分泌的一种具有多种生物活性的细胞因子,与受体结合能产生多种生物效应,如免疫刺激、调节机体的抗菌作用、蛋白激酶C 的激活和涉及多种炎症、细胞生长的基因表达的激活。
心肌细胞等多种非免疫细胞在某些应激状态下(如心力衰竭) 也具有产生TNF-α的能力。
心力衰竭时心肌细胞可能通过如下机制产生TNF -α:(1)心肌组织缺血、缺氧激活了心肌细胞和心肌局部单核/巨噬细胞,导致TNF - α的表达增加;(2)压力负荷刺激作用心脏时,心肌细胞表达TNF - α明显增加; (3)心力衰竭时交感-肾上腺系统及肾素-血管紧张素-醛固酮系统的激活可能直接影响细胞因子的表达。
肿瘤坏死因子-α与不孕症的研究进展

·综述·肿瘤坏死因子 α与不孕症的研究进展李南南 吴菲 马瑞红 赵志梅 夏天 向恬 王宝娟 郭孟佳基金项目:国家自然科学基金(81774351)作者单位:300193天津,天津中医药大学中医妇科学(李南南、吴菲、向恬、郭孟佳);天津中医药大学第一附属医院生殖中心(马瑞红、赵志梅、夏天、王宝娟)通讯作者:赵志梅(zhaozhim2003@aliyun.com)【摘要】 不孕症是指与固定性伴侣发生正常性生活一年及以上,无任何避孕措施而未妊娠者。
随着现代社会环境、生活压力、经济环境等因素的影响,患有不孕症的人数呈上升趋势,而导致不孕症的病因复杂多样,为临床的治疗带来了困难。
研究发现,慢性炎症与不孕(育)症关系密切,尤其是与肿瘤坏死因子 α(TNF α)有关。
TNF α是一种具有广泛生物学活性的小分子蛋白,通过多种途径参与多囊卵巢综合症、卵巢早衰、子宫内膜息肉以及子宫内膜异位症的病理反应,与女性不孕具有密切的相关性。
本文就国内外关于肿瘤坏死因子α与部分不孕症病因的关系研究做一综述。
【关键词】 肿瘤坏死因子 α; 不孕症; 卵巢功能; 子宫内膜 不孕症(infertility)是指性生活正常,一年未采取任何避孕措施而未成功妊娠者。
临床根据既往是否存在妊娠史,将不孕症分为原发性不孕和继发性不孕两大类。
不孕是女性常见的生殖疾病,女性不孕因素以盆腔因素为主,如输卵管异常、子宫内膜异位症(endometriosis,EMS)、子宫内膜炎症粘连、子宫内膜息肉(endometrialpolyps,EP)、生殖道肿瘤及发育畸形等;其次为排卵异常,包括多囊卵巢综合征(polycysticovarysyndrome,PCOS)、卵巢早衰(prematureovarianfailure,POF)及高泌乳素血症等[1]。
随着世界人口总数的增长,社会、生活、经济环境及女性妊娠年龄等因素的改变,不孕症患者数量呈逐年上升趋势,目前,已有超过8000万人受此病痛的折磨,约占全球所有夫妇的8%~12%[2]。
肿瘤坏死因子-α(TNF-α)生物学活性测定

响。因为 TNF-β 细胞毒生物学作用等很多生物学效应均与 TNF-α 相似。
肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性 地杀伤某些肿瘤细胞,而且有多种免疫调节作用。其检测方法主要包括生物学活性测定和免 疫学检测方法。其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶 联免疫吸附试验(ELISA)和放射免疫测定法。
(一) 原理: TNF-α 受体广泛地分布于多种肿瘤细胞和血细胞,根据 TNF-α 与相应靶细胞结合后引 起不同的生物学效应,建立了多种检测 TNF-α 生物学活性方法。某些肿瘤细胞膜表面的 TNF-α 受体与 TNF-α 结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤 能力,来反映 TNF-α 的生物学活性。若这种肿瘤细胞先用 3H-TdR 标记,则被杀伤后3H-TdR 释放至细胞外,牽 I 通过测定肿瘤细胞释放3H-TdR 的量来反映 TNF-α 的杀伤活性。 (二) 操作步骤:
用 DYQ-Ⅱ型多头细胞收集器收集样品于 "9999"型玻璃纤维滤纸上
↓ 烤干后,进行 β 计数
结果判定:
1. TNF-α 作用 24h 后,在倒置显微镜下判定 50%L929 细胞杀伤的稀释度即为1个
TNF-α 活性单位。
2. 根据测得的 cpm 值按下列公式计数活性单位:
TNF-α 活性单位(U/ml)
对照组 cpm 值。
3. 胰蛋白酶和 DNA 酶浓度和消化时间要严格控制,犆?批酶均要摸索最适浓度和时间。
否则,消化时间过长或过短者会影响实验结果。
4. 为了增强检测系统的敏感性,在测定系统中加入放线菌素 D,但浓度不宜过大,一
般最终浓度为 0.5~1μg/ml。
肿瘤坏死因子-α在炎症与肿瘤中的作用

由4 外 显 子 和 3 内含 子 组 成 ,定 位 于人 第 6 染 色 体 个 个 对 上 。T F 前体 由2 3 氨 基 酸残 基 组 成 , 7 个 氨基 酸 N— 3个 含 6 残 基 的信 号 肽 , 除 信 号 肽 后 成熟 型 T F 为 17 基 酸 切 N— 5氨 残 基 , 糖 基 化 , 6 位 和 1 1 两个 半 胱 氨酸 形成 分 子 内 非 第 9 0位 二 硫 键 [。 2 I T F 0有 2 N 一 l 种受 体 T F tmo n coi fc r eetr, N R( r ers at cpo) u s or 分 别 为 分 子 量 为 5 0 5 0 0的 肿 瘤 坏 死 因 子 受 体 I 型 fD 2a N R F A C 10/ F S 1 1和 分 子 量 为 7 0 的 肿 瘤 坏 死 因 子 受 T 50 0 体 Ⅱ型 f DI0 fN R F B , 型 受 体 在 信 号 转 导上 存 在 C 2 bI F S 1 ) 两 ' 定 的差 异f。在 大 多数 组 织 中肿瘤 坏 死 因子 受体 I型 的 3 1 表 达较 多 见 。而T F 大 部分 生 物 活性 是 由T F N— N R I型所 介 导 , 细胞 的损 伤 、 抗 病 毒 的 活性 、 纤 维 细 胞 的增 在 拈 成 殖 、 胞 的程 序 性 死 亡 、 活 核转 录 因子 一c 细 激 -B等 生 物活 性
肿瘤坏死因子—α在急性胰腺炎中的作用

肿瘤坏死因子—α在急性胰腺炎中的作用细胞因子在急性胰腺炎发病机制的作用日益被重视,其中肿瘤坏死因子-α(TNF-α)作为急性胰腺炎发病过程中极其重要的因子及其在疾病中的作用也同样被重视。
TNF-α不仅通过对胰腺、肠道、肝脏等多器官的损伤,导致机体出现严重的炎症反应,还介导其他炎症因子的释放,加重对机体的损伤。
标签:急性胰腺炎;TNF-α急性胰腺炎(acute pancreatitis)是临床上的急腹症,其发病机制目前尚不明确。
自从1988年Rinderknecht提出了白细胞过度激活学说[1]后,细胞因子在急性胰腺炎发病机制中的作用逐渐被重视,肿瘤坏死因子-α(TNF-α)作为急性胰腺炎始动因子的作用已经得到证实[2]。
现就促炎性细胞因子TNF-α在急性胰腺炎中的作用综述如下。
1 肿瘤坏死因子1.1 TNF-α的产生1975 年Carswell等发现了能使荷瘤鼠肿瘤发生出血、坏死而对正常组织细胞无明显作用的肿瘤细胞毒因子,Old将其命名为肿瘤坏死因子(tumor necrosis factor TNF)。
TNF主要分为由活化T细胞产生的TNF-β和活化的单核细胞产生的TNF-α。
在人体内,产生TNF-α的主要细胞是单核巨噬细胞。
Ramudo等的研究表明,胰腺相关性腹水时胰腺腺泡细胞中的TNF-α量增加,而非单核细胞或淋巴细胞,可见腺泡细胞是真正产生TNF-a的炎症细胞[3]。
1.2 TNF-α的调节正常人循环中的TNF-α水平为(10~80)pg/mL。
在人和动物,能诱导产生TNF-α物质为LPS,静脉输入LPS后2h,血清TNF-α达到高峰,4h内恢复到基线水平。
部分细胞因子也能诱导TNF-α,例如:IFN、IL-1、IL-2等。
糖皮质激素、IL-4、IL-6、IL-10、PAF受体拮抗剂和抗MHC-Ⅱ类分子抗体等均能在转录水平或转录后水平抑制TNF-α产生。
能抑制NF-κB活性的物质(N-乙酰半胱氨酸、谷胱甘肽等)和能抑制氧化酶的物质均能抑制TNF-α产生。
肿瘤坏死因子-α的药理学和病理学研究

肿瘤坏死因子-α的药理学和病理学研究肿瘤坏死因子-α是通过结合跨膜受体发挥多种生理作用的多效应细胞因子,本文着重介绍其调节炎性反应、细胞凋亡和促进改善脑缺血方面研究的最新进展。
[Abstract] Tumor necrosis factor (TNF) -α is a pleiotropic cytokine, which exerts its biological functions by interactions with one of two transmembrane receptors. The current progress of among which the most important regulatory functions, inflammatory response and cell apoptosis, improvement of cerebral ischemia are discussed in this review.[Key words] Tumor necrosis factor (TNF) -α; Inflammatory response; Cell apoptosis; Cerebral ischemia1962年,O’Malley第一次证实了内毒素间接影响了肿瘤出血性坏死,提出了内毒素具有“肿瘤坏死因子样”调节作用。
Carswell等人证实了TNF(tumor necrosis factor alpha,TNF-α)具有甲胆蒽A(MethA)诱导纤维肿瘤出血性坏死相似的药理作用[1]。
之后开始了肿瘤坏死因子的广泛研究,其结构、作用机制、病理学和药理学作用得到了重点研究和证实。
1 TNF-α的结构及合成TNF-α基因是人类第6号染色体的复制基因,由4个外显子和3个内含子组成。
成熟TNF-α序列的80%以上在第四个外显子中编码。
在生理条件下,肺、肝、脾、胸腺及肾脏的组织均有TNF-α mRNA的表达;脂多糖刺激、细菌和病毒入侵等致炎因素均能快速诱导心脏、胰腺、输卵管及子宫等多脏器对TNF-α的合成表达[2]。
肿瘤坏死因子

肿瘤坏死因子(TNF-α)是免疫系统中细胞所产生的一种重要炎症因子,广泛参与到一些自身免疫疾病的病理损伤过程中。
在健康人体内,TNF-α浓度非常低,而在病患者体内则会发生成倍的增长。
TNF-α的过度表达会导致一些慢性炎症的病发,如风湿性关节炎、牛皮癣等,同时它还与败血性休克综合症、糖尿病等疾病的发生存在关联,因而是癌症和感染疾病在发病初期的一个重要标志物,实现TNF-α的高灵敏检测对于疾病诊断、遗传机理和药物传输的研究都具有重要意义。
目前有多种方法如酶联免疫法、荧光免疫检测和电化学免疫分析可用于TNF-α的检测。
为进一步提高检测的灵敏度,东南大学化学化工学院刘松琴课题组将“高分子聚合辅助的传感信号放大”概念引入到TNF-α的检测中,以SiO2作为载体在表面接枝聚合物,利用高分子动态聚合链的增长,将单个标记分子或者信号基团通过链增长而得到成千上百个重复单元,达到荧光、电化学和电化学发光信号增强的目的(Analytical Chemistry, DOI: 10.1021/ac201558w)。
首先制备粒径均一、分散性好的SiO2纳米微球,利用表面富含的羟基再修饰上聚合引发剂,选择具有生物兼容性基团的聚合单体(GMA),利用该引发剂标记的纳米微球引发A TRP反应,得到聚合物包裹的SiO2纳米微球Si/PGMA,再通过表面PGMA中的环氧基与量子点中的羧基反应结合上CdTe制得Si/PGMA/CdTe荧光纳米探针,并采用电化学发光和电化学方法对TNF-α进行了夹心免疫检测。
夹心免疫过程包括在金电极表面上先电聚合一层富含羧基的聚邻氨基苯甲酸(PAB)膜,活化羧基后结合抗体蛋白分子Ab1,并依次识别抗原Ag 和荧光纳米探针标记的二抗分子Si/PGMA/CdTe/Ab2,在检测TNF-α浓度的同时还研究了该新型纳米探针的信号放大作用。
实验过程如下图所示。
图1. Si/PGMA/CdTe/Ab2纳米荧光探针的制备过程示意图图2. Si/PGMA/CdTe/Ab2做为纳米荧光探针在夹心免疫检测中的应用示意图TEM图中可以明显看出聚合物和CdTe量子点成功包裹在了SiO2表面,并且探针分子修饰在金电极上以后仍然保持良好的荧光性质。
肿瘤坏死因子α的生物学作用

肿瘤坏死因子α的生物学作用作者:金叶秦丽娟来源:《科技视界》2017年第05期肿瘤坏死因子是由巨噬细胞产生的,具有免疫应答、炎症反应以及修复细胞等生物学意义的细胞因子[1]。
Carswell等研究发现,接种卡介苗后的小鼠,其血清中含有一种高活性的细胞因子,这种因子可引起肿瘤细胞出血坏死,后来将其命名为肿瘤坏死因子。
肿瘤坏死因子一方面具有调节机体的免疫功能,使某些肿瘤细胞坏死的作用;另一方面又可介导炎症过程、组织损伤、休克等病理生理反应。
LPS是诱导肿瘤坏死因子产生的较强刺激剂,此外,T细胞和NK细胞在某些刺激因子的作用下也可分泌肿瘤坏死因子。
肿瘤坏死因子包括TNF-α和TNF-β两种。
其中,TNF-β由活化的淋巴细胞产生,又称淋巴毒素;TNF-α由活化的单核巨噬细胞产生,又称恶液素,二者有相似的活性。
1 TNF-α的分类和蛋白质结构TNF-α分为17kDa的可溶性TNF-α(sTNF-α)和26kDa膜结合的TNF-α(tmTNF-α)[2-3]。
tmTNF-α的一级结构有233个氨基酸残基,在金属蛋白酶TACE的作用下,tmTNF-α的胞外段1-157位可被水解,脱落为sTNF-α[4]。
2 TNF-α表达巨噬细胞和T细胞是TNF-α的主要生产者,其它细胞也可产生TNF-α,例如B细胞、NK 细胞、嗜中性粒细胞、肥大细胞、内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞、破骨细胞、成骨细胞、星形胶质细胞、树突状细胞、小胶质细胞、角质形成细胞、脂肪细胞、肾上腺皮质细胞和肾小球系膜细胞等[5-7]。
3 TNF-α受体TNF-α的生物学作用通过两种不同的细胞表面受体传递信号,这两种受体分别命名为TNFR1和TNFR2,分子量分别为55kD和75kD,各含有455和461个氨基酸。
人类TNFR1和TNFR2的细胞外结构域有28%的同源性,但两者胞内结构域的一级氨基酸序列不同。
TNFR1是大多数细胞TNF-α作用的关键受体,而TNFR2仅在淋巴系统的细胞中起主要作用以及通过增强或协同TNFR1起辅助作用[8-10]。
肿瘤坏死因子(TNF-α):自身免疫系统疾病关键靶点

肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点导语:⽬前,⽆论是传统的化药龙头,⾎制品公司还是很多初创的创新性药企,越来越多的公司致⼒于抗体类药物的研发。
⼀夜之间,似乎变成了不研究⼏个单抗产品,出去都不好意思打招呼的局⾯:)但是⽬前全球抗体类药物的市场还是集中在⼏家巨头⼿中,我国的抗体类药物更是⾯临着起步晚,⼤规模制备技术较落后,医保不能覆盖等很多问题,但随着研发技术的提⾼,制备⼯艺的优化,以及医保⽬录的调整等,相信我国的抗体类药物会迎来发展的春天。
民⽣证券医药⾏业研究团队负责⼈吴汉靓将通过⼀系列的报告来研究说明整个抗体药物领域,⽬前的主题包括:靶点的选择,⼯艺的优化,双抗产品的研发等。
下⾯是第⼀篇:肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点。
主要涉及阿达⽊单抗,英夫利昔单抗,依那西普以及我国⾃主研发的益赛普,安佰诺等TNF抑制剂的现状和未来前景。
⼀、单克隆抗体:⽣物药领域最⼤的⼦⾏业,2016年全球市场900亿美⾦1)单克隆抗体:⽣物药领域最⼤的⼦⾏业,占据⽣物药市场的43%根据Transparency Market Research预测,全球⽣物药市场将从2016年的2098亿美⾦增长到2024年的4798亿美⾦,复合增长率11%。
图1:全球⽣物药市场⽣物药可以细分为单克隆抗体、⽣长激素、融合蛋⽩、疫苗等⼦⾏业,其中单克隆抗体是⽣物药领域最⼤的⼦⾏业,2016年占据⽣物药市场的43%,预计从2016年的900亿美⾦增长到2024年的2217亿美⾦,复合增长率11.9%。
单克隆抗体(Monoclonal Antibody, mAb),简称单抗,是由⼀种类型的B细胞分泌产⽣的,具有和特定抗原发⽣特异性结合的免疫球蛋⽩。
单抗药物针对的靶点包括细胞表⾯分化抗原、细胞⽣长因⼦、⾎管内⽪⽣长因⼦等。
其中临床获批和临床研究最多的四个靶点是CD20、TNF-α、EGFR和HER2。
图2:临床研发和上市的⽣物药靶点2)肿瘤坏死因⼦-α(TNF-α):细胞信号通路中重要⼀环,药物研发的热门靶点肿瘤坏死因⼦-α(Tumor Necrosis Factor-α, TNF-α)是⼀种涉及到系统性炎症的细胞因⼦,主要由巨噬细胞分泌。
tnf-a名词解释

tnf-a名词解释
TNF-α(肿瘤坏死因子-α)是一种由多种细胞产生的细胞因子,它在机体的免疫反应和炎症过程中起着重要作用。
它主要由活化的巨噬细胞、单核细胞、淋巴细胞和自然杀伤细胞等细胞产生。
TNF-α可以通过与细胞表面TNF受体结合而发挥其生物学效应。
它可以激活巨噬细胞和中性粒细胞,促进炎症反应和免疫反应的发生。
TNF-α还能增强血管通透性,促进内皮细胞黏附分子的表达,并促使白细胞向炎症部位迁移。
此外,TNF-α还能刺激胃酸分泌和肠蠕动增强,对机体的代谢和造血功能也有一定影响。
在炎症疾病中,过度产生的TNF-α可导致炎症反应过激,引
发组织损伤和疾病的恶化,如类风湿关节炎、炎症性肠病等。
因此,抑制TNF-α的生理功能已成为多种治疗炎症性疾病的
方法,如使用抗TNF-α药物来控制炎症反应,减轻相关疾病
的症状和病程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肿瘤坏死因子摘要恶性肿瘤疾病目前仍是全世界需要共同面对的一个医学难题,其发病隐匿,早期容易被忽视,而临床患者多数已到中晚期,此时的疾病已很难治疗。
肿瘤坏死因子是一种能使肿瘤出血,并能抑制、杀伤体外培养的肿瘤细胞的蛋白类物质,1984年TNF基因的克隆开辟了临床试验的时代,是第一个用于肿瘤生物疗法的细胞因子,但因其缺少靶向性且有严重的副作用,对该基因的研究和应用形成了很大的障碍,目前很多研究人员正致力于该基因改造与应用。
关键词TNF、肿瘤1TNF的生物学特征TNF按其结构可以分为两种:TNFα和TNFβ。
TNFα是一种单核因子,主要由活化的单核细胞和巨噬细胞产生,TNFβ是一种淋巴因子,由活化的T细胞和NK细胞产生,目前研究多为TNFα。
人的TNFα位于第6号染色体短臂上,与MHC紧密连锁[1],人的TNFα基因大小为2.76kb,由4个外显子和3个内含子组成。
TNFα的蛋白质结构有多种形成,有二聚体、三聚体、五聚体,其中有生物活性的是三聚体。
TNFβ位于TNF α的5’端,同样由4个外显子和3个内含子构成,其中第4个外显子与TNFα高度同源,编码80%-90%的成熟蛋白质。
2 TNFα的来源与表达TNFα在人体内的来源途径有很多,如单核细胞、巨噬细胞、内皮细胞、成纤维细胞等都可以在一定的条件下产生和释放TNFα。
目前认为TNFα主要的生物合成场所有心、肝、肺、肾[2]。
各种外来刺激如内毒素脂多糖(LPS)、肠毒素、霉菌抗原、某些寄生虫的溶解物、病毒颗粒等,均可以引起TNFα的表达与释放。
在正常情况下,TNFα只由心肌间质的巨噬细胞产生,在某些病理状态下,如感染或内毒素的刺激下,心脏可以产生TNFα,Giroir[3]等研究证实这一点,在这些应激状态下,成熟的心肌细胞同样可以产生TNFαmRNA及其蛋白质,且产生的量同巨噬细胞产生的差不多。
Kleine等[4]证实,在生理状态下,脑内在结构和功能方面与巨噬细胞相似的细胞如神经元、小胶质细胞、血管内皮细胞均可合成分泌TNF、IL-6等细胞因子。
在炎症情况下,这些细胞因子的水平明显升高,且对中性粒细胞有明显趋化作用[5]。
有研究表明,有大约20%的恶性肿瘤的发生与慢性炎症有关[6]。
3 TNFα受体通过对TNFα分子一级结构的研究表明,C-末端在TNFα的生物学活性中起决定性作用。
由于C-末端参与TNFα高级结构的构成,只要切掉1个氨基酸就可使TNFα丧失生物学活性。
而N-末端的变化范围较大,适当改变其长度并不影响其生物学活性,N-末端还与TNFα对受体的结合能力密切相关,可能为与受体结合的部位。
TNFα生物学效应的发挥,有赖于其与靶细胞上的TNFR相结合,并通过受体后效应将信号传至胞核。
TNFR存在于多种细胞表面,肿瘤细胞表面同样也存在TNFR[7],不同细胞表面上受体的数目以及亲和力都有所不同,且这些差异不呈平行关系。
TNFα受体可分为2种,即TNFRⅠ和TNFRⅡ,两类TNFR均为糖蛋白,两类受体胞外区域氨基酸序列相似度很高,但胞内区域则完全不同。
由于各种细胞表达TNFR存在差异,使得TNFα对各种细胞的作用不同,一般来说,受体数目越高越容易受到TNFα的损伤。
TNFR还存在2种可溶性形式,为从细胞膜上通过蛋白酶水解下来的受体片段。
它们通过与TNFα结合而影响TNFR和TNFα的功能及其含量变化,且影响效果是显著的。
采用表面等离子体共振技术研究表明,TNFα与其可溶性受体的亲和常数远高于一般的抗原与抗体结合的亲和力[8]。
4 TNFα的生物学活性TNFα在体内、体外均能杀死某些肿瘤细胞,或抑制其增殖作用。
TNFα杀伤肿瘤的机理还不十分清楚,与补体或穿孔素杀伤细胞相比,TNFα杀伤细胞没有穿孔现象,而且杀伤过程相对比较缓慢。
TNFα能够增加过氧化物阴离子产生,增强ADCC功能,刺激细胞脱颗粒和分泌髓过氧化物酶,促进中性粒细胞粘附到内皮细胞上,从而刺激机体局部炎症反应。
TNFα促进T细胞MHCⅠ类抗原表达,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子的产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌。
5 TNFα与临床TNFα是目前发现的抗肿瘤活性最强的细胞因子。
在许多疾病,如心血管疾病、恶病质和败血症休克所致的多器官功能衰竭、类风湿性关节炎、多发性硬化症、炎症性肠病、移植物抗宿主病和骨髓造血紊乱综合症等的病理生理过程中起着重要的作用[9]。
TNFα除了对肿瘤细胞本身具有细胞毒性之外,它也能摧毁实体瘤周围的血管上皮组织,并且通过血栓的形成,阻断肿瘤的血液营养供应,最终导致肿瘤的出血性坏死、消退或消失。
超过一定浓度的TNFα具有明显的抗新生血管形成作用。
TNFα能明显降低实体瘤周围间隙组织的压力,扩大肿瘤周围上皮组织的间隙,改变周围血管的通透性,使化疗的药物到达靶组织周围。
另外,TNFα通过对人体免疫系统的调节从而加强自身的抗肿瘤作用。
TNFα导致的心肌机能障碍包括钙平衡的改变、直接的细胞毒作用、氧化张力、兴奋-收缩耦联破坏、心肌细胞凋亡等。
研究表明,严重的充血性心力衰竭、心肌梗死、心肌炎、扩张性心肌病、心脏移植排斥反应和进行心肺旁路手术患者的血浆TNFα水平显著升高。
6 TNFα的制备常用制备TNFα的方法有体内法、体外法和基因工程法。
体内法将卡介苗和LPS注入实验动物体内,诱导体内TNFα的产生。
外周血单个核细胞在重组白介素-2和有丝分裂原刺激下,或在十四酰沸波乙酸酯和LPS作用下均能产生TNFα,此法可在体外大量收集细胞培养物,实现批量生产。
分子生物学技术的应用,极大的促进了人TNFα的制备工作。
人TNFα的氨基酸序列已弄清楚,并克隆出编码TNFα蛋白质的cDNA。
利用基因工程法可获得高活性、高纯度的TNFα。
基因工程法制备1)改造TNFα的分子结构分析hTNFα的空间结构是研究新型hTNFα的前提。
具有生物活性的hTNF α其空间结构是3个TNFα单体以边对面形式形成的近似三角锥形的三聚体,结构与功能研究表明,删去N端前7个氨基酸残基不影响hTNFα三聚体空间结构。
相反,在删去N端7个氨基酸的同时增加N端的碱性氨基酸,可以增强形成活性三聚体的能力,从而提高hTNFα的抗肿瘤活性[10]。
何晓龙等[11]构建了3种hTNFα的衍生物。
这三种衍生物比以往报道的单独缺失N端氨基酸或单独增强N端碱性氨基酸引起的活性升高要大得多,说明两种突变在提高TNFα的细胞毒活性方面具有协同作用,具有潜在的临床应用前景。
2)制备TNFα融合蛋白1.具有TNFα抗肿瘤活性和靶细胞专一性的融合蛋白借助于细胞因子与其受体的特异性,hTNFα融合蛋白可以导向杀伤那些表达受体的肿瘤细胞。
刘丽等[12]针对TNFα在肿瘤治疗剂量下产生的严重毒副作用及一些肿瘤细胞白介素-6受体明显增高的事实,采用PCR技术将TNF α突变体与人IL-6成熟肽链编码区cDNA通过人工接头进行融合,并将融合的蛋白在大肠杆菌中表达,经活性检测结果证实,该融合蛋白在具有TNFα的对L929细胞和人骨髓瘤细胞的细胞毒作用和结合IL-6受体的能力,在高表达IL-6受体的人骨髓瘤细胞上测得的细胞毒活性教同样位点突变的TNFα高约3倍。
国内比较成功的例子是抗肝癌单链抗体融合TNFα的双功能抗体。
陈波等[13]将hTNFα同带有肝细胞特异结合位点的乙肝病毒表面抗原pre(1-65)肽段进行融合表达,并在融合蛋白之间加入了连接肽段或凝血酶酶切位点,获得了TNFα与preS1融合蛋白的表达产物,该产物具有TNFα的对L929细胞的细胞毒活性。
2.具有双重活性的融合蛋白构建融合蛋白不仅要考虑其靶向性,还要增加其功能。
IL-2和TNFα是引人注目的抗肿瘤活性因子,两者在抗肿瘤及免疫调节方面具有协同作用。
颜世庆等[14]利用逆转录病毒载体构建了包括编码IL-2前导肽和TNFα成熟肽序列的融合基因,表达的融合基因产物在体内和体外都对肿瘤细胞的生成具有抑制作用。
高长寿等[15]将人α降钙素基因相关肽与hTNFα高效融合表达,表达的融合蛋白既有CGRP的结合活性,又有hTNFα的活性。
7 检测方法生物学检测方法:常用TNF对肿瘤细胞的细胞毒作用的强弱来判断它的活性。
检测TNF对靶细胞的细胞毒作用的指标主要有:胎盼兰活细胞计数法,中性红细胞摄入法,结晶紫染色法,MTT法,荧光素标记法等。
免疫学检测方法:免疫学检测主要是根据TNF分子本身具有抗原性的特点,与抗TNF 抗体发生特异性结合,具有较高的灵敏度和特异性。
与生物学检测相比,免疫学检测方法由于不需要进行细胞培养,从而大大简化了操作过程,使得临床检测TNF成为可能。
近几年基因工程的迅速发展,也为免疫学检测方法提供了大量高纯度的TNF标准品。
8 结语TNFα是由激活的单核细胞、巨噬细胞产生的一种具有多种生物活性的多肽细胞因子,与机体免疫反应、急性期反应及炎症反应关系密切,它可通过激活细胞因子网络系统而诱发全身炎性反应,导致血液动力学改变、心肌抑制、微血管损伤及急性肺间质损伤等。
运用正确适当的抗TNFα治疗将可能成为一种新的治疗疾病的方法,但其临床应用价值还有待于进一步的证实。
参考文献[1] Nedwin GE,Naylor SL,Sakaguchi AY,et al. Human lymphotoxin and chromosomal localization. Nucleic Acids Res,1985,13:6361[2] Kapadia S ,Lee J,Torre-Amione G ,et al. Tumor necrosis factor alpha gene and protein experission in adult feline myocardium after endotoxin administration[J]. J Clin Invest,1995,96(2):1042-1052[3] Giroir BP .Inhibition of tumour necrosis factor prevents myocardial dysfunction during burn shock[J].Am J Physiol,1994,267:118-124.[4] Kleine TO ,Zwerenz P ,Zofel P,et al.New and old diagnostic markers of meningitis in cerebrospinal fluid (CSF) [J]. Brain Res bell,2003,61(3):287.[5]生物化学与生物物理进展Progress in Biochemistry and Biophysics,2007,34(6):604-610.[6] Balkwill,F,Mantovani A. Inflammation and cancer:back to Virchow?Lancet,2001,357(9255):539-545.[7] Brocktumor M. Identification of two types of tumor necrosis factor receptors on human cell lines by monoclonal antibodies Proe Natl Acad Sei USA,1990,87(8):3127[8] 分析化学(FENXI HUAXUE)特约来稿,第5期,第41卷,2013年5月,644-669[9] Maiai SR .Infliximab treatment of rheumatoid arthritis[J].Rheum Dis Clin North Am,2004,30(2):329-347[10] Soma GI ,Kitahara N,Tsuji Y,et al. Improve of cytotoxicity of tumor necrosis factor(TNF) by increase in basicity of its Ntermina. Biophys Res Comm,1987,148(2):629-635.[11] 何晓龙,常金丽,蔡武城,等,3种肿瘤坏死因子衍生物的研制[J].生物化学与生物物理学报,1995,27(1):87-73.[12] 刘丽,谢宝树,冷爱军.人白细胞介素-6与肿瘤坏死因子突变体融合蛋白对人骨髓瘤细胞的细胞毒作用[J].中华微生物学和免疫学杂志,1997,17(1):56-59.[13] 陈波,刘惠,任红玉等.乙肝病毒表面抗原preS1与人肿瘤坏死因子α融合基因的表达[J].生物化学与生物物理学报,1999,31(5):513-518.[14] 逆转录病毒介导的IL-2和TNFα融合基因在卵巢癌细胞中的表达及其对肿瘤细胞生长的影响[J].中华微生物学和免疫学杂志,1994,14(5):309-313. [15] 人α降钙素基因相关肽与肿瘤坏死因子的融合表达[J].生物化学与生物物理学报,1995,27(1):1-8.超临界流体萃取原理:利用超临界流体的溶解能力与其密度的关系,即利用压力和温度对超临界流体溶解能力的影响而进行的。
