人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
肿瘤坏死因子-α 正常水平

肿瘤坏死因子-α正常水平肿瘤坏死因子-α(Tumor Necrosis Factor-alpha,TNF-α)是一种由活化的免疫细胞分泌的细胞因子,广泛参与了多种免疫和非免疫反应。
TNF-α可以激活、调节各类免疫细胞、介导细胞凋亡、促进炎症反应、改变代谢、参与器官发育、影响认知和情绪等多种生理和病理过程。
本文将重点介绍 TNF-α的正常水平及其相关参考内容。
正常水平TNF-α的正常水平会因年龄、性别、生理状态、环境因素等多种因素而异。
正常人体血清中 TNF-α的浓度大约是 1.6 -14.5 pg/mL,但这个水平也有很大的变异性。
此外,不同的检测方法和试剂盒也可能对 TNF-α的检测结果产生影响。
鉴于此,医生在判读检测结果时应该参考具体的医学指南并结合患者情况,以免产生误差。
参考值的设定通常是以健康人群的平均值为基准,多数实验室以3 pg/mL ~ 5 pg/mL为临界值。
当血清中 TNF-α的浓度超过临界值,则有可能存在某些炎症、感染、肿瘤等疾病。
当然,TNF-α检测结果应该与临床症状、其他病理检查结果等综合分析,不能单独作为诊断标准。
影响因素TNF-α的分泌受到多种生理和病理因素的影响。
以下是一些常见影响因素:1. 炎症和感染:TNF-α主要在炎症和感染状态下才会被大量产生。
细菌、病毒或其他致病微生物侵入机体后,会刺激免疫细胞分泌 TNF-α,以启动炎症反应并抵抗病原体。
2. 创伤和手术:创伤和手术也可以引起机体炎症反应,从而促进 TNF-α的分泌。
尤其是大面积的烧伤、创伤和手术后综合征等情况,TNF-α的水平会显著升高,并可能影响病情和预后。
3. 肥胖和代谢紊乱:一些研究表明,肥胖、2型糖尿病和代谢综合征等代谢紊乱疾病与 TNF-α的水平升高有关。
这可能是由于TNF-α与脂肪细胞、胰岛素、葡萄糖代谢等有关的机制。
4. 其他因素:其他因素如精神压力、某些药物、环境污染等也可能引起 TNF-α的变化,但目前仍需进一步研究证实。
肿瘤坏死因子TNFα

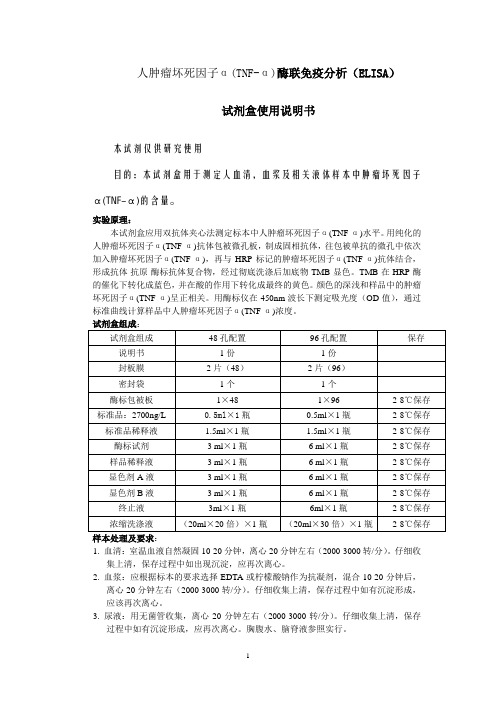
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
TNF-α、IL-1β、IL-6、IL-10联合检测在儿童传染性单核细胞增多症中的诊断价值

1.476)、TNF-α(OR =15.991,95%CI:5.476~369.052)、IL-1β(OR =2.015,95%CI:1.095~3.706)、IL-6
(OR=2.853,95%CI:1.398~5.822)及IL-10(OR =1.221,95%CI:1.083~1.377)为IM 的 危 险 因 素 (P<
儿空腹静脉血清 TNF-α、IL-1β、IL-6及IL-10水平,并收 集 患 儿 一 般 资 料 及 实 验 室 检 查 资 料。通 过 Logistic回
归分析 TNF-α、IL-1β、IL-6、IL-10水平与IM 的关系,而后建立基于 TNF-α、IL-1β、IL-6 及IL-10 水平的预测列
Key words:tumor necrosisfactor α; interleukin; infectious mononucleosis; children; diagnostic efficacy
传染性单核细胞 增 多 症 (IM)患 儿 的 免 疫 因 子 表 达可能发 生 异 常[1-2]。IM 作 为 以 发 热 起 病 的 感 染 性 疾病,免疫因 子 并 非 其 特 异 性 诊 断 因 素,容 易 与 其 他 感染性疾病混淆 。 [3] 肿瘤坏死因子 α(TNF-α)由 巨 噬 细胞释放,在 感 染 性 疾 病 中 TNF-α 水 平 可 能 出 现 异 常;白细胞介 素 (IL)由 白 细 胞 释 放,在 感 染 性 疾 病 发 病过程中起着传 递 抗 原 信 息 的 作 用 。 [4-6] 本 研 究 旨 在
良好。结论 TNF-α、IL-1β、IL-6及IL-10联合检测可以有效地提升IM 患儿的诊断效能,可以将之运用于基层
医院发热患儿IM 的早期诊断中。
肿瘤坏死因子-α(TNF-α)生物学活性测定

响。因为 TNF-β 细胞毒生物学作用等很多生物学效应均与 TNF-α 相似。
肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性 地杀伤某些肿瘤细胞,而且有多种免疫调节作用。其检测方法主要包括生物学活性测定和免 疫学检测方法。其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶 联免疫吸附试验(ELISA)和放射免疫测定法。
(一) 原理: TNF-α 受体广泛地分布于多种肿瘤细胞和血细胞,根据 TNF-α 与相应靶细胞结合后引 起不同的生物学效应,建立了多种检测 TNF-α 生物学活性方法。某些肿瘤细胞膜表面的 TNF-α 受体与 TNF-α 结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤 能力,来反映 TNF-α 的生物学活性。若这种肿瘤细胞先用 3H-TdR 标记,则被杀伤后3H-TdR 释放至细胞外,牽 I 通过测定肿瘤细胞释放3H-TdR 的量来反映 TNF-α 的杀伤活性。 (二) 操作步骤:
用 DYQ-Ⅱ型多头细胞收集器收集样品于 "9999"型玻璃纤维滤纸上
↓ 烤干后,进行 β 计数
结果判定:
1. TNF-α 作用 24h 后,在倒置显微镜下判定 50%L929 细胞杀伤的稀释度即为1个
TNF-α 活性单位。
2. 根据测得的 cpm 值按下列公式计数活性单位:
TNF-α 活性单位(U/ml)
对照组 cpm 值。
3. 胰蛋白酶和 DNA 酶浓度和消化时间要严格控制,犆?批酶均要摸索最适浓度和时间。
否则,消化时间过长或过短者会影响实验结果。
4. 为了增强检测系统的敏感性,在测定系统中加入放线菌素 D,但浓度不宜过大,一
般最终浓度为 0.5~1μg/ml。
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α(TNF-α),再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α(TNF-α)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
血清TNF

血清TNF摘要:目的:旨在研究2型糖尿病(t2dm)患者血清肿瘤坏死因子-α(tumor necrosis factor,tnf-α)与视网膜病变的相关性。
方法:进入本研究的共有120例,所有受试者中无高血压、冠心病、脑血管病病史,其中单纯2型糖尿病(non-diabetic retinopathy,ndr组)者31例,2型糖尿病合并背景期dr(background-diabetic retinopathy,bdr组)者30例,2型糖尿病合并增殖期dr (proliferative-diabetic retinopathy,pdr组)者29例及正常对照组30例。
测定受试者禁食8-10小时过夜后的空腹血糖(fpg)、糖化血红蛋白(hba1c)、tc、tg、hdl-c、ldl-c并测量身高、体重,计算bmi。
结论:bdr组血清tnf-α水平明显高于ndr组,pdr组血清tnf-α水平高于bdr组,随着dm病程的延长及视网膜受损程度与tnf-α呈显著正相关。
关键词:2型糖尿病肿瘤坏死因子-α糖尿病视网膜病变【中图分类号】r4 【文献标识码】a 【文章编号】1008-1879(2012)12-0048-02糖尿病视网膜病(diabetic retinopathy,dr)是糖尿病最常见的微血管并发症之一,是造成糖尿病病人失明的主要原因,其发生机制尚不完全清楚。
当血液中tnf-α异常增高时,可损伤血管内皮细胞,造成血管内皮细胞形态改变,细胞膜及细胞器损害等,并能增加内皮细胞的通透性。
1 临床资料1.1 一般资料。
符合1998年who诊断标准2型糖尿病患者共90例,男42例,女48例,dr诊断按全国眼底病协作组制定的糖尿病视网膜诊断标准,根据直接眼底镜检查将患者分为三组:①无视网膜病变组(non-dr,ndr)31例,男15例,女16例,年龄58.5±6.9岁,病程6个月-5年。
②背景期dr组(background-dr,bdr)30例,男15例,女15例,年龄60.3±5.4岁,病程3-15年。
绵羊肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
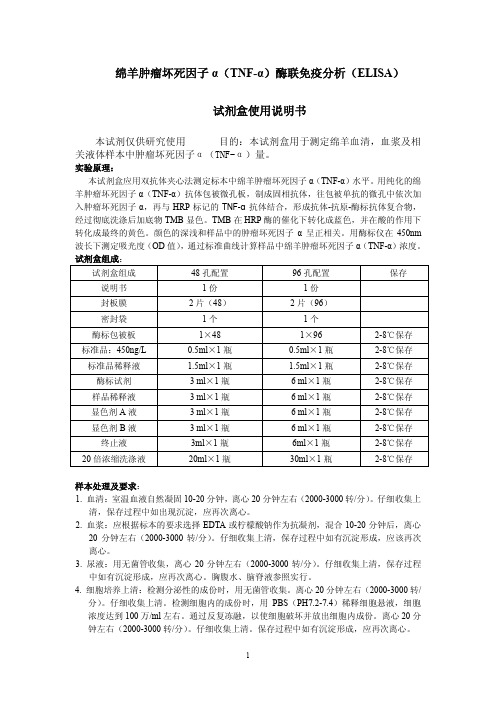
绵羊肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定绵羊血清,血浆及相关液体样本中肿瘤坏死因子α(TNF-α)量。
实验原理:本试剂盒应用双抗体夹心法测定标本中绵羊肿瘤坏死因子α(TNF-α)水平。
用纯化的绵羊肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的TNF-α抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD值),通过标准曲线计算样品中绵羊肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存20倍浓缩洗涤液20ml×1瓶30ml×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
肿瘤坏死因子检测方法

肿瘤坏死因子检测方法
肿瘤坏死因子(Tumor Necrosis Factor, TNF)是一种由免疫细胞产生的蛋白质,它在调节炎症反应、免疫应答和细胞凋亡等方面发挥重要作用。
检测肿瘤坏死因子的方法对于疾病诊断和治疗具有重要意义。
目前,常用的肿瘤坏死因子检测方法主要包括酶联免疫吸附试验(ELISA)、
流式细胞术和PCR技术等。
首先,酶联免疫吸附试验是一种常用的定量检测方法。
该方法通过特异性抗体
与目标物结合,再利用辣根过氧化物酶或碱性磷酸酶等酶标记的二抗进行检测。
通过测量酶标记物的反应产物的光学密度,可以定量检测肿瘤坏死因子的含量。
其次,流式细胞术也广泛应用于肿瘤坏死因子检测。
该方法通过标记特异性抗体,结合细胞表面的肿瘤坏死因子,再利用荧光染料检测的原理,可以定量分析肿瘤坏死因子在不同细胞亚群中的表达水平。
流式细胞术具有高灵敏度和高通量的优点,能够同时检测多个指标。
此外,PCR技术也可以用于肿瘤坏死因子的检测。
PCR技术利用特异性引物扩增目标基因片段,通过测量扩增产物的数量来定量分析肿瘤坏死因子的表达水平。
PCR技术具有高度的灵敏度和特异性,能够快速准确地检测目标物。
综上所述,肿瘤坏死因子的检测方法包括酶联免疫吸附试验、流式细胞术和PCR技术等。
这些方法在临床诊断、疾病监测和药物研发中具有重要意义,有助
于深入理解肿瘤坏死因子在疾病发生发展中的作用机制,并为个体化治疗提供参考依据。
ELISA法检测人血清血浆样本中肿瘤坏死因子α TNF-α的浓度

双抗体夹心ELISA法检测样本中TNF-α的浓度TNF-α简介:肿瘤坏死因子(TNF-α)是由单核细胞和巨噬细胞产生的多肽类细胞因子,在炎症反应、免疫系统的发展、细胞程序性死亡和脂代谢中起重要的作用。
其功能主要是在免疫反应中是一个多功能的调节器甚至作为一个强烈的热原性物质刺激中性粒细胞,改变血管内皮细胞的特性,调节其它组织的代谢活性。
TNF-α也可通过抑制脂蛋白脂肪酶的活性而导致恶液病。
爱泼斯坦病毒引起的细胞活化也可被TNF-α所抑制。
巨噬细胞表面的淋巴因子和肉毒素也可介导包括上皮细胞、内皮细胞和肿瘤细胞等产生TNF-α。
据报道干扰素能显著提高TNF-α的分泌量。
TNF-α在关节炎和其它组织的炎症的发病机理中起重要作用。
TNF-α也参与了包括哮喘、克罗恩氏病、类风湿性关节炎、神经性疼痛、肥胖症、 型糖尿病、自身免疫病和肿瘤等疾病的发生检测原理:本试剂盒采用双抗体夹心ELISA法检测样本中TNF-α的浓度。
TNF-α捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的TNF-α会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。
当加入生物素化的抗人TNF-α抗体后,抗人TNF-α抗体与TNF-α接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。
随后加入辣根过氧化物酶标记的亲合素。
生物素与亲合素特异性结合,亲合素连接的酶就会与夹心的免疫复合物连接起来;其它游离的成分通过洗涤的过程被除去。
最后加入显色剂,若样本中存在TNF-α将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。
通过酶标仪检测,读其450nm处的OD值,TNF-α浓度与OD450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中OD值,即可算出标本中TNF-α浓度。
实验过程需自备的材料:1.不同规格的加样枪及相应的枪头;2.酶标仪;3.自动洗板机; 4.去离子水或双蒸水;标本收集:1.标本的收集请按下列流程进行操作:A.细胞上清标本离心去除悬浮物后即可;B.血清标本应是自然凝固后,取上清,避免在冰箱中凝固血液;C.血浆标本,推荐用EDTA的方法收集;D. 若待测样本不能及时检测,标本收集后请分装,冻存于-20℃,避免反复冻融。
TNF肿瘤坏死因子的介绍

TNF肿瘤坏死因子的介绍TNF-α(肿瘤坏死因子-α)是一种重要的细胞生物活性因子,是免疫系统中的关键分子之一、它起源于巨噬细胞、单核细胞、淋巴细胞、T细胞等,并且在感染、炎症和免疫反应中起着重要的调节作用。
TNF-α在炎症反应和组织修复过程中发挥着重要的作用。
TNF-α主要由活化的巨噬细胞和T细胞分泌,它的分泌受到多种刺激因素的调控。
在感染时,病原体成分经过细胞感应机制激活细胞表面的受体,这些受体激活之后会引起下游信号通路的激活,最终导致TNF-α的产生和释放。
TNF-α的产生和作用具有很强的时效性,可以迅速对炎症反应作出反应,并诱导其他炎性细胞的积聚和活化。
TNF-α的生物活性非常广泛,它可以通过多种机制参与免疫调节。
首先,TNF-α可以增加细胞表面黏附分子的表达,这些黏附分子对炎症细胞的黏附和集聚起着重要作用。
其次,TNF-α可以增强血管的渗透性,使白细胞更容易穿过血管壁进入炎症区域。
此外,TNF-α还可以促进细胞的凋亡,即程序性细胞死亡,从而清除病原体和受损细胞。
尽管TNF-α在炎症反应和免疫调节中扮演重要角色,但过度产生TNF-α也可能引起炎症反应失控,导致严重的炎症性疾病。
例如,关节炎、炎性肠病、系统性红斑狼疮和肺部感染等疾病的发展与TNF-α的过度产生密切相关。
因此,抑制TNF-α的作用已成为许多药物研发的重要目标之一在临床治疗中,针对TNF-α的治疗策略已被广泛采用。
针对TNF-α的免疫抑制药物已被用于治疗类风湿性关节炎、银屑病和炎性肠病等疾病。
这些药物可以通过结合TNF-α并中和其生物活性来达到治疗的效果。
此外,利用基因工程技术生产的可溶性TNF-α受体融合蛋白也作为治疗TNF-α相关疾病的一种手段。
总之,TNF-α作为一种免疫系统中的重要调节因子,参与多个疾病的发生和发展过程中,具有广泛的生物活性和调节作用。
深入研究TNF-α的分子机制和功能,不仅有助于揭示炎症反应和免疫调节的机制,还为相关疾病的治疗提供了重要的思路和方法。
肿瘤坏死因子-α

蛋白质的一级结构特点
蛋白质的一级结构特点
二级结构预测
三级结构预测
蛋白(TNFR-1) (p60) 在所 有细胞类型上表达,是启动 TNF-α 大部分生物活性的关键。
➢ 而TNF受体2 (TNFR-2) (p80) 只 在免疫细胞中表达。
➢ 只有TNFR-1即具有转导细胞 存活信号的能力亦有诱导细胞 凋亡能力,但这种生死信号调 节的作用机制至今也未被透彻 理解。
TNFR2复合物,从而促进细胞的存活。 ➢ 筛选TNFR2的拮抗剂,可以抑制Treg,可以被开发为抗肿瘤药物。
感谢聆听!
武汉轻工大学
肿瘤坏死因子-α
主讲:XXX
专业:
时间:
概述
肿瘤坏死因子(tumor necrosis factor,TNF),又称恶液质素。TNF主要由活化的巨 噬细胞,NK细胞及T淋巴细胞产生,其中,巨噬细胞产生的TNF命名为TNF-α,T淋巴细 胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。TNFα的生物学活性占TNF总活性 的70%~95%,因此目前常说的TNF多指TNF-α。TNF-α作为主要的炎性介质在多种肿瘤 中表达。TNF-α一方面可以通过诱导癌细胞凋亡去抑制肿瘤细胞生长,另一方面也刺激大 多数对TNF诱导的细胞毒性具有抗性的癌细胞的增殖、存活、迁移和血管生成,从而导致 肿瘤的发展发生。
潜在价值
在关节炎或炎症性肠道疾病中,需要增强TNF-α合成来达到抗炎治疗目的;在自 身免疫病中,需要抑制TNF-α的作用,以便减轻炎症因子对自身细胞的攻击。
值得注意的是,TNF-α是人体正常的免疫分子之一。因此,未来的研究可能会开 发出一种保护细胞免疫系统但选择性阻断TNF-α作用的药物组合,以便在长期内克 服抗TNF-α治疗的副作用。
骨肉瘤血清肿瘤坏死因子-α水平测定及临床意义

骨肉瘤血清肿瘤坏死因子-α水平测定及临床意义汤丽娜;胡蓓蓓;林峰;姚阳;郑水儿;郭跃武【期刊名称】《临床肿瘤学杂志》【年(卷),期】2013(018)002【摘要】目的探讨骨肉瘤患者治疗前血清肿瘤坏死因子-α(TNF-α)的水平及其与预后的关系.方法采用酶联免疫吸附法(ELISA)分别测定56例骨肉瘤患者治疗前和50例健康对照者血清中TNF-α水平,分析骨肉瘤患者血清中TNF-α水平与临床病理特征及预后的关系.结果 56例骨肉瘤患者治疗前血清TNF-α为(32.08±19.68) pg/ml,显著高于健康对照者的(18.00±19.88) pg/ml,差异有统计学意义(P=0.04).骨肉瘤患者治疗前血清TNF-α水平与碱性磷酸酶水平(P=0.002)及肿瘤分期(P=0.026)有关.治疗前血清TNF-α升高患者(n=44)的中位生存时间为22.2个月,TNF-α水平正常者(n=12)为32.1个月,差异有统计学意义(P =0.037).结论骨肉瘤患者治疗前血清TNF-α水平明显升高,且与预后相关,该指标对判断预后及指导治疗具有一定的参考价值.%Objective To investigate the serum level of tumor necrosis factor-a (TNF-a) in patients with osteosarcoma pre-treatment and its correlation with prognosis. Methods The serum levels of TNF-a in 56 patients with osteosarcoma before chemotherapy and 50 healthy people were detected by ELISA method. The factors affecting the serum TNF-a level of osteosarcoma patients and the correlation of TNF-a with prognosis were also studied. Results The expression of serum TNF-a pretreatment of 56 osteosarcoma patients was (32. 08 ± 19. 68) pg/ml, higher than (18. 00 ± 19. 88) pg/ml of the healthy people. There were statistical significances(P = 0.04). The level of TNF-a in osteosarcoma patients was correlated to alkaline phosphatase(P = 0. 002) and stage(P =0.026) . In osteosarcoma patients, the median overall survival ( OS) in elevated TNF-a group ( n = 44 ) was 22. 2 months, lower than 32. 1 months in normal TNF-a group. There were statistical significances (P =0. 037). Conclusion The level of serum TNF-a in patients with osteosarcoma is significantly increased, and is correlated to prognosis. The detection of serum TNF-a has certain value for prognosis and treatment of osteosarcoma.【总页数】3页(P126-128)【作者】汤丽娜;胡蓓蓓;林峰;姚阳;郑水儿;郭跃武【作者单位】200233 上海上海交通大学附属第六人民医院肿瘤内科;200233 上海上海交通大学附属第六人民医院肿瘤内科;200233 上海上海交通大学附属第六人民医院肿瘤内科;200233 上海上海交通大学附属第六人民医院肿瘤内科;200233 上海上海交通大学附属第六人民医院肿瘤内科;200233 上海上海交通大学附属第六人民医院肿瘤内科【正文语种】中文【中图分类】R738.1【相关文献】1.急性有机磷农药中毒合并MODS血清肿瘤坏死因子-α水平测定临床意义 [J], 何伟明2.消化性溃疡患者血清c反应蛋白和肿瘤坏死因子α水平测定的临床意义 [J], 姚莉亚;徐立3.支原体肺炎患儿血清白细胞介素18和肿瘤坏死因子α水平测定的临床意义 [J], 严晓慧;郦敏霞4.慢性阻塞性肺疾病患者血清及诱导痰中肿瘤坏死因子α水平测定的临床意义 [J], 黄希芬;裴文仲5.类风湿关节炎患者血清中肿瘤坏死因子-α的水平测定及临床意义 [J], 王宏伟因版权原因,仅展示原文概要,查看原文内容请购买。
ELISA法检测肿瘤坏死因子

ELISA法检测肿瘤坏死因子ELISA法检测肿瘤坏死因子肿瘤坏死因子(TNF)是由激活的单核细胞巨噬细胞受内毒素刺激后产生的一种分子量为17 000的蛋白质。
其中,由巨噬细胞产生的称TNF-α,是巨噬细胞介导细胞毒效应的细胞因子;由淋巴细胞产生的称TNF-β。
TNF在体内具有广泛的生物学活性:可作为免疫应答中的一种中间介质,既有抗病效应,又有致病效应;可引起肿瘤的出血坏死;可刺激成纤维细胞增殖;可增加HLA-A、HLA-B、HLA-C抗原的表达;可激活中性粒细胞及杀伤细胞;可促进B细胞增殖及分化、增加IL-2受体表达。
肝脏是TNF的主要发源地,同时也是TNF清除的主要部位。
目前,以TNF-α在临床的意义较大,是内毒素引起肝损害的重要介质。
TNF-α只有通过与靶细胞表面的膜型受体(mTNF-aR)特异结合才能发挥毒性效应,这一结合过程又受血清中可溶性TNF-α受体(sTNF-aR)的调节和制约,而sTNF-aR可与mTNF-aR竞争结合TNF-。
临床上常以检测TNF-α为主。
[检测方法] ELISA法[方法学原理] 在微孔反应板上包被抗人TNF-α单克隆抗体,待测标本和标准品中的TNF-a会与单克隆抗体结合,游离的成分被洗去,同时加入生物素化的抗人TNF-α抗体和辣根过氧化物酶标记的亲和素。
生物素与亲和素特异结合,抗人TNF抗体与结合在单克隆抗体上的人TNF-α结合而形成免疫复合物,游离的成分被洗去。
加入显色剂,若反应孔中有TNF-α,HRP会使无色的显色剂呈现蓝色,加终止液变黄色。
在波长450nm处测吸光度,TNF浓度与吸光度成正比,可通过绘制标准曲线求出标本中的TNF-α浓度。
[标本准备] 静脉血2ml,不抗凝。
[试剂]1.预包被微孔反应板2.浓缩酶结合物3.酶结合物稀释液4.标准品和标本稀释液5.浓缩生物素化抗体6.IFN标准晶7.浓缩洗涤液8.显色剂A、B9.终止液[仪器] 酶标仪或全自动酶联免疫检测仪。
肿瘤坏死因子(TNF-α):自身免疫系统疾病关键靶点

肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点导语:⽬前,⽆论是传统的化药龙头,⾎制品公司还是很多初创的创新性药企,越来越多的公司致⼒于抗体类药物的研发。
⼀夜之间,似乎变成了不研究⼏个单抗产品,出去都不好意思打招呼的局⾯:)但是⽬前全球抗体类药物的市场还是集中在⼏家巨头⼿中,我国的抗体类药物更是⾯临着起步晚,⼤规模制备技术较落后,医保不能覆盖等很多问题,但随着研发技术的提⾼,制备⼯艺的优化,以及医保⽬录的调整等,相信我国的抗体类药物会迎来发展的春天。
民⽣证券医药⾏业研究团队负责⼈吴汉靓将通过⼀系列的报告来研究说明整个抗体药物领域,⽬前的主题包括:靶点的选择,⼯艺的优化,双抗产品的研发等。
下⾯是第⼀篇:肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点。
主要涉及阿达⽊单抗,英夫利昔单抗,依那西普以及我国⾃主研发的益赛普,安佰诺等TNF抑制剂的现状和未来前景。
⼀、单克隆抗体:⽣物药领域最⼤的⼦⾏业,2016年全球市场900亿美⾦1)单克隆抗体:⽣物药领域最⼤的⼦⾏业,占据⽣物药市场的43%根据Transparency Market Research预测,全球⽣物药市场将从2016年的2098亿美⾦增长到2024年的4798亿美⾦,复合增长率11%。
图1:全球⽣物药市场⽣物药可以细分为单克隆抗体、⽣长激素、融合蛋⽩、疫苗等⼦⾏业,其中单克隆抗体是⽣物药领域最⼤的⼦⾏业,2016年占据⽣物药市场的43%,预计从2016年的900亿美⾦增长到2024年的2217亿美⾦,复合增长率11.9%。
单克隆抗体(Monoclonal Antibody, mAb),简称单抗,是由⼀种类型的B细胞分泌产⽣的,具有和特定抗原发⽣特异性结合的免疫球蛋⽩。
单抗药物针对的靶点包括细胞表⾯分化抗原、细胞⽣长因⼦、⾎管内⽪⽣长因⼦等。
其中临床获批和临床研究最多的四个靶点是CD20、TNF-α、EGFR和HER2。
图2:临床研发和上市的⽣物药靶点2)肿瘤坏死因⼦-α(TNF-α):细胞信号通路中重要⼀环,药物研发的热门靶点肿瘤坏死因⼦-α(Tumor Necrosis Factor-α, TNF-α)是⼀种涉及到系统性炎症的细胞因⼦,主要由巨噬细胞分泌。
10种常用细胞因子检测方法盘点

10种常用细胞因子检测方法盘点研究细胞因子为临床上疾病的预防、诊断、机理研究以及治疗等奠定了良好的基础,应用前景非常广泛。
目前检测细胞因子的方法有很多,根据检测原理和手段的不同,检测技术大致可分为四类:免疫学方法、生物学方法、分子生物学方法及质谱法。
细胞因子是由免疫细胞(如单核、巨噬细胞、T细胞、B细胞、NK细胞等)和某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质。
细胞因子一般通过结合相应受体调节细胞生长、分化和效应,调控免疫应答。
这些细胞因子的种类很多,包括肿瘤坏死因子—α(TNF-α)、白介素—1β(IL-1β)、白介素—6(IL-6)、转化生长因子—β(TGF-β)等。
细胞因子(cytokine,CK)是主要由机体中固有免疫细胞和适应性免疫细胞合成、分泌的一类具有多种活性功能的小分子多肽或糖蛋白。
细胞因子能介导细胞间的相互作用,具有多种生物学功能,如调节细胞生长、分化成熟、功能维持、调节免疫应答、参与炎症反应、创伤愈合和肿瘤消长等。
研究细胞因子为临床上疾病的预防、诊断、机理研究以及治疗等奠定了良好的基础,应用前景非常广泛。
目前检测细胞因子的方法有很多,根据检测原理和手段的不同,检测技术大致可分为四类:免疫学方法、生物学方法、分子生物学方法及质谱法。
本篇我们就和大家一起来汇总一下10种方法的技术原理及方法特点:1、7种基于免疫学的常用的细胞因子检测方法Western Blot法、酶联免疫吸附测定法(ELISA)、酶联免疫斑点技术(ELISpot)、超敏电化学发光技术(MSD)、Luminex液相芯片检测技、Olink技术、Simoa技术(Simoa)7种常用的细胞因子检测方法差异对比2、2种基于生物学的检测方法反转录·聚合酶链反应(RT-PCR)Cytometric Bead Array(CBA)系统3、质谱法4、12项细胞因子检测的临床意义一、基于免疫学的检测方法炎症因子作为一种蛋白质抗原,可以特异性与其单克隆抗体结合,利用抗原抗体反应检测细胞因子,近年来发展比较快,其方法包括Western Blot法、酶联免疫吸附测定法、酶联免疫斑点技术、超敏电化学发光技术、Luminex液相芯片检测技术、Olink技术、Simoa技术。
人肿瘤坏死因子α转化酶(TACE)ELISA检测试剂盒说明书
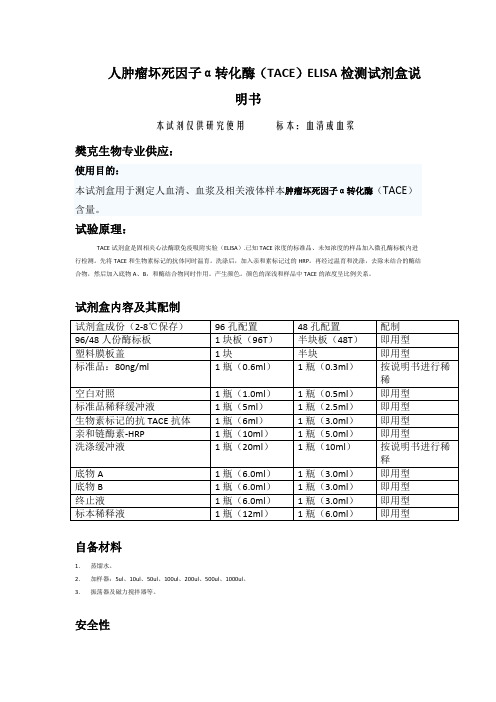
人肿瘤坏死因子α转化酶(TACE)ELISA检测试剂盒说明书本试剂仅供研究使用标本:血清或血浆樊克生物专业供应:使用目的:本试剂盒用于测定人血清、血浆及相关液体样本肿瘤坏死因子α转化酶(TACE)含量。
试验原理:TACE试剂盒是固相夹心法酶联免疫吸附实验(ELISA).已知TACE浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。
先将TACE和生物素标记的抗体同时温育。
洗涤后,加入亲和素标记过的HRP。
再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用。
产生颜色。
颜色的深浅和样品中TACE的浓度呈比例关系。
试剂盒内容及其配制试剂盒成份(2-8℃保存)96孔配置48孔配置配制96/48人份酶标板1块板(96T)半块板(48T)即用型塑料膜板盖1块半块即用型标准品:80ng/ml 1瓶(0.6ml)1瓶(0.3ml)按说明书进行稀稀空白对照1瓶(1.0ml)1瓶(0.5ml)即用型标准品稀释缓冲液1瓶(5ml)1瓶(2.5ml)即用型生物素标记的抗TACE抗体1瓶(6ml)1瓶(3.0ml)即用型亲和链酶素-HRP 1瓶(10ml)1瓶(5.0ml)即用型洗涤缓冲液1瓶(20ml)1瓶(10ml)按说明书进行稀释底物A 1瓶(6.0ml)1瓶(3.0ml)即用型底物B 1瓶(6.0ml)1瓶(3.0ml)即用型终止液1瓶(6.0ml)1瓶(3.0ml)即用型标本稀释液1瓶(12ml)1瓶(6.0ml)即用型自备材料1.蒸馏水。
2.加样器:5ul、10ul、50ul、100ul、200ul、500ul、1000ul。
3.振荡器及磁力搅拌器等。
安全性1.避免直接接触终止液和底物A、B。
一旦接触到这些液体,请尽快用水冲洗。
2.实验中不要吃喝、抽烟或使用化妆品。
3.不要用嘴吸取试剂盒里的任何成份。
操作注意事项1.试剂应按标签说明书储存,使用前恢复到室温。
稀稀过后的标准品应丢弃,不可保存。
tnf-a名词解释

tnf-a名词解释
TNF-α(肿瘤坏死因子-α)是一种由多种细胞产生的细胞因子,它在机体的免疫反应和炎症过程中起着重要作用。
它主要由活化的巨噬细胞、单核细胞、淋巴细胞和自然杀伤细胞等细胞产生。
TNF-α可以通过与细胞表面TNF受体结合而发挥其生物学效应。
它可以激活巨噬细胞和中性粒细胞,促进炎症反应和免疫反应的发生。
TNF-α还能增强血管通透性,促进内皮细胞黏附分子的表达,并促使白细胞向炎症部位迁移。
此外,TNF-α还能刺激胃酸分泌和肠蠕动增强,对机体的代谢和造血功能也有一定影响。
在炎症疾病中,过度产生的TNF-α可导致炎症反应过激,引
发组织损伤和疾病的恶化,如类风湿关节炎、炎症性肠病等。
因此,抑制TNF-α的生理功能已成为多种治疗炎症性疾病的
方法,如使用抗TNF-α药物来控制炎症反应,减轻相关疾病
的症状和病程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
试剂盒使用说明书
本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:
本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的羊抗人抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:
样本处理及要求:
1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上
清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心
20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程
中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/
分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞
浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备
用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
分装后一份待检测,其余冷冻备用。
6. 标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上
进行试验,可将标本放于-20℃保存,但应避免反复冻融.
7. 不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1.标准品的稀释与加样:在酶标包被板上设标准品孔12孔,在第一、第二孔中分别加标
准品100μl;然后从第一孔、第二孔中各取50μl分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μl,混匀;然后在第三孔和第四孔中各取50μl分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50ul,混匀;混匀后从第
五、第六孔中各取50μl分别加到第七、第八孔中,再在第七、第八孔中分别加标准品
稀释液50μl,混匀后从第七、第八孔中分别取50μl加到第九、第十孔中,再在第九第十孔分别加标准品稀释液50μl,混匀后从第九第十孔中各取50μl加到第十一、第十二孔中,再在第十一、第十二孔分别加标准品稀释液50μl,混匀后从第十一、第十二孔中各取50μl弃掉。
(稀释后各孔加样量都为50μl,浓度分别为40 ng/ml,20 ng/ml ,
10 ng/ml,5ng/ml,2.5 ng/ml, 1.25 ng/ml)。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样
品孔。
在酶标包被板上待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30(48T的20倍)倍浓缩洗涤液用蒸馏水30(48T的20倍)倍稀释后备用。
5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此
重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色
15分钟.
10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
11.测定:以空白空调零,450nm波长依序测量各孔的吸光度(OD值)。
测定应在加终止
液后15分钟以内进行。
注意事项:
1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD值大于标准品孔第一孔的OD值),请先用样品稀释液稀释一定倍数(n倍)后再测定,计
算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
10. 如与英文说明书有异,以英文说明书为准。
计算:Array以标准物的浓度为横坐标,OD值为纵坐标,
在坐标纸上绘出标准曲线,根据样品的OD
值由标准曲线查出相应的浓度;再乘以稀释
倍数;或用标准物的浓度与OD值计算出标
准曲线的直线回归方程式,将样品的OD值
代入方程式,计算出样品浓度,再乘以稀释
倍数,即为样品的实际浓度。
(此图仅供参考)试剂盒性能:
1.样品线性回归与预期浓度相关系数R值为0.92以上。
2.批内与批见应分别小于9%和15%
检测范围:
0.7ng/ml -40 ng/ml
保存条件及有效期:
1.试剂盒保存:;2-8℃。
2.有效期:6个月。
