铜催化的偶联反应
铜催化芳基卤代烃与咪唑的偶联反应资料

目录摘要: (2)关键词: (2)引言 (3)1 实验部分 (4)1.1 实验原理 (4)1.2 实验仪器及试剂 (4)1.3 实验步骤 (4)1.4 产物及产率 (5)2 结果与分析 (5)3 讨论 (6)3.1 本实验的优点 (6)3.2 实验中的注意事项 (6)相关产物谱图: (7)参考文献 (10)致谢 (10)铜催化芳基卤代烃与咪唑的偶联反应田小李化学化工学院应用化学专业 2008级指导老师:秦大斌摘要:某些过度金属可催化亲电性不饱和碳与含活泼氢的氮、氧、硫、碳原子直接成键,这种交叉偶联反应是现代有机合成中重要的手段之一,与钯、镍等过度金属相比,铜是一种廉价且毒性低的金属。
近年来,亚铜催化的碳杂偶联反应以其高效、低成本和易制备等优点被广泛研究并应用于工业生产、有机合成及生物活性分子的制备中。
用铜来催化这些交叉偶联反应不仅可以节省贵金属的消耗,降低成本,而且可以减少对环境的污染,促进绿色化学的发展。
偶联反应,是由两个有机化学单位进行某种化学反应而得到一个有机分子的过程.偶联反应又可分为交叉偶联和自身偶联反应。
进行偶联反应时,介质的酸碱性是很重要的。
在这里,我们研究了以亚铜为催化剂,在弱碱性条件下芳基卤代烃与咪唑的偶联反应,其产物为咪唑衍生物。
咪唑衍生物种类繁多,如烷基咪唑、硝基咪唑、苯并咪唑、吡啶并咪唑,其在农业,医药等领域都有广泛应用。
关键词:铜催化;偶联反应;咪唑衍生物Copper catalyzed aryl radical coupling reaction of alkyl halides withimidazoleLi TianxiaoSchool of Chemistry and Chemical Engineering Grade 2008 Instructor:Dabin QinAbstract:Some transition metal catalyzed electrophonic unsaturated carbon containing active hydrogen, nitrogen, oxygen, sulfur, carbon atoms directly bonded, this cross-coupling reaction is one of the important tool in modern organic synthesis, Compared with palladium,nickel and other transition metals, copper is a cheap and low toxic metal. In recent years, the cuprous-catalyzed C hybrid coupling reaction has been extensively studied and used in the preparation of industrial production, organic synthesis and biological activity of molecules because its high efficiency, low cost and ease of preparation and other advantages. Using copper to catalyze cross-coupling reaction can not only save precious metal consumption, reduce costs, but also can reduce environmental pollution, and promote the development of green chemistry.Coupling reaction is a chemical reaction process of an organic molecule composed of two organic chemistry units. The coupling reaction can be divided into the cross-coupling and coupling reaction. The medium pH is very important when the coupling reaction.Here, we studied the copper as catalyst, in the condition of weak alkaline aryl halogenated hydrocarbons and imidazole coupling reaction, their product is the imidazole derivatives. There are wide variety of imidazole derivatives, such as alkyl imidazole, nitroimidazole, benzimidazole, pyridine and imidazole, which are widely used in agriculture, medicine and other fields.Key words:Copper catalysis, coupling reaction, sulfonated derivatives引言有机含氮化合物(即分子中含有C—N 键的有机化合物)是一类非常重要的化合物, 它不仅广泛存在于各类具有生理活性的天然产物、药物中, 也是诸多化工材料的重要组分, 有些更是生命活动不可缺少的物质. 因此在一些结构简单的含氮化合物基础上构建新的C—N键对这类化合物的合成显得尤为重要, 而对这一领域的研究也一直是有机化学的热点之一.Ullmann[1]在1903年首次提出了铜盐催化的芳香卤代物与胺反应合成二芳基胺衍生物的方法。
铜催化金属钐介入碳碳键还原偶联反应研究

标题:铜催化金属钐介入碳碳键还原偶联反应研究探讨一、引言在有机化学领域,金属催化的反应一直备受关注,其中铜催化反应在碳碳键还原偶联反应中具有重要的应用价值。
近年来,学术界对铜催化金属钐介入碳碳键还原偶联反应进行了深入研究,本文将探讨这一主题,并分析其深度和广度。
二、铜催化反应及其在有机合成中的应用铜是周期表中的一种过渡金属,具有良好的催化性能。
在有机合成中,铜催化反应广泛应用于碳碳键的形成、断裂和转化等反应中。
由于铜的廉价和丰富性,以及其在催化反应中的高效性能,铜催化反应已成为有机合成领域的研究热点之一。
三、金属钐介入碳碳键还原偶联反应的研究现状金属钐介入碳碳键还原偶联反应是一种重要的有机合成方法,其可以实现碳碳键的构建和功能基团的引入。
在过去的研究中,学者们主要关注于过渡金属如铜、镍等的催化作用及其机理,同时对碳碳键还原偶联反应的底物适用性、反应条件优化等方面进行了深入研究。
在以铜为催化剂的金属钐介入碳碳键还原偶联反应中,尤其受到了学者们的广泛关注。
一些新型的配体设计、反应条件优化以及底物范围的拓展,为金属钐介入碳碳键还原偶联反应的研究提供了新的发展方向。
四、个人观点和理解在我看来,铜催化金属钐介入碳碳键还原偶联反应是一项具有重要意义的研究领域。
其不仅可以为有机合成提供新的方法和策略,还可以促进金属催化反应的发展。
我个人认为,在今后的研究中,可以进一步探索金属钐介入碳碳键还原偶联反应在药物合成、功能材料制备等领域的应用,以期为科学研究和工业生产提供更加可持续和高效的方法。
五、总结与展望铜催化金属钐介入碳碳键还原偶联反应在有机合成领域具有重要的应用前景。
深度的研究将有助于揭示其反应机理、拓展其底物适用性,并加速其在药物合成、材料科学等领域的应用。
相信在未来的研究中,金属钐介入碳碳键还原偶联反应将取得更多令人振奋的成果,为化学领域的发展贡献力量。
以上为本文对铜催化金属钐介入碳碳键还原偶联反应的探讨,希望对您有所帮助。
金属催化C-O键形成合成二芳基醚的研究进展

CO2Me
68% yield
Cl
F
O NHBoc
O
t-Bu 42% yield
7% yield
CO2Me
Evans, D. A. et al Tetrahedron. Lett. 1998, 39, 2937.
铜催化芳基硼酸的偶联反应合成二芳基醚
B(OH)2 HO
R1
+
O Cu(OAc)2 (1-2 equiv) R2 Et3N or pyridine (2-3 equiv) R1
HO
OR
B
+
OR
PhB(OH)2 (PhBO)3 PhB(Oi-Pr)2
O Ph B
O
t-Bu 17% 43% 39%
29%
t-Bu Cu(OAc)2 (1 eq)
O
Et3N or pyridine (2 eq)
CH2Cl2, rt, 24 h
O Ph B
O
32% O Ph B O
21%
Me
O
Me
Ph B
MeR2 = H, Me, CN, CO2Me
P(t-Bu)2 Me
P(t-Bu)2
i-Pr
i-Pr i-Pr
i-Pr
P(t-Bu)2 i-Pr
6 i-Pr
7
8
i-Pr
Buchwald, S. L. et al Angew. Chem. Int. Ed. 2006, 45, 4321.
钯催化的Buchwald-Hartwig偶联反应合成二芳基醚
Ph
Ph
Ph ligand
n
n
OR
R = t-Bu, rt, 14 h, 79% R = TBS, rt, 16 h, 99% R = 4-MeOC6H4, rt, 70 h, 99%
金属催化偶联反应

利用连续流动反应技术,实现反应物的高效混合和传质,提高反应 速率和选择性。
优化反应动力学参数
通过调整反应物浓度、催化剂用量等反应动力学参数,实现反应的 高选择性和高效率。
06
金属催化偶联反应的挑战与 未来发展
面临的挑战和问题
选择性问题
金属催化偶联反应中,如何实现高选择性地合成目标产物是一个重要挑战。不同底物和反应条件下,选择性控制需要 更加精细的策略。
过渡金属催化偶联反应
随着过渡金属催化剂的发展,金属催化偶联反应取得了重大突破。过渡金属(如铜、镍、 铁等)具有较低的毒性和成本,且可在较温和的条件下实现高效催化。这些催化剂可通过 均相或多相体系进行反应,具有广泛的应用前景。
金属有机框架(MOFs)在偶联反应中的应用
近年来,金属有机框架(MOFs)作为一类新型多孔材料,在金属催化偶联反应中展现出独 特的优势。MOFs具有高的比表面积、可调的孔径和化学功能性,可作为催化剂载体或直接 作为催化剂参与反应,提高反应的效率和选择性。
04
金属催化偶联反应在有机合 成中的应用
构建碳-碳键的方法
01
02
03
交叉偶联反应
利用不同的有机金属试剂 进行交叉偶联,构建碳-碳 键,如Suzuki偶联、 Heck偶联等。
自身偶联反应
相同的有机金属试剂在金 属催化剂作用下进行自身 偶联,生成对称与亲核试剂发生烯丙基化 反应,构建碳-碳键。
感谢您的观看
THANKS
绿色溶剂与试剂
开发可生物降解、低毒性的绿色溶剂和试剂,替代传统有毒有害的 溶剂和试剂,降低金属催化偶联反应的环境负担。
原子经济性
通过优化反应路径和提高原子利用率,实现金属催化偶联反应的高 原子经济性,减少资源浪费。
铜催化二羟基乙酸 、胺和炔三组分脱羧偶联反应的机理

铜催化二羟基乙酸、胺和炔三组分脱羧偶联反应的机理王钦【摘要】The author studied the mechanism of Cu-catalyzed three-component decarboxylative coupling reaction of glyoxylic acid ,an amine and an alkyne by using the density functional theory methods .First ,the reaction mechanism proposed in experiments was calculated ,and then a new reaction mechanism was proposed and calculated involving the coordination of the iminium salt , in situ formed from the glyoxylic acid and the amine , decarboxylation , alkyne coordination and insertion , protonation , nucleophilic addition , ligand exchange steps . The results of theoretical calculation show that the rate-determining step of the mechanism is the insertion of the alkyne ,and the energy barrier of reaction is 129 .8 kJ/mol ,w hich is in agreement with the result of experimental reaction temperature of 110 ℃ .%用密度泛函方法,研究铜催化二羟基乙酸、胺和炔三组分脱羧偶联反应的机理.通过计算实验提出的反应机理,给出并计算新的反应机理:二羟基乙酸与胺原位生成的亚胺盐,先配位到催化剂的铜中心发生脱羧反应,再进行端炔配位和插入、质子化、亲核加成、配体交换等步骤.理论计算结果表明,该机理的决速步骤为端炔插入,反应能垒为129.8 kJ/mol,与实验反应温度为110℃的结果一致.【期刊名称】《吉林大学学报(理学版)》【年(卷),期】2018(056)001【总页数】8页(P159-166)【关键词】铜催化;三组分反应;脱羧偶联反应;密度泛函理论;反应机理【作者】王钦【作者单位】吉林大学理论化学研究所 ,长春130021【正文语种】中文【中图分类】O643.3多组分反应(MCR)是由3个或3个以上反应物按一定反应方式生成一个产物的反应[1]. 作为合成复杂结构分子的多组分反应目前已广泛应用于有机化学等领域, 如新药开发、天然产物全合成等. 经典醛、胺和炔三组分偶联反应[2-6](A3-coupling)的生成产物为炔丙基胺类化合物, 具有光学活性, 是一类重要的有机化合物骨架及有机合成中间体, 可用于合成各种具有广泛生物活性和药理作用的含氮化合物. 近年来, 利用铜作为催化剂催化三组分偶联反应的研究发展迅速[5]. 与钯、镍等相比, 铜是一种廉价且低毒的金属. 除铜可催化醛、胺和炔三组分偶联反应外[6-7], 酮[8-9]、缺电子炔[10-11]、二卤代烷烃[12-15]、炔醛[16]、丙炔酸[17-20]、 2-氧代乙酸[21]和α-氨基酸[22]等均可在铜催化下发生三组分偶联反应.在铜催化下, 二羟基乙酸可与胺和炔进行脱羧偶联反应, 生成的产物为四组分偶联产物, 即有两分子的炔参与了反应, 从实验上对其微观反应机理进行了猜测[23], 如图1所示. 由图1可见, 端炔的C—H键与[Cu]反应生成炔铜中间体, 炔铜与二羟基乙酸和胺原位生成的亚胺盐进行配位和脱羧反应后进行质子化生成联烯, 最后联烯再与炔铜中间体反应, 脱去[Cu]得到有两分子炔参与的产物3-氨基-1,4-烯炔. 该催化循环中涉及脱羧反应, 且有两分子炔参与反应, 使得反应机理较复杂. 由于实验未检测到联烯中间产物, 因此, 本文通过理论计算, 从原子水平研究铜催化二羟基乙酸、胺和炔脱羧偶联反应的微观机理.图1 实验上提出的反应机理Fig.1 Reaction mechanism proposed in experiments1 计算方法所有计算均由Gaussian 09程序[24]完成. 运用密度泛函方法B3LYP[25-27]优化势能面上极小点和过渡态的几何构型, 对金属Cu原子采用Wachters-Hay基组6-311G(d)[28-29], 其他主族元素原子(C,H,O,N,P,Br), 除苯基采用6-31G(d)外, 均采用6-311G(d,p). 在相同水平下计算频率, 确定极小点没有虚频, 过渡态有且仅有一个虚频, 并得到298.15 K和101 325 Pa下的自由能校正. 用内禀反应坐标(IRC)[30]确定过渡态. 在已优化的几何构型基础上, 用密度泛函方法M06[31], 对Cu和其他主族元素原子分别采用6-311G(d)和6-311+G(d,p)基组, 使用SMD[32]溶剂模型, 在甲苯中计算单点能.2 结果与讨论根据实验[23]提出的催化循环,在理论上计算反应势能面. 将实验的磷配体PPh3取模型为PH3, 胺中N上两个烷基取代基取模型为Me, 二羟基乙酸和端炔的取代基与实验相同, 催化活性体H3P—Cu—Br(1)与端炔和亚胺盐反应得到的脱羧偶联产物配合物5的势能面如图2所示. 由图2可见, 催化活性体1先与端炔反应, 经过渡态TS1-2. 断开C—H键脱去HBr得到炔铜中间体2. 该步骤的能垒为76.7kJ/mol, 比催化活性体1与的能垒之和高61.5 kJ/mol. 二羟基乙酸和胺原位生成的亚胺盐进行配位得到配合物3. 经过渡态TS3-4, 炔基亲核进攻CN的C得到配合物4, 再经TS4-5进行脱羧反应脱去CO2得到配合物5.图2 催化活性体1与端炔和亚胺盐反应得到配合物5的势能面Fig.2 Potential energy surfaces calculated for reaction of catalytic active species 1 with alkyne and iminium salt to form complex 5在配合物5中, Ph取代的C与Cu相连, 经过渡态TS5-5iso发生1,3-迁移得到NMe2取代的C与Cu成键的配合物5iso. TS5-5iso分别比配合物5和5iso的能垒高32.9,10.9 kJ/mol, 表明配合物5易越过过渡态TS5-5iso, 与配合物5iso达到化学平衡, 如图3所示.图3 配合物5与5iso形成化学平衡的势能面Fig.3 Potential energy surfaces of chemical equilibrium formed by complexes 5 and 5iso配合物5有两条质子化反应路径: 1) HBr中H+加成到NMe2取代的C上, 经过渡态TS5-6A得到炔丙基胺配位的配合物6A, 如图4(A)所示. 2) HBr中的H+加成到Ph取代的C上, 经过渡态TS5-6B得到联烯配位的配合物6B, 如图4(B)所示. 配合物5iso也有两条质子化反应路径: HBr中的H+加成到NMe2取代的C和Ph 取代的C上, 分别经过渡态TS5iso-6A和TS5iso-6B得到配合物6A(图4(C))和6B(图4(D)). 其中过渡态TS5-6B的能垒最低, 表明反应更易经过渡态TS5-6B得到配合物6B, 即后续反应更易从联烯配位的配合物6B开始.图4 配合物5和5iso分别经两条质子化反应路径的势能面Fig.4 Potential energy surfaces for two protonation reaction pathways of complexes 5 and 5iso respectively配合物6B脱去联烯重新生成催化活性体1, 如图5所示. 由图5可见, 催化活性体1与端炔反应得到炔铜配合物2, 1→TS1-2→2的过程与图1过程相同, 联烯配位到炔铜配合物2得到配合物7, 配合物7经过渡态TS7-8发生插入反应生成配合物8, 再进行质子化反应得到配合物9, 最后解离得到最终产物3-氨基-1,4-烯炔和催化活性体1. 配合物6B和7均为联烯配位, 由于炔铜2比催化活性体1的能垒高61.5 kJ/mol, 配合物7比6B的能垒高65.4 kJ/mol, 过渡态TS7-8比配合物7的能垒高147.0 kJ/mol, TS7-8比6B的能垒高212.4 kJ/mol, 因此反应需从6B越过212.4 kJ/mol的能垒才能生成最终产物3-氨基-1,4-烯炔. 由于实验温度[23]为110 ℃, 无法越过212.4 kJ/mol的能垒, 因此下面考虑该反应是否有其他反应机理. 图5 配合物6B至产物3-氨基-1,4-烯炔的势能面Fig.5 Potential energy surfaces from complex 6B to product 3-amino-1,4-enyne催化活性体1与亚胺盐反应的过程如图6所示. 由图6可见, 亚胺盐配位到Cu中心得到配合物10, 先脱去膦配体生成配合物11, 再经过渡态TS11-12发生脱羧反应得到配合物12. 由于脱膦和脱羧可同时经过渡态TS10-12一步完成, TS10-12比TS11-12的能垒低29.0 kJ/mol, 因此反应更易经同时脱膦脱羧的路径生成配合物12.图6 催化活性体1与亚胺盐反应得到配合物12的势能面Fig.6 Potential energy surfaces calculated for reaction of catalytic active species 1 with iminium salt to form complex 12端炔配位到配合物12得到配合物14, 其过程如图7所示. 由图7可见, 配合物13比12的能垒低19.8 kJ/mol, 表明端炔容易配位. 再经过渡态TS13-14, 端炔插入到Cu—C键生成配合物14, TS13-14比配合物13的能垒高129.8 kJ/mol.图7 端炔配位到配合物12进行插入得到配合物14的势能面Fig.7 Potential energy surfaces calculated for coordination of alkyne to complex 12 and insertion to form complex 14由配合物14有两条反应路径得到配合物16, 如图8所示. 在第一条路径中, 配合物14与端炔作用, 经过渡态TS14-15活化C—H键脱去HBr得到配合物15后, HBr 提供H+进行质子化反应, 经过渡态TS15-16得到配合物16. 在另一条路径中, 端炔直接提供H+进行质子化, 经过渡态TS14-16一步生成配合物16. 由于TS14-16比TS14-15和TS15-16的能垒约高21 kJ/mol, 因此反应更易经第一条路径两步生成配合物16, 即14→TS14-15→15→TS15-16→16. 经过渡态TS16-17炔基亲核进攻CN的C得到配合物17后, 亚胺盐配位脱去最终产物3-氨基-1,4-烯炔, 重新生成配合物11.配合物12除发生端炔配位插入到Cu—C的反应机理外, 端炔还可提供H+进行质子化反应, 其过程如图9所示. 与配合物14到16的质子化过程类似, 配合物12到19包括两条反应路径:在第一条路径中, 端炔提供H+脱去HBr得到配合物18后, HBr提供H+给CN的C生成配合物19;在另一条路径中, 端炔直接提供H+给CN的C一步生成配合物19. 由于TS12-19比TS18-19的能垒低6.8 kJ/mol, 因此经过渡态TS12-19端炔直接提供H+的路径更易发生. 配合物19炔基亲核进攻CN的C经过渡态TS19-20得到配合物20后, 亚胺盐配位脱去炔丙基胺产物, 重新生成配合物11.图8 配合物14与端炔反应得到最终产物3-氨基-1,4-烯炔的势能面Fig.8 Potential energy surfaces calculated for reaction of complex 14 with alkyne to generate final product 3-amino-1,4-enyne由配合物12的端炔配位插入路径及质子化反应路径可见, TS13-14比TS12-19的能垒低21.9 kJ/mol, 表明经TS13-14生成3-氨基-1,4-烯炔产物的路径更易进行, 与实验[23]得到该产物的结果一致.最优的整个催化循环为:从配合物11开始, 经脱羧、端炔配位和插入、质子化、亲核加成、配体交换等步骤得到最终产物3-氨基-1,4-烯炔, 并重新生成配合物11, 其过程如图10所示. 其中端炔插入为决速步骤, 能垒为129.8 kJ/mol, 与实验上反应温度为110 ℃的结果一致. 从配合物11开始的脱羧反应, 若有膦配体, 则膦配体先配位, 再经脱膦脱羧反应生成配合物12;若无膦配体, 则配合物11直接脱羧生成配合物12, 该步骤能垒为105.0 kJ/mol(考虑到从配合物17亚胺盐取代最终产物得到配合物11需吸收23.5 kJ/mol的能量), 仍比决速步骤能垒低24.8 kJ/mol. 因此有无膦配体该反应均可发生, 且决速步骤不变 , 均为能垒为129.8 kJ/mol的端炔插入步骤, 与文献[23]结果相符.图9 配合物12与端炔反应得到另一产物炔丙基胺的势能面Fig.9 Potential energy surfaces calculated for reaction of complex 12 with alkyne to generate another product propargylamine图10 整个催化循环Fig.10 Whole catalytic cycle综上所述, 本文采用密度泛函理论方法, 对铜催化二羟基乙酸、胺和炔的三组分反应进行了理论研究. 先按实验提出的反应机理进行了计算, 即先生成联烯, 联烯再与炔铜反应生成最终产物. 结果表明, 生成炔铜反应需吸收61.5 kJ/mol的能量, 联烯与炔铜发生插入反应的能垒为147.0 kJ/mol. 炔铜不稳定及插入能垒较高导致该反应机理需越过212.4 kJ/mol的能垒才能生成最终产物, 与实验结果不符. 因此提出新的反应机理: 首先二羟基乙酸与胺原位反应生成的亚胺盐先配位到铜中心而发生脱羧反应, 其次端炔配位和插入, 第二个端炔C—H活化生成HBr后, HBr再提供H+进行质子化反应, 最后亲核加成以及亚胺盐取代生成的产物而重新生成催化活性体. 该反应机理的决速步骤为端炔插入步骤, 反应能垒为129.8 kJ/mol, 与实验上反应温度为110 ℃的结果一致.参考文献【相关文献】[1] Zhu J, Bienaymé H. Multicomponent Reactions [M]. Weinheim, Germany: Wiley-VCH, 2005.[2] WEI Chunmei, LI Zigang, LI Chaojun. The Development of A3-Coupling (Aldehyde-Alkyne-Amine) and AA3-Coupling (Asymmetric Aldehyde-Alkyne-Amine) [J]. Synlett, 2004, 35(40): 1472-1483.[3] Zani L, Bolm C. Direct Addition of Alkynes to Imines and Related CN Electrophiles: A Convenient Access to Propargylamines [J]. Chem Commun, 2006(41): 4263-4275.[4] Kouznetsov V V, Méndez L Y V. Recent Developments in Three-Component Grignard-Barbier-Type Reactions [J]. Synthesis, 2008, 39(21): 491-506.[5] Yoo W J, ZHAO Liang, LI Chaojun. The A3-Coupling (Aldehyde-Alkyne-Amine) Reaction:A Versatile Method for the Preparation of Propargylamines [J]. Aldrichimica Acta, 2011, 44: 43-51.[6] Peshkov V A, Pereshivko O P, Eycken E V, Van der. A Walk around the A3-Coupling [J]. Chem Soc Rev, 2012, 41(10): 3790-3807.[7] 张成刚, 陈文明, 李建军. Cu(Ⅰ)催化的多组分反应的研究进展 [J]. 有机化学, 2009, 29(2): 174-187. (ZHAN G Chenggang, CHEN Wenming, LI Jianjun. Progress in the Copper(Ⅰ)-Catalyzed Multicomponent Reactions [J]. Chinese J Org Chem, 2009, 29(2): 174-187.) [8] Rajesh U C, Gulati U, Rawat D S. Cu(Ⅱ)-Hydromagnesite Catalyzed Synthesis of Tetrasubstituted Propargylamines and Pyrrolo[1,2-a] Quinolines via KA2,A3 Couplings and Their Decarboxylative Versions [J]. ACS Sustainable Chem Eng, 2016, 4(6): 3409-3419. [9] Beek W E, Van, Stappen J, Van, Franck P, et al. Copper(Ⅰ)-Catalyzed Ketone, Amine, and Alkyne Coupling for the Synthesis of 2-Alkynylpyrrolidines and -Piperidines [J]. Org Lett, 2016, 18(19): 4782-4785.[10] ZHOU Lei, JIANG Huanfeng, LI Chaojun. Efficient Synthesis of γ,δ-Alkynyl-β-amino Acid Derivatives by a New Copper-Catalyzed Amine-Alkyne-Alkyne Addition Reaction [J]. Adv Synth Catal, 2008, 350: 2226-2230.[11] ZHOU Lei, SHUAI Qi, JIANG Huanfeng, et al. Copper-Catalyzed Amine-Alkyne-Alkyne Addition Reaction: An Efficient Method for the Synthesis of γ,δ-Alkynyl-β-amino Acid Derivatives [J]. Chem Eur J, 2009, 15: 11668-11674.[12] YU Dingyi, ZHANG Yugen. Copper-Catalyzed Three-Component Coupling of Terminal Alkyne, Dihalomethane and Amine to Propargylic Amines [J]. Adv Synth Catal, 2011,353(1): 163-169.[13] LIN Zhewang, YU Dingyi, ZHANG Yugen. Propargylic Amines Constructed via Copper-Catalyzed Three-Component Coupling of Terminal Alkynes, Benzal Halides and Amines [J]. Tetrahedron Lett, 2011, 52: 4967-4970.[14] Grirrane A, Alvarez E, Garcia H, et al. Deactivation of Cationic Cu-Ⅰand Au-ⅠCatalysts for A(3) Coupling by CH2Cl2: Mechanistic Implications of the Formation of Neutral Cu-Ⅰ and Au-Ⅰ Chlorides [J]. Ange Chem Inter Ed, 2014, 53(28): 7253-7258.[15] ZENG Suwei, XU Sen, WANG Yong, et al. Copper Nanoparticles Catalyzed Three-Component Coupling of Alkyne, Dihalomethane and Amine for the Synthesis of Propargylic Amine [J]. Chinese J Org Chem, 2015, 35(4): 827-834.[16] Choi Y J, Jang H Y. Copper-Catalyzed A3-Coupling: Synthesis of 3-Amino-1,4-diynes [J]. Eur J Org Chem, 2016, 2016(18): 3047-3050.[17] FENG Huangdi, ZHAO Panfeng, SUN Zhihua. CuI/CuBr2-Catalyzed Decarboxylative/A3 Reaction of Propiolic Acids for the Facile Synthesis of 1,4-Diheterocycle-2-butynes [J]. Tetrahedron Lett, 2015, 47(4): 5676-5680.[18] Gulati U, Rajesh U C, Rawat D S. CuO/Fe2O3 NPs: Robust and Magnetically Recoverable Nanocatalyst for Decarboxylative A3 and KA2 Coupling Reactions under Neat Conditions [J]. Tetrahedron Lett, 2016, 57(40): 4468-4472.[19] Ermolat’ev D S, FENG Huangdi, SONG Gonghua, et al. Copper(Ⅰ)-Catalyzed Decarboxylative Coupling of Propiolic Acids with Secondary Amines and Aldehydes [J]. Eur J Org Chem, 2014, 46(8): 5346-5350.[20] FENG Huangdi, Ermolat’ev D S, SONG Gonghua, et al. Synthesis of Symmetric 1,4-Diamino-2-butynes via a Cu(Ⅰ)-Catalyzed One-Pot A3-Coupling/Decarboxylative Coupling of a Propiolic Acid, an Aldehyde, and an Amine [J]. J Org Chem, 2012, 77(11): 5149-5154.[21] FENG Huangdi, Ermolat’ev D S, SONG Gonghua, et al. Microwave-Assisted Decarboxylative Three-Component Coupling of a 2-Oxoacetic Acid, an Amine, and an Alkyne [J]. J Org Chem, 2011, 76(18): 7608-7613.[22] BI Haipeng, TENG Qingfeng, GUAN Min, et al. Aldehyde- and Ketone-Induced Tandem Decarboxylation-Coupling (Csp3-Csp) of Natural α-Amino Acids and Alkynes [J]. J Org Chem, 2010, 75(3): 783-788.[23] FENG Huangdi, Ermolat’ev D S, SONG Gonghua, et al. Regioselective Cu(Ⅰ)-Catalyzed Tandem A3-Coupling/Decarboxylative Coupling to 3-Amino-1,4-enynes [J]. Org Lett, 2012, 14(7): 1942-1945.[24] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09. Revision A.02 [CP/CD]. Pitt Sburgh, PA: Gaussian Inc, 2009.[25] Becke A D. Density-Functional Exchange-Energy Approximation with Correct Asymptotic Behavior [J]. Phys Rev A, 1988, 38(6): 3098-3100.[26] Lee C, Yang W, Parr R G. Development of the Colle-Salvetti Correlation-Energy Formula into a Functional of the Electron Density [J]. Phys Rev B, 1988, 37(2): 785-789. [27] Becke A D. Density-Functional Thermochemistry. Ⅲ. The Role of Exact Exchange [J]. J Chem Phys, 1993, 98: 5648-5652.[28] Wachters A J H. Gaussian Basis Set for Molecular Wavefunctions Containing Third-Row Atoms [J]. J Chem Phys, 1970, 52: 1033-1036.[29] Hay P J. Gaussian Basis Sets for Molecular Calculations. The Representation of 3d Orbitals in Transition-Metal Atoms [J]. J Chem Phys, 1977, 66: 4377-4384.[30] Fukui K. The Path of Chemical Reactions: The IRC Approach [J]. Acc Chem Res, 1981, 14: 363-368.[31] ZHAO Yan, Truhlar D G. The M06 Suite of Density Functionals for Main Group Thermochemistry, Thermochemical Kinetics, Noncovalent Interactions, Excited States, and Transition Elements: Two New Functionals and Systematic Testing of Four M06Functionals and 12 Other Functionals [J]. Theor Chem Acc, 2008, 120: 215-241.[32] Marenich A V, Cramer C J, Truhlar D G. Universal Solvation Model Based on Solute Electron Density and on a Continuum Model of the Solvent Defined by the Bulk Dielectric Constant and Atomic Surface Tensions [J]. J Phys Chem B, 2009, 113(18): 6378-6396.。
铜催化C-N偶联反应总结

28
R1SO2NHR2
ArX
X=I,Br
N,N-二甲基甘氨酸
CuI
DMF
100/回流
24-48
K3PO4
50-99
29
PhX
X=I,Br
CuI
DMF
110
36
K2CO3
70-86
30
R1CONHR2
ArI
CuI
DMF/DMSO
110
24
K3PO4
65-98
31
R1CONHR2
R3B(OH)3
K3PO4
10-82
17
X=I,Br,Cl
DMEDA
CuI
二氧六环
THF
68,100
1-12
Cs2CO3
86-99
18
CF3CONH2
ArBr
DMEDA
CuI
二氧六环
45-75
24
K2CO3
6-99
19
BocNH2
DMEDA
CuI
THF
80
16
Cs2CO3
57-96
20
R1CONHR2
R3Cl
[Cu(OH)TMEDA]2Cl2
23-93
5
R1R2NH
ArX
X=Br,I
HOCH2CH2NMe2
CuI
Rt-90
11-48
K3PO4
2-90
6
R1R2NH
ArI
Cu(PPh3)3Br
甲苯
110-175
24
Cs2CO3
10-88
7
RNH2
R=杂环
铜催化的偶联反应

铜催化的偶联反应作者:佟林来源:《科技创新与生产力》 2016年第7期佟林(江苏蓝丰生物化工股份有限公司,江苏新沂 221400)摘要:文章介绍了铜催化偶联反应,设计了铜催化偶联反应实验步骤并优化了反应条件,讨论了反应条件的优化与筛选、反应溶剂的选择、反应碱的选择、催化剂量的选择、目标产物的核磁表征,指出在铜催化C-S偶联反应中,以KOH为碱、DMSO为溶剂的超强碱体系催化碘代芳烃与硫酚发生偶联反应,收率较高。
关键词:铜催化;交叉偶联;Ullmann;二苯硫醚中图分类号:O643.32;O625.72 文献标志码:A DOI:10.3969/j.issn.1674-9146.2016.07.106收稿日期:2016-03-30;修回日期:2016-05-06作者简介:佟林(1985-),男,江苏新沂人,助理工程师,主要从事应用化学研究,E-mail:379166092@。
C-N,C-O,C-S结构广泛存在于具有生理活性的天然产物、药物及聚合物材料中。
C-X(N,O,S)键的形成是有机化学中重要反应之一,利用该反应可以合成很多复杂结构的分子。
过渡金属催化的Ullmann偶联反应是实现此类化学键合成反应中最为常用且有效的一种手段。
过渡金属催化的交叉偶联反应条件温和,可以高效地合成一系列包含C-X(N,O,S)键的芳基化合物,从而在染料、医药、农药、日用化工品以及高聚物的制备中有着广泛的应用[1-2]。
1 铜催化偶联反应简介与Pd催化方法相比,Cu催化方法价廉易得,并对环境相对友好,近年来受到人们的普遍关注。
传统的Cu催化体系需要高温、强碱、计量的Cu或Cu盐、较长反应时间等比较苛刻的条件。
经研究发现,合适配体的应用有助于提高Cu催化反应的活性,人们开始倾向于寻找更加温和高效的配体来促进该反应,研究取得了一定的进展,尤其是对于芳基卤化物的研究。
经过几十年的发展,Cu催化剂实现C-X(N,O,S)交叉偶联反应不仅成为有机合成研究的一个新热点、过渡金属催化领域中的一个新动向,而且成为化学工业绿色化进程中的一个挑战性课题[3-9]。
suzuki_-miyaura偶联反应_概述说明

suzuki -miyaura偶联反应概述说明1. 引言1.1 概述Suzuki-Miyaura偶联反应是有机合成中一种重要的偶联反应方法,它以其高效、高选择性和广泛的底物适用性而受到广泛关注。
该反应以有机卤化物和有机硼酸酯为底物,在铜盐和配体的催化下进行,生成相应的偶联产物。
该反应可以构建碳-碳键和碳-氮键,常用于构建芳香化合物、杂环化合物等复杂分子结构。
1.2 文章结构本文将首先介绍Suzuki-Miyaura偶联反应的原理,包括反应机理、催化剂和底物选择性以及该反应的发展历史与应用领域。
然后会详细说明该反应的条件与步骤,包括底物准备与选择、反应条件控制以及步骤与工艺优化。
接下来将介绍实验操作与注意事项,包括实验操作步骤、常见问题与解决方法以及安全注意事项。
最后我们将给出结论部分,总结Suzuki-Miyaura偶联反应的优势和局限性,并展望其在未来发展中的重要性,并提出研究方向和未解决问题。
1.3 目的本文的目的是介绍Suzuki-Miyaura偶联反应及其在有机合成中的重要性。
通过对该反应原理、条件与步骤以及实验操作和注意事项的详细讲解,旨在帮助读者更好地理解和应用该反应,并掌握其正确操作方法。
同时,我们也将指出该反应存在的局限性,并展望其在未来发展中的前景和研究方向,希望能够激发更多科学家对该领域的兴趣并促进相关研究的推进。
2. Suzuki-Miyaura偶联反应的原理2.1 反应机理Suzuki-Miyaura偶联反应是一种重要的C-C键形成方法,其基本反应机理可被概括为以下几个步骤。
首先,芳香环上的硼酸和卤代烷基(或烯基)底物在催化剂的存在下发生吕得霉素配合物与底物之间的交换反应,生成含有硼酸酯官能团的中间体。
接下来,中间体与有机卤化物经过还原消除反应,在钯催化剂参与下进行脱羧作用,生成新的碳-碳键以及相应的芳香环。
最后,在正常工作温度条件下,溶剂中反应产物与锡盐或锂盐等强碱进行水解,得到目标产物。
Ulman苯偶联反应

3) 分子内的Ullmann反应 分子内的Ullmann反应可以用来合成多环化合物,为了 使反应能够顺利进行,通常使用碘代芳烃,且其邻位有 吸电子基团。
O O I C2H5 I C2H5 O Cu DMF,回流 C2H5 C2H5 O O O
90%
过渡金属催化的Ullmann反应
早期的Ullmann 反应中需要苛刻的反应条件(高温, 强碱当量的铜或者铜盐,较长的反应时间),而且产率 不高,导致了这个反应较难推广应用。在Ullmann反应 一百多年的发展过程中,化学家们发展了很多方法来克 服以上缺点。在钯和镍催化剂被发现和应用以后,人们 发现钯和镍具有反应条件温和、反应简单以及后处理简 单等优点
该方法操作简单安全, 不需要高压反应釜.反应机理 类似于直接提供氢气为还原剂的Pd/C 催化卤代芳烃偶合 反应.这一体系中利用锌与水反应当场生成氢气使二价 钯还原生成零价钯催化剂, 从而实现新的催化循环.
二价钯催化还原Ullmann 偶合反应:二价钯催化的Ullmann 类型的偶合的反应, 然而二 价钯并不能直接催化芳香卤的偶合, 因此它必须在化学计量的还原剂作用下使二价钯 转化为零价钯, 然后零价钯还原卤代芳烃发生偶合反应, 形成碳—碳键.
Ullmann反应研究的新进展
经过Ullmann反应不断研究发现,其不仅可以实现芳卤的偶联(C-C 键),还是形成C-N键、C-O键、C-S键的有效方法,通过Ullmann反应所生 成的芳基醚、芳基胺、芳基硫醚、烷基醚、烷基胺、烷基硫醚及其衍生物, 实现亲电性sp2碳与亲核试剂之间的直接偶联,被用来合成许多有机分子的 重要中间体,广泛应用于医药、农药、染料及有机导体、有机半导体等领 域中。反应的通式表示如下:
氰基化反应制备苯甲腈类化合物
三氟甲基稳定高价铜配合物

三氟甲基稳定高价铜配合物
三氟甲基稳定高价铜配合物是指利用三氟甲基可以稳定铜-碳键的特性,通过结构明确的三氟甲基一价铜配合物和烷基卤化物的氧化加成反应,分离并表征的四配位离子型和五配位中性的三价铜络合物。
在铜催化的偶联反应中,一般认为一价铜物种与亲电底物氧化加成生成三价铜中间体是该催化反应中的决速步,但由于三价铜络合物稳定性低,很难被分离鉴定,所以相关机理研究颇具挑战。
沈其龙课题组利用三氟甲基的这一特性,发现可以实现对催化反应中氧化加成/还原消除两个基元反应的能垒的调控,利用两种结构确定的三氟甲基一价铜配合物与卤代乙腈反应,在室温下实现了一价铜至三价铜的氧化加成过程。
这些发现对铜催化偶联反应机理的研究具有重要意义,也为相关反应的工业应用提供了新的思路。
芳卤的偶联(Ullmann反应)课件

(2)氧化加成/ 还原消除机理:
Cu X
Cu CuX
Cu
Cu
X
-CuX Cu
X
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
反应活性讨论
1)不同芳卤对反应的影响 进行偶联反应的芳卤的活性次序为:ArI>ArBr>ArCl,
卤素的邻位有吸电子的基团存在时,Ullmann反应活 性提高。 2)不对称二芳基化合物的合成 如采用两种活性相差较大的卤代芳烃进行偶联,则可以 得到满意的不对称芳基化合物。通常为了减少活泼芳 卤的自身对称偶联,可使用活性较低的氯化物或溴化 物。为了保证不活泼卤代芳烃能顺利反应,则可使用 碘代的芳烃。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
过渡金属催化的Ullmann反应
早期的Ullmann 反应中需要苛刻的反应条件(高温, 强碱当量的铜或者铜盐,较长的反应时间),而且产 率不高,导致了这个反应较难推广应用。在Ullmann 反应一百多年的发展过程中,化学家们发展了很多方 法来克服以上缺点。在钯和镍催化剂被发现和应用以 后,人们发现钯和镍具有反应条件温和、反应简单以 及后处理简单等优点
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
氰基化反应制备苯甲腈类化合物
Ullmann反应也已应用于卤代芳烃制备苯甲腈的氰基 化反应,在卤代芳烃的氰基化反应中,以Cu、Pd或Ni 等过渡金属络合物作催化剂催化反应。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
该方法操作简单安全, 不需要高压反应釜.反应机理 类似于直接提供氢气为还原剂的Pd/C 催化卤代芳烃偶 合反应.这一体系中利用锌与水反应当场生成氢气使 二价钯还原生成零价钯催化剂, 从而实现新的催化循 环.
铜催化的偶联反应

铜催化的偶联反应标题:铜催化的偶联反应:重塑化学合成的未来引言:化学合成一直是现代科学领域的核心。
为了开发更有效、可持续的合成方法,有机化学家们一直在不断探索新的催化剂和反应体系。
在这个过程中,铜催化的偶联反应逐渐成为研究的热点。
铜催化的偶联反应不仅具有高效、选择性高的特点,还能够构建复杂有机分子,为合成化学带来了前所未有的机遇。
本文将介绍铜催化的偶联反应的原理、应用和未来发展方向。
铜催化的偶联反应是一种通过铜催化剂催化的碳-碳键形成反应。
一般来说,该反应涉及两个有机物分子,其中一个含有活性碳氢键,另一个含有活性碳-氧、碳-氮或碳-卤键。
在铜催化剂的作用下,活性碳氢键上的氢被去除,而铜碳中间体形成。
然后,铜碳中间体与另一个有机物分子发生反应,形成新的碳-碳键。
2. 铜催化的偶联反应应用铜催化的偶联反应在有机合成中有广泛的应用。
例如,它可以用于构建碳-碳键和碳-氧键,合成酮、醛、酰胺等重要有机化合物。
此外,铜催化的偶联反应还可以用于构建芳香化合物,如苯、萘等,扩展了有机合成的范围。
这些反应具有高效、高选择性和可控性的特点,对于有机合成的发展具有重要的意义。
3. 铜催化的偶联反应的未来发展铜催化的偶联反应在有机合成领域已取得了巨大的成就,但仍面临一些挑战。
例如,反应条件的选择、底物适用性和反应的可控性等问题仍然需要进一步解决。
为此,有机化学家们正在努力开发新的铜催化剂和反应体系,以实现更高效、更可持续的合成方法。
此外,铜催化的偶联反应在药物合成、材料科学等领域也有着广阔的应用前景。
未来,我们可以期待铜催化的偶联反应在化学合成中发挥更重要的作用。
结论:铜催化的偶联反应作为一种重要的有机合成方法,具有广泛的应用前景和发展潜力。
通过不断地优化反应条件、开发新的催化剂和反应体系,铜催化的偶联反应将为合成化学带来更多的机遇和挑战。
在未来的研究中,我们期待铜催化的偶联反应能够在构建复杂有机分子和实现可持续合成方面发挥更重要的作用,为化学合成的发展做出更大的贡献。
偶联反应机理

偶联反应机理
在有机化学领域中,偶联反应是一种重要的合成方法,可以将两个或多个分子通过形成新的键而结合在一起。
这种反应通常由一个催化剂引发,可以在不同的底物之间形成碳-碳、碳-氮、碳-氧等键。
偶联反应机理的研究对于设计和优化合成路线至关重要。
一种常见的偶联反应是钯催化的Suzuki偶联反应。
在这种反应中,芳基溴化物和芳基硼酸酯经过交替的反应步骤,在钯催化下发生偶联,生成一个新的碳-碳键。
这种反应的机理经过多年的研究已经比较清楚:首先,芳基溴化物在钯催化下发生还原消除反应,生成一个活性的芳基钯中间体;同时,芳基硼酸酯在碱的作用下与钯生成的芳基钯中间体发生反应,形成新的碳-碳键。
另一种常见的偶联反应是钯催化的Heck偶联反应。
在Heck偶联中,烯烃和芳基卤化物在钯的催化下发生偶联反应,生成一个新的碳-碳键。
这种反应的机理也得到了广泛的研究:首先,烯烃与钯催化剂形成配合物,然后与芳基卤化物发生反应,生成一个新的碳-碳键。
这种反应通常在惰性气氛下进行,以防止氧化或还原反应的竞争。
除了钯催化的偶联反应,还有许多其他的偶联反应,如铜催化的Ullmann偶联、铂催化的Sonogashira偶联等。
每种偶联反应都有其独特的机理和反应条件,需要仔细设计和优化才能实现高效合成。
总的来说,偶联反应是有机合成中一种重要的反应类型,通过形成
新的键来构建复杂的分子结构。
对偶联反应机理的深入研究可以帮助化学家设计更高效、更环保的合成路线,为药物、材料等领域的研究提供重要支持。
希望随着技术的进步,偶联反应可以在更广泛的领域得到应用,为人类社会带来更多福祉。
7铜催化C_N交叉偶联反应的研究进展

摘要 对铜催化的 C-N 交叉偶联反应的最新研究进展作了综述. 按照反应中含氮化合物种类的不同将亲核试剂分为氨 基酸、胺、酰胺、含氮芳香杂环化合物、其它含氮化合物五类, 对各类亲核试剂参与反应的体系(包括亲电试剂、催化 剂前驱体、配体、溶剂、温度、碱、反应时间)做了全面归纳, 在此基础上以配体为主线对各类亲核试剂涉及的反应进 一步做了详细介绍. 另外, 对这一反应的机理研究也做了综述. 关键词 C-N 交叉偶联反应; 铜; 催化; 进展
Electrophile
Catalyst precusor
Solvent Temp./℃ Time/h Base
Yield/%
1
ArX X=Br, I
CuI
DMA
90
48 K2CO3 0~92[7]
2
CuI
DMF
100
48 K2CO3 53[10]
3
CuI
DMF
100
48 K2CO3 0~87[11]
182
有机化学
110~125 ℃催化完成卤代芳烃与咪唑的 C-N 交叉偶联 反应. 至此, 铜作为一类廉价低毒的催化剂已初步显示 出了其在这类反应中的催化潜力[9]. 这些研究结果也因 此引起了广大化学工作者的浓厚兴趣, 经过近十年的发 展, 铜催化的 C-N 交叉偶联反应也在诸多方面得到了补 充和完善. 本文便将这类构建 C—N 键的方法作一系统 综述. 以下我们将根据含氮化合物的不同将亲核试剂分 类, 并对应用于各类亲核试剂的催化体系分别加以介 绍.
偶联反应
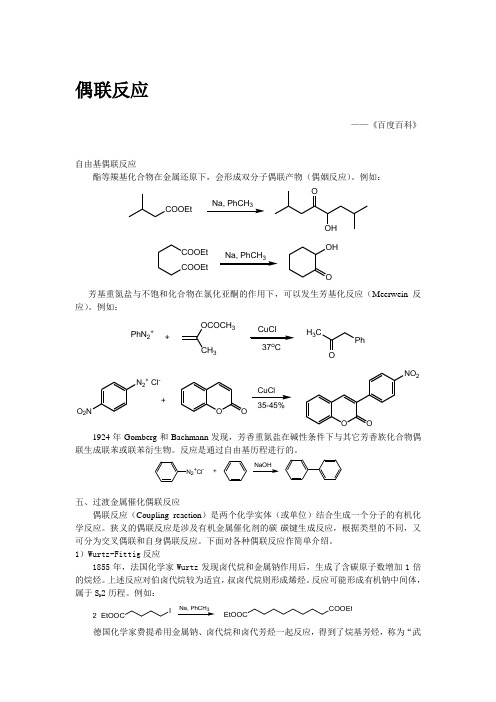
偶联反应——《百度百科》自由基偶联反应酯等羰基化合物在金属还原下,会形成双分子偶联产物(偶姻反应)。
例如:COOEt3OOHCOOEtCOOEt OHO 3芳基重氮盐与不饱和化合物在氯化亚酮的作用下,可以发生芳基化反应(Meerwein 反应)。
例如:PhN 2++OCOCH 3337o CH 3CPhON 2+ Cl-O 2NOOOONO 235-45%+CuCl1924年Gomberg 和Bachmann 发现,芳香重氮盐在碱性条件下与其它芳香族化合物偶联生成联苯或联苯衍生物。
反应是通过自由基历程进行的。
N 2+Cl -+五、过渡金属催化偶联反应偶联反应(Coupling reaction )是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
下面对各种偶联反应作简单介绍。
1)Wurtz-Fittig 反应1855年,法国化学家Wurtz 发现卤代烷和金属钠作用后,生成了含碳原子数增加1倍的烷烃。
上述反应对伯卤代烷较为适宜,叔卤代烷则形成烯烃。
反应可能形成有机钠中间体,属于S N 2历程。
例如:EtOOCI23COOEtEtOOC德国化学家费提希用金属钠、卤代烷和卤代芳烃一起反应,得到了烷基芳烃,称为“武尔兹-费提希反应”。
本法收率较高,副产物容易分离,是一种重要的制备烷基芳烃方法。
2)Glaser 偶联反应1869年,Glaser 发现末端炔烃在亚铜盐、碱以及氧化剂作用下,可以形成二炔烃化合物。
例如:4260%3)Ullmann 反应Ullmann 偶合反应是有机合成中构建碳—碳键最重要的方法之一。
Ullmann 偶合反应首次报道1901年, 它通常是利用铜作为催化剂, 催化卤代芳烃发生偶合反应生成联苯及其衍生物。
一般反应式为:2 ArXPd(0)或Pd(II)X= Cl 、Br 、I Ar-Ar目前该反应的底物范围、反应条件以及催化剂等都有了较大的改进。
铜催化剂参与反应

铜催化剂参与反应全文共四篇示例,供读者参考第一篇示例:铜催化剂是一种常用的催化剂,它在许多化学反应中发挥着重要作用。
铜催化剂能够促进反应的进行,降低反应的能量,加速反应速率,并提高反应的选择性。
铜催化剂在有机合成、氧化还原反应、氨基化反应等领域中得到了广泛应用。
铜催化剂参与的反应有很多种,下面我们就来详细介绍一些常见的反应类型及其机理。
1. 烯烃的环化反应铜催化剂在烯烃的环化反应中发挥重要作用。
烯烃经过环化反应后可以形成环烷烃或环芳烃等化合物,这对于有机合成有着重要意义。
铜催化剂通常能够催化烯烃的氧化环化反应,将烯烃转化为环化合物。
这种反应通常采用氧化剂作为辅助剂,如过氧酸、金属叶酸等。
2. 羧基的偶联反应在有机合成领域,羧基的偶联反应也是一种常见的反应类型。
铜催化剂可以促进羧基之间的偶联反应,形成碳-碳键或碳-氧键。
这种反应通常以铜催化剂为主导,通过活化羧基中的碳原子或氧原子来实现羧基之间的偶联。
铜催化剂还常常用于炔烃的环加成反应中。
炔烃经过环加成反应后可以形成环戊烷或环戊二烯等化合物,这对于有机合成也有着极大的意义。
铜催化剂通常能够加速炔烃的环加成反应,降低反应的活化能垒,提高反应的速率。
4. 芳香族化合物的取代反应5. 碳碳键形成反应铜催化剂在碳碳键形成反应中也是一个重要的催化剂。
碳碳键的形成对于有机合成来说是至关重要的,而铜催化剂可以促进碳碳键的形成反应,降低反应的活化能,提高反应的速率,从而实现碳碳键的高效合成。
第二篇示例:铜催化剂是一种在许多有机合成反应中起着重要作用的催化剂。
铜催化剂具有良好的催化活性和选择性,广泛应用于碳-碳键和碳-氮键的形成以及氢原子转移等反应中。
本文将重点介绍铜催化剂在有机合成中的应用和作用原理。
我们来介绍一下铜催化剂在碳-碳键和碳-氮键形成反应中的应用。
在有机合成中,碳-碳键的形成对于构建有机分子结构至关重要。
铜催化的Cross-Coupling反应是一种常用的方法来实现碳-碳键的形成。
金属催化剂在有机合成中的应用

金属催化剂在有机合成中的应用金属催化剂是有机合成领域中的重要工具,通过催化反应促进化学物质的转化和合成。
金属催化剂的应用广泛,包括有机合成中的碳-碳键形成、碳-氧键形成、碳-氮键形成等重要反应。
本文将探讨金属催化剂在有机合成中的应用以及这些催化反应的优势和挑战。
一、金属催化剂在碳-碳键形成反应中的应用碳-碳键形成反应是有机合成中最基础且最重要的反应之一。
金属催化剂在碳-碳键形成反应中起到关键作用,常用的金属催化剂包括钯、铂、铜等。
例如,钯催化的Suzuki偶联反应可以将芳香环和有机硼酸钾进行交叉偶联,合成目标化合物。
铜催化的Sonogashira偶联反应可以在碳碳三键形成的同时引入取代基,构建复杂有机分子。
二、金属催化剂在碳-氧键形成反应中的应用碳-氧键形成反应在有机合成中也具有重要地位,常见的反应包括醇酯化、醇醛缩合等。
金属催化剂在这些反应中起到催化剂的作用,常用的金属催化剂包括钌、铑等。
例如,钌催化的醇酯化反应可以将醇和酸酐反应得到酯化产物。
铑催化的醇醛缩合反应可以将醇和醛反应得到酯化产物。
三、金属催化剂在碳-氮键形成反应中的应用碳-氮键形成反应是有机合成中的重要反应,常见于氨基酸、药物分子的合成等领域。
金属催化剂在碳-氮键形成反应中起到非常重要的作用,常用的金属催化剂包括钯、铜等。
例如,钯催化的Suzuki-Miyaura偶联反应可以将芳香醚与芳香胺构建成N-芳香醚的键。
铜催化的Buchwald-Hartwig偶联反应可以将苯胺与卤代烃偶联,构建氨基取代的化合物。
金属催化剂在有机合成中的应用不仅提高了反应的选择性和效率,也扩展了有机合成的研究和应用领域。
然而,金属催化剂的应用也面临着一些挑战。
首先,金属催化剂的催化活性和稳定性需要进一步改进,以提高反应效率。
其次,金属催化剂在催化反应中可能会引发副反应,导致产物失活或污染。
此外,金属催化剂的负载和回收利用也是一个挑战,需要开发更高效、可回收的金属催化剂。
铜催化卤代芳烃ullmannc-n偶联反应和水解反应研究

铜催化卤代芳烃ullmannc-n偶联反应和水解反应研究1. 什么是铜催化卤代芳烃Ullmann-C-N偶联反应铜催化卤代芳烃Ullmann-C-N偶联反应是一种有机合成方法,通过使用铜催化剂将卤代芳烃与氨基化合物(通常是胺)进行偶联反应。
这种反应可以在中性条件下进行,生成C-N键,从而构建芳香胺化合物。
这种反应对于有机合成领域非常重要,因为芳香胺化合物在医药、化学品和材料科学等领域具有广泛的应用。
2. 铜催化卤代芳烃Ullmann-C-N偶联反应的机理是什么铜催化卤代芳烃Ullmann-C-N偶联反应的机理是一个复杂的过程,涉及多个反应步骤。
首先,铜催化剂与卤代芳烃形成配合物。
然后,胺分子中的氮原子与卤代芳烃上的卤素形成中间体。
接下来,中间体被铜催化剂促使脱去卤素,并与胺分子发生亲电进攻反应形成Ar-N键。
最后,通过脱去配体,形成最终的芳香胺产物。
整个反应过程中,铜催化剂起到催化剂和氧化剂的作用。
3. 铜催化卤代芳烃Ullmann-C-N偶联反应有哪些优点铜催化卤代芳烃Ullmann-C-N偶联反应具有多个优点。
首先,这种反应方法具有高选择性,可以在芳烃分子中选择性地引入氨基基团而不影响其他功能团。
其次,反应条件温和,不需要高温或强酸碱条件,有利于可持续发展的绿色化学。
此外,铜催化剂具有较高的反应活性和广泛的底物适应性,可以应用于多种卤代芳烃和不同类型的氨基化合物。
所有这些优点使得铜催化卤代芳烃Ullmann-C-N偶联反应成为有机合成中的重要工具。
4. 铜催化卤代芳烃Ullmann-C-N偶联反应有哪些应用领域铜催化卤代芳烃Ullmann-C-N偶联反应在医药、化学品和材料科学等领域具有广泛的应用。
在医药领域,芳香胺化合物是许多药物分子的重要结构基元,通过铜催化卤代芳烃Ullmann-C-N偶联反应可以高效地合成这些关键结构。
在化学品领域,芳香胺化合物可以用作染料、涂料和高分子材料的前体。
在材料科学领域,通过铜催化卤代芳烃Ullmann-C-N偶联反应可以合成具有特定电子结构和光学性质的分子,用于有机电子器件和光电材料的制备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水相中铜催化的偶联反应
摘要
在胺的、醇、硫醇等的芳基偶联反应中,铜是一种强有力催化剂,但是,这些是在有毒的有机溶剂中进行的。
因此,使用温和的和良性的水作为溶剂已经引起了关注。
这里回顾了最近的铜催化的水相中的偶联反应。
并且对于水相反应中水的作用和铜催化的C-N键的形成进行了简述。
引言
在过去的几年当中,对于碳杂键的建立,铜催化剂被认为是一种有效的物质,并且在工业生产中得到了使用。
在这一类型的反应中,许多的温和的不同于以往在反应中使用的有害的有机溶剂水被开发。
这一工作实现了绿色化学的目标,避免了少量的有机溶剂带来的环境污染问题。
在许多的绿色溶剂中水是比较理想的[1]。
水被认为是一种比较好的良性溶剂。
在化工的生产中,水是一种消费较低、安全、使用和绿色的物质。
而在偶联反应中水不仅是一种好的溶剂而且还影响着反应的速度。
水的作用
在反应中,催化剂和化学计量的水在提高反应速率和化学反应选择和立体选择性上都有很大的影响[2]。
据报道一些研究的工作者认为水能够加速反应,这主要归咎于有机物质的疏水作用。
在反应中,由于有机物质不溶于水中这样它们能够和好的聚集在一起,紧密的接触而更好的反应。
这是因为反应物的
非极性部分不能与水有很好的相容性而致,同时这对于在许多的有机溶剂中的反应有较好的立体和电子效应的影响[3]。
然而,在么有加溶剂的情况下,让有机反应物很好的接触却没有得到好的产率,这可能是由于水的加入形成氢键的作用吧!
另一方面,有报道说,某些在水中发生的反应的加速和得到很高的产率的现象是因为有机反应物只能在水相的表面,以致这一反应发生在水相和有机相的界面一点接着一点地发生[4]。
报道还说在这样的反应体系中,不均匀性是加速反应的必要条件同时报道不均匀不是提高产率的原因。
报道还说氢键是发生加速反应的重要因素而不是前面说的由于紧密接触引起的。
最近有报道支持这一说法[5],有人通过研究水分子在水和油界面的行为,得出水分子在界面容易和产物形成氢键。
另外,在过渡金属催化的特殊情况下,通过水分子中的氧原子水分子可能会改变这过渡金属盒配合物螯合的立体结构。
比起在缺水的情况下,这一种螯合能够加速反应的进行。
总之,在反应中水的使用在绿色化学中表现处较好的优势。
铜催化的C-N键的形成
据报道[6]说在水中发生的对苯基邻氨基苯甲酸的芳基化在铜的作用下发生的例子。
由于水的本质特征在最初的水相反应中它的规模受到了较大的限制,因此,常常被有机溶剂所替代。
例如[7],有研究者在做溴吡啶的胺化时,用水做溶剂时没有用乙二醇做溶剂得到的产率高。
但是,也有报道说在酰胺的N芳基化中少量水的加入有助于反
应的进行,但是,只限于少量的底物。
在水和DMSO的混合溶液中有研究者研究了一些铜催化的氨基醇的N芳基化,发现异丙醇在做溶剂时得到比较好的结果,所以,他们选择了异丙醇作为溶剂。
更好的是有研究者在使用DMF和水做溶剂,K2CO3作为碱,碘化铜作为催化剂,成功地做成了一系列的有关氨基酸和碘化物的合成。
同时他们准备把这新奇的方案应用于生物活性分子。
最近一些研究者报道[8]了二苯基吡咯-2-磷酸酯,其中碘化亚铜作为催化剂和磷酸钾作为碱,发现它是有效的配体对于氨的芳基化。
更好的是他们发现在DMF作为溶剂时,少量水的加入使氨的芳基化过程变得容易,即:
无独有偶,有研究者成功地发现[9]在DMF中碘化亚铜作为催化剂TEAC 作为碱的情况下,对于咪唑的芳基化很好的实现了。
并且发现少量水的加入对于这是有利的。
这一条件成功的应用到了碘和溴的芳基氯上即:
还有研究者观察到[10],在水合磷酸钾作为减,N,N二甲基甲酰胺作为溶剂,碘化亚铜作为催化剂的条件下,吡啶和一系列的碘的芳基化合物成功反应了。
确实干碱可以导致聚合反应。
利用这一发现,他们决定把水作为溶剂,二甲乙醇胺作为配体来实现氨基酸的芳基化。
这一方案被发现不仅仅对于亲水的氨基酸实用而且二元胺也实用。
最近,微波辐射现在已经用到了一系列铜催化的氨的N芳基化。
有研究者[11]观察到BCO可以很好的和氧化铜螯合,在水作为溶剂时其对于一系列的氨和芳基溴的化合物有很好的偶联作用。
进一步的改变的情况下,即在使用氢氧化钾作为碱,TBAB作为想转移催化剂的条件下,对于芳基和芳基取代物也有同样的偶联范围。
研究者报道[12]在没有碱的条件下,使用活泼的铜在水中使用微波辐射进行芳基卤化物的偶联。
许多反应能够很好的在水中和自由的溶剂中得到和油浴同样的效果。
有意思的是,在同样标准加热的情况下,许多反应在水中比起在有机溶剂中有了很好的产率。
还有报道说在水中由于微波的辐射可以提高氨基酸和氨基羧酸酯的外消旋化。
这些研究者在使用碘化亚铜作为催化剂时,对于氨基酸的芳基化表现出适中的产率。
可是只有在比较高的温度下才能得到氯代物的芳基化。
在水中,有研究者使用碘化亚铜作为催化剂,TMEDA作为配体时对于芳基氟化物的偶联得到了很好的产率。
而且这水相中的反应,催化剂可以很好的利用和循环能完成两种不同的苯氟的偶联。
参考文献:
[1]B. Schlummer and U. Scholz, Adv. Synth. Catal., 2004, 346,
1599.
[2] J. E. Klijn and J. B. F. N. Engberts, Nature, 2005, 435, 746
[3] C. M. Kleiner and P. R. Schreiner, Chem. Commun., 2006, 4315.
[4]S. Narayan, J. Muldoon, M. G. Finn, V. V. Fokin, H. C. Kolb and K. B. Sharpless, Angew. Chem., Int. Ed., 2005, 44, 3275.
[5] Y. Jung and R. A. Marcus, J. Am. Chem. Soc., 2007, 129,5492.
[6] R. F. Pellon, R. Carrasco and L. Rodes, Synth. Commun., 1993, 23,1447.
[7] F. Lang, D. Zewge, I. N. Houpis and R. P. Volante, Tetrahedron.Lett., 2001, 42, 3251.
[8]H. Rao, H. Fu, Y. Jiang and Y. Zhao, J. Org. Chem., 2005, 70,8107.
[9] L. Liu, M. Frohn, N. Xi, C. Dominguez, R. Hungate and P. J.Reider, J. Org. Chem., 2005, 70, 10135.
[10] Z. Lu, R. J. Twieg and S. D. Huang,Tetrahedron Lett., 2003, 44,6289.
[11] Z. Lu and R. J. Twieg, Tetrahedron Lett., 2005, 46, 2997.
[12]X. Zhu, Y. Ma, L. Su, H. Song, G. Chen, D. Liang and Y. Wan,Synthesi s, 2006, 3955.。
