氨基酸代谢
氨基酸分解代谢

高氨血症常见于先天性氨基酸代谢障碍、肝硬化、重症 肝炎等疾病。
治疗高氨血症的方法包括使用降氨药物、限制蛋白质摄 入、促进氨排泄等,同时需积极治疗原发病。
肝性脑病
肝性脑病是指由于肝功能严重 受损,导致氨代谢异常,引起 中枢神经系统功能紊乱的综合
酶的共价修饰
一些酶在催化过程中会发生共价修饰,如磷酸化、乙酰化 等。这些修饰可以改变酶的活性或调节酶的功能。
激素的调控
01
激素的合成与释放
激素在特定的内分泌细胞中合成,并通过血液或其他途径传输到靶细胞。
激素的合成和释放受到上游激素和营养物质的调节。
02 03
激素与受体结合
激素与靶细胞表面的受体结合,触发一系列信号转导途径,最终影响基 因表达和代谢过程。不同的激素与不同的受体结合,产生不同的生物学 效应。
02 氨基酸分解代谢的过程
氨基酸的活化
总结词
氨基酸的活化是指将游离氨基酸转变为氨基酰-tRNA的过程,是氨基酸分解代谢的起始步骤。
详细描述
在氨基酸的活化过程中,游离氨基酸与特定的tRNA结合,通过氨基酰-tRNA合成酶催化,形成氨基酰tRNA复合物。这个过程需要消耗ATP,为氨基酸提供活化所需的能量。
03 氨基酸分解代谢的调控
酶的调控
酶的激活与抑制
酶的活性受到多种因素的调节,包括激活剂和抑制剂的影 响。某些物质可以促进酶的活性,称为激活剂,而另一些 物质则抑制酶的活性,称为抑制剂。
酶的合成与降解
酶的合成和降解是动态过程,受到基因表达和蛋白质降解 的影响。在某些情况下,增加酶的合成可以促进代谢反应, 而酶的降解则可能降低代谢速率。
征。
第九章氨基酸代谢

5.96
CH3-CH-CH2 CHCOOH
Leu L
CH3
NH2
5.98
二、氨基酸的脱氨基作用
? 脱氨基作用 是指氨基酸脱去氨基生成相 应α-酮酸的过程。
氧化脱氨基
转氨基作用 ?方式
联合脱氨基
*嘌呤核苷酸循环
(一) 氧化脱氨基作用
1. L-谷氨酸脱氢酶广泛 存在于肝、脑、肾等组织中。 2. 其辅酶为 NAD+ 或NADP+。 3. GTP、ATP为其抑制剂; GDP、ADP为其激活剂。
尿素
鸟氨酸
氨基甲酰磷酸
精氨酸
延胡索酸
O2
NO
一氧化氮合酶 (NOS)
精氨酸代 琥珀酸
瓜氨酸
天冬氨酸
对心脑血管方面
NO在感觉传入以及学习记忆等有很重要的作用。先
天性精氨酸代琥珀酸合成酶(裂解酶)缺乏可出现严重
的精神障碍症状。还有研究发现 NO可抑制肿瘤的生长。
(三)高氨血症和氨中毒
1.血氨浓度升高称 高氨血症,此时可引起脑 功能障碍,称 氨中毒。常见于肝功能严重损伤、 尿素合成酶系的遗传缺陷。
1.总氮平衡 摄入氮 = 排出氮(正常成人)。 2.正氮平衡 摄入氮 > 排出氮(儿童、孕妇等 )。 3.负氮平衡 摄入氮 < 排出氮(饥饿、消耗性
疾病患者 )。 4.氮平衡意义 可反映体内蛋白质代谢的慨况。
(二) 需要量
成人每日最低蛋白质需要量为 30~50g,我 国营养学会推荐成人每日蛋白质需要量为 80g。
食物蛋白质
组织 分解 蛋白质
合成
氨基酸 代谢库
尿素 氨
α-酮酸
酮体 氧化供能
糖
Hale Waihona Puke 体内合成氨基酸 (非必需氨基酸)
氨基酸的一般代谢

总反应式:
2NH3+CO2+3ATP+3H2O
尿素 鸟氨酸 精氨酸酶 H2O 精氨酸
尿素+2ATP+AMP+2Pi+PPi
NH3 + CO2
H2O 瓜氨酸
H2O
NH 3
NH2 + CO2 + H2O 线粒体 2ATP 2ADP+Pi 氨基甲酰磷酸 Pi 瓜氨酸 N-乙酰谷氨酸
胞液
鸟氨酸
瓜氨酸 鸟氨酸循环 鸟氨酸 尿素 H2O 精氨酸 ATP AMP+PPi 精氨酸代琥珀酸
天冬氨酸
α- 酮戊二酸
氨基酸
草酰乙酸
谷氨酸
α- 酮酸
苹果酸 延胡索酸
⑷ 鸟氨酸循环的特点: ① 尿素分子中的2个氮原子,一个来自氨, 另一个来自天冬氨酸,而天冬氨酸又可 由其它氨基酸通过转氨基作用而生成。 ② 尿素合成是一个耗能的过程,合成1分子
尿素需要消耗4个高能磷酸键。
⑸ 氨的其它去路
① 在肾小管细胞中,谷氨酰胺在谷氨酰胺 酶的作用下脱氨基,氨基与尿液中的H+ 结合,然后以胺盐的形式由尿排除。 ② 参与合成非必需氨基酸。 ③ 参与核酸中碱基的合成。
4.高血氨症和氨中毒
正常生理情况下,血氯的来源与去路保持动 态平衡,血氨浓度处于较低的水平。氨在肝脏中 合成尿素是维持这种平衡的关键。 当肝功能严重损伤时,尿素合成发生障碍, 血氨浓度升高,称为高血氨症。 一般认为,氨进入脑组织.可与脑中的α酮戊二酸结合生成谷氨酸,氨也可与脑中的谷氨 酸进一步结合生成谷氨酰胺。因此,脑中氨的增 加可以使脑细胞中的α一酮戊二酸减少,导致三 羧酸循环减弱,从而使脑组织中ATP生成减少, 引起大脑功能障碍,严重时可发生昏迷,这就是 肝昏迷氨中毒学说的基础。
氨基酸代谢的三种方式

氨基酸代谢的三种方式
氨基酸的代谢主要有三种方式,分别是脱氨反应、反应价和酶促反应。
这几种氨基酸的代谢方式在生物体内起着至关重要的作用。
首先是脱氨反应。
氨基酸在体内以脱氨的方式释放能量,生成酮体。
这一过程会产生大量的氨气,从而导致酸碱失衡。
因此,生物体需要通过尿素循环将多余
的氨排出体外,维持体内的酸碱平衡。
其次是反应价。
反应价主要是通过氨基酸的羟基反应,来调节氨基酸的浓度。
当氨基酸的浓度过高时,生物体可以通过增加羟基反应的速度,来降低氨基酸的浓度。
反之,当氨基酸的浓度过低时,生物体可以通过减少羟基反应的速度,来提高氨基酸的浓度。
最后是酶促反应。
氨基酸在体内的代谢过程中,绝大部分是通过酶的催化来进行的。
氨基酸可以通过酶的催化,进行氧化脱羧、脱氨、转氨和分子重排等反应,从而实现其在体内的代谢。
综上所述,氨基酸的代谢主要有脱氨反应、反应价和酶促反应三种方式。
这三种方式在生物体内协同作用,维持着氨基酸的正常代谢,并使其发挥出应有的生
理功能。
氨基酸代谢名词解释

氨基酸代谢名词解释
氨基酸代谢是指体内氨基酸之间相互转化和利用的过程,是维持机体正常生命活动所必需的过程。
氨基酸代谢的异常会导致一系列疾病的发生,因此研究氨基酸代谢对于预防和治疗疾病具有重要意义。
在氨基酸代谢中,必需氨基酸是指人体无法自身合成而必须从饮食中摄入的氨基酸。
这些必需氨基酸包括赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、异亮氨酸、亮氨酸和缬氨酸。
这些必需氨基酸对于人体的生长、维持组织和细胞功能、合成激素和神经递质等具有重要作用。
条件性必需氨基酸是指在某些特定条件下必须由饲料供给的氨基酸。
这些条件性必需氨基酸包括异亮氨酸、亮氨酸和缬氨酸。
在这些氨基酸缺乏的情况下,饲料中的这些氨基酸会被转化为其他有用的蛋白质,从而保证机体其他重要蛋白质的供应。
氨基酸代谢中的异常现象包括氨基酸尿症、苯丙酮尿症等。
氨基酸尿症是一种常见的氨基酸代谢疾病,其特征是氨基酸尿和脑损伤。
苯丙酮尿症是一种常见的氨基酸代谢疾病,其特征是苯丙氨酸水平升高,导致苯丙氨酸及其酮酸蓄积,损害神经系统和其他器官。
研究氨基酸代谢对于预防和治疗疾病具有重要意义。
通过研究氨基酸代谢的异常现象,可以揭示相关疾病的发生机制,为预防和治疗疾病提供理论基础。
同时,通过研究氨基酸代谢的调节机制,可以开发新的药物和治疗方法,提高疾病的治疗效果。
7第七章 氨基酸代谢

转变为蛋白质。这就是为什么食物中蛋白质不能为糖、脂肪替代,
而蛋白质却能替代糖和脂肪供能的重要原因。
三、脂类与氨基酸代谢的联系 20种氨基酸分解后均能生成乙酰CoA,经还原缩合反应可合成脂肪 酸进而合成脂肪,即蛋白质可转变为脂肪。乙酰CoA还能合成胆固 醇以满足机体的需要。氨基酸也可作为合成磷脂的原料。脂类不
三、含硫氨基酸的代谢 体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
(一)蛋氨酸(甲硫氨酸)代谢
1.蛋氨酸是体内重要的甲基供体
三、含硫氨基酸的代谢 体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
(一)蛋氨酸(甲硫氨酸)代谢
2.蛋氨酸是必需氨基酸
3.蛋氨酸循环
三、含硫氨基酸的代谢
体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
一、氨基酸的脱氨基作用 (一)氧化脱氨基作用
一、氨基酸的脱氨基作用 (二) 转氨基作用
知识卡片
ALT是反应肝细胞损伤非常灵敏的指标
这是由于ALT主要存在于细胞质中,AST主要存在于线粒体中。病变较 轻的肝病如急性肝炎时,释放入血的转氨酶主要是ALT,血中ALT升高 程度高于 AST 。但在慢性肝炎或中毒性肝炎,特别是肝硬化时,病变
累及线粒体,此时AST升高程度就会超过ALT。故在国外,对怀疑是肝
炎患者,常同时测 AST 和 ALT ,并计算 AST/ALT 的比值,以此判断肝炎
的变化与转归。
一、氨基酸的脱氨基作用
(三)联合脱氨基作用
联合脱氨基作用有以下特点: 1.联合脱氨基作用的顺序一般先转氨 基,再氧化脱氨基。 2.转氨基作用的氨基受体是α-酮戊
氨基酸代谢

第十二章 氨基酸代谢第一节 体内氨基酸的来源一、 外源氨基酸(一)蛋白质在胃和肠道被消化被成氨基酸和寡肽1.场所一:胃酶类:胃蛋白酶原、胃酸、胃蛋白酶消化程度:多肽及少量氨基酸2.场所二:小肠酶类:肠激酶、胰液蛋白酶(原)、内/外肽酶 消化程度:氨基酸和小肽——小肠是蛋白质消化的主要部位3.场所三:小肠粘膜细胞内酶类:寡肽酶(例如氨基肽酶及二肽酶等) 消化程度:最终产生氨基酸。
(二)氨基酸的吸收是一个主动转运过程吸收部位:主要在小肠粘膜细胞 吸收形式:氨基酸、寡肽、二肽 吸收机制:耗能的主动吸收过程1.方式一:载体蛋白与氨基酸、Na+组成三联体,由ATP 供能将氨基酸、Na+转入细胞内,Na+再由钠泵排出细胞。
2.方式二:γ-谷氨酰基循环(三)未被吸收的蛋白质在肠道细菌作用下发生腐败作用腐败作用的产物大多有害,如胺、氨、苯酚、吲哚、硫化氢等;也可产生少量的脂肪酸及维生素等可被机体利用的物质,对机体有一定的营养作用。
组胺和尸胺:降血压;酪胺:升血压;酪胺和苯乙胺:假神经递质(肝性脑病)二、 内源氨基酸(一)蛋白质的降解及其半寿期1.半寿期:蛋白质降低其原浓度一半所需要的时间,用t1/2表示。
2. PEST 序列:脯-谷-丝-苏,快速降解标志序列。
(二)真核细胞内有两条主要的蛋白质的降解途径胃蛋白胃蛋白酶 + 多肽碎片胃酸、胃蛋白酶 (十二指肠分泌,胆汁激活)1.外在和长寿蛋白质在溶酶体通过ATP-非依赖途径降解 (1)不依赖ATP (2)利用溶酶体中的组织蛋白酶降解外源性蛋白、膜蛋白和长寿命的细胞内蛋白2.异常和短寿蛋白质在蛋白酶体通过需要ATP 的泛素途径降解 (1)依赖ATP (2)泛素共价地结合于底物蛋白质,蛋白酶体特异性地识别被泛素标记的蛋白质并将其迅速降解,泛素的这种标记作用是非底物特异性的,称为泛素化。
(3)降解异常蛋白和短寿命蛋白 3*.P53蛋白:细胞内的分子警察由这种基因编码的蛋白质是一种转录因子,其控制着细胞周期的启动。
氨基酸代谢

Chapter 9 Metabolism of Amino Acids
氨基酸(amino acids)是蛋白质(protein)的基本 组成单位。 氨基酸代谢包括合成代谢和分解代谢。 本章主要讨论氨基酸的分解代谢。
第一节 蛋白质在体内的降解 第一节 蛋白质在体内的降解
COOH
H2N - CH CH2 COOH
天冬氨酸
N - CH CH2 NH (CH ) COOH C
2 3
H2N- CH COOH
精氨酸代琥珀酸
4.精氨酸代琥珀酸的裂解:
在胞液中由精氨酸代琥珀酸裂解酶催化,将精氨酸代琥珀酸裂解生成 精氨酸和延胡索酸。
NH2 C
COOH
精氨酸代琥 珀酸裂解酶
NH2 C NH (CH2)3 H2N- CH COOH
谷氨酰胺的运氨作用
肝外组织细胞 ATP + NH3 ADP + Pi
谷氨酰胺合成酶
glutamic acid
谷氨酰胺酶
glutamine
血液
NH3
肝细胞
H2O
第四节 氨基酸转变为生物活性物质 第四节 氨基酸转变为生物活性物质
一. 形成生物胺类
(一)5-羟色胺的生成:
5-羟色胺(5-hydroxytryptamine,5-HT)是一种重要的神 经递质,且具有强烈的缩血管作用。 5-羟色胺的合成原料是色氨酸(tryptophan)。
二、氨基酸的脱氨基作用
氨基酸主要通过三种方式脱氨基,即氧化脱氨基,联 合脱氨基和非氧化脱氨基。 在这三种脱氨基作用中,以联合脱氨基作用最为重 要;而非氧化脱氨基作用则主要见于微生物中。
(一)氧化脱氨基作用:
氨基酸代谢

氨基酸代谢蛋白质降解产生的氨基酸能通过氧化产生能量供机体需要,例如食肉动物所需能量的90%来自氨基酸氧化供给;食草动物依赖氨基酸氧化供能所占比例很小;大多数微生物可以利用氨基酸氧化供能;光合植物则很少利用氨基酸供能,却能按合成蛋白质、核酸和其他含氮化合物的需求合成氨基酸。
大多数生物氨基酸分解代谢方式非常相似,而氨基酸合成代谢途径则有所不同。
例如,成年人体不能合成苏氨酸、赖氨酸、甲硫氨酸、色氨酸、苯丙氨酸、缬氨酸、亮氨酸和异亮氨酸等八种必需氨基酸,婴幼儿时期能合成组氨酸和精氨酸,但合成数量不能满足要求,仍需由食物提供,昆虫不能合成甘氨酸。
人和动物,当食物缺少蛋白质或处于饥饿状态或患消耗性疾病时,体内组织蛋白质的分解即刻增强。
这说明人和动物要不断地从食物中摄取蛋白质,才能使体内原有蛋白质得到不断更新,但食物中的蛋白质首先要分解成氨基酸才能被机体组织利用。
本章只讨论蛋白质的酶促降解,组织内氨基酸的分解代谢和氨基酸合成代谢概况,而蛋白质的生物合成在本书第十三章讨论。
一、蛋白质的酶促降解膳食给人体提供各类蛋白质,在胃肠道内,通过各种酶的联合作用分解成氨基酸。
蛋白质在胃肠道内消化过程简述如下:食物蛋白质经口腔加温,进入胃后,胃粘膜分泌胃泌素,刺激胃腺的腔壁细胞分泌盐酸和主细胞分泌胃蛋白酶原。
无活性的胃蛋白酶原经激活转变成胃蛋白酶。
胃蛋白酶将食物蛋白质水解成大小不等的多肽片段,随食糜流入小肠,触发小肠分泌胰泌素。
胰泌素刺激胰腺分泌碳酸氢盐进入小肠,中和胃内容物中的盐酸。
pH达7.0左右。
同时小肠上段的十二指肠释放出肠促胰酶肽,以刺激胰腺分泌一系列胰酶酶原,其中有胰蛋白酶原、胰凝乳蛋白酶原和羧肽酶原等。
在十二指肠内,胰蛋白酶原经小肠细胞分泌的肠激酶作用,转变成有活性的胰蛋白酶,催化其他胰酶原激活。
这些胰酶将肽片段混合物分别水解成更短的肽。
小肠内生成的短肽由羧肽酶从肽的C端降解,氨肽酶从N端降解,如此经多种酶联合催化,食糜中的蛋白质降解成氨基酸混合物,再由肠粘膜上皮细胞吸收进入机体。
氨基酸的代谢

3
提高蛋白质营养价值的方法
①食物蛋白质的互补作用 将几种营养价值低的蛋白质混合食用,则必需氨基酸互 相补充而提高营养价值,为蛋白质的互补作用。
例如:谷类蛋白质(赖氨酸少 色氨酸多)豆类蛋白质(赖氨酸多 色氨酸少)
①提高蛋白质的消化率和利用率
加工或者烹调
.
5
第二节 氨基酸的一般代谢
一、氨基酸代谢概况 二、氨基酸的脱氨基作用
(一)氨的来源与去路
1、氨的来源 2、氨的去路
(二)高血氨与氨中毒
.
14
(一)氨的来源与去路
氨的来源
氨的去路
(1)内源性氨:组织
中氨基酸脱氨基作用是体 内氨的主要来源。
(2)外源性氨:由肠
道吸收的氨。 包括:自由食物蛋白质在 肠道腐败产生的氨;血中 尿素渗透至肠腔在细菌作 用下分解产生的氨。
(1)尿素的合成 (2)谷氨酰胺的合成 (3)氨的其他代谢途径
一、氨基酸的脱羧基作用 二、一碳单位的代谢
三、含硫氨基酸的代谢 四、芳香族氨基酸的代谢
.
34
一个车夫,赶着一辆马车, 车上坐着7个人,每个人背 着7个袋,每个袋里装7只 大猫,每只大猫带着7只小 猫,每个小猫带着7只老鼠 作为干粮,问:一共多少条 腿?求腿数!!!
.
35
一、氨基酸的脱羧基作用
几种重要的胺类物质
多胺
某些氨基酸在体内经脱羧作用可产生多胺。包括:腐胺、 亚精胺、精氨。
.
36
二、一碳单位的代谢
1、一碳单位的概念
某些氨基酸代谢过程中产生的只含有一个碳原子的 基团,称为一碳单位。
2、一碳单位的来源
主要由丝氨酸、组氨酸、甘氨酸、色氨酸代谢产生。
3、一碳单位的载体
氨基酸的代谢
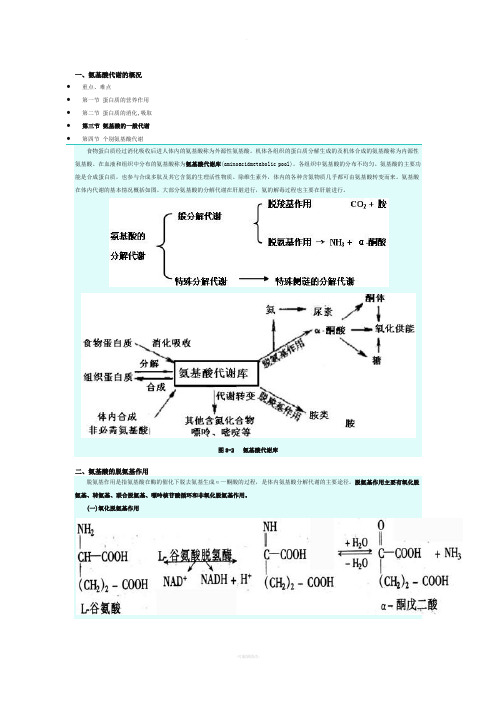
一、氨基酸代谢的概况∙重点、难点∙第一节蛋白质的营养作用∙第二节蛋白质的消化,吸取∙第三节氨基酸的一般代谢∙第四节个别氨基酸代谢食物蛋白质经过消化吸收后进人体内的氨基酸称为外源性氨基酸。
机体各组织的蛋白质分解生成的及机体合成的氨基酸称为内源性氨基酸。
在血液和组织中分布的氨基酸称为氨基酸代谢库(aminoacidmetabolic pool)。
各组织中氨基酸的分布不均匀。
氨基酸的主要功能是合成蛋白质,也参与合成多肽及其它含氮的生理活性物质。
除维生素外,体内的各种含氮物质几乎都可由氨基酸转变而来。
氨基酸在体内代谢的基本情况概括如图。
大部分氨基酸的分解代谢在肝脏进行,氨的解毒过程也主要在肝脏进行。
图8-2 氨基酸代谢库二、氨基酸的脱氨基作用脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α—酮酸的过程,是体内氨基酸分解代谢的主要途径。
脱氨基作用主要有氧化脱氨基、转氨基、联合脱氨基、嘌呤核苷酸循环和非氧化脱氨基作用。
(一)氧化脱氨基作用氧化脱氨基作用是指在酶的催化下氨基酸在氧化的同时脱去氨基的过程。
组织中有几种催化氨基酸氧化脱氨的酶,其中以L-谷氨酸脱氢酶最重要。
L-氨基酸氧化酶与D-氨基酸氧化酶虽能催化氨基酸氧化脱氨,但对人体内氨基酸脱氨的意义不大。
1.L-谷氨酸氧化脱氨基作用由 L谷氨酸脱氢酶(L-glutamatedehydrogenase)催化谷氨酸氧化脱氨。
谷氨酸脱氢使辅酶NAD+还原为NADH+H+并生成α-酮戊二酸和氨。
谷氨酸脱氢酶的辅酶为NAD+。
谷氨酸脱氢酶广泛分布于肝、肾、脑等多种细胞中。
此酶活性高、特异性强,是一种不需氧的脱氢酶。
谷氨酸脱氢酶催化的反应是可逆的。
其逆反应为α-酮戊二酸的还原氨基化,在体内营养非必需氨基酸合成过程中起着十分重要的作用。
(二)转氨基作用转氨基作用:在转氨酶(transaminase ansaminase)的催化下,某一氨基酸的a-氨基转移到另一种a-酮酸的酮基上,生成相应的氨基酸;原来的氨基酸则转变成a-酮酸。
氨基酸代谢

第一个反应是泛素C-末端的羧基与泛素活化 酶结合,消耗ATP,将泛素激活。
第二个反应泛素被转移到泛素结合酶的巯基 上;
第三个反应泛素蛋白连接酶识别待降解蛋白 质,并将活化的泛素转移到蛋白质赖氨酸 的侧链氨基上,侧链氨基可连接上下泛素, 形成泛素链。
O
ATP AMP+PPi
O
泛素 C O- + HS-E1
(二)丙酮酸和草酰乙酸通过转氨基作用生成 丙氨酸和天冬氨酸
丙酮酸
或草酰乙酸
谷氨酸
转氨酶
丙氨酸
或天冬氨酸
α - 酮戊二酸
(三)谷氨酰胺合成酶利用谷氨酸和游离氨 合成谷氨酰胺
• 其余12种氨基酸体内可以合成,称非必需氨基酸。 (nutritionally non-essential amino acid)
组氨酸和精氨酸虽能在人体内合成,但 合成量不多,长期缺乏也能造成负氮平衡, 可以将这两种氨基酸视为营养半必需氨基酸 (nutritionally semi-essential amino acid)。 酪氨酸在体内需由苯丙氨酸为原料来合成, 半胱氨酸必需以蛋氨酸为原料来合成.
是一个26S蛋白质复合物, 由20S的核心颗粒(core particle, CP)和 19S的调节颗粒(regulatory particle, RP)组成。
核心颗粒
蛋白酶体的核心颗粒是由4个环——2个α环和 2个β环组成的圆柱体。
每个α环由7个α类型的亚基组成,它们位于 圆柱体的顶端。
每个β环由7个β类型的亚基组成,它们位于 圆柱体的中央。
β-羟酪胺和苯乙醇胺结构类似儿茶酚胺,它 们可取代儿茶酚胺与脑细胞结合,但不能传递 神经冲动,使大脑发生异常抑制。
CH2NH2 CH2
氨基酸代谢

1.4.9 第九章氨基酸代谢第九章氨基酸代谢学习目标知识目标(1)理解蛋白质的生理功能、需要量和营养价值。
(2)理解氨基酸代谢概况。
(3)阐述脱氨基作用的种类,列举转氨酶的应用意义。
(4)理解氨中毒的机制。
(5)阐述一碳单位的概念、意义,以及氨基酸脱羧基的意义。
能力目标(1)通过分析血氨的来源与去路,总结出降低血氨的措施。
(2)通过学习氨基酸特殊代谢,解释白化病、苯丙酮尿症(PKU)、尿黑酸症的原因。
蛋白质是生命活动的物质基础。
构成蛋白质的基本单位是氨基酸,体内合成蛋白质的氨基酸主要来源于食物中的蛋白质,蛋白质在体内要首先降解为氨基酸,氨基酸可供蛋白质合成时再利用,或进一步代谢,氨基酸还可以转变为糖或许多具有重要生理功能的其他含氮化合物。
1.4.9.1 第一节蛋白质的营养作用第一节蛋白质的营养作用一、蛋白质的生理功能(一)维持组织细胞的生长、更新和修复蛋白质参与构成机体的各种组织细胞。
人体膳食中必须提供足够质和量的蛋白质,才能维持机体生长发育、更新修补和增殖的需要,特别是组织损伤时,更需要从食物蛋白质中获得修补的原料。
(二)参与体内重要生理反应和物质输送人体体内的蛋白质具有多种特殊功能,如肌肉收缩、生物催化、血液凝固等都是由蛋白质实现的。
载体蛋白可以在体内运载各种物质,如酶(除核酶的本质是核酸外,人体体内大多数酶的本质是蛋白质)、多肽类激素、抗体(各种免疫球蛋白)、调节蛋白(如细胞信息传递过程中的G蛋白和钙调素等)、运输物质(如血红蛋白、清蛋白、载脂蛋白等)、血液凝固物质(除参与血液凝固的各种酶外,还有纤维蛋白等)。
(三)氧化供能1g蛋白质完全氧化可产生16.74kJ(4kcal)的能量。
一般来说,成人每日约有18%的能量来自蛋白质,但是蛋白质的这种功能可由糖或脂肪代替,因此氧化供能仅是蛋白质的一种次要功能。
二、蛋白质的生理需要量(一)氮平衡蛋白质的含氮量较恒定,平均约为16%。
食物中的含氮物质绝大部分是蛋白质,通过测定食物中的氮含量可估计出它所含的蛋白质。
第七章.氨基酸代谢

第七章.氨基酸代谢一、教学目标1.了解蛋白质酶促降解过程中各种主要酶的作用。
2.掌握氨基酸分解代谢的一般规律,包括脱氨基作用、转氨基作用、联合脱氨基作用和脱羧基作用。
3.掌握氨基酸分解产物氨和酮酸的进一步代谢。
4.了解氨基酸合成代谢的一般过程。
5.对于个别氨基酸的代谢,作为一般内容了解。
二、生化术语1.生物固氮作用(Biological nitrogen fixation):大气中的氮被还原为氨的过程。
生物固氮只发生在少数的细菌和藻类中。
2.脱氨(deamination):在酶的催化下从生物分子(氨基酸或核苷酸分子)中除去氨基的过程。
3.氧化脱氨(oxidative deamination):α-氨基酸在酶的催化下脱氨生成相应α-酮酸的过程。
氧化脱氨过程实际上包括脱氢和水解两个步骤。
4.转氨酶(transaminases):也称之氨基转移酶(aminotransferases)。
催化一个α-氨基酸的α-氨基向一个α-酮酸转移的酶。
5.转氨(transamination):一个α-氨基酸的α-氨基借助转氨酶的催化作用转移到一个α-酮酸的过程。
6.乒乓反应(ping-pong reaction):在该反应中,酶结合一个底物并释放出一个产物,留下一个取代酶,然后该取代酶再结合第二个底物和释放出第二个产物,最后酶恢复到它的起始状态。
7.氨基酸的联合脱氨作用(transdeamination): 一般认为氨基酸在体内不是直接氧化脱去氨基,而是采取联合的方式进行。
有以L-谷氨酸脱氢酶为中心的联合脱氨和嘌呤核苷酸循环两种方式,后者是氨基酸脱氨的主要的方式。
8.尿素循环(urea cycle):是一个由4步酶促反应组成的可以将来自氨和天冬氨酸的氮转化为尿素的代谢循环。
该循环是发生在脊椎动物肝脏中的一个代谢循环9.生糖氨基酸(glucogenic amino acids):那些降解能生成可作为糖异生前体分子,例如丙酮酸或柠檬酸循环中间代谢物的氨基酸。
生物化学-氨基酸代谢

CHNH 2 COOH
Gln
NH4+
入血 Glu
随尿排出
二、氨的转运
• 氨是有毒物质,血中的NH3主要是以 无毒的Ala及Gln两种形式运输的。
(一)丙氨酸-葡萄糖循环
(二)谷氨酰胺的运氨作用
(一)丙氨酸-葡萄糖循环
肌肉
血液
肝
氨基酸 α-酮酸
α-酮戊 Ala 二酸
Ala Ala
谷 氨 酸 丙酮酸
COOH
CH2 CH2 CO COOH α -酮戊二酸 COOH
H2C CH2
H2N CH COOH
L-谷 氨 酸
NADH + H+ + NH3
LL--谷谷氨氨酸酸脱脱氢氢酶酶
NAD+ + H2O
Ala + -酮戊二酸 Glu + NAD+ + H2O
丙酮酸 + Glu -酮戊二酸+ NADH + NH4+
肝中活性最高
α-酮戊二酸
AST
Glu 心肌中活性最高
(三)联合脱氨基作用
• 在转氨酶和谷氨酸脱氢酶的联合作用下, 使各种氨基酸脱下氨基的过程。它是体 内各种氨基酸脱氨基的主要形式。其逆 反应也是体内生成非必需氨基酸的途径。
R
H2N CH COOH
α-氨基 酸 转转氨酶
R
CO COOH α -酮酸
一、体内氨的来源
1. 氨基酸脱氨基作用:是主要来源。还有 少量胺的氧化。
2. 肠道吸收的氨:4g/日 ①蛋白质的腐败作用 ②肠道尿素的水解
尿素 肠菌尿素酶 H2O
2NH3 + CO2
3. 肾小管上皮细胞分泌氨
生物化学第三节 氨基酸的一般代谢

小节练习第三节氨基酸的一般代谢2015-07-07 71802 0一、体内蛋白质分解生成氨基酸体内的蛋白质处于不断合成与降解的动态平衡。
成人体内的蛋白质每天约有1%~2%被降解,其中主要是骨骼肌中的蛋白质。
蛋白质降解所产生的氨基酸,大约70%~80%又被重新利用合成新的蛋白质。
(一)蛋白质以不同的速率进行降解不同的蛋白质降解速率不同。
蛋白质的降解速率随生理需要而变化,若以高的平均速率降解,标志此组织正在进行主要结构的重建,例如妊娠中的子宫组织或严重饥饿造成的骨骼肌蛋白质的降解。
蛋白质降解的速率用半寿期(half-life,t1/2)表示,半寿期是指将其浓度减少到开始值的50%所需要的时间。
肝中蛋白质的t1/2短的低于30分钟,长的超过150小时,但肝中大部分蛋白质的t1/2为1~8天。
人血浆蛋白质的t1/2约为10天,结缔组织中一些蛋白质的t1/2可达180 天以上,眼晶体蛋白质的t1/2更长。
体内许多关键酶的t1/2都很短,例如胆固醇合成的关键酶HMG-CoA还原酶的t1/2为0.5~2小时。
为了满足生理需要,关键酶的降解既可加速亦可滞后,从而改变酶的含量,进一步改变代谢产物的流量和浓度。
(二)真核细胞内蛋白质的降解有两条重要途径细胞内蛋白质的降解也是通过一系列蛋白酶和肽酶完成的。
蛋白质被蛋白酶水解成肽,然后肽被肽酶降解成游离氨基酸。
1.蛋白质在溶酶体通过ATP非依赖途径被降解溶酶体的主要功能是消化作用,是细胞内的消化器官。
溶酶体含有多种蛋白酶,称为组织蛋白酶(cathepsin)。
这些蛋白酶对所降解的蛋白质选择性较差,主要降解细胞外来的蛋白质、膜蛋白和胞内长寿蛋白质。
蛋白质通过此途径降解,不需要消耗ATP。
2.蛋白质在蛋白酶体通过ATP依赖途径被降解蛋白质通过此途径降解需泛素的参与。
泛素是一种由76个氨基酸组成的小分子蛋白质,因其广泛存在于真核细胞而得名。
泛素介导的蛋白质降解过程是一个复杂的过程。
氨基酸代谢

L-谷氨酸脱氢酶:专一性强,分布广泛
(动、植、微生物),活力强,以NAD+或 NADP+为辅酶。
3、联合脱氨基作用
由于转氨并不能最后脱掉氨基,氧化脱氨 中只有谷氨酸脱氢酶活力高,转氨基和氧化 脱氨联合在一起才能迅速脱氨。 • AA的α- NH3借助转氨转移到α-酮戊二酸上, 生成相应的α-酮酸和谷AA。
5'
N N N R
5'
P
P
(二)氨基酸的脱羧基作用
AA
脱羧酶
专一性强
胺类化合物
(辅酶为磷酸吡哆醛)
谷AA 天冬AA 赖AA 鸟AA
丝氨酸 乙醇胺 胆碱
γ-氨基丁酸+CO2 β-丙AA+CO2 尸胺+ CO2 腐胺+ CO2
卵磷脂
色氨酸
吲哚丙酮酸
吲哚乙醛
吲哚乙酸
胺类有一定的生理作用,但有些胺类化合物有害(尤 其对人),应维持在一定水平,体内胺氧化酶可将多余 的胺氧化成醛,进一步氧化成脂肪酸。
Phe Tyr
琥 酰 珀 -CoA Ile M e t Se r Thr Val
3 再合成AA
COO
COO
L-谷氨酸脱氢酶
NH4 +
(CH2)2
C O
(CH2)2 HC
+ NH3
NADH+H
NAD++H2O
COO
α-酮戊二酸
COO
α-谷氨酸
(五)氨基酸与一碳单位
概念:含一个碳原子的基团
种类:甲基(methyl)、甲烯基(methylene、 甲炔基(methenyl)、甲酰基(formyl)及亚氨 甲基(formimino)
第十章 氨基酸代谢

P217
此反应发生在线粒体中; 鸟氨酸转氨甲酰酶(ornithine transcarbamoylase)催 化该反应;
鸟氨酸产生于细胞溶胶,所以它必须通过一个特异的运 送体系进入线粒体;
尿素循环的以后几步都在细胞溶胶中进行,瓜氨酸必须 从线粒体中脱出。
(3)尿素第二个氮原子的获取
不同生物其合成蛋白质的能力不同,所摄取的氮源也不
同,但要合成蛋白质,必须先合成氨基酸;
蛋白质代谢的概念(阅读)2-2
蛋白质的代谢主要是讨论生物机体内氨基酸和蛋白质的
合成、分解和转变的化学过程,以及这些过程与生物机
体的生殖、发育和一切生理之间的关系;
微生物、植物与动物的蛋白质代谢途径有其相同的一面,
(1)尿素第一个氮原子的获取
P216
反应发生于细胞溶胶; NH4+在ATP、Mg2+存在下与HCO3-缩合: 形成氨甲酰磷酸;
氨甲酰磷酸合成酶(carbamoylphosphate synthetase, CPS) (该酶不属于尿素循环的一员)催化该反应;
反应伴随有两个ATP的水解。
(2)氨甲酰磷酸的氨甲酰基转移到鸟氨酸上形成瓜氨酸
在柠檬酸循环中形成的草酰乙酸(经转氨基反应形成天 冬氨酸)将两循环连接在一起;
鸟氨酸循环把两个氨基和一个碳原子(CO2)转化为非 毒性的排泄物尿素;
每生成1mol尿素消耗3molATP;
尿素是哺乳动物的蛋白质代谢的最终产物;
尿素循环中的能量变化
循环中使用了4个“高能”磷酸键(3个ATP水解为两个
合成的尿素进入血液,再被肾脏汇集,从尿中排除;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十二章氨基酸代谢
一、名词解释
二、是非题
1、Lys在人体内可以通过复杂的合成途径合成,是人体生物合成所必需的氨基酸,故为“必需氨基酸”之一。
2、γ-谷氨酰循环的生理功能是向细胞内转运氨基酸。
3、对于苯丙酮尿患者来说Tyr也是必需氨基酸。
4、同型半胱氨酸是人体内蛋白质组成成分之一。
三、填空题
1、谷氨酸转变为α-酮戊二酸后,进一步氧化成二氧化碳,其中()分子二氧化碳在三羧酸循环中生成,______________分子二氧化碳在循环外生成。
四、单项选择题
1、下列哪个化合物参与鸟氨酸循环( )
A.丙氨酸( )
B.异柠檬酸( )
C.PRPP ( )
D.精氨代琥珀酸()
2、因严重疾病长期不能进食时,蛋白质的代谢特点是
A.肌肉蛋白质的分解减少
B.肌肉蛋白质的分解增加
C.尿中尿素减少
D.尿中尿素不变
3、在植物体内,能直接脱氨基形成三羧酸循环中间产物的氨基酸是
A.Thr
B.Ala
C.Ser
D.Asp
4、动物合成蛋白质的氮素来源是
A.N2
B.NH4+
C.NO3-
D.氨基酸
5、引起人类白化病的原因是由于体内缺乏:
A、尿黑酸氧化酶
B、酪氨酸酶
C、脯氨酸氧化酶
D、脯氨酸脱氢酶
6、苯丙氨酸酪氨酸降解后生成的进入三羧酸循环的物质是
A柠檬酸Bα-酮戊二酸C琥珀酰辅酶A D延胡索酸
五、简答题
1、请写出四种由甘氨酸参与合成的不同类型的生物活性物质,并分别说明他们的主要功用。
2、2.甲基化作用是体内重要的代谢反应,具有广泛的生理意义。
哪种氨基酸可以提供甲基?其活性形式如何?
六、论述题
1、试述天冬氨酸转变为葡萄糖的详细反应过程,并计算消耗的ATP的摩尔数
2、2
3、某一病孩反复呕吐,精神智力发育不全,并有毛发白斑现象,经化验,尿中苯丙氨酸与苯丙酮酸明显升高,试从生化角度回答
1、为什么苯丙氨酸、苯丙酮酸升高?与什么酶缺陷有关?
2、为什么毛发会有白斑现象?
3、如何予防与治疗?。
