分析化学试卷9及答案
分析化学试卷10

分析化学试卷10一、选择题1.下列有关系统误差的正确叙述是:A.系统误差具有随机性 B.系统误差在分析过程中不可避免C.系统误差具有单向性D.系统误差是由一些不确定的偶然因素造成的2.配制PH=9.0的缓冲溶液,缓冲体系最好选择A.一氯乙酸(PK a=2.86)-盐B.氨水(PK b=4.74)-盐C.六压甲基四胺(PK b=8.85)-盐D.醋酸(PK a=4.74)-盐3.实验室两位新分析人员对同一样品进行分析,得到两组分析结果。
考察两组接过的精密度是否存在显著性差异,应采用的检验方法是:A. t检验法B. Q检验法C. T检验法D. F检验法4.下列物质中,可以直接用来标定I2溶液浓度的物质是:A. As2O3B. 硼砂C. 邻苯二甲酸氢钾D. 淀粉KI 5.等体积的0.10mol/L的羟胺(NH2OH)和0.050mol/L的NH4Cl混合溶液的PH值为:(NH2OH PK b=8.04,NH3 PK b=4.74)A. 6.39B. 7.46C. 7.61D. 7.76 6.在水溶液中,HClO4酸和HCl酸均显示强酸性质而无法区别其强度,是由于A. 两种酸本身性质相同B. 两种酸均具有Cl元素C. 对两种酸而言,水是较强的碱D. 水易形成氢键7.用0.10mol/L NaOH标准溶液滴定0.10mol/L甲酸(PK a=3.75)时,最好应选用的指示剂是:A. 甲基橙(PK a=3.4)B. 甲基红(PK a=5.2)C. 酚红(PK a=8.0)D. 酚酞(PK a=9.1)8.用甲醛法测定(NH4)2SO4质量分数≥98%的肥田粉中NH4+含量时,若将试样溶解后用250ml容量瓶定容,用25.00ml移液管吸取三份溶液做平行测定,分别用0.2000mol/L NaOH溶液滴定,则应称取多少克试样?((NH4)2SO4 Mr=132)A. 2.6g~4.0gB. 1.3g~2.0gC. 5.2g~8.0gD.1.0g~1.5g9.将酚酞分别加入到MnS(a)和CuS(b)的饱和水溶液中,所观察到的现象是:(已知:MnS K sp=2×10-10;Cus K sp=6×10-36;H2S K a1=1.3×10-7,K a2=7.1×10-15 A. a,b均无色 B. a无色,b呈红色 C. a呈红色,b无色 D. a,b 均呈红色10.用BaSO4重量法测定煤中S的含量,最后洗涤沉淀的洗涤剂应选择:A. H2OB. 稀H2SO4C. 稀BaCl2D. H2O+NH4Cl11.使用磺基水杨酸分光光度法测定微量Fe3+时,光度计检测器直接测定的是:A. 入射光的强度 B. 吸收光的强度 C. 透过光的强度 D. 散射光的强度12.今在铵盐存在下,利用氨水作为沉淀剂沉淀Fe3+,若铵盐浓度固定,增大氨的浓度,Fe(OH)3沉淀对Ca2+、Mg2+、Zn2+、Ni2+等四种离子的吸附量将是A. 四种离子都增加B. 四种离子都减小C. Ca2+、Mg2+增加而Zn2+、Ni2+减小D.Zn2+、Ni2+增加而Ca2+、Mg2+减小13.(1)用0.050mol/L KMnO4溶液滴定0.25mol/L Fe2+溶液,(2)用0.010mol/L KMnO4溶液滴定0.050mol/L Fe2+溶液;上述两种情况下其滴定突跃将是A. 一样大B.(1)>(2)C.(2)>(1)D.缺电位值,无法判断14.用摩尔法测定Cl-;控制PH=4.0,其滴定终点将A.不受影响B.提前到达C.推迟到达D.刚好等于化学计量点15.在配位滴定中用返滴定法测定Al3+时,若在PH=5~6以某金属离子标准溶液回滴过量的EDTA,金属离子标准溶液应选用A. Ag+B. Zn2+C. Al3+D. Ca2+16.在螯合物萃取体系中,当水相的H+浓度越大时,其萃取效率A. 越低B. 越高C.取决于萃取剂的浓度D.取决于萃取常数17.在酸碱滴定中,选择强酸强碱作为滴定剂的理由是A.强酸强碱可以直接配制标准溶液B.使滴定突跃尽量大C.加快滴定反应速度D.使滴定曲线较美观18.“持久性有机污染物(POPs)”如二恶英定对环境和人体健康具有极大危害,对此类物质错误的描述是A.具有长期残留性和高度危害性B.只有通过生物方法可以全部降解C.Cl-离子可能与KMnO4反应D.以上均不对20.测定酸性粘土试样中SiO2的含量,宜采用的分解试剂是:A.K2CO3+KOHB.HCl+乙醇C.HF+HClD.CaCO3+NH4Cl二、填空题1.0.5000g有机物试样以浓H2SO4煮解,使其中的氮转化为(NH4)HSO4,并使其沉淀为(NH4)2PtCl6,再将沉淀物灼烧成0.1765g Pt,则试样中N%为________________________。
专升本《分析化学》_试卷_答案

专升本《分析化学》_试卷_答案专升本《分析化学》试卷答案一、选择题(每题 3 分,共 30 分)1、下列哪种方法不是定量分析化学中的常用方法()A 重量分析法B 容量分析法C 仪器分析法D 定性分析法答案:D解析:定性分析主要是确定物质的组成成分,而不是进行定量测定。
重量分析、容量分析和仪器分析则是定量分析中常见的方法。
2、误差的正确定义是()A 测量值与真值之差B 测量值与平均值之差C 操作不符合要求所造成的误差D 由于系统误差和偶然误差引起的误差答案:A解析:误差是指测量值与真值之间的差异。
真值是客观存在的,但通常难以准确获得,只能通过多次测量来逼近。
3、下列哪种情况会引起系统误差()A 天平零点突然有变动B 读取滴定管读数时,最后一位估计不准C 滴定时,不慎从锥形瓶中溅出少量试液D 试剂中含有微量杂质答案:D解析:系统误差是由某些固定的原因造成的,在相同条件下重复测量时会重复出现。
试剂中含有微量杂质会导致每次测量结果都受到相同的影响,从而引起系统误差。
4、精密度的表示方法不包括()A 平均偏差B 相对平均偏差C 标准偏差D 绝对误差答案:D解析:绝对误差是测量值与真值之差,用于表示误差的大小,而不是精密度。
精密度常用平均偏差、相对平均偏差、标准偏差等来表示。
5、用 01000mol/L HCl 溶液滴定 2000mL 01000mol/L NaOH 溶液,化学计量点时 pH 为()A 700B >700C <700D 无法确定答案:A解析:HCl 与 NaOH 完全中和时,生成的 NaCl 溶液呈中性,pH =700。
6、在酸碱滴定中,选择指示剂的依据是()A 指示剂的变色范围全部或部分落在滴定的 pH 突跃范围内B 指示剂的变色范围与化学计量点完全一致C 指示剂的变色范围应完全在滴定的 pH 突跃范围之外D 只要指示剂变色明显即可答案:A解析:指示剂的变色范围应全部或部分落在滴定的pH 突跃范围内,这样才能较为准确地指示滴定终点。
《分析化学》期末考试试卷附答案

《分析化学》期末考试试卷附答案一、填空题(每空2分,共40分)1.测定一物质中某组分的含量,测定结果为(%):59.82,60.06,59.86,60.24。
则平均偏差为;相对平均偏差为;标准偏差为;相对标准偏差为;置信区间为(18.33,05.0t)2.系统误差的减免是采用标准方法与所用方法进行比较、校正仪器及做试验和试验等方法减免,而偶然误差则是采用的办法减小。
3.有一磷酸盐混合溶液,今用标准盐酸滴定至酚酞终点时耗去酸的体积为V1;继续以甲基橙为指示剂时又耗去酸的体积为V2。
当V1=V2时,组成为;当V1<V2时,组成为。
(V1>0,V2>0)4.NH4CN质子条件为5.在含有Ca2+、Ag2+混合溶液中,在pH=12条件下,用EDTA标准溶液滴定其中的Ca2+。
加入三乙醇胺的作用是,加入NaOH的作用是。
6.某有色溶液,当液层厚度为1cm时,透过光强度为入射光强的80%。
若通过5cm的液层时,光强度将减弱%。
7.强碱滴定弱酸的滴定曲线中,滴定突跃的大小与和有关。
8.当电流等于扩散电流一半时,滴汞电极的电位称为。
不同离子在不同介质中具有特征值,是极谱分析的基础。
9.组分分子从气相到气-液界面进行质量交换所遇到的阻力,称为。
10.分子的外层电子在化学能的作用下使分子处于激发态,再以无辐射弛豫转入第一电子激发态的最低振动能级,然后跃迁回基态的各个振动能级,并产生辐射。
这种发光现象称为。
二、选择题(每题3分,共30分)1.下列有关随机误差的论述中不正确的是()A.随机误差是由一些不确定的偶然因素造成的;B.随机误差出现正误差和负误差的机会均等;C.随机误差在分析中是不可避免的;D.随机误差具有单向性2.下列各酸碱对中,属于共轭酸碱对的是()A.H2CO3——CO32-B.H3O+——OH—C.HPO42-——PO43-D.NH3+CH2COOH——NH2CH2COO—3.已知H3PO4的pK a1=2.12,pK a2=7.20, pK a3=12.36,若用NaOH滴定H3PO4,则第二个化学计量点的pH值约为()A.10.7 B.9.7 C.7.7 D.4.94.EDTA与金属离子形成螯合物时,其螯合比一般为()A.1:1 B.1:5 C.1:6 D.1:45.用异烟酸-吡唑酮作显色剂可测定水中CN-的含量。
完整版)大学分析化学试题和答案

完整版)大学分析化学试题和答案分析化学试卷一一。
填空(每空1分,共35分)1.写出下列各体系的质子条件式:1) NH4H2PO4: [H+]+[H3PO4]=[OH-]+[NH3]+[HPO42-]+2[PO43-]2) NaAc-H3BO3: [H+]+[HAc]=[H2BO3-]+[OH-]2.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长不变,透射比减小。
3.检验两组结果是否存在显著性差异采用t检验法,检验两组数据的精密度是否存在显著性差异采用F检验法。
4.二元弱酸H2B,已知pH=1.92时,[H2B]=[HB-];pH=6.22时[HB-]=[B2-],则H2B的pKa1=1.92,pKa2=6.22.5.已知Φ(Fe3+/Fe2+)=0.68V,Φ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 XXX滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为0.68V,化学计量点电位为1.06V,电位突跃范围是0.86-1.26V。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由黄色变为红色。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配比为99:1.8.容量分析法中滴定方式有直接滴定,反滴定,置换滴定和间接滴定。
9.I2与Na2S2O3的反应式为I2+2S2O32-=2I-+S4O62-。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称为吸收光谱曲线;光吸收最大处的波长叫做最大吸收波长,可用符号λmax表示。
11.紫外可见分光光度计主要由光源、单色器、吸收池、检测部分四部分组成。
12.XXX灵敏度以符号S表示,等于M/ε;XXX灵敏度与溶液浓度有关,与波长无关。
13.在纸色谱分离中,水是固定相。
大学分析化学试卷及答案

分析化学试卷一、判断题。
10分1、(×)在化学定量分析中,常采用的分析方法是微量分析。
2、(√)金属指示剂与金属离子生成的配合物的稳定性应比金属EDTA配合物的稳定性要差一些。
3、(√)指示剂的变色范围越窄越好。
4、(×)酸碱滴定中溶液愈浓,突跃范围愈大,可供选择的指示剂愈多。
5、(√)当金属离子与指示剂形成的显色配合物的稳定性大于金属离子与EDTA形成的配合物的稳定性时,易产生封闭现象。
6、(×)高锰酸钾法通常在强酸性溶液如HNO3溶液中进行。
7、(√)使用酸式滴定管时,应大拇指在前,食指和中指在后。
8、(√)随机误差具有重复性,单向性。
9、(×)滴定分析中,指示剂颜色突变时停止滴定,这一点称为化学计量点。
10、(×)有两组分析数据,要比较它们的测量精密度有无显著性差异,应当用Q验。
二、选择题。
20分1、分析化学依据分析的目的、任务可分为:…………………………………………( A )A:定性分析、定量分析、结构分析 B:常量分析、半微量分析、微量分析C:无机分析、有机分析 D:化学分析、仪器分析2、下列误差属于系统误差的是:……………………………………………………( B )A:天平零点突然变化 B:读取滴定管的度数量偏高C:环境温度发生变化 D:环境湿度发生变化3、用于反应速度慢或反应物是固体,加入滴定剂后不能立即定量完成或没有适当的指示剂的滴定反应,常采用的滴定方法是:………………………………………………(B)A:直接滴定法 B:返滴定法C:置换滴定法 D:间接滴定法4、以下试剂不能作为基准物质的是:……………………………………………( D )A:优级纯的Na2B4O7·10H2O B:99.99%的纯锌C:105-110。
C烘干2h的Na2C2O4 D:烘干的Na2C035、某AgNO3标准溶液的滴定度为T AgNO3/NaCl=0.005858g/L,若M NaCl=58.44,则AgNO3标准溶液的浓度是:…………………………………………………………………………( B )A:1.0 mol.L-1 B:0.1002 mol.L-1C:0.0100 mol.L-1 D:0.1 mol.L-16、下列各组混合液中,可作为缓冲溶液使用的是:…………………………………( C )A:0.1mol.L-1HCl与0.05mol.L-1NaOH等体积混合B:0.1mol.L-1HAc0.1mL与0.1mol.L-1NaAc1L相混合C:0.2mol.L-1NaHC03与0.1mol.l-1NaOH等体积混合D:0.1mol.L-1NH3·H20lmL与0.1mol.L-1NH4CllmL及1L水相混合7、在EDTA直接滴定法中,终点所呈现的颜色是:………………………………( B )A: 金属指示剂与待测金属离子形成的配合物的颜色B:游离金属指示剂的颜色C:EDTA与待测金属离子形成的配合物的颜色D:上述A项与B项的混合色8、在间接碘量法中,正确加入淀粉指示剂的时机是:……………………………(D)A:滴定前 B:滴定开始后C:终点前 D:近终点9、可以用直接法配制的标准溶液是:………………………………………………( C )A:Na2S2O3 B:NaNO3C:K2Cr2O7 D:KMnO410、使用碱式滴定管时,下列错误的是:…………………………………………( C )A: 用待装液淌洗滴定管2-3次B: 左手控制活塞,大拇指在前,食指在后挤捏玻璃珠外橡皮管,中指、无名指和小指辅助夹住出口管C: 左手控制活塞,大拇指在前,食指在后挤捏玻璃珠外橡皮管D: 读数时滴定管应保持垂直,视线、刻度线、液面凹月面三点一线三、填空题。
分析化学期末试卷及答案

分析化学期末试卷及答案2008 –2009 学年第⼆学期期末考试分析化学试卷⼀、选择题(每题2分,共30分)1.定量分析结果的标准偏差代表的是-----------------------------(C )。
A. 分析结果的准确度B. 分析结果的精密度和准确度C. 分析结果的精密度D. 平均值的绝对误差2.下列哪种情况应采⽤返滴定法-------------------------------------(C )。
A. ⽤AgNO3标准溶液测定NaCl试样含量B. ⽤HCl标准溶液测定Na2CO3试样含量C. ⽤EDTA标准溶液测定Al3+试样含量D. ⽤Na2S2O3标准溶液测定K2Cr2O7试样含量3.下列各项叙述中不是滴定分析对化学反应要求的是----------(D )。
A. 反应必须有确定的化学计量关系B. 反应必须完全C. 反应速度要快D. 反应物的摩尔质量要⼤4. 下列四个数据中为四位有效数字的-------------------------------- ( C )(1)0.0056 (2)0.5600(3)0.5006 (4)0.0506A. 1, 2B. 3, 4C. 2, 3D. 1, 45. 以下有关随机误差的论述正确的是------------------------------( C )A. 正误差出现概率⼤于负误差B. 负误差出现概率⼤于正误差C. 正负误差出现的概率相等D. ⼤⼩误差出现的概率相等6. 在⽤K2Cr2O7法测定Fe 时, 加⼊H3PO4的主要⽬的是--( B )A. 提⾼酸度, 使滴定反应趋于完全B. 降低化学计量点前Fe3+/Fe2+电对的电位,使⼆苯胺磺酸钠在突跃范围内变⾊C. 提⾼化学计量点前Fe3+/Fe2+电对的电位, 使⼆苯胺磺酸钠不致提前变⾊D. 有利于形成Hg2Cl2⽩⾊丝状沉淀7. ⽤Fe3+滴定Sn2+在化学计量点的电位是--------------------------( D )[' (Sn4+/Sn2+)=0.14V]' (Fe3+/Fe2+)=0.68V,A. 0.75VB. 0.68VC. 0.41VD. 0.32V8. 测定试样中CaO 的质量分数, 称取试样0.9080 g,滴定耗去EDTA 标准溶液20.50 mL, 以下结果表⽰正确的是---------------( C )A. 10%B. 10.1%C. 10.08%D. 10.077%9. 下列滴定分析操作中会产⽣系统误差的是-----------------------( C )A. 指⽰剂选择不当B. 试样溶解不完全C. 所⽤蒸馏⽔质量不⾼D. 称样时天平平衡点有±0.1mg的波动10. 某溶液含Ca2+、Mg2+及少量Al3+、Fe3+,今加⼊三⼄醇胺, 调⾄pH=10, 以铬⿊T为指⽰剂, ⽤EDTA滴定, 此时测定的是---------( A )A. Ca2+, Mg2+总量B. Ca2+量C. Mg2+量D. Ca2+, Mg2+, Al3+, Fe3+总量11. EDTA滴定⾦属离⼦时,若仅浓度均增⼤10倍,pM突跃改变---( A )A. 1个单位B. 2个单位C. 10个单位D. 不变化12. 符合朗伯-⽐尔定律的⼀有⾊溶液,当有⾊物质的浓度增加时,最⼤吸收波长和吸光度分别是------------------------------------------------ ( A )A. 不变、增加B. 不变、减少C. 增加、不变D. 减少、不变13. ⼈眼能感觉到的光称为可见光,其波长范围是----------------( B)A. 200~320nmB. 400~780nmC. 200~780nmD. 200~1000nm14. 下列各条件中何者不是晶形沉淀所要求的沉淀条件--------(A)A. 沉淀作⽤宜在较浓溶液中进⾏;B. 应在不断的搅拌下加⼊沉淀剂;C. 沉淀作⽤宜在热溶液中进⾏;D. 应进⾏沉淀的陈化。
云南大学分析化学题库9

云南大学至学年学期化学科学与工程学院各专业级本科《分析化学(1)》期末考试(闭卷)试卷(第9卷)满分100分;考试时间:120分钟;任课教师:学院专业学号姓名一、选择题(本大题共6小题,每题2分,共12分)1.在下列物质中能用直接法配制标准溶液浓度的是[ ] A:EDTA;B:CaCO3;C:NaOH;D:KMnO4答案:B2.下列情况中,对测定(标定)结果产生正误差的是 [ ]A:以失去部分结晶水的硼砂为基准物标定HCl的浓度;B:以BaSO4重量法测定钡时,沉淀剂H2SO4加入量不足;C:标定NaOH溶液时,所用的邻苯二甲氢钾中含有少量的邻苯二甲酸;D:用吸收了CO2的NaOH标准溶液测定HAc的含量;答案:D3.有两组分析数据,要比较它们的精密度有无显著性差异,则应当用哪种方法检验?[ ] (A)F检验(B)t检验(C)u检验(D)Q检验答案:A4.分析测定中的偶然误差,就其统计规律来说,下列叙述中正确的是- -( ) A:偶然误差的数值固定不变;B:偶然误差具有单项性和可预测性;C:正误差出现的机率大于负误差出现的机率;D:大误差出现的机率小,小误差出现的机率大,正负误差出现的机率是相等的。
答案:D5.有一份磷酸盐溶液,可能为Na 3PO 4、Na 2HPO 4及NaH 2PO 4中的一种或两种物质的混合物,以百里酚酞(p K HIn =10)为指示剂,用标准HCl 溶液滴定至终点,消耗HCl 体积V 1(mL ),再以甲基橙(p K HIn =3.4)为指示剂,继续用此HCl 溶液滴定至终点时,又消耗HCl 体积V 2(mL )。
若V 1>0,且V 2>V 1,则溶液组成为 [ ]A :Na 3PO 4;B :Na 3PO 4+Na 2HPO 4;C :Na 3PO 4+NaH 2PO 4;D : Na 2HPO 4+NaH 2PO 4 答案:B6.以HCl 标准溶液滴定NH 3⋅H 2O 时,分别以甲基橙和酚酞做指示剂,消耗HCl 的体积分以V (甲)和V (酚)表示,则V (甲)和V (酚)关系是 [ ](A) V (甲) > V (酚); (B) V (甲) = V (酚); (C) V (甲) < V (酚); (D) 无法确定 答案:A7.用0.1mol/L 的NaOH 溶液滴定0.1mol/L 的HCl 和0.1mol/L 的H 3PO 4(K a1 = 7.6⨯10-3、K a2 = 6.3⨯10-8、K a3 = 4.4⨯10-13)的混合溶液,在滴定曲线上出现几个突跃 [ ]A :1个;B :2个;C :3个;D :4个 答案:B8.在下列各组酸碱物质中,属于共轭酸碱对的是 [ ] A :H 3PO 4—Na 2HPO 4, B :(CH 2)6N 4H +—(CH 2)6N 4 C :H 2CO 3—CO 32- D :H 2Ac +—Ac - 答案:B9.酸碱滴定法选择指示剂时可以不考虑的因素 [ ] (A) 滴定突跃的范围; (B) 指示剂的变色范围; (C) 指示剂的颜色变化; (D) 指示剂相对分子质量的大小 答案:D10.若A -为强酸根,且体系中存在可与金属离子M 形成络合物的试剂L ,则难溶盐MA 在水中的溶解度为 [ ] (A) )1()(+L M sp K α; (B))(L M sp K α; (C) )(L M sp K α; (D))1()(+L M sp K α答案:B11.下列叙述中错误的是 [ ](A) AgCl 沉淀在0.1mol/L NaNO 3溶液中的溶解度大于其在纯水中的溶解度; (B) Ag 2CrO 4在0.0010mol/L AgNO 3或0.0010mol/L K 2CrO 4中的溶解度相等; (C) ZnS 易于在HgS 沉淀表面而不在BaSO 4沉淀表面继沉淀;(D) 继沉淀引入杂质的量随放置时间的延长而增加 答案:B12.络合反应一般都是在一定的pH 下进行的。
分析化学试卷(含答案)

《分析化学》试卷一.选择题(每题2分,共30分)1. 定量分析中,精密度与准确度之间的关系是( )A.精密度高,准确度必然高B.准确度高,精密度也就高C.精密度是保证准确度的前提D.准确度是保证精密度的前提2. 可用下列何种方法减免分析测试中的系统误差()A.进行仪器校正B.增加测定次数C.认真细心操作D.测定时保证环境的湿度一致3. 测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA 标准溶液20.50mL,以下结果表示正确的是( )A.10%B.10.1%C.10.08%D.10.077%4. 在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为()A.化学计量点B.滴定误差C.滴定终点D.滴定分析5. 滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积()mLA. 10B. 20C. 30D. 406. 共轭酸碱对的Ka与Kb的关系是()A.KaKb = 1B.KaKb =KwC.Ka/Kb =KwD.Kb /Ka =Kw7. 酸碱滴定中选择指示剂的原则是()A.指示剂变色范围与化学计量点完全符合B.指示剂应在pH =7.00时变色C.指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D.指示剂变色范围应全部落在滴定pH突跃范围之内8. 测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为()A.NH3的Kb太小B.(NH4)2SO4不是酸C.(NH4)2SO4中含游离H2SO4D.NH4+的Ka太小9. 一般情况下,EDTA与金属离子形成的配合物的配位比是()A.1:1B.2:1C.1:3D.1:210. 铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是()。
A.直接滴定法B.置换滴定法C.返滴定法D.间接滴定法11. 间接碘量法中加入淀粉指示剂的适宜时间是()。
分析化学试卷附答案
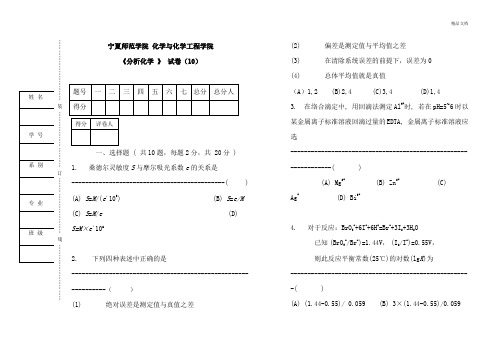
宁夏师范学院化学与化学工程学院《分析化学》试卷(10)一、选择题 ( 共10题,每题2分,共 20分 )1. 桑德尔灵敏度S与摩尔吸光系数e的关系是---------------------------------------------( ) (A) S=M/(e´106) (B) S=e/M (C) S=M/e(D)S=M×e´1062. 下列四种表述中正确的是--------------------------------------------------------------()(1) 绝对误差是测定值与真值之差(2) 偏差是测定值与平均值之差(3) 在清除系统误差的前提下,误差为0(4) 总体平均值就是真值(A)1,2 (B)2,4 (C)3,4 (D)1,43. 在络合滴定中, 用回滴法测定Al3+时, 若在pH=5~6时以某金属离子标准溶液回滴过量的EDTA, 金属离子标准溶液应选----------------------------------------------------------------( )(A) Mg2+ (B) Zn2+ (C)Ag+ (D) Bi3+4. 对于反应:BrO3-+6I-+6H+=Br-+3I2+3H2O已知(BrO3-/Br-)=1.44V,(I2/I-)=0.55V,则此反应平衡常数(25℃)的对数(lg K)为-----------------------------------------------------( )(A) (1.44-0.55)/ 0.059 (B) 3×(1.44-0.55)/0.059(C) 2×6×(1.44-0.55)/0.059(D) 6×(1.44-0.55)/0.0595. EDTA滴定金属离子时,若仅浓度均增大10倍,pM突跃改变--------------------------( )(A) 1个单位 (B) 2个单位(C) 10个单位 (D) 不变化6. 在氧化还原滴定中,配制Fe2+标准溶液时,为防止Fe2+被氧化,应加入--------------( )(A) HCl (B) H3PO4(C) HF (D) 金属铁7. 溴酸钾法测定苯酚的反应如下:BrO3- + 5Br- + 6H+→ 3Br2+ 3H2OBr2 + 2I-→ 2Br- + I2I2 + 2S2O32-→ 2I- + S4O62-在此测定中, Na2S2O3与苯酚的物质的量之比为-----------------------------------------( )(A) 6:1 (B) 4:1 (C) 3:1 (D) 2:18. 对 Ox-Red 电对, 25℃时条件电位( ) 等于--------------------------------------( )9. AgNO3滴定NaCl时,若浓度均增加10倍,则突跃pAg增加------------------------------( )(A)1个单位 (B)2个单位 (C)10个单位 (D)不变化………………………………装……………………………订……………………………线……………………10. 下面哪种说法不符合正态分布的特点--------------------------------------------------------( )(A) 大误差出现的概率小,小误差出现的概率大(B) 绝对值相同,正负号不同的误差出现的概率相等 (C) 误差为零的测量值出现的概率最大 (D) 各种数值的误差随机出现二、填空题 ( 共15题 30分 )11. 图1~图4是分光光度法中常见的图形,它们分别代表什么曲线(填A 、B 、C 、D)(1) 图1 __________ A. 工作曲线 (2) 图2 __________ B. 吸收曲线(3) 图3 __________ C. 络合比法测定络合物组成 (4) 图4 __________ D. 测量结果的相对误差 12. 在滴定分析中若指示剂的变色点与化学计量点恰好相同,____(能或不能)说滴定误差为零。
分析化学试题及答案

分析化学试题及答案分析化学试题及答案⼀. 填空(每空1分,共28分,答在试卷上)1.定量分析过程包括,,和四个步骤.2. 根据有效数字计算规则计算: 1.683 + 37.427.33÷21.40.056 = 14.4 。
3. 某酸H2A的⽔溶液中,若δH2 A为0.28,δ5δA2-,那么δA2-为。
4. 含有2+和3+的酸性缓冲溶液,欲在5~5.5的条件下,⽤标准溶液滴定其中的2+,加⼊⼀定量六亚甲基四胺的作⽤是;加⼊4F的作⽤是。
5.滴定时, 浓度增⼤10倍, 则滴定曲线突跃范围增⼤个单位; 若为滴定H34, 则突跃范围增⼤个单位.6.对于实验数据中的异常值的取舍,通常可根据、和⽅法来判断。
7. 莫尔法与佛尔哈德法的指⽰剂分别为、。
8. 紫外可见分光光度计由 , ,和四部分组成.9. 检验两组结果是否存在显著性差异采⽤检验法,检验两组数据的精密度是否存在显著性差异采⽤检验法。
10. 吸光物质的摩尔吸光系数与溶液的关,与波长关。
11. 以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最⼤处的波长叫做,可⽤符号表⽰。
12.光度法测定某物质,若有⼲扰,应根据和原则选择波长。
⼆. 简答和名词解释(每题2分,共 16 分,答在试卷纸上)1.什么是准确度?什么是精密度?2. ⽤K22O7溶液滴定2+试液时, 常向溶液中加⼊H34,为什么?3.已知滴定管的读数标准偏差为0.01 , 若滴定时耗去30.00 溶液, 则该溶液体积的相对标准偏差为多少?4写出浓度为c (4)23溶液的质⼦条件式。
5. 摩尔吸光系数6.下图是薄层⾊谱分离物质的⾊谱图,根据图写出值计算式。
7. 光度分析中,当浓度较⾼时,⼯作曲线逐渐偏离直线,这是什么原因?8 .在螯合物萃取体系中,影响液-液萃取分离的因素有哪些?三. 回答问题(每题4分,共24分,答在试卷纸上)1.为满⾜重量分析的要求,晶型沉淀的沉淀条件是什么,并简述其原因。
分析化学考试试卷及答案

分析化学试卷一、填空题(每空1分,共20分)1.测定一物质中某组分的含量,测定结果为(%):59.82,60.06,59.86,60.24。
则平均偏差为 0.16 % ;相对平均偏差为 0.26% ;标准偏差为0.20%;相对标准偏差为 0.33% ;置信区间为 (60.00±0.32)% (18.33,05.0=t )2.=⨯⨯⨯-002034.0151.21003.40.51347.03.滴定管的读数常有±0.01mL 的误差,则在一次滴定中的绝对误差可能为 ±2 mL 。
常量滴定分析的相对误差一般要求应≤0.1%,因此,滴定时消耗标准溶液的体积必须控制在 20 mL 以上。
4.从误差的基本性质来分,可以将它分为 随机误差 、 系统误差、 过失量误差 。
5.NH 4CN 质子条件为 [HCN]+[H +]=[OH —]+NH 36.已知HAc 的p K b =4.74,则0.10mol/L NaAc 溶液的pH= 8.877.六次甲基四胺的p K b =8.85,用它配制缓冲溶液时的pH 范围是 5.15±18.H 2C 2O 4的p K a 1=1.2,p K a 2=4.1。
当pH=5时,草酸溶液中的主要存在形式是C 2O 42-9.在含有Ca 2+、Ag 2+混合溶液中,在pH=12条件下,用EDTA 标准溶液滴定其中的Ca 2+。
加入三乙醇胺的作用是 掩蔽Fe 3+、Al 3+,加入NaOH 的作用是掩蔽Mg 2+,使之形成Mg(OH)210.氧化还原指示剂变色的电位范围E=n 059.01±θϕ,选择指示剂的原则是使指示剂的 条件电位 处于滴定的 突跃范围 内。
二、选择题(在本题的每一小题的备选答案中,只有一个答案是正确的,请把你认为正确答案的题号,填入题干的括号内。
多选不给分。
每题1分,共10分)1.下列有关随机误差的论述中不正确的是( D )A .随机误差是由一些不确定的偶然因素造成的;B .随机误差出现正误差和负误差的机会均等;C .随机误差在分析测定中是不可避免的;D .随机误差具有单向性2.下列各酸碱对中,属于共轭酸碱对的是( C )A .H 2CO 3——CO 32-B .H 3O +——OH —C .HPO 42-——PO 43-D .+NH 3CH 2COOH ——NH 2CH 2COO —3.已知H 3PO 4的p K a 1=2.12,p K a 2=7.20, p K a 3=12.36,若用NaOH 滴定H 3PO 4,则第二个化学计量点的pH 值约为( B )A .10.7B .9.7C .7.7D .4.94.能用HCl 标准溶液直接滴定的碱是( D )A .NaF (HF, p K a =3.46)B .NaAc (HAc, p K a =4.74)C .苯甲酸钠(p K a =4.21)D .苯酚钠(p K a =9.95)5.金属离子M ,能够用EDTA 直接滴定的条件是( B )A .cK a ≥10-8B .610'≥MY cKC .610≥MY cKD .610g 1≥MY cK6.佛尔哈德法则Ag +,所用滴定标准溶液、pH 条件和应选择的指示剂是(B )A .NH 4SCN ,碱性,K 2CrO 4;B .NH 4SCN ,酸性,NH 4Fe(SO 4)2C .AgNO 3,酸性,NH 4Fe(SO 4)2;D .AgNO 3,酸性,K 2Cr 2O 7;E .NH 4SCN ,碱性,NH 4Fe(SO 4)27.若两电对在反应中电子转移数分别为1和2,为使反应完全程度达到99.9%,两电对的条件电位差至少应大于( C )A .0.09VB .0.18VC .0.27VD .0.36V8.用Fe 3+滴定Sn 2+时,下列有关滴定曲线的叙述中,不正确的( A )A .滴定百分率为25%处的电位为Sn 4+/Sn 2+电对的标准电位;B .滴定百分率为50%处的电位为Sn 4+/Sn 2+电对的标准电位;C .滴定百分率为100%处的电位为计量点电位;D .滴定百分率为200%处的电位为Fe 3+/Fe 2+电对的条件电位。
《分析化学》期末试卷及答案

《分析化学》期末考试试卷
出卷人:
_ 审核人:
系级
班 姓名
题号 一
二
三
四
得分
评分人
一、填空 (每空 1 分,共 20 分)
学号
成绩
五 总分
1. 定量分析过程包括 取样 , 溶(熔)样,分析方法选择, 干扰杂质的分离 和分析测定 数据处理及结果的报出等步骤。 2. 碘量法主要的误差来源是I2 的挥发___和I-的氧化 ,为减小上述原因所造成的误差,滴 定时的速度可 快些 ,溶液不需剧烈摇动 。 3. 系统误差影响分析结果的: 准确度 ;偶然误差影响分析结果的: 精密度 。 4. 莫尔法与佛尔哈德法的指示剂分别为 铬酸钾(K2CrO4) 、铁铵钒(NH4Fe(SO4)2)。 5. 配位滴定中,由于 H+的存在,使 EDTA 参加主反应能力降低的现象,称为酸效应。 6. 滴定分析对滴定反应的基本要求是反应定量完全进行、 反应速度快、 有指示终点的方法。 7. 酸碱滴定曲线是以 PH 值 变化为特征的。 8. 在氧化还原滴定中常用的指示剂是 自身指示剂、 特殊指示剂和氧化还原指示剂。 9. 在滴定过程中,指示剂发生颜色变化的转变点称为 滴定终点 。
D. 滴定碘的颜色褪去
读书破万卷 下笔如有神
读书破万卷 下笔如有神
二、选择(每小题 2 分,共 40 分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 161. 间接碘量法加入淀粉指示剂的时间是( B )。 A. 滴定开始前 B. 滴定至接近终点时 C. 滴定至中途
2. 用佛尔哈德法测定的条件是( D )。
分析化学试卷及答案

南昌大学抚州医学分院《分析化学》(1)题号一二三四五六七总分总分人得分一、填空题( 每小题2分,共30分)1. 以下计算结果中各有几位有效数字(不必计算只说明几位)?0.1000×(25.00-24.50)×246.47(1) w(X) = ───────────────×100% ,____________1.000×10000.1208×(25.00-1.52)×246.47(2) w(X) = ───────────────×100% ,____________1.000×10002. 用甲醛法测定工业(NH4)2SO4{M r [(NH4)2SO4]=132}中氨的质量分数w(NH3), 把试样溶解后用250 mL容量瓶定容,移取25 mL,用0.2 mol/L NaOH标准溶液滴定, 则应称取试样约_________ g。
3. 多组分的吸收峰互相重叠,欲进行每个组分的测定是根据和通过的方法得到的。
4. 在含有酒石酸(A)和KCN的氨性缓冲液中以EDTA滴定Pb2+,Zn2+混合液,在化学计量点时铅存在的主要形式是____________,锌存在的主要形式是_________。
5. 向20.00 mL 0.1000 mol/L的Ce4+溶液中分别加入15.00 mL、25.00 mL 0.1000 mol/L FeCl2, 平衡时体系的电位分别为___________, __________。
6. 用BaSO4重量法测定Na2SO4试剂纯度时,若沉淀吸留(包藏)了Na2SO4, 测定结果___________, 若吸留了NH4Cl则结果___________。
(填偏高、偏低或无影响)7. 在滴定分析中标准溶液浓度一般应与被测物浓度相近。
两溶液浓度必需控制在一定范围。
若浓度过小,将使_______________ ;若浓度过大则_____________。
分析化学试卷含答案

、选择题(共9题18分)1.2分在pH为10.0的氨性溶液中,已计算出Zn(NH3)=1047,Zn(OH=102\Y(H)=10°5。
则在此条件下lgK(ZnY)为()[已知lg K(ZnY)=16.5](A)8.9(B)11.8(C)14.3(D)11.32.2分每100mL人体血浆中,平均含Kf18.0mg和Cl-365mg。
已知M(K+)=39.1g/mol,M(Cl-)=35.5g/mol。
血浆的密度为1.0g/mL。
则血浆中K+和Cl-的浓度为()(A)1.80X10-1和3.65mol/L(B)7.04X10-3和1.30X10-1mol/L(C)4.60X10-3和1.03x10-1mol/L(D)4.60x10-6和1.03x10-4mol/L3.2分欲配制pH=5.1的缓冲溶液,最好选择()(A)一氯乙酸(p K a=2.86)(B)氨水(p&=4.74)(C)六次甲基四胺(p氏=8.85)(D)甲酸(pK=3.74)4.2分用间接碘量法测定BaCl2的纯度时,先将Ba2+沉淀为Ba(IO3)2,洗涤后溶解并酸化加入过量的KI,然后用N&S2Q标准溶液滴定,此处BaCl2与N&S2Q的计量关系[n(BaCl2):n(Na2S2Q)]为()(A)1:2(B)1:3(C)1:6(D)1:12某病人吞服10gNhkCl1小时后,他血液的pH=7.38。
已知HCG的p K ai=6.38,p分=10.25。
此时他血液中[HCQ-]/[H2CO]之比为()(A)1/10(B)10(C)1/2(D)26.2分反应2A++3B4+-2A4++3才到达化学计量点时电位是()7.2分配制含镒0.1000mg/mL的KMnO溶?夜100.0mL,需取0.018000mol/LKMnO4溶液(在酸性溶液中作氧化剂)的体积为()[M(KMnO)=158.03,A(Mn)=54.94](A)14.15mL(B)8.09mL(C)10.11mL(D)6.07mL8.2分用铀量法测定铁时,滴定至50%时的电位是()(A)0.68V(B)1.44V(C)1.06V(D)0.86V9.2分用50mL滴定管滴定,终点时正好消耗20mL滴定剂,正确的记录应为----()(A)20mL(B)20.0mL(C)20.00mL(D)20.000mL二、填空题(共12题27分)1.2分有一铁矿试样,测得含水0.84%,铁的质量分数为52.69%。
医学院,分析化学试卷及答案9

医学院,分析化学试卷及答案9《分析化学》试卷(9)⼀、选择题 ( 共 9题,每题2分,共18分 )1. 对于下列四种表述,不正确的是----------------()(1) 为了减⼩测量误差,称样量越⼤越好(2) 仪器分析⽅法因使⽤仪器,因此准确度⾼(3) 增加平⾏测定次数不能消除系统误差(4) 做空⽩试验可消除系统误差(A)1,2 (B)1,2,4 (C)1,3,4 (D)1,2,3 2. ⽤沉淀滴定法测定银,下列⽅式中适宜的是-----------------( )(A) 莫尔法直接滴定 (B) 莫尔法间接滴定 (C) 佛尔哈德法直接滴定 (D) 佛尔哈德法间接滴定3. ⽤NaOH标准溶液测定FeCl3溶液中的游离HCl时,Fe3+将产⽣沉淀⽽引起⼲扰,可消除其⼲扰的物质是-----------------------( )(A) Na2H2Y (B) CaY2- (C) 柠檬酸三钠 (D)三⼄醇胺4. 某有⾊络合物溶液的透射⽐T = 9.77%,则吸光度值lg(1/T)为------------------( )(A)1.0 (B)1.01 (C)1.010 (D )1.01015. 移取饱和Ca(OH)2溶液50.00mL,⽤0.05000mol/L HCl 标准溶液滴定,终点时, 耗去20.00mL,由此得Ca(OH)2沉淀的Ksp为-------------------------( )(A) 1.6×10-5 (B) 8.0×10-6(C) 2.0×10-6 (D) 4.0×10-66. 若络合滴定反应为: M + Y = MY,则酸效应系数aY(H)表⽰--------------------( )│H+HiY(i=1-6)(A) [Y]/c(Y) (B) ∑[HiY]/c(Y)(C)[Y]/([Y]+∑[HiY]) (D) ([Y]+∑[HiY])/[Y]7. 在⼀定酸度下,⽤EDTA滴定⾦属离⼦M。
分析化学试卷及其答案

分析化学试卷及其答案分析化学测试卷一、选择题(40分)1.定量分析结果的标准偏差代表的是(C)。
A。
分析结果的准确度B。
分析结果的精密度和准确度C。
分析结果的精密度D。
平均值的绝对误差2.下列哪种情况应采用返滴定法(C)。
A。
用AgNO3标准溶液测定NaCl试样含量B。
用HCl标准溶液测定Na2CO3试样含量C。
用EDTA标准溶液测定Al3+试样含量D。
用Na2S2O3标准溶液测定K2Cr2O7试样含量3.下列各项叙述中不是滴定分析对化学反应要求的是(D)。
A。
反应必须有确定的化学计量关系B。
反应必须完全C。
反应速度要快D。
反应物的XXX质量要大4.下列叙述中错误的是(B)。
A。
K2CrO4指示剂法,在溶液pH=12时,用AgNO3标准溶液滴定含Cl-试样,会产生正误差B。
共沉淀、后沉淀和均匀沉淀都会使测定结果产生正误差C。
偶然误差可通过增加测定次数减小D。
在消除系统误差后,精密度高的结果,其准确度一定高5.重量分析法测定0.5126 g Pb3O4试样时,用盐酸溶解样品,最后获得0.4657 g PbSO4沉淀,则样品中Pb的百分含量为(C)。
已知Pb3O4=685.6,PbSO4=303.26,Pb=207.2)。
A。
82.4%B。
93.1%C。
62.07%D。
90.8%6.用含少量NaHCO3的基准Na2CO3标定盐酸溶液时(指示剂变色点为pH5.1),结果将(D)。
A。
偏低B。
不确定C。
无误差D。
偏高分析:m不变,但消耗盐酸的V减小,由m/M =CV,则C增大7.碘量法测定漂白粉中有效氯时,其主要成分CaCl(OCl)与Na2S2O3的物质的量比为(B)。
A。
2:1B。
1:2C。
1:1D。
3:18.磷酸的pKa1=2.12,pKa2=7.21,pKa3=12.66.当用0.200mol/L NaOH标准溶液滴定浓度均为0.100mol/L盐酸和磷酸混合溶液时,可产生明显的滴定突跃最多为(B)。
《分析化学》试卷(附答案)

《分析化学》试卷(附答案)分析化学试卷(答案)⼀、填空(共15分每空1分)1.⽤⽆⽔Na2CO3标定HCl溶液时,选⽤甲基橙作指⽰剂。
若Na2CO3吸⽔,则测定结果偏⾼。
2.标定EDTA时,若选⽤铬⿊T作指⽰剂,则应控制pH=10。
若选⽤⼆甲酚橙作指⽰剂,则应控制pH=5。
3.测定⽔的总硬度时⽤三⼄醇胺掩蔽Fe3+、Al3+等少量共存离⼦。
4.50ml滴定管的最⼩分度值是0。
1ml,如果放出约20ml溶液时,记录数据为位有效数字。
在滴定操作中左⼿控制滴定管,右⼿握锥形瓶。
5.铝合⾦中铝含量的测定中,在⽤Zn2+返滴定过量的EDTA后,加⼊过量的NH4F,使AlY-与F-发⽣置换反应,反应式为AlY-+6F-+2H+== AlF63-+H2Y2-6.⽤移液管吸取溶液时,右⼿拿移液管,左⼿拿吸⽿球,溶液上升⾄标线以上,迅速⽤⾷指按紧上⼝。
7.在定量转移中,当溶液由烧杯沿玻璃棒转移主容量瓶内,溶液流完后,将烧杯沿玻璃棒稍向上提。
⼆、选择(共10分每题1分)1.⽤SO42-使Ba2+形成BaSO4沉淀时,加⼊适当过量的SO42-,可以使Ba2+沉淀的更完全,这是利⽤何种效应?( E )A.盐效应;B.酸效应;C.络合效应;D.溶剂化效应;E.同离⼦效应.2.⽤重铬酸钾法测定铁矿⽯中铁的含量时选⽤下列哪种还原剂?( A )A.⼆氯化锡;B.双氧⽔;C.铝;D.四氯化锡.3.⽤下列哪⼀标准溶液滴定可以定量测定碘?(D )A.Na2S;B.Na2SO3;C.Na2SO4;D.Na2S2O3.4.⽤含有微量杂质的草酸标定⾼锰酸钾浓度时,得到的⾼锰酸钾的浓度将是产⽣什么结果?( B )A.偏⾼;B.偏低;C.正确;D.与草酸中杂质的含量成正⽐.5.不含其它⼲扰性杂质的碱试样,⽤0.1000MHCl滴定⾄酚酞变⾊时,⽤去HCl20.00ml,加⼊甲基橙后,继续滴定⾄终点⼜⽤去HCl10.00ml,此试样为下列哪种组成?( A )A.NaOH, Na2CO3 ;B.Na2CO3 ;C.Na2CO3 , NaHCO3 ;D.NaHCO3 , NaOH .6.EDTA在PH<1的酸性溶液中相当于⼏元酸?( E )A.3;B.5;C.4;D.2;E.6.7.如果要求分析结果达到0.1%的准确度,滴定时所⽤滴定剂溶液的体积⾄少应为多少ml?(D )A.10ml;B.10.00ml;C.18ml;D.20ml.11.配制0.1M的NaS2O3标准液,取⼀定量的Na2S2O3晶体后,下列哪步正确?( B )A.溶于沸腾的蒸馏⽔中,加0.1gNa2CO3放⼊棕⾊瓶中保存;B.溶于沸腾后冷却的蒸馏⽔中,加0.1gNa2CO3放⼊棕⾊瓶中保存;C.溶于沸腾后冷却的蒸馏⽔中,加0.1gNa2CO3放⼊玻璃瓶中保存.8.使⽤碱式滴定管滴定的正确操作⽅法应是下⾯哪种?(B )A.左⼿捏于稍⾼于玻璃近旁;B.右⼿捏于稍⾼于玻璃球的近旁;C.左⼿捏于稍低于玻璃球的近旁.9.欲取50ml某溶液进⾏滴定,要求容器量取的相对误差≤0.1%,下列容器中应选哪种?( D )A.50ml滴定管;B.50ml容量瓶;C.50ml量筒;D.50ml移液管.10.需配0.1MHCl溶液,请选最合适的仪器量取浓酸.( A )A.量筒;B.容量瓶;C.移液管;D.酸式滴定管.三、简答(共30分每⼩题5分)1.⽤草酸钠标定KMnO4溶液时,适宜的温度范围为多少?过⾼或过低有什么不好?为什么开始滴⼊的KMnO4紫⾊消失缓慢,后来却消失很快?写出该标定反应的化学⽅程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、选择题 ( 共 9题 18分 )1. 2 分不能用作对照试验的试样是-------------------()(A) 标准试样(B)管理试样(C) 组成类似的试样(D) 人工合成试样2. 2 分用佛尔哈法测定Ag+,滴定剂是------------------- ( )(A)NaCl (B)NaBr (C)NH4SCN (D)Na2S3. 2 分在下列溶液中,用1.0×10-2mol/L EDTA 滴定1.0×10-2mol/L Zn2+至化学计量点时, pZn'最小的是-----------------------------------( )(A) pH=9.0, [NH3]=0.01mol/L (B) pH=10.0, [NH3]=0.01mol/L(C) pH=9.0, [NH3]=0.05mol/L (D) pH=10.0, [NH3]=0.15mol/L4. 2 分在下列4个量中表征有限次测定数据集中趋势的是-----------()(1) 算术平均值(2) 中位数M(3) 总体平均值μ(4) 真值(A)1,2 (B)3,4 (C)1,3 (D)2,45. 2 分用重量法测定试样中的砷,首先使其形成Ag3AsO4沉淀,然后转化为AgCl,并以此为称量形式,则用As2O3表示的换算因数是---------------------------------------( )(A) M r(As2O3)/M r(AgCl) (B) 2M r(As2O3)/3M r(AgCl)(C) 3M r(AgCl)/M r(As2O3) (D) M r(As2O3)/6M r(AgCl)6. 2 分已知乙二胺(L)与Ag+形成络合物的lg b1,lg b2分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是-------------------( ) (A) 10-4.7>[L]>10-7.7 (B) 10-3.0>[L]>10-7.7(C) 10-3.0>[L]>10-4.7 (D) [L]=10-4.77. 2 分在下列溶液中,以0.020 mol / L EDTA滴定同浓度的Zn2+至化学计量点时,pY¢计值最小的是……………………… ( )( A ) pH = 10 .0, [ NH3 ] = 0.02 mol / L ( B ) pH = 10.0 , [ NH3]= 0.05 mol / L( C ) pH = 10.0 , [ NH3 ] = 0.1 mol / L ( D ) pH = 10.0 , [ NH3]= 0.2 mol / L8. 2 分在下列两种情况下,以EDTA滴定相同浓度的Zn2+;一是在pH = 10.0的氨性缓冲溶液中,二是在pH=5.5的六次甲基四胺缓冲溶液中。
叙述滴定曲线pZn 突跃范围大小正确的是………………………( )( A )突跃范围大小相同 ( B )前者pZn的突跃范围比后者大( C )前者pZn的突跃范围比后者小 ( D )上述三种情况都有可能9. 2 分指出下列叙述中错误的结论-----------------( )(A) 络合剂的酸效应使络合物的稳定性降低(B) 金属离子的水解效应使络合物的稳定性降低(C) 辅助络合效应使络合物的稳定性降低(D) 各种副反应均使络合物的稳定性降低二、填空题 ( 共14题 32分 )1. 3分某(NH4)2HPO4溶液c[(NH4)2HPO4] = c mol/L,其物料平衡式为____________________________; 电荷平衡式为___________________ ______________________。
2. 3 分正态分布的μ称为__________,σ称为___________,其曲线的概率密度函数为______ _____________。
3. 2 分用K2Cr2O7法测定铁, 试样重 1.000 g, 若使滴定管上的 K2Cr2O7溶液体积读数在数值上恰好等于试样中铁的质量分数, 则配制 K2Cr2O7溶液的浓度为__________ ________________mol/L。
[M r(K2Cr2O7)= 294.2, A r(Fe)= 55.85]4. 2 分(Ⅰ)试液中含有SO42-,(Ⅱ)试液中含有Ba2+。
欲用BaSO4重量法测定其含量,已知两种试液中均含有H+、Mg2+、K+、Na+、NO3-杂质。
则(Ⅰ)试液中扩散层优先吸附的离子是______;(Ⅱ)试液扩散层优先吸附的离子是____。
5. 2 分国产721型分光光度计单色器元件是 ________, 检测器(接受器)元件是_________。
6. 2 分EDTA滴定中, 介质pH越低, 则αY(H)值越____, K'(MY)值越____, 滴定的pM'突跃越____,化学计量点的pM'值越____。
7. 2 分常用的分解试样的方法有:⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽法、⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽法、⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽法。
8. 2 分各级试剂所用的符号为(填A,B,C,D)(1) 一级 _____________ (A) A.R.(2) 二级 _____________ (B) C.P.(3) 三级 _____________ (C) G.R.(4) 四级 _____________ (D) L.R.9. 2 分根据有效数字的运算规则,下面算式的结果应为______。
0.1000×(25.00-21.25)×0.1020────────────1.502110. 2 分卤化银对卤化物和各种吸附指示剂的吸附能力如下: 二甲基二碘荧光黄>Br->曙红>Cl->荧光黄。
如用法扬司法测定Br-时,应选________指示剂;若测定Cl-,应选______指示剂。
11. 2 分 (3120)某人误将参比溶液的透射比调至98%,而不是100%, 在此条件下测得有色溶液的透射比为36%,则该有色溶液的正确透射比应为_________%。
12. 2 分某溶液含有M和N两种金属离子,已知K(MY) > K(NY)。
lg K'(MY)先随溶液的pH增加而增大,这是由于 ________________;而后当pH增加时,lg K'(MY)保持在某一定值(N在此条件下不水解),这是因为________________________________。
13. 4分下列基准物常用于何种反应? (填A,B,C,D)(1) 金属锌___________ (A)酸碱反应(2) K2Cr2O7___________ (B)络合反应(3) Na2B4O7·10H2O ___________ (C)氧化还原反应(4) NaCl ___________ (D)沉淀反应14. 2 分单盘天平优于双盘天平是因为其______恒定,没有_____误差,缩短了_______的时间。
三、计算题 ( 共 4题 30分 )1. 10 分某一溶液由HCl,KH2PO4和HAc混合而成,其浓度分别为c(HCl) = 0.10 mol/L,c(KH2PO4) = 1.0×10-3mol/L, c(HAc) = 2.0×10-6mol/L 。
计算该溶液的pH及[Ac-],[PO43-]各为多少?(已知H3PO4的p K a1~p K a3分别是2.12,7.20, 12.36, HAc 的p K a = 4.74)2. 5 分测得某试样中钒的质量分数w(V)/%为:1.20, 1.27, 1.22, 1.15, 1.30。
计算置信度95%时平均值的置信区间。
3. 5 分称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL。
移取25.00mL,加入H 2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL。
计算此Na2S2O3溶液的浓度。
[M r(K2Cr2O7)=294.2]。
4. 10分已知ϕθ(Ag+/Ag)=0.799V,ϕθ(Ag2CrO4/Ag)=0.446V。
计算Ag2CrO4在纯水中的溶解度及Ag+的浓度四、问答题 ( 共 2题 20分 )1. 10 分已知氯乙酰(CH3COCl)和水及醇(ROH)在吡啶介质中及适当条件下发生如下反应:CH3COCl+H2O=HCl+CH3COOH (1)CH3COCl+ROH =HCl+CH3COOR (2)试利用以上反应设计测定水的方法,不必指出详细条件,只需指出测定方法,标准溶液,指示剂以及n(H2O)的计算式。
2. 10 分Fe3+与I-反应能否达到99.9%的完全度?为什么能用间接碘量法测定Fe3+?化学分析试卷答案一、选择题 ( 共 9题 18分 )DAD 6-9. CDDD二、填空题 ( 共14题 32分 )1. 3 分[NH4+]+[H+] = [H2PO4-]+2[HPO42-]+3[PO43-]+[OH-]2. 4 分总体平均值,总体标准差, y = [1/(s(2p)1/2)]exp[-(x-m)2/(2s2)]3. 2 分0.029844. 2 分NO3- H+5. 2 分玻璃棱镜, 光电管6. 2 分大, 小, 小, 小7. 2 分溶解、熔融、干灰化8. 4 分1. C2. A3. B4. D9. 2 分0.025510. 2 分3064曙红或荧光黄; 荧光黄11. 2 分36.712. 2 分aY(H)减小(或酸效应系数减小);此时a Y(N) > a Y(H),而K¢(MY)的大小由a Y(N)决定,aY(N)基本上与pH无关。
13. 2 分1. B2. C3. A4. D14. 2 分感量(或灵敏度);不等臂性;调整砝码三、计算题 ( 共 4题 30分 )1. 10 分c(HCl)>>c(H2PO4-),溶液[H+]由HCl决定pH = 1.0010-4.74[Ac-]= c x0=10-5.7──────── =10-9.44 10-4.74+10-1.0= 3.6×10-10 (mol/L)[PO43-]= cx010-21.68= 10-3.0──────────────── 10-3.0+10-4.12+10-10.32+10-21.68= 10-21.71 = 1.9×10-22 (mol/L)X和Y等体积混合,则有[HA]= 0.500 mol/L,[A-]=(0.500 + 5.00)/2 = 2.75 (mol/L),因此所得溶液的pH为4. 10 分5031ϕθ(Ag2CrO4/Ag) = ϕθ(Ag+/Ag)+0.059/2×lg K spK= 1.1×10-12spS = (K/4)1/3 = 6.5×10-5(mol/L)sp[Ag+] = 2S = 1.3×10-4(mol/L)四、问答题 ( 共 2题 20分 )1. 10 分移取同量氯乙酰溶液两份:其一:在一干燥瓶中准确加入一定量氯乙酰及被测水和吡啶,在适当条件下待反应完成后, 加入过量无水乙醇, 然后以酚酞为指示剂, 以NaOH标准溶液滴定耗去V1;其二:为空白实验,仅不含水,方法同前,此耗去NaOH标准溶液为V2 , 则:n(H2O) = c(NaOH)·(V1-V2)2. 10 分不能,(当n1=1,n2=2时, E>0.27V时才能反应完全),间接碘量法是加入过量I-,而且生成的I2不断被S2O32-滴定,故反应很完全。
