有机化学 亲核加成 机理
化学反应中的亲核加成反应机理研究

化学反应中的亲核加成反应机理研究化学反应是研究原子之间发生的转化和变化的科学领域。
亲核加成反应是一类常见的化学反应,其机理研究对于解释反应细节和优化化学合成具有重要意义。
本文将重点讨论亲核加成反应的机理研究,探究其在化学领域中的应用和意义。
一、亲核加成反应概述亲核加成反应是指亲核试剂通过共用电子对的方式与亲电试剂发生反应,形成新的化学键。
亲核试剂通常是具有孤对电子的化合物,如氨、醇、胺、卤素等,而亲电试剂则是带有正电荷或部分正电荷的分子,如卤代烃、酰卤等。
在亲核加成反应中,亲核试剂攻击亲电试剂的部分正电荷中心,形成一个新的共价键。
二、亲核加成反应的机理亲核加成反应的机理可以分为以下几个步骤:亲核试剂的攻击、亲电试剂的离去、质子转移和生成产物。
1. 亲核试剂的攻击亲核试剂通过其孤对电子攻击亲电试剂。
亲电试剂中的部分正电荷可以吸引亲核试剂,使其接近并进行反应。
这一步骤是亲核加成反应的关键环节。
2. 亲电试剂的离去亲核试剂攻击亲电试剂后,形成一个新的化学键。
在这个过程中,亲电试剂原来的化学键发生了断裂,从而产生一个具有正电荷的离去基团。
离去基团离开后,反应的原子间距离会有所变化。
3. 质子转移在亲核加成反应中,质子转移是常见的步骤之一。
它可以帮助调整反应物的电荷和立体结构,使反应进行得更加顺利。
质子的转移通常涉及到酸碱中心的变化。
4. 生成产物经过亲核试剂的攻击、亲电试剂的离去和质子转移等步骤后,最终会形成一个新的化学键,并生成产物。
产物的结构和性质取决于反应物的选择和反应条件的控制。
三、亲核加成反应的应用和意义亲核加成反应在化学合成中具有广泛的应用和意义。
1. 合成有机化合物亲核加成反应可以用于合成各种有机化合物,例如醇、酮、醛、酸等。
通过选择不同的反应物和反应条件,可以实现不同的合成目标,并得到具有特定结构和性质的化合物。
2. 研究反应机理亲核加成反应的机理研究有助于揭示反应发生的细节和规律,深入理解化学反应的本质。
氰基与水合肼反应机理

氰基与水合肼反应机理一、引言氰基与水合肼是常见的有机化合物,它们在有机合成、医药领域以及爆炸物的制备中发挥着关键作用。
理解氰基与水合肼反应的机理对于这些应用的优化和控制至关重要。
本文将对氰基与水合肼反应的机理进行全面、详细且深入的探讨。
二、氰基与水合肼反应机理概述氰基与水合肼反应是一种典型的加成反应,其反应机理可分为两个主要步骤:亲核加成和质子转移。
2.1 亲核加成亲核加成是氰基与水合肼反应的关键步骤,该过程涉及氰基离子(CN^-)的进攻和水合肼分子(H2N-OH)的开放。
在该反应中,亲核试剂氰基离子向水合肼的酸性氢原子发起进攻反应,产生一个中间体。
2.2 质子转移在亲核加成之后,质子转移是氰基与水合肼反应的第二个主要步骤。
在该过程中,中间体与溶液中的质子发生转移,生成产物和一个水分子。
这一步骤是整个反应过程中的速率决定步骤。
三、氰基与水合肼反应的详细机理解析3.1 亲核加成机理亲核加成的机理主要包括进攻原子的亲核性、立体位阻效应和键的断裂与形成。
3.1.1 进攻原子的亲核性氰基离子(CN^-)是一种高亲核试剂,它对于水合肼中酸性氢原子的亲攻性很强。
亲核试剂的选择对于亲核加成反应的效果有着重要的影响。
3.1.2 立体位阻效应水合肼分子中的氢原子周围存在着空间障碍,因此亲核试剂在进攻过程中会受到立体位阻的影响。
这种立体效应会导致亲核试剂进攻的速率受到限制。
3.1.3 键的断裂与形成亲核进攻与离去基团的离去导致了化学键的断裂和形成。
在氰基与水合肼反应中,氰基进攻后,酸性氢原子离去,形成了一个中间体。
3.2 质子转移机理质子转移是氰基与水合肼反应的第二个关键步骤,其机理涉及溶液中质子的转移和中间体的重排。
3.2.1 质子转移过程在质子转移过程中,中间体中的质子与其他溶液中存在的质子进行转移,形成了产物和一个水分子。
3.2.2 中间体的重排在质子转移过程中,中间体发生了重排,形成了产物。
重排的方式和条件会影响产物的生成率和选择性。
亲核加成反应机理

亲核加成反应机理一、介绍亲核加成反应是有机化学中一种重要的反应类型。
它通过亲核试剂攻击电荷不饱和的碳原子,形成新的碳-亲核键,并伴随有官能团的转换。
本文将对亲核加成反应的机理进行全面、详细、完整且深入地探讨。
二、亲核加成反应概述亲核加成反应是一类重要的有机化学反应,其主要特点是用亲核试剂攻击双键或三键上的电子,形成新的化学键。
亲核试剂可以是阴离子、中性分子或阳离子。
在亲核加成反应中,亲核试剂通常经历亲核进攻、负离子重排和质子化等阶段。
1. 亲核进攻亲核试剂在亲核加成反应中起到亲核进攻的作用。
通常情况下,亲核试剂具有可用的自由电子对,能与电子不足的碳原子形成新的化学键。
亲核进攻的速率和选择性受到亲核试剂的性质、反应条件和底物的结构等因素的影响。
2. 负离子重排在某些亲核加成反应中,亲核试剂的亲核进攻会导致反应过渡态产生负电荷,形成负离子。
负离子重排是亲核加成反应中的一个重要步骤,可以通过改变碳原子的排列顺序来稳定负离子。
3. 质子化质子化是亲核加成反应中的最后一个阶段,通过给亲核试剂或负离子成员质子化,使反应产物获得更稳定的结构。
质子化通常发生在负离子重排之后。
三、亲核加成反应的分类亲核加成反应可根据亲核试剂和底物的不同进行分类。
下面将对几种常见的亲核加成反应进行介绍。
1. 碱性条件下的亲核加成反应在碱性条件下,亲核试剂通常是醇、酚、胺等带有孤对电子的化合物。
这类亲核试剂能够与电荷不饱和的碳原子形成新的化学键。
碱性条件下的亲核加成反应常用于合成醇、酚、胺等化合物。
2. 酸性条件下的亲核加成反应在酸性条件下,亲核试剂通常是具有孤对电子的阴离子,如卤素离子、亚硫酸根离子等。
酸性条件下的亲核加成反应可以用于合成卤代烷、磺酸酯等化合物。
3. 中性条件下的亲核加成反应在中性条件下,亲核试剂通常是中性分子,如水、醛、酮等。
中性条件下的亲核加成反应常用于合成醇、酮等化合物。
四、亲核加成反应的机理解析1. 碱性条件下的亲核加成反应机理以醇作为亲核试剂为例,碱性条件下的亲核加成反应机理如下:1.酸性条件下,氧上的醇质子化生成质子化醇。
有机化学基础知识点整理加成反应的类型与机理

有机化学基础知识点整理加成反应的类型与机理在有机化学中,加成反应是一种常见且重要的反应类型。
它能够在有机化合物的化学合成和转化中起到关键的作用。
本文将对有机化学基础知识点进行整理,并探讨加成反应的类型和机理。
一、有机化学基础知识点整理1.有机化合物的结构:有机化合物由碳、氢和其他元素构成,其中碳结构的多样性决定了有机化合物的丰富性。
2.键的极性:碳与其他原子之间的化学键可以分为极性和非极性键。
极性键中,电子偏向某个原子形成部分正电荷,而另一个原子则形成部分负电荷。
3.官能团:有机化合物中特定的原子或原子团,赋予分子特定的性质和反应活性。
常见的官能团包括羟基、羰基、羧基、胺基等。
4.取代基:由于碳的四价特性,它可以与其他原子或原子团连接形成取代基。
不同的取代基会对有机化合物的物理性质和化学反应产生影响。
5.共价键的形成:有机化合物中的共价键是通过原子间电子的共享而形成的。
共价键的类型包括单键、双键和三键,取决于共享的电子对数目。
二、加成反应的类型在有机化学中,加成反应是指两个或多个反应物中的官能团相互作用,形成一个新的化学键,并释放出水或其他小分子。
根据反应物的不同,加成反应可分为以下几种类型:1.亲电加成反应:在亲电加成反应中,一个亲电试剂与一对电子丰富的化合物发生反应。
其中,亲电试剂通常是带有正电荷的分子或离子,如卤代烃、酰卤等。
反应中,亲电试剂攻击电子密度较高的区域,形成新的化学键。
2.亲核加成反应:亲核加成反应是指亲核试剂与亲电性较强的化合物发生反应。
亲核试剂通常是带有负电荷或富电子的分子或离子,如氢化物、氨等。
亲核试剂通过提供电子对,与亲电性较强的分子中的正荷或部分阳离子进行配对,形成新的化学键。
3.自由基加成反应:自由基加成反应是指自由基与其他分子反应,形成新的化学键。
自由基可由光解或断裂键的方式产生,其反应过程中自由基与其他分子发生相互作用,形成新的共价键。
三、加成反应的机理加成反应的机理与反应类型密切相关。
有机化学基础知识点亲核加成反应的机理

有机化学基础知识点亲核加成反应的机理亲核加成反应是有机化学中一种重要的反应类型,常见于碳原子与亲核试剂之间的化学反应。
在亲核加成反应中,亲核试剂攻击电子不饱和化合物中的亲电中心,形成化学键。
本文将探讨亲核加成反应的机理,并介绍几种典型的亲核加成反应。
一、机理介绍亲核加成反应的机理通常分为两步:亲核试剂的攻击和中间物的转变。
1. 亲核试剂的攻击亲核试剂(Nu^-)攻击亲电中心(通常是碳原子)是亲核加成反应的第一步。
亲核试剂的正电荷亲密接触到亲电中心,形成一个新的化学键。
亲核试剂的反应活性基团(如氢、氧、卤素等)与亲电中心形成共价键。
2. 中间物的转变中间物的转变是亲核加成反应的第二步。
在中间物转变过程中,通常发生一系列的质子转移、断裂和重组步骤。
这些步骤可能涉及过渡态的形成和裂解,从而改变化合物的结构。
二、典型亲核加成反应案例以下是几种常见的亲核加成反应,以展示亲核加成反应的机理。
1. 酯的水解反应酯的水解反应是一种典型的亲核加成反应。
在碱性条件下,水分子作为亲核试剂攻击酯的羰基碳,在酸催化下进行酯的水解反应。
反应过程中,产生的中间物经过质子转移和断裂反应后,生成酸和醇。
2. 溴代烃的亲核取代反应在碱性条件下,亲核试剂(如氢氧化钠)攻击溴代烃中的溴原子,形成亲核取代产物。
此过程中,亲核试剂中的氧原子攻击溴原子,形成碳氧双键,然后其他基团进行重排,最终生成相应的取代产物。
3. 醛/酮的亲核加成反应醛和酮是常见的亲电中心,可以与亲核试剂发生亲核加成反应。
例如,醛和酮可以与氢氰酸反应形成氰醇化合物。
在这个过程中,氰离子作为亲核试剂攻击醛或酮的羰基碳,形成碳氮键,同时产生一个羟基。
4. 酸催化的醇与双键的加成反应在酸催化下,醇可以与烯烃中的双键发生亲核加成反应。
在反应过程中,醇中的氧原子攻击烯烃的亲电中心,形成一个新的碳氧键。
此外,酸催化也可促进醇与烯烃的异构化反应,产生具有不同结构的化合物。
总结:亲核加成反应是有机化学中常见的反应类型,可以用于合成新的有机分子。
有机化学中的亲核加成与消除反应

有机化学中的亲核加成与消除反应亲核加成和消除反应是有机化学中两种重要的反应类型,广泛应用于有机合成、药物化学、材料科学等领域。
本文将对亲核加成和消除反应的概念、机理和应用进行介绍。
一、亲核加成反应亲核加成反应是指亲核剂(也称为亲核物质)与电子不足的亲电试剂发生反应,亲核剂的亲电性中心攻击亲电试剂上的正电子中心,形成新的化学键。
常见的亲核加成反应有醇与卤代烃的反应、醛或酮与亲核试剂的反应等。
1. 醇与卤代烃的反应醇与卤代烃的反应是亲核加成反应中的一种常见类型。
在此反应中,醇中的氧原子攻击卤代烃中的卤原子,生成醚化合物。
例如,乙醇与溴甲烷反应可得到乙基溴化物。
2. 醛或酮与亲核试剂的反应醛或酮与亲核试剂的反应也是亲核加成反应的一种重要类型。
在这类反应中,亲核试剂的亲电性中心攻击醛或酮分子中的羰基碳原子,形成新的化学键。
例如,丁酮与甲胺反应可得到丁酮胺。
二、消除反应消除反应是指一个分子中两个基团之间的共价键发生断裂,形成另外两个分子。
消除反应可以分为酸性消除和碱性消除两种类型。
1. 酸性消除酸性消除是指在酸性条件下,分子中的负电荷离子与负电荷中心形成的碳阳离子相互消除。
酸性消除是有机化学中最常用的消除反应之一。
例如,酮中的α-碳上的氢可以被酸催化的消除剂(如氢气和铂催化剂)去除,生成烯烃。
2. 碱性消除碱性消除是指在碱性条件下,负电中心与负电荷离子形成的碳阴离子相互消除,产生另外两个分子。
例如,醇中的β-羟基在碱性条件下可以消除,生成烯烃。
三、应用亲核加成和消除反应在有机合成中有着广泛的应用。
它们可以用于构建碳-碳和碳-氧化学键,实现分子结构的定向调整和功能的引入。
通过选择不同的反应条件和催化剂,可以实现对化合物结构和立体化学的精确控制。
此外,亲核加成和消除反应还常用于药物化学和材料科学领域。
在药物合成中,这些反应可以用于构建具有特定生物活性的分子骨架。
而在材料科学中,亲核加成和消除反应则被应用于构建高分子聚合物和功能性材料的合成。
有机化学—亲核加成

PhCHCN
PhCHCOOH
67%
5.影响亲核加成的因素 .
影响亲核加成的因素
• ① 电子效应
• a.当羰基C上连有吸电基(-I,-C)时,吸电性增加, .当羰基C上连有吸电基( , ) 吸电性增加, 使羰基C上的电子云密度减小,即增加了 原子的正电 使羰基 上的电子云密度减小,即增加了C原子的正电 上的电子云密度减小 荷,则有利亲核试剂的进攻。 则有利亲核试剂的进攻。
H+ H2 O △
CH2-CHCHO OH OH
4. 与含硫亲核试剂的反应
与含硫亲核试剂的反应
• 与亚硫酸氢钠的加成: 与亚硫酸氢钠的加成: • 亚硫酸氢钠可以和 醛 或甲基酮及8个C以下的环酮的羰 甲基酮及 个 以下的 以下的环酮的羰 发生加成反应,产物称为:亚硫酸氢钠加成物。 基发生加成反应,产物称为:亚硫酸氢钠加成物。
醛脂肪族甲基酮和八个碳以下的环内酮1与hcn加成cnohcoohohohchhcnchohcnch是制备醇的好方法2与grignard试剂加成替格氏试剂chchcchch与羰基相连的手性碳上两个较小的基团在羰基两旁呈邻交叉型较大的基团与羰应时进攻试剂主要从位阻小的一边进攻羰基
羰基化合物的亲核加成反应
• 亲核试剂的亲核性增强,Kc增大。 增大。 亲核试剂的亲核性增强, 增大
CHO
CHO
+ HCN
+ HCN
CHOH CN
CHOH CN Br
Kc= 210
Kc= 530
Br
O R C R` 随着R、R` 、亲核试剂的体积增大,Kc减少。
谢谢! 谢谢!
2)与醇加成
• 缩醛常用于保护醛基 • 如:
O O COC2 H5
有机化学中的亲核加成反应反应机制和应用

有机化学中的亲核加成反应反应机制和应用亲核加成反应是有机化学中一种重要的反应类型,它在有机分子的构建和合成中具有广泛的应用。
亲核加成反应通常由一个亲核试剂和一个电荷亲和性较强的底物(通常是电子不足的烯烃或亚稳的阳离子)进行反应,最终形成一个新的化学键。
本文将介绍亲核加成反应的反应机制和一些常见的应用。
一、加成反应的机理亲核加成反应的机理可以分为两步:亲核试剂与底物的相互作用,以及生成产物。
1. 亲核试剂与底物的相互作用亲核试剂与底物发生相互作用的过程中,亲核试剂中的亲核性基团(通常是负离子或带有孤对电子的中性分子)攻击底物中的电子云不足的中心,形成较稳定的中间体。
2. 生成产物通过重新组合键,产生加成产物。
这个步骤的具体机理取决于试剂和底物的性质,可能包括质子转移、环闭合、重排等。
二、亲核加成反应的应用亲核加成反应在有机化学中有着广泛的应用,下面将介绍几个常见的应用领域。
1. 合成有机化合物亲核加成反应是有机合成中最常用的反应类型之一。
通过选择不同的亲核试剂和底物,可以合成各种结构和功能的有机化合物,如醇、醛、酮等。
例如,醇和酸酐之间的酯化反应就是一种亲核加成反应。
2. 制备药物亲核加成反应在合成药物中有着重要的应用。
许多药物的合成步骤中都包含亲核加成反应,用于构建药物分子的关键骨架和功能基团。
例如,合成乙酰水杨酸的反应中,苯酚与乙酰氯的亲核加成反应是一个关键步骤。
3. 制备橡胶和合成纤维亲核加成反应也被广泛用于生产橡胶和合成纤维。
例如,合成氨纶的过程中使用的底物与亲核试剂之间发生亲核加成反应,形成聚合物链的骨架,从而得到弹性优良的合成纤维。
4. 天然产物的合成亲核加成反应在天然产物合成领域也发挥着重要的作用。
通过亲核试剂与底物的反应,可以合成具有天然产物活性的复杂有机结构。
例如,弗里德尔-克拉夫茨反应是天然二萜类化合物合成中常用的亲核加成反应。
总结:亲核加成反应是有机化学中常见的反应类型,它通过亲核试剂与底物的相互作用,生成具有新化学键的产物。
亲核加成反应机理

亲核加成反应机理一、引言亲核加成反应是有机化学中最为基础和重要的反应之一。
它是指一种亲核试剂与一个电子缺陷的亲电试剂之间发生加成反应,形成一个新的化合物。
这个新化合物由于不稳定,往往会进一步发生消除、重排、氧化还原等反应,最终得到目标产物。
二、亲核试剂和亲电试剂1. 亲核试剂亲核试剂通常是带有孤对电子或负电荷的分子或离子,如氢氧根离子(OH-)、氨(NH3)、硫醇(SH-)等。
它们具有强大的亲核性,可以攻击含有正离子或部分正电荷的分子或离子,并与其形成共价键。
2. 亲电试剂亲电试剂通常是带有正离子或部分正电荷的分子或离子,如卤素(Cl2、Br2、I2)、羰基(CO)、烯丙基阳离子等。
它们具有强大的亲电性,在反应中可以吸引周围的电子密度,并与相邻原子形成新键。
三、机理1. 两种反应机理亲核加成反应可以分为两种不同的机理:S N 2和S N 1。
它们的区别在于反应物的电子密度和反应条件。
2. S N 2机理在S N 2机理中,亲核试剂直接进攻亲电试剂上的部分正电荷,形成一个过渡态,然后断裂原有键,形成新的共价键。
这个过程是单步反应,不需要中间体参与。
它适用于那些具有较高电子密度、不太稳定、易于受到亲核试剂攻击的亲电试剂。
3. S N 1机理在S N 1机理中,亲电试剂先失去一个离子(通常是卤素离子),形成一个带正电荷的中间体。
然后亲核试剂进攻这个中间体上的部分正电荷,形成新的共价键。
这个过程是两步反应,需要中间体参与。
它适用于那些具有较低电子密度、较稳定、难以受到亲核试剂攻击的亲电试剂。
四、影响因素1. 反应物结构反应物结构对亲核加成反应起着至关重要的作用。
一般来说,亲电试剂上的部分正电荷越大,反应越容易进行。
而亲核试剂上的孤对电子或负电荷越强,反应也越容易进行。
2. 溶剂效应溶剂对亲核加成反应也有一定的影响。
通常来说,极性较大、能够稳定离子的溶剂有利于S N 1机理的进行;而极性较小、不太稳定离子的溶剂则有利于S N 2机理的进行。
有机化学基础知识点加成反应的机理和规律

有机化学基础知识点加成反应的机理和规律有机化学是研究有机物的合成、结构、性质和反应规律的学科。
其中,加成反应是有机化学中最常见和重要的反应类型之一。
本文将介绍有机化学基础知识点加成反应的机理和规律。
一、加成反应的基本概念加成反应是指两个或多个亲电体或亲核体通过共用或转移共用键的方式结合成为一个新的分子。
通常情况下,亲电体是电子亏损的,而亲核体则是电子富集的。
加成反应可以分为亲电加成和亲核加成两种类型。
亲电加成是指亲电体攻击亲核体的反应,通常发生在亲电性较强的反应物之间。
亲电体可以是群基或离子,如卤代烃、酸酐等。
亲核体则是电子丰富的反应物,如双键化合物、亲核试剂等。
亲电加成反应的机理通常通过质子转移或亲电物种中间体来实现。
亲核加成是指亲核体攻击亲电体的反应,通常发生在亲核性较强的反应物之间。
亲核体可以是碱、醇、胺等,而亲电体则是电子不足的反应物,如羰基化合物、卤代烃等。
亲核加成反应的机理通常通过亲核物种中间体来实现。
二、加成反应的机理1. 亲电加成反应机理亲电加成反应的机理通常分为两步:攻击和解离。
在第一步攻击中,亲电体通过接触或近距离攻击亲核体的亲核中心,形成共价键。
这个过程中,亲电体亲核中心上的正电荷被亲核体的电子对所攻击,形成新的中间态。
在第二步解离中,中间态的反应物通过质子转移或亲电物种中间体的相互作用,形成产物。
质子转移可以通过迁移原子或群基来实现。
2. 亲核加成反应机理亲核加成反应的机理通常涉及四个步骤:一个亲核物种的进攻、质子转移、解离和质子移位。
在第一步进攻中,亲核物种通过攻击亲电体的亲电中心,形成新的单线性中间体。
这个过程中,原有单线性中间体的离去反离子被亲核物种攻击,形成一个新的中间态。
在第二步质子转移中,中间态的亲反离子通过质子转移到亲核物种上,产生新的离子。
在第三步解离中,离子经历解离过程,生成产物。
在第四步质子转移中,产物通过质子转移重新排列,形成最终的产物。
三、加成反应的规律1. 酯酰类加成反应规律酯酰类化合物在亲电加成反应中通常发生C=O双键的受攻击。
《亲核加成反应》课件

总结词
未来,亲核加成反应的发展将更加注重绿色、高效、可 持续性。
详细描述
随着环保意识的不断提高和化学工业的发展,对亲核加 成反应的效率和环保性的要求也将越来越高。未来,需 要继续研究和开发新型催化剂和绿色合成方法,以推动 亲核加成反应的发展。同时,还需要解决反应过程中可 能出现的各种问题,如副反应、废物处理等,以满足可 持续发展的要求。
羧酸类底物在亲核加成反应中,与亲核试剂反应后生成酯类化合物 ,该类化合物具有较高的稳定性和较低的反应活性。
立体化学在亲核加成反应中的应用
立体化学
在亲核加成反应中,立体化学是一个重要的概念。它涉及到反应过程中空间构型 的变化以及反应速率与空间构型的关系。
手性
手性是立体化学中的一个重要概念。它是指一个物体不能与其镜像相重合的特性 。在亲核加成反应中,手性底物与手性亲核试剂的反应可以产生手性产物。
04
亲核加成反应的实验技术 与操作技巧
实验装置与操作流程
实验装置
包括反应器、温度计、搅拌器、冷凝器等 主要部件,以及必要的辅助设备和安全设 施。
VS
操作流程
包括反应物准备、反应器清洗、加料、反 应温度控制、产物分离和纯化等步骤。
反应条件的优化与控制
反应温度
温度对反应速率和产物质量有重要影响,需根据 反应物的性质和实验要求选择合适的反应温度。
亲核加成反应的催化剂与 促进剂
金属催化剂
01
02
03
铝催化剂
如AlCl3、AlBr3等,可通 过Friedel-Crafts反应引 发亲核加成反应。
锌催化剂
如ZnCl2、ZnBr2等,常 用于加成到烯烃或炔烃上 。
铁催化剂
如FeCl3、FeBr3等,可 促进碳碳双键的亲核加成 反应。
羰基的亲核加成
上述构型中双键碳上所连的两个大的基团处在反位比较稳定(即 构型以反式为主)。 当分子中含有两个羰基时(二醛、二酮、或一种醛与一种酮),
在碱催化作用下,也可发生分子内羟醛缩合生成五元环或六元环 的不饱和醛酮。
高等有机化学
O
OH
CH3 C CH2CH2CH2CHO
(2)Knoevenagel缩合 不含a氢的醛酮与含活泼的a氢的化合物的合成
高等有机化学
O
O
O
O
* R CH2 C H
OH
*
RCH2CHO
*
R CH C H
R CH2 C CH C H
Step 1
Step 2
HR
O * R CH C H
H2O Step 3
OH
O
*
R CH2 C CH C H
HR
H2O Step 4
O * R CH2 C C C H
HR
如果用两种不同的具有α-H的醛缩合时为混合物,其产物复杂, 合成上意义不大。但无α-H的醛可以与有α-H 的醛发生羟醛
CZ
C Z + CH3CH CHCOOEt
CH3CH CHCOOEt CZ
CH3CH CHCOOEt CZ
BH CH3CH CH2COOEt
CZ
O CH3CH CH COEt
CZ
BH
OH
CH3CH CH COEt
CZ
高等有机化学
例1
CH3CH CHCOOEt + CH2(COOEt)2
C2H5ONa C2H5OH
CHCN + CH2 CH CN C2H5
KOH
OCHCH2CH2CN C2HC5H2CH2COOEt
有机化学中的加成反应

有机化学中的加成反应有机化学是研究有机化合物结构、性质及其变化规律的分支学科。
其中,加成反应是有机化学中常见且重要的一类反应。
本文将介绍有机化学中的加成反应,包括其定义、机理、应用以及相关的例子。
一、定义加成反应是指在有机化合物中,两个或更多的原子、基团或离子结合在一起形成新的化学键。
在加成反应中,通常有两种或多种物质在反应中发生化学变化,生成不同的产物。
二、机理1. 亲核加成反应亲核加成反应是指,在有机化合物中,亲核试剂攻击电子不足的碳原子形成新的化学键。
这类反应通常通过亲核试剂的亲核性通过原子间空间的进攻进行。
2. 电泌加成反应电泌加成反应是指,在有机化合物中,亲电试剂向电子富集的碳原子进行攻击形成新的化学键。
这类反应通常通过亲电试剂的电子亏损通过原子间空间的进攻进行。
三、应用加成反应在有机合成中具有广泛的应用价值。
以下是一些典型的加成反应及其应用:1. 烯烃的加成反应烯烃是加成反应常见的反应物。
通过加成反应,烯烃可以与其他物质发生加成反应,生成具有新的功能团的有机化合物。
例如,烯烃与水加成反应生成醇,与卤素加成反应生成卤代烷,与羧酸加成反应生成酯等。
2. 炔烃的加成反应炔烃也是加成反应的重要反应物之一。
通过加成反应,炔烃可以与其他物质发生加成反应,生成具有新的化学键的有机化合物。
例如,炔烃与氢气加成反应生成烯烃,与卤素加成反应生成卤代烯等。
3. 羰基化合物的加成反应羰基化合物是加成反应的常见反应物之一。
通过加成反应,羰基化合物可以与亲核试剂或亲电试剂发生加成反应,生成具有新的官能团的有机化合物。
例如,羰基化合物与胺发生加成反应生成酰胺,与醇发生加成反应生成醚等。
四、加成反应的例子1. 醇与烯烃的加成反应在存在酸催化条件下,醇可以与烯烃加成反应,生成醚化合物。
例如,甲醇与乙烯加成反应生成乙醇。
2. 羰基化合物与胺的加成反应在存在催化剂存在下,羰基化合物可以与胺发生加成反应,生成酰胺。
例如,乙酰胺与甲胺加成反应生成甲酰胺。
有机化学基础知识点整理醛和酮的亲核加成和还原反应机理

有机化学基础知识点整理醛和酮的亲核加成和还原反应机理有机化学基础知识点整理醛和酮的亲核加成和还原反应机理一、引言有机化学是研究碳元素和碳以及其他元素之间的化学反应的学科。
在有机化学中,醛和酮是常见的官能团,其具有亲核加成和还原反应机理。
本文将对醛和酮的亲核加成和还原反应机理进行整理。
二、醛和酮的亲核加成反应1. 亲核加成反应定义亲核加成反应是指亲核试剂中的亲核试剂从反应中代替醛或酮中的部分或全部官能团的过程。
该反应常见的亲核试剂有:醇、胺、氨等。
2. 亲核加成反应机理(1)亲核试剂攻击羰基碳亲核试剂通过其自由电子对攻击醛或酮中的碳,形成一个五元环中的过渡态。
(2)五元环的形成亲核试剂中的亲核部分攻击羰基碳后,将剩余的电子通过共轭转向氧原子上,形成五元环中的过渡态。
(3)负电荷的转移氧原子上的负电荷转移到亲核试剂的负电荷上,亲核试剂离开后,得到最终产物。
三、醛和酮的还原反应1. 还原反应定义还原反应是指通过还原剂将醛或酮中的羰基还原成相应的醇。
常用的还原剂有:氢气、亚磷酸酯等。
2. 还原反应机理(1)氢化钠和水的生成还原剂与醛或酮中的羰基发生反应,生成相应的醇官能团。
(2)还原剂的失去电子还原剂通过失去电子的方式与醛或酮中的羰基发生反应,形成相应的醇官能团。
(3)中间物的形成中间物形成后,通过质子转移的方式,生成最终的醇产物。
四、示例以丙酮和甲醛为例,说明醛和酮的亲核加成和还原反应机理。
1. 丙酮的亲核加成反应以氯乙烷为亲核试剂,攻击丙酮中的碳,形成五元环过渡态。
氯离子离开后,得到丙酮和氯乙烷反应生成的产物。
2. 甲醛的还原反应以氢气和铜催化剂为还原剂,发生还原反应。
氢氧化钠作为碱催化剂。
甲醛经过还原反应后,得到甲醇作为最终产物。
五、结论本文对醛和酮的亲核加成和还原反应机理进行了整理。
醛和酮的亲核加成反应通过亲核试剂攻击羰基碳,形成五元环过程实现。
而醛和酮的还原反应则是通过还原剂将羰基还原成相应的醇官能团。
化学反应中的加成反应机理探讨

化学反应中的加成反应机理探讨在化学领域中,加成反应是一种常见的化学反应类型。
加成反应是指两个或多个反应物中的原子、离子或分子结合形成新的化学键。
在本文中,我们将探讨加成反应的机理。
1. 加成反应的基本特征加成反应是一种化学键形成反应,通常发生在多重键(例如双键、三键)上。
在加成反应中,一个或多个原子、离子或分子与多重键之间发生相互作用,使原子间的键减少,同时新的化学键形成。
2. 加成反应的机理加成反应的机理可以分为电子亲和性和核亲和性两种类型。
2.1 电子亲和性加成反应电子亲和性加成反应是指一个或多个原子或分子中心的孤对电子或$\pi$电子与多重键中的$\pi$电子形成新的共轭体系。
这种反应通常涉及到云堆积扩张和双电子扩散的步骤。
2.2 核亲和性加成反应核亲和性加成反应是指一个或多个原子或分子中的正电荷与多重键中的$\pi$电子或负电荷形成新的共价或离子键。
这种反应通常发生在含有正电荷中心的分子中,如羰基化合物。
3. 机理示例让我们以马科夫尼科夫规则为基础来探讨一个常见的加成反应机理示例:烯烃的加成反应。
考虑1,3-丁二烯与溴水反应的机理。
首先,溴分子与1,3-丁二烯中的双键之间形成亲核加成过渡态。
在这个过渡态中,两个溴原子分别与两个碳原子形成新的化学键。
然后,溴原子中间的$\sigma$键开始形成,并释放出两个碳原子上原本存在的$\pi$电子。
最后,生成的产物是1,4-二溴丁烷。
在这个加成反应中,烯烃的碳碳双键在两个碳原子上分别形成了两个碳溴键。
这个例子展示了电子亲和性加成反应的典型机理。
4. 加成反应中的应用加成反应在有机合成中有广泛的应用。
通过合理设计反应条件和选择适当的反应物,可以合成复杂的有机分子和功能性材料。
例如,烯烃的加成反应可以用于合成药物、橡胶、塑料等。
此外,加成反应还用于生物化学、材料科学和环境领域的研究。
5. 总结加成反应是一种常见的化学反应类型,通过两个或多个反应物中的原子、离子或分子的相互作用形成新的化学键。
有机化学中的重要反应和机理

有机化学中的重要反应和机理有机化学是研究碳氢化合物及其衍生物的科学分支。
其中,很多重要的反应和机理是有机化学的核心内容。
本文将介绍有机化学中最为重要的反应及其机理。
一、加成反应(Addition Reaction)加成反应是指在不改变已有分子的化学键的基础上,将新的原子或组合氢加入到分子中的反应。
加成反应是有机化学中最常见的反应之一。
其中,加成反应中一个重要的反应是亲核加成反应。
1. 亲核加成反应亲核加成反应是指亲核试剂与电子不足的反应物相互作用,将新的基团与反应物中的双键或三键中一个原子上的原子替代掉的反应。
例子有酰胺水解反应、烯丙基甲酸酯水解缩合反应等。
以酰胺水解反应为例,其机理如下:在此反应中,水为亲核试剂,攻击羰基碳上的电子,使氧原子的钝化更加明显,于是二次水解便容易发生,产生对应的羧酸和胺。
二、消除反应(Elimination Reaction)消除反应是指从一个或多个有机化合物中消失一个分子,同时生成一个双键或三键的反应。
消除反应是有机化学反应中相对简单的一类反应,其中一个重要的消除反应是亲电消除反应。
1. 亲电消除反应亲电消除反应是指一个含有亲电性基团的反应物,通过消除一个氢离子与卤原子离子(X)来形成双键或三键,同时释放出一个离子,即反应物通过加成反应生成的求电子亲电基团逆反应中的一个重要反应。
以烯丙醇的消除反应为例,其机理如下:三、取代反应(Substitution Reaction)取代反应以原子或原子团互相取代,被取代原子或原子团和取代原子或原子团在所形成化合物中不同位置上共存的反应。
取代反应是有机化学反应中另一类相对常见的反应,其中一个重要的取代反应是亲核取代反应。
1. 亲核取代反应亲核取代反应是指亲核试剂与取代体相互作用,亲核试剂中的电子攻击取代体中的一个原子,将其原子或原子团替代成亲核试剂中的相应原子或原子团的反应。
例子有卤代烃亲核取代反应、苯的亲核取代反应等。
以卤代烃的亲核取代反应为例,其机理如下:在此反应中,亲核试剂(醇)的氧原子攻击卤代烃中的卤素离子,将其取代为醇基团,同时生成HCl。
化学反应中的亲核亲电加成反应机理探讨

化学反应中的亲核亲电加成反应机理探讨化学反应是物质之间发生变化的过程,其中亲核亲电加成反应是一类常见的反应机理。
本文将探讨亲核亲电加成反应的机理以及相关实例。
一、亲核亲电加成反应的机理亲核亲电加成反应是一种化学反应机理,在该反应中,亲核试剂和亲电试剂通过共价键形成新的化学键。
这种反应机理常见于酰基、亚胺、酮等官能团之间的化学反应。
亲核试剂是具有亲核性质的化合物,通常带有孤立电子对或负电荷。
亲电试剂则是具有亲电性质的化合物,通常带有正电荷或部分正电荷。
亲核试剂的亲核性质使其可以攻击亲电试剂中的亲电中心,从而形成新的化学键。
亲核亲电加成反应的机理可以分为三个步骤:亲核试剂的亲核性攻击、共价键的形成和负电荷的转移。
1. 亲核试剂的亲核性攻击:亲核试剂中的亲核性质使其攻击亲电试剂中的亲电中心,常见的亲电中心包括氢原子、碳原子和电子不足的原子。
2. 共价键的形成:亲核试剂攻击亲电中心后,形成新的化学键。
这种化学键通常是通过共用电子对的形式形成的。
3. 负电荷的转移:在形成新的化学键后,部分电荷会从亲核试剂转移到亲电试剂上,使亲电试剂带有正电荷或部分正电荷。
亲核亲电加成反应的机理可以通过一系列实验和计算验证。
通过观察反应物和产物的结构和性质变化,可以确定亲核试剂攻击亲电中心的位置和方式。
同时,分子模拟和量子化学计算方法也可以用来研究和预测亲核亲电加成反应的机理。
二、亲核亲电加成反应的实例亲核亲电加成反应在有机合成中有着广泛的应用。
以下是一些常见的亲核亲电加成反应实例:1. Michael加成反应:该反应是以亲核试剂为亮点试剂,亲电试剂为含有α,β-不饱和酮或醛的化合物。
亲核试剂通过攻击亲电中心,形成新的碳碳键。
2. Aldol加成反应:该反应以亲核试剂为含有羰基的化合物,亲电试剂为醛或酮。
亲核试剂中的羰基攻击亲电中心,形成新的碳碳键。
3. Grignard反应:该反应以亲核试剂为Grignard试剂(一种具有亲核性质的有机锂或有机镁化合物),亲电试剂为卤代烷或羰基化合物。
亲电加成与亲核加成的区别

亲电加成与亲核加成的区别加成反应是有机化学中一类最基本的化学反应,它主要包含亲电加成反应、亲核加成反应和游离基加成反应几大类.其中由于亲电加成和亲核加成的“形式”相像, 而本质却存在着很大的差别, 因而学生往往会对亲电加成和亲核加成区分不清, 产生混淆,例如为什么同样是双键,碳碳双键易发生亲电加成反应而碳氧双键却易发生亲核加成反应。
本文就简单分析分析亲电加成和亲核加成的本质区别.关键词:亲电加成,亲核加成,结构特征,反应机理一 .亲电试剂与亲核试剂就一个反应来讲, 是亲电的还是亲核的, 通常规定由进攻试剂是亲电的还是亲核的来决定。
所以要弄清楚什么是亲电加成反应什么是亲核加成反应, 就必须先弄清楚亲电试剂和亲核试剂的含义.所谓亲电试剂是针对进攻试剂讲的,它一般是一个缺电子的正离子也可以是偶极或诱导偶极正的一端,由于缺电子, 所以它总是倾向于和给电子反应物即底物进行反应,因此我们把它叫做亲电试剂.亲核试剂也是对进攻试剂而言的, 它一般是一个富电子的负离子也可以是含有孤电子对的基团, 由于富电子, 所以它倾向于和缺电子反应物特别是碳核发生反应,因此我们把它叫做亲核试剂。
二.底物的结构特特征1、亲电加成反应中底物的结构特征亲电加成的典型代表就是碳碳双键的亲电加成反应。
碳碳双键包含着处于不同状态的两个键,一个较强的σ键,另一个较弱的π键由于π轨道重的一对电子比σ轨道中的一对电子更为分散,被碳核拉得较松,因此就很容易被极化而导致双键中的二键容易断开,形成两个更强的σ键。
另外由于电子云是聚集在分子平面的上部和下部,在整个分子中, 电子向外暴露的态势较为突出, 由此我们可以看出它们能遮蔽分子使之不易受到亲核试剂的进攻,相反却容易受到亲电试剂的进攻而发生亲电加成反应。
碳碳双键。
由碳的一个2s亚层和两个2P亚层杂化为三个sp2杂化轨道。
这三个sp2杂化轨道分布在同一平面上。
苯环中的每个碳原子采用sp2杂化方式,每个碳原子都有一未参加杂化的p轨道。
烯酮加成机理

烯酮加成机理
烯酮加成是有机化学中一种重要的化学反应,其机理是指在一定条件下,烯酮与其他化合物发生加成反应的过程。
烯酮加成反应可以分为两类:1,亲核加成;2,电环化加成。
亲核加成是指烯酮分子中有一个亲电子亲和性较强的双键,可以与亲核试剂反应形成加成产物。
常见的亲核试剂有胺、醇、硫酸、水等。
以烯酮与胺为例,胺中的氮原子具有孤对电子,可以攻击烯酮中的双键,形成中间物质,最后水分子参与反应,质子化中间物,生成最终产物。
亲核加成反应通常需要在碱性条件下进行,加成位置通常在烯酮双键的顶端。
电环化加成是指烯酮分子中有一个亲电子亲和性较弱的双键,可以与电子丰富的部分反应形成环化产物。
常见的电子丰富部分有醇、胺、硫酸等。
以烯酮与醇为例,醇中的氧原子可以向烯酮中的双键攻击,形成中间物质,最后质子化中间物,生成最终产物。
电环化加成反应通常需要在酸性条件下进行,加成位置通常在烯酮双键的中间。
烯酮加成反应有着广泛的应用,可以用于药物、材料、农药等领域,具有很高的研究和开发价值。
在研究和开发过程中,需要考虑反应条件、反应机理、产物结构等因素,以实现理想的反应效果。
此外,还需要采用适当的实验方法和技术手段,以确保实验结果的准确性
和可靠性。
烯酮加成反应是有机化学中一种重要的反应类型,具有广泛的应用价值和研究意义。
在进行相关研究和开发时,需要充分考虑反应条件、机理、产物结构等因素,以实现理想的反应效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH C CH
H2 Lindlar cat
OH (H3C)2C CH CH2
Al2O3
H2C C CH CH2 CH3
二、羰基的亲核加成
4. 含C亲核试剂
(3) 有机金属试剂——格氏试剂、有机锂试剂等 广泛用于合成各级醇,也可用于合成醛酮。
O
R MgBr
OMgBr
H2O
OH
R
R
O R MgBr Y
2. 含O, S亲核试剂 (3) RSH
二、羰基的亲核加成
2. 含O, S亲核试剂
(4) NaHSO3 产物为盐,溶于水 用于将醛酮同不溶于水的有机物分开
O + NaHSO3
R H(R')
ONa
R
H(R') SO3H
OH
R
H(R') SO3Na
OH
R
H(R') SO3Na
O +
R H(R')
HCl
CO
2) 羰基氧被N取代 C O
Nu E H2NY
C OE Nu
Y CN
3) 羰基氧被C取代
CO
4) 亲核取代反应
CO Y
Ph3P CR1R2
R1 CC
R2
Nu
CO + Y
Nu
一、羰基的结构及反应特性
4. 亲核反应活性
烷基给电子作用
一、羰基的结构及反应特性
4. 亲核反应活性
空间位阻影响
一、羰基的结构及反应特性
Nucleophiles that are relatively weak bases, such as ¯CN, amines, thiols, and X¯, usually form conjugated addition products.
二、羰基的亲核加成
影响 1,2-和1,4-加成的因素
关于亲核加成的小结 1. 概述 —— 结构、机理、反应活性、立体化学 2. 含O, S亲核试剂 包括H2O, ROH, RSH, 和NaHSO3
羰基的保护 醛酮的分离纯化
3. 含N亲核试剂 (1) RNH2 and YNH2 (2) R2NH
亚胺及其衍生物的形成 烯胺的形成
4. 含C亲核试剂 —— C-C键的形成
(1) 亲核试剂的碱性
CC
Nu
CO H
irreversible 1,4-addition
major
when Nu is a strong base
C
C C
O + NuH
irr1e,v2e-arsdidbilteion
1,2re-avdedrsitiibolne
CC C OH Nu
CC C OH
when Nu is a weak base Nu
羟胺
结构式 R
CN
OH CN
生成物
名称
席夫碱(shiff base)
肟(oxime)
NH2
肼
NHC6H5
苯肼
NHCONH2 氨基脲
C N NH2
腙(hydrazone)
C N NHC6H5 苯腙(phenylhydrazone)
C N NHCONH2 缩氨脲(semicarbazone)
二、羰基的亲核加成
Both 1,2-addition and 1,4-addition can happen, they are also called as direct addition and conjugated addition
二、羰基的亲核加成
影响 1,2-和1,4-加成的因素
(1) 亲核试剂的碱性
Nucleophiles that are strong bases, such as RLi and LiAlH4, tend to form direct addition products,for the reaction is irrersible.
M
S
Nu
R
L
次要产物
二、羰基的亲核加成
2. 含O, S亲核试剂
包括H2O, ROH, RSH, 和NaHSO3 (1) H2O
水合物
酸碱催化,加快平衡的达到,但不影响平衡移动。
二、羰基的亲核加成
(1) H2O
O +
H3C CH3 99.8%
O +
H3C H 42%
O +
HH 0.1%
O +
Cl3C H
major miner;HCl
O CH CHCH
CH3SH
O
CN
O CH CH2CH SCH3
影响 1,2-和1,4-加成的因素
(2) 空间位阻
O CH3
1.EtMgBr
CH CH C C CH3
CH3
2.H3O
O CH3
CH CH2 C C CH3
Et
CH3
1,4-加成 100%
一、羰基的结构及反应特性
1. 羰基的结构特点
The carbonyl group is polar and the partial positive charge on the carbonyl carbon causes carbonyl compounds to be attacted by nucleophiles.
其中:Y=X or OR
OMgBr Y
R
-YMgBr
O
R MgBr H2O
R
OH R
R
CN
R MgBr
NMgBr
H2O
R
O R
格氏试剂的应用
R CH2OH
1°醇
1.HCHO 2.H3O
R COOH 羧酸
1.CO2 2.H2O
O
O
OH
HCOR'
R CH 醛
RMgX
R CH R
2°醇
1. O
R
CH2CH2OH
cyanohydrin
C
OH CN
a-羟基腈
H ,H2O
H2 Pt
C
OH COOH
C
OH CH2NH2
a-羟基酸 b-氨基醇
二、羰基的亲核加成
4. 含C亲核试剂
(2) ¯C≡CR
O + HC CR KOH H2O
C
OH C CR
CH3COCH3 + KC CH
KOH 一缩二乙二醇二甲醚
(H3C)2C
3. 含N亲核试剂
(2) R2NH 经历亲核加成和脱水两个步骤
脱水发生在羰基的 a - C上而非N上,形成烯胺
(enamine)
C O + NHR2
C
O NHR2
H -H
C
OH NHR2
-H H
C NR2 -H C
an enamine
C NR2 C
H
-H2O
C
OH2 NR2
H
C
OH NR2
neutral tetrahedral intermediate
—— it is completely regioselective, unlike E2 —— it is also stereoselective
Ph3P CH
NO2 + H3CO
O2N
CHO 25℃
H H
89%
唯一产物
OCH3
顺反烯烃的生成受条件和Ylide试剂的结构、活性等影响很大
The use of Wittig reaction in industry
二、羰基的亲核加成
(2) ROH 可逆反应,通过油水分离器不断除去
反应过程中形成的水,使反应完全。 缩醛和缩酮在碱性条件下稳定,酸
性水溶液中加热又回复到醛、酮。 因此,可利用这一反应保护醛酮的羰基。
例1
(2) ROH 羰基的保护,例1
(2) ROH 羰基的保护,例2
二、羰基的亲核加成
1. Summary
(3) Stereochemistry
手性条件下,有立体选择性,Cram法则: 羰基上的R基团与大的基团 (L) 呈重叠式构象,羰 基氧则处于中等基团 (M) 与较小基团 (S) 中间,亲 核试剂从小的基团这一方进攻为主要进攻方向。
O
M
S Nu
E
RL
OE MS
+
R
Nu
L
主要产物
OE
一、羰基的结构及反应特性
2. 各种含羰基的化合物
O
O
(1) Class I —— 醛和酮 R H
主要发生亲核加成反应
an aldehyde
(2) Class II —— 羧酸及其衍生物
RR an ketone
主要发生亲核取代反应
一、羰基的结构及反应特性
3. 发生在羰基上的反应的类型(亲核反应)
1) 亲核加成
O CH CH C
1.
MgBr
2.H3O
O CH CH2 C
1,4-加成 92%
O
1.
MgBr
CH CH C CH3
2.H3O
O CH CH2 C CH3 +
OH CH CH C H
1,4-加成 12%
1,2-加成 80%
三、羧酸及其衍生物的亲核取代反应
二、羰基的亲核加成
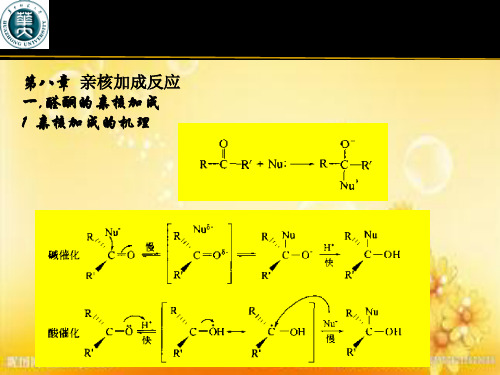
1. Summary (2) Mechanism
碱性条件下
O
酸性条件下
O
Nu
OE
E Nu
慢
Nu
快
