精子畸形试验
用小鼠精子畸形试验评价生物羊膜遗传毒性的研究

批号 000 ,规 格型 4 81 羊 膜 是人类 两 层胎膜 的 f , I常 羊膜薄 而透 明 . 状 胬 内、角膜 溃疡穿 孔的修 复 ( 向层 I 无 【管 。 在光镜下可 分 为 5晨 上 皮层、基底膜 、 密层 号 Z 5× ) 血 致 K一 5 。 剂 :09 氯化 钠注射 液 (C) 0 甲醇 ,2 伊 2试 . % S ,1% % 纤维 母细 胞层和海绵 层 。羊膜主要 利用的 是基底膜 。基 1 底幞是 无细 胞结构 的胶原组 织层 .羊膜移 植是将羊 膜植 红染色液 ,环磷酰 胺 ( P 。 c ) 片根 据创 面大 小的 要求 ,平 贴 于眼表 ,再 行缝合 ,受体 1 . 器 :Olmp s双 日屁微镜 (o e-1) 3仪 y u c vr 8,手提 式压 0 周遍 的健 康结膜 组织 的新 生上皮 细胞 向羊膜移 行 ,两 3 力蒸汽 消毒 器,生 化培养箱 L 一5B,分析 天平 ,镊 RH 10 周后 ,新生 上皮长 好 ,羊幞 自动 脱落。生 物羊膜 是取 用 子 剪 7 。 ] 健 康剖富 产产女I 胎盘组 织 ,产 前 l清 学检查按 照国家 I = 的 f Ⅱ . 4动物 :雄 性 昆 明种 小 鼠 ( - 吉,体 重 2—5 ,山 68』】 53g 相关标 准进行 .排 除乙肝 、丙肝 、梅毒 及艾滋 痫 ,从 而 东 鲁抗医 药集团 有限公 司 ) 。 确 保原料 的腱康安 垒性 。生物 羊膜属植 入 3 医疗器械 1 类 . 5动物管理 :动物 饲养 条件符 合 “ 实验 动物管 理条例 ” 应 从生物 、物理 .化学等 方面 作必 要的质量控 { ,以 保 要求 。 I j l J {产品 的安全性 因此 对羊膜 产品的 质量要 求是 :无致 l E 敏 、 刺激、无细 胞毒性 无遗传 毒性 . 无 具合 适的 P 值 H 厚薄均 匀,具有 ・ 定的 韧性 。本研究就 是从 生物学 方面 评价 其是 舀J 遗传毒性 。具 体操 怍如下 : 生
实验2-小鼠精子畸形试验-20121025

制
颈椎脱臼 处死小鼠 取双侧 附睾
片
3ml磷酸盐 剪碎附睾 缓冲液
擦镜纸 过滤
取悬液滴于 玻片上推片
甲醇固定5 分钟
伊红染色30分钟
(五)阅片
首先在低倍镜下选择背景清晰、精子分布 均匀、重叠较少的区域,然后在高倍镜下 观察结构完整的500个精子,计数其中畸 形的精子数。
五、结果分析与评价
精子畸形形态观察 无钩、香蕉形、无定形、双头、 胖头、 折尾、双尾 计算精子畸形的发生率(头部重叠或全部 重叠的精子、无尾精子不进行计数)。
注意鉴别制片过程中人为造成的精子损伤。
正常精子
胖头精子
双头精子
双尾精子
双尾精子
双尾精子
香蕉形精子
人类精子
Thanks!
四、操作步骤
(一)动物选择 (二)剂量与分组 (三)染毒与采样 (四)制片 (五)阅片
(四)制片
颈椎脱臼法处死小鼠,剪开腹腔,分离并摘取 双侧附睾,将附睾放入盛有约3ml磷酸盐缓冲液或 生理盐水的小平皿中,以眼科剪将附睾剪成小 块,用吸管将悬浮液轻轻吹打5~6次,静置3~ 5min,用四层擦镜纸滤除组织碎片,吸取此精子 悬液滴于清洁载玻片上,均匀推片,待玻片晾干 后用甲醇固定5min,干燥后(此时也可镜检观察 精子形态)再用1%的伊红醇溶液染色1~2h(或 30min),流水冲洗,晾干后镜检。
一、目的
精子畸形试验是检测受试化学毒物 能否破坏哺乳动物精子正常形态的 实验方法 通过该实验,学习和掌握小鼠精子 畸形试验的原理和步骤
二、原理
精子畸形是指精子的形状异常和异常精 子数量的增多; 生殖系统对化学毒物的作用十分敏感, 在其它系统还未出现毒性反应之前,生 殖系统可能已出现损害作用;
实验一 小鼠精子畸形试验

实验目的
通过该实验,学习和掌握小鼠精子畸形 实验的原理和步骤
实验原理
精子畸形是指精子形状改变和畸形精子
数量增多。
生殖系统对化学毒物的敏感性
用检测雄性动物接触化学毒物后精子畸
形率的高低,来反应该化学毒物的生殖 毒性和对生殖细胞潜在的致突变性。
实验动物和材料
精子形态
实验操作步骤
二、制片
实验操作步骤 三、阅片
低倍镜 找到背景清晰、精子重叠较少的
部位高倍镜 按顺序检查精子的形态。 每只动物检查完整的精子1000个。
实验结果分析与评价
精子畸形 主要表现在头部,畸形的类型
可分为无钩、香蕉形、无定形、胖头、 双头以及双尾等。 精子畸形百分率 分别记录各种类型畸形 的精子,进行精子畸形类型构成比分析, 并计算每组动物精子畸形百分率。
实验动物:雄性小鼠 (6-8周)24只 实验材料:
1.器材:眼科剪、眼科镊、玻璃平皿、显微镜、擦镜
纸、吸管
2.试剂:生理盐水、甲醇(分析纯)、 2%伊红水溶液
环磷酰胺( 50mg/kg )
实验操作步骤
一、动物分组及处理
动物选择 分组及处理:
阳性对照组:8只雄鼠,环磷酰胺腹腔注射三次 空白对照组:16只雄鼠,不做任何处理
小鼠精子畸形实验报告

一、实验目的本实验旨在探究不同因素对小鼠精子形态的影响,分析精子畸形率的变化,评估其对小鼠生殖健康的影响。
二、实验材料1. 实验动物:昆明种雄性小鼠,体重25~30g。
2. 实验药品:白头翁水提取物、硫酸镉、丝裂霉素C。
3. 实验器材:显微镜、染色液、培养皿、注射器、剪刀、眼科剪等。
三、实验方法1. 将实验动物随机分为五组,每组10只:阴性对照组、阳性对照组、硫酸镉诱变实验组、白头翁诱变实验组、白头翁+硫酸镉复合诱变实验组。
2. 阴性对照组:正常饲养,不予任何处理。
3. 阳性对照组:腹腔注射丝裂霉素C(1.0mg/kg)一次,模拟化学物质对精子的影响。
4. 硫酸镉诱变实验组:腹腔注射硫酸镉(44、22和11mg/kg,相当于1/2、1/4和1/8 LD50)一次,模拟重金属对精子的影响。
5. 白头翁诱变实验组:灌胃白头翁水提取物(1.0、2.0、4.0和8.0g/kg,相当于人5、10、20和40临床剂量)一次,模拟中药对精子的影响。
6. 白头翁+硫酸镉复合诱变实验组:同时给予硫酸镉和白头翁水提取物处理。
7. 实验后35天,处死动物,取出两侧副睾,放入盛有2mL生理盐水的平皿中。
8. 用眼科剪将副睾纵向剪1~2刀,静止3~5min,轻轻摇动。
9. 用四层擦镜纸过滤,吸滤液涂片。
10. 空气干燥后,用甲醇固定5min以上干燥。
11. 用1%~2%伊红染色1min,用水冲洗。
12. 镜检精子形态,记录精子畸形率。
四、实验结果1. 阴性对照组:精子畸形率为5%。
2. 阳性对照组:精子畸形率为30%。
3. 硫酸镉诱变实验组:精子畸形率为20%。
4. 白头翁诱变实验组:精子畸形率为10%。
5. 白头翁+硫酸镉复合诱变实验组:精子畸形率为35%。
五、讨论1. 实验结果表明,硫酸镉和丝裂霉素C对小鼠精子形态有显著的畸形作用,导致精子畸形率升高。
2. 白头翁水提取物对硫酸镉诱变有明显的抑制作用,降低精子畸形率。
WHO人类精液检查与处理实验手册

正 主段应是直的,均一的,比中段细,其 主段应是直的,均一的,比中段细,非
常 长约45um。
卷曲的,其长约为45um。
标 准
异 主段缺陷包括:短、多尾、发卡形、断 主段缺陷包括:短、多尾、发卡形、断
常裂
裂
标 主段急剧弯曲、主段宽度不规则、主段 主段弯曲(>90度)、主段宽度不规则、
准 卷曲以及上述缺陷的任何组合
生育力评估
评估男性生育三大要点:
女方妊娠 妊娠时相 精液参数
其他男性病诊断
精子的总数:睾丸生殖功能 输精管道的通畅程度
血精、脓精:附性腺疾病 精浆生化: 附性腺功能
治疗策略制定(常规治疗及辅助生殖)
少精子症的分类和ART治疗方案
精子浓度
治疗
轻度少精子症 ≧10,<20(15) ×106/ml
主段卷曲以及上述缺陷的任何组合
精子胞浆小滴判断标准
胞浆小滴体积大于精子头部的1/3
胞浆小滴体积大于精子头部的1/3
WHO第四版与第五版精子形态学评估标准比较研究
研究目的:比较WHO第四版与第五版精子形态学评估标准的变化。 研究对象: 1000个精子图片,一张精子形态质控版 研究方法: 1.用WHO第四版的评估标准,对上述精子进行评估 2.精子库9名工作人员学习第五版精子形态学评估标准及精子图谱,并进行室内质量控
因此,有必要建立或选用特殊实验对精子功 能进行测定。
精子存活率 精子形态分析 精子顶体完整性 精子与透明带结合试验 精子细胞核成熟度与DHA损伤检测 精子表面结合抗体检测 附睾功能检测
精子形态学评估标准
在评估精子正常形态时应采用严格标准 (Krugeret al.,1986;Menkveld et al.,1990;Coetzee al.,1998)
金诃牌雪益康胶囊急性毒性和遗传毒性试验研究

金诃牌雪益康胶囊急性毒性和遗传毒性试验研究作者:刘有菊马文俊袁发荣孙跃宁陈海莲来源:《食品界》2020年第07期摘要:目的:研究金诃牌雪益康胶囊的急性毒性和遗传毒性实验,评价其食用安全性。
方法:依据《食品安全性毒理学评价程序和方法》进行急性毒性试验、遗传毒性试验(Ames 试验、骨髓细胞微核试验和精子畸形试验)。
结果:小鼠急性毒性试验经口最大耐受剂量(MTD)>30 g/kg·bw,属无毒级。
Ames 实验、骨髓细胞微核试验和精子畸形试验结果均为阴性,表明受试物无致突变作用。
结论:金诃牌雪益康胶囊急性毒理分级属无毒级,无遗传毒性,在本试验剂量范围内,金诃牌雪益康胶囊属于安全性保健食品。
关键词:金诃牌雪益康胶囊;急性毒性;遗传毒性;金诃牌雪益康胶囊产品配方精选海拔3000米左右高原特色草本植物唐古特白刺果、柴达木枸杞果、沙棘果等为主要原料制成的保健食品。
优越的地理环境,日照时间长,太阳辐射强,昼夜温差大,培育出高活性的高原物质。
以传统医学与现代养生理论为指导原则,六种植物科学配伍、合理配比,采用传统炮制与现代工艺相结合的技术手段,精制而成的一款高端产品,其主要保健功能是调节血糖。
为评价产品的安全性,根据《保健食品检验与评价技术规范》的要求,现进行金诃牌雪益康胶囊的急性毒性及遗传毒性试验。
1. 材料与方法1.1 材料1.1.1 受试样品金诃牌雪益康胶囊由金诃藏药股份有限公司提供。
样品推荐量为每日3次,每次3-4粒,0.3g/粒,总量为3.6g,相当于成人推荐量0.06g/kg·bw(以60kg计)。
1.1.2 实验动物和饲养环境 KM种小鼠,清洁级,体重18-22g,动物合格证号:青医动字第001号,由青海省实验动物中心提供;实验动物购进后首先于恒温恒湿的动物房环境中适应3天,单笼饲养。
1.1.3 菌株鼠伤寒沙门氏菌TA97a、TA98、TA100 、TA102。
由上海市疾病预防控制中心提供。
精子形态评估报告单

精子形态评估报告单精子形态评估报告单是一种用于评估男性精子形态的常规检测方法。
通过对精子形态的评估,可以判断男性生殖系统是否存在异常,并进一步指导治疗方案的选择。
下面是针对精子形态评估报告单的详细解读:一、精子形态评估指标1. 精子头部形态:正常精子头部应呈椭圆形或倒卵形,头部大小和形状均匀一致。
2. 精子颈部形态:正常精子颈部应该呈细长的形状,与头部连接紧密,无异常变形。
3. 精子尾部形态:正常精子尾部应呈长而细的形状,具有较好的运动能力。
二、评价结果1. 正常精子:正常精子形态占总数的比例,一般应在15%以上。
2. 异常精子:头部变性、变形、颈部异常、尾部缺损等异常精子的数量。
一般来说,异常精子数量越少,说明精子形态越好。
三、临床意义通过精子形态评估报告单的分析,可以判断男性生殖系统是否存在异常,主要有以下几个方面的临床意义:1. 婚前检查:精子形态评估是婚前检查的一项重要内容,可以帮助双方了解是否存在生育障碍。
2. 不孕症筛查:精子形态评估可以作为不孕症筛查的指标之一,对不孕症的诊断和治疗提供重要依据。
3. 治疗指导:根据精子形态评估结果,可以指导选择适当的治疗方案,如助孕技术、生殖细胞治疗等。
四、改善措施对于精子形态评估不理想的男性,可以尝试以下改善措施:1. 保持良好的生活习惯:戒烟戒酒,保持正常的作息时间,避免长时间暴露在高温环境中。
2. 饮食调理:均衡饮食,补充富含维生素C、E等抗氧化物质的食物,如水果、蔬菜、坚果等。
3. 控制体重:过重或过轻都会对精子质量产生不利影响,保持适当的体重对精子形态有益。
4. 避免应激:长期的精神、情绪应激对精子质量会产生不良影响,保持良好的心态有利于精子形态的改善。
5. 避免接触有害物质:避免长时间接触有害物质,如重金属、辐射等,以免对精子产生不良影响。
总之,精子形态评估报告单是对男性生殖系统健康的一种重要评估手段。
理解评估结果,并采取相应的改善措施,可以提高男性生育能力,达到更好的生殖效果。
厦门大学-实验六.小鼠精子畸形试验(讲义)

轻冲洗,晾干。
标本制备
颈椎脱臼处死小鼠
取双侧附睾, 纵向剪开被膜
+ NS 1ml,静置5min 轻摇,剔除大的组织, 收集悬液于1.5ml EP 管,加300 µl NS清洗
1000 rpm离心5 min 弃上清, 余0.15 ml液体
将受试物各剂量组精子畸形发生率分别与阴性对照组进行 比较。 阳性的判断标准是畸形发生率至少为阴性对照组 的倍量或经统计学处理有显著性差异,并存在剂量-反应 关系者。
一般正常小鼠的精子畸形率为0.8%~3.4%
结果分析
分别计算各剂量组的精子畸形发生率。各剂量组的精子畸 形率与阴性对照组之间的差异分析采用秩和检验。
精子畸形发生率和畸形类型分析
试验报告
(1)受试物名称、理化性状、配制方法、所用溶剂; (2)动物种属和品系、体重、数量、来源(注明合格证号
和动物级别); (3)实验动物饲养环境,包括饲料来源、室温、相对湿度
、实验动物室合格证号; (4)剂量分组,染毒途径和方式; (5)试验方法:简述操作步骤,所用统计学方法; (6)结果:以列表方式报告受试物对动物精子畸形发生率
有条件时,可于给受试物后第1、4和10周处死动物,检查 精子形态 (各种致突变物作用于精子的不同发育阶段,可在接触某种 致突变物后不同时间出现精子畸形)
动物染毒情况记录
操作步骤
标本制备
制片:用颈椎脱臼法处死小鼠,剖开腹腔,暴露睾丸,分 离两侧附睾,放入盛有1 mL 生理盐水(37℃预热)的平皿中 。用眼科剪剖开附睾组织,室温下静置5 min ,轻轻摇动 ,用镊子将大的组织块挑出;收集悬液于1.5 mL 离心管 中;另取300 µL生理盐水冲洗平皿,收集于同一离心管中 ;1000 rpm离心5 min;弃上清,余约0.15 mL液体,吹打 混匀,常规涂片;
WHO人类精液检验与处理实验手册第五版

致谢本手册的出版由UNDP/UNFPA/WHO/世界银行人类生殖研究、发展和研究培训特别规划署及WHO人类生殖健康与研究部共同完成。
我们对所有参与本手册筹备、编辑和校订的人员表示诚挚的感谢。
另外感谢:Ms Cathy Treece, Ms Charlene Tollner和Jim Overstreet教授(University of California, Davis, CA, USA)提供形态学显微照片以及对媒体文件的校对;Dr Rune Eliasson (Sophiahemmet Hospital, Stockholm, Sweden) 帮助定义非精子细胞;Dr Gary N Clarke (The Royal Women´s Hospital, Carlton, Australia), Dr Roelof Menkveld (Tygerberg Academic Hospital and University of Stellenbosch, Tygerberg, South Africa)和Pieter Wranz 教授(University of Stellenbosch, Tygerberg, South Africa) 对本手册编译工作提供附注。
衷心感谢国际男科学会提供的经济支持。
这个版本的手册是为纪念已故前WHO男性生育调控方法学工作组负责人Geoffrey Waites (1928-2005),他也是第二、第三和第四版实验室手册的共同编辑。
编辑委员会全身心投入工作的动力来自于对Geoff诚实、公平和关心疾苦人格的欣赏。
缩写词Ab antibody 抗体AI artificial insemination 人工授精AID artificial insemination with donor semen 供精人工授精AIH artificial insemination with husband’s semen 夫精人工授精ALH amplitude of lateral head displacement 头侧摆振幅ANOV A analysis of variance 变量分析APAAP alkaline phosphatase: anti-alkaline phosphatase complex 碱性磷酸酶: 抗碱性磷酸酶复合物AR acrosome-reacted 顶体反应ART assisted reproductive technology 辅助生殖技术ASA anti-sperm antibody 抗精子抗体BCF beat-cross frequency (Hz) 交打频率BSA bovine serum albumin 牛血清白蛋白BWW Biggers, Whitten and Whittingham试液CASA computer-aided sperm analysis 计算机辅助精子分析CASMA computer aided sperm morphometric assessment 计算机辅助精子形态评估CBA VD congenital bilateral absence of the vas deferens 先天性双侧输精管缺失CD compact disk 压缩盘CD cytoplasmic droplet 胞质小滴CD45 cluster of determination 45 (pan-leukocyte marker) 决定簇45 (全白细胞标记物)CD46 cluster of determination 46 (acrosomal antigen) 决定簇46 (顶体抗原)CI confidence interval 可信区间CL confidence limits 可信界限CO2 carbon dioxide 二氧化碳DMSO dimethyl sulfoxide 二甲基亚砜DNA deoxyribonucleic acid 脱氧核糖核酸DPBS Dulbecco’s phosphate-buffered saline Dulbecco’s磷酸缓冲盐溶液DVD digital versatile disc 数字多用盘EDTA ethylenediamine tetra-acetic acid 乙二胺四乙酸(依地酸)EQA external quality assurance 外质量保险EQC external quality control 外质量控制ERC excess residual cytoplasm 残余胞质FITC fuorescein isothiocyanateFMLP formyl-methionyl-leucyl-phenylalanine甲酰-甲硫氨酰-亮氨酰-苯丙氨酸GIFT gamete intrafallopian transfer输卵管内配子移植术GPC glycerophosphocholineH2O2hydrogen peroxide 过氧化氢HBSS Hanks’ balanced salt solution Hanks’平衡盐溶液HBV hepatitis B virus 乙肝病毒hCG human chorionic gonadotrophin 人绒毛膜促性腺激素HCV hepatitis C virus 丙肝病毒HIV human immunodefciency virus 人免疫缺陷病毒HOP hamster oocyte penetration 仓鼠卵穿透HOS hypo-osmotic swelling 低渗肿胀试验HPF high power field 高倍视野HRP horseradish peroxidase 辣根过氧化物酶HSA human serum albuminxiv 人血清白蛋白IVHTF human tubal fuid 人输卵管液IB immunobead 免疫珠IBT immunobead test免疫珠试验ICSI intracytoplasmic sperm injection 胞浆内精子注射Ig immunoglobulin 免疫球蛋白IM immotility 不动IQC internal quality control 内质量控制IU international unit 国际单位IUI intrauterine insemination 宫腔内人工授精IVF in vitro fertilization 体外受精KRM Krebs-Ringer Medium Krebs-Ringer培养液LIN linearity 线性LLQ lower limit of quantifcation 定量下限LPF low power field 低倍视野MAD mean angular displacement 平均角位移MAI multiple anomalies index 复合异常指数MAR mixed antiglobulin reaction 混合抗球蛋白反应NA numerical aperture数值孔径NP non-progressive (motility) 非前向的(活力)PBS phosphate-buffered saline 磷酸缓冲盐溶液PDCA plan, do, check, actPMA phorbol 12-myristate 13-acetate (12-)十四酸佛波酯(-13-)乙酸盐PMSG pregnant mare serum gonadotrophin 孕马血清PNPG p-nitrophenol glucopyranoside 对硝基苯酚吡喃葡萄糖苷PR progressive (motility) 前向的(活力)PSA Pisum sativum agglutinin 碗豆凝集素QA quality assurance质量保险QC quality control 质量控制RCF relative centrifugal force 相对离心力RI refractive index 屈光指数RNA ribonucleic acid 核糖核酸ROS reactive oxygen species 活性氧类物质rpm revolutions per minute 每分钟转速SD standard deviation 标准差SDI sperm deformity index 精子畸形指数SDS sodium dodecyl sulfate十二烷基硫酸钠SE standard error 标准误SOP standard operating procedure 标准操作流程STR straightness (VSL/V AP) 直向TBS Tris-buffered saline Tris缓冲盐溶液TGG Tyrode’s glucose glycerolTZI teratozoospermia index 畸形精子症指数V AP average path velocity 平均轨道速率VCL curvilinear velocity 曲线速率VSL straight-line (rectilinear) velocity 直线速率WHO World Health Organization 世界卫生组织WOB wobble (V AP/VCL) 摆动第1章背景1.1 导言鉴于人类精液检查标准化需求的日益增加,世界卫生组织于1980年首次出版了《世界卫生组织人类精液及精子-宫颈粘液相互作用实验室检验手册》。
精子畸形率检测实验

精子畸形率检测一、实验目的:精子畸形试验是检测受试化学毒物能否破坏哺乳动物精子正常形态的实验方法。
通过该实验,学习和掌握小鼠精子畸形试验的原理和步骤。
1.熟悉精子畸形的概念及类型、精子畸形试验的实验设计、试验检测的遗传学终点。
2.学习和掌握小鼠精子畸形试验的基本方法步骤,正常精子及畸形精子的镜下观察。
3.了解精子畸形试验数据整理、分析方法及结果的评价。
二、实验原理:1.小鼠精子畸形受基因控制,具有高度遗传性,许多常染色体及X、Y性染色体基因直接或间接地决定精子形态。
2.精子的畸形主要是指形态的异常,是决定精子形成的基因发生突变的结果。
因此形态的改变提示有关基因及其蛋白质产物的改变。
三、实验器材及试剂:眼科剪、眼科镊、小平皿、显微镜、擦镜纸、带橡皮头吸管、载玻片、玻璃染缸1%伊红染液、9%生理盐水四、实验步骤:1.制片颈椎脱臼处死小鼠,取出双侧附睾,将附睾放入1ml磷酸盐缓冲液或生理盐水中。
用眼科剪将附睾纵向剪1~2下,静止3~5min,轻轻摇动。
吸取此精子悬液滴于清洁载玻片一端,均匀推片,待玻片晾干后用甲/乙醇固定5min以上,自然晾干。
用1%~2%伊红染色15min,用水轻冲,干燥。
2.阅片在低倍镜下找到背景清晰、精子重叠较少的区域,然后用油镜计数。
每只小鼠为一观察单位,计数1000条完整的精子中畸形精子数,计算各组小鼠精子畸变率。
其中有头无尾(轮廓不清)、头部与其他精子或碎片重叠及人为剪碎的精子均不计算。
精子畸形主要表现在头部,其次为尾部,可分为无钩、香蕉形、胖头、无定形、尾折叠、双头、双尾等。
异常精子均应记录显微镜的坐标数,以备复查。
并分别记录异常类型,以便统计精子畸形率及精子类型的构成比。
判断双头、双尾畸形时,要注意与两条精子的部分重叠相鉴别,判断无定形时要与人为剪碎及折叠相鉴别。
五、注意事项:判断双头、双尾畸形时,要注意与两条精子的部分重叠相鉴别,判断无定形时要与人为剪碎及折叠相鉴别。
中药肠宁Ⅱ对小鼠的精子畸形试验和微核试验
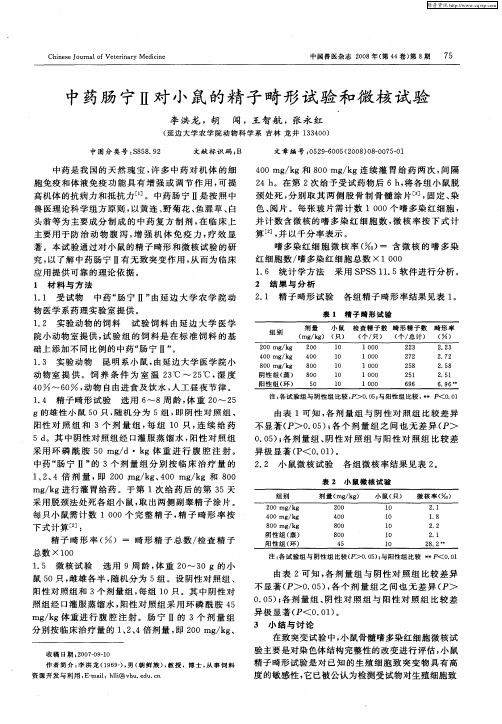
2 1 精 子 畸形 试 验 .
各组 精 子 畸形 率结果 见表 1 。
表 1 精 子 畸 形 试 验
1 3 实 验动 物 昆明 系小 鼠 , . 由延边 大学 医 学 院小 动 物室 提 供 。饲 养 条 件 为 室 温 2 ℃ ~ 2 ℃ , 度 3 5 湿 4 ~ 6 , 0 0 动物 自由进食 及 饮水 , 工昼 夜节 律 。 人 14 精 子 畸形 试验 选 用 6 . ~8周 龄 , 重 2 ~ 2 体 0 5
收稿 日期 :0 70 —0 20 —91
作者 简 介 : 洪 龙 ( 9 9 ) 男 ( 鲜 族 ) 教 授 ,博 士 , 事 饲 料 李 1 6一 , 朝 , 从
g的雄 性 小 鼠 5 0只 , 机 分 为 5组 , 阴 性 对 照 组 、 随 即
注 : 试 验 组 与 阴 性 组 比 较 , > . 5; 阳 性 组 比 较 , * P< O 0 各 PD O 0 与 * .1
阳性 对 照 组 和 3个 剂 量 组 , 组 1 每 0只 , 续 给 药 连 5d 。其 中阴性对 照 组 经 口灌 服 蒸馏 水 , 阳性 对 照 组 采用 环 磷 酰 胺 5 / 0mg d・k g体 重 进 行 腹 腔 注 射 。 中药 “ 宁 Ⅱ” 3个 剂 量 组 分别 按 临 床 治 疗 量 的 肠 的 1 2 4倍 剂 量 , 2 0 mg k 、 0 / g 和 8 0 、、 即 0 / g 4 0 mg k 0
维普资讯
C iee o ra f tr ayMe in hns un l ei r dc e J o Ve n i
中 国兽 医 杂 志 20 0 8年 ( 4 第 4卷 ) 8期 第
精子实验报告

精子检测报告怎么看?如何看精液分析报告单?男人精子是否有问题需要做精液检查,那么检查结果如何知道是否有问题呢?精子检测报告怎么看?如何看精液分析报告单?下文为大家讲解精子检查报告的一些正常值和异常值。
精液量:正常数值范围是2~6毫升精液量是指每次射精排出的数量。
正常的精液量是2~6毫升,最低需要1.5~2毫升,如果低于这个数值,就说明精液量有点少了,甚至可能是少精症。
当然,精液量也并不是越多越好,如果精液量太多,需要排除是不是病态的“多”。
精子密度:每毫升1500万算正常精子密度是指单位体积内精子的数量。
现在,精子密度能达到每毫升1500万就已经算是正常了。
然而,在30年前,精子密度要求达到每毫升6000万~2亿。
“可以说,现在男性的生殖能力已经大大退化。
这种退化跟现在的环境以及人们的生活方式不无关系。
比如现在人们开车的多了,走路的少了,长时间坐着的人多了,运动少了。
”精子密度少于1500万/毫升,属于少精症,精子进入子宫腔及输卵管的机会就会减少,从而导致受孕能力降低;但如果超过2亿/毫升,则属于多精症,精子活动力会受到影响,同样也会影响精子受孕的能力。
因此,精子密度过高、过低甚至无精,都是男性不育因素。
精子活动力:直线前向运动精子要≥32% 精子的活动力一般分四级。
0级指无活动的精子;1级指在原地活动的精子;2级为缓慢向前曲线游动的精子;3级为直线向前游动的精子;4级为快速直线向前游动的精子。
一般情况下,3级以上的精子,才有可能使卵子受精。
要成功受孕,一般要求3级精子加上4级精子的比例要大于32%。
精子成活率和畸形率:分别为58%以上和96%以下精子的成活率也很重要。
成活率通常是指在射精后一小时内,具有活动能力的精子比例。
正常的情况下,精子的成活率要在58%以上。
同样,精子的畸形率也影响着精子的受孕能力。
精子畸形率在92%以下是一个比较理想的指标。
“如果能够在96%以下也算是及格了。
”事实上,精子成活率和畸形率的标准也已经降低了。
小鼠精子畸形实验报告

小鼠精子畸形实验报告
实验目的:
本实验旨在观察小鼠种公对辐射的敏感性和精子畸形情况,进
一步探究辐射对生殖系统的影响,为人类辐射防护提供科学依据。
实验方法:
选取雄性C57BL/6J小鼠10只,年龄在8~12周之间,均无生
殖系统疾病等慢性病史。
将小鼠随机分为两组:对照组(5只)和辐射组(5只)。
对照组小鼠暴露于正常环境,无额外操作。
辐射组小鼠在对照组操作基础上,于每日9:00-10:00和16:00-17:00左右,接受单次0.5Gy X射线辐射,共连续6天。
辐照前,检测所
有小鼠前列腺并记录体重。
辐射后第11天晚间,左双侧睾丸进行
离体解剖,取出精液供检测精子形态和结构。
实验结果:
与对照组相比,辐射组的平均体重有所下降,辐射组的平均体
重下降了2.3克;对照组的前列腺质量为12.4±2.3(mg),辐射组为10.0 ± 1.2(mg),辐照组比对照组减轻了19.4%(p<0.05)。
检
测精液样本可知,辐射组的精子畸形率为15.74±0.8%,对照组的
精子畸形率为7.32±2.6%。
辐射组的畸形率高出对照组8.4% (p<0.01)。
实验结论:
小鼠对辐射的敏感性显著,在短时间辐射后,辐射组小鼠体重
减轻和前列腺质量流失均有显著差异。
同时,精子畸形率显著提高,证实辐射对生殖系统造成伤害。
因此,对于长期接触辐射工
作者应加强防护,减少辐照量,防止过大辐照对生殖系统的影响。
实验三精子形态和畸型率检测课件

二、材料和仪器设备
• 猪新鲜精液 • 染色液(红墨水) 三、实验步骤
1、染色剂
美兰、纯兰或红墨水
2、稀释
稀释液0.9%NaCl • 牛:1:10 • 羊: 1:20 • 猪: 1:2
3、抹片
4、固定
在抹片上滴95%的 酒精数滴,固定4
• 尾部折回、尾部卷曲、尾部套索、双尾、 断尾
• 有近端原生质小滴
畸形精子
视野中 的畸形
精子
双头和双尾精子
四、作业
• 绘出你所观察到的各类畸形精子, 计算精子的畸型率?
• 写出实验报告!
分钟,甩去多余的 酒精
5、染色
将载玻片放在用玻璃棒制
的片架上,滴上红墨水5-10滴, 5分钟后,用洗瓶或自来水轻轻 冲去染色剂,甩去水分凉干。
6、检查畸形率
• 将载玻片放在400或600倍的显微镜下进 行观察,分别记录每个视野中精子总数 和畸形精子数,共观察3-5视野。
7、畸形率种类
• 头部膨大、头部小于正常、双头、头部 不完整
一、目的和要求
由于所需时间等原因,无需对每次采精进行 精子畸形率的测定。但应当每月对每一头种公畜 进行一次畸形率的测定,以绘出精子畸形率变化 图。畸形率突然增高,表明存在问题,应当查找 和分析原因。畸形率在25%以内,受精力一般不 受影响。
通过本实验,了解家畜精液中精子形态与精 液品质的关系,掌握精子形态的分类和分析方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
十三、精子畸形试验
Sperm Malformation Test
1 范围
本规范规定了动物精子畸形试验的基本原则、要求和方法。
本规范适用于化妆品原料的遗传毒性检测。
2 引用标准
GB 14924 试验动物与饲料标准
GB 15193·94 食品安全性毒理学评价程序
3 定义
精子畸形(sperm malformation)
指精子形态的异常改变。
4 原理
已知精子畸形是决定精子形成的基因发生突变的结果。
常染色体和Y-性连锁基因突变及某些染色体重排,如性-常染色体易位,也可使精子发生畸形。
小鼠精子畸形试验能评价受试物对精子生成、发育的影响,可检测受试物在体内对生殖细胞的遗传毒性作用。
5 试验的基本原则
通过适当的途径使动物接触受试物,经过一定时间后处死动物,取其附睾,制备涂片,经固定、染色,在显微镜下计数畸形精子。
6 仪器和器械
生物显微镜、解剖剪、镊子、表面皿、离心管、小漏斗、吸管、滴管、载玻片、擦镜纸等。
7试剂
7.1 1%伊红染色液
称取伊红1g溶于100mL蒸馏水中。
7.2 生理盐水、甲醇(A.R)
8 实验动物和饲养环境
常规使用动物是雄性小鼠。
6周~8周龄,体重为30g ~35g。
实验动物及实验动物房应符合国家相应规定。
9 剂量分组
受试物至少设三个剂量组。
分别取1/2、1/5、1/10或1/20LD50剂量。
当受试物的LD50大于5g/kg体重时,可取5g/kg体重为最高剂量。
另外设阴性(溶剂)对照组和阳性物对照组。
常用溶剂为水、生理盐水、植物油(玉米油、花生油)等。
阳性物对照组可采用环磷酰胺40mg/kg/
日。
每组至少有5只存活动物。
10 染毒途径和方式
染毒途径视实验目的而定。
常用途径为经口灌胃方式。
受试物各剂量组、阴性对照组和阳性物对照组的动物,均连续染毒5d,每日一次。
一般于首次染毒后的第35d处死动物。
11 试验方法
11.1 制片
用颈椎脱臼法处死小鼠,剖开腹腔,暴露睾丸,分离两侧附睾,用眼科剪剖开附睾组织,与适量生理盐水混匀,涂片。
11.2 固定
待涂片干燥后,放入甲醇(A.R)液中固定5min。
取出晾干。
11.3 染色
将涂片于1%伊红染液中染色1h,然后用蒸馏水轻轻冲洗,晾干。
11.4 观察与计数
首先,在低倍镜下选择背景清晰、精子分布均匀、重叠较少的区域,然后,在高倍镜下观察结构完整的1000个精子,计数其中畸形的精子。
精子畸形主要表现在头部。
按Wyrobeks 的分类标准,主要类型有:无钩、香蕉形、无定形、胖头、尾折叠、双头及双尾。
无尾精子、头部重叠的或整个与另一个重叠的精子均不计数。
判断双头、双尾精子时,要注意与两条精子的部分重叠相区别。
12 数据处理和结果判断
每只动物应按精子畸形类型分别记录,以便计算各实验组的精子畸形发生率和精子畸形类型的构成比。
利用Wilcoxon秩和检验法和其他适当的统计学方法。
将受试物各剂量组精子畸形发生率分别与阴性对照组进行比较。
精子畸形试验阳性的判断标准是畸形发生率至少为阴性对照组的倍量或经统计学处理有显著性差异,并存在剂量-反应关系者。
一般正常小鼠的精子畸形率为0.8%~3.4%,但每个实验室应有自己稳定的精子自发畸形率。
13 试验报告
试验报告应包括以下内容:
(1)受试物名称、理化性状、配制方法、所用溶剂;
(2)动物种属和品系、体重、数量、来源(注明合格证号和动物级别);
(3)实验动物饲养环境,包括饲料来源、室温、相对湿度、实验动物室合格证号;
(4)剂量分组,染毒途径和方式;
(5)试验方法:简述操作步骤,所用统计学方法;
(6)结果:以列表方式报告受试物对动物精子畸形发生率和精子畸形类型分析的结果(表1和表2);
(7)结论。
表1 ×××精子畸形发生率
组别剂量
(g/kg)
动物数
(只)
受检精子总数
(个)
畸变精子数
(个)
畸变率
(%)
P值
受试物
溶剂对照
阳性物对照(mg/kg)
注:畸变率以均数 标准差表示。
表2 ×××精子畸形类型分析
组别剂量
(g/kg)
动物数
(只)
受检精子
总数(个)
精子畸形分类及比例(%)
无钩香蕉形胖头无定型其他总计
受试物
溶剂对照
阳性物对照(mg/kg)。
