高中化学《电解饱和食盐水》课件 (共15张)
合集下载
高中化学第四章第三节第二课时电解原理的应用课件新人教选修4.ppt
第 二 课 时 电 解 原 理 的 应 用
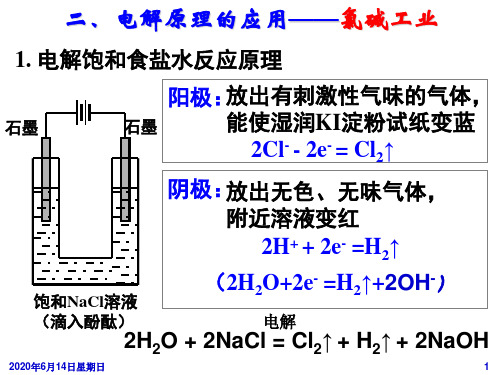
一、氯碱工业
1.饱和食盐水中的离子 在饱和食盐水中,氯化钠完全电离产生了 Na+和 Cl-, 同时水部分电离产生了 H+ 和 OH-.
2.离子的移动方向 通电后 Na+ 和 H+向阴极移动, Cl-和 OH-向阳极
移动.
3.电极上的放电顺序 阳极: Cl- > OH-,阴极: H+>_ Na+.
二、电化学计算的基本方法 原电池和电解池的计算包括两极产物的定量计算、溶 液pH的计算、相对原子质量和阿伏伽德罗常数测定的 计算、根据电量求产物的量与根据产物的量求电量等 的计算.不论哪类计算,均可概括为下列三种方法:
1.根据电子守恒法计算 用于串联电路、阴阳两极产物、正负两极产物、相同 电量等类型的计算,其依据是电路上转移的电子数相 等.
二、电镀
1.概念 应用 电解 原理在某些金属表面镀上一薄层 其他金属 或 合金 的方法.
2.目的 使金属增强 抗腐蚀能力 ,增加 美观和表面硬度 .
3.原理 (1)电极的选择:
阳极: 镀层金属 ;阴极: 待镀金属制品 . (2)电解质溶液的选择:使用含有 镀层金属离子 的电解
质溶液.
(3)电极反应(以镀铜为例): 阳极:Cu-2e-=== Cu2+, 阴极:Cu2++2e-===Cu.
mol、 0.5 mol和0.25 mol.所以共放出有色气体(Cl2) 0.5 +0.5=1 mol,无色气体(O2和H2) 0.5+0.25=0.75 mol.
[答案] C
[关键一点]
根据得失电子守恒及元素的化合价可得出常见电极产物
计算关系式:
物质:2H2~O2~2Cl2~2Cu~4Ag~4H+~4OH-~4e-
还原反应, 反应,溶液中的阳
一、氯碱工业
1.饱和食盐水中的离子 在饱和食盐水中,氯化钠完全电离产生了 Na+和 Cl-, 同时水部分电离产生了 H+ 和 OH-.
2.离子的移动方向 通电后 Na+ 和 H+向阴极移动, Cl-和 OH-向阳极
移动.
3.电极上的放电顺序 阳极: Cl- > OH-,阴极: H+>_ Na+.
二、电化学计算的基本方法 原电池和电解池的计算包括两极产物的定量计算、溶 液pH的计算、相对原子质量和阿伏伽德罗常数测定的 计算、根据电量求产物的量与根据产物的量求电量等 的计算.不论哪类计算,均可概括为下列三种方法:
1.根据电子守恒法计算 用于串联电路、阴阳两极产物、正负两极产物、相同 电量等类型的计算,其依据是电路上转移的电子数相 等.
二、电镀
1.概念 应用 电解 原理在某些金属表面镀上一薄层 其他金属 或 合金 的方法.
2.目的 使金属增强 抗腐蚀能力 ,增加 美观和表面硬度 .
3.原理 (1)电极的选择:
阳极: 镀层金属 ;阴极: 待镀金属制品 . (2)电解质溶液的选择:使用含有 镀层金属离子 的电解
质溶液.
(3)电极反应(以镀铜为例): 阳极:Cu-2e-=== Cu2+, 阴极:Cu2++2e-===Cu.
mol、 0.5 mol和0.25 mol.所以共放出有色气体(Cl2) 0.5 +0.5=1 mol,无色气体(O2和H2) 0.5+0.25=0.75 mol.
[答案] C
[关键一点]
根据得失电子守恒及元素的化合价可得出常见电极产物
计算关系式:
物质:2H2~O2~2Cl2~2Cu~4Ag~4H+~4OH-~4e-
还原反应, 反应,溶液中的阳
2.1.1 粗盐提纯 电解饱和食盐水(课件)高一化学(沪科版2020必修第一册)

三、课堂精练
B 3. 下列关于电解氯化钠水溶液(两根石墨棒作电极)的叙述正确的是( ) A. 若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕黄色 C. 电解时在阳极得到氯气,在阴极得到金属钠 D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
二、知识梳理
例题:粗盐中含有泥沙和硫酸盐、氯化钙、氯化镁等可溶性杂质,请加 入有关试剂进行精制
(1)通过 过滤 ,除去不溶性泥沙; (2)滴加 氯化钡 试剂; (3)滴加 碳酸钠 试剂; (4)滴加 氢氧化钠 试剂;
(5)过滤;
(6)滴加 盐酸 试剂至溶液pH=7;
若先进行第(6)步,再进行第(5)步,将对实验结果产生影响,原因
第二章 海洋中的卤素资源
2.1 海水中的氯
第1课时 粗盐提纯 电解饱和食盐水
授课人:
学习要点
一、 用化学沉淀法进行粗盐提纯 二、 电解饱和食盐水的简单原理 三、
课堂导入
一、课堂导入
地球表面海洋面积占到71%,海洋是人类千万年来取之不尽、用之不竭的巨大资源宝 库。其中的水资源和其他化学资源具有十分巨大的开发潜力。
阳极反应: 2Cl--2e-===Cl2↑
阴极反应: 2H2O+2e-===H2↑+2OH-
总反应化学方程式: 2NaCl+2H2O 电解 2NaOH+Cl2↑+H2↑
2Cl-+2H2O 电解 H2↑+Cl2↑+2OH-
用电解饱和食盐水的方法制备氯气、氢气和烧碱,并以它们为原料生 产一系列含氯、含钠化工产品的工业称为氯碱工业。
实验方案:
离子,均可用 沉淀 法除去 (2)除杂试剂(适当过量)
Ca2+ CaCO3沉淀
电解原理电解食盐水(课件PPT)

工具
第一章 化学反应与能量转化
4.电解方程式 化学方程式: 2NaCl+2H2O=通==电==2NaOH+H2↑+Cl2↑,
离子方程式: 2Cl-+2H2O=通==电==2OH-+H2↑+Cl2↑ 。
工具
第一章 化学反应与能量转化
[开放探究] 2.用石墨棒作电极电解NaCl溶液(含酚酞)时, 阴极附近溶液为什么变红?
工具
第一章 化学反应与能量转化
用Pt电极电解足量AgNO3溶液 (1)写出电极反应式: 阴极________________;阳极______________。 (2) 电 解 离 子 方 程 式 ________________________________ ________________________________________。
种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的 是(双选)( )
A.AgNO3[AgNO3] C.KCl[KCl] 思路点拨:
B.NaOH[H2O] D.CuSO4[CuO]
分析电极产物 ―确―定→ 减少的元素 ―判―断→ 应加入物质
工具
第一章 化学反应与能量转化
A.4AgNO3+2H2O=通==电==4Ag+O2↑+4HNO3,脱离反应体
工具
第一章 化学反应与能量转化
答案: (1)4Ag++4e-―→4Ag 4OH-―→O2↑+ 2H2O+4e-
(2)4Ag++2H2O=通==电==4Ag+O2↑+4H+
工具
第一章 化学反应与能量转化
名师提醒: (1)书写电极反应式时,无论是强电解质电离 出的离子参与电极反应,还是弱电解质电离出的离子参与电极 反应,均以离子符号形式表示,且两极得、失电子数应相等。
最新【人教版】化学选修四:4.3《电解池(第2课时)》ppt课件课件PPT

【答案】 A
学生分组探究一 电解原理的应用 第 1 步探究——问题引入,自主探究 1.电解饱和食盐水时,阴极上的产物是什么? 【提示】 阴极产生 NaOH 和 H2。 2.电解精炼铜时,粗铜中的杂质发生了什么变化? 【提示】 比铜活泼的金属被氧化(如锌、铁等);比铜活泼性 弱的金属形成阳极泥(如 Ag、Au 等)。
4.电冶金 (1)本质:使矿石中的金金属属离离子子获得电子,从它们的化合物中 还原出来。如 Mn++ne-===M。
(2)电冶金:电解是最强有力的氧化还原手段,适用于一些活 泼金属单质的制取,如冶炼 NNaa、、CCa、a、MMg、AAll 等活泼金属。
(3)举例
2.工业上用电解法制备金属镁用 MgCl2 还是 MgO?能用电 解 AlCl3 的方法制备金属铝吗?
2.关于电解氯化钠水溶液(铁作阴极、石墨作阳极),下列叙 述正确的是 ( )
A.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 B.若在阳极附近的溶液中滴入 KI 溶液,溶液呈棕黄色 C.电解时在阳极得到氯气,在阴极得到金属钠 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌 后溶液呈中性
【解析】 电解食盐水时发生的反应: 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ 总反应:2NaCl+2H2O=电==解==2NaOH+H2↑+Cl2↑ 对照分析选项,C 错误;阳极附近的溶液中会溶有少量的 Cl2, 滴加 KI 溶液后发生反应:Cl2+2I-===I2+2Cl-,溶液呈棕黄色, B 正确;阴极附近产生大量的 OH-,滴加酚酞后变红色,A 错误; 电解后生成 NaOH,溶液呈碱性,D 错误。 【答案】 B
4.下列关于铜电极的叙述中,正确的是( ) A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜作阴极 C.在镀件上电镀铜时可用金属铜作阴极 D.电解稀硫酸制 H2、O2 时铜作阳极
学生分组探究一 电解原理的应用 第 1 步探究——问题引入,自主探究 1.电解饱和食盐水时,阴极上的产物是什么? 【提示】 阴极产生 NaOH 和 H2。 2.电解精炼铜时,粗铜中的杂质发生了什么变化? 【提示】 比铜活泼的金属被氧化(如锌、铁等);比铜活泼性 弱的金属形成阳极泥(如 Ag、Au 等)。
4.电冶金 (1)本质:使矿石中的金金属属离离子子获得电子,从它们的化合物中 还原出来。如 Mn++ne-===M。
(2)电冶金:电解是最强有力的氧化还原手段,适用于一些活 泼金属单质的制取,如冶炼 NNaa、、CCa、a、MMg、AAll 等活泼金属。
(3)举例
2.工业上用电解法制备金属镁用 MgCl2 还是 MgO?能用电 解 AlCl3 的方法制备金属铝吗?
2.关于电解氯化钠水溶液(铁作阴极、石墨作阳极),下列叙 述正确的是 ( )
A.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 B.若在阳极附近的溶液中滴入 KI 溶液,溶液呈棕黄色 C.电解时在阳极得到氯气,在阴极得到金属钠 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌 后溶液呈中性
【解析】 电解食盐水时发生的反应: 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ 总反应:2NaCl+2H2O=电==解==2NaOH+H2↑+Cl2↑ 对照分析选项,C 错误;阳极附近的溶液中会溶有少量的 Cl2, 滴加 KI 溶液后发生反应:Cl2+2I-===I2+2Cl-,溶液呈棕黄色, B 正确;阴极附近产生大量的 OH-,滴加酚酞后变红色,A 错误; 电解后生成 NaOH,溶液呈碱性,D 错误。 【答案】 B
4.下列关于铜电极的叙述中,正确的是( ) A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜作阴极 C.在镀件上电镀铜时可用金属铜作阴极 D.电解稀硫酸制 H2、O2 时铜作阳极
第4章第2节第2课时电解原理的应用课件上学期高二化学人教版选择性必修1

A.X是负极,Y是正极 B.Pt是阴极,Cu是阳极 C.CuSO4溶液的pH逐渐减小 D.CuSO4溶液的pH不变
石
石
Cu
Cu
墨
墨
【思考】 如果想在铁制品表面镀上铜,该如何设计实验?
2.电镀: 应用电解原理,在金属表面镀上一薄层金属或合金的方法。
目的:增强金属的抗腐蚀能力、耐磨性或改善金属制品的外观。
例如: 通常条件下,锌、锡、铬、镍等金属比铁稳定,将这些金
属镀在铁制品表面可以达到保护铁制品的目的。 在火箭插销的金属片上镀金,可以确保其具有良好的接触
移向阴极 鸟贵有翼,人贵有志。
治天下者必H先+立、其志N。a+
无所求则无所获。
现象: 对没志气的人,路程显得远;对没有银钱的人,城镇显得远。
鹰爱高飞,鸦栖一枝。
阴极有无色气体产生,阴极端溶液变红,阳极 产生的黄绿色气体能使淀粉—KI溶液变蓝。
湿润的淀 粉—KI试纸 变蓝
1.电解饱和食盐水:(氯碱工业)
5.
6.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正
确的是(
)
A.P是电源的正极 B.F极上发生的反应为:4OH- - 4e-=2H2O+O2↑ C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参 加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
7.下图所示装置中,a、b都是惰性电极,通电一段时间后,b 电极附近溶液呈红色。下列说法正确的是( )
电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 有志者自有千方百计,无志者只感千难万难。 【知识支持】镍的金属活动性排在铁和锡之间。 向电解后的溶液中加入酚酞的现象: 加入冰晶石Na3AlF6的作用? 6 g固体时,阳极产生标准状况下氧气________L。 可避免H2和Cl2混合;
石
石
Cu
Cu
墨
墨
【思考】 如果想在铁制品表面镀上铜,该如何设计实验?
2.电镀: 应用电解原理,在金属表面镀上一薄层金属或合金的方法。
目的:增强金属的抗腐蚀能力、耐磨性或改善金属制品的外观。
例如: 通常条件下,锌、锡、铬、镍等金属比铁稳定,将这些金
属镀在铁制品表面可以达到保护铁制品的目的。 在火箭插销的金属片上镀金,可以确保其具有良好的接触
移向阴极 鸟贵有翼,人贵有志。
治天下者必H先+立、其志N。a+
无所求则无所获。
现象: 对没志气的人,路程显得远;对没有银钱的人,城镇显得远。
鹰爱高飞,鸦栖一枝。
阴极有无色气体产生,阴极端溶液变红,阳极 产生的黄绿色气体能使淀粉—KI溶液变蓝。
湿润的淀 粉—KI试纸 变蓝
1.电解饱和食盐水:(氯碱工业)
5.
6.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正
确的是(
)
A.P是电源的正极 B.F极上发生的反应为:4OH- - 4e-=2H2O+O2↑ C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参 加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
7.下图所示装置中,a、b都是惰性电极,通电一段时间后,b 电极附近溶液呈红色。下列说法正确的是( )
电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 有志者自有千方百计,无志者只感千难万难。 【知识支持】镍的金属活动性排在铁和锡之间。 向电解后的溶液中加入酚酞的现象: 加入冰晶石Na3AlF6的作用? 6 g固体时,阳极产生标准状况下氧气________L。 可避免H2和Cl2混合;
人教化学选修4第四章第3节 电解池(共19张PPT)
Cl2
H2
(2)电解饱和食盐水
2的Cl离-+子2方H2程O式=电=是解==2;OH淡-盐+水H2↑+Cl2N↑a+ (3)电解时用盐酸控
溶液A
制阳极区溶液的pH
氯 H减在 衡 酸C少气的移2l~O氯与作动,3气水用原,增在反_理用_大水应解_化H_中:释学_C_的C盐l平_的l_溶2+浓;解H度,2可O有使精利制平于饱衡和氯逆H气水向C的(移含l+溢少动出,。
2020年6月14日星期日
10
二、电解原理的应用——电解精炼铜
2020年6月14日星期日
11
二、电解原理的应用——电冶金
电解是最强有力的氧化还原手段,用于 冶炼Na、Ca、Mg、Al这样活泼的金属
钠的冶炼 (熔融NaCl作电解质)
阳极:2Cl--2e-=Cl2↑ 阴极:2Na++2e-=2Na 总反应: 2NaCl(熔融)通==电=2Na+Cl2↑
Cu
以粗铜为阳极,以纯铜
Zn Fe
纯铜 Cu
为阴极, 以CuSO4溶液 为电解液进行电解。
Ni Ag
Au
②电解后CuSO4浓度的变化 CuSO4浓度减小
CuSO4溶液
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+
阴极: Cu2+ +2e-=Cu
2020年6月14日星期日
NaCl
量NaOH) 19
阴极:
4Al 3+ + 12 e- =4Al 阳极:
C
Fe
6O 2- -12e - =3O2↑ 总反应: 2Al2O3(熔融)通==电=4Al+3O2↑
电解饱和食盐水PPT培训课件

空气中形成白雾
H20
HCl
1V : 500V
2、构成微粒 HCl分子
练1:工业上利用电解饱和食盐水的方法制 取 Cl2 、 H2 和 NaOH 。在电源正极上 方收集到的气体能使湿润的 变 淀粉碘化钾试纸 蓝色,证明是 Cl2 ;在电源负极上方收 集到的气体是 H2 ,在该电极附近的水 溶液中滴几滴酚酞溶液,则溶液 变红 , 明有 NaOH 生成。若电解一段时间后, 电源正极上方收集到的气体0.2mol,则在 电源负极上方将收集到 0.4g g H2 气体,在溶液中产生 16g g NaOH。停止通 电后,待溶液混合均匀,溶液的pH 会 升高 。
研究物质性质的步骤
物质 物理性质 化学性质 制法
用途
三、氢氧化钠
1.物理性质
白色固体,极易溶于水,溶解时放出大量 的热,易潮解。
氢氧化钠是一种碱性干燥剂
注意;不能干燥酸性气体(HCl、CO2、 SO2、H2S等)
氢氧化钠有强烈的腐蚀性
俗名:苛性钠、火碱、烧碱
在使用氢氧化钠时必须十分小 心,防止皮肤、衣服被它腐蚀
友情提醒 (默写)
• 物质的量的计算 • 电离方程式 • 电解饱和食盐水 • 氢氧化钠参与反应的方程式
3.取一张用饱和NaCl溶液浸湿的pH
试纸,两根铅笔笔芯作电极,接 通直流电源,一段时间后,发现a 电极与试纸接触处出现一个双色 同心圆,内圆为白色,外圈呈浅 红色。则下列说法错误的是 A. b电极是阴极 B. a电极与电源的正极相连接 C. 电解过程中,水是氧化剂 D. b电极附近溶液的pH变小
总反应:
通电
2H2O + 2NaCl → Cl2↑ + H2↑ + 2NaOH
阳极区 阴 极 区
H20
HCl
1V : 500V
2、构成微粒 HCl分子
练1:工业上利用电解饱和食盐水的方法制 取 Cl2 、 H2 和 NaOH 。在电源正极上 方收集到的气体能使湿润的 变 淀粉碘化钾试纸 蓝色,证明是 Cl2 ;在电源负极上方收 集到的气体是 H2 ,在该电极附近的水 溶液中滴几滴酚酞溶液,则溶液 变红 , 明有 NaOH 生成。若电解一段时间后, 电源正极上方收集到的气体0.2mol,则在 电源负极上方将收集到 0.4g g H2 气体,在溶液中产生 16g g NaOH。停止通 电后,待溶液混合均匀,溶液的pH 会 升高 。
研究物质性质的步骤
物质 物理性质 化学性质 制法
用途
三、氢氧化钠
1.物理性质
白色固体,极易溶于水,溶解时放出大量 的热,易潮解。
氢氧化钠是一种碱性干燥剂
注意;不能干燥酸性气体(HCl、CO2、 SO2、H2S等)
氢氧化钠有强烈的腐蚀性
俗名:苛性钠、火碱、烧碱
在使用氢氧化钠时必须十分小 心,防止皮肤、衣服被它腐蚀
友情提醒 (默写)
• 物质的量的计算 • 电离方程式 • 电解饱和食盐水 • 氢氧化钠参与反应的方程式
3.取一张用饱和NaCl溶液浸湿的pH
试纸,两根铅笔笔芯作电极,接 通直流电源,一段时间后,发现a 电极与试纸接触处出现一个双色 同心圆,内圆为白色,外圈呈浅 红色。则下列说法错误的是 A. b电极是阴极 B. a电极与电源的正极相连接 C. 电解过程中,水是氧化剂 D. b电极附近溶液的pH变小
总反应:
通电
2H2O + 2NaCl → Cl2↑ + H2↑ + 2NaOH
阳极区 阴 极 区
电解饱和食盐水PPT课件

第14页/共16页
•4. 实验结束后,将电泳管内胶体液倒掉 ,用蒸馏水多 洗几次,然后倒放在铁架台上。
•5. 实验过程中,随着时间的推移,两电极周围会有许
多小气泡产生,导致电路不畅通,带来误差。此时应该
再关闭两侧的活塞,并停止秒表,关闭电源,取出两个
电极,再加入一些辅助液,放入铂电极,重复以上步骤。
Байду номын сангаас
电解条件: 有自由移动的离子
阴,阳离子的来源:电解质在水溶液中电离出来的 电离: 电解质在溶于水或受热熔化时离解成自由移动的离子的过程
第2页/共16页
电解池
正 阳
Cl- , OH-
负 电流:a——c——d—— b电子流:c——a——b——d
Na+, H+ , OH-, Cl-
阴
NaCI= Na+ + Cl-
第11页/共16页
实验步骤
(一)Fe(OH)3溶胶的制备
•1 . 水 解 法 制 备 Fe(OH)3溶 胶 : 在 250ml 烧 杯 中加入50ml蒸馏水,加热至沸,慢慢地滴入 1mol/LFeCl3溶液,并不断搅拌,至得到红棕 色的Fe(OH)3溶胶。
第12页/共16页
(二)电泳
加入2g尿素,搅拌,加进U 形管,至两臂各留下4cm, 再小心滴入0.01mol/L硝酸 溶液,至两臂剩下1cm,插 入电极。
第13页/共16页
实验注意事项
•1. 胶体制备时,取150ml 水,1mol/LFeCl3慢慢 滴加并不停搅拌,加完后再沸腾5min即可。 •2. 刚制备的胶体冷却时 ,反应要逆向进行 ,故 必 须渗析。在烧杯内加蒸馏水大约300ml,保持温度 在60~70C进行热渗析。 •3. 电泳管加入胶体液后不要有气泡,若有气泡要挤 压乳胶管使之被赶走。电泳管在加胶体液之前要用 蒸馏水洗几次,再用辅助液或胶体液润洗一次,保 证电泳管洁净无其它杂质。加入的胶体液稍高于两 侧的活塞,关闭活塞,将活塞上方多余的胶体液设 法倒掉,再放入辅助液,插入铂电极。
•4. 实验结束后,将电泳管内胶体液倒掉 ,用蒸馏水多 洗几次,然后倒放在铁架台上。
•5. 实验过程中,随着时间的推移,两电极周围会有许
多小气泡产生,导致电路不畅通,带来误差。此时应该
再关闭两侧的活塞,并停止秒表,关闭电源,取出两个
电极,再加入一些辅助液,放入铂电极,重复以上步骤。
Байду номын сангаас
电解条件: 有自由移动的离子
阴,阳离子的来源:电解质在水溶液中电离出来的 电离: 电解质在溶于水或受热熔化时离解成自由移动的离子的过程
第2页/共16页
电解池
正 阳
Cl- , OH-
负 电流:a——c——d—— b电子流:c——a——b——d
Na+, H+ , OH-, Cl-
阴
NaCI= Na+ + Cl-
第11页/共16页
实验步骤
(一)Fe(OH)3溶胶的制备
•1 . 水 解 法 制 备 Fe(OH)3溶 胶 : 在 250ml 烧 杯 中加入50ml蒸馏水,加热至沸,慢慢地滴入 1mol/LFeCl3溶液,并不断搅拌,至得到红棕 色的Fe(OH)3溶胶。
第12页/共16页
(二)电泳
加入2g尿素,搅拌,加进U 形管,至两臂各留下4cm, 再小心滴入0.01mol/L硝酸 溶液,至两臂剩下1cm,插 入电极。
第13页/共16页
实验注意事项
•1. 胶体制备时,取150ml 水,1mol/LFeCl3慢慢 滴加并不停搅拌,加完后再沸腾5min即可。 •2. 刚制备的胶体冷却时 ,反应要逆向进行 ,故 必 须渗析。在烧杯内加蒸馏水大约300ml,保持温度 在60~70C进行热渗析。 •3. 电泳管加入胶体液后不要有气泡,若有气泡要挤 压乳胶管使之被赶走。电泳管在加胶体液之前要用 蒸馏水洗几次,再用辅助液或胶体液润洗一次,保 证电泳管洁净无其它杂质。加入的胶体液稍高于两 侧的活塞,关闭活塞,将活塞上方多余的胶体液设 法倒掉,再放入辅助液,插入铂电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解饱和食盐水
说课流程
教材分析 学情分析 教学目标 教学重难点 教学过程 教学反思与评价
1
人教版 选修4 第四章 电解原理及其应用 电解饱和食盐水
地位和 作用
“电解饱和食盐水”实验不仅能巩固电解原理
知识,而且在工业生产、实际生活中,工业废 水处理中都有广泛应用,并且在高考中也是热 点知识
2
已有 基础
培养学生运用所学知识解决环 保问题,将“青山绿水就是金山 银山”的十九大精神渗入课堂。
4
实验教学重点 :电解产物的 分析与检验, 电极反应式的 书写
实验教学难点 :实验现象的 分析,实验方 案的设计
5
旧知回顾
传统实验, 发现问题水中NaCl和H2O发生电离:
NaCl = Na+ + ClH2O = H+ + OH-
阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- =H2↑
总反应:
2NaCl
+
2H2O
电解
==
2NaOH
+H2↑
+
Cl2
↑
不足之处: 1.不便于收集气体检验 2.没有尾气处理,有氯气溢出,污 染环境
电压:25V
_
2 1
1-C棒电极 2-饱和氯化钠溶液 3-C棒电极 4-湿润的淀粉KI试纸 5-浸有NaOH的棉花
联系旧知识,回归考题
6
优点
装置简单,现象明显,产物便于检 验,环保
若操作不当可能还是有微量气体泄漏
不足
实验设计部分缺少学生的参与
突破
在不足之处下来不断探究,加以改进
Thank you !
已基本掌握电解原理;知道常见物 质的检验方法 能对问题进行简单的分析
局限 认识
对电解原理没有感性认识,仅停留 于书本表面的知识
发展 方向
能熟练操作电解饱和食盐水实验 ,并通过实验验证电解原理
3
学科 素养
巩固电解原理、掌握电解 的基本操作、学会对电解产 物的检验
能将所学知识运用于生活、生产当 中,真正体会到“科学技术就是生 产力”的含义。
酒精灯上检验试管内气体 轻微的爆鸣声
阴极附近生成NaOH 阳极附近生成Cl2
阴极产生的气体是H2
为什么淀粉碘化钾试纸先变蓝后又褪色?
变蓝:Cl2 + 2I- = 2Cl- + I2
褪色:
Cl2和I2反应生成碘酸盐:Cl2 + I2 +6H2O = 12H+ + 10Cl- + 2IO3Cl2和H2O反应生成 HClO:Cl2 +H2O = HCl + HClO
+
5 4 3
1.按图连接好装置,水槽中盛滴有酚酞的饱 和氯化钠溶液
2.接通电源,观察阴极溶液是否变红, 淀粉KI试纸是否变蓝
3.断开电源,检验阴极的气体
4.揭开棉花,向漏斗内滴入氢氧化钠进行 尾气处理 5.反应一段时间之后,再拆除并清 洗仪器。
接通电源,两极立即有气体产生
阴极附近溶液变红 阳极附近溶液呈浅黄绿色 淀粉KI试纸变蓝
说课流程
教材分析 学情分析 教学目标 教学重难点 教学过程 教学反思与评价
1
人教版 选修4 第四章 电解原理及其应用 电解饱和食盐水
地位和 作用
“电解饱和食盐水”实验不仅能巩固电解原理
知识,而且在工业生产、实际生活中,工业废 水处理中都有广泛应用,并且在高考中也是热 点知识
2
已有 基础
培养学生运用所学知识解决环 保问题,将“青山绿水就是金山 银山”的十九大精神渗入课堂。
4
实验教学重点 :电解产物的 分析与检验, 电极反应式的 书写
实验教学难点 :实验现象的 分析,实验方 案的设计
5
旧知回顾
传统实验, 发现问题水中NaCl和H2O发生电离:
NaCl = Na+ + ClH2O = H+ + OH-
阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- =H2↑
总反应:
2NaCl
+
2H2O
电解
==
2NaOH
+H2↑
+
Cl2
↑
不足之处: 1.不便于收集气体检验 2.没有尾气处理,有氯气溢出,污 染环境
电压:25V
_
2 1
1-C棒电极 2-饱和氯化钠溶液 3-C棒电极 4-湿润的淀粉KI试纸 5-浸有NaOH的棉花
联系旧知识,回归考题
6
优点
装置简单,现象明显,产物便于检 验,环保
若操作不当可能还是有微量气体泄漏
不足
实验设计部分缺少学生的参与
突破
在不足之处下来不断探究,加以改进
Thank you !
已基本掌握电解原理;知道常见物 质的检验方法 能对问题进行简单的分析
局限 认识
对电解原理没有感性认识,仅停留 于书本表面的知识
发展 方向
能熟练操作电解饱和食盐水实验 ,并通过实验验证电解原理
3
学科 素养
巩固电解原理、掌握电解 的基本操作、学会对电解产 物的检验
能将所学知识运用于生活、生产当 中,真正体会到“科学技术就是生 产力”的含义。
酒精灯上检验试管内气体 轻微的爆鸣声
阴极附近生成NaOH 阳极附近生成Cl2
阴极产生的气体是H2
为什么淀粉碘化钾试纸先变蓝后又褪色?
变蓝:Cl2 + 2I- = 2Cl- + I2
褪色:
Cl2和I2反应生成碘酸盐:Cl2 + I2 +6H2O = 12H+ + 10Cl- + 2IO3Cl2和H2O反应生成 HClO:Cl2 +H2O = HCl + HClO
+
5 4 3
1.按图连接好装置,水槽中盛滴有酚酞的饱 和氯化钠溶液
2.接通电源,观察阴极溶液是否变红, 淀粉KI试纸是否变蓝
3.断开电源,检验阴极的气体
4.揭开棉花,向漏斗内滴入氢氧化钠进行 尾气处理 5.反应一段时间之后,再拆除并清 洗仪器。
接通电源,两极立即有气体产生
阴极附近溶液变红 阳极附近溶液呈浅黄绿色 淀粉KI试纸变蓝
