水中无机污染物的迁移转化
3.2水中无机污染物的迁移转化 (4)

或者在两个羧基间螯合:
或者与一个羧基形成配合物:
在环境中对污染物的影响 与金属作用:许多研究表明:重金属在天然水体中主要以腐殖酸的 配合物形式存在。Matson等指出Cd、Ph和Cu在美洲的大湖(Great Lake)水中不存在游离离子,而是以腐殖酸配合物形式存在。表3—9 列出不同来源腐殖酸与金属的配合稳定常数,并可看出,Hg和Cu有较 强的配合能力,在淡水中有大于90%的Ca、Hg与腐殖酸配合,这点对 考虑重金属的水体污染具有很重要的意义。特别是Hg,许多阳离子如 Li+ 、Na+ 、Co2+ 、Mn2+ 、Ba2+ 、Zn2+ 、Mg2+ 、La3+ 、Fe3+ 、A13+ 、Ce3+ 、 Th4+,都不能臵换Hg。水体的pH、Eh等都影响腐殖酸和重金属配合作 用的稳定性。
K2 [ Zn ( NH [ ZnNH
2 3 3
Zn(NH3)22+
)2
2
]
3
2 . 1 10 ]
2
][ NH
K1、K2称为逐级生成常数(或逐级稳定常数),表示NH3加至中心Zn2+上是
一个逐步的过程。
积累稳定常数是指几个配位体加到中心金属离子过程的加和。例如,
Zn(NH3)22+的生成可用下面反应式表示:
五、配合作用
1、概述
污染物特别是重金属污染物,大部分以配合物形态存在于水体,其 迁移、转化及毒性等均与配合作用有密切关系。重金属容易形成配合 物的原因是重金属为过渡性元素,最外层为s轨道电子数目为2或1, 次外层为d轨道或f轨道电子,数目为1-9,为充满,则过渡金属元素 失去外层s轨道电子后,未充满的d轨道仍旧可以接受外来电子,形成 配合的络合物或者螯合物。 天然水体中有许多阳离子,其中某些阳离子是良好的配合物中心体, 某些阴离子则可作为配位体。 天然水体中重要的无机配位体有OH-、Cl-、CO32-、HCO3-、F-、S2 - 。它们易与硬酸进行配合。如OH - 在水溶液中将优先与某些作为中 心离子的硬酸结合(如Fe3+、Mn3+等),形成羧基配合离子或氢氧化物 沉淀,而S2-离子则更易和重金属如Hg2+、Ag+等形成多硫配合离子或 硫化物沉淀。
第二节、水中无机污染物的迁移转化

于晶格中离子的同晶替代造成的,例如硅氧四面体中的Si4+被
Al3+所取代,或者铝氢氧八面体中的Al3+被Mg2+所取代等,都会 产生这种永久负电荷。另一部分为可变电荷,主要随着环境pH
的改变而发生改变,原因是 Si-OH中的H+ 在碱性溶液中的离解。
Si-OH+OH-=Si-O-+H2O。
特征:这种吸附是一种可逆反应,能够迅速达到平衡。 不受温度影响,酸碱条件下均可进行,其交换吸附能力 与溶质的性质、浓度及吸附剂性质等有关。对于那些具 有可变电荷表面的胶体,当体系pH高时,也带负电荷并
n
以lgG对lgc作图可得一直线。lgk为截距,因此, k值是c=1时的吸附 1
n 量,它可以大致表示吸附能力的强弱。
浓度增长的强度。
该等温线不能给出饱和吸附量。 L型等温式为:G=G0c/(A+c)
为斜率,它表示吸附量随
式中:G0——单位表面上达到饱和时间的最大吸附量; A——常数。 G对c作图得到一条双曲线,其渐近线为G=G0,即当c→∞时,G→G0。 在等温式中A为吸附量达到时溶液的平衡浓度。 转化为:1/G = 1/G0 + (A/G0)(1/c)
1 以G
1 对 作图,同样得到一直线。 c
等温线在一定程度上反映了吸附剂与吸附物的特性,其形式在许
多情况下与实验所用溶质浓度区段有关。当溶质浓度甚低时,可能在 初始区段中呈现H型,当浓度较高时,曲线可能表现为F型,但统一起 来仍属于L型的不同区段。 影响吸附作用的因素有以下几种: 首先是溶液pH值对吸附作用的影响。在一般情况下,颗粒物对重金 属的吸附量随pH值升高而增大。当溶液pH超过某元素的临界pH值时, 则该元素在溶液中的水解、沉淀起主要作用。吸附量(G)与pH、平衡 浓度(C)之间的关系可用下式表示:G = A· C· 10BpH式中:A、B—常数。
第三章 水环境化学水中无机污染物的迁移转化汇总

20
1. 胶体颗粒凝聚的基本原理和方式
1) 带电胶粒稳定性的经典理论--DLVO理论 带电胶粒的两种相互作用力
双电层重叠时的静电排斥力 粒子间的长程范德华吸引力
DLVO理论认为,当吸引力占优势时,溶胶发生聚 沉; 当排斥力占优势,并大到足以阻碍胶粒由于 布朗运动而发生聚沉时,则胶体处于稳定状态。 颗粒在相互接近时两种力相互作用的总位能随相 隔距离的变化而变化: 总位能 VT=VR+VA 式中:VA——由范德华力所产生的位能; VR——由静电排斥力所产生的位能。
4
一 、 颗粒物与水之间的迁移
2、水环境中颗粒物的吸附作用
专属吸附是指吸附过程中,除了化学键的作
用外,尚有加强的憎水键和范德华力或氢键在 起作用。
专属吸附作用不但可使表面电荷改变符号, 而且可使离子化合物吸附在同号电荷的表面上。
5
表3-8水合氧化物对金属离子的专属吸附 与非专属吸附的区别
项目 非专属吸附 专属吸附 发生吸附的表面净电荷的符号 - -、0、+ 金属离子所起的作用 反离子 配位离子 吸附时发生的反应 阳离子交换 配位体交换 发生吸附时体系的PH值 >零电位点 任意值 吸附发生的位置 扩散层 内层 对表面电荷的影响 无 负电荷减少, 正电荷增多 注:本表摘自陈静生主编,1987。
(4)水体悬浮沉积物
悬浮沉积物是以矿物微粒,特别是粘土矿物 为核心骨架,有机物和金属水合氧化物结合在矿 物微粒表面上,成为各微粒间的粘附架桥物质, 把若干微粒组合成絮状聚集体(聚集体在水体中 的悬浮颗粒粒度一般在数十微米以下),经絮凝 成为较粗颗粒而沉积到水体底部。
(5)其他
3
一、 颗粒物与水之间的迁移
第三章水环境化学水中无机污染物的迁移转化

胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化

对于其他金属碳酸盐则可写为: -lg[Me2+] =0.5p Ksp -0.5pα2 由2 [Me2+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]得: (Ksp/α2)1/2 (2 – α1- 2α2) + [H+] – Kw/[H+] = 0
当pH > pK2 时,α2≈1,CO32-为主,lg[Ca2+] = 0.5 lg KSP
四、氧化还原
氧化-还原平衡对水环境中无机污染物的迁移转化 具有重要意义。水体中氧化还原的类型、速率和平衡, 在很大程度上决定了水中主要溶质的性质。例如,厌 氧型湖泊,其湖下层的元素都将以还原形态存在;碳 还原成-4价形成CH4;氮形成NH4+;硫形成H2S;铁 形成可溶性Fe2+。其表层水由于可以被大气中的氧饱 和,成为相对气体性介质,如果达到热力学平衡时, 则上述元素将以氧化态存在:碳成为CO2;氮成为 NO3-;铁成为Fe(OH)3沉淀;硫成为SO42-。显然这种 变化对水生生物和水质影响很大。
发生吸附的表面净电荷的符号 - 金属离子所起的作用 吸附时所发生的反应 发生吸附时要求体系的pH值 吸附发生的位置 对表面电荷的影响 反离子
阳离子交换 配位体交换 >零电位点 任意值 扩散层 无 内层 负电荷减少 正电荷增加
(2)吸附等温线和等温式:在固定温度下,当吸附达到平 衡时,颗粒物表面的吸附量(G)与溶液中溶质平衡浓度
达到临界状态,就可以发生快速凝聚。
三、溶解和沉淀
溶解与迁移 实际溶解沉淀过程的复杂性 1、氧化物和氢氧化物:氧化物可以视作氢氧化物的脱水产物 Me(OH)n (s) Men+ + n OH根据溶度积: Ksp= [ Men+ ] [ OH- ]n 可转化为: [ Men+ ] = Ksp / [ OH- ]n = Ksp[ H+] / Kwn -lg [ Men+ ] = -lgKsp – n lg [ H+ ] + n lgKw pc = pKsp- n pKw + n pH = pKsp – n pOH 可以做 pc-pH 图,斜率等于 n,即金属离子价; 截距是 pH = 14 - (1/n)pKsp。
3.2水中无机污染物的迁移转化(3)

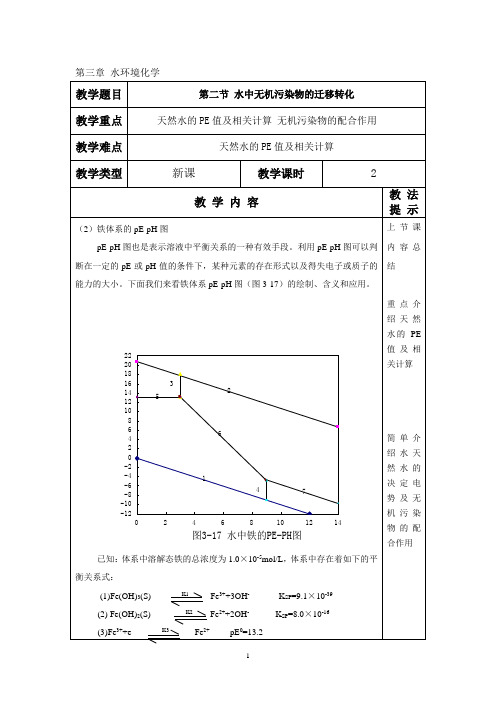
第三章:水环境化学——污染物存在形态第二节、水中无机污染物的迁移转化一、颗粒物与水之间的迁移、二、水中胶体颗粒物聚集的基本原理和方式 三、溶解和沉淀 四、氧化—还原1、概述2、天然环境中的氧化剂和还原剂3、氧化还反应概念回顾4、电子活度和氧化还原电位5、天然水体的pE-pH 关系图● 在氧化还原体系中,往往有H +或OH -离子参与转移,因此,pE 除了与氧化态和还原态浓度有关外,还受到体系pH 的影响,这种关系可以用pE-pH 图来表示。
该图显示了水中各形态的稳定范围及边界线。
● 由于水中可能存在物类状态繁多,于是会使这种图变得非常复杂。
例如一个金属,可以有不同的金属氧化态、羟基配合物、金属氢氧化物、金属碳酸盐、金属硫酸盐、金属硫化物等。
(1)水的氧化-还原限度绘制pE —pH 图时,必须考虑几个边界情况。
首先是水的氧化还原反应限定图中的区域边界。
选作水氧化限度的边界条件是1.0130×105Pa 的氧分压,水还原限度的边界条件是1.0130×105Pa 的氢分压(此时P H2=1,P O2=1),这些条件可获得把水的稳定边界与pH 联系起来方程。
天然水中本身可能发生的氧化还原反应分别是: 水的还原限度(还原反应):221H e H ↔++ pE 0=0.00 pE = pE 0 – lg((P H2)1/2/[H +])pE = –pH水的氧化限度(氧化反应):O H e H O 222141↔+++ pE 0 = +20.75]}[lg{4120++=H po pE pEpE=20.75—pH(2)pE—PH图假定溶液中溶解性铁的最大浓度为1.0×10-7mol/L,没有考虑Fe(OH)2+及FeCO3等形态的生成,根据上面的讨论,Fe的pE—pH图必须落在水的氧化还原限度内。
下面将根据各组分间的平衡方程把pE—pH的边界逐一推导。
①Fe(OH)3(s)和Fe(OH)2(s)的边界。
3.2水中无机污染物的迁移转化 (2)

数浓度图可看出,同价金属离子的各线均有相同的斜率,靠图右边斜
线代表的金属氢氧化物的溶解度大于靠左边的溶解度。根据此图大致 可查出各种金属离子在不同pH溶液中所能存在的最大饱和浓度。
可见众多金属随着溶液pH的降低,pC增加,即溶解度增加,这说明酸
性条件下,有利于金属氢氧化合物的溶解,而碱性条件有利于其形成 沉淀。
不过图3—11和式(3—43)所表征的关系,并不能充分反映出氧化 物或氢氧化物的溶解度,应该考虑这些固体还能与羟基金属离子配 合物[Me(OH)nz-n]处于平衡。如果考虑到羟基配合作用情况,可以 把金属氧化物或氢氧化物的溶解度(MeT)表征如下:
MeT [ Me ] [ Me (OH ) n
PbO(s) + 2H2O→Pb(OH)3- + H+
1g*Ks3 = –15.4
根据上式,Pb2+ 、PbOH+ 、Pb(OH)20 和Pb(OH)3 - 作为pH值函数的特 征线分别有斜率–2、–1、0和+1,把所有化合态都结合起来,可以得 到图3—12中包围着阴影区域的线。因此,[Pb(Ⅱ)T]在数值上可由下 式得出: [Pb(Ⅱ)T] = *Ks0[H+]2 + *Ks1[H+] + Ks2 + *Ks3[H+]-1 图3—12表明固体的氧化物和氢氧化物具有两性的特征。它们和 质子或羟基离子都发生反应,存在有一个pH值,在此pH值下溶解度为 最小值,在碱性或酸性更强的pH值区域内,溶解度都变得更大。
下面着重介绍金属氧化物、氢氧化物、硫化物、碳酸盐及多种成分 共存时的溶解—沉淀平衡问题。
1、氧化物和氢氧化物 : Al(OH)3 、 Fe(OH)3 、 Fe(OH)2 、 Hg(OH)2 、
第三章 第二节 水中无机污染物的迁移转化要点

常见的吸附等温线
G G
n是一个经验 值,不是由一个 过程控制,一般 适用于有机物 lgG
lgK
H型
G0/2
单分子吸附 适用于金属
L型 c
L型 1/c
0 A
当溶质浓度甚低时,可能在初始阶段呈现 H 型,当浓度较 高时,可能表现为 F 型,但统一起来仍属于 L 型的不同区段。
2、异体凝聚理论
(1)适用条件:适用于物质本性不同、粒径不等、电荷符
号不同、电位高低不等的分散体系。 (2)主要论点: A、电荷符号相异的胶体微粒接近时,吸引力总是占优势; B、电荷符号相同但电性强弱不等,则位能曲线上的能峰高 度总是决定于荷电较弱而电位较低的一方。
因此异体凝聚时,只要有一种胶体的稳定性甚低而电位
纯饱和溶液中 [S2-]= Ksp/ [H+]2 = 1.16×10-23 / 8.9×10-9 = 1.3×10-15mol/L 任意水体中 [S2-]= 1.16×10-23 / [H+]2 [Me2+] [S2-]=Ksp 因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子
的饱和浓度为:
2、硫化物
H2S H++ HSK1 = 8.9×10-8 HSH++ S2K2 = 1.3×10-15 两者相加可得: H2S 2H+ + S2K12 = K1·K2 = 1.16×10-22
在饱和水溶液中,H2S 浓度总是保持在 0.1mol/L,因此可认
为饱和溶液中 H2S 分子浓度也保持在 0.1mol/L,得: [H+]2[S2-] =1.16×10-22×0.1 = 1.16×10-23 = Ksp´
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
污染物在水体中的迁移转化方式

污染物在水体中的迁移转化方式主要有以下三种途径:
(1)氧化-还原作用。
天然水体中有许多无机和有机氧化剂和还原剂,如溶解氧、Fe3+、Mn4+、Fe2+、S2-及有机化合物等,这些物质对污染物的转化起重要作用。
如环境中重金属在一定氧化-还原条件下,容易发生价态变化,结果是其化学性质改变,迁移能力也会发生改变。
水体中的氧化-还原类型、速率和平衡,在很大程度上决定了水中重要溶质和污染物的性质。
如在一个厌氧湖泊中,湖下层的元素以还原态存在:碳还原成CH4,氮还原成[*]等,而表层水由于可被大气中氧补充,成为氧化性介质,达到热力学平衡时,碳成为CO2,氮成为[*]。
显然这种变化对水生生物和水质影响很大。
(2)络合作用。
天然水体中有许多无机配位体,如OH-、Cl-[*]、[*]和有机配位体如氨基酸、腐殖酸,以及洗涤剂、农药、大分子环状化合物等,它们可以与水中的污染物,特别是重金属发生络合反应,改变其性质和存在状态,影响污染物在水体中发生、迁移、反应和生物效应。
(3)生物降解作用。
水体中的微生物,特别是底泥中的厌氧微生物,可以使一些污染物发生转化,如把无机汞转变为有机汞。
第3节 无机污染物的迁移转化

其中:腐殖酸是能溶于碱而沉于酸的组分;富里酸是兼能 溶于碱和酸的组分;胡敏素是酸碱皆不溶的组分。
水环境中发现的腐殖质大部分为富里酸这一类,原因在于 易溶于水,来源有二:一部分是水生植物的分泌物和降解产物; 另一部分来自土壤,由土壤淋溶液和泾流带入水体。河水中腐 殖质平均含量在10~15mg/L,但起源于沼泽地带的河流其含量 要丰富的多。
1 1 1 1 G b ab c
3
沉积物中重金属的释放
此为二次污染问题,诱发释放的主要因素有: (1) 盐浓度升高:碱金属及碱土金属离子浓度较高时可将 颗粒表面吸附的重金属离子交换而释放出来。
(2) 氧化还原条件的变化:在较低电位下铁锰氧化物溶解 度大增,使被吸附或共沉淀的重金属离子释放出来。
2 3 3 3 1 1 2 3 2 1 2 2 2 3 3 3 1 1 2
2
2= CO
3
CO KK H CO HCO CO H K H K K
CT = [ CO32- ] + [ HCO3- ] + [ H2CO3 ]
Ca
将各氢氧化物的Ksp 代入并以lg [Men+] 对 pH 作图即可得到p.132.图3-11各金属氢氧化物的溶解 度。 用的更多的是将其溶解度表达式写为:
pc = pKsp - n pKw + n pH
例:已知氧化铅与羟基配合物的反应和平衡常数如下 (25℃): PbO(s) + 2 H+ = Pb2+ + H2O lg Ks0 = 12.7 PbO(s) + H+ = PbOH+ lg Ks1 = 5.0 PbO(s) + H2O = Pb(OH)20 lg Ks2 = -4.4 PbO(s) + 2 H2O = Pb(OH)3- + H+ lg Ks3 = -15.4 画出可溶性各型体的溶解度曲线并求出其溶解度。 解:Ks0 = [Pb2+] / [H+]2 [Pb2+] = Ks0 [H+]2 lg [Pb2+] = lg Ks0 -2 pH [PbOH+] = Ks1 [H+] lg [PbOH+] = lg Ks1 - pH [Pb(OH)20] = Ks2 lg [Pb(OH)20] = lg Ks2 [Pb(OH)3-] = Ks3 / [H+] lg[Pb(OH)3-] = lg Ks3 + pH 在画线时同时要画出[H+]和[OH-]这两条线: lg [H+] = - pH 而 lg [OH-] = pH- 14 以 lg c ~ pH 作图即为 P. 133. 图 3-12 PbO溶解度图。
第二节 水无机污染物的迁移转化

第二节水中无机污染物的迁移转化水中无机污染物特别是重金属污染物进入水体,不能被生物降解,主要是通过沉淀-溶解、氧化-还原、配合作用、胶体形成、吸附-解吸等作用进行迁移转化。
一、颗粒物与水之间的迁移1、矿物颗粒物和黏土颗粒物常见矿物颗粒物为石英、长石、云母及黏土矿物等硅酸盐矿物,主要由物理作用形成。
2、金属水合氧化物:铝、铁、锰、硅等金属以无机高分子及溶胶等形态存在。
例:铝在岩土中是丰量元素,在水中浓度低,<0.1mg/L。
水解,主要形态是:Al3+Al(OH)2+Al2(OH)24+Al(OH)22+Al(OH)3+等铁水合氧化物:Fe3+Fe(OH)2+Fe(OH)2+ Fe2(OH)24+Fe(OH)3等硅酸聚合物:Si n O2n-m(OH)2m3、腐殖质是一种代负电的高分子弱电解质。
4、水体悬浮沉积物是以矿物微粒为核心骨架,有机物和金属水合氧化物结合在矿物微粒表面上,经絮凝成为较粗颗粒而沉积在底部。
5、其它藻类、细菌、病毒、表面活性剂、油滴等。
二、水环境中颗粒物的吸附作用1、表面吸附:胶体具有巨大的表面积和表面能;属物理吸附,胶体表面积越大,吸附越强。
2、离子吸附:由于胶体表面的电荷引力。
3、专属吸附:除了化学键以外,尚有加强的憎水键及范德华力或氢键起作用。
水锰矿对Co、Cu、Ni、K和Na离子的吸附及其随pH的变化图:对于碱金属离子,在低浓度时,体系pH在水锰矿ZPC以上时发生吸附。
表明其为离子吸附。
而Co 、Cu 、Ni 等在体系pH 在ZPC 处或小于时都能进行吸附,这表明不带电荷或带正电均能吸附过渡金属。
4、吸附理论――有效层流脱理论5、吸附方向和推动力6、吸附等温线和等温式(1) 等温吸附经验式――弗罗因德利希式Freundlich 型等温式为: G =kC 1/n两边取对数: log G =log k +1/nlog C,nkP P k n Γ=Γ--吸附量-吸附压力常数(2) 单分子层吸附理论――兰格缪尔吸附等温式单分子层吸附吸附剂表面是均匀被吸附的分子与其它同气体分子无作用力吸附是一个动态平衡φ被吸附质分子覆盖的吸附表面积覆盖率()=吸附剂的总表面积 Langmuir 型吸附等温线:G =G 0C /(A +C ) 1/G =1/G 0+(A /G 0)(1/C )G0------单位表面上达到饱和时间的最大吸附量; A-------常数(3)Henry 型吸附等温线为直线,等温式为: G =kCk------分配系数影响吸附作用的因素:(a) pH 值的影响:一般情况下,吸附量随pH 升高而增大。
水中无机污染物的迁移转化

[SiO2] + Al(Ⅲ) → [AlO2- ] + Si(Ⅳ)
第二节 水中无机污染物的迁移转化
3、水环境中颗粒物的吸附作用 吸附:指溶液中的溶质在界面层浓度升高的 现象。 表面吸附:由于颗粒物具有巨大的比表面和 表面能,产生表面吸附;物理吸附。
第二节 水中无机污染物的迁移转化
离子交换吸附:胶体颗粒大部分带负电荷,容 易吸附各种阳离子;物理化学吸附。
第三章
第二节
水环境化学
水中无机污染物的迁移转化
第二节 水中无机污染物的迁移转化
一、在颗粒物与水之间的迁移 1、水中颗粒物的类别
(1) 矿物颗粒和粘土矿物: 主要为硅酸盐 (2) 金属的水合氧化物:
第二节 水中无机污染物的迁移转化 (3)腐殖质 腐殖质是一种带负电的高分子弱电解质。腐殖质
是生物体物质在土壤、水和沉积物中转化而成。分子
G0
G0/2 L型
1/G=1/G0+(A/G0)(1/C)
G0------单位表面上达到饱
1/G
A
C
和时间的最大吸附量;
L型
A-------常数
1/C
第二节 水中无机污染物的迁移转化 影响吸附作用的因素: (a) pH值的影响 表3-9 重金属的临界pH值和最大吸附量 元 素 Zn 7.6 6.7 Co 9.0 3.3 Cu 7.9 3.9 Cd 8.4 8.2 Ni 9.0 2.2
根据溶度积:Ksp= [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn
-lg[Men+] = -lgKsp - nlg[H+] + nlgKw
第二节水中无机污染物的迁移转化

2. pH对水解速率的影响 水解速率: RH = Kh [C]= {KA[H+] + KN + KB[OH-]} [C]
式中: KA、KN 、KB ——分别为酸性、碱性和中性催化过 程的二级反应水解速率常数
Kh = KA[H+] + KN + KBKw/[H+]
c溶解相中有机毒物的浓度kv挥发速率常数kv单位时间混合水体的挥发速率常数z水体的混合深度p在所研究的水体上面有机毒物在大气中的分压kh亨利定律常数?第三节水中有机污染物的迁移转化二挥发作用kvcpkhzkvcpkhtc??kvctc??有机物可溶解相分数w
第三章
第三节
水环境化学
有机污染物的迁移转化
第三节 水中有机污染物的迁移转化 水解速率常数:Kh = KA[H+] + KN + KBKw/[H+]
第三节 水中有机污染物的迁移转化 对于IAN点应满足于: lgKh = lg KA – pH = lg KN 三条切线得到三个交点, IAN IAB 和K INB / K ) pH= lg KN –lg KA = -、 lg ( N A 对于IAB点应满足于: lgKh = lg KA – pH = lgKBKw + pH pH = -1/2 lg(KBKw/KA) 对于INB点应满足于: lgKh = lgKBKw + pH = lg KN pH = - lg(KBKw/ KN)
水体中,若悬浮物中85%为细颗粒,有机碳含量为
5%,其余粗颗粒有机碳含量为1%,已知该有机物 在水中溶解度为0.05mg/L,那么,其分配系数(Kp)
就可根据公式计算出:
解: lgKow = 5.00-0.670lg(0.05×103/192)=5.39 则 Kow =2.46×105 Koc=0.63 Kow=1.55×105 Kp = 1.55×105[0.2(1-0.85)(0.01) + 0.85×0.05] = 6.63×103
优选环境化学第三章水中无机污染物的迁移转化

2020/9/4
21
水处理中新型絮凝剂
无机高分子絮凝剂 以三氯化铁、硫酸铝和碱式氯化铝等 为基体制备 如:聚合硫酸铁(poly ferric sulfate, PFS)、含硼聚硅硫酸铁、聚合硅铝酸铁 等Al2(SO4)3- CPAM(阳离子聚丙烯胺)
2020/9/4
22
水处理中新型絮凝剂
有机高分子絮凝剂
2020/9/4
18
天然水环境和水处理条件下主要的颗 粒物聚集方式
1.压缩双电层的聚集
水中电解质浓度增大而离子强度增大, 压缩扩散层,颗粒物吸引而聚集
2. 专属吸附凝聚
胶体颗粒专属吸附异电的离子化合态, 降低表面电位,产生电中和现象,使颗粒 物聚集
2020/9/4
19
天然水环境和水处理条件下主要的颗 粒物聚集方式
2020/9/4
7
一、颗粒物与水之间的迁移
悬浮沉积物
各种环境胶体物质的聚集物,组成不固定
其他
湖泊中的藻类、污水中的细菌、病毒、废 水中的表面活性剂或油滴。
2020/9/4
8
2.水环境中颗粒物的吸附作用
表面吸附—物理吸附,与胶体的比表面 积有关。
离子交换吸附—物理化学吸附,水环境中 一部分胶体带负电荷,吸附一部份阳离子, 同时释放等量其它阴离子。
属可逆反应,不受温度影响,交换吸附能力 与溶质的性质、浓度、吸附剂性质有关
2020/9/4
9
2.水环境中颗粒物的吸附作用
专属吸附—受化学键作用外,还受加强 的憎水键、 范德华力、氢键等的作用。 在水环境中:配合离子、无机高分子、有 机离子、 有机高分子专属吸附强烈,水 合氧化物胶体对金属离子有较强的专属吸 附。 氧化物表面配位吸附模式(p124)
水中无机污染物的迁移转化

一.颗粒物与水之间的迁移 二.水中颗粒物的聚集 三.溶解与沉淀 四.氧化与还原 五.配合作用
一、颗粒物与水之间的迁移
1. 水中颗粒物的类别:
a) 矿物微粒和黏土矿物:石英沙、长石等,云母、蒙脱石、 高岭土等有胶体特性的黏土矿物
b) 金属水合氧化物:铝、铁、锰、硅等元素,以无机高分 子及溶胶形式存在(聚合铝絮凝剂中铝的聚合形态?)
lg[Me2+] = 0.5lgKsp- 0.5lgK2-0.5pH lg[Me2+] = 0.5lgKsp- 0.5lgK1K2-0.5pH
三、溶解和沉淀
b) Me2+- H2O - CO2(g)开放体系 [Me2+] cT
cT
[CO2 ]
0
1Hale Waihona Puke 0KHpCO2
因为大气中CO2分压恒定,则据Henry定律,[CO2]恒定
液的离子强度增大而减小 2. VA随颗粒间距离增大而减弱,与离子强度
无关 3. VT必然在某个距离有最大值,只有粒子的
热运动能超过VT, 才能发生聚集 4. 提高溶液的离子强度有利于聚集
适合处理电解质凝聚体系
二、水中颗粒物的聚集
异体凝聚理论
适用于处理物质本性不同、粒径不等、电荷符号不同、电位 高低不等之类的分散体系
电性相异的胶粒相接近,吸引力占优势
电性相同的胶粒相接近,位能最大值取决于荷电较弱而电 位较低的一方。
只要有一种的稳定性甚低而电位达到临界状态,就必然 发生快速凝集
二、水中颗粒物的聚集
天然水环境和水处理过程的聚集方式
压缩双电层凝聚 专属吸附凝集 胶体相互凝集 边对面凝集 第二极小值凝集 聚合物粘结架桥凝集 无机高分子的絮凝 絮团卷扫絮凝 颗粒层吸附絮凝 生物絮凝
3-2水中无机污染物的迁移转化

第二节 水中无机污染物的迁移转化一、 颗粒物与水之间的迁移1.水中颗粒物的类别(1)矿物微粒和粘土矿物 硅酸盐矿物(2)金属水合氧化物 Al 、Fe 、Mn 、Si 等(3)腐殖质 带负电荷的高分子弱电解质,多含有–COOH 、–OH 等(4)水体悬浮沉积物 胶体物质的聚集物,结构组成不固定(5)其他 藻类、细菌、病毒、表面活性剂或油滴。
2.水环境中颗粒物的吸附作用表面吸附—物理吸附,与胶体的比表面积有关。
离子交换吸附—物理化学吸附,胶体每吸附一部分阳离子,同时也放出等量其它阳离子。
可逆,不受温度影响,在酸碱条件下均可进行,交换吸附能力与溶质的性质、浓度及吸附剂性质等有关。
专属吸附—吸附过程中,除了受化学键作用外,尚有加强的憎水键、 范德华力或氢键等在起作用。
可使表面电荷改变符号或使离子化合物吸附在同号电荷的表面上;吸附作用发生在胶体双电层的Stern 层中,作用力较大。
配合离子、有机离子、 有机和无机高分子的专属吸附强烈;水合氧化物胶体对金属离子有较强的专属吸附。
(1)吸附等温线和等温式吸附是指溶液中的溶质在界面层浓度升高的现象。
在固定的温度下,当吸附达到平衡时,颗粒物表面上的吸附量(G )与溶液中溶质平衡浓度 (C) 之间的关系用吸附等温式表达。
H 型( Henry )等温式(直线型)式中:K ——分配系数F 型(Freundlich )等温式:用对数表示:Langmuir 型吸附等温线G =G 0C /(A +C )1/G =1/G 0+(A /G 0)(1/C ) G 0------单位表面上达到饱和时间的最大吸附量; A-------常数kC G =n kCG 1=C nk G lg 1lg lg +=(2)氧化物表面吸附的配合模式金属氧化物表面都含有≡MeOH 集团;把具体表面看作一种聚合酸,其大量羟基可发生表面配合反应。
在配合平衡过程中需将邻近集团的电荷影响考虑在内。
3.沉积物中重金属的释放1)盐浓度升高:碱金属和碱土金属离子可将吸附在颗粒物表面的重金属离子置换出来,重金属解吸的重要途径之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
将[Fe(OH)+] = 1.0×10-7 mol/L代入,
pH = 11.6
(2)
2020/4/3
47
pE – pH 图
Fe(OH)3(S) Fe2+的边界 Fe(OH)3(S) + 3H+ + e = Fe2+ + 3H2O
K Fe2 H 3 e
lgK =17.9
pE = 17.9 - 3pH - log[Fe2+] 将[Fe2+]=1.0×10-7 mol/L代入
pE 0 0.00
pE pE 0 log H
pE pH
2020/4/3
45
pE – pH 图
以Fe为例,Fe的pE-pH图落在水的氧化-还 原限度内,假定溶解性铁最大浓度为1.0×107mol/L。
Fe(OH)3(S)和Fe(OH)2(S)的边界
Fe(OH)3 (S) + H+ + e = Fe(OH)2 (S)
2020/4/3
38
1. 电子活度和氧化还原电位
氧化还原电位E与pE的关系 Ox + n e = Red
根据Nernst方程,
E
E0
2.303 RT nF
log
Re d Ox
2020/4/3
39
1. 电子活度和氧化还原电位
反应平衡时,E0 2.303RT lg K nF
平衡常数K可表示为:
K
Re d Ox en[M Nhomakorabean
]
K SP [OH
]n
2020/4/3
23
三、沉淀和溶解
lg[M n ] lg KSP nlg[OH ] lg KSP nlg KW nlg[H ]
pC pKSP npKW npH
金属氧化物和氢氧化物的溶解度与溶液 的pH值呈线性关系。(p132,133)
2020/4/3
2020/4/3
3
一、颗粒物与水之间的迁移
黏土矿物(云母、蒙脱石、高岭石)
主要是铝镁的硅酸盐,由其他矿物经
化学风化而成,具有晶体层状结构、 有粘性、具有胶体性质, 可以生成稳 定的聚集体。
2020/4/3
4
一、颗粒物与水之间的迁移
金属水合氧化物
Al、Fe、Mn、Si等的水合氧化物,在天 然水体中以无机高分子及溶胶等形式存在, 在水环境中发挥重要的胶体化学作用。
2020/4/3
37
1. 电子活度和氧化还原电位
热力学定义: 根据 H2 的半电池反应 2H+(aq)+ 2e = H2 (g)
当反应的全部组分活度为1单位,该 反应的自由能变化ΔG可定义为零。
即当H+(aq)为1个单位活度与H2为 1.0130×105 Pa (活度1)平衡的介质中, 电子活度α为1,则pE = 0.0。
2
(1
[H ] K1 K 2
[H ])1 K2
2020/4/3
30
2.碳酸盐(以CaCO3为例)
当pH < pK1时,α2 ≈ K1K2 / [H+]2 则 lg[Ca2+] = 0.5lgKSP – 0.5lgK1k2 – lgpH (图3-14)
2020/4/3
31
2020/4/3
32
则
e
Re d K Ox
1 n
2020/4/3
40
1. 电子活度和氧化还原电位
pE
loge
1 n
log
K
lg
Re d
Ox
EF 2.303RT
1 0.059
E
( (E0 E)nF ,
2.303RT
nE 0 F 2.303RT
)
pE 0 E 0 F 1 E 0 2.303 RT 0.059
2020/4/3
6
一、颗粒物与水之间的迁移
悬浮沉积物
各种环境胶体物质的聚集物,组成不固定
其他
湖泊中的藻类、污水中的细菌、病毒、废 水中的表面活性剂或油滴。
2020/4/3
7
2.水环境中颗粒物的吸附作用
表面吸附—物理吸附,与胶体的比表面 积有关。
离子交换吸附—物理化学吸附,水环境中 一部分胶体带负电荷,吸附一部份阳离子, 同时释放等量其它阴离子。 属可逆反应,不受温度影响,交换吸附能 力与溶质的性质、浓度、吸附剂性质有关
[Ca2+] = [HCO3-] + [H2CO3*] + [CO32-] = CT
根据电中性原则:
[H+] +2 [Ca2+] = [HCO3-] + 2[CO32-] + [OH-]
2020/4/3
29
2.碳酸盐(以CaCO3为例)
当pH > pK2 > 10.33时,α2≈1
lg[Ca2+] = 0.5 lg KSP 当pK1< pH < pK2时 α2 ≈ K2 / [H+] 则,lg[Ca2+] = 0.5lgKSP–0.5lgk2–0.5lgpH
一、颗粒物与水之间的迁移 水中颗粒物
矿物微粒和粘土矿物 金属水合氧化物 腐殖质 水体悬浮沉积物 其他
2020/4/3
2
第二节 水中无机污染物的迁移转化
一、颗粒物与水之间的迁移
1.水中的颗粒物
矿物微粒和黏土矿物
矿物微粒 主要指硅酸盐矿物,其中:石英
(SiO2)、长石(KAlSi3O8)等矿物微粒颗粒粗、不 易碎裂, 缺乏粘结性。
胶体颗粒专属吸附异电的离子化合 态,降低表面电位,产生电中和现象, 使颗粒物聚集
2020/4/3
18
天然水环境和水处理条件下主要的颗 粒物聚集方式
3. 胶体相互凝聚
电荷相反的两种胶体相互吸引凝聚
4. “边对面”凝聚(“边对边”、“面对 面”)
黏土矿物颗粒呈板状,板面荷负电, 边缘荷正电, 各颗粒的边面之间可由静 电引力结合。
2020/4/3
8
2.水环境中颗粒物的吸附作用
专属吸附—受化学键作用外,还受加强 的憎水键、 范德华力、氢键等的作用。 在水环境中:配合离子、无机高分子、有 机离子、 有机高分子专属吸附强烈,水 合氧化物胶体对金属离子有较强的专属吸 附。 氧化物表面配位吸附模式(p124)
2020/4/3
9
氧化物表面配合吸附模式
开放体系
CaCO3暴露在含有CO2的气相中,大气
中pCO2固定,溶液中CO2浓度也相应固定。
CT
1
0
K H pCO 2
[CO32 ]
2 0
KH
pCO 2
2020/4/3
33
开放体系
由于:
[CO3
2
]
2 0
K H pCO 2
根据溶度积关系则:
[Ca 2 ] 0 K SP (图3-15) 2 K H pCO 2
2020/4/3
14
4 沉积物中重金属的释放(p125)
水环境pH值的降低,导致硫酸盐和氢 氧化物的溶解
废水中配合剂的含量增加,和重金属 形成稳定的可溶性配合物,使重金属 重新进入水体,以上几种途径都有可 能构成环境水体重金属的二次污染
2020/4/3
15
二、水中颗粒物的聚集
胶体颗粒聚集的基本原理是:两颗 粒在相互接近时产生几种作用力,如多 分子范德华力、双电层静电斥力和水化 膜阻力等,这几种作用力的综合效应使 颗粒物聚集。
2020/4/3
21
水处理中新型絮凝剂
有机高分子絮凝剂
聚多胺,聚丙烯酰胺,阳离子型 (淀粉-二甲基二烯丙基氯化铵接枝 共聚物), 两性絮凝剂等。
复合型絮凝剂
2020/4/3
22
三、沉淀和溶解
1. 金属氧化物和氢氧化物
M (OH )n (S ) M n nOH
KSP [M n ][OH ]n
2020/4/3
10
3、吸附等温线和等温式
吸附是指溶质在界面层浓度升高的现 象,水体中颗粒物对溶质的吸附是一个 动态平衡过程。
在一定的温度下,当吸附达到平衡时, 颗粒物表面上的吸附量(G)与溶液中溶 质平衡浓度 (C) 之间的关系用吸附等温 式表达。
2020/4/3
11
3、吸附等温线和等温式
H型( Henry)等温式(直线型)
G kC 式中:K——分配系数
F型(Freundlich)等温式
1
G kC n
用对数表示: lg G lg k 1 lg C n
2020/4/3
12
3、吸附等温线和等温式
L型(Langmuir)等温式
G G0C /(A C)
1/ G 1/ G0 ( A / G0 )(1/ C)
G0—单位表面上达到饱和时的最大吸量
1
K H e
lgK =4.62 pE = 4.62 – pH (1)
2020/4/3
46
pE – pH 图
Fe(OH)2(S) 和 FeOH+ 的边界 Fe(OH)2(S) + H+ = FeOH+ + H2O K= [Fe(OH)+]/ [H+] lgK =4.6
pH = 4.6 - log[Fe(OH)+]
A—常数
(p122 图3-4)
2020/4/3
13
4 沉积物中重金属的释放(p125)
沉积物中的重金属可能重新进入水体,这 是产生二次污染的主要原因。
碱金属和碱土金属离子可将吸附在颗粒 物表面的重金属离子置换出来,这是重金属 从颗粒物表面解吸的重要途径之一。
