电化学-1电化学基本概念导电机理迁移数电导率讲解
【电化学】第一章 电解质及其物理化学性质 (1)

2、稀溶液的经验式: lg k I k为常数 3、德拜-休克尔方程:
(1)m 0.001mol / kg的溶液,lg A ZZ I
(2)0.001
m
0.01mol / kg,lg
A ZZ 1 Ba
I
I
(3)0.01 m 1mol / kg, lg
A ZZ 1 Ba I
I
bI
三、固体电解质
1、按其中的传导离子来分类: (1)银离子导体(Ag+) 如AgX; (2)铜离子导体(Cu+)如CuX; (3)碱金属离子导体(Na+,Li+)如B- 氧化铝
(NaO2●Al2O3, n = 5-11); (4)氧离子导体 如ZrO2,ThO2; (5)氟离子导体如NaF,AlF3。 2、应用:燃料电池等。
(1)m与关系:m=Vm C,Vm是含1mol电解质溶液的体积,
C为体积摩尔浓度。
(2)m与淌度的关系:m= U++U- F,
:电离度,F:法拉第常数,F=eNA=96500C / mol。
对无限稀溶液:=1m
U
U
F,离子独立移动定律:mmm NhomakorabeaU
U
F
对浓度不太大的强电解质溶液,近似有:m
1
(3)平均质量摩尔浓度:m=(m+
m ) - ++-
若已知 ,有近似计算:+= m+,-= m-
二、德拜-休克尔方程
1、溶液的离子浓度I:
I 1
2
i
mi zi2
例:溶液内含0.01mol/kg NaCl 和.02mol/kg 的CdCl2,则Na+,Cd2+和
Cl- 离I 子1 强0.0度11为2 :0.02 22 0.05 (1)2 0.07 2
电化学知识点总结

电化学知识点总结一、电化学基础1. 电化学的基本概念电化学是研究电化学反应的科学,它涉及到电流和电势的关系,以及在电化学反应中的能量转换和催化作用。
电化学反应通常发生在电极上,电化学反应的方向与电流的流动方向相反。
2. 电化学的基本原理电化学的基本原理包括电极反应、电解、电荷传递和能量转换等。
在电池中,通过氧化还原反应产生的电能被转化为化学能,进而转化为电能,从而产生电流。
3. 电化学的基本参数电化学的基本参数包括电压、电流、电解、电极电势、电导率、离子迁移速率等。
这些参数是电化学研究的基础,也是电化学应用的基本原理。
二、电化学反应1. 电化学反应的基本类型电化学反应包括氧化还原反应、电解反应、电化学合成反应等。
氧化还原反应是电化学反应中最常见的一种,它涉及到电子的转移,产生电压和电流。
电解反应是电化学反应中电流通过电解质溶液时发生的反应,通常涉及到离子的迁移和溶液中的化学反应。
电化学合成反应是指利用电能进行化学合成反应,通常包括电极合成和电解合成两种方式。
2. 电化学反应的热力学和动力学电化学反应的热力学和动力学是电化学研究的重要内容。
热力学研究电化学反应的热能转化和热能产生的条件,动力学研究电化学反应的速率和电化学动力学理论。
三、电化学动力学1. 电化学反应速率电化学反应速率是指单位时间内电化学反应所产生的物质的变化量。
电化学反应速率与电流和电压密切相关,它是电化学反应动力学研究的关键之一。
2. 催化作用催化作用是指通过催化剂来提高电化学反应速率的现象。
催化剂可以降低反应的活化能,提高反应速率,通常在电化学反应中有着重要的应用。
3. 双电层理论双电层是电极表面和电解质溶液之间的一个电荷层,它对电化学反应速率有着重要的影响。
双电层理论是电化学研究的重要理论之一,它涉及到电极和电解质溶液中的电位差和电荷分布。
4. 交换电流交换电流是指在电化学反应中与电流方向相反的电流,它是电化学反应速率的一个重要参数,也是电化学动力学研究的重要内容。
电化学原理知识点

电化学原理第一章 绪论两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
第八章 电化学基础 第三节 电导、电导率和摩尔电导率

c/(mol·m-3) 103 102 10 1 10-1
κ/(S·m-1) 11.19 1.289 0.1413 0.01469 0.001489
2023/2/20
4
(三)摩尔电导率m (molar conductivity)
●定义 相距1m的两平行电极间含1mol电解质溶液时的电导
●与Κ的关系
•单位 S·m-1Fra bibliotek•意义 电导率
Κ为单位截面积、单位长度时的电导,即电阻率的倒数;对电解质 溶液:为二个相距1m,面积各为1m2的电解质溶液的电导
•求取 =G(l/A)=GKcell
Kcell=l/A——电导池常数,单位:m-1,求取:测已知的物质(KCl)
的G(R)求之
2023/2/20
3
c/(mol·dm-3) 1 0.1 0.01 0.001 0.0001
12
五、电导测定的应用
(一)计算弱电解质的解离度及解离常数
例,浓度为c的醋酸水溶液中,醋酸部分解离,解离度为α时
CH3COOH = H+ + CH3COO-
解离前
c
0
0
解离平衡时 c(1-) c
c
解离常数Kθ与醋酸的浓度c和解离度的关系为
(c / c )2 (1)c / c
2 1
c c
m
m m
m m
m (K2SO4) (K2SO4) / c(K2SO4)
97S·m-1
2023/2/20
= 0.06997 S·m-1/2.5 S·m-3=0.02799 S·m2·mol-1 7
三、摩尔电导率m与浓度c的关系
●柯尔劳施公式(Kohlrausch F) 实验:很稀溶液中,强电
电化学原理知识点

电化学原理知识点————————————————————————————————作者:————————————————————————————————日期:电化学原理第一章 绪论两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
电化学简述

HCl NaOH AgNO3
HAc c
2020/9/3
电解质溶液的电导与浓度的关系
强电解质摩尔电导率与浓度之间的关系 随着浓度下降,m升高,当浓度降至0.001molm3 以下时,m与 c之间呈线性关系。
2020/9/3
电解质溶液的电导
电导(电解质溶液的导电能力)
L 1 R
电导是电阻的倒数,单位:S or -1
由物理学已知
R l
A
L 1A
l
L的大小与导体的截面积A成正比,导体长度成反比。
2020/9/3
电解质溶液的电导
电导率(,电阻率的倒数)
令 1
整理得
则L A
l
κ L l 或κ 1 l
离子的电迁移和迁移数
离子的电迁移现象
1. 通电后,溶液中的离子作定向迁移,其方向: 阴离子迁向阳极 阳离子迁向阴极
2. 正、负离子协同完成电量的输运,承担的份额 不一定相等。影响因素包括: 离子数目 离子所带电荷数 离子的运动速度
2020/9/3
离子的电迁移和迁移数
设离子都是一价的,当通入4 mol电子的电量时,阳极上 有4 mol负离子氧化,阴极上有4 mol正离子还原。 两电极间正、负离子协同合作,累计承担4 mol电子电量 的运输任务。 现在离子都是一价的,则离子运输电荷的数量只取决于 离子迁移的速度。
Λ Λ Λ Λ
m HAc
m HCl
m NaAc
m NaCl
426.2104 91.01104 126.45104
390.7 104 S m2 mol1
第一章电化学基本知识

0.280
0.650 0.615 0.098
氯化银电极
Ag/AgCl, Sat. KCl
0.199
电解质溶液
使溶液具有导电能力的物质,是电极间电子传递的媒 介。
可以是液体、固体,偶尔也可是气体。
组成:溶剂 溶质(电解质):导电作用 电活性物种:发生电化学反应
分类:水溶液 有机溶液 熔融盐体系
隔膜
(1)分区进行:氧化、还原反应分别在阳极、阴极上 进行。反应中涉及的电子通过电极(电子交换的场所) 和外电路传递。
(2)特殊的异相催化氧化还原反应: 对一般的异相催化反应:催化剂只能加速反应到达平衡 的时间,但不能改变反应的平衡位置,及不会改变反 应的平衡常数。 对电极反应:在电极溶液界面,我们有可能在一定范围 内随意控制反应表面的“催化活性”与反应条件,因 而可以改变电极反应的平衡位置和平衡常数。
参比电极:
(1)一个已知电势的,接近于理想不极化的电极,基本没有电 流通过。
(2)基本要求: (I)应为可逆电极,电极电位符合Nernst方程。 (II)参比电极反应应具有较大的交换电流密度,流过微小的 电流时电极电势能迅速恢复原状。 (III)具有良好的电势稳定性和重现性。 (3)实际工作中,WE和RE中溶液常不一样,采用盐桥来减小 影响。 (4)为了减小未补偿的溶液电阻,常用鲁金毛细管。 (5)有时,CE和RE合二为一。
负载接通后能够自发地将电能送到外电路的装
置。 通过反应物反应得到电力——电池
活负氧消,不正还保
活负氧消,不正还保
电解池(电解槽):把两个电极与直流电源相通, 使电流通过体系的装置以投入电力获得附加值 高的生成物为目的——电解 阳氧正,阴还负
正负极是按电位高低来分
电化学原理知识点

电化学原理知识点 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT电化学原理第一章绪论两类导体:第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极原电池(-)电解池(+)阴极:发生还原反应的电极原电池(+)电解池(-)电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I : 离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
电化学基本概念

电化学基本概念【电导】描述物体导电性能的物理量,其值是电阻的倒数,单位是“西门子”,用S表示。
某物体的电阻愈小它的电导就愈大。
【电导率】又称比电导。
可用来衡量和比较物体的导电性能。
当物体的长度为1厘米,截面积为1平方厘米时的电导,为该物体的电导率。
对电解质溶液来说,当两电极面积各为1平方厘米,电极相距1厘米时为溶液的电导。
电解质溶液的电导率与电解质的种类、溶液的浓度及温度等有关。
【离子淌度】又称离子迁移率。
某种离子在一定的溶剂中,当电位梯度为每米1伏特时的迁移速率称为此种离子的淌度,单位是米2·秒-1·伏特-1。
离子淌度是代表离子迁移速率特征的物理量。
【离子迁移率】见离子淌度条。
【离子强度】在电解质溶液中离子之间平均静电相互作用的一种量度,常用I表示,其定义式如下:上式的含义是:某电解质溶液的离子强度等于每种离子的质量摩尔浓度mi与其价数Zi平方的乘积之和的一半。
【双电层】在两种不同物体的接触界面上,正负电荷分别排列成的一种面层,例如在金属和电解质溶液相接触的界面上,金属表面电荷层与液溶中的相反电荷的离子层就构成双电层,由于溶液中的离子的热运动,溶液中的一层又分为紧密层和扩散层。
【可逆电池】热力学意义上的可逆电池必须具备两个条件,即可逆电池在充电和放电时不仅物质的转变是可逆的,而且能量的转变也是可逆的。
如果把放电时放出的电能全部储存起来并用它对电池充电,则能恰好使电池内化学反应体系及外界环境全部恢复原状。
一般意义的可逆电池就是指由于放电而被消耗的物质,可以通过充电使之再生的电池,此电池的充电反应恰好是放电反应的逆过程,如常用的铅蓄电池。
【可逆电极】构成可逆电池的电极。
主要有以下三种类型:(1)金属电极、氢电极、氧电极、卤素电极。
金属电极是将金属浸在含有该种金属离子的溶液中构成,以符号M|M2+表示;氢电极、氧电极、氯电极,分别是将被H2、O2、Cl2的气流冲击着的铂片浸入含有H+、OH-、Cl-的溶液中构成,分别用符号(Pt)H2|H+或(Pt)H2|OH-、(Pt)O2|OH-或(Pt)O2|H2O,H+以及(Pt)Cl2|Cl-表示。
第六章 电化学
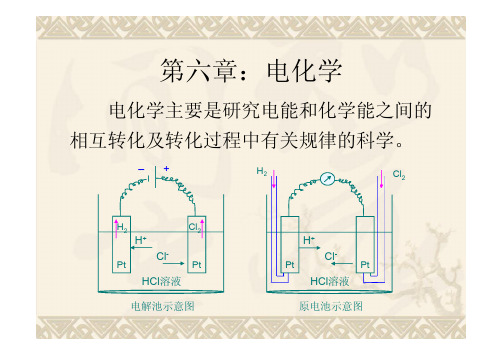
原电池示意图
§6.1 电化学基本概念
电极命名
物理学: 电势高者称为正极; 电势低者称为负极。
原电池 正极是阴极(还原极) 负极是阳极(氧化极)
电化学: 发生氧化反应为阳极; 发生还原反应为阴极。
电解池 正极是阳极(氧化极) 负极是阴极(还原极)
§6.1 电化学基本概念
法拉第电解定律(Faraday’s law of electrolysis)
§6.1 电化学基本概念
电化学装置:电解池和原电池
H2 Cl2
H2电极: H2 → 2H++ 2e 氧化 Cl2电极: Cl2 + 2e → 2Cl- 还原
H+ ClPt Pt
电池反应: Cl2 + H2 → 2HCl 该反应的∆GT, P <0,为自发反应;即此过 程中 ∆GT, P降低,化学能转化为电能。
向电解质溶液通电后,在电极上起反应 的物质的量与通入的电量成正比。
表达式:
Q = nzF 或
n = Q / zF
式中Q是通入的电量; z:电极反应中电子转移的计量系数; n:物质的量; F:Faraday’s constant
§6.1 电化学基本概念
电化学的基本单位
在讨论电解质溶液导电问题时,是以含有单位元电荷 (即质子、电子电荷的绝对值)的物质作为基本单元。 Mz+或Mz-的基本单元为1/z M
第六章:电化学
电化学主要是研究电能和化学能之间的 相互转化及转化过程中有关规律的科学。
– +
H2 Cl2
H2
Cl2
H+
Pt
H+ ClPt Pt
ClHCl溶液
Pt
材料电化学基础知识点总结

材料电化学基础知识点总结一、电化学基础概念电化学是研究电能与化学变化之间相互转化的学科,它是电学和化学的交叉学科。
在电化学中,研究的两个基本方向是电生化学和化学电子学。
1. 电生化学电生化学是研究电场对化学反应速率的影响以及电能转化为化学能的过程。
电生化学是一种通过外加电场来改变化学反应速率的手段,利用外加电场可以调控电化学反应的速率,进而控制电化学反应的过程和产物的选择性。
2. 化学电子学化学电子学是研究化学物质中电子的产生、转移和传递过程以及在这些过程中的电能转化为化学能的过程。
化学电子学研究的主要对象是电子输运和电子转移,即电子在化学反应中的迁移和转移过程。
在电化学中,常用的基本概念包括电位、电流、电解质、电极反应等。
二、电化学反应电化学反应是在外加电压或电场的作用下,在电解质溶液中或者在电极表面发生的化学反应。
电化学反应主要包括两种类型:电解反应和电极反应。
1. 电解反应电解反应是指在外加电压或电场的作用下,将化学反应进行向某一方向的强制进行。
电解反应发生在电解质溶液中,产生电势差,并可导致电解质溶液中发生氧化还原反应。
2. 电极反应电极反应是指电解质溶液中电极上发生的氧化还原反应,包括氧化反应和还原反应。
在电极反应中,外加电压或电场会导致电子在电解质溶液和电解质溶液之间转移,从而产生电流和电势差。
在电化学反应中,有几个重要的概念需要了解:(1)电极势和电动势电极势是指电极表面发生氧化还原反应时的电势。
而电动势是电化学反应全过程中某种能量转化的大小,也是电化学反应的推动力。
(2)过电位过电位是指在电化学反应中,当电极势高于或低于理论电解反应电势的现象。
过电位是电化学反应进行的一个重要参数,也是电化学反应过程中的热力学和动力学参数。
(3)电极极化电极极化是指外加电压或电场作用下,导致电解质溶液中电极发生电位变化的现象。
电极极化可能是由于金属电极的活性变化,导致电解质溶液中的电极反应速率变化。
电化学 1电化学基本概念导电机理迁移数电导率讲解

? 上一内容 ? 下一内容 ?回主目录
? 返回
2019/6/10
§7-1电解池、原电池和法拉第定律
? 一、两类导体
?
第一类:电子导体
?
金属、石墨等
? 载流子: 自由电子
? 温度升高: R↗
? 导电过程 无化学反应
第二类:离子导体 电解质溶液、熔融电解质
离子 R↘ 有化学反应
? 上一内容 ? 下一内容 ?回主目录
? 返回
2019/6/10
?二、电解池与原电池
化学能 原电池? G<0
电解池? G>0
负载
–
+
电能
V A
Zn
Cu
H2 ←
Fe
→O 2
Ni
多
阴 NaOH 阳
孔
隔 ZnSO 4 膜 CuSO 4
? G = – 212kJ?mol-1
石棉隔膜
H2O(l)? H2(g)+O2(g) ? G =237.2kJ ?mol-1
? 上一内容 ? 下一内容 ?回主目录
? 返回
2019/6/10
五、物质的量的基本单元
n=N/L ,其中N为基本单元的个数,所以n值 与基本单元有关。例如18g水,可表示为:
n(H2O)=1mol , n(2H2O)=0.5mol , n(1/3H2O)=3mol , 等
?在研究电解质溶液导电性质时,习惯于以一个元 电荷(e- or e)为基础指定物质量的基本单元。
? 特点:?化学能—? 电能
?
?内部电流方向 低电势—? 高电势
? 3.应用
电化学知识点

电化学知识点电化学是研究电与化学之间相互作用的科学领域。
它既涉及物理学中的电学,又包括化学学科中的电化学反应。
电化学的研究对于理解和应用电池、电解、腐蚀等过程具有重要意义。
本文将介绍电化学中的一些基本概念和实践应用。
1. 电化学基础电化学中的两个重要概念是电位和电流。
电位是指物体上的电势差,它描述了正电荷和负电荷之间的相对能量差异。
电路中,当电流通过导体时,就像水流动一样,在形成的闭合回路中,电荷会从一个电极流向另一个电极。
这种电流是电化学反应的结果。
2. 电池和蓄电池电池是将化学能转化为电能的装置,它由两个或多个半电池组成。
半电池是一个化学反应产生电流的半截。
蓄电池则是能够重复充放电的电池,它可以在外部电源未连接时储存能量。
蓄电池的工作原理是将化学反应的产物吸附到电极上,然后再通过反向反应释放能量。
3. 电解和电沉积电解是电化学过程中将化学物质分解为离子的过程。
通过将电流通过液体或熔融的盐,可将阴阳离子分离出来。
而电沉积是指通过电流将离子沉积到一个电极上的过程。
这种过程常用于电镀,可以制备出金属薄膜或改变物体的表面性质。
4. 电化学传感器电化学传感器是利用电化学原理来测量、检测化学物质浓度或气体浓度的传感器。
例如,氧气传感器可通过电反应测量氧气浓度,用于监测空气中的氧含量。
另外,pH传感器可以测量溶液中的酸碱度,用于环境监测和实验室分析。
5. 电化学腐蚀电化学腐蚀是金属或合金遭受化学或电化学反应而受到损害的过程。
当金属与电解质接触时,会发生氧化还原反应,导致金属表面的物质流失。
腐蚀不仅使金属失去外观,还可能降低其机械性能和耐用性。
电化学腐蚀的研究有助于开发新的材料和防腐蚀措施。
6. 超级电容器超级电容器是一种能够高效储存电能的装置。
它与传统电池不同,不通过化学反应来储存能量,而是通过电荷在电极表面的吸附和释放来实现。
超级电容器具有高功率密度、长循环寿命和快速充放电等优点,因此被广泛应用于电子设备、电动车等领域。
物理化学总结-电化学-思维导图

3.德拜-休克尔极限公式
7.4 电解质溶液的活 度、活度因子及德 拜-休克尔极限公式
化学可逆性 热力学可逆ቤተ መጻሕፍቲ ባይዱ 电池的可逆含义
实际可逆性 电池的表示方法 1.可逆电池
电池电动势的定义 丹聂耳电池和韦斯顿标准电池
波根多夫对消法 2.电池电动势的测定
7.5 可逆电池及其电动势的测定
第七章 电化学
7.6 原电池热力学
2.原电池电动势的计算
3.液体接界电势及其消除 液接电势的计算
7.8 电极的种类
金属电极和卤素电极
1.第一类电极 氢电极
氧电极 酸性、碱性下氧电极反应
2.第二类电极
金属-难溶盐电极 金属-难溶氧化物电极
3.第三类电极 氧化还原电极
4.不同类型电极之间标准电极电势的 换算
7.9 原电池的设计
设计电池一般步骤(三步) 1.氧化还原反应 2.中和反应 3.沉淀反应 4.扩散过程——浓差电池 5.化学电源
柯尔劳施离子独立运动定律
4.离子独立运动 定律和离子的摩 尔电导率
计算弱电解质的解离度及解离常数
计算难溶盐的溶解度 5.电导测定的应用
电导滴定
7.3 电导、 电导率和 摩尔电导
平均离子活度 活度因子
1.平均离子活度和平均活度因子
定义:I=1/2∑(bB ZB^2 ) 求解
2.离子强度
内容lgγ±=—Az+|z-| 适用范围:强电解质稀溶液
7.2 离子 的迁移数
电导G:G=1/R,单位S
强电解质 弱电解质
电导率与 溶液浓度 的关系
电导率,G=1/R=κA/l
1.定义
摩尔电导率Λm:在相距为单位长度的两平 行电极之间,放置有1 电解质溶液时的电导
电化学-1电化学基本概念导电机理迁移数电导率讲解

通 电
阳极
前 (Pt)
阳极区
+++++
-----
中间区
+++++
-----
阴极区
+++++
-----
阴极 (Pt)
通 电 后
++
--
+++++
-----
++++
-- --
② 对任意离子B,nB(迁移) ≠ nB(电极反应)
例:n+(迁移)=3mol, n+(阴极反应)=4mol n-(迁移)=1mol, n-(阳极反应)=4mol
上一内容 下一内容 回主目录
返回
2019/6/10
② 电解质 M A
M A 电离 Mz Az
∴
用 n
1
z
M A
描述电解质的物质的量
例 n(KCl),n(1/2Na2SO4) , n(1/3AlCl3) …
这样做的好处是:
第七章 电化学 Chapter 7 Electrochemistry
电化学:物理化学的一个重要分支
内容:化学反应←→电现象。既包括热力学问题,也包
括动力学问题。
用途:
电池
化学能
电能
电解池
所以电化学系统就是电池或电解池(系统特点:由导体或半 导体组成,由于带电粒子个性不同,在相间存在电位差); 为科学研究及生产过程提供精确快速的研究测定方法。
阳极区 中间区 阴极区
通 电
阳极
+++++
电化学基本原理

现在国际上对电极电位通用的定义表述为:若 任一电极M与标准氢电极组成一特殊原电池, 此电池的电动势(开路电压,无电流通过时)E即 为M电极的电极电位。 规定标准氢电极:(H+/H2) = 0 V
标准氢电极为负极 待= E
标准氢电极为正极 待= –E
相对标准电极电位的测量
所测得的电势为
由图中可以看出,在不同 的电流密度下,析氢过电 位是不同的。由此可以的 得到如下定义:在某一电 流密度下,氢实际析出的 电位EH与氢的平衡电位 EHp的差值,就叫做在该 电流密度下的析氢过电位。 数学表达式:△EH= EHp-EH 实验表明,氢在不同金属上还原时,过电位 是不同的,许多金属上氢的析出过电位与阴极电 流密度的关系服从塔菲尔(Tafel)公式:
对于电极反应来说,若有 a氧化态+ze b还原态 b 则有 RT 还原态
E E0
ln zF 氧化态 a
T—开尔文温度,K; z—电极反应中电子的化学计量数; F—法拉第常数,为96485C· -1 mol 上述方程式称为能斯特方程,它表明氧化还原反应中,溶质 的浓度、气体的压力对电极电势的影响。
△EH=a+blg|Dk|
金属上析氢过电位与电流密度对数值关系
1.0
Pb C
Hg Cu Fe Pt
-η( 伏 )
Au
0.6
0.2 Ni -7 -6 -5 -4 -3 -2 -1 0 1
Lgi(安培/厘米2)
四、金属的电结晶过程
金属的电结晶过程是一个相当复杂的过程
单独研究金属的电结晶过程十分困难
极化度表示了某一电流密 度下电极极化程度变化的 趋势,因而反应了电极过 程进行的难易程度:极化 度越大,电极极化的倾向 也越大,反之,极化度越 小,则电极极化的倾向越 小。
整理-电化学基本概念

·鉴于编者的水平极其有限,错误疏漏在所难免,敬请批评指正电化学基本概念1. 导体(Conductor):能导电的物质称为导体。
有些导体依靠其中的电子传递电流,称为电子导体或第一类导体(如金属,石墨,PbO2、Fe3O4等金属氧化物);有些导体靠离子的移动来实现其导电任务,称为离子导体或第二类导体(如电解质溶液,熔融电解质,固体电解质)。
一般来说,离子导体的导电能力比电子导体小得多。
2. 电极反应(Electrode Reaction):电子导体能够独立地完成导电任务;而要想让离子导体导电,必须有电子导体与之相连接。
但流经两类导体的电荷载体不一样,为了使电流持续不断地通过离子导体,在两类导体界面上必然会有得电子或失电子的反应发生。
这种在两类导体界面界进行的有电子得失的化学反应称为电极反应或电化学反应。
★自发电池 / 电解池3. 阴极(Cathode):电流通过两类导体界面时,使正电荷从电极进入溶液(发生还原反应)的电极。
4. 阳极(Anode):电流通过两类导体界面时,使正电荷从溶液进入电极(发生氧化反应)的电极。
5. 法拉第(Faraday):一摩尔电子的电量。
摩尔常数N A =6.02×1023;每个电子的电量 e 0 = 1.602×10-19库仑(Coulomb);一库仑为一安培·秒(Ampere-second);所以:1法拉第 = 6.02×1023×1.602×10-19≈96500库仑1法拉第 = 6.02×1023×1.602×10-19÷3600≈26.8安时(Ampere-hour)6. 法拉第定律(Faraday Law):在整个电路中各处的电流是相等的,因此电极上通过的电量与电极反应的反应物和反应产物之间有如下的精确关系:若反应为M z + + z e- = M,则生成1摩尔 M 所需的电量为 z 法拉第。
电化学原理基本概念总结

第一章电化学体系:由两类不同导体组成,在电荷转移时,不可避免地伴随有物质变化的体系。
电极反应:两类导体上发生的氧化反应或还原反应。
电化学反应:电化学体系中发生的、伴随有电荷转移的化学反应。
电化学科学:研究电子导电相(金属、半导体)和离子导电相(溶液、固体电解质)之间的界面上所发生的各种界面效应的科学。
即伴有电现象发生的化学反应的科学。
电极:电子导电相和离子导电相相接触,且在相界面上有电荷的转移,整个体系称为电极。
电极电位:电极体系中,两类导体界面所形成的相间电位,即电极材料和离子导体(溶液)的内电位差。
第二章绝对电位:金属与溶液之间的内电位差的数值。
参比电极:能作为基准的、电极电位保持恒定的电极。
相对电位:将参比电极与被测电极组成一个原电池回路,所测出的电池端电压,叫做该被测电极的相对电位。
习惯上直接称为电极电位,用表示)标准氢电极:气体分压为101325Pa 的氢气和离子活度为1的氢离子溶液所组成的电极体系。
用氢标电位:相对于标准氢电极的电极电位。
金属接触电位:相互接触的两个金属相之间的外电位差。
形成原因:当两种金属接触时,由于电子逸出功不等,相互逸入的电子数目将不相等,因此在界面形成了双电层结构。
这一双电层结构的电位差就是金属的接触电位。
电子逸出功:电子离开金属逸入真空所需要的最低能量 液体接界电位相互接触的两个组成不同或浓度不同的电解质溶液相之间存在的相间电位。
形成原因:两溶液相组成或浓度不同;溶质离子发生迁移;正、负离子运动速度不同;两相界面形成双电层产生电位差在恒压下原电池电动势对温度的偏导数称为原电池电动势的温度系数吉布斯—亥姆荷茨方程应用于电池热力学的另一种表达式,可通过测求反应的焓变电解池腐蚀电池:只能导致金属材料破坏而不能对外作功的短路的原电池。
电池反应所释放的化学能以热能的形式耗散,电池反应不能生成有价值的物质 浓差电池:原电池的电池总反应不是化学变化,而是一种物质从高浓度向低浓度状态的转移。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B
E
① uB:离子B的电迁移率(淌度),m2.s-1.V-1。 单位场强(1 V m-1)时的电迁移速度。
② uB = f(T, p, c, B本性,D本性),∴ uB不是 B的特性参数(∵与c,D本性有关 ), uB 值 应具体测量。
上一内容 下一内容 回主目录
返回
2019/6/10
2HClH2 +Cl2
3电流在界面上连续, 构成回路
结果:电源做功W’= -qV; 系统(G)T,p>0 若可逆进行: (G)T,p= Wr’= - Q电量 E
上一内容 下一内容 回主目录
返回
2019/6/10
1 界面上自发 反应:
H2(g)+Cl2(g)2HCl 负极:H2 2e 2H+ 正极:Cl2 +2 e 2Cl-
2 接通外电路,由于 电势差,产生电流
3 进入溶液的离子定向 迁移,构成回路
结果:系统(G)T,p<0; 对外做功W’; 若可逆进行: (G)T,p= Wr’=-Q电量 E
上一内容 下一内容 回主目录
返回
2019/6/10
电解质溶液的导电机理 ①电解质溶液内部有正负离子定向迁移; ②电极与电解质溶液界面上分别发生氧化还原反
应,电荷转移,一个电极放正电,另一个电极放负电 。导电停止溶液显中性,不带电。 结果实现了化学 能和电能之间的转换。
上一内容 下一内容 回主目录
返回
2019/6/10
•四、电极的区分与名称
• 1. 阴、阳极 • 阴极:发生还原反应的电极。 • 阳极:发生氧化反应的电极。 • 2. 正、负极 • 正极:电势高的电极。 • 负极:电势低的电极。 • 3.正、负极与阴、阳极的关系 • 电解池:阴——负、阳——正 • 原电池:阴——正、阳——负
离子 R↘ 有化学反应
上一内容 下一内容 回主目录
返回
2019/6/10
•二、电解池与原电池
化学能 原电池G<0
电解池G>0
负载
–
+
电能
V A
Zn
Cu
多 孔
H2 ←
Fe
Ni
阴 NaOH 阳
→O2
隔 ZnSO4 膜 CuSO4
G = – 212kJmol-1
石棉隔膜
H2O(l)H2(g)+O2(g) G =237.2kJmol-1
通 电
阳极
前 (Pt)
阳极区
+++++
-----
中间区
+++++
-----
阴极区
+++++
-----
阴极 (Pt)
通 电 后
++
--
+++++
-----
++++
-- --
② 对任意离子B,nB(迁移) ≠ nB(电极反应)
例:n+(迁移)=3mol, n+(阴极反应)=4mol n-(迁移)=1mol, n-(阳极反应)=4mol
上一内容 下一内容 回主目录
返回
2019/6/10
五、物质的量的基本单元
n=N/L,其中N为基本单元的个数,所以n值 与基本单元有关。例如18g水,可表示为:
n(H2O)=1mol, n(2H2O)=0.5mol, n(1/3H2O)=3mol, 等
在研究电解质溶液导电性质时,习惯于以一个元 电荷(e- or e)为基础指定物质量的基本单元。
上一内容 下一内容 回主目录
返回
2019/6/10
本章基本要求
• 了解表征电解质溶液导电性质的物理量(电导、电导率、摩尔电 导率、电迁移率,迁移数)。
• 理解离子平均活度及平均活度系数定义并掌握其计算。了解离子 强度的定义。
• 了解德拜-休格尔极限公式计算离子平均活度系数的方法。 • 理解可逆电池的概念,理解能斯特方程的推导掌握其应用。 • 掌握电池电动势与热力学函数的关系及其计算。 • 掌握常用电极符号、电极反应及其电极电势的计算,掌握电池电动
特点:概念多,要以理解为主。
上一内容 下一内容 回主目录
返回
2019/6/10
本章研究的主要内容
• 电解质溶液的导电机理 • 原电池 • 电解池
上一内容 下一内容 回主目录
返回
2019/6/10
目录
§7-1 Electrolytic cell、Galvanic cell and Faraday’s law §7-2 The ionic transport number §7-3 Electric conductivity and molar Electric conductivity §7-4 The Law independent migration ions §7-5 The application of conductance determine §7-6 Mean ionic activity of electrolyte §7-7 Debye—Hcükel limiting law §7-8 Reversible cell §7-9 Thermodynamic of reversible cell §7-10 Nernst equation §7-11 电池电动势及标准电池电动势测定 §7-12 电极电势和电池电动势 §7-13 电极种类 §7-14 电池设计 §7-15 电解和极化
①
离子Mz+
:用 n
1 z
M z
描述离子的物质的量,
例 n(H+),n(1/2Cu2+),n (1/3Fe3+) …
离子Az- :用
n
1 z
A z
描述离子的物质的量,
例 n(Cl-),n(1/2SO42-) …
这样做的好处是,1mol任何离子所带的电量均为6.023×1023e。
第七章 电化学 Chapter 7 Electrochemistry
电化学:物理化学的一个重要分支
内容:化学反应←→电现象。既包括热力学问题,也包
括动力学问题。
用途:
电池
化学能
电能
电解池
所以电化学系统就是电池或电解池(系统特点:由导体或半 导体组成,由于带电粒子个性不同,在相间存在电位差); 为科学研究及生产过程提供精确快速的研究测定方法。
(1) 1mol任何电解质全电离均产生
6.023×1023e的正电荷和负电荷;
(2) 同一溶液中,电解质全电离时
n
1
z
M
A
n
1 z
Mz n
1 z
A z
例如:5mol 1/2Na2SO4溶于水全电离产生 5mol Na+ 和 5mol 1/2SO42-
• 特点:化学能—电能
•
内部电流方向 低电势—高电势
• 3.应用
• 电解、电镀、电池、防腐、生物工程
上一内容 下一内容 回主目录
返回
2019/6/10
三、电解质溶液的导电机理
1 电场力作用下: H+ 向负极迁移 Cl- 向正极迁移
2 界面上: 负极 2H+ +2e H2 正极 2Cl- 2e Cl2
• 1mol电子的电量称为1F,1F=Le=96500Cmol-1
• 2.数学表达式:Q=nF
• 3.说明:
• 法拉第定律是由实践总结出来的。
• 法拉第定律适用于电解池,也适用于原电池。
• 当有1mol电子的电量通过AgNO3溶液时在阴极有1molAg 沉淀,当有1mol电子的电量通过CuSO4溶液时在阴极有 1mol(1/2Cu)沉淀。
上一内容 下一内容 回主目录
返回
2019/6/10
③ 参与氧化还原反应的物质M:
M ze re Mz-
M z-
oxM
ze
以
n 1 z
M
描述物质M的物质的量
例如:电解CuCl2溶液产生Cl2和Cu,则用 n(1/2Cl2)和n(1/2Cu)表示。
总结:1mol的任何物质(离子、电解质或其他
上一内容 下一内容 回主目录
返回
2019/6/10
七、电量计(库仑计) 测量电量的装置
电量计(库仑计):以电极上析出(固体或气体)或溶解的 物质的量测定电量。 如:铜电量计,银电量计和气体电量计。 例:阴极上析出0.4025g银,则通过的电量为:
Q=nF=(0.4025/109) 96500=356.3C 阴极上析出0.2016g铜,则通过的电量为: Q=nF=(0.2016/63.5) 2 96500=612.7C
势的计算及其应用。 • 理解原电池的设计原理。 • 了解极化作用和超电势的概念。
上一内容 下一内容 回主目录
返回
2019/6/10
§7-1电解池、原电池和法拉第定律
• 一、两类导体
•
第一类:电子导体
•
金属、石墨等
• 载流子: 自由电子
• 温度升高: R↗
• 导电过程 无化学反应
第二类:离子导体 电解质溶液、熔融电解质
-----
阴极区
+++++
-----
阴极 (Pt)
通 电 后
++
--
+++++
-----
++++
