湘潭大学结构化学考试题目范围
(完整word版)结构化学 考卷及答案(word文档良心出品)

考试A卷课程名称结构化学一、选择题(每小题2分, 共30分)得分评卷人1. 在长l = 2 nm的一维势箱中运动的He原子,其de Broglie波长的最大值是:------------ ( )(A) 1 nm (B) 2 nm (C) 4 nm (D) 8 nm (E) 20 nm2. 立方势箱中的粒子,具有E= 的状态的量子数。
则n x、n y、n z 可以是------------ ( )(A) 2 1 1 (B) 2 3 1 (C) 2 2 2 (D) 2 1 33. 下列哪几点是属于量子力学的基本假设:----------- ( ) (A) 描写微观粒子运动的波函数必须是正交归一化的9. 通过变分法计算得到的微观体系的能量总是:----------------- ( )(A) 大于真实基态能量(B) 不小于真实基态能量(C) 等于真实基态能量(D) 小于真实基态能量10. 对于"分子轨道"的定义,下列叙述中正确的是:----------------- ( )(A) 原子轨道线性组合成的新轨道(B) 分子中所有电子在空间运动的波函数(C) 分子中单个电子空间运动的波函数(D) 分子中单电子完全波函数(包括空间运动和自旋运动)11. 下面说法正确的是:----------------- ( )(A) 如构成分子的各类原子均是成双出现的,则此分子必有对称中心(B) 分子中若有C4,又有i,则必有σ(C) 凡是平面型分子必然属于C s群(D) 在任何情况下,=12. B2H6所属点群是:----------------- ( )(A) C2v(B) D2h(C) C3v(D) D3h(E) D3d13. 已知配位化合物MA4B2的中心原子M是d2sp3杂化,该配位化合物的异构体数目及相应的分子点群为:----------------- ( ) (A) 2,C2v,D4h(B) 2,C3v,D4h(C) 3,C3v,D4h,D2h(D) 4,C2v,C3v,D4h,D2h14.某基态分子含有离域π66键,其能量最低的三个离域分子轨道为:= 0.25 φ1 + 0.52 φ2 + 0.43 ( φ3 + φ6) + 0.39 ( φ4 +φ5)1= 0.5 ( φ1 + φ2 ) - 0.5 ( φ4 +φ5 )2= 0.60 ( φ3 -φ6 ) + 0.37 ( φ4 -φ5 )3若用亲核试剂与其反应,则反应发生在(原子编号):------------ ( )(A) 1 (B) 2 (C) 1,2 (D) 3,6 (E) 4,515. 已知C2N2分子偶极矩为0,下列说法何者是错误的?------------- ( )共轭体系(A) 是个线型分子(B) 存在一个44(C) 反磁性(D) C—C键比乙烷中的C—C键短二、填空题(24分)得分评卷人1. 在电子衍射实验中,││2对一个电子来说,代表_____________________。
结构化学复习题及答案

结构化学复习题及答案一、选择题1. 原子轨道的波函数是关于原子核对称的,下列哪个轨道是关于z轴对称的?A. s轨道B. p轨道C. d轨道D. f轨道答案:A2. 根据分子轨道理论,下列哪个分子具有顺磁性?A. O2B. N2C. COD. NO答案:A3. 氢键通常影响分子的哪种性质?A. 熔点B. 沸点C. 密度D. 折射率答案:B二、填空题4. 原子轨道的电子云图是按照______概率密度绘制的。
答案:最高5. 根据价层电子对互斥理论,水分子H2O的几何构型是______。
答案:弯曲6. 一个分子的偶极矩为零,则该分子可能是______分子。
答案:非极性三、简答题7. 简述杂化轨道理论中sp^3杂化的特点。
答案:sp^3杂化是指一个原子的1个s轨道和3个p轨道混合形成4个等价的杂化轨道,这些杂化轨道的电子云呈四面体分布,通常用于描述四面体构型的分子,如甲烷。
8. 什么是分子轨道理论?它与价键理论的主要区别是什么?答案:分子轨道理论是一种化学理论,它将分子中的原子轨道组合成分子轨道来描述分子的电子结构。
与价键理论不同,分子轨道理论不假设电子成对形成共价键,而是将电子视为分布在整个分子空间中的分子轨道上的粒子。
分子轨道理论可以解释分子的磁性和电子的离域性,而价键理论则不能。
四、计算题9. 假设一个氢原子的电子从n=3的能级跃迁到n=2的能级,计算该过程中释放的光子能量。
答案:根据氢原子能级公式E_n = -13.6 eV / n^2,电子从n=3跃迁到n=2时释放的光子能量为ΔE = E_3 - E_2 = -13.6 eV / 3^2 - (-13.6 eV / 2^2) = 1.89 eV。
10. 计算一个CO分子的键能,已知C和O的电负性分别为2.55和3.44,CO的键长为1.128 Å。
答案:根据键能公式E = (χ1 - χ2)^2 / (4 * χ1 * χ2) * (1 - r / r0)^2,其中χ1和χ2分别是C和O的电负性,r是CO的键长,r0是C和O单键的标准键长1.43 Å。
结构化学考试题库 含具体答案

结构化学考试题库1第一部分量子力学基础与原子结构一、单项选择题(每小题1分)1.一维势箱解的量子化由来()①人为假定②求解微分方程的结果③由势能函数决定的④由微分方程的边界条件决定的。
答案:④2.下列算符哪个是线性算符()①exp ②▽2③sin④答案:②3.指出下列哪个是合格的波函数(粒子的运动空间为0+)()①sinx②e -x③1/(x-1)④f(x)=e x (0x 1);f(x)=1(x 1)答案:②4.基态氢原子径向分布函数D(r)~r 图表示()①几率随r 的变化②几率密度随r 的变化③单位厚度球壳内电子出现的几率随r 的变化④表示在给定方向角度上,波函数随r 的变化答案:③5.首先提出微观粒子的运动满足测不准原理的科学家是()①薛定谔②狄拉克③海森堡③波恩答案:③6.立方势箱中22810ma hE <时有多少种状态()①11②3③7④2答案:③7.立方势箱在22812ma h E ≤的能量范围内,能级数和状态数为()①5,20②6,6③5,11④6,17答案:③8.下列函数哪个是22dx d 的本征函数()①mxe②sin 2x ③x 2+y 2④(a-x)e -x答案:①9.立方势箱中2287ma h E <时有多少种状态()①11②3③4④2答案:③10.立方势箱中2289ma h E <时有多少种状态()①11②3③4④2答案:③11.已知xe 2是算符x P ˆ的本征函数,相应的本征值为()①ih2②i h 4③4ih ④ i h答案:④12.已知2e 2x 是算符x i ∂∂-的本征函数,相应的本征值为()①-2②-4i③-4ih④-ih/π答案:④13.下列条件不是品优函数必备条件的是()①连续②单值③归一④有限或平方可积答案:③14.下列函数中22dx d ,dx d的共同本征函数是()①coskx②xe-bx③e-ikx④2ikxe-答案:③215.对He +离子而言,实波函数||m nl ψ和复波函数nlm ψ,下列哪个结论不对()①函数表达式相同②E 相同③节面数相同④M 2相同答案:①16.氢原子基态电子几率密度最大的位置在r =()处①0②a 0③∞④2a 0答案:①17.类氢体系m43ψ的简并态有几个()①16②9③7④3答案:①18.对氢原子和类氢离子的量子数l ,下列叙述不正确的是()1l 的取值规定了m 的取值范围2它的取值与体系能量大小有关3它的最大取值由解R 方程决定4它的取值决定了轨道角动量M 的大小答案:②19.对He +离子实波函数py2ψ和复波函数121-ψ,下列结论哪个不对()①Mz 相同②E 相同③M 2相同④节面数相同答案:①20.对氢原子实波函数px2ψ和复波函数211ψ,下列哪个结论不对()①M 2相同②E 相同③节面数相同④Mz 相同答案:④21.He +体系321ψ的径向节面数为()①4②1③2④0答案:④22.Li 2+体系3p ψ的径向节面数为()①4②1③2④0答案:②23.类氢离子体系Ψ310的径向节面数为()①4②1③2④0答案:②24.若l =3,则物理量M z 有多少个取值()①2②3③5④7答案:④25.氢原子的第三激发态是几重简并的()①6②9③12④16答案:④26.由类氢离子薛定谔方程到R ,H ,Ф方程,未采用以下那种手段()①球极坐标变换②变量分离③核固定近似④线性变分法答案:④27.电子自旋是()①具有一种顺时针或逆时针的自转②具有一种类似地球自转的运动③具有一种非空间轨道运动的固有角动量④因实验无法测定,以上说法都不对。
湘潭大学有机化学试卷2008
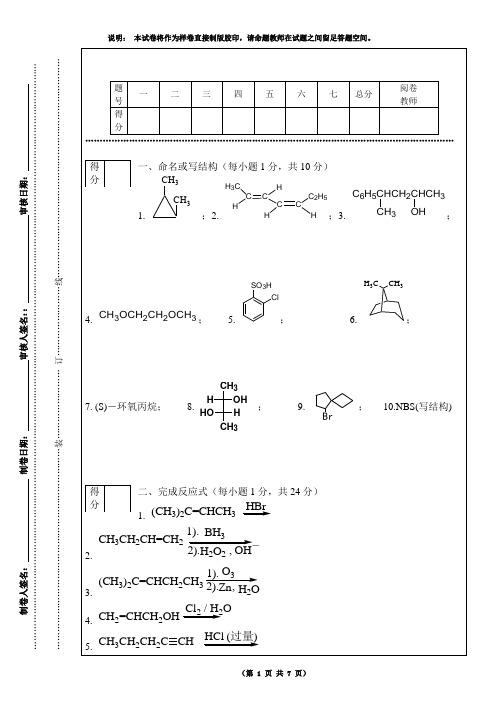
得
分
六、机理题(每小题4分,共12分)
1.
2
3
得
分
七、合成题(除规定外,可选用四碳及以下的有机原料,无机原料任选)(每小题4分,共16分)
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
得
分
三、比较有关性质(每小题1分,共10分)
1.下列化合物中,偶极矩最小的是()。
① ② ③
2.下列烷基自由基中稳定性最高的()。
① ② ③
3.下列化合物在NaOH-H2O中,按SN2机理,反应活性由大到小依次为()。
① ② ③
4.将下列化合物的PKa按由大到小排列依次为()。
① ② ③
5.化合物 在1H NMR谱中有()种等价质子。
①5②8③4
6.下列二醇不能与H5IO6发生C-C键断裂反应的是()。
① ② ③
7.比较萘的低温磺化反应速度的大小()。①α-位磺化,②β-位磺化
8.比较水溶性的高低()。
①C(CH2OH)4,②(CH3)3CCH2OH
3.画出最稳定的椅式构象。
(1) ,(2)反-4-氯-1-叔丁基环己烷
4.请用箭头标出芳香亲电进攻的位置。
湘潭大学结构化学考试题目范围
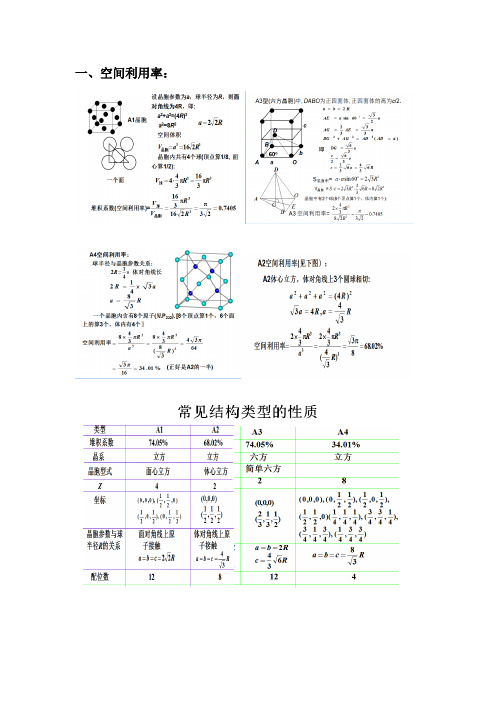
一、空间利用率:二、1 52 63 748三、离域分子轨道理论5.21试分析下列分子中的成键情况,比较Cl 的活泼性,说明理由。
H 3CCl ; 2H C=CHCl ; HC CCl ≡ 解:(a )H 3CCl :该分子为CH 4分子的衍生物。
同CH 4分子一样,C 原子也采用3sp 杂化轨道成键。
4个3sp 杂化轨道分别与3个H 原子的1s 轨道及Cl 原子的3p 轨道重叠共形成4个σ键,分呈四面体构型,属3C υ点群。
(b )2H C CHCl =:该分子为22H C CH =分子的衍生物,其成键情况与C 2H 4分子的成键情况既有相同之处又有差别。
在C 2H 3Cl 分子中,C 原子(1)的3个2sp 杂化轨道分别与两个H 原子的1s 轨道和C 原子(2)的2sp 杂化轨道重叠形成3个σ键;C 原子(2)的3个2sp 杂化轨道则分别与H 原子的1s 轨道、Cl 原子的3p 轨道及C 原子(1)的2sp 杂化轨道重叠共形成3个σ键。
此外,两个C 原子和Cl 原子的相互平行的p 轨道重叠形成离域π键43π。
成键情况示于下图:C 2HClHHσσσσσC 2H 3Cl 分子呈平面构型,属于s C 点群。
43π的形成使C Cl -键缩短,Cl 的活泼性下降。
(c )HC CCl ≡:该分子为C 2H 2分子的衍生物。
其成键情况与C 2H 2分子的成键情况也既有相同之处又有差别。
在C 2HCl 分子中,C 原子采取sp 杂化。
C 原子的sp 杂化轨道分别与H 原子的1s 轨道(或Cl 原子的3p 轨道)及另一个C 原子sp 杂化轨道共形成两个σ键。
此外,C 原子和Cl 原子的p 轨道(3个原子各剩2个p 轨道)相互重叠形成两个离域π键:43x π和43y π。
分子呈直线构型,属于C υ∞点群。
两个43π的形成使C 2HCl 中C Cl -键更短,Cl 原子的活泼性更低。
根据以上对成键情况的分析,C Cl -键键长大小次序为: 3232CH Cl C H Cl C HCl >>5.22 试分析下列分子中的成键情况,指出C Cl -键键长大小次序,并说明理由。
大三结构化学考试题及答案

大三结构化学考试题及答案一、单选题(每题2分,共20分)1. 以下哪种晶体结构中,原子的配位数为12?A. 立方体心立方晶格B. 面心立方晶格C. 六角密堆积D. 体心立方晶格答案:B2. 根据价层电子对互斥理论,水分子的空间构型是:A. 直线形B. V形C. 四面体形D. 三角锥形答案:B3. 在分子轨道理论中,下列哪个分子的键级为2.5?A. H2B. N2C. O2D. F2答案:B4. 下列哪种元素的电负性最高?A. 氟B. 氧C. 氮D. 碳答案:A5. 根据晶体场理论,八面体配位场中,d轨道分裂能Δo的大小与下列哪个因素无关?A. 配体的场强B. 金属离子的电荷C. 配体的几何构型D. 金属离子的电子排布答案:C6. 以下哪种化合物不属于离子化合物?A. NaClB. HClC. MgOD. CaF2答案:B7. 根据分子轨道理论,下列哪种分子的键级为3?A. COB. N2C. O2D. NO答案:A8. 在周期表中,第VA族元素的原子最外层电子排布为:A. ns^2np^1B. ns^2np^2C. ns^2np^3D. ns^2np^4答案:C9. 根据价层电子对互斥理论,氨分子的空间构型是:A. 三角锥形B. 四面体形C. V形D. 直线形答案:B10. 在分子轨道理论中,下列哪个分子的键级为1.5?A. O2B. N2C. COD. NO答案:A二、填空题(每题2分,共20分)1. 根据晶体场理论,八面体配位场中,d轨道分裂能Δo的大小与配体的场强成正比。
2. 价层电子对互斥理论中,分子的几何构型是由中心原子周围的价层电子对数决定的。
3. 电负性是衡量原子吸引电子对的能力的物理量,通常用Pauling电负性标度来表示。
4. 离子化合物是由正负离子通过静电作用力结合而成的化合物。
5. 分子轨道理论认为,分子轨道是由原子轨道通过分子形成时的相互作用而形成的。
6. 根据价层电子对互斥理论,乙炔分子的空间构型是直线形。
大三结构化学考试题及答案

大三结构化学考试题及答案一、选择题(每题2分,共20分)1. 下列哪种元素的电子排布符合洪特规则?A. 碳(C)B. 氧(O)C. 氮(N)D. 磷(P)答案:C2. 根据原子轨道理论,s轨道的形状是:A. 球状B. 哑铃状C. 双叶状D. 四叶状答案:A3. 价层电子对互斥理论(VSEPR)认为,分子的几何构型是由以下哪个因素决定的?A. 原子核的电荷B. 电子云的排斥C. 原子半径的大小D. 电子的自旋方向答案:B4. 以下哪个化合物不是共价化合物?A. HClB. NaClC. H2OD. CO2答案:B5. 金属键的形成是由于:A. 共用电子对B. 电子的排斥C. 电子的离域D. 电子的局域答案:C6. 晶体场理论中,八面体配位的中心金属离子的d轨道分裂为:A. t2g和egB. a1g和t1uC. e和t2D. a1和t1答案:A7. 下列哪个分子具有顺磁性?A. O2B. N2C. H2D. He答案:A8. 根据分子轨道理论,H2分子的键级是:A. 0B. 1C. 2D. 3答案:B9. 下列哪种晶体属于离子晶体?A. 石墨B. 金刚石C. NaClD. SiO2答案:C10. 以下哪个元素的电负性最高?A. FB. OC. ND. C答案:A二、填空题(每空1分,共20分)1. 根据鲍林电负性标度,电负性最高的元素是________。
答案:氟(F)2. 原子轨道的量子数n可以取的最小值是________。
答案:13. 一个s轨道最多可以容纳________个电子。
答案:24. 根据路易斯酸碱理论,HCl是一个________酸,而NH3是一个________碱。
答案:布伦斯特(Brønsted);路易斯(Lewis)5. 晶体中,面心立方(FCC)结构的配位数是________。
答案:126. 根据分子轨道理论,N2分子的键级是________。
答案:37. 一个原子的电子亲和能是该原子获得一个电子时释放的能量,而电离能是该原子失去一个电子时吸收的能量,因此电离能总是________电子亲和能。
结构化学考试题及答案

结构化学考试题及答案一、选择题(每题2分,共20分)1. 以下哪项不是原子轨道的量子数?A. 主量子数(n)B. 角量子数(l)C. 磁量子数(m_l)D. 自旋量子数(m_s)答案:D2. 氢原子的1s轨道中,电子的自旋量子数可能的取值是:A. +1/2 或 -1/2B. +1 或 -1C. +1/2 或 -1/2D. 0 或 1答案:A3. 根据泡利不相容原理,一个原子轨道最多可以容纳的电子数是:A. 1B. 2C. 3D. 4答案:B4. 原子轨道的径向概率密度函数表示的是:A. 电子在轨道上运动的速度B. 电子在轨道上运动的路径C. 电子在轨道上出现的概率D. 电子在轨道上的能量答案:C5. 原子轨道的能级由以下哪个量子数决定?A. 主量子数(n)B. 角量子数(l)C. 磁量子数(m_l)D. 自旋量子数(m_s)答案:A6. 原子的电子排布遵循哪个原理?A. 洪特规则B. 泡利不相容原理C. 能量最低原理D. 所有上述原理答案:D7. 以下哪个元素的电子排布不符合洪特规则?A. 碳(C)B. 氮(N)C. 氧(O)D. 磷(P)答案:D8. 元素的电负性与其原子的哪个量子数有关?A. 主量子数(n)B. 角量子数(l)C. 核电荷数(Z)D. 磁量子数(m_l)答案:C9. 共价键的形成是由于:A. 原子间的引力B. 原子间的排斥力C. 原子间的电子共享D. 原子间的电子转移答案:C10. 以下哪个分子的键角不是109.5°?A. CH4B. BF3C. H2OD. NH3答案:C二、填空题(每题2分,共20分)1. 原子轨道的角量子数l可以取的值范围是0到________。
答案:n-12. 根据洪特规则,电子在轨道中的排布应尽可能使每个轨道中的电子自旋方向________。
答案:相同3. 原子轨道的磁量子数m_l可以取的值范围是________。
答案:-l到+l4. 原子轨道的自旋量子数m_s可以取的值是________。
大学结构化学试题及答案

大学结构化学试题及答案一、选择题(每题2分,共20分)1. 下列哪种元素的原子半径最大?A. 氢B. 氧C. 钠D. 氯答案:C2. 根据价层电子对互斥理论,SO2分子的空间构型是:A. 直线型B. V型C. 三角形D. 四面体答案:B3. 以下化合物中,哪一个是离子化合物?A. HClB. H2OC. NaClD. CH4答案:C4. 元素周期表中,第ⅢA族元素的价电子数是:A. 1B. 2C. 3D. 45. 以下哪种元素的电子排布遵循洪特规则?A. 碳B. 氧C. 氮D. 氖答案:C6. 根据分子轨道理论,N2分子的键级是:A. 1B. 2C. 3D. 4答案:C7. 以下哪种化合物是共价化合物?A. Na2OB. MgOC. H2OD. KOH答案:C8. 根据路易斯酸碱理论,H2O是一个:A. 酸B. 碱C. 两性化合物D. 非酸非碱答案:B9. 以下哪种元素是过渡金属元素?B. 钠C. 铁D. 氦答案:C10. 以下哪种化合物是超分子化合物?A. 苯B. 石墨C. 环己烷D. 冠醚答案:D二、填空题(每题2分,共20分)1. 原子轨道是______的波函数。
答案:单电子2. 金属键是由______电子形成的。
答案:自由3. 根据分子轨道理论,CO分子的键级是______。
答案:34. 元素周期表中,第ⅤA族元素的价电子数是______。
答案:55. 根据价层电子对互斥理论,H2O分子的空间构型是______。
答案:弯曲6. 以下化合物中,______是金属氢化物。
答案:NaH7. 以下哪种化合物是配位化合物?答案:[Cu(NH3)4]SO48. 以下哪种化合物是金属有机化合物?答案:Ti(C5H5)29. 以下哪种元素是稀土元素?答案:镧10. 以下哪种化合物是离子化合物?答案:KCl三、简答题(每题10分,共30分)1. 简述原子轨道的类型及其能量顺序。
答案:原子轨道的类型包括s、p、d、f等,能量顺序一般为1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f。
《结构化学》期末考试试卷附答案

《结构化学》期末考试试卷附答案一、单选题(共15小题,每小题4分,共60分)1、任一自由的实物粒子,其波长为λ,今欲求其能量,须用下列哪个公式( )(A) λch E = (B) 222λm h E = (C) 2) 25.12 (λe E = (D) A ,B ,C 都可以 2、电子在核附近有非零概率密度的原子轨道是( )(A)p 3ψ (B)d 4ψ (C)p 2ψ (D)2s ψ3、用来表示核外某电子运动状态的下列各组量子数 ( n ,l ,m ,m s )中,合理的是( )(A) ( 2, 1, 0, 0 ) (B) ( 0, 0, 0, 1/2 )(B) ( 3, 1, 2, 1/2 ) (D) ( 2, 1, -1, -1/2 )(E) ( 1, 2, 0, 1/2 )4、已知一个电子的量子数 n , l , j , m j 分别为 2,1,3/2,3/2,则该电子的总角动量在磁场方向的分量为 ( ) (A) 2πh (B) 2πh 23 (C) 2π-h 23 (D) 2πh 21 5、氢原子波函数113ψ与下列哪些波函数线性组合后的波函数与ψ300属于同一简并能级:⑴ 023ψ ⑵ 113ψ ⑶ 300ψ下列答案哪一个是正确的? ( )(A ) ⑵ (B ) ⑴, ⑵ (C ) ⑴, ⑶(D ) ⑵, ⑶ (E ) ⑴, ⑵, ⑶6、Cu 的光谱基项为2S 1/2,则它的价电子组态为哪一个? ( )(A) s 1d 10 (B) s 2d 9 (C) s 2d 10 (D) s 1d 9 (E) s 2d 87、H 2 分子的基态波函数是:-----------------------------( )(A) 单重态 (B) 三重态 (C) 二重态 (D) 多重态8、通过变分法计算得到的微观体系的能量总是( )(A) 等于真实基态能量 (B) 大于真实基态能量(C) 不小于真实基态能量 (D) 小于真实基态能量9、对于"分子轨道"的定义,下列叙述中正确的是 ( )(A) 分子中电子在空间运动的波函数(B) 分子中单个电子空间运动的波函数(C) 分子中单电子完全波函数(包括空间运动和自旋运动)(D) 原子轨道线性组合成的新轨道10、下列分子具有偶极矩且不属于 C n v 的分子是 ( )(A) H 2O 2 (B) NH 3 (C) CH 2Cl 2 (D) CH 2═CH 211、下列各组分子中,哪些有极性但无旋光性 ( )(1)I 3- (2)O 3 (3)N 3-分子组:(A) 1,2 (B) 1,3 (C) 2,3 (D) 1,2,3 (E) 212、下列命题中正确者为( )(A) 如构成分子的各类原子均是成双出现的,则此分子必有对称中心(B) 分子中若有C 4,又有i ,则必有σ(C) 凡是平面型分子必然属于C s 群(D) 在任何情况下,2ˆn S =E ˆ 13、2,4,6-三硝基苯酚是平面分子,存在离域π 键,它是 ( )(A) 1612∏ (B) 1814∏ (C) 1816∏ (D) 1616∏ (E) 2016∏14、下列分子中C —O 键长最长的是 ( )(A) CO 2 (B) CO (C) 丙酮15、已知丁二烯的四个π分子轨道为:则其第一激发态的键级P12,P23为何者:(π 键级)( )(A) 2AB,2B2;(B) 4AB,2(A2+B2)(C) 4AB,2(B2-A2) (D) 0,2(B2+A2)(E) 2AB,B2+A2二、简答题(共2小题,每小题20分,共40分)1.比较N2+,N2和N2-键长并说明原因。
结构化学试题库及答案

结构化学试题库及答案1. 请简述原子轨道的概念,并说明s、p、d轨道的形状。
答案:原子轨道是描述电子在原子核外的空间运动状态的数学函数。
s轨道呈球形,p轨道呈哑铃形,d轨道则有四个瓣状结构。
2. 什么是化学键?请列举三种常见的化学键类型。
答案:化学键是相邻原子之间强烈的相互作用,使得原子能够结合在一起形成分子或晶体。
常见的化学键类型包括离子键、共价键和金属键。
3. 描述分子轨道理论的基本原理。
答案:分子轨道理论是基于量子力学的化学键理论,认为分子中的电子不再属于单个原子,而是在整个分子范围内分布,形成分子轨道。
4. 什么是杂化轨道?请举例说明sp3杂化。
答案:杂化轨道是指原子轨道在形成化学键时,由于原子间的相互作用而重新组合成新的等价轨道。
sp3杂化是指一个s轨道和三个p轨道混合形成四个等价的sp3杂化轨道,常见于四面体构型的分子中。
5. 请解释价层电子对互斥理论(VSEPR)。
答案:价层电子对互斥理论是一种用来预测分子几何形状的理论,它基于中心原子周围的价层电子对(包括成键电子对和孤对电子)之间的排斥作用,从而推断出分子的空间几何结构。
6. 什么是超共轭效应?请给出一个例子。
答案:超共轭效应是指在有机分子中,非成键的σ电子与π电子之间的相互作用,这种效应可以增强分子的稳定性。
例如,在乙烷分子中,甲基上的σ电子可以与乙烯的π电子发生超共轭,从而稳定乙烯。
7. 描述共振结构的概念及其在化学中的重要性。
答案:共振结构是指分子中电子分布的两种或多种等效的描述方式,这些描述方式虽然不同,但都能合理地解释分子的性质。
共振结构在化学中的重要性在于它们提供了一种理解分子稳定性和反应活性的方法。
8. 什么是芳香性?请列举三个具有芳香性的化合物。
答案:芳香性是指某些环状有机化合物具有的特殊稳定性,这种稳定性来源于环上的π电子的离域化。
具有芳香性的化合物包括苯、吡啶和呋喃。
9. 请解释什么是分子的极性,并举例说明。
结构化学试题及答案

结构化学试题及答案一、选择题(每题2分,共10分)1. 以下哪个元素的原子核外电子排布遵循泡利不相容原理?A. 氢(H)B. 氦(He)C. 锂(Li)D. 铍(Be)答案:B2. 原子轨道的量子数l代表什么?A. 电子云的形状B. 电子云的径向分布C. 电子云的角动量D. 电子云的自旋答案:C3. 以下哪个化合物是离子化合物?A. 二氧化碳(CO2)B. 氯化钠(NaCl)C. 氮气(N2)D. 水(H2O)答案:B4. 共价键的形成是由于:A. 电子的共享B. 电子的转移C. 电子的排斥D. 电子的吸引答案:A5. 根据分子轨道理论,以下哪个分子是顺磁性的?A. 氮气(N2)B. 氧气(O2)C. 氟气(F2)D. 氢气(H2)答案:B二、填空题(每题2分,共10分)1. 原子轨道的量子数n=1时,可能的l值有______。
答案:02. 碳原子的价电子排布是______。
答案:2s^2 2p^23. 离子键是由______形成的。
答案:电子的转移4. 根据杂化轨道理论,甲烷(CH4)的碳原子采用______杂化。
答案:sp^35. 金属键的形成是由于______。
答案:电子的共享三、简答题(每题5分,共20分)1. 简述价层电子对互斥理论(VSEPR)的基本原理。
答案:价层电子对互斥理论认为,分子的几何构型是由中心原子周围的价层电子对之间的排斥作用决定的,这些电子对可以是成键电子对或孤对电子。
2. 什么是分子轨道理论?答案:分子轨道理论是一种化学理论,它将分子中的电子视为分布在整个分子空间内的轨道上,而不是局限于两个原子之间。
这些分子轨道是由原子轨道线性组合而成的。
3. 描述一下什么是超共轭效应。
答案:超共轭效应是指在有机分子中,通过σ键的π轨道与π键的π轨道之间的相互作用,从而降低π键的能级和增加σ键的稳定性的现象。
4. 什么是路易斯酸碱理论?答案:路易斯酸碱理论认为,酸是能够接受电子对的物种,而碱是能够提供电子对的物种。
大三结构化学考试题及答案

大三结构化学考试题及答案一、选择题(每题2分,共20分)1. 下列元素中,原子半径最大的是:A. NaB. MgC. AlD. Si答案:A2. 以下化合物中,属于共价化合物的是:A. NaClB. NaOHC. CaOD. HCl答案:D3. 原子轨道的径向分布函数描述的是:A. 电子云的形状B. 电子云的密度C. 电子云的分布范围D. 电子云的移动速度答案:C4. 以下分子中,具有平面正方形构型的是:A. CH4B. SF6C. PCl5D. XeF4答案:B5. 根据价层电子对互斥理论,SO4^2-的几何构型是:A. 正四面体B. 正八面体C. 正六边形D. 正四面体答案:B二、填空题(每题2分,共20分)1. 原子轨道的角量子数l=1时,其形状为______。
答案:哑铃形2. 根据分子轨道理论,H2分子的键级为______。
答案:13. 金属晶体中,原子排列最紧密的晶格类型是______。
答案:面心立方4. 根据路易斯酸碱理论,H2O是一个______。
答案:路易斯酸5. 晶体场理论中,d轨道分裂能的大小与______有关。
答案:中心离子的电荷三、简答题(每题10分,共30分)1. 简述离子键和共价键的区别。
答案:离子键是由正负离子之间的静电吸引力形成的,而共价键是由两个原子共享电子对形成的。
2. 描述一下分子轨道理论的基本原理。
答案:分子轨道理论认为分子中的电子不是属于单个原子,而是属于整个分子,分子轨道是原子轨道的线性组合。
3. 什么是配位化合物?请举例说明。
答案:配位化合物是由中心离子(或原子)和围绕它的配体通过配位键结合形成的化合物。
例如,[Cu(NH3)4]SO4是一种配位化合物。
四、计算题(每题15分,共30分)1. 计算NaCl晶体的晶格能。
答案:晶格能计算公式为U = (N * e^2) / (4 * π * ε * r0),其中N为阿伏伽德罗常数,e为电子电荷,ε为介电常数,r0为离子半径。
2023大学_结构化学试题及答案

2023结构化学试题及答案结构化学试题一.选择答案1B 2A 3B 4C 5A 6A 7C 8A 9B 10C11A 12C 13B 14B 15A 16B 17A 18A 19B 20C21A 22C 23B 24B 25B二. 利用结构化学原理,分析并回答问题构成生命的重要物质如蛋白质和核酸等都是由手性分子缩合而成,具有单一手性。
药物分子若有手性中心,作为对映异构体的两种药物分子在这单一手性的受体环境——生物体中进行的`化学反应通常是不同的,从而对人体可能会有完全不同的作用。
许多药物的有效成份只有左旋异构体, 而右旋异构体无效甚至有毒副作用。
所以,药物的不对称合成越来越受到化学家的普遍关注,这类分子通常属于点群Cn和Dn点群,因为这种分子具有手性。
三.辨析概念,用最简洁的文字、公式或实例加以说明1. 若A=a, 则a是算符A的本征值, 是算符A的具有本征值a的本征函数.2. jd1, (ij)i__jd0, (ij)i__四. 填空在丁二烯的电环化反应中,通过分子中点的C2轴在(对)旋过程中会消失,而镜面在(顺)旋过程中会消失。
作为对称性分类依据的对称元素,在反应过程中必须始终不消失。
将分子轨道关联起来时,应使S与(S)相连、A与(A)相连(且相关轨道能量相近);如果这些连线需要交叉,则一条S-S连线只能与另一条(A-A)连线相交,一条A-A连线只能与另一条(S-S)连线相交。
五. 差错并改正错误1. “它描述了电子运动的确切轨迹”。
改正: 它并不描述电子运动的确切轨迹.根据不确定原理, 原子中的电子运动时并没有轨迹确切的轨道.错误2.“原子轨道的正、负号分别代表正、负电荷”。
改正: 原子轨道的正、负号分别代表波函数的位相.错误3. “电子在每一点出现的可能性就增大到原来的C2倍”。
改正: 电子在每一点出现的可能性不变(根据玻恩对波函数物理意义的几率解释).六. 计算题x1111x10211x0100x31x111x1x1x111x0x101(x1)x(x3x2)1__3x2__4x2x1(x1)(__3x1)(x1)0,x11__3x10__3x1令y=__3x3232323224242这个三次方程可用作图法求解:作y~x曲线,然后,作过y=1的水平线与曲线相交,交点的x值即为近似解.为便于作图, 可先取几个点:x=0, y=x3+x2-3x=0x=1, y=x3+x2-3x=-1x=2, y=x3+x2-3x=6x=-1, y=x3+x2-3x=3x=-2, y=x3+x2-3x=2按此法可画出如下曲线. 但对于学生答卷则只要求画出大致图形,求出近似值即可.作过y=1的水平线与曲线相交,交点的x值即为三个近似解.x2 -2.2, x3 -0.3, x4= 1.5x4(1.5) x1(1.0) x3 (-0.3) x2( -2.2)因为E=-x , 而本身为负值. 所以, x越大, 能级越高. 下列顺序就是相应能级的顺序:x4 (1.5) x1(1.0) x3 (-0.3) x2( -2.2)另一等价的做法是:令y=x3+x2-3x-1,作出y~x曲线,求其与x轴的交点,交点的x值即为近似解.结构化学试题答案一.选择答案,以工整的字体填入题号前[ ]内。
2023年湘潭大学化学学院考试大纲

2023年湘潭大学化学学院考试大纲一、根据实验的原理选择仪器和试剂,根据实验的目的决定仪器的排列组装顺序,一般遵循气体制取→除杂(若干装置)→干燥→主体实验→实验产品的保护与尾气处理。
其中除杂与干燥的顺序,若采用溶液除杂则为先净化后干燥。
尾气处理一般采用溶液吸收或将气体点燃。
若制备的物质易水解或易吸收水分及co2气体,如2000年高考题第24题就涉及主产品的保护,应在收集fecl3的装置后除去cl2的装置前连接一个装有干燥剂的装置,以防止主产品fecl3的水解。
二、接口的连接一般应遵循装置的排列顺序。
对于吸收装置,若为洗气瓶则应“长”进(利于杂质的充分吸收)“短”出(利于气体导出),若为盛有碱石灰的干燥管吸收水分和co2,则应“大”进(同样利用co2和水蒸气的充分吸收)“小”出(利于余气的导出),若为排水量气时应“短”进“长”出,排出水的体积即为生成气体的体积。
三、气密性检查凡有制气装置都存在气密性检查问题。
关键是何时进行气密性检查?如何进行气密性检查?显然应在仪器连接完之后,添加药品之前进行气密性检查。
气密性检查的方法虽多种多样,但总的原则是堵死一头,另一头通过导管插入水中,再微热(用掌心或酒精灯)容积较大的玻璃容器,若水中有气泡逸出,停止加热后导管中有一段水柱上升则表示气密性良好,否则须重新组装与调试。
四、防倒吸如何收气体或排水集气的`实验中都要防倒吸。
一般来说防倒吸可分为两种方法:一是在装置中防倒吸(如在装置中加安全瓶或用倒扣的漏斗吸收气体等),例如1993年高考题未冷凝的气体用盛有naoh溶液的倒扣的漏斗吸收,以防倒吸;1996年高考题用排水法收集h2的装置前加装一个安全瓶防倒吸;1992年高考题中用naoh溶液吸收so2,co2前加装一个安全瓶b防倒吸。
一般来说在加热制气并用排水集气或用溶液洗气的实验中,实验结束时应先撤插在溶液中的导管后熄灭酒精灯以防倒吸。
五、事故处理诨学实验过程中由于操作不当或疏忽大意必然导致事故的发生。
《结构化学》期末考试试卷(b) ()

化学本科《结构化学》期末考试试卷(B )(时间120分钟)一、填空题(每小题2分,共20分)1、一维无限深势阱中的粒子,已知处于基态时,在——————处几率密度最大。
2、原子轨道是原子中单电子波函数,每个轨道最多只能容纳——————个电子。
3、O 2的键能比O 2+的键能——————。
4、在极性分子AB 中的一个分子轨道上运动的电子,在A原子的A ψ原子轨道上出现几率为36%,在B 原子的B ψ原子轨道上出现几率为64%, 写出该分子轨道波函数———————————————。
5、分裂能:—————————————————————————————。
6、晶体按对称性分共有—————晶系。
晶体的空间点阵型式有多少种:———。
7、从CsCl 晶体中能抽出—————点阵。
结构基元是:———。
8、对氢原子 1s 态: 2ψ在 r 为_______________处有最高值;9、谐振子模型下,双原子分子振动光谱选律为:_____________________________。
10、晶体场稳定化能:__________________________________________________。
二、选择题(每小题2分,共30分)1、微观粒子的不确定关系,如下哪种表述正确? ( ) (A )坐标和能量无确定值(B )坐标和能量不可能同时有确定值 (C )若坐标准确量很小,则动量有确定值, (D )动量值越不准确,坐标值也越不准确。
2、决定多电子原子轨道的能量的因素是: ( ) (A )n (B)n,l,Z (C)n+0.7l (D)n,m3、氢原子3d 状态轨道角动量沿磁场方向的分量最大值是 (A ) 5 (B ) 4 (C ) 3 (D ) 24、杂化轨道是: ( )(A )两个原子的原子轨道线性组合形成的一组新的原子轨道。
(B )两个分子的分子轨道线性组合形成的一组新的分子轨道。
(A )一个原子的不同类型的原子轨道线性组合形成的一组新的原子轨道。
结构化学考试题库(含具体答案)

结构化学考试题库1第一部分量子力学基础与原子结构一、单项选择题(每小题1分)1.一维势箱解的量子化由来()①人为假定②求解微分方程的结果③由势能函数决定的④由微分方程的边界条件决定的。
答案:④2.下列算符哪个是线性算符()①exp ②▽2③sin④答案:②3.指出下列哪个是合格的波函数(粒子的运动空间为0+)()①sinx②e -x③1/(x-1)④f(x)=e x (0x 1);f(x)=1(x 1)答案:②4.基态氢原子径向分布函数D(r)~r 图表示()①几率随r 的变化②几率密度随r 的变化③单位厚度球壳内电子出现的几率随r 的变化④表示在给定方向角度上,波函数随r 的变化答案:③5.首先提出微观粒子的运动满足测不准原理的科学家是()①薛定谔②狄拉克③海森堡③波恩答案:③6.立方势箱中22810ma hE <时有多少种状态()①11②3③7④2答案:③7.立方势箱在22812ma h E ≤的能量范围内,能级数和状态数为()①5,20②6,6③5,11④6,17答案:③8.下列函数哪个是22dx d 的本征函数()①mxe②sin 2x ③x 2+y 2④(a-x)e -x答案:①9.立方势箱中2287ma h E <时有多少种状态()①11②3③4④2答案:③10.立方势箱中2289ma h E <时有多少种状态()①11②3③4④2答案:③11.已知xe 2是算符x P ˆ的本征函数,相应的本征值为()①ih2②i h 4③4ih ④ i h答案:④12.已知2e 2x 是算符x i ∂∂-的本征函数,相应的本征值为()①-2②-4i③-4ih④-ih/π答案:④13.下列条件不是品优函数必备条件的是()①连续②单值③归一④有限或平方可积答案:③14.下列函数中22dx d ,dx d的共同本征函数是()①coskx②xe-bx③e-ikx④2ikxe-答案:③215.对He +离子而言,实波函数||m nl ψ和复波函数nlm ψ,下列哪个结论不对()①函数表达式相同②E 相同③节面数相同④M 2相同答案:①16.氢原子基态电子几率密度最大的位置在r =()处①0②a 0③∞④2a 0答案:①17.类氢体系m43ψ的简并态有几个()①16②9③7④3答案:①18.对氢原子和类氢离子的量子数l ,下列叙述不正确的是()1l 的取值规定了m 的取值范围2它的取值与体系能量大小有关3它的最大取值由解R 方程决定4它的取值决定了轨道角动量M 的大小答案:②19.对He +离子实波函数py2ψ和复波函数121-ψ,下列结论哪个不对()①Mz 相同②E 相同③M 2相同④节面数相同答案:①20.对氢原子实波函数px2ψ和复波函数211ψ,下列哪个结论不对()①M 2相同②E 相同③节面数相同④Mz 相同答案:④21.He +体系321ψ的径向节面数为()①4②1③2④0答案:④22.Li 2+体系3p ψ的径向节面数为()①4②1③2④0答案:②23.类氢离子体系Ψ310的径向节面数为()①4②1③2④0答案:②24.若l =3,则物理量M z 有多少个取值()①2②3③5④7答案:④25.氢原子的第三激发态是几重简并的()①6②9③12④16答案:④26.由类氢离子薛定谔方程到R ,H ,Ф方程,未采用以下那种手段()①球极坐标变换②变量分离③核固定近似④线性变分法答案:④27.电子自旋是()①具有一种顺时针或逆时针的自转②具有一种类似地球自转的运动③具有一种非空间轨道运动的固有角动量④因实验无法测定,以上说法都不对。
结构化学考试题和答案

结构化学考试题和答案一、单项选择题(每题2分,共20分)1. 原子轨道中,具有相同能量的轨道是:A. s、p、dB. s、p、fC. 2s、2pD. 3s、3p答案:C2. 氢原子的能级是量子化的,其能级由主量子数n决定,下列哪个能级的能量最高?A. n=1B. n=2C. n=3D. n=4答案:D3. 根据分子轨道理论,下列哪个分子是顺磁性的?A. O2B. N2C. COD. H2答案:A4. 以下哪种晶体类型具有各向异性?A. 立方晶体B. 六角晶体C. 正交晶体D. 等轴晶体答案:B5. 根据价层电子对互斥理论,下列哪个分子具有平面三角形结构?A. BF3B. NH3C. H2OD. SO2答案:A6. 以下哪种元素的电负性最高?A. FB. OC. ND. C答案:A7. 以下哪种化学键是离子键?B. Na-ClC. C=CD. H-O答案:B8. 以下哪种化合物的键能最大?A. NaClB. HClC. H2D. NaH答案:A9. 以下哪种分子的偶极矩为零?A. H2OB. CO2D. CH4答案:D10. 以下哪种晶体属于分子晶体?A. NaClB. SiO2C. H2OD. MgO答案:C二、填空题(每题2分,共20分)1. 根据量子力学,原子轨道的波函数ψ描述了电子在空间中______的概率密度。
答案:出现2. 原子轨道的径向分布函数R(r)描述了电子在原子核周围______的概率密度。
答案:距离3. 根据分子轨道理论,分子轨道是由原子轨道通过______作用形成的。
答案:分子形成4. 价层电子对互斥理论中,VSEPR模型预测分子的几何构型,其中“VSEPR”代表______。
答案:价层电子对互斥5. 晶体场理论中,中心离子的d轨道在配体场的作用下发生______分裂。
答案:能级6. 电负性是指原子对______的吸引力。
答案:电子7. 离子晶体中,离子间的相互作用力主要是______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、空间利用率:二、1 52 63 748三、离域分子轨道理论5.21试分析下列分子中的成键情况,比较Cl 的活泼性,说明理由。
H 3CCl ; 2H C=CHCl ; HC CCl ≡ 解:(a )H 3CCl :该分子为CH 4分子的衍生物。
同CH 4分子一样,C 原子也采用3sp 杂化轨道成键。
4个3sp 杂化轨道分别与3个H 原子的1s 轨道及Cl 原子的3p 轨道重叠共形成4个σ键,分呈四面体构型,属3C υ点群。
(b )2H C CHCl =:该分子为22H C CH =分子的衍生物,其成键情况与C 2H 4分子的成键情况既有相同之处又有差别。
在C 2H 3Cl 分子中,C 原子(1)的3个2sp 杂化轨道分别与两个H 原子的1s 轨道和C 原子(2)的2sp 杂化轨道重叠形成3个σ键;C 原子(2)的3个2sp 杂化轨道则分别与H 原子的1s 轨道、Cl 原子的3p 轨道及C 原子(1)的2sp 杂化轨道重叠共形成3个σ键。
此外,两个C 原子和Cl 原子的相互平行的p 轨道重叠形成离域π键43π。
成键情况示于下图:C 2HClHHσσσσσC 2H 3Cl 分子呈平面构型,属于s C 点群。
43π的形成使C Cl -键缩短,Cl 的活泼性下降。
(c )HC CCl ≡:该分子为C 2H 2分子的衍生物。
其成键情况与C 2H 2分子的成键情况也既有相同之处又有差别。
在C 2HCl 分子中,C 原子采取sp 杂化。
C 原子的sp 杂化轨道分别与H 原子的1s 轨道(或Cl 原子的3p 轨道)及另一个C 原子sp 杂化轨道共形成两个σ键。
此外,C 原子和Cl 原子的p 轨道(3个原子各剩2个p 轨道)相互重叠形成两个离域π键:43x π和43y π。
分子呈直线构型,属于C υ∞点群。
两个43π的形成使C 2HCl 中C Cl -键更短,Cl 原子的活泼性更低。
根据以上对成键情况的分析,C Cl -键键长大小次序为: 3232CH Cl C H Cl C HCl >>5.22 试分析下列分子中的成键情况,指出C Cl -键键长大小次序,并说明理由。
65C H Cl 652C H CH Cl ()652C H CHCl ()653C H CCl解:在C 6H 5Cl 分子中,一方面,C 原子相互间通过22sp sp -杂化轨道重叠形成C C -σ键,另一方面,一个C 原子与一个Cl 原子间通过23sp p -轨道重叠形成C Cl -σ键。
此外,6个C 原子和Cl 原子通过p 轨道重叠形成垂直于分子平面的离域π键37π。
由于Cl 原子参与形成离域π键,因而其活性较低。
在C 6H 5CH 2Cl 分子中,苯环上的C 原子仍采用2sp 杂化轨道与周边原子的相关轨道重叠形成σ键,而次甲基上的C 原子则采用3sp 杂化轨道与周边原子的相关轨道重叠形成σ键。
此外,苯环上的6个C 原子相互间通过p 轨道重叠形成离域π键:66π。
在中性分子中,次甲基上的C 原子并不参与形成离域π键,但当Cl 原子被解离后,该C 原子的轨道发生了改组,由3sp 杂化轨道改组为2sp 杂化轨道,此时它就有条件参加形成离域π键。
因此,在[C 6H 5CH 2]+中存在67π。
由于π电子的活动范围扩大了,67π的能量比66π的能量低,这是C 6H 5CH 2Cl 分子中的Cl 原子比C 6H 5Cl 分子中的Cl 原子活性高的另一个原因。
在()652C H CHCl 分子中,苯环上的C 原子采用2sp 杂化轨道与周边原子的相关轨道重叠形成σ键,而非苯环上的C 原子则采用3sp 杂化轨道与周边原子的相关轨道重叠形成σ键。
这些σ键和各原子核构成了分子骨架。
在中性分子中,非苯环上的C 原子不参与形成离域π键,分子中有2个66π。
但当Cl 原子解离后,该C 原子形成σ键所用的杂化轨道由3sp改组为2sp ,于是它就有条件参与共轭,从而在()652C H CH +⎡⎤⎣⎦中形成更大的离域π键1213π。
这使得()652C H CHCl 分子中的Cl 原子更活泼。
在()653C H CCl 分子中,C 原子形成σ键的情形与上述两分子相似。
非苯环上的C 原子也不参与共轭,分子中有3个66π。
但Cl 原子解离后,非苯环上的C 原子改用2sp 杂化轨道形成σ键,剩余的p 轨道与18个C 原子的p 轨道重叠,形成更大更稳定的离域π键1819π,这使得()653C H CCl 分子中的Cl 原子在这4个分子中最活泼。
综上所述,Cl 原子的活泼性次序为:()()65652656523C H Cl C H CH Cl C H CHCl C H CCl >>>5.23 试比较2CO ,CO 和丙酮中C O -键键长大小次序,并说明理由。
解:三个分子中碳-氧键键长大小次序为:丙酮2CO CO >>丙酮分子中的碳-氧键为一般双键,键长最长。
CO 2分子中除形成σ键外还形成两个离域π键43π。
虽然碳-氧键键级也为2,但由于离域π键的生成使键能较大,键长较短,但比一般三键要长。
在CO 分子中,形成一个σ键,一个π键和一个π配键,键级为3,因而碳-氧键键长最短。
丙酮、CO 2和CO 分子中碳-氧键键长分别为121pm ,116pm 和113pm 。
5.24 苯胺的紫外可见光谱和笨差别很大,但其盐酸盐的光谱和苯相近,解释这现象。
解:通常,有机物分子的紫外可见光谱是由π电子在不同能级之间的跃迁产生的。
苯及简单的取代物在紫外可见光谱中出现三个吸收带,按简单HMO 理论,这些吸收带是π电子在最高被占分子轨道和最低空轨道之间跃迁产生的。
苯分子中有离域π键66π,而苯胺分子中有离域π键87π。
两分子的分子轨道数目不同,能级间隔不同,π电子的状态不同,因而紫外可见光谱不同,但在653C H NH Cl 分子中,N原子采用3sp 杂化轨道成键,所形成的离域π键仍为66π,所以其紫外可见光谱和苯相近。
四、前线轨道理论【5.17】用前线轨道理论分析CO 加2H 反应,说明只有使用催化剂该反应才能顺利进行。
解:基态CO 分子的HOMO 和LUMO 分别为3σ和2π,基态H 2分子的HOMO 和LUMO 分别为1s σ和*1s σ。
它们的轮廓图示于图5.17(a )。
COH 22(3)σ*01()sσ0(2)π21()s σ图 CO 和H2的前线轨道轮廓图由图可见,当CO 分子的HOMO 和H 2分子的LUMO 接近时,彼此对称性不匹配;当CO 分子的LUMO 和H 2分子的HOMO 接近时,彼此对称性也不匹配。
因此,尽管在热力学上CO 加H 2(生成烃或含氧化合物)反应能够进行,但实际上,在非催化条件下,该反应难于发生。
CO H 2Ni图5.17(b ) CO 和H 2在Ni 催化剂上轨道叠加和电子转移情况若使用某种过度金属催化剂,则该反应在不太高的温度下即可进行。
以金属Ni 为例,Ni 原子的d 电子转移到H 2分子的LUMO 上,使之成为有电子的分子轨道,该轨道可与CO 分子的LUMO 叠加,电子转移到CO 分子的LUMO 上。
这样,CO 加H 2反应就可顺利进行。
轨道叠加及电子转移情况示于图5.17(b )中。
Ni 原子的d 电子向H 2分子的LUMO 转移的过程即H 2分子的吸附、解离而被活化的过程,它是CO 加H 2反应的关键中间步骤。
【5.18】用前线轨道理论分析加热或光照条件下,环己烯和丁二烯一起进行加成反应的规律。
解:环己烯与丁二烯的加成反应和乙烯与丁二烯的加成反应类似。
在基态时,环己烯的π型HOMO 与丁二烯的π型LUMO 对称性匹配,而环己烯的π型LUMO 与丁二烯的π型HOMO 对称性也匹配。
因此,在加热条件下,两者即可发生加成反应: 前线轨道叠加图示于图5.18中。
丁二烯3LUMOψ2HOMOψHOMOπ*LUMOπ图5.18 环己烯和丁二烯前线轨道叠加图在光照条件下,π电子被激发,两分子激发态的HOMO 与LUMO 对称性不再匹配,因而不能发生加成反应(但可发生其他反应)。
5.19 用前线轨道理论分析乙烯环加成变为环丁烷的反应条件及轨道叠加情况。
解:在加热条件下,乙烯分子处在基态,其HOMO 和LUMO 分别为2p π和#2p π。
当一个分子的HOMO 与另一个分子的LUMO 接近时,对称性不匹配,不能发生环加成反应,如图 5.19(a )。
+++---++--++--2HOMO()p π*2LUMO()pπ*2()LUMOp π*2()HOMOp π图5.19(a) 图5.19(b)但在光照条件下,部分乙烯分子被激发,电子由2pπ轨道跃迁到#2p π轨道,此时#2p π轨道变为HOMO ,与另一乙烯分子的LUMO 对称性匹配,可发生环加成反应生成环丁烷,如图5.19(b )。
五、杂化轨道理论、六、HMO 计算离域化能 1、【5.12】用HMO法解环丙烯正离子()33C H +的离域π键分子轨道波函数,并计算π键键级和C 原子的自由价。
解:(1)()33C H +的骨架如图5.12(a )所示:C 1C 2C 3HH H图5.12(a)按LCAO ,其离域π键分子轨道为:112233i i c c c c ψφφφφ=++=∑式中i φ为参与共轭的C 原子的p 轨道,i c 为变分参数,即分子轨道中C 原子的原子轨道组合系数,其平方表示相应原子轨道对分子轨道的贡献。
按变分法并利用HMO 法的其本假设进行简化,可得组合系数i c 应满足的久期方程:()()()123123123000E c c c c E c c c c E c αβββαβββα-++=⎧⎪+-+=⎨⎪++-=⎩用β除各式并令()/x E αβ=-,则得:123123123000xc c c c xc c c c xc ++=⎧⎪++=⎨⎪++=⎩欲使i c 为非零解,则必须使其系数行列式为零,即:1111011x x x=解此行列式,得:1232,1,1x x x =-== 将x 值代入()/x E αβ=-,得:1232,,E E E αβαβαβ=+=-=-能级及电子分布如图5.12(b )。
E 2=E 3=α-βαE 1=α+2β图5.12(b)将12E αβ=+代入久期方程,得:123123123202020c c c c c c c c c βββββββββ--=⎧⎪-+=⎨⎪+-=⎩解之,得:123c c c ==。
根据归一化条件,2221231c c c ++=,求得:)123123c c c ψφφφ====++将23E E αβ==-代入久期方程,得:123123123000c c c c c c c c c βββββββββ++=⎧⎪++=⎨⎪++=⎩即: 1230c c c ++=利用分子的镜面对称性,可简化计算工作:若考虑分子对过2C 的镜面对称,则有: 1321,2c c c c ==- 根据归一化条件可得:132c c c ===波函数为:)1232ψφφφ=-+若考虑反对称,则132,0c c c =-=。
