北航大学化学习题册参考答案
大学基础化学考试练习题及答案331

大学基础化学考试练习题及答案31.[单选题]氯化亚汞(Hg2Cl2)的俗名是A)皓矾B)升汞C)甘汞D)明矾答案:C解析:2.[单选题]下面四种电解质对于AgI正溶胶的聚沉值最小的是 ( )A)MgCl2B)Na2SO4C)AlCl3D)K3[Fe(CN)6]答案:D解析:3.[单选题]已知Mg(OH)2的Ksp为5.7×10-12,若溶液中Mg2+浓度为1.0×10-4 mol·L-1,OH-浓度为2.0×10-4 mol·L-1,则下列正确的是( )A)有沉淀析出B)无沉淀析出C)为饱和溶液D)无法确定答案:B解析:4.[单选题]下列物质中,可用做水果催熟剂的是 。
A)乙烯B)丙烯C)乙炔D)丙炔答案:A解析:5.[单选题]氢气还原氧化铜的实验过程中,包含四步操作:①加热盛有氧化铜的试管②通入氢气③撤去酒精灯④继续通入氢气直至冷却,正确的操作顺序是()A)①②③④B)②①③④6.[单选题]一定量的某气体,压力增为原来的4倍,绝对温度是原来的2倍,那么气体体积变化的倍数是()。
A)8B)2C)1/2D)1/8答案:C解析:7.[单选题]下列溶液中,加入氯化钡溶液不产生沉淀,再继续加人氢氧化钠溶液后才产生沉淀的是( )A)NaHSO4B)NaNO3C)AgNO3D)NaHCO3答案:D解析:8.[单选题]下列化合物中,属于共轭二烯烃的是A)CH2=CHCH2CH=CH2B)CH2=CH-CH=CH-CH=CH2C)CH2=CH-CH=CH2D)CH2=C=CHCH3答案:C解析:9.[单选题]标准状态下,88g CO2的体积约是( )A)11.2LB)22.4LC)44.2LD)44.8L答案:D解析:10.[单选题]下列气体中,不会造成空气污染的是( )。
A)N2B)NOC)NO211.[单选题]配平下列反应式:FeSO4+HNO3+H2SO4=Fe2(SO4)3+NO↑+H2O,下列答案中系数自左到右正确的是()。
《大学化学》课后习题答案大全

《⼤学化学》课后习题答案⼤全第⼀章课后作业答案1-4.判断下列⼏种说法是否正确,并说明理由。
(1)原⼦是化学变化中最⼩的微粒,它由原⼦核和核外电⼦组成;正确原⼦是化学变化中的最⼩粒⼦。
原⼦是由居于原⼦中⼼的原⼦核和核外电⼦构成,原⼦核⼜由质⼦和中⼦两种粒⼦构成的。
构成原⼦的基本粒⼦是电⼦、质⼦、中⼦。
(2)相对原⼦质量就是⼀个原⼦的质量;错误相对原⼦质量是指以⼀个碳-12原⼦质量的1/12作为标准,任何⼀个原⼦的真实质量与⼀个碳-12原⼦质量的1/12的⽐值。
(3)4g H2和4g O2所含分⼦数⽬相等;错误4g H2含有2mol氧⽓分⼦。
氢⽓相对分⼦质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧⽓分⼦。
氧⽓相对分⼦质量32,4g/(32g/mol)=0.125mol。
所以分⼦数⽬不相等。
(4)0.5mol的铁和0.5mol的铜所含原⼦数相等;正确铁和铜都是由原⼦构成的⾦属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表⽰原⼦数相同。
(5)物质的量就是物质的质量;错误物质的量:表⽰物质所含微粒数(N)(如:分⼦,原⼦等)与阿伏加德罗常数(NA)之⽐,即n=N/NA。
物质的量是⼀个物理量,它表⽰含有⼀定数⽬粒⼦的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置⽽改变,是物质的基本属性之⼀,通常⽤m表⽰物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最⾼?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最⾼,所以尿素的肥效最⾼。
北航研究生固体化学习题解答

③ 有一AB2型立方面心晶体, 问一个晶胞中可能含有多少个A 和多少个B?
④ 某一立方晶系晶体, 晶胞的顶点位置全为A原子占据, 面心 为B原子占据, 体心为C原子占据, 则ⅰ画出晶胞结构, 并写出 该晶体的分子式; ⅱ 写出3种原子的分数坐标; ⅲ 写出该晶体 的空间点阵型式; ⅳ 在晶胞中标注出晶体的结构基元.
⑥ 指出点群C3v和C4h所包含的全部对称操作和子群.
解: C3v={E, L3, L32, Mv1, Mv2, Mv3, [hC=o6(}I;II)(NH2CH2CH2NH2)3]3+
C3v 共有4个子群, 分别是
三乙二胺合钴(III) 离子
G1={E, L3, L32}, G2={E, Mv1}, G3={E, Mv2}, G4={E, Mv3},
C4h
由左图可确定C4h点群的全部对称操作 C4h= {E, L4, L2, L43, Mh, I, L4I, L43I} ;
L21 L23
C4v
D2
L22 E
D2的乘法表
D2
E
L21
L22
L23
E
E
L21
L22
L23
L21
L21
E
L23
L22
L22
L22
L23
E
L21
L23
L23
L22
L21
E
D2对称元素的投影图和对称操作的一般等效点系
ⅱ 晶胞中的A和B分属2套等同点.
AB
素格子P
结构基元
② 平面周期结构按下列平行四边形单位并置重复而成, 试指出 各周期结构的点对称性和二维正当点阵单位.
A
B
C
北航大学化学习题参考答案-前4章

班级学号____________
姓名____________
分数________
1.9 10 11 ln 3.9 10 19 8.314 1500.15 1000.15 J mol -1 1500.15 1000.15
441.6 103 J mol -1 441.6kJ mol -1
K 6.29 1018
4 解 由公式
ΔrG mӨ = 2.303RTlgK Ө ΔrG mӨ(T) =ΔrH mӨ (T)-TΔrS mӨ(T)
可得
H K2 T T2 ln r m 1 R K1 T2T1
依题意 K 2 3.9 10 19 1.9 10 11 , K1
2
习题答卷
班级学号____________
姓名____________
分数________
ΔrHm,4Ө (298.15K)=ΔrHm,1Ө (298.15K)+2ΔrHm,2Ө (298.15K)-ΔrHm,3Ө (298.15K) = 393.5 2 285.8 890.4kJ mol -1
74.7kJ mol -1
4 解 2N2H4 (l) + N 2O 4 (g)= 3N 2 (g) + 4H 2O(l) fHӨm(298.15K)/kJmol-1 50.63 9.16 0 -285.83
则该反应的HӨm(298.15K) = -1253.74 kJmol-1 -1253.74×1000 / 2×32 = 1.96×10 PV=nRT
B
4 1999.1 11 285.83 3 484.5
北航大学化学习题参考答案-前4章汇编
∴ K1 Ө (<464.5K) >1
5
习题答卷 班级学号____________ 姓名____________ 分数________
(3) ΔG Ө (564.5K) ≈ -46.11×103 – (564.5K)×(-99.27) = 9.93 kJ·mol-1 ln K2 Ө (564.5K) = -ΔG Ө (564.5K) / RT = - 9.93×103 / 8.314×564.5= -2.12
74.7kJ mol-1
4解 fHӨm(298.15K)/kJmol-1
2N2H4 (l) + N 2O 4 (g)= 3N2 (g) + 4H 2O (l)
50.63
9.16
0
-285.83
则该反应的HӨm(298.15K) = -1253.74 kJmol-1
-1253.74×1000 / 2×32 = 1.96×104 kJ
习题答卷 班级学号____________ 姓名____________ 分数________
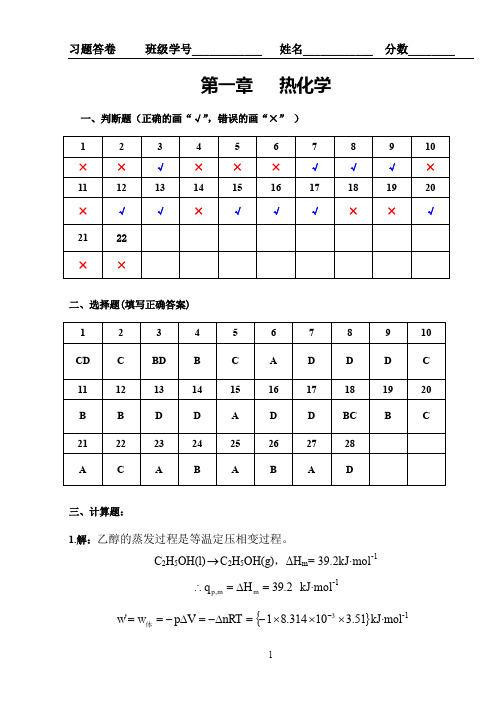
第一章 热化学
一、判断题(正确的画“√”,错误的画“×” )
1
2
3
4
5
6
7
8
9
10
×
×
√
×
×
×
√
√
√
×
11
12
13
14
15
16
17
18
19
20
×
√
√
×
√
√
√
×
×
√
21
22
×
×
二、选择题(填写正确答案)
《大学化学》课后习题答案大全

第一章课后作业答案1-4.判断下列几种说法是否正确,并说明理由。
(1)原子是化学变化中最小的微粒,它由原子核和核外电子组成;正确原子是化学变化中的最小粒子。
原子是由居于原子中心的原子核和核外电子构成,原子核又由质子和中子两种粒子构成的。
构成原子的基本粒子是电子、质子、中子。
(2)相对原子质量就是一个原子的质量;错误相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量与一个碳-12原子质量的1/12的比值。
(3)4g H2和4g O2所含分子数目相等;错误4g H2含有2mol氧气分子。
氢气相对分子质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧气分子。
氧气相对分子质量32,4g/(32g/mol)=0.125mol。
所以分子数目不相等。
(4)0.5mol的铁和0.5mol的铜所含原子数相等;正确铁和铜都是由原子构成的金属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表示原子数相同。
(5)物质的量就是物质的质量;错误物质的量:表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
物质的量是一个物理量,它表示含有一定数目粒子的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置而改变,是物质的基本属性之一,通常用m表示物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最高?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最高,所以尿素的肥效最高。
北京市航空航天大学附属中学2025届化学高二第一学期期末达标检测模拟试题含答案

北京市航空航天大学附属中学2025届化学高二第一学期期末达标检测模拟试题含答案注意事项:1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、常温下,向0.1 mol·L-1Na2SO3溶液中加入少量NaOH固体或加水稀释,下列有关量一定增大的是A.c(Na+) / c(SO32-)的值B.水解常数K hC.水的电离程度D.溶液中c(OH−)•c (H+)2、关于下列过程熵变的判断不正确的是()A.溶解少量食盐于水中,B.纯碳和氧气反应生成C.H2O(g)变成液态水,D.CaCO3(s)加热分解为CaO和CO2(g),3、与3—甲基—1—戊烯同属烯烃且主链为4个碳的同分异构体共有( )A.3种B.4种C.5种D.6种4、随着能源危机影响的加剧,全球寻找新能源的步伐加快。
下列能源中不属于新能源的是()A.生物质能B.天然气C.核聚变能D.潮汐能5、在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%.在下列反应中:①置换反应②化合反应③分解反应④取代反应⑤加成反应⑥消去反应⑦加聚反应⑧乙烯在Ag做催化剂被氧气氧化制环氧乙烷,能体现这一原子最经济原则的是A.①②⑤B.②⑤⑦⑧C.只有②D.只有⑦6、检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是A.硫氰化钾B.硝酸银C.盐酸酸化的氯化钡 D.硝酸酸化的硝酸钡7、已知:(1)Zn(s)+1/2O2(g)====ZnO(s)ΔH=﹣348.3 kJ·2Ag(s)+1/2O2(g)====Ag2O(s)ΔH=﹣31.0 kJ·则Zn(s)+Ag2O(s)====ZnO(s)+2Ag(s)的ΔH等于( )A.﹣317.3 kJ·B.﹣379.3 kJ·C.﹣332.8 kJ·D.+317.3 kJ·8、分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有()A.2种B.3种C.4种D.5种9、区别溶液和胶体最简单的方法A.看外观B.加热C.分析粒子直径大于10-7cm D.发生丁达尔现象10、等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)2Z(g)+W(s) ΔH<0,下列叙述正确的是()A.达到平衡时,X、Y的平衡转化率不同B.升高温度,平衡常数K值增大C.平衡常数K值越大,X的转化率越大D.达到平衡时,反应速率v正(X)=2v逆(Z)11、准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。
大学基础化学考试练习题及答案521

大学基础化学考试练习题及答案51.[单选题]氧化铝(Al2O3)的俗名是A)苦土B)生石灰C)刚玉D)赤铁矿答案:C解析:2.[单选题]下列各溶液中能与氢氧化钠溶液反应,但没有明显现象的是()A)三氧化硫B)硫酸铜溶液C)酚酞试液D)石灰水答案:A解析:3.[单选题]关于反应速率的有效碰撞理论要点,下列说法不正确的是A)为了发生化学反应,反应物分子必须碰撞B)只有具有足够高的能量的哪些分子的碰撞才能发生反应C)对活化分子不需要具备一定的能量D)只有沿着特定方向碰撞才能发生反应答案:C解析:4.[单选题]用基准物草酸钠标定高锰酸钾的反应是()。
A)沉淀滴定法B)配位滴定法C)酸碱滴定定法D)氧化还原滴定法答案:D解析:5.[单选题]禁用工业酒精配制饮用酒,是因为工业酒精中含有( )A)甲醇B)乙醇C)丙醇D)丙三醇6.[单选题]人体血液中的缓冲对不包括( )A)H2CO3-NaHCO3B)NaOH- HClC)NaH2PO4- Na2HPO4D)H2CO3-KHCO3答案:B解析:7.[单选题]下列物质中,不能用高锰酸钾溶液检验的是 。
A)乙烷B)乙烯C)乙炔D)甲苯答案:A解析:8.[单选题]2NO+O2=2NO2+Q反应已达到平衡状态。
若使平衡向右移动,可采取的措施是()A)增加NO2B)将NO引出体系C)降低温度D)增大压强答案:D解析:9.[单选题]下列哪一个化合物易溶于碳酸氢钠A)苯甲酸B)苯酚C)对-甲基苯酚D)β-萘酚答案:A解析:10.[单选题]下列哪种物质与HBr发生加成反应须遵守马氏规则A)CH3CH=CHCH3B)(CH3)2C=C(CH3)2C)CH2 = CH2D)CH3CH=CH2答案:D解析:B)硝石C)火硝D)大苏打答案:A解析:12.[单选题]某烃的分子式为C5H12,其构造异构体有A)2种B)3种C)4种D)5种答案:B解析:13.[单选题]不属于乙醇化学性质的是( )A)可与金属钠反应B)能发生加成反应C)可被氧化成乙醛D)可与乙酸发生酯化反应答案:B解析:14.[单选题]实验过程产生的剧毒药品废液,说法错误的是:( )A)妥善保管B)不得随意丢弃、掩埋C)集中保存,统一处理D)稀释后用大量水冲净答案:D解析:15.[单选题]国际上常用 的产量来衡量一个国家的石油化学工业水平。
北航研究生固体化学习题解答

z
x ' 0 x 1 y 0z
y ' 1 x 0 y 0z
z ' 0 x 0 y 1z
0 1 0 M 1 0 0 0 0 1
P=(x, y, z)
r
x
y
=45o
O
y P’(y, x, z) x P(x, y, z)
③ 指出下列分子的全部对称元素和所属点群, 并依据对称性 判断哪些分子是极性分子, 哪些是非极性分子. (1) CH2F2 (2) 1, 3, 5—三氯苯 (3) 邻苯二酚 (4) 间苯二酚 (5)
③ 指出下列分子的全部对称元素和所属点群, 并依据对称性 判断哪些分子是极性分子, 哪些是非极性分子. (1) CH2F2 (2) 1, 3, 5—三氯苯 (3) 邻苯二酚 (4) 间苯二酚 (5) 对苯二酚
④ 一个AB3型分子有一三重轴, 实验测得其偶极矩为零, 判断该 分子所属点群.
⑤ 指出属于下列点群的分子是否为手性分子
间点阵型是: ⑴ 立方P; ⑵ 立方I ; ⑶ 立方F ; ⑷ 不能确定;ⅱ 画出晶体的结构基元.
《固体化学》习题二 ① 有一AB型晶体, 晶胞中的A和B的分数坐标分别为 (0, 0, 0) 和 (1/2, 1/2, 1/2) 试指出该晶体的空间点阵型式和晶胞中不同等同
点的套数.
解: ⅰ 该晶体的空间点阵型式是素格子P, 所属晶系取决于特征 对称元素, 若晶体的特征对称元素为1×4 , 则空间点阵型式为tP;
C4h={E, L4, L42, L43 , EMh=Mh, L4Mh , L42Mh=I, L43Mh, h=8 };
C4h共有5个子群, 分别是
G1={E, L4, L42, L43}, G2={E, L42}, G3={E, Mh}, G4={E, I}, G5={ (L4Mh)i , i=1, 2, 3, 4 L4Mh , L2 , L43Mh , E}. ={L4I , L2 , L43I , E}? 答: 因G5和G6两个子群同构, 故G6不是一个独立的子群. ⑦ 判断下列论述是否正确, 说明结论理由. 问题: C4h是否还有一个子群G6={ (L4I)i , i=1, 2, 3, 4}
北航考研化学真题答案

北航考研化学真题答案北航考研化学真题答案在考研备考的过程中,掌握历年真题是非常重要的一部分。
本文将为大家提供一些关于北航考研化学真题的答案,希望能够帮助到正在备考的同学们。
首先,我们来看一道选择题的答案。
这道题目是关于有机化学的,题目如下:1. 下列化合物中,不具有手性中心的是:A. 丙烯醛B. 丙酮C. 乙醛D. 乙酮正确答案是B. 丙酮。
丙酮是一个酮类化合物,没有手性中心,因此不具有手性。
接下来,我们来看一道计算题的答案。
这道题目是关于化学计量的,题目如下:2. 在化学反应中,若氧化剂的化学当量为1.5mol/L,还原剂的化学当量为0.5mol/L,当氧化剂和还原剂的摩尔比为2:1时,求氧化剂和还原剂的质量比。
解答:根据题目中给出的摩尔比,氧化剂的化学当量为1.5mol/L,还原剂的化学当量为0.5mol/L,将两者的摩尔比转化为质量比需要知道它们的摩尔质量。
假设氧化剂的摩尔质量为M1,还原剂的摩尔质量为M2,则氧化剂和还原剂的质量比为M1:M2。
根据化学当量的定义,化学当量等于摩尔质量除以化学当量的单位。
因此,氧化剂的化学当量等于M1/1.5mol/L,还原剂的化学当量等于M2/0.5mol/L。
根据题目中给出的摩尔比,可以得到以下等式:(1.5mol/L)/(0.5mol/L) = 2/1将上面两个等式联立,可以解得氧化剂和还原剂的质量比为M1:M2 = 3:1。
通过以上计算,我们得出了氧化剂和还原剂的质量比为3:1。
最后,我们来看一道解答题的答案。
这道题目是关于化学动力学的,题目如下:3. 请解释化学反应速率与反应物浓度的关系。
解答:根据化学动力学的研究,化学反应速率与反应物浓度之间存在着一定的关系。
在一般情况下,反应物浓度越高,反应速率也越快。
这是因为反应物分子之间的碰撞是引发化学反应的基本原因。
当反应物浓度增加时,反应物分子之间的碰撞频率也会增加,从而增加了反应物分子发生有效碰撞的概率。
大学化学:练习册习题及答案第三章

第三章水化学一.判断题(正确的画“∨”,错误的画“×”)1.单组分系统必定是单相系统。
2.多组分系统必定是多相系统。
3.在一封闭系统中,一定温度下当H2O(l) H2O(g) 达成平衡,如果系统的体积减小为原来的1/2,则蒸气压增大2倍。
4.在蔗糖水溶液、冰、水蒸气、氧气、氮气组成的系统中,有3个相,4种组分。
5.巳知两种弱酸溶液的pH值相同,而氢离子浓度不相同。
6.在H2S饱和的水溶液中c(S2-)=1/2c(H+)。
7.某共轭酸给出质子的能力强,是强酸,则其共轭碱必定是弱碱。
8.弱酸的K a值愈小,酸性愈弱,其盐的水解度愈大。
9.BaSO4在水中的溶解度大于在硫酸溶液中的溶解度。
10.在Mg(OH)2在0.1mol·L-1NaOH溶液中其溶解度S=K sp·10-2。
11.巳知AgCl的K sp=1.56×10-10>Ag2CrO4的K sp=9×10-12,所以AgCl在水中的溶解度大于Ag2CrO4。
12.加入过量的酸或碱到缓冲溶液中,溶液的pH值也会保持不变。
13.某缓冲溶液共轭酸浓度等于其共轭碱的浓度时,该溶液的c(H+)=K a。
14.二元弱酸的水溶液,H+主要来源于一级解离。
15.弱酸的共轭阴离子是弱碱。
16.在含有Cl-和I-的溶液中,加入沉淀剂AgNO3,首先沉淀的是K sp大的AgCl。
17.巳知BaCrO4、CaF2和AgI的溶度积分别为1.6×10-10、3.4×10-11和1.6×10-16,则它们在水中的溶解度从大到小的顺序为:S (BaCrO4) > S (CaF2) >S(AgI)。
18.0.1mol·L-1NaCl和0.1mol·L-1NaNO3,其浓度相同,溶液蒸气压降低值不相等。
19.对于难溶电解质的多相离子平衡系统来说,其溶液是稀的未饱和溶液。
基础化学课后习题答案

基础化学课后习题答案在基础化学课后习题中,通常会涉及到化学反应原理、化学计量学、化学键、物质的分类、化学平衡、溶液的浓度计算等方面的问题。
以下是一些基础化学课后习题的典型答案示例:1. 化学反应原理- 题目:解释为什么铁在氧气中燃烧会产生火花?- 答案:铁在氧气中燃烧是一个氧化反应。
当铁与氧气接触时,铁原子失去电子形成Fe²⁺或Fe³⁺离子,而氧气获得电子形成O²⁻离子。
这个过程中释放出大量的能量,表现为火花和热量。
2. 化学计量学- 题目:计算2摩尔的氢气(H₂)与1摩尔的氧气(O₂)反应生成水的摩尔数。
- 答案:根据化学方程式 \(2H_2 + O_2 \rightarrow 2H_2O\),2摩尔的氢气与1摩尔的氧气完全反应生成2摩尔的水。
3. 化学键- 题目:描述离子键和共价键的区别。
- 答案:离子键是由正负离子之间的静电吸引力形成的,通常存在于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
4. 物质的分类- 题目:区分纯净物和混合物。
- 答案:纯净物是由单一物质组成的,具有固定的化学组成和性质。
混合物则是由两种或两种以上的物质混合而成,没有固定的化学组成。
5. 化学平衡- 题目:解释勒夏特列原理。
- 答案:勒夏特列原理指出,如果一个处于平衡状态的化学反应系统受到外部条件的改变(如温度、压力或浓度的变化),系统会自动调整以减少这种改变的影响,从而重新达到平衡状态。
6. 溶液的浓度计算- 题目:如果将50毫升的0.1摩尔/升的盐酸溶液稀释到200毫升,计算稀释后的浓度。
- 答案:稀释前后溶质的物质的量不变。
稀释前的盐酸物质的量为\(50 \text{ mL} \times 0.1 \text{ mol/L} = 5 \text{ mmol}\)。
稀释后的浓度为 \(5 \text{ mmol} / 200 \text{ mL} = 0.025\text{ mol/L}\)。
大学化学复习题 答案.doc

b. HCIc.CCI4d.BF3a. KCI 大学化学复习题+答案《大学化学》复习题答案一、是非题:请在各题括号中,用“丿”、“X”分别表示题文中叙述是否正确。
(J ) 1.电子云是描述核外某空间电子出现的几率密度的概念。
(7)2.同种原子之间的化学键的键长越短,其键能越大,化学键也越稳定。
(V )3•系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和恰的变化量均为零。
(V ) 4. AgCI在NaCI溶液中的溶解度比在纯水中的溶解度小。
(X ) 5.原子轨道的形状由量子数m决定,轨道的空间伸展方向由I决定。
二、选择题(1)某元素原子基态的电子构型为Is22s22p63s23p5,它在周期表中的位置是:aa.p区VHA族b. s区IIA族c. ds区II B族d. p区VI族(2)下列物质中,哪个是非极性分子:ba.H20b. C02c. HCId. NH3(3)极性共价化合物的实例是:b2H2(g) + O2(g) = 2H2O(l) 贝lj H20(l)的ZHm® 为:d a. 572 kJ • mol— 1c. 286 kJ • mol— 1ArH m® = -572 kJ • mol-1b.-572 kJ • mol— 1d. -286 kJ •mol— 1a. A rHml ® + ArHm2 ®A rHml ® — A rHm2A rHml ® +2 A rHm2 ® A rHm2 ® — A rHmla.02b. Pt,c. Si02d. KCI(5)在298K, lOOkPa 下,反应(6)定温定压下,已知反应B=A的反应热为△rHml®,反应B = C的反应热为△rHm2®,则反应A=C的反应热△rHm3®为:d1(7)已知HF (g)的标准生成热△fHm=-565 kJ • mol-1,则反应H2(g)+F2(g)=2HF(g)O的△rHm® 为:da. 565 kJ • mol-1b. -565 kJ • mol-1c.1130 kJ • mol-1d. -1130 kJ • mol-1(8)在氨水溶液中加入固体NH4CI后,氨水的离解度:da.没变化b.微有上升c.剧烈上升d.下降(9)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得a. NaCI NaAc FeCI3 KCN多,这主要由于NH3: ca.分子量最小b.取向力最强c.存在氢键d.诱导力强(10)在一定条件下,一可逆反应其正反应的平衡常数与逆反应的平衡常数关系是:ca.它们总是相等b.它们的和等于1c.它们的积等于1d.它们没有关系(11)下列反应及其平衡常数H2(g) + S(s)=H2S(g) K1® ;S(s)+O2(g)=SO2(g) K2 ® ,则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数K ®是:da. KI® +K2®b. K10-K2®c. K1®XK2®.d.KI® 4-K2®(12)在298K时石墨的标准摩尔生成焙△fHm®为:ca. 大于零b. 小于零c.等于零d.无法确定(13)不合理的一套量子数(n, I, m, ms)是:ba. 4, 0, 0, + b・ 4, 0, —1,-c. 4, 3, +3, - d・ 4, 2, 0, +(14)向HAc溶液中,加入少许固体物质,使HAc离解度减小的是:(15)NH3溶于水后,分子间产生的作用力有:d212121212c.诱导力和色散力d.取向力、色散力、诱导力及氢键(16)25°C 时,Mg(0H)2 的Ksp® 为1.2X10-11,在O.Olmol • L—1的NaOH溶液中的溶解度为:ca. 1.2X10-9 mol • L-lb. 2.4X10-9 mol • L-1c. 1.2X10-7 mol • L-ld. 1.7X10-5 mol • L -1(17)已知E©(Fe3+/Fe2+) = 0.770V, E©(Cu2+/Cu) = 0.340V,则反应2Fe3+(lmol *L—l)+Cu = 2Fe2+(lmol • L—1) + Cu2+(lmol • L—1)可以:ba.呈平衡状态b.自发正向进行c.自发逆向进行d.前三者都错(18)已知Fe3++e = Fe2+, E© = 0.770V,测定一个Fe3+/Fe2+ 电极电势E= 0.750 V,则溶液中必定是:da. c(Fe3+)<lb. c( Fe2+)<1c. c( Fe2+)/ c(Fe3+)<ld. c(Fe3+)/ c( Fe2+)<1(19)角量子数丨描述核外电子运动状态的:ca.电子能量高低;b.电子自旋方向;c.电子云形状;d.电子云的空间伸展方向;(20)以下各组物质可做缓冲对的是:ac. HAc—H2SO4d. NaOH—NH3 ・ H2O三、填空题1.写出具有下列指定量子数的原子轨道符号:A. n=4, 1=1 ____ 4p _______B. n=5, 1=2 ______ 5d _____2.写出下列原子在基态时的电子排布(1). Mn: Is22s22p63s23p63d54s2; (2).Fe __ I s22s22p63s23p63d64s2;3.等性sp2、sp3杂化轨道的夹角分别为_120 ______ ._109.5 ___ .4.在定温定压下已知反应A=3B的反应热为△rHml®,反应3A=C的反应热为△rHm2®,则反应9B=C的反应热△rHm3®为(△rHm2®-3 A rHml ®)。
2014年北航高分子化学试题A(final)及参考答案

烯酸甲酯,而自由基聚合一般只能制备无规结构的聚甲基丙烯酸甲酯;对于聚甲基丙烯
酸甲酯的无规结构、全同结构和间同结构,在稀碱中水解时,水解速率从大到小的顺序
是
>
>
;这表明聚合物基团化学反应的
效应。
3【8 分】
环氧乙烷在甲醇钠引发下进行的活性阴离子开环聚合,欲结束聚合,必须人为加入
使活性链失活;加入乙醇会发生
(2)【17 分】 聚苯乙烯可以由自由基聚合、阴离子聚合或阳离子聚合制备。苯乙烯自由基本体聚
合时,具有
、
和
的机理特征,其中
是控
制速率的步骤,这也是自由基聚合难以实现活性聚合的原因;在低转化率条件下,聚合
速率的微观动力学方程是
,
要得到以上方程,需要满足
、
、
、和
四
个假设。苯乙烯活性阴离子聚合时,聚合显示
(5)【6 分】 聚苯乙烯脆性比较大,可以通过聚丁二烯接枝聚苯乙烯合成高抗冲击性聚苯乙烯。
在自由基接枝反应中,在正己烷中阴离子聚合制备的聚丁二烯比在四氢呋喃中阴离子聚
合制备的聚丁二烯
(更容易或更难?)。产生接枝点的反应有三类,依照反应
速率常数依次减小的顺序,分别是
,
,和
。(可以描述,也可以画反应式)
何改性得到,聚合物 B 是如何制备的;图(b)中聚合物 C 是如何改性得到,聚合物 D 是如何制备的?(写出各步骤,须指明各步骤的单体、引发剂、溶剂、终止剂等条件)
(a) (b)
5
(9)【7 分】
分别应用活性阴离子聚合和活性自由基聚合来制备下列篏段共聚物,
(苯乙烯)x-(甲基丙烯酸甲酯)y-(苯乙烯)x
(6)【6 分】 苯乙烯是不饱和聚酯树脂的稀释剂和共固化剂。不饱和聚酯是由乙二醇、邻苯二酸
大学基础化学课后习题解答(1)

⼤学基础化学课后习题解答(1)⼤学基础化学课后习题解答第⼀章溶液和胶体溶液第⼆章化学热⼒学基础2-1 什么是状态函数?它有什么重要特点?2-2 什么叫热⼒学能、焓、熵和⾃由能?符号H 、S 、G 、?H 、?S 、?G 、θf m H ?、θc m H ?、θf m G ?、θr m H ?、θm S 、θr m S ?、θr m G ?各代表什么意义? 2-3 什么是⾃由能判据?其应⽤条件是什么?2-4 判断下列说法是否正确,并说明理由。
(1)指定单质的θf m G ?、θf m H ?、θm S 皆为零。
(2)298.15K 时,反应 O 2(g) +S(g) = SO 2(g) 的θr m G ?、θr m H ?、θr m S ?分别等于SO 2(g)的θf m G ?、θf m H ?、θm S 。
(3)θr m G ?<0的反应必能⾃发进⾏。
2-5 298.15K 和标准状态下,HgO 在开⼝容器中加热分解,若吸热22.7kJ 可形成Hg (l )50.10g ,求该反应的θr m H ?。
若在密闭的容器中反应,⽣成同样量的Hg (l )需吸热多少?解:HgO= Hg(l)+1/2O 2(g)θr m H ?=22.7×200.6/50.1=90.89 kJ·mol -1 Qv=Qp-nRT=89.65 kJ·mol -1 2-6 随温度升⾼,反应(1):2M(s)+O 2(g) =2MO(s)和反应(2):2C(s) +O 2(g) =2CO(g)的摩尔吉布斯⾃由能升⾼的为 (1) ,降低的为 (2) ,因此,⾦属氧化物MO 被硫还原反应2MO(s)+C(s) =M(s)+ CO(g)在⾼温条件下正向⾃发。
2-7 热⼒学第⼀定律说明热⼒学能变化与热和功的关系。
此关系只适⽤于:A.理想⽓体;B.封闭系统;C.孤⽴系统;D.敞开系统2-8 纯液体在其正常沸点时⽓化,该过程中增⼤的量是:A.蒸⽓压;B.汽化热;C.熵;D.吉布斯⾃由能2-9 在298K 时,反应N 2(g)+3H 2(g) = 2NH 3(g),θr m H ?<0则标准状态下该反应A.任何温度下均⾃发进⾏;B.任何温度下均不能⾃发进⾏;C.⾼温⾃发;D.低温⾃发2-10 298K ,标准状态下,1.00g ⾦属镁在定压条件下完全燃烧⽣成MgO(s),放热24.7kJ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
起始时物质的量 /mol 平衡时物质的量 /mol
8.0 8.0-x
4.0 4.0-x/2
0 x
在恒温恒容条件下,系统总压与系统的总物质的量成正比。 故
根据分压定律,各气体平衡时的分压分别为
2、解: (1) f
H m (298.15k)
(KJ)
(298.15k) m (KJ)
SiO2(s) -910.94
8 √ 18 √ 28 × 38 ×
9 × 19 √ 29 × 39 ×
10 √ 20 × 30 × 40 √
二、选择题(填写正确答案A、B或……)
1 C 11 B 21 A 31 D 41 B
2 A 12 C 22 A 32 D 42 C
3 C 13 A 23 AC 33 A 43 B
4 A 14 C 24 BC 34 B 44 D
21
×
22
√
23
×
24
√
25
×
26
×
27
×
28
×
二、选择题(填写正确答案A、B或……) 1 D 11 A 21 2 C 12 D 22 3 C 13 C 23 4 D 14 C 24 5 C 15 C 25 6 C 16 D 26 7 A 17 C 27 8 D 18 A 28 9 B 19 C 29 10 B 20 C 30
大学化学
习题册(1-4章) 参考答案
第一章 热化学
一、判断题(正确的画“√”,错误的画“×”)
1 × 11 ×
2 × 12 ×
3 × 13 ×
4 × 14 √
5 × 15 √
6 √ 16 √
7 √ 17 ×
8 √ 18 ×
9 √ 19 √
10 × 20 ×
二、选择题(填写正确答案)
少选得分, 多选无分
第二章 化学反应的基本原理
一、判断题(正确的画“√”,错误的画“×”)
1 √ 11 × 21 × 31 ×
2 × 12 × 22 √ 32 ×
3 √ 13 × 23 × 33 ×
4 × 14 × 24 √ 34 √
5 × 15 × 25 √ 35 ×
6 × 16 × 26 × 36 √
7 √ 17 × 27 × 37 ×
D
B
BC
C
B
C
C
AB C
A
C
三、原电池图示练习
A. () Pt I 2 ( s), I Fe3 (aq), Fe 2 (aq) Pt () B. C.
() Pt Sn2 (aq), Sn 4 (aq) CrO72 (aq), Cr 3 (aq), H Pt ()
()Co Co2 (aq) Cl (aq) Cl2 ( g ) Pt ()
B
C2H4(g) + 3O2(g)→ 2CO2(g) + 2H2O(l)
△fHmθ(KJ.mol-1) 52.26 0 -393.509 -285.83
△rHmθ=∑νB △fHmθ=(-393.509) ×2+(-285.83) ×2-52.26
B
=-1410.938 (KJ.mol-1)
负号,放热: ︱乙烯△rHmθ ︱ >︱乙炔△rHmθ ︱ 所以同物质的量的乙炔和乙烯充分燃烧生成液态水时乙烯放出的热量多。
四、填空
1、A、0.235 2、3.9×10-5 4、 0.57
B、-45.3
C、8.8×107 3、0.104 5、1.66
D、1.07×10-4
6、(1) (3) (5) (7)
1.18×10-2 4.7 2.0× 10-5 0
(2) -0.28 (4) 2.0×10-5 (6) -104 (8) 6.17×1025
2 CD B 16 17 B C
1
3 A 18 C
4 D 19 A
5 D 20 D
6 D 21 D
7 8 9 10 D BC A D 22 23 24 25 B B A B
11 C 26 B
12 B 27 B
13 B 28 D
14 C 29 B
15 A 30 A
三、计算题 1、解: C6H6(l) + 15/2O2(g) = 6CO2(g) + 3H2O(l) Cv(H2O)=4.18J/(g.k) C总=1230J.K-1
25 26 27 28 29 30 31 32 33 34
× √
√
√
√
√
√
√
√
√
二、选择题(填写正确答案A、B或……)
1 A 11 B 21 B 31 C 41 A
2 3 C B 12 13 C C 22 23 B C 32 33 A C 42 43 CD AD
4 A 14 B 24 AD 34 D 44 B
+
2C(石墨) == Si(s) 0 0
+ 2CO -110.525
S
41.84
5.740
18.83
197.674
△rGmθ=△rH mθ -T△rSmθ
△rH mθ =2×(-110.525)+0-0-(-910.94)=689.89(KJ)
△rSmθ=2×197.674+18.83-2×5.740-41.84 = 0.361(KJ/mol.k)
依题意知道反应前后温差△T=23.43-21.30=2.13(K)
0.500g苯燃烧释放的热量 q1 =[Cv(H2O).m(H2O)+ C总] △T =[4.18×2050+1230] ×2.13 =20871.87(J)=20.87(KJ)
已知 M(C6H6)=78g/mol
78 78 0.500g C6H6 燃烧时,qv = q1 × =20871.87 × 0.500 0.500
5 B 15 B 25 B 35 A 45 B
6 D 16 A 26 D 36 B 46 D
7 D 17 D 27 A 37 A 47 B
8 B 18 A 28 A 38 A 48 A
9 B 19 BC 29 B 39 D 49 C
10 D 20 A 30 B 40 B 50 A
三、计算题
1、解: 设平衡时SO3的物质的量为x mol
G m (T ) = -39.57 ln K RT
Kθ=6.5×10-18
第三章
水化学
一、判断题ห้องสมุดไป่ตู้正确的画“√”,错误的画“×”)
1
2
3
4
5
6
7
8 √
9 √
10 11 12 × × ×
× × × √
× × √
13 14 15 16 17 18 19 20 21 22 23 24
√ √ × × × √ × √ √ × √ √
3. 4
4.(1)基本不变
=10
(2)减小 (3)减小 (4)降低
第四章
1 √ 11 √ 2 × 12 × 3 × 13 √ 4 √ 14 × 5 √ 15 √
电化学
6 √ 16 × 7 × 17 × 8 × 18 × 9 √ 19 × 10 × 20 √
一、判断题(正确的画“√”,错误的画“×”)
= 3.256 ×103(KJ)
2、解:
△fHmθ(KJ.mol-1)
C2H2(g) + 5/2O2(g)→ 2CO2(g) + H2O(l)
226.73 0 -393.509 -285.83
△rHmθ=∑νB △fHmθ=(-285.83)+(-393.509) ×2-226.73=-1299.578 (KJ.mol-1)
5 A 15 B 25 C 35 D 45 BC
6 B 16 C 26 B 36 B 46 A
7 C 17 B 27 B 37 D
8 A 18 A 28 C 38 D
9 B 19 A 29 D 39 D
10 B 20 C 30 D 40 BD
三、填空题
1. 0.2mol/L 中 2. HCl,H2S 1.9 ×10-3mol/L 碱 AC- ,NO2-,CO32H2PO4,H2O, HS-
△G
r
θ m =689.89-298.15×0.361=582.258(KJ/mol)>0
不能自发进行。 (2) 自发反应时△rGmθ<0且△rSmθ>0 得T>1911.80K
r H m (298.15K ) T> r Sm (298.15K )
(3) △rGmθ(T) = △H mθ(298.15k) -T△Smθ (298.15k)
