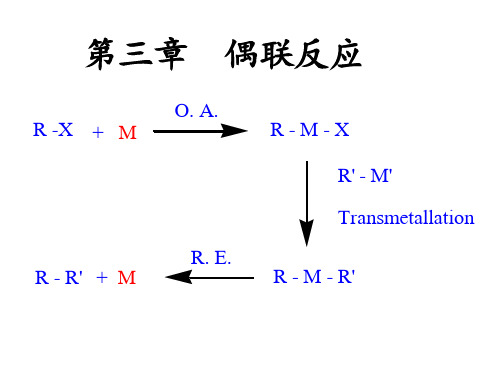
3金属有机试剂参与的反应
有机化学反应概要(修订版)

1. Friedel-Crafts 酰化反应(Friedel-Crafts Acylation )酰基正离子、当量催化剂、不可逆、少重排、I>Br>Cl>F 、一元取代。
2. Friedel-Crafts 烷化反应(Friedel-Crafts Alkylation )碳正离子、催化量催化剂、可逆、多重排、F>Cl>Br>I 、多元取代。
3. Gattermann 和Gattermann-Koch 甲酰化反应(Gattermann and Gattermann-Koch Formylation ) 用CO 、HCl 、Lewis 酸将芳环甲酰化(Gattermann-Koch 反应):CO,H Cl AlCl 3C H O当芳环上有吸电子基团时,反应不能发生。
也可用HCN 、HCl进行甲酰化,先生成亚胺,然后水解得醛(Gattermann 反应):HCN,HCl AlCl 3NH OH 2CHO4. Houben-Hoesch 反应用腈作为亲电试剂对活化的芳环进行亲电取代,产物亚胺水解得到芳环的酰基化产物,可以防止因芳环活性很高造成的多取代。
5. Kolbe-Schmidt 反应CO 2作为亲电试剂,可以对活化的芳环进行亲电取代,生成芳香羧酸。
一般是在绝对无水、高压的CO 2条件下,用酚盐参与反应。
由于在反应中酚盐的金属离子被酚氧基、CO 2络合,故金属离子的体积对于取代位点的控制很重要。
一般说来,大离子利于对位取代,小离子利于邻位取代。
6. Reimer-Tiemann 反应CHCl 3在碱作用下发生α-消除生成二氯卡宾,后者作为缺电子的亲电试剂对活泼的酚芳环进行亲电取代,水解得到甲酰化产物:CHCl 3OH-C ClCl O-OC -ClClHH+~C -OClCl Cl--OClO H 2H+-O-Cl OHCl--OO H H+~OHOH7. Snieckus 定向邻位金属化反应(Snieckus Directed Ortho Metalation )苯环上有含杂原子的取代基时,用RLi 进行金属化,Li 可以被诱导这些取代基的邻位。
金属参与的现代有机合成反应(麻生明)课件class no. 3
Br
R
Ph Pd(PPh 3)4
R (17)
H
COOR Kto3luPeOn4e-3, H1020OoC
H COOR
Ph
O CONMe 2 CH 2N2/Pd(OAc) 2
Ph
B
O CONMe 2
Et2O
O CONMe 2 B
O CONMe 2
H2O
Ph
Pd(PPh 3)4
Ph
B(OH) 2
Kto3luPeOn4e-3, H1020OoC
8
Ph
9%
Bu
Ph 9
RPdXLn + NaOMe RH + PdL4
RPdOMeLn - CH2O
RPdHLn
Hex
Cl
+
BX2
Cl
Cl PdY (PPh3)2
Hex Cl
Cl
Cl
(9)
10
11
12
Y = OAc, OMe
Yes
Cl
No
RX Pd (0)
R'' R
16
RP dXL2 13
R'' 15 PdRL2
[ Pd ] LiCl
(36)
1. LDA 2. Tf2NPh
OT f
Me3Sn SiMe 3
SiMe 3
O
91 %
95:5
PdL4, LiCl 100 %
95:5 29
1. i-Pr2NMgBr 2. Tf2NPh
OT f
Me3Sn
SiMe 3
SiMe 3
63 %
97:3
PdL4, LiCl
金属参与的现代有机合成反应(麻生明)课件ClassNo.7

E+
H RE
H
56
H R SnB3u
PdH
54
7.6.5镁 氢 化 反 应
R
R'
57
1. i-BuMgBr ca.t Cp2TiCl2
2. E+
H R E (11)
R' 58
E+ = H2O,D2O,I2, MeI, RCHO
R, R'=Me, Ph; n-Bu,Me3Si; Me3Si, Ph
1 . E t2Z n ( 1 .1 e q u iv . ) - 6 0 oC 2. 0 oC , 6 h
H
O
MnO 2 85 oC
BD PSO
BD PSO
BD PSO OH
1. K H M D S A , T H F, - 78 oC
2 . T f2N P h , -7 8 ~ 0 oC , 1 2 h
BD PSO
N S
H
H
Cu r ac in A
O
H OMe
7 .1 .3 硼 氢 化 反 应
(1) 一般的硼氢化反应
X R + HB
X
X R + HB
X
X XB H
R X XB H
R
( 2 ) 过 渡 金 属 催 化 的 硼 氢 化 反 应
O BH +
O
O
cat. R hC l(P Ph3)3
第七章 金属氢化 (Hydrometallation) 和 金属碳化反应 (Carbometallation)
7.1 金属氢化反应 7.1.1 铝氢化反应 (Hydroalumination)
金属有机化学3

Et2O
NiCl2 + 2CH2 CHCH2MgBr
-10 C
o
Ni
Hale Waihona Puke + 2MgBrCl
-CO CoH(CO)4N + CH2 CHCH CH2 OC
Co CO CO
+ OC
Co CO CO
Fe OC CO CO
+ HCl
Fe OC CO
Cl CO
4. 具有过渡金属-碳 σ 键的络合物的合成
含有M-C σ 键的过渡金属化合物通常是不稳定的,但是 若有了环戊二烯基、CO、叔膦、联吡啶等有机碱配体后, 可以合成相当稳定的烷基或芳基化合物。 这类配体被称为稳定化配体(stabilizing ligand)或支持 配体(supporting ligand)。
CH3CMn(CO)5 O CH3Mn(CO)5 + CO
p- CH3C6H4SO2IrCl2(CO)(PPh3)2
p- CH3C6H4IrCl2(CO)(PPh3)2
-SO2
C6H5N2PtCl(PEt3)2
Al2O3 -N2
C6H5PtCl(PEt3)2
当加热不能发生消除反应时,光反应有时是有效的。 另外,芳基过渡金属络合物的合成方法与烷基化合物相似。
Ni Ni(cod)2
在此,AlEt2(OEt)为还原剂, 把Ni2+还原为Ni0.
Fe + 1,5-COD
Fe(cod)2
2. n-芳烃络合物 苯等芳烃配位所形成的络合物, 可由低原子价过渡金属络 合物和芳烃的置换反应, 或由过渡金属卤化物在芳烃存在下 还原而合成:
C6H5CH3 + Mo(CO)6
金属有机化学在有机合成中的应用

金属有机化学在有机合成中的应用金属有机化学是有机化学领域中的一个重要分支,主要研究金属与有机化合物的相互作用和反应机理。
金属有机化合物作为催化剂和试剂在有机合成中发挥着重要的作用。
本文将探讨金属有机化学在有机合成中的应用,并介绍一些实际的例子。
一、金属有机化合物作为催化剂金属有机化合物在有机合成中常用作催化剂,可以提高反应速率,降低反应温度,并且能够选择性地催化特定的反应。
其中,过渡金属有机化合物是最为常见的催化剂之一。
1. 钯催化的偶联反应钯催化的偶联反应是有机合成中非常重要的反应之一。
以钯有机化合物为催化剂,能够实现碳—碳键或碳—氮键的形成。
例如,苯基钯(Pd(PPh3)4)在Suzuki反应中催化芳基溴化物与烯丙基硼酸芳基酯之间的偶联反应,产生芳基烯丙基化合物。
2. 铑催化的氢化反应铑催化的氢化反应是有机合成中常用的氢化方法之一。
铑有机化合物能够高效催化烯烃、炔烃和酮等化合物的氢化反应,生成相应的饱和化合物。
例如,二茂铑(RhCl(cod))催化苯乙烯的氢化反应,可以得到环己烷。
二、金属有机化合物作为试剂除了作为催化剂,金属有机化合物也常用作有机合成中的试剂,可以用于特定反应的开展,或者作为中间体参与反应。
1. 金属烷基试剂的引入金属烷基试剂,如格氏试剂(RMgX)和有机锂试剂(RLi),常用于将烷基基团引入到有机分子中。
例如,格氏试剂可以将烷基基团引入到酮中,生成相应的醇。
有机锂试剂则可以与酰氯反应,生成相应的醇酸盐。
2. 金属有机化合物的配体反应金属有机化合物可以与其他有机小分子或配体发生反应,生成新的金属配合物。
这种反应常用于有机合成的前体合成和金属配位化学的研究。
例如,格氏试剂与胺发生缩脲反应,得到相应的金属有机缩脲化合物。
三、金属有机化学在药物合成中的应用金属有机化学在药物合成中具有重要的应用。
金属有机化合物可以作为药物分子的合成中间体或催化剂,为药物的研发和合成提供了有效的方法。
偶联反应 三甲基硅醇钾

偶联反应三甲基硅醇钾全文共四篇示例,供读者参考第一篇示例:偶联反应是有机合成中一种常见的化学反应类型,它通常用于合成C-C键或C-X键(X代表氮、氧、硫等)的化合物。
在偶联反应中,两种或多种分子通过一种催化剂或试剂的作用结合在一起,生成新的化合物。
三甲基硅醇钾是一种常用的偶联反应试剂,具有独特的化学性质和应用价值。
三甲基硅醇钾的化学结构为C3H9OSi,它是一种无机化合物,常见的结构式为Me3SiOK。
三甲基硅醇钾是一种强碱,通常以液体形式存在,易溶于有机溶剂如乙醚、甲苯等,在有机合成中起着重要的作用。
三甲基硅醇钾在偶联反应中主要用于催化烷基化反应。
在烷基化反应中,烷基基团被转移至另一有机分子上,生成新的碳-碳键。
三甲基硅醇钾作为碱性催化剂,能促进烷基碳与亲电试剂之间的反应,从而实现烷基化反应的进行。
除了在烷基化反应中的应用外,三甲基硅醇钾还可用于其他偶联反应,如羟基化、氟化、氨基化等反应。
它的独特性质使得在有机合成中有广泛的应用前景,可以用于合成功能化合物、药物分子等。
在实际应用中,制备三甲基硅醇钾往往需要一定的实验技术和条件。
一般可以通过硅烷和氯化钾的反应制备得到。
制备过程中需要注意控制反应条件,确保产品的纯度和产率。
三甲基硅醇钾是一种重要的偶联反应试剂,在有机合成中具有重要的应用价值。
通过合理使用三甲基硅醇钾,可以实现多种偶联反应,为有机合成化学研究和工业生产提供重要支持。
希望未来能够进一步探索三甲基硅醇钾的化学性质和应用,为有机合成领域的发展做出更大的贡献。
第二篇示例:偶联反应是通过碳-碳键形成来连接两个分子的方法,通常使用金属试剂作为催化剂。
金属试剂通常为过渡金属盐类,如钯、铑、镍等金属催化剂。
三甲基硅醇钾是一种有机金属试剂,其分子结构为[(CH3)3Si]3K。
在偶联反应中,三甲基硅醇钾可以作为亲核试剂参与反应,也可用于络合金属催化剂。
三甲基硅醇钾作为有机金属试剂,具有多种优点。
三甲基硅醇钾在反应中可以稳定并控制活性金属催化剂,提高反应的选择性和效率。
第三章 有机金属化合物的反应

*** 1. 有机锂试剂与格氏试剂的差异:
⑵ 与α,β-不饱和羰基化合物加成
与α,β-不饱和羰基化合物加成时,格氏试
剂优先发生1,4-加成反应,而有机锂试剂则优先
进行1,2-加成反应。
O C6H5CH=CHCC6H5
C6H5MgX
OH
(C6H5)2CHCH=CC6H5
(C6H5)2CHCH2COC6H5
RMgX
该反应是法国有机化学家Grignard(格利雅)于1901年在
他的博士论文研究中首次发现的。为纪念这位化学家对化学
事业的贡献,人们将烷基卤化镁称为Grignard试剂。
(2) 机理 : R-X Mg R• + X • (在金属表面产生)
X • + Mg
X Mg • RX R Mg X + X •
RCH2CH2OH
合成增加两个碳的伯醇
11
格氏反应 (2)与醛(除甲醛外)、取代环氧乙烷反应制备仲醇
1) R' MgX RCHO 2) H3+O
OH R-CH-R'
OH
O
1) RMgX
CH3 2) H3 +O
R-CH2-CH-CH3
注:格氏试剂一般是进攻空间位阻小的碳原子。
12
格氏反应
(3)与酮、羧酸衍生物反应制备叔醇
(CH3)2CHCH2CH2Li
3. 有机锂化合物与同某些电正性较低的金属 卤化物反应,制备该金属的有机化台物。
4RLi + SnCl4
R4Sn + 4LiCl
2RLi + HgC]2
R2Hg + 2LiCl
2RLi + CuI 乙醚/THF R2CuLi + LiI
(完整)金属有机化学中的钯催化的反应全解

(完整)金属有机化学中的钯催化的反应全解编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)金属有机化学中的钯催化的反应全解)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)金属有机化学中的钯催化的反应全解的全部内容。
XXXX大学研究生学位课程论文(2012 —--— 2013 学年第一学期)学院(中心、所):化学化工学院专业名称: 应用化学课程名称:高等有机化学论文题目: 金属有机化学中的钯催化的反应授课教师(职称) XXXX(教授)研究生姓名: XXXX年级: 2012级学号: XXXXXXXXX成绩:评阅日期:XXXX大学研究生学院2012年 12 月 25 日金属有机化学中的钯催化的反应XXXXXX(XXXX大学化学化工学院,山西,太原,030006)摘要:过渡金属钯在金属有机化学方面具有丰富的反应性,在各类有机化学反应中如氢化、氧化脱氢、偶联、环加成等反应中,钯是优良的催化剂,或是催化剂的重要组分之一.本文在查阅大量近几年文献资料的基础上,综述了钯催化的反应,同时综述了钯催化反应的机理以及钯催化反应的研究现状。
关键词:钯,催化剂,反应机理,研究进展1钯催化的反应类型及反应机理在现今炼油、石油化工等工业催化反应中,有很多的钯催化反应,尤其是氢化反应中的选择加氢,以及氧化反应中选择氧化生产乙醛、醋酸乙烯、甲基丙烯酸甲酯,均广泛采用和开发钯催化剂.对石油重整反应,钯也是常选取的催化剂组分之一。
1.1氢化反应钯催化剂具有很大的活性和极优良的选择性,部分氢化选择性高,常用作烯烃选择性氢化催化剂.1。
1.1反应式及反应机理反应底物首先和氢气分子分别被吸附到催化剂上,然后和催化剂的活性中心形成配位键,最后完成氢的转移,氢和反应底物形成σ—键。
第三章_金属有机反应

一、有机锂试剂的制备
1.卤代烷和金属锂反应
卤代烷与金属锂在非极性溶剂(无水乙醚、
石油醚、苯)中作用生成有机锂化合物:
RX + 2Li → RLi + LiX
C4H9X + 2 Li
石油醚
C4H9Li + LiX
卤代烷与锂反应的活性次序为:R1>RBr >RCl>RF。氟代烷的反应活性很小.而 碘代烷又很容易与生成的RLi发生反应生成 高碳的烷烃,所以常用RBr或RCl来制取 RLi。 由于烯丙基氯和苄氯易发生Wurtz类偶联反 应,不易用此法制备相应的烯丙基锂和苄 基氯。
O2N
MgBr
+
O2N
CHO
1.
乙 醚
?
CH3COCH3 Cl2
(CH3)2CHMgBr
?
KOH
?
2. O O NH MgBr
?
?
CH3COCl
CH22H27NO2
O O
NH
O N
MgBr O O N OH N
CH3COCl
3.3
有机锂试剂
有机锂试剂与Grinard试剂有许多相似之处,并比 Grinard试剂活泼,且具备一些特殊的反应性能: 与位阻大的酮反应 与羧酸盐负离子反应生成酮 与α,β-不饱和羰基化合物反应 与酰胺和-C=NR官能团化合物反应 与CO2反应 与烯烃双键反应 偶联反应 与电正性较低的金属卤化物反应
提示:锂的反应活性高于镁,烷基锂的化学活
性也高于烷基卤化镁,在有机合成中有机锂显
得特殊重要。由于有机锂中的碳锂键的离子性
很强,碳负离子非常容易被氧化或与活泼氢结 合,所以在制备有机锂时应在情性气体保护下 进行,所用溶剂如乙醚、苯、环己烷等必须是 特别干燥。
有机金属锂试剂反应

有机金属锂试剂是一类强还原剂,通常用于有机合成中的碳-碳键形成反应。
它与各种有机卤化物、醛、酮等反应,生成碳负离子,进而进行亲核取代反应。
以下是一些有机金属锂试剂常见的反应:
1. 亲核取代反应:有机金属锂试剂与卤代烷烃发生亲核取代反应,生成新的碳-碳键。
例如:
RLi + RX →RR'
其中,R和R'为有机基团,X为卤素。
2. 羰基化合反应:有机金属锂试剂可以与酮或醛反应,发生羰基化合反应,生成醇。
例如:
RLi + R'2C=O →R'RCH(OH)
这是通过亲核加成的方式进行的。
3. 脱卤反应:有机金属锂试剂可以用于脱卤反应,例如:
RLi + RX →RH + LiX
4. 烯烃的合成:有机金属锂试剂可以与卤代烯烃反应,生成烯烃。
例如:
RLi + R'CH=CH2 →R'RCH=CH2
需要注意的是,有机金属锂试剂是强还原剂,对水非常敏感,因此在实验室中常需在无水条件下使用,并采取适当的安全措施。
3金属有机试剂参与的反应

OH
CH3MgBr
91%
O
O
CH3MgBr CuCl
1,4-加成产物(82.5%)
3.1.2.3与羧酸衍生物的反应
(1)醇的制备
①与醛反应:R'CHO + RMgX ②与酮反应: R'COR'' + RMgX ③与酰卤反应: R'COX + RMgX'
R'
R
R'' C
R' R
CHOH
OH
R' OMgX' C
CH3CH2CH2CH2Li + LiCl
Br + Li Et2O
Li
CH2=CHCH2X、PhCH2X 不宜用此法制备相应的锂 试剂 (容易发生偶联反应 )
二、锂-氢交换反应
RH + R'Li
例如
n-BuLi
RLi + R'H
Li
n-BuLi
n-C4H9 C CH
n-C4H9 C CLi
+ PhLi N CH3
C6H5
CH
CH C O (1)C6H5MgBr C6H5
| CH3
(2)H2O (3)互变异构
C6H5
CH CH2 C O + C6H6 CH CH C OH
C6H5
CH3
CH3
1,4-加成产物(12%)
1,2-加成产物(88%)
C6H5 CH
CH
CO | CH3
(1)C2H5MgBr (2)H2O
O Ph C CH2CH3 + CH3CH2MgBr
CH3 OH
有机合成中常见的危险反应

有机合成中常见的危险反应2018-01-27 有机合成在有机合成中,完全是重中之重。
下面介绍几种在平时做实验中常见的有可能引起危险的反应的注意事项供大家参考。
一、丁基锂和DIBAL-H之类的易燃液体试剂参与的反应1、一般取用100mL以下的试剂,可以用注射器抽取(同时用氮气球平衡内部压力),用量较大的可以用搭桥法:正压搭桥法和负压搭桥法2、正丁基锂和仲丁基锂可以用注射器抽取。
但叔丁基锂由于在针头拔出的瞬间很容易与空气摩擦起火所以只能用搭桥法(三甲基铝也类似极易着火)。
3、丁基锂遇水遇湿极易燃烧,因此反应要确保远离水源,保持操作台干燥整洁。
用氮气流吹干反应容器,针头,双头针软管等等确保整个体系无水。
4、空的丁基锂试剂瓶不能乱扔,要安全处理: 先用惰性气体置换瓶内空气,然后用THF稀释,加入乙醇或异丙醇淬灭。
5、用稀盐酸或饱和氯化铵溶液淬灭反应时,一定要充分搅拌,开始要做氮气保护下逐滴加入,后面可以加快。
整个过程一般在0摄氏度下进行,淬灭温度不能太低,淬灭试剂量至少要大于理论量的50%,先在0度下搅拌10min,后再升温到室温搅拌。
二、重氮甲烷参与的反应1、重氮甲烷是非常易爆的气体,制备装置是专门定制的一体化装置,绝不允许在实验室用磨口玻璃装置进行制备。
2、重氮甲烷必须现做现用,不允许把制备好的乙醚溶液放在冰箱中保存。
3、剩余的重氮甲烷可以在氮气流保护下用稀醋酸或很稀的盐酸(浓度要小于1N)小心淬灭,淬灭时会放出毒气,要在通风良好的通风橱中进行。
4、操作时动作要轻,不要撞击。
5、制备重氮甲烷的反应不能用油浴加热只能用水浴加热,而且水温不能超过70oC。
三、锂、钠、钾等易燃金属参与的反应1、要远离水源,保持操作台干燥整洁。
2、要快速切成小片,不要太薄,加入反应液中,开始反应液温度会上升较快,可以考虑用水浴冷却,但水浴上要用灭火毯盖住,防止金属掉入水中起火。
3、擦拭金属的纸不能直接仍入垃圾桶中,防止起火。
有机合成中常见的危险反应

有机合成中常见的危险反应2018-01-27 有机合成在有机合成中,完全是重中之重。
下面介绍几种在平时做实验中常见的有可能引起危险的反应的注意事项供大家参考。
一、丁基锂和DIBAL-H之类的易燃液体试剂参与的反应1、一般取用100mL以下的试剂,可以用注射器抽取(同时用氮气球平衡内部压力),用量较大的可以用搭桥法:正压搭桥法和负压搭桥法2、正丁基锂和仲丁基锂可以用注射器抽取。
但叔丁基锂由于在针头拔出的瞬间很容易与空气摩擦起火所以只能用搭桥法(三甲基铝也类似极易着火)。
3、丁基锂遇水遇湿极易燃烧,因此反应要确保远离水源,保持操作台干燥整洁。
用氮气流吹干反应容器,针头,双头针软管等等确保整个体系无水。
4、空的丁基锂试剂瓶不能乱扔,要安全处理: 先用惰性气体置换瓶内空气,然后用THF稀释,加入乙醇或异丙醇淬灭。
5、用稀盐酸或饱和氯化铵溶液淬灭反应时,一定要充分搅拌,开始要做氮气保护下逐滴加入,后面可以加快。
整个过程一般在0摄氏度下进行,淬灭温度不能太低,淬灭试剂量至少要大于理论量的50%,先在0度下搅拌10min,后再升温到室温搅拌。
二、重氮甲烷参与的反应1、重氮甲烷是非常易爆的气体,制备装置是专门定制的一体化装置,绝不允许在实验室用磨口玻璃装置进行制备。
2、重氮甲烷必须现做现用,不允许把制备好的乙醚溶液放在冰箱中保存。
3、剩余的重氮甲烷可以在氮气流保护下用稀醋酸或很稀的盐酸(浓度要小于1N)小心淬灭,淬灭时会放出毒气,要在通风良好的通风橱中进行。
4、操作时动作要轻,不要撞击。
5、制备重氮甲烷的反应不能用油浴加热只能用水浴加热,而且水温不能超过70oC。
三、锂、钠、钾等易燃金属参与的反应1、要远离水源,保持操作台干燥整洁。
2、要快速切成小片,不要太薄,加入反应液中,开始反应液温度会上升较快,可以考虑用水浴冷却,但水浴上要用灭火毯盖住,防止金属掉入水中起火。
3、擦拭金属的纸不能直接仍入垃圾桶中,防止起火。
实验室常用的几个反应机理必需掌握

Negishi偶联反应偶联反应,也写作偶合反应或耦联反应,是两个化学实体或单位结合生成一个分子的有机化学反应;狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应; 在偶联反应中有一类重要的反应,RMR = 有机片段, M = 主基团中心与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'; 1由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖; 2偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯 PhBr与氯乙;烯形成苯乙烯PhCH=CH2•自身偶联反应:相同的两个片段形成一个分子,如:碘苯 PhI自身形成联苯 Ph-Ph;反应机理偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成;第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上;最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂;不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快;中间体通常不倾向发生β-氢消除反应;3在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应;4还原消除的速率高低如下:乙烯基-乙烯基 > 苯基-苯基 > 炔基-炔基 > 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基 > 乙烯基-烷基 > 烷基-烷基;另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理;催化剂偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂;钯催化剂当中常用的如:四三苯基膦钯等;钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性;如下一些关于钴催化的偶联反应的综述,钯和镍介导的反应以及它们的应用离去基团离去基团X在有机偶联反应中,常常为溴、碘或三氟甲磺酰基;较理想的离去基团为氯,因有机氯化合物相对其他的这些离去基团更廉价易得;与之反应的有机金属化合物还有锡、锌或硼;操作条件虽然大多的偶联反应所涉及的试剂都对于水和空气极其敏感,但不可认为所有的有机偶联反应需要绝对的无水无氧条件;有些有机钯介导的反应就可在水溶液中,使用三苯基膦和硫酸制备的磺化膦试剂进行反应;15总体来讲,空气中的氧气能够影响偶联反应,这是因为大多这类反应都是通过不饱和金属络合物发生反应,而这些络合物都不满足18共价电子的稳定结构;根岸偶联反应Negishi coupling是一个有机反应;反应中,有机锌试剂与卤代烃在镍或钯的配合物的催化下发生偶联,生成一根新的碳-碳键12:其中,•卤素X可以是氯、溴或碘,也可以是其它的基团,如三氟甲磺酰基或乙酰氧基,而基团R则可以是烯基、芳基、烯丙基、炔基或炔丙基英语:propargyl;•卤素X'同样可以是氯、溴或碘,R'则可以是烯基、芳基、烯丙基或者烷基;•催化剂中的金属M可以是镍或者钯;•配体L可以是三苯基膦,dppe,BINAP或者双二苯基膦丁烷英语:chiraphos;用含钯催化剂时,通常产率较高,对官能团的耐受性也比较好;反应以日本化学家根岸英一命名,根岸凭借此贡献得到了2010年诺贝尔化学奖反应机理在这个反应中具有催化活性的是零价的金属M0;反应整体上经过了卤代烃对金属的氧化加成、金属转移英语:transmetalation与还原消除这三步:卤化烃基锌与二烃基锌都可以作为反应物;对模型化合物的研究发现,在金属转移一步中,前者会生成顺式的络合物从而能很快地发生还原消除的后续步骤,生成产物;而后者则会生成反式的络合物,必须经过缓慢的顺反异构体异构化过程3;编辑最新进展Negishi偶联反应在最近的多个合成中有应用,包括从2-溴吡啶合成2,2'-联吡啶所用的催化剂为四三苯基膦合钯0英语:tetrakistriphenylphosphinepalladium04,从邻甲苯基氯化锌和邻位取代的碘苯仍以四三苯基膦合钯0作催化剂合成联苯衍生物5,以及从1-癸炔与Z-1-碘-1-己烯合成5,7-十六碳二烯6;Negishi偶联还用于六二茂铁苯的合成,如下式所示7:这个反应用六碘苯与双二茂铁锌为原料,以三二亚苄基丙酮二钯0英语:trisdibenzylideneactonedipalladium0作催化剂,在四氢呋喃中反应;产率仅为4%,这与芳环周围的位阻有关;Negishi反应的一种最新的变化形式是先用2-氯-2-苯基苯乙酮1来氧化钯,生成含有OPdCl基团的钯配合物;该化合物随后发生双金属转移反应,接受分别来自有机锌试剂2和有机锡试剂3的两个烃基,如下式所示8:Heck反应Heck反应也被叫做Mizoroki-Heck反应,是由一个不饱和卤代烃或三氟甲磺酸盐和一个烯烃在强碱和钯催化下生成取代烯烃的一个反应;其命名是因为其发现者、美国化学家Richa rdF.Heck;Heck反应图示Heck反应所用的催化剂主要是含钯类化合物;所用的卤化物和三氟基甲磺酸盐是一类芳基化合物,甲苯基化合物和乙烯基化合物等;催化剂主要有氯化钯,醋酸钯,三苯基膦钯等;载体主要有三苯基膦,BINAP等;所用的碱主要有三乙胺,碳酸钾,醋酸钠等;heck反应- 反应机理从反应机理图示可以看出,Heck反应实质上是一系列围绕着催化剂钯的循环反应;Heck反应机理图示第一步:醋酸钯Ⅱ被三苯基膦还原为零价钯,而三苯基膦被氧化为三苯基氧化物;第二步:零价钯通过氧化加成反应插入到芳溴键间;第三步:钯与烯烃形成键;第四步:烯烃化合物通过顺式加成反应插入到钯碳键间;第五步:化合物发生构象转变;第六步:通过β氢消去形成新的烯钯配合物;第七步:烯钯配合物分解;第八步:二价钯通过还原消去反应重新成为零价钯;heck反应- 工业应用由于该反应在肉桂酸酯类衍生物、某些医药中间体的合成总有着广泛的应用,受到了人们的极大关注;近年来人们又利用分子内Heck反应合成了很多复杂化合物,也有不少学者用Heck反应合成高分子化合物;工业生产的萘普生和防晒油中的主要成分桂皮酸盐都是通过Heck反应生产的;heck反应Suzuki反应铃木反应- 简介Suzuki反应铃木反应,也称作Suzuki偶联反应、Suzuki-Miyaura反应铃木-宫浦反应,是一个较新的有机偶联反应,零价钯配合物催化下,芳基或烯基硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联;该反应由铃木章在1979年首先报道,在有机合成中的用途很广,具强的底物适应性及官能团容忍性,常用于合成多烯烃、苯乙烯和联苯的衍生物,从而应用于众多天然产物、有机材料的合成中;铃木反应示意图铃木反应- 概述Suzuki反应对官能团的耐受性非常好,反应物可以带着-CHO、-COCH3、-COOC2H5、-O CH3、-CN、-NO2、-F等官能团进行反应而不受影响;反应有选择性,不同卤素、以及不同位置的相同卤素进行反应的活性可能有差别,三氟甲磺酸酯、重氮盐、碘鎓盐或芳基锍盐和芳基硼酸也可以进行反应,活性顺序如下:R2-I > R2-OTf > R2-Br >> R2-Cl 另一个底物一般是芳基硼酸,由芳基锂或格氏试剂与烷基硼酸酯反应制备;这些化合物对空气和水蒸气比较稳定,容易储存;Suzuki反应靠一个四配位的钯催化剂催化,广泛使用的催化剂为四三苯基膦钯0,其他的配体还有:AsPh3、n-Bu3P、MeO3P,以及双齿配体Ph2PCH22P Ph2dppe、Ph2PCH23PPh2dppp等; Suzuki反应中的碱也有很多选择,最常用的是碳酸钠;碱金属碳酸盐中,活性顺序为:Cs2CO3 > K2CO3 > Na2CO3 > Li2CO3 而且,加入氟离子F−会与芳基硼酸形成氟硼酸盐负离子,可以促进硼酸盐中间体与钯中心的反应;因此,氟化四丁基铵、氟化铯、氟化钾等化合物都会使反应速率加快,甚至可以代替反应中使用的碱;首先卤代烃2与零价钯进行氧化加成,与碱作用生成强亲电性的有机钯中间体4;同时芳基硼酸与碱作用生成酸根型配合物四价硼酸盐中间体6,具亲核性,与4作用生成8;最后8经还原消除,得到目标产物9以及催化剂1;氧化加成一步,用乙烯基卤反应时生成构型保持的产物,但用烯丙基和苄基卤反应则生成构型翻转的产物; 这一步首先生成的是顺式的钯配合物,而后立即转变为反式的异构体;还原消除得到的是构型保持的产物;SUZUKI cross coupling reaction 的基本因素总的来说可以分为下面几个部分,底物的活性简单的分类可以是:ArN2+X->>ArI>ArBr>ArCl>ArOTf≥ArOTs,ArOMe这里面常用的是卤代物,其中尤其是碘代和溴代最为常见,也是反应效果较好的;但是,ArN2+ X在有些情况下,是个很好的选择;它的制备我可以给出一个常用的方法,这里我们的重氮盐,是氟硼盐.碱的参与2.SUZUKI cross coupling reaction 在没有碱的参与下,是很难反应的,甚至不反应反应中碱的影响不仅取决于碱负离子的强弱,而且要兼顾阳离子的性质;阳离子如果太小不利于生成中间的过渡态ylidePd中间体,如果要弄清楚这个问题简单的机理介绍是必不可少的,下面化学式可以明了的解释这个原理;通常来说,大的阳离子的碱,如Ba,Cs,会加速反应,当阳离子太小而被屏蔽反应的速率和效率将显著下降;溶剂选择常用的溶剂分为质子,非质子,极性和非极性,当然他们是互相交叉的,我这里再一次强调一下,溶剂和碱要综合考虑选择,这里只简单的给出一些常用的二者间的配合:BaOH2/95%EtOH, Na2CO3,K2CO3,CsCO3/dioxane,DMF,CsF,K3PO4/toluene......当然,具体到实际的应用上还要考虑你底物在这些溶剂中的溶解性;底物芳基硼酸及酯Suzuki 偶联反应的优势就是形成了这个过渡的中间体,让反应更容易进行;有点类似催化剂,严格说这不准确的芳基硼酸及酯是一个对水和空气稳定的物质,因此它的储存将不是问题,而同时又具备好的反应活性;它是一个弱酸PKa=12左右,因此,可以在反应的后处理中利用这一点,用氢氧化钠与它成盐,有机溶剂提杂纯化它;另外还有一点要特别注意的芳基硼酸在加热干燥过程中自身会脱水形成酸酐,所以如果你要测它的熔点时,你会发现这是很困难的;芳基硼酸的合成一般的来说,有两个方法,一个用有机锂盐,另外一个用格式试剂,后面一个很常用,自己也做过,前面没用过,有谁用的可以分享一下;现在大家更常用的是芳基硼酯,这里面以频那醇硼酸酯最普遍,这个方法是由Miyanra 小组对Suzuki 偶联反应改良产生的感兴趣的可以看看这个文献:JOC.60, 7508芳基频那醇硼酸酯制备方法中,用Pddppf作为催化剂适用碘代物,和溴代物以及三氟甲磺酰基物;用Pddba3/PCy3,和PdOAc做为不活泼的氯化物的制备;特别说一点,这里的用的碱不能用太强的,一般用醋酸钾就可以了,太强的碱会造成同分子的双分子偶合,这是我们不愿意看到的;催化剂和配体这是这个反应最精髓的地方,也是最新最有挑战性的一个领域;这里我只简单的介绍一下,Suzuki 偶联反应的催化剂主要有两大类Pd类,Ni类,前者可用于含水体系,耐受很多的官能团,后者在反应中必需是无水无氧的;Suzuki 偶联反应的催化剂的发展经历过三个过程:1 简单的零价Pd0和Ni0的盐和磷的配合物,反应活性较低如PdCl2,Pd/C等2 高活性的钯催化剂3 高活性,可反复利用的催化剂我们日常用的多的是第一和第二类,第一类中以PdPPh34为最常见,最广谱,用于底物是溴化物和碘化物最好,如果用于不活泼的氯化物反应的条件要苛刻一点;一般的配体就是PPh3,P Cy3.Suzuki 偶联反应的催化剂都是怕氧的所以反应进行中脱氧是必备的一步,这里很有意思的是第三代的催化剂,它具有高活性,高效率,它是固态的不溶于溶剂中的因此反应后处理通过过滤出去,回收反复利用,这样的体系,要加点季铵盐提高催化剂的稳定性同时是不是还有相转移催化剂的功能;2铃木反应- 2010诺贝尔化学奖美国科学家理查德-海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖;这一成果广泛应用于制药、电子工业和先进材料等领域,可以使人类造出复杂的有机分子;瑞典皇家科学院诺贝尔颁奖委员会在颁奖状中称,钯催化的交叉偶联是今天的化学家所拥有的最为先进的工具;这种化学工具极大地提高了化学家们创造先进化学物质的可能性,例如,创造和自然本身一样复杂程度的碳基分子;碳基有机化学是生命的基础,它是无数令人惊叹的自然现象的原因:花朵的颜色、蛇的毒性、诸如青霉素这样的能杀死细菌的物质;有机化学使人们能够模仿大自然的化学,利用碳能力来为能发挥作用的分子提供一个稳定的框架,这使人类获得了新的药物和诸如塑料这样的革命性材料;2010年诺贝尔化学奖获得者sonogashire反应由Pd/Cu混合催化剂催化的末端炔烃与sp2型碳的卤化物之间的交叉偶联反应通常被称之为Sonogashira 反应Eq. 1. 这一反应最早在1975年由Heck, Cassar以及Sonogashira等独立发现. 经过近三十年的发展, 它已逐渐为人们所熟知, 并成为了一个重要的人名反应. 目前, Sonogashira反应在取代炔烃以及大共轭炔烃的合成中得到了广泛的应用, 从而在很多天然化合物,农药医药,新兴材料以及纳米分子器件的合成中起着关键的作用;在通常条件下Sonogashira反应对于活泼卤代烃如碘代烃和溴代烃具有较好的反应活性; 但对于氯代烃其活性通常较低, 从而要求的反应条件较为苛刻. 而且, 当炔烃上取代基为强吸电子基团如CF3时, 即使对于活泼卤代烃Sonogashira反应活性也将明显降低5. 其次, Sonogashira反应通常要求严格除氧, 以防止炔烃化合物自身氧化偶联反应的发生, 从而有利于反应向所期待的方向进行6. 此外, Sonogashira反应复合催化剂中的Pd化合物价格通常较为昂贵, 限制了该反应在一些较大规模合成中的应用.鉴于以上的种种问题, 最近几年来人们对Sonogashira反应做了多方面的探索与研究, 并取得了一些重要进展, 其中主要包括了Sonogashira 反应的进一步优化,联串化,绿色化以及非Pd催化的Sonogashira反应等. 由于这些进展对于许多实验室乃至工业合成有着重要的科学和经济价值, 本文对这些最新的研究结果进行了综述.Pd催化的Sonogashira 反应Sonogashira反应自发现以来, Pd化合物是应用最多的催化剂. 在对原始反应条件进行了改进的基础上, 人们最近还实现了由Pd 催化剂单独催化完成Sonogashira反应. 此外, 还发现了一些由Sonogashira反应诱导的联串反应, 使得该反应在有机合成中有了更为广泛的应用.Pd催化Sonogashira反应工序的改进早期的Sonogashira反应通常在胺类溶剂中进行,Sonogashira偶联反应和醇氧化反应这不仅需要较高的反应温度, 反应物也必须经过仔细地纯化并严格地除氧. 尽管这样, 在很多Sonogashira反应中人们仍然能够得到可观量的炔烃氧化偶联7Glaser 偶联产物. 为此人们常常需要在反应中使用过量的炔烃. 这种作法不仅不够经济, 而且导致了分离上的困难. 经过多年的完善, 至今Sonogashira反应已得到了多方面的改进. 以下我们将以溶剂的变化为主线辅以催化剂,配体以及碱的变化, 来概述这一发展过程.1997年, Miller等8在合成过程中使用PdPPh3Cl2/ CuI为催化剂, 以THF代替胺作为溶剂, 在0 ℃即可完成Sonogashira反应. 对于其给出的底物反应只需25~5 min, 产率最高可达97% Eq. 2.1998年, Krause等9也以THF为溶剂,稀PdPPh3- Cl2/CuI为催化剂,Et3N为碱完成了Sonogashira反应. 使用这一改进后反应条件, 反应的底物可以为普通试剂级化合物, 除氧的工序也得到了简化, 而炔烃氧化偶联的产物则大为减少. 很多不活泼的底物在改进后的反应中也能够顺利地给出产物Eq. 3.后来Karpov等10报道, 使用Krause的方法也可以完成苯乙炔与溴代杂环化合物的偶联Eq. 4.同样在1998年, Ecker等11又对Krause的方法作了改进, 仍以THF为溶剂,PdPPh3Cl2/CuI为催化剂, 而改用K2CO3作为碱, 在较为温和的条件下完成了带有吸电子基团的炔烃与碘代芳香化合物的偶联Eq. 5.此外在1998年, Shultz等12在合成共轭炔烃的过程中, 以乙醚为溶剂, 使用零价的金属Pd为催化剂, PPh3为配体, 在室温下短时间内完成了底物的Sonogashira偶联, 产率可达92% Eq. 6.2001年, Buchmeiser等13合成出了新型Pd催化剂1, 在THF溶剂中, 以Bu3N为碱, 在CuI的共同作用下, 除碘代,溴代芳烃外, 氯代芳烃亦能顺利得到偶联产品Eq.7.Krause的方法适用于溴代以及碘代芳烃的Sonogashira偶联. 针对更为活泼的碘代芳烃, Yamagu-chi等14在1999年优化出了一种在DMF溶剂中完成的低温下的Sonogashira偶联方法. 该方法以Pd2dba3/CuI dba: 二亚苄基丙酮为催化剂, i-Pr2NEt为碱, 此外还需加入n-Bu4NI作为活化剂. 比较于Krause的方法, Yamaguchi 的方法需要严格除氧. 然而, 使用这一方法能够在-20 ℃下实现Sonogashira偶联, 并且对于部分取代基团其底物可以完成定量反应. 在这样的反应条件下, 很多活泼的有机基团不会被破坏. 因此, Yamaguchi提出的反应方法能够适用于一些脆弱的天然化合物的合成Eq. 8.2002年Batey15合成出了钯的碘化物催化剂2, 同样在DMF溶剂中, 以Et3N或Cs2CO3为碱, 这一新型催化剂与CuI共同作用, 可以高效催化溴代芳烃与炔烃的Sonogashira偶联反应, 对于一些底物产率高达99% Eq. 9.Hunckttmark等16在2000年, 以PdPhCN2Cl2/CuI为催化剂, i-Pr2NH为碱, 在二氧六环溶剂中, 也完成了活性较低的溴代芳烃与炔烃的Sonogashira偶联 Eq. 10.2001年Chow等17报道, 以甲苯为溶剂, 在PdPPh3Cl2/CuI的共同催化作用下, 可使用NaOH作为碱, 在加入活化剂Bu4NI的情况下, 同样可以完成溴代芳烃的Sonogashira偶联Eq. 11.同年, Dai等18在合成过程中使用乙腈/三乙胺作为混合溶剂, PdPPh34/CuI为催化剂, 加入n-Bu4NI作为活化剂, 顺利地得到了底物的偶联产物Eq. 12. 从表1中我们可以看出n-Bu4NI对于该反应显著的活化作用, 产率较不加时提高了两倍多.近来, Elangovan等20也以乙腈为溶剂完成了溴代表1 改进的Sonogashira反应中n-Bu4NI的活化作用Table1 Activation effects of n-Bu4NI on Sonogashira reactiondevelopedNo. n-Bu4NI/mol% t/h 产率/%1 0 17 292 50 24 563 100 24 844 150 24 91吡啶与炔烃的Sonogashira偶联Eq. 13. 其独特之处在于, 反应过程中使用氢气与氮气的混合气体取代了以往单纯的氮气作为保护氛围, 使该反应的主要副产品——炔烃自身氧化偶联产物, 得到了大幅度的降低比较情况见表 2. 在反应过程中, 如果单纯的通入氧气, 其产品主要为炔烃的自身偶联产物, 高达92%左右, 并且在增加催化剂量的条件下, 这一副产品也会相应增加. 鉴于这两个现象, 他们提出了该条件下反应可能的机理图1, 认为在有氢气存在的条件下, H2与反应体系中的氧作用, 从而抑制了Pd催化剂的氧化, 使得反应更有利于向期待的方向进行.表2 改进前后反应产率对比 Table 2 Changes of yields due to the improvementNo. R N2氛产率/% N2+H2氛产率/%1 2,4-Me2 59 33 89 1.902 4-OMe 64 28 91 1.883 4-NMe2 63 25 94 1.784 4-NEt25 30 95 25 4-H 45 45 88 26 4-Me 58 31 85 1.85a 括号中为主要副产品——炔烃自身氧化偶联产物的产率.No. 1 王晔峰等:Sonogashira反应研究的最新进展 11图 1 Elangovan条件下的反应机理Figure 1 Reaction mechanism under Elangovan's conditions2002年, Yang等19报道在溶剂DMAc N, N-二甲基乙酰胺中也可完成溴代芳烃的Sonogashira偶联. 在这一条件下, 选择PdOAc2/CuI作为催化剂, Cs2CO3作为碱, 氮杂卡宾化合物3作为催化剂配体, 其产率一般达到了94%以上, 对于部分底物可完成定量反应. 值得一提的是活性较低的氯代芳烃在这一条件下也有50%左右的偶联产品生成Eq. 14.Stille反应Stille反应,也称Stille偶联反应、Stille偶合反应,是有机锡化合物和不含β-氢的卤代烃或三氟甲磺酸酯在钯催化下发生的交叉偶联反应X通常是卤素, 比如氯, 溴, 碘. 另外,X可以是类卤素比如三氟甲磺酰基;该反应由John Kenneth Stille和David Milstein于20世纪70年代首先发现,是有机合成中很重要的一个偶联反应,在1992年的偶连发表文献当中占到一半以上;反应同时还被工业合成大量应用,尤其是药物合成反应一般在除水除氧溶剂及惰性环境中进行;等计量的CuI或MnII盐可以提高反应的专一性及反应速率;101112氧气会使钯催化剂发生氧化,并导致有机锡化合物发生自身偶联;四三苯基膦合钯0是最常用的钯催化剂,其他催化剂还有:PdCl2PPh32、PdCl2MeCN2等;使用的卤代烃一般为乙烯基或芳基三氟甲磺酸酯或氯、溴、碘代烃;用三氟甲磺酸酯时,加入少量的氯化锂可以活化氧化加成一步的产物,使反应速率加快;烃基三丁基锡是最常用的有机锡原料;虽然烃基三甲基锡的反应性更强,但较大的毒性约前者的1000倍限制了其应用;强极性溶剂如六甲基磷酰胺、二甲基甲酰胺或二恶烷可以提高有机锡原料的活性;反应机理该反应的机理与其他钯催化的偶联反应机理类似;其催化循环如下:活性零价钯与卤代烃发生氧化加成反应,生成顺式的中间体,并很快异构化生成反式的异构体;后者与有机锡化合物发生金属交换反应,然后发生还原消除反应,生成零价钯和反应产物,完成一个催化循环;锡所连基团发生金属交换一步时的速率有如下顺序:炔基 > 烯基 > 芳基 > 烯丙基 = 苄基 > α-烷氧基烃基 > 烃基零价钯Pd0PPh32和-PdII-X-Sn-C环状中间体的存在于2007年通过质谱分析得到证实;编辑反应改进为了改进反应进程,氯化锂经常被加入参与反应. 这个试剂的作用能够稳定氧化加成形成的反应中间体从而加速反应进程;反应活性和选择性能够通过加入等当量的CuI或者MnII盐来获得改善.161718偶连反应能够被高供电子数的配位剂所抑制;在CuI盐的催化下,钯碳被证明是一个非常高效的催化剂.在绿色化学领域,Stille反应被报道可以在一个特定的条件下反应:低熔点高极性混合物:糖比如甘露糖, 脲比如二甲基脲和一个盐,比如氯化铵2122. 催化体系是 Pd2dba3和三苯砷:Buchwald-Hartwig反应Buchwald–Hartwig偶联反应布赫瓦尔德-哈特维希反应,又称Buchwald–Hartwig反应;Buchwald–Hartwig交叉偶联反应;Buchwald–Hartwig胺化反应钯催化和碱存在下胺与芳卤的交叉偶联反应,产生 C-N 键,生成胺的N-芳基化产物;此反应是合成芳胺的重要方法;反应中的芳卤也可为拟芳卤三氟甲磺酸的酚酯所代替;胺可为伯胺或仲胺,胺上的取代基可以为任何有机基团;钯催化剂常为钯磷配合物,如四三苯基膦钯0,也可为三双亚苄基丙酮二钯01等其他钯配合物;反应用碱一般为双三甲硅基氨基钠或叔丁醇盐;类似的反应为 Stille反应和 Heck反应;反应也可扩展到碳亲核试剂,如丙二酸酯;以及扩展到氧亲核试剂如酚,用于合成二芳醚,由此提供了铜介导的Ullmann二芳醚合成和 Goldberg反应以外的选择;Buchwald–Hartwig 这一类型的反应最早是由乌克兰的 Lev M. Yagupolskii 等在 1986 年发现的;他们用多取代的活化氯代芳烃与苯胺衍生物在 1mol% 的 PdPhPPh32I 催化之下进行反应,得到了偶联产物,产率中等;此后美国的 Buchwald 和 Hartwig 两个团队又分别在 1994 年重新发现这个反应;耶鲁大学的 Hartwig 等用的是对溴甲苯与三丁基锡基胺之间的偶联;麻省理工学院的 Buchwald 等用的则是间溴苯甲醚与另一三丁基锡胺之间的偶联,见下;。
有机合成:Chapter 4 有机金属化合物的反应

H3C
C CH2 Ph
(85%)
(返回)
30
羰基化合物中,只有酰卤能与有机铜(I)试剂作用,反 应生成醛/酮:
- 78 C (CH3)2CuLi + CH3(CH2)4CO(CH2)4COCl
15 min
CH3(CH2)4CO(CH2)4COCH3 (95%)
产物酮不能再参与反应。又如:
( H2C
CH3(CH2)3COCH3 (80%)
(2)产物有空间位阻,例如:
(CH3)3CCH2MgCl + (CH3)3CCOCl
O (CH3)3CCH2 C C(CH3)3 (87%)
(返回)
20
对一级和二级酰胺,格氏试剂主要是从氢上除去质子, 生成烃,例如:
δδ XMg R
H NHCOR'
RH + R'CONHMgX
9
4.2.3 有机铜(I)试剂
制备:
RLi +
Cu2X2
RCu or R2CuLi
有机铜(I)试剂反应特点: (1)特别容易取代卤素生成烃; (2)在羰基化合物中只与酰卤作用,生成醛/酮; (3)与α,β-不饱和羰基化合物反应得到共轭加成产物;
(4)在加热或氧化剂存在时,特别容易发生偶联反应。
10
2 R C CH + Cu2Cl2
2 R C CCu + 2 HCl
炔基铜(I)化合物易制备,并且比烷基或芳基铜(I) 化合物要稳定得多,主要反应有:
(1)从不活泼的位置取代卤素; (2)将酰氯转变为酮;
(3)偶联反应生成共轭二炔。
12
4.4 总结
4.4.1 切断与合成等价物 合成某种化合物,可以有不同的切断方式,而同一种切
有机化学中的金属有机化合物和金属催化反应原理

有机化学中的金属有机化合物和金属催化反应原理有机化学是研究碳基化合物的性质和反应的科学,而金属有机化合物和金属催化反应则是有机化学中的重要分支,应用广泛,影响深远。
一、金属有机化合物金属有机化合物指的是含有金属-碳键的化合物,其中金属通常是过渡金属。
这类化合物具有很多特殊的化学性质,例如可以参与金属催化反应,也可以作为有机合成中的试剂。
1. 有机锂化合物有机锂化合物是一类常用的金属有机化合物,由于锂的电负性较低,因此有机锂化合物具有非常强的亲电性。
常见的有机锂化合物包括丁基锂、叔丁基锂等。
有机锂化合物常用于有机合成中的羧酸酯化反应、卤代烃的取代反应等反应中。
2. 有机铜化合物有机铜化合物与有机锂化合物一样具有很强的亲电性,但由于铜的电负性较锂高,因此有机铜化合物通常比有机锂化合物更加稳定。
常见的有机铜化合物包括第一类和第二类有机铜试剂。
有机铜化合物在有机合成中主要用于烯丙基化反应、自由基反应等反应中。
3. 有机铁化合物有机铁化合物是一类特殊的金属有机化合物,其中铁通常是三价的。
常见的有机铁化合物包括费希尔试剂和格氏试剂等。
有机铁化合物在有机合成中常用于羰基化反应、烯烃羰基化反应等反应中。
二、金属催化反应金属催化反应是指在金属催化剂的作用下进行的有机合成反应,通过金属催化剂的引发、传递或者接受中间体上的电子或质子,加速有机物之间的化学反应,并且能够在较温和的条件下实现。
1. 氧化还原反应氧化还原反应是有机合成中常见的反应,而金属催化剂常用于氧化还原反应中。
例如钯、铑、钌等金属常用于氧化还原反应中,例如Suzuki反应、Heck反应等。
金属催化氧化还原反应具有高效、温和、反应通用等优点。
2. 烯丙基化反应烯丙基化反应是有机合成中重要的反应,它广泛用于生物活性物质及金属有机化合物的合成中。
在烯丙基化反应中,常用钯、镍等金属作为催化剂,通过催化剂引发的活化,将烯丙基试剂与底物反应,生成烯丙基化产物。
3. 环合成反应环合成反应是指将一条链状分子合成成为一个环状分子的过程。
有机合成中的金属有机化学反应

有机合成中的金属有机化学反应金属有机化学反应是有机合成中的重要领域,通过引入金属元素作为催化剂或反应物,可以实现一系列高效、高选择性的有机化学反应。
本文将介绍几种常见的金属有机化学反应,并分析其反应机制和应用。
一、金属催化的还原反应铂金催化剂在有机合成中常用于还原反应。
以酮类化合物的还原为例,金属催化剂可以将酮还原成相应的醇。
催化剂通常采用铂、钯、铑等贵金属催化剂,反应机制包括氢原子的传递和还原剂的再生。
此外,参与还原反应的金属催化剂还可以催化酸酐的还原、酯类的还原以及羧酸的还原等反应。
这些反应在医药、农药和染料等领域具有广泛应用。
二、金属催化的氧化反应铬催化剂在有机合成中常用于氧化反应。
以醇的氧化为例,铬催化剂可以将醇氧化成酮、醛或羧酸。
常用的铬催化剂有Jones试剂和柠檬酸铬。
金属催化的氧化反应也包括其他反应,如烯烃的氧化、烷烃的氧化和芳烃的氧化等。
这些反应在有机合成中起到重要的作用,为合成各类功能化合物提供了有效的方法。
三、金属有机化学反应中的羧化反应羧化反应是将有机化合物转化成羧酸的重要方法。
金属催化的羧化反应通常使用碘代试剂作为氧化剂。
以烷烃的羧化为例,碘代试剂将烷烃氧化成相应的醇,然后通过金属催化剂将醇进一步氧化为羧酸。
此外,金属有机化学反应中还包括氢化反应、烯烃的合成、烷基化反应、催化偶联反应等。
这些反应在有机合成中发挥着重要的作用,广泛应用于农药、医药和化学品的合成过程中。
总结:金属有机化学反应在有机合成中具有重要的地位,通过金属催化剂的引入,可以实现高效、高选择性的有机化学转化。
其中,金属催化的还原反应、氧化反应和羧化反应是常见的反应类型。
理解这些反应的机理和应用,对于有机合成研究和新药物合成具有重要意义。
在未来的研究中,可以进一步探索不同金属催化剂在有机合成中的应用,寻找新的催化体系,并优化反应条件,以实现更高效、更可持续的有机合成反应。
通过金属有机化学反应的研究和应用,有望为新药物的合成和化学品的绿色生产提供新的思路和方法。
金属有机化学3有机过渡金属络合物的基元反应
Pd(PPh3)4 18 电子
Pd(PPh3)3 + PPh3 16 电子
➢ 同样,常用的金属络合物还有:Ni(COD)2, Fe(CO)5, Mo(N2)2(dppe)2, dppe=Ph2PCH2CH2PPh2。
2. 氧化加成和还原消除(Oxidative Addition
and Reductive Elimination)
c. 非极性加成物
如:H2,R2SiH,R3GeH,R3SnH,RSH,RCHO,Ar-H, RH等。
i) H2
Vaska络合物与H2发生O.A.得到顺式产物
OC PPh3
Ir
+ H2
Ph3P Cl
PPh3 OC Ir Ha Cl PPh3Hb
JHaHb= 8.4 Hz
16e dsp2 (平面正方形) 可能是协同机理:
R
(bipy)Ni
+ CH2=CH
R
X
CH2=CHX R
(bipy)Ni R
(bipy)Ni(CH2=CHX) + R R
同样:
R1
R2 O
O
R1
R2
(bipy)Ni
O
(bipy)Ni O
O+
R2 R1
O
R1
R2
(bipy)Ni OC6H5 O CR O
O
O
(bipy)Ni O
O O + RCOC6H5 O
LnM + A B
只改变一个电子的反应
A
A
AB
L M B +L M B
L M M L+A B
反应过程中,金属的氧化态和络合物的配位数都减少了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
RMgX
OH
R'COX + RMgX'
④与酯反应:
O R' C OR''
OH (1) 2 RMgBr (2) H3O+ R' C R R
⑤与酸酐反应:
O R' R' C C O O + RMgX O RC R' RMgX R R' C R OH
(2) 合成醛酮
1、与酰胺反应(主要用于N,N-二取代酰胺,否则活性H 使格式试剂分解)
3.1 有机镁化合物(格氏试剂) 格林尼亚试剂简称“格氏试剂”,是含卤化镁的有 机金属化合物,由于含有碳负离子,因此属于亲核 试剂,由法国化学家维克多· 格林尼亚 (François Auguste Victor Grignard)发
现。格氏试剂在有机合成上十分有用,格氏试剂至
今在国内外还在进行广泛的研究。是我们最熟悉、 常用的一种金属有机试剂。
O PhCH2MgBr H3O
+
OH Ph
OH CH2Ph
?
O
PhCH2Li
H3O
+
3.1.2.7 Barbier 反应
1899 年 P. A. Barbier
O + CH3I + Mg THF H3O
+
OH
I
CN
Mg
H3O+
O
O
I Mg
OH H3O+
3.1.2.8 与烃基化试剂反应——Wurtz 反应
②共价化合物的性质:Hg Si Ge Sn Pb Tl
二甲基汞 [(CH3)2Hg] 四甲基硅 [(CH3)4Si]
③路易斯酸性:Mg B Al Ga In
三甲基铝 [(CH3)3Al] 三甲基镓 [(CH3 )3Ga]
二、重要性
金属有机化合物作为有机合成试剂和有机反应的
高效、高选择性催化剂,近二十年来进行了广泛而 深入的研究,发展迅速。 此外,在塑料添加剂、抗震剂、杀菌剂等方面 也有着广泛应用。如果没有金属有机化合物作为催 化剂,精细有机化工如制药工业、香料工业的发展 简直不可想象。
加成反应
OH CH3MgBr O O CH3MgBr CuCl 1,4-加成产物(82.5%) 91%
3.1.2.3与羧酸衍生物的反应
(1)醇的制备
R' R'CHO ①与醛反应: + RMgX
R''
+
CHOH R
C R' R
R' OMgX' C R X R R C O + MgXX'
②与酮反应: R'COR'' ③与酰卤反应:
第三章 金属有机试剂参与的反应
3.1 有机镁化合物(格氏试剂) 3.2 有机锂化合物 3.3有机铜化合物 3.4 有机锌化合物 3.5有机硼化合物
3.6有机硅化合物
概
述
元素有机化合物是指有机基团以碳原子直接与金
属或非金属元素(H,O,N,Cl,Br,I,S等非金
属元素除外)相连接的化合物。 如果有机基团是通过氧原子与金属或非金属元素
连接的,这一类化合物就不属于元素有机化合物。
例如 :醇钠(RONa)、磷酸酯 [(RO)3PO] 一般将含有金属-碳键(M-C)的化合物称为有机金
属化合物或金属有机化合物。
1827年问世的ZeiseKPtCl3(CH2=CH2)是第一个被发现的具 有不饱和有机分子与金属键链的有机金属化合物。此后,有 机硅、有机钠、有机锌等相继问世并得到应用。著名的格氏 试剂及其催化反应极大地推动了有机化学的发展,ZieglerNatta催化剂也给工业带来了巨大经济效益。1951年具有特
3.1.1有机镁化合物制备
一、RX 与 Mg 反应
RX + Mg Et2O or THF RMgX
反应放热。为了避免局部过热、浓度高产生副产物,要在搅拌 下进行。格氏试剂对O2、CO2及水敏感,一般在惰性气体(如N2) 中进行,并注意隔绝潮气。 卤代烃的反应活性为:RI > RBr > RCl;1o > 2o > 3o RX 活泼卤代烃一般在乙醚溶剂中反应,活性较差的卤代烃在 四氢呋喃中反应,活性很差的卤代烃还要使用活性镁
3、格氏试剂与原甲酸酯反应合成醛
格氏试剂与原甲酸乙酯反应得到缩醛,经酸性水解后得醛。
OEt EtO C H OEt RMgBr R OEt C H OEt
+
O C R H
H3O
4、格氏试剂与甲酸盐反应
OMgBr C2H5MgBr + HCOOH THF 0℃ CH (CH2)5MgBr HCOOMgBr 3 0-20℃,40分钟 H2O-H
C H 3K 甲基钾 (C H 3 ) 2 H g 二甲基汞 (C H 3 C H 2 ) 3 A l 三乙基铝 n -C 4 H 9 L i 正丁基锂
2、以硅烷或锡烷等衍生物命名。
(C H 3 ) 4 S i 四甲基硅烷 (C H 3 C H 2 ) 2 S n C H 3 三乙基甲基锡烷
3、当金属原子除了与有机基团相连外,还连有 无机原子,可将其看作是带有有机基团的无机 盐加以命名.
RR1CHOMgX
CH3
H2O
H2O
RCH2OH
RR1CHOH
R CHO + RMgX
O CH3CH2 C CH3
+ CH3 CH CH2MgBr
CH3
CH3 CH3 CH CH2 C CH2CH3 OH
28%
O CH3 C CH3 + n-BuMgBr
OH CH3 C Bu-n 50%
CH3
O Ph C CH2CH3 + CH3CH2MgBr CH2CH3
OH C Ph CH2CH3
80%
3.1.2.2 与α ,β -不饱和醛酮加成
C C C C O + RMgX C R C C C R C OH 1,4-加 成 OH 1,2-加 成
产物是1,2-加成,还是1,4-加成,和两个反应 物结构有关,就α ,β -不饱和羰基化合物来说:
R' C R C C R'''
一、RX 与 Li 反应
RX + 2 Li
例如
CH3CH2CH2CH2Cl + 2 Li n-C6H14
RLi + LiX
CH3CH2CH2CH2Li + LiCl
Br
+ Li
Et2O
Li
CH2=CHCH2X、PhCH2X 不宜用此法制备相应的锂 试剂 (容易发生偶联反应 )
二、锂-氢交换反应
51%
反应的可能机理是:
H RMgX + C NR'2 O R H C OMgBr 2H NR 2' H R C O H R H C O
NH R'2
R'' RMgX + R'CON R''
OMgX R C R' N
R'' R''
H
RCOR' + MgX + R''2NH
2、格氏试剂与腈反应
O R' C N (1) RMgBr (2) H3O+ C R'
殊结构和类似芳烃的二茂铁得到了制备和结构确证,为有机
过渡金属开辟了一大类新型的有机金属配合物。现已发现, 周期表中几乎所有金属元素都能和碳结合,形成不同形式的 金属有机化合物。迄今已先后有10位科学家因在有机金属化 学领域做出的巨大贡献而荣获Nobel化学奖。
有机金属化合物的命名
1、在金属名称之前加上相应的有机基团的名称。
C 6H 5
CH
CH C O | CH3
(1)C2H5MgBr (2)H2O
C 6H 6
CH C2H5
CH2
O C
CH3 + C 6H6
C2H5 CH CH C OH CH3
1,4-加成产物(60%)
1,2-加成产物(40%)
如用下面的不饱和酮,羰基旁和一个很大的 叔丁基相连,则无论用哪一种格氏试剂,都得到
RH + R'Li
例如
n-BuLi
RLi + R'H
Li
n-C4H9
C
CH
+
n-BuLi
PhCH2Cl
Br H3C CH3 (1)Mg (2)CH3OSO2OCH3 CH3 CH3
(1)Mg PhCH2CH2CH3 + MgCl(OSO2OC2H5) (2)C2H5OSO2OC2H5
CH3 H3 C CH3 + MgX(OSO2OCH3) 60%
70-75%
3.2 有机锂化合物
3.2.1 有机锂化合物制备
O R1 C N R
3
R2
(1) RMgBr (2) H3O+ R
1
O C R
N CHO
PhCH2CH2MgCl
H 3O +
PhCH2CH2CHO
MgX + HCON CF3
CH3 Ph CF3
CHO
92%
CH3(CH2) 3C
CMgBr + HCON
CH3 CH3 CH3(CH2)3C
C CHO
H R C R' NH
R
H 2O R C R' O
RMgX + R'C
N
