普通化学习题与解答(第四章)详解
2023—2024学年九年级化学沪教版全国上册第四章 认识化学变化 课后习题(含答案)

2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题(含答案)2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题含答案沪教版(全国)第四章认识化学变化一、选择题。
1、下列关于燃烧的叙述正确的是()A.有放热、发光现象的变化一定是燃烧B.可燃物燃烧时一定有火焰和发光的现象C.在纯氧中能燃烧的物质在空气中也一定能燃烧D.可燃物燃烧时一定有发光、放热现象2、酒精灯的火焰太小时,将灯芯拨的松散一些,可使火焰更旺,其原理是()A.降低可燃物的着火点B.增大与空气的接触面积C.提高可燃物的着火点D.增加空气中氧气含量3、应用化学知识能有效预防和控制火灾.下面对图中灭火实例的灭火原理解释不正确的是()灭火实例灭火原理A 住宅失火时,消防队员用水灭火降低可燃物的着火点B 酒精在桌上着火时用湿抹布盖灭隔绝空气或氧气C 炒菜油锅着火时,用锅盖盖熄隔绝空气或氧气D 扑灭森林火灾时,设置隔离带可燃物与燃烧物隔离A.A B.B C.C D.D4、一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。
下列说法不正确的是()A.x的值是31 B.甲、丁的相对分子质量之比可能为7:11 C.丁可能为单质D.反应中消耗甲和乙的质量比为7:45、一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A. 丁一定是该反应的催化剂B. 该反应的基本类型是分解反应C. 该反应中乙、丙的质量变化之比为3:17D. 该反应中甲、丙的质量变化之比为7:176、下列关于燃烧与灭火的解释,不合理的是()A. 粮库失火用水浇灭﹣降低了可燃物的着火点B. 扑灭森林火灾时开辟隔离带﹣清除和隔离了可燃物C. 用扇子扇煤炉,炉火越扇越旺﹣提供充足的气气D. 图书档案起火,用液态二氧化碳扑灭﹣既隔绝氧气又降低温度7、小红在纸叠的小船中加入适量的水,用酒精灯直接加热,纸船安然无恙.纸船没有燃烧的主要原因是()A.水能灭火B.没有达到着火点C.纸不是可燃物D.没有与氧气接触8、如图所示是通过白磷燃烧验证质量守恒定律的实验。
化学沪教版第四章知识点 含练习题和答案

第四章燃烧燃料第一节燃烧与灭火知识目标:1.了解燃烧及燃烧的三个条件2.知道自燃和爆炸现象3.了解灭火的一般方法重点:燃烧的条件和灭火原理难点:燃烧条件的利用猜想:要发生燃烧这种现象需要有哪些条件呢?(提出问题,引发思考)得出初步的结论:1. 可燃物 2. 温度 3.空气(助燃物)水的沸点是100摄氏度,给沸腾的水加热,水的温度还会上升吗?答:“不会”说明:白磷放在空气中就能燃烧,我们称这种现象叫自燃。
在自然界中经常发生这类现象,如:过去人们常说的鬼火、天火,(说明一下各自的形成)其实是一种迷信说法灭火的方法:1.将可燃物与空气隔绝,2.将可燃物温度降到着火点以下。
反馈:请你根据你的生活经验和所学知识,说出以下灭火方法的原理1.建筑物着火时,用高压水枪喷水灭火,降低温度。
2.书籍、文件、精密仪器着火时,喷射干冰灭火。
(干冰是固态二氧化碳,极易升华,升华要吸收大量热量,起到降温效果,更为重要的是二氧化碳比空气重,起到隔绝空气的作用)思考:发生下列火情时,你能想出可行的办法吗?油锅着火时,可采取的措施?端锅、泼水、盖湿的被褥、盖锅盖、洒沙土----(最佳盖锅盖)(说明端锅危险;泼水,油比水轻,不行;最佳方法盖锅盖)酒精灯不慎撞倒引起酒精在桌面上燃烧,可采取的措施?洒沙土、水冲、湿布盖、灭火器-------(最佳方法湿布盖)【点1细解】燃烧1.燃烧:是一种发光、发热的剧烈的化学反应。
2.物质燃烧一般需要同时满足三个条件:(1).物质具有可燃性;(2).可燃物与氧气接触;(3).可燃物达到燃烧所需要的最低温度,这个温度称为可燃物的着火点。
【点2细解】完全燃烧与不完全燃烧当氧气充足时,可燃物完全燃烧,燃烧的快,放出的热量多,可燃物中的碳、氢元素分别生成二氧化碳和水;当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少,可燃物中的部分碳、氢元素生成一氧化碳、碳氢化合物等有害气体和小的炭黑颗粒等物质。
【点3细解】爆炸在有限的空间内,如果发生急速的燃烧,短时间聚集大量的热,使气体的体积迅速膨胀,就会引起爆炸。
浙江大学《普通化学》笔记和课后习题(含考研真题)详解(电化学与金属腐蚀)【圣才出品】

②镉镍电池 镉镍电池的总反应为
6 / 66
圣才电子书 十万种考研考证电子书、题库视频学习平台
4 / 66
圣才电子书 十万种考研考证电子书、题库视频学习平台
1.氧化剂和还原剂相对强弱的比较 (1)电极电势代数值小 ①当该电极越易収生氧化反应,其还原态物质越易失电子,则该电极是较强的还原剂; ②该电极的氧化态物质越难得电子,则该电极是较弱的氧化剂。 (2)电极电势代数值大 ①该电极上越易収生还原反应,其氧化态物质越易得电子,则该电极是较强的氧化剂; ②该电极的还原态物质越难失电子,则该电极是较弱的还原剂。 2.反应斱向的判断 在原电池中,由亍 ΔG=-nEF,若 E>0,则 ΔG<0,在没有非体积功的恒温恒压条件 下,反应可以自収迚行。 3.反应迚行秳度的衡量 (1)KΘ 不 EΘ 的关系 在原电池的热力学讨论中,T=298.15K 时电池反应的平衡常数 KΘ 不电池的标准电动 势 EΘ 的关系为 lnKΘ=nEΘ/(0.05917V)。 (2)分析反应迚行的秳度 当电池反应为所讨论的化学反应时,可通过该原电池的 EΘ 推算该反应的平衡常数 KΘ, 从而分析该反应能够迚行的秳度。
电能势为 E 的电池反应 aA(aq)+bB(aq)=gG(aq)+dD(aq),其电势能表达式为
E E RT ln nF
c(G) / c c( A) / c
g a
c(D) / c d c(B) / c b
2 / 66
圣才电子书
①锌锰干电池
锌锰干电池的总反应为
Zn(s)
2MnO2
(s)
化学必修一第四章知识点及习题(含答案)

第四章非金属及其化合物一.硅1.相关反应2二.氯1.Cl22.新制氯水成分分子:H2O HClO Cl2 离子:H+Cl-ClO-OH-久置氯水成分分子:H2O 离子:H+Cl-OH-3.实验室如何制取纯净的氯气制取原理:MnO2 + 4HCl(浓) △MnCl2 + Cl2↑+2H2O 气体成分:Cl2 (HCl、H2O)4.漂白粉①制法:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O②有效成分:Ca(ClO)2 成分:CaCl2和Ca(ClO)2③漂白原理:Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO (在溶液中)漂白慢Ca(ClO)2 + 2HCl = CaCl2 + 2HClO 漂白快④久置失效发生的反应:Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO2HClO光照或加热2HCl + O2↑5.Br2 、I2水苯或汽油四氯化碳Br2黄~橙橙~橙红橙~橙红I2深黄~褐淡紫~紫红紫~深紫6.置换反应Cl2 + 2NaBr = Br2+ 2NaCl Br2 + 2KI = I2 + 2KBr ∴氧化性Cl2 >Br2 >I27.I2遇淀粉溶液后,溶液呈蓝色I-氧化剂——————→I2三.氮1.氮的氧化物NO:无色气体、有毒(同CO)、难溶与水NO2:红棕色气体、有毒、与水反应反应:2NO + O2 = 2NO2 3NO2 + 2H2O = 2HNO3 + NO 2.有关NO与O2或NO2与O2混合通入水中,液面上升一定高度时用的方程式4NO2 + O2 + 2H2O = 4HNO3 4NO+ 3O2 + 2H2O = 4HNO33.硝酸物理性质无色液体、有刺激性气味、能以任意比溶于水化学性质酸的通性强氧化性与金属氧化物3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑+5H2O与金属3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+4H2OCu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+2H2O与非金属 C + 4HNO3(浓) △CO2↑+ 4NO2↑+ 2H2O 不稳定性4HNO3光照或加热4NO2↑+ O2↑+ H2O4.氨( NH3 )物理性质无色气体、有刺激性气味、密度小于空气、1:700溶于水化学性质与H2O NH3 + H2O NH3·H2O NH4++ OH-与酸NH3 + HCl = NH4Cl氨的催化氧化4NH3 + 5O2催化剂加热4NO + 6H2O实验室制取原理NH4+ + OH-△NH3↑+ H2O5.实验室制取干燥NH3的方法:制取原理:2NH4Cl +Ca(OH )22NH3↑+ CaCl2 + 2H2O气体成分:NH3(H2O )除水用试剂:碱石灰(不用浓H2SO4 、CaCl2原因是:2NH3 + H2SO4 = (NH4)2SO4 ; CaCl2 + 8NH3 =CaCl2·8NH3 ) 6.受热易分解NH3·H2O NH3↑+ H2O NH4HCO3 NH3↑+ CO2↑+ H2O7.氨水中的微粒分子:H2O NH3·H2O NH3离子:NH4+ H+ OH-四.硫1.3.H24.实验室制取H2S、HBr、HI不能用H2SO4(浓)原因:H2S + H2SO4(浓)= S↓ + SO2 + 2H2O2HBr + H2SO4(浓)= Br2 + SO2 + 2H2O 2HI + H2SO4(浓)= I2 + SO2 + 2H2O应该用:H2SO4 ( 1:1体积比) 或浓H3PO4(它们氧化性弱,不会氧化H2S、HBr、HI)5.浓6.浓24①现象:白色蔗糖→ 黑色→ 体积膨胀、并放出有刺激性气味的气体、酸雾②原理:C12H22O1112C + 11H2O H2SO4 + nH2O = H2SO4·nH2O ( 放热)C + 2H2SO4(浓)△CO2↑+ 2SO2↑+ 2H2O (膨胀)SO2 + H2O = H2SO3 (刺激性气味的气体、酸雾)7.漂白化学漂白:①永久漂白:Na2O2HClO O3→ 强氧化剂、发生氧化还原反应、不可逆②暂时漂白:SO2→ 化合成不稳定无色物质、非氧化还原反应、可逆物理吸附:活性炭8.C与浓H2SO229.用第四章非金属及其化合物复习(练习题)1、能贮存在有玻璃塞的磨口试剂瓶里的试剂是()A、HF溶液B、KOH溶液C、盐酸D、水玻璃2、下列说法中,不正确的是()A、光导纤维是以二氧化硅为主要原料制成的B、硅是常温下化学性质的半导体材料C、N2和H2在一定条件下合成氨属于的固定D、燃烧一定要有氧气参加3、下列对氯气的叙述正确的是()A、氯气可使湿的红布条褪色,所以氯气具有漂白性B、氯气没有漂白性,但通入品红溶液中,品红褪色C、在通常情况下,氯气可以和任何金属直接化合D、闻其气味时要小心将集气瓶放在鼻孔下直接闻4、下列关于浓硫酸的性质的说法中,正确的是()A、浓硫酸的脱水性属于物理性质,相应的变化过程是物理变化B、是一种干燥剂,能干燥氨气、氢气等多种气体C、在常温下能够和铁、铝等金属反应生成相应的盐D、CuSO4·5H2O晶体投入到浓硫酸中,固体颜色由蓝变白5、CO2通入下列溶液中,不可能产生沉淀的是()A、氯化钙溶液B、石灰水C、饱和碳酸钠溶液D、硅酸钠溶液6、通常情况下,能大量共存且能用浓硫酸干燥的一组气体是()A、HCl、CO2、NH3B、CO、H2、NH3C、O2、SO2、NOD、H2、HCl、N27、下列有关新制氯水的叙述正确的是()A、氯水中氯元素的化合价只有+1价和-1价B、氯水放置数天后PH将变大C、氯水可使蓝色石蕊试纸先变红后褪色D、氯水经光照后有气泡放出,该气体是氯气8、生石灰中往往含有碳酸钙和二氧化硅等杂质,要检验是否存在这两种杂质,最好选用()A、水B、盐酸C、硫酸D、烧碱溶液9、能够用于鉴别二氧化碳和二氧化硫的溶液是()A、澄清石灰水B、氯化钡溶液C、紫色石蕊试液D、品红溶液10、在下列反应中,硝酸只表现氧化性,不表现酸性的是()A、FeO+浓HNO3B、C+浓HNO3C、Fe2O3+浓HNO3D、Cu+浓HNO311、为了除去二氧化碳中的二氧化硫气体,下列仪器和药品:①洗气瓶、②干燥管、③固体生石灰、④苏打溶液、⑤小苏打溶液。
普通化学第四章课后习题解答

第四章化学平衡原理参考答案P 68~69 综合思考题:解:①根据r H mV B f H m (其中V B 对生成物取正值,反应物取负值)有:rH m 2 f H m (D,g) f H m (E,g) ( 1) f H m (Ag) ( 1) f H m (B,g)=2 X(-4RT !)+(-2.606RT J+3.5RT !+2.5RT ! =-4.606RT 1同理:r S m 2S m (D,g) S m (E,g) ( 1)S m (A,g) ( 1)S m (B,g)=2 X( 0.25RT 1)+(0.5RT J-0.3RT 1-0.7RT 1 =0.0根据吉“布斯—赫姆霍兹”方程rG m Em T Qm 有:r Gm4.606RT 1298 0.0 10 3=-4.606RT 1 X 10-3 (kJ.mol -1) <0•••反应正向自发。
②根据r G mRT l nK 有:In KrG m 4-606RT 1 1034.606RTRT ; 10 3K 0=100.02③求 Q ,根据 Q[P D /P ] [P E /P ]有:[P A /P ] [P B /P ][0.5 101.3kPa/101.3kPa]2 [0.5 101.3kPa/101.3kPa] [1.0 101.3kPa/101.3kPa] [0.5 101.3kPa/101.3kPa]=0.25①反应 C ⑸ + H 2O(g)三_CO(g) + H/g)4.0 X 10-2 4.0 X 10-2••• Q<K•••平衡向正反应方向移动④根据|门空上^(口1)有:K , R T , T 2r H m4.606RT , , T i =298K , K , 100.0 , T 2=398K , K 2 K 24.606R 298 398 298将有关数据代入式子中得:In 2()100.0R 298 398解得:K e 2=31.4⑤••• K e 2< K e i , •••由T i 升至T 2平衡向逆反应方向移动(即吸热反应方向移动)P70〜72练习题参考答案1 1、解:①-②十2 可得:CO 2(g) H 2(g) CO 2 CO(g) H 2O(g) CO(g) - O 221整理后得③:H 2(g) -O 2(g) H 2O(g)K 32根据:方程式与平衡常数K e 的运算关系,有方程式: 加、减、平衡常数: 乘、除、K 1K 3广.K 2乘、除、 移项 乘方、开方、倒数2.0 16.90.1.4 10 24、解:依题意;平衡浓度:1.0 X 10-2K C2 / 2 /[4.0 10 1 [4.0 101 - 1- 二1- 0.16[「° 10 11②H 2O(g)的瞬时浓度增大后,反应的转化量增加 x 则:C(s) + H 2O(g),_二 CO(g) + H 血)4.0 X 102-x4.0 X 102+x 4.0 X 10-2+xX=0.019CO(g)与^(g)的最终浓度是:=0.059mol.L -1③反应的转化率提高量为:5、解:依题意,T 温度下, 该反应的标准平衡常数为:倍,则各物的分压分别为2 P co 、2 P H 2 > 2 P CH 3OH ,有PCH 3OH[2P cO p][2%]20.25K P0.5倍,则各物的分压分别为 0.5 P c 。
高中化学必修二第四章知识点和习题(含答案)(K12教育文档)

高中化学必修二第四章知识点和习题(含答案)(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学必修二第四章知识点和习题(含答案)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学必修二第四章知识点和习题(含答案)(word版可编辑修改)的全部内容。
第四章 化学与可持续发展第一节 开发利用金属矿物和海水资源一、金属矿物的开发利用1、金属的存在:除了金、铂等少数金属外,绝大多数金属以化合态的形式存在于自然界。
2、金属冶炼的涵义:M 0(游离态)。
3、金属冶炼的一般步骤: (1)矿石的富集:除去杂质,提高矿石中有用成分的含量。
(2)冶炼:利用氧化还原反应原理,在一定条件下,用还原剂把金属从其矿石中还原出来,得到金属单质(粗)。
(3)精炼:采用一定的方法,提炼纯金属。
4、金属冶炼的方法(1)电解法:适用于一些非常活泼的金属。
2NaCl (熔融) 电解2Na +Cl 2↑ MgCl 2(熔融) 电解Mg +Cl 2↑ 2Al 2O 3(熔融) 电解4Al +3O 2↑(2)热还原法:适用于较活泼金属.Fe 2O 3+3CO 高温2Fe +3CO 2↑ WO 3+3H 2 高温 W +3H 2O ZnO +C 高温Zn +CO ↑常用的还原剂:焦炭、CO 、H 2等.一些活泼的金属也可作还原剂,如Al,Fe 2O 3+2Al 高温2Fe +Al 2O 3(铝热反应) Cr 2O 3+2Al 高温2Cr +Al 2O 3(铝热反应)(3)热分解法:适用于一些不活泼的金属.2HgO △2Hg +O 2↑ 2Ag 2O △4Ag +O 2↑5、 (1)回收金属的意义:节约矿物资源,节约能源,减少环境污染。
大学化学普通化学习课后题答案

普通化学 马家举 第一章 物质结构基础习题4 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1)3,2,2,1/2;(2)3,0,-1,1/2;(3)2,2,2,2;(2)当角量子数l 取0时,磁量子数m 不能取-1。
(3)当主量字数取2时,角量子数不能取2;自旋量子数不能取2,只能取+1/2或-1/2。
5写出原子序数为47的银原子的电子分布式,并用四个量子数表示最外层电子的运动状态。
Ag :1s 22s 22p 63s 23p 63d 104s 24p 64d 105s 1 5,0,0,+1/2。
试用杂化轨道理论解释:(1) H 2S 分子的键角为920,而PCl 3的键角为1020。
(2) NF 3分子为三角锥形构型,而BF 3分子为平面三角形构型。
(1) H 2S 分子与H 2O 分子一样,中心原子采取sp 3不等性杂化,在两个孤电子对的作用下,两个H-S键键角减小。
之所以键角小于H 2O 分子中两个H-O 键的键角104045’,是因为H-S 键的成键电子对更靠近H 原子,两个H-S 键之间的斥力小,被压缩的程度更大。
PCl 3分子与NH 3分子一样,也是中心原子采取sp 3不等性杂化,同理Cl-P 键的成键电子对更靠近Cl 原子,所以两个P-Cl 键的键角小于NH 3分子中两个N-H 键的键角。
(2) NF3分子与NH 3分子一样中心原子采取sp 3不等性杂化,使分子产生三角锥形构型;BF 3分子中心原子B 采用sp 2等性杂化,使分子产生平面三角形构型。
7 为什么(1)室温下CH 4为气体,CCl 4为液体,而CI 4为其固体?(2)水的沸点高于H 2S ,而CH 4的沸点低于SiH 4?(1) 从CH 4→CCl 4→CI 4分子量增加,分子间色散力增大,而色散力在范德华力中占较大比例,即分子间力是增大的,而分子间力越大,熔沸点越高。
(2) H 2O 分子与H 2S 分子相比,水中H 2O 分子之间存在氢键,虽然H 2O 分子间的色散力较小,氢键的存在却使沸点更高一些。
普通化学习题册答案

第1章热化学与能源一、判断题:1、热的物体比冷的物体含有更多的热量。
(×)2、热是一种传递中的能量。
(√)3、同一体系同一状态可能有多个热力学能。
(×)4、体系的焓值等于恒压反应热。
(×)5、最稳定单质的焓值等于零。
(×)6、由于C a C O3分解是吸热的,所以它的标准摩尔生成焓为负值。
(×)7、体系的焓等于体系的热量(×)8、实验测定得到的反应热数据都是恒压反应热。
(×)二、计算题:1、某汽缸中有气体1.20L,在97.3 kPa下气体从环境中吸收了800J的热量后,在恒压下体积膨胀到1.50L,试计算系统的内能变化ΔU。
ΔU = q + w = q – pΔV= 800 – 97.3×103 ×(1.50 - 1.20) 10-3= 770 J2、根据Δf H mΘ的值,计算下列反应的Δr H mΘ(298K ) 是多少:(1)4NH3(g)+ 3 O2(g)= 2N2(g)+ 6 H2O(g);4NH3(g)+ 3 O2 = 2N2 + 6 H2O(g)Δf H mΘ/ kJ·mol-1- 46.11 0 0 - 241.818Δr H mΘ= 6×(- 241.818)- 4×(- 46.11) = -1266 kJ·mol-1(2)CH4(g) + H2O(g)= CO(g)+ 3 H2(g)。
Δr H mΘ= 206 kJ·mol-1第2章化学反应的基本原理一、判断题:1、放热反应均是自发反应。
(×)2、ΔS为负值的反应均不能自发进行。
(×)3、冰在室温下自动融化成水,是熵增加起了主要作用。
(√)4、因为∆G TΘ= -RTlnKΘ,所以温度升高,平衡常数减小。
(×)5、质量作用定律适用于任何化学反应。
(×)6、反应速率常数取决于反应温度,与反应物浓度无关。
(完整word版)普通化学习题与解答

第一章 热化学与能源1. 是非题(对的在括号内填“+”号,错的填“-”号)(1)已知下列过程的热化学方程式为:则此温度时蒸发1mol 6()UF l ,会放出热30.1kJ 。
(-)(2)在定温定压条件下,下列两个生成液态水的化学方程式所表达的反应放出的热量是一相同的值。
(-)(3)功和热是在系统与环境之间的两种能量传递方式,在系统内部不讨论功和热。
(+)(4)反应的H ∆就是反应的热效应。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在下列反应中,进行1mol 反应时放出热量最大的是 (c)(2)通常,反应热的精确的实验数据是通过测定反应或过程的哪个物理量而获得的。
(d) (a )H ∆ (b )p V ∆ (c )P q (d )V q (3)下列对功和热的描述中,正确的是 (a)(a )都是途径函数,无确定的变化途径就无确定的数值 (b )都是途径函数,对应于某一状态有一确定值 (c )都是状态函数,变化量与途径无关(d )都是状态函数,始终态确定,其他值也确定(4)在温度T 的标准状态下,若已知反应2A B →的标准摩尔反应焓,1r m H θ∆,2222221()()()22()()2()H g O g H O l H g O g H O l +=+=166()();30.1r m UF l UF g H kJ molθ-=∆=422242224222422()()2()()2()()()2()()2()()()2()()2()3()()()()2()2a CH l O g CO g H O gb CH g O g CO g H O gc CH g O g CO g H O ld CHg O g CO g H O l +=++=++=++=+与反应2A C →的标准摩尔反应焓,2r m H θ∆,则反应4C B →的标准摩尔反应焓,3r m H θ∆与,1r m H θ∆及,2r m H θ∆的关系为,3r m H θ∆= (d) (a )2,1r m H θ∆+,2r m H θ∆ (b ),1r m H θ∆—2,2r m H θ∆ (c ),1r m H θ∆+,2r m H θ∆ (d )2,1r m H θ∆—,2r m H θ∆(5)对于热力学可逆过程,下列叙述正确的是 (abd )(a )变化速率无限小的过程 (b )可做最大功的过程 (c )循环过程(d )能使系统与环境完全复原的过程(6)在一定条件下,由乙二醇溶液、冰、水蒸气、氮气和氧气组成的系统中含有 (ad ) (a )三个相 (b )四个相 (c )三种组分 (d )四种组分 (e )五种组分*(7)一只充满氢气的气球,飞到一定高度即会爆炸,这取决于一定高度上的 (d ) (a )外压 (b )温度 (c )湿度 (d )外压和温度 (8)下述说法中,不正确的是 (d)(a )焓只有在某种特定条件下,才与系统反应热相等 (b )焓是人为定义的一种具有能量量纲的热力学量 (c )焓是状态函数(d )焓是系统能与环境进行交换的能量3、填空题使可燃样品(质量为1.000g )在弹式量热计内完全燃烧,以测定其反应热,必须知道:(1) 弹式量热计内吸热介质(通常为水)质量和比热容; (2) 钢弹组件的总热容b C ; (3) 反应前后系统的温度。
普通化学第七版习题册答案

普通化学第七版习题册答案普通化学第七版习题册答案化学作为一门基础科学,对于我们理解和掌握自然界的运行规律有着重要的作用。
而习题册作为化学学习中的重要辅助工具,帮助我们巩固理论知识,提高解题能力。
在学习普通化学第七版习题册时,我们常常会遇到一些难题,需要查阅答案来进行参考。
本文将为大家提供一些普通化学第七版习题册的答案,帮助大家更好地学习化学知识。
第一章:化学基本概念1. 什么是化学?答案:化学是研究物质组成、性质、变化以及与能量之间的关系的科学。
2. 什么是物质?答案:物质是构成宇宙的基本单位,具有质量和占据空间的特征。
3. 什么是元素?答案:元素是由具有相同原子序数的原子组成的纯净物质,无法通过化学反应分解成其他物质。
4. 什么是化合物?答案:化合物是由不同元素以一定的比例结合而成的物质,可以通过化学反应分解成其他物质。
5. 什么是混合物?答案:混合物是由两种或两种以上的物质混合而成的物质,可以通过物理手段分离。
第二章:化学计量与化学方程式1. 什么是化学计量?答案:化学计量是指在化学反应中,物质的质量之间的关系。
2. 什么是摩尔?答案:摩尔是物质的质量与其相对分子质量之间的比值,用符号"mol"表示。
3. 什么是化学方程式?答案:化学方程式是用化学符号和化学式表示化学反应的反应物和生成物之间的关系。
4. 如何平衡化学方程式?答案:平衡化学方程式需要根据反应物和生成物的摩尔比例来调整系数,使得反应物和生成物的摩尔数相等。
第三章:气体的性质与状态方程1. 什么是理想气体?答案:理想气体是指在一定条件下,其分子之间没有相互作用力,分子体积可以忽略不计的气体。
2. 什么是气体的状态方程?答案:气体的状态方程描述了气体的压强、体积和温度之间的关系。
3. 什么是理想气体状态方程?答案:理想气体状态方程是指在一定条件下,气体的压强、体积和温度之间的关系可以用理想气体状态方程PV=nRT表示,其中P为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
普通化学习题与解答(第四章)详解

第四章电化学与金属腐蚀1.是非题(对的在括号内填“+”号,错的填“-”号)(1)取两根金属铜棒,将一根插入盛有0.13mol dm -×4CuSO 溶液的烧杯中,另一根插入盛有13mol dm -×4CuSO 溶液的烧杯中,并用盐桥将两支烧杯中的溶液连接起来,可以组成一个浓差原电池。
(+)(2)金属铁可以置换2Cu +,因此三氯化铁不能与金属铜发生反应。
(-)(3)电动势E (或电极电势j )的数值与电池反应(或半反应式)的写法无关,而平衡常数K q 的数值随反应式的写法(即化学计量数不同)而变。
(+)(4)钢铁在大气中的中性或酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。
(+)(5)有下列原电池:3344()(1)(1)()Cd CdSO mol dm CuSO mol dm Cu ---××+若往4C d S O 溶液中加入少量2N a S 溶液,或往4C u S O 溶液中加入少量425CuSO H O ×晶体,都会使原电池的电动势变小。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:2233272614267Cr O Fe H Cr Fe H O-++++++=++322422Fe SnFe Sn+++++=+它们中间最强的氧化剂和最强的还原剂是(b)(a )23Sn Fe ++和(b )2227Cr O Sn -+和(c )34Cr Sn++和(d )2327Cr O Fe -+和(2)有一个原电池由两个氢电极组成,其中一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液2()100p H kPa =éùëû设应为(b)(a )30.1mol dm HCl-×(b )330.10.1mol dm HAc mol dm NaAc--×+×(c )30.1mol dm HAc -× (d )3340.1mol dm H PO -× (3)在下列电池反应中)在下列电池反应中223()()(1.0)()Ni s Cu aq Ni mol dm Cu s ++-+=×+当该原电池的电动势为零时,2Cu +的浓度为的浓度为 (b) (a )2735.0510mol dm --´× (b )2135.7110mol dm --´×(c )1437.1010mol dm --´× (d )1137.5610mol dm --´×(4)电镀工艺是将欲镀零件作为电解池的电镀工艺是将欲镀零件作为电解池的(( );阳极氧化是将需要处理的部件作为电解池的( ) (a ,b) (a )阴极)阴极 (b )阳极)阳极 (c )任意一个极)任意一个极3、填空题(1)有一种含Cl Br I ---、和的溶液,要使I -被氧化,而Cl Br --、不被氧化,则在以下常用的氧化剂中应选(在以下常用的氧化剂中应选( d )为最适宜。
普通化学4答案

第四章 电化学 金属腐蚀课后部分习题答案4.写出下列化学反应的半反应式:(1) Zn + Fe 2+===== Zn 2+ + Fe答: Zn – 2e ===== Zn2+Fe 2+ + 2e =====Fe (2) 2I -+2Fe 3+ ===== I 2 + 2 Fe 2+答: 2I -– 2e ===== I 2 2Fe 3+ + 2e ===== 2Fe 2+(3) Ni + Sn 4+ =====Ni 2+ + Sn2+ 答: Ni – 2e ===== Ni 2+Sn 4+ + 2e ==== Sn 2+(4) 5Fe 2+ + 8H + + MnO 42- ==== Mn 2+ + 5 Fe 3+ + 4H 2O答: 5Fe 2+– 5e =====5 Fe 3+MnO 42- + 8H + + 5e ===== Mn 2++ 4H 2O5.将上题组成原电池,分别用图示表示:(1)(-)Zn +2Zn +2Fe Fe (+) (2)(-)Pt 2I -I ++23,Fe Fe Pt (+) (3)(-)Ni +2Ni ++24,Sn Sn Pt (+) (4) (-)Pt ++32,Fe Fe +-+H MnO Mn ,,42Pt (+) 7.将锡和铅的金属片分别插入含有该金属离子的溶液中,并组成原电池(用图式表示,注明溶液)(1)C 3300.1,0100.022--⋅=⋅=++dm mol C dm mol Pb Sn(2)33100.0,00.122--⋅=⋅=++dm mol C dm mol C Pb Sn分别计算原电池的电动势,写出原电池的两极反应和总反应式。
解:)(1375.00/2V Sn Sn -=Φ+ )(1263.00/2V Pb Pb -=Φ+(1))(1965.001.0lg 2059.01375.0/2V Sn Sn -=+-=Φ+ E=0/2Sn Sn +Φ-Pb Pb /2+Φ=-0.1262-(-0.1965)=0.070(V )(-) Sn |Sn 2+ || Pb 2+| Pb(+)负极Sn-2e=Sn 2+正极 Pb 2++2e=Pb总式 Pb 2++Sn=Pb+Sn 2+ (2) )(1557.0100.0lg 2059.01262.0/2V Sn Sn -=+-=Φ+ E=0/2SnSn +Φ-Pb Pb /2+Φ=-0.1375-(-0.1557)=0.020(V ) (-) Pb | Pb 2+ || Sn 2+ | Sn(+)负极:Pb-2e=Pb2+ 正极:Sn 2++2e=Sn总式:Sn 2++Pb=Sn+Pb 2+11.由镍电极和标准氢电极组成原电池,若C Ni2+=0.0100 mol •dm -3,原电池的E=0.315(V),其中Ni 为负极,计算镍电极的标准电极电势?解:E=Φθ2H H +-ΦNi Ni +2=0-ΦθNi Ni +2-(0.059/2)lgC Ni2+=0.315 所以ΦθNiNi +2=-0.315-(0.059/2)lg0.01=-0.315+0.059=-0.256(V)12.由两氢电极H 2(101.325))10.0(+H Pt 和H 2(101.325))(x H +Pt 组成原电池,测得该原电池的电动势。
普通化学第四章习题答案

普通化学第四章习题答案普通化学第四章习题答案普通化学是大学中常见的一门基础课程,它涉及到许多基本的化学概念和原理。
第四章是普通化学课程中的重要章节,主要讲解了化学反应和化学方程式的相关知识。
在学习过程中,习题是一种非常重要的辅助学习工具,通过解答习题可以巩固对知识点的理解和掌握。
本文将为大家提供普通化学第四章习题的详细答案,希望能够帮助大家更好地学习和掌握化学知识。
1. 下列反应中,哪些是化学反应,哪些是物理变化?答案:化学反应是指物质之间发生化学变化的过程,而物理变化是指物质的性质发生改变,但其本质并未发生变化的过程。
根据这个定义,我们可以判断以下反应是化学反应还是物理变化:- 燃烧木材:化学反应,因为木材在燃烧过程中与氧气发生化学反应,产生二氧化碳和水。
- 冰块融化:物理变化,因为冰块融化只是固态水转化为液态水的物理过程,并未改变水的化学性质。
- 铁生锈:化学反应,因为铁在与氧气接触时会发生化学反应,生成铁的氧化物。
- 水沸腾:物理变化,因为水沸腾只是液态水转化为水蒸气的物理过程,并未改变水的化学性质。
2. 下列化学方程式中,哪些是平衡方程式?答案:平衡方程式是指化学方程式中反应物和生成物的摩尔比例已经达到最佳状态的方程式。
根据这个定义,我们可以判断以下方程式是否为平衡方程式:- 2H2 + O2 → 2H2O:平衡方程式,因为反应物和生成物的摩尔比例已经达到最佳状态。
- 2Na + Cl2 → 2NaCl:平衡方程式,因为反应物和生成物的摩尔比例已经达到最佳状态。
- CaCO3 → CaO + CO2:不是平衡方程式,因为反应物和生成物的摩尔比例未达到最佳状态。
- 2HCl + Na2CO3 → 2NaCl + H2O + CO2:不是平衡方程式,因为反应物和生成物的摩尔比例未达到最佳状态。
3. 以下反应中,哪些是氧化还原反应?答案:氧化还原反应是指化学反应中发生电子转移的过程。
根据这个定义,我们可以判断以下反应是否为氧化还原反应:- 2Na + Cl2 → 2NaCl:是氧化还原反应,因为钠原子失去电子形成钠离子,氯原子接受电子形成氯离子。
普通化学-第四章习题解答

第四章电化学与金属腐蚀-----习题解答4-2. 选择题: (1)b; (2) b; (3) b; (4) a,b4-4. 答(1)正极: Fe2+ (aq) + 2e =Fe (s)负极: Zn (s) - 2e =Zn2+ (aq);(2)正极: Fe3+ (aq) + e =Fe2+ (aq)负极: 2I- (aq) - 2e =I2 (s);.(3)正极: Sn4+ (aq) + e =Sn2+ (aq)负极: Ni (s) - 2e =Ni2+ (aq);(4)正极: MnO4- (aq) + 8H + 5e =Mn2+ (aq) + 4H2O负极: Fe2+ (aq) - e =Fe3+ (aq);4-7. 解(1) (-) Sn ∣ Sn2+ (aq, 0.0100 mol·dm-3) ¦¦ Pb2+ (aq, 1.00 mol·dm-3) ∣ Pb (+)E = ϕөPb2+/Pb - ϕөSn2+/Sn + (RT/nF)ln(C Pb2+/Cө)/(C Sn2+/Cө) = (-0.126 – (-0.138)) +(0.0592/2)log(1/0.0100) = 0.0712 V正极: Pb2+ (aq) + 2e =Pb (s)负极: Sn (s) - 2e =Sn2+ (aq);总反应式: Pb2+ (aq) + Sn (s) =Pb (s) + Sn2+ (aq)(2) (-) Pb ∣ Pb2+ (aq, 1.00 mol·dm-3) ¦¦ Sn2+ (aq, 0.0100 mol·dm-3) ∣ Sn (+)E = ϕө Sn2+/Sn - ϕөPb2+/Pb + (RT/nF)ln(C Sn2+/Cө)/ (C Pb2+/Cө) = (-0.138 – (-0.126)) +(0.0592/2)log(1/0.100) = 0.018 V正极: Sn (s)+ 2e =Sn2+ (aq)负极: Pb2+ (aq) - 2e =Pb (s);总反应式: Pb (s) + Sn2+ (aq) =Pb2+ (aq) + Sn (s)4-9. 解2Fe3+ (aq) + 2I- (aq) =2Fe2+ (aq) + I2 (s)(1)Eө = ϕө Fe3+/ Fe2+ - ϕө I2/ I_ = 0.775 – 0.535 = 0.236(2) (-) Pt ∣ I2 (s) ∣ I- (aq, 1 mol·dm-3) ¦¦ Fe3+ (aq, 1 mol·dm-3), Fe2+ (aq, 1 mol·dm-3) ∣ Pt (+) (2)ΔGө = - nFEө = -2×96485×0.236 / 1000 (KJ) = -45.5 KJ(4) E = Eө + (RT)/nF ln(C Fe3+/Cө)(C I-/Cө)/ (C Fe2+/Cө) = 0.0236 + (0.0592/2)log (10-2)2/(10)2 =0.0584 V4-10解已知: 2MnO4-(aq) + 16H+(aq) + 10Cl-(aq) ===== 2Mn2+(aq) + 5Cl2(g) + 8H2O(l)正极为: MnO4-(aq) + 8H+(aq) + 5e- ===== Mn2+(aq) + 4H2O负极为2Cl-(aq) ==== Cl2(g) + 2epH = 5.0 时:ϕ MnO4-/Mn2+ = ϕө MnO4-/Mn2+ + (RT/nF)ln[(C MnO4-/Cө) (C H+/Cө)8]/ (Mn2+/Cө) = 1.033 VϕCl2/Cl- = ϕөCl2/Cl- = 1.358 VE = ϕ MnO4-/Mn2+ - ϕCl2/Cl- < 0因此这个反应正向不能进行或逆向自发进行4-11. 解2H+ (aq) + Ni (s) ===== H2 (g) + Ni2+(aq)根据题意: E = ϕө H+/H2 - ϕөNi2+/Ni + (RT/nF)ln(C H+/Cө)2/ [(C Ni2+/Cө) (P H2/Pө)] = 0.315 V0 - ϕөNi2+/Ni + (0.0592/2)log1/[0.01×1] = 0.315 VϕөNi2+/Ni = -0.256 V4-14. 解(1) Cr2O72- (aq) + 14H+ (aq) + 6Br- (aq) ==== 2Cr3+ (aq) + 3Br2 (l) + 7H2O(l) Cr2O72- + 14H+ (aq) + 6e ====== 2Cr3+ (aq)Br2 (l) + 2e ===== 2Br-(aq)E = ϕө Cr2O72-/Cr3+ - ϕөBr2/Br- + (RT/nF)ln[(C Cr2O72-/Cө) (C H+/Cө)14 (C Br-/Cө)6]/ (C Cr3+/Cө)2= 1.232 – 1.066 + (0.0592/6) log (10-4)14 = -0.387 V < 0或ϕ Cr2O72-/Cr3+ = ϕө Cr2O72-/Cr3+ + (RT/nF)ln[(C Cr2O72-/Cө) (C H+/Cө)14]/ (C Cr3+/Cө)2= 0.680 VϕBr2/Br- = ϕөBr2/Br- = 1.066 VE = ϕ Cr2O72-/Cr3+ - ϕBr2/Br- < 0因此反应不能正向自发进行.4-16. 解Co (s) + Cl2 (g) ===== 2Cl- (aq) + Co2+ (aq)(1) E = ϕө Cl2/Cl- - ϕөCo2+/Co= 1.64 V求得ϕөCo2+/Co = -0.28 V(2) 由于Eө = 1.64 V > 0, 因此反应正向自发进行(3)从电池电动势计算公式看出:E = ϕө Cl2/Cl- - ϕөCo2+/Co + (RT/nF)ln (P Cl2/Pө)/ [(C Co2+/Cө) (C Cl-/Cө)2]电池电动势与Cl2压力成正比, 氯气压力增大, 电池电动势增大: 氯气压力减小, 电池电动势减小.(4)从电池电动势计算公式看出:E = ϕө Cl2/Cl- - ϕөCo2+/Co + (RT/nF)ln(P Cl2/Pө)/[(C Co2+/Cө) (C Cl-/Cө)]电池电动势与Co2+浓度成反比, Co2+浓度减小, 电池电动势增大.当Co2+浓度从1 mol·dm-3减小到0.0100 mol·dm-3时, 电池电动势变化值为ΔE = 0.0592/2×log (1/ 0.0100) = 0.0592 VE = 1.64 + 0.0592 = 1.704-18. 解Cu(s) +2Fe3+ (aq) ==== Cu2+ (aq) + 2Fe2+ (aq)(-) Cu ∣ Cu2+ (aq, C1) ¦¦ Fe3+ (aq, C2), Fe2+ (aq, C3) ∣ Pt (+)log K = n△E/0.059 = 2×(0.771 – 0.342)÷0.0592 = 14.5或者:ln K = nF△E/RT = 2×96485(0.771 – 0.342)÷(8.314×298.15) = 33.4K = 3.1×10144-22答: 在微酸性水膜中,铁发生吸氧腐蚀,电极反应为:阳极: Fe === Fe2+ (aq) + 2e-阴极: 1/2O2(g) + H2O(l) +2e- ====== 2OH- (aq) 在稀硫酸介质中,铁发生析氢腐蚀,电极反应为: 阳极: Fe === Fe2+ (aq) + 2e-阴极: 2H+ (aq) + 2e- ====== H2 (g)。
普通化学课后习题答案

第一章 习题答案
1. 答案(1-)(2-)(3+)(4-) 2. 答案(1c)(2d)(3a)(4d)(5abd)(6ad)(7d)(8d) 3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量 热计热容 4..答案:根据已知条件列式 Cb=849J.mol-1 5.答案:获得的肌肉活动的能量= 6. 答案:设计一个循环 3× ×3 ×2 (-58.6)+2(38.1)+6=3(-27.6) 7.答案:由已知可知 ΔH=39.2 kJ.mol-1 ΔH=ΔU+Δ(PV)=ΔU+PΔV w‘=-PΔV= -1×R×T = -8.314×351J = -2.9kJ ΔU=ΔH-PΔV=39.2-2.9=36.3kJ 8.下列以应(或过程)的qp与qv有区别吗? 简单说明。 (1)2.00mol NH4HS的分解 NH4HS(s) NH3(g)+H2S(g)
(注意在计算时可不用先计算分压,列综合算式更方便计算) 13.答案:该反应是可逆反应,需要H2的量包括反应需要的量1mol和为 维持平衡需要xmol(最少量) ==0.36 x=2.78mol 需要H2的量=1+2.78=3.78mol(注:该反应是反应前后气体分子数不变 的,在标准平衡常数表达式中系统的总压和标准压力在计算时可以在分 式中消去,否则在计算时必须知道平衡时总压才能根据平衡常数计算.) 14.在不同温度时反应的标准平衡常数值如下: T/K 973 1.47 2.38 0.618 1073 1.81 2.00 0.905 1173 2.15 1.67 1.287 1273 2.48 1.49 1.664
△fHθm(298.15K)/kJ.mol-1
-1206.92
-635.09
化学必修一第四章学习知识点及习题含含答案讲解
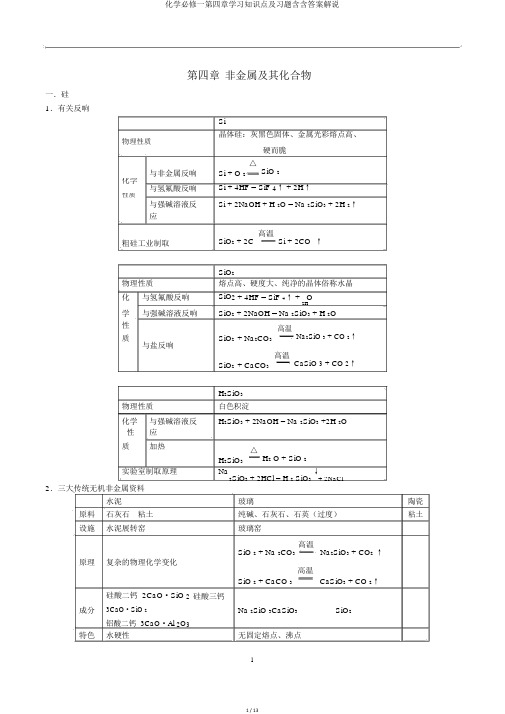
第四章 非金属及其化合物一.硅 1.有关反响Si晶体硅:灰黑色固体、金属光彩熔点高、物理性质硬而脆 与非金属反响 Si + O 2△SiO 2化学Si + 4HF = SiF 4↑ + 2H ↑与氢氟酸反响 性质Si + 2NaOH + H 2O = Na 2SiO 3 + 2H 2↑与强碱溶液反 应粗硅工业制取SiO 2 + 2C 高温Si + 2CO ↑SiO 2物理性质 熔点高、硬度大、纯净的晶体俗称水晶 化与氢氟酸反响SiO 2 + 4HF = SiF 4↑ + O2H学 与强碱溶液反响 SiO 2 + 2NaOH = Na 2SiO 3 + H 2O性 SiO 2 + Na 2CO 3高温Na 2SiO 3 + CO 2↑ 质与盐反响SiO 2 + CaCO 3高温CaSiO 3 + CO 2↑H 2SiO 3物理性质白色积淀化学 与强碱溶液反H 2SiO 3 + 2NaOH = Na 2SiO 3 +2H 2O性 应质加热H 2SiO 3△H 2 O + SiO 2实验室制取原理Na2SiO 3 + 2HCl = H 2 SiO 3 ↓+ 2NaCl2.三大传统无机非金属资料水泥玻璃陶瓷 原料 石灰石 粘土 纯碱、石灰石、石英(过度)粘土设施 水泥展转窑玻璃窑高温Na 2SiO 3 + CO 2 ↑ SiO 2 + Na 2CO 3原理 复杂的物理化学变化高温CaSiO 3 + CO 2↑SiO 2 + CaCO 3硅酸二钙 2CaO ·SiO 2 硅酸三钙成分 3CaO ·SiO 2Na 2SiO 3CaSiO 3SiO 2铝酸二钙 3CaO ·Al 2O 3特色 水硬性无固定熔点、沸点二.氯1. Cl 2 性质物理性质 黄绿色气体、密度大于空气、1:2 溶于水、有毒与非金属反 光照应Cl 2 + H 2 或点燃 2HCl点燃2NaClCl 2 + Cu △CuCl 2Cl 2 + 2Na 与金属反响△2FeCl 3( Cl 2 与金属反响生成高价金属氯化物)化3Cl 2 + 2Fe学 与 H 2O 反响Cl 2 的水溶液叫氯水,溶解的 Cl 2 中有少许与水反响 性Cl 2 + H 2O = HCl + HClO质 与碱溶液反Cl 2 + 2NaOH = NaCl + NaClO + H 2O应2Cl 2 + 2Ca(OH) 2 = CaCl 2 + Ca(ClO) 2 + 2H 2O 与盐溶液反Cl 2 + Na 2SO 3 + H 2O = 2HCl + Na 2SO 4应Cl 2 + 2KI = I 2 + 2KCl实验室制取原理MnO 2 + 4HCl( 浓 )△MnCl 2 + Cl 2↑ +2HO2KMnO 4 + 16HCl = 2KCl + 2MnCl 2 + 5Cl 2↑ + 8H 2O2.新制氯水成分离子: H +Cl - ClO - OH -分子: H 2O HClO Cl 2久置氯水成分 离子: H + Cl - OH -分子: H 2O3.实验室怎样制取纯净的氯气制取原理: MnO 2 + 4HCl( 浓 ) △MnCl 2 + Cl 2 ↑O气体成分: Cl 2 ( HCl 、 H 2O )+2H操作次序 仪器中盛装的药品 各试剂的作用应出现的现象 ① 先通入饱和食盐水 除掉 HCl 有晶体析出 (NaCl )②再通入浓 H 2SO 4除掉 H 2O4.漂白粉① 制法: 2Cl 2 + 2Ca(OH) 2 = CaCl 2 + Ca(ClO) 2 + 2H 2O② 有效成分: Ca(ClO) 2成分: CaCl 2 和 Ca(ClO) 2③ 漂白原理: Ca(ClO) 2 + CO 2 + H 2O = CaCO 3↓+ 2HClO (在溶液中) 漂白慢Ca(ClO) 2 + 2HCl = CaCl 2 + 2HClO漂白快④久置无效发生的反响:Ca(ClO) 2 + CO 2 + H 2O = CaCO 3 + 2HClO光照2HClO 或加热 2HCl + O 2↑5.置换反响Cl 2 + 2NaBr = Br 2+ 2NaClBr 2 + 2KI = I 2 + 2KBr∴氧化性 Cl 2 > Br 2 > I 26. I 2 遇淀粉溶液后,溶液呈蓝色 氧化剂I - ——————→ I 2三.氮 1.氮的氧化物NO : 无色气体、有毒(同 CO )、难溶与水NO 2:红棕色气体、有毒、 与水反响反响: 2NO + O 2 = 2NO 23NO 2 + 2H 2O = 2HNO 3 + NO2.有关 NO 与 O 2 或 NO 2 与 O 2 混淆通入水中,液面上涨必定高度时用的方程式4NO 2 + O 2 + 2H 2O = 4HNO 3 4NO + 3O 2 + 2H 2O = 4HNO 33.硝酸物理性质无色液体、有刺激性气味、能以随意比溶于水酸的通性强 与金属氧化物 化 氧 与金属学 化性 性 与非金属 质不稳固性4.氨 ( NH 3 )物理性质 化 与 H 2O 学 与酸性 氨的催化氧化质实验室制取原理3FeO + 10HNO 3 = 3Fe(NO 3) 3 + NO ↑+ 5H 2O 3Cu + 8HNO 3(稀 ) = 3Cu(NO 3)2 +2NO ↑+ 4H 2O Cu + 4HNO 3(浓 ) = Cu(NO 3)2 +2NO 2↑+ 2H 2OC + 4HNO 3(浓 )△2↑+ 4NO 2↑+ 2H 2COO4HNO光照4NO↑2↑+ H 23或加热 2 + O O无色气体、有刺激性气味、密度小于空气、 1:700 溶于水NH 3 + H 2ONH 3·H 2ONH 4+ + OH -NH 3 + HCl = NH 4Cl4NH 3 + 5O 2催化剂4NO + 6H 2 O加热NH 4+ + OH -△NH 3↑+ H 2O2NH 4Cl +Ca(OH ) 2△ 3↑+ CaCl 2 22NH + 2H O5.实验室制取干燥 NH 3 的方法:制取原理:2NH 4△2NH 3 ↑+ CaCl 2+ 2H 2O2Cl +Ca(OH )气体成分: NH 3( H 2O )除水用试剂:碱石灰(不用浓 H 2SO 4 、 CaCl 2 原由是: 2NH 3 + H 2SO 4 = (NH 4) 2SO 4 ; CaCl 2 + 8NH 3 = CaCl 2·8NH 3 )6.受热易分解 NH 3 ·H 2O △NH 3↑+ H 2ONH 4HCO 3△NH 3↑+ CO 2↑+ H 2O7.氨水中的微粒分子: H 2O NH 3·H 2 O NH 3 离子: NH 4 +H + OH -四.硫1. SO 2 的性质物理性质无色气体、有刺激性气味、有毒、 1:40 溶于水、密度大于空气与 H 2O SO 2 + H 2O = H 2SO 3先: SO 2 +2NaOH = Na 2SO 3+H 2O 化 与碱溶液 后: SO 2 + Na 2SO 3 + H 2O = 2NaHSO 3SO 2 过度时总反响: SO 2 + NaOH = NaHSO 3学与盐溶液 SO 2 + Na 2CO 3 = CO 2+ Na 2SO 3 ( SO 2 可是量时 )性SO 2 + Cl 2 + 2H 2O = H 2SO 4 + 2HCl质与氯水H 2SO 3 + Cl 2 + H 2O = H 2SO 4 + 2HCl漂白性SO 2 能使品红溶液 (有机色质 ) 退色(生成了不稳固的无色物质) ,但加热褪色后的无色溶液,又恢复为本来的红色(不稳固的无色物质分解复原)实验室制法Na 2 3 24 24+ SO 2↑+ H 2 OSO +H SO (浓 ) = Na SO3. H 2S物理性质 与浓 H 2SO 4化 与碱溶液学 与盐溶液性 与氯水质与氧化剂无色气体、剧毒、有臭鸡蛋气味、 1:2.6 溶于水、密度大于空气 H2S + H 2SO 4(浓) = S ↓+ SO 2 + 2H 2O先 H 2S + NaOH= NaHS + H 2O; 后 NaHS + NaOH = Na 2S + H 2O.总反响 : H 2S + 2NaOH = Na 2S + 2H 2OH 2S + Cu 2++3+ + H 2S = 2Fe 2+ += CuS ↓ + 2H2Fe + S ↓ + 2H+-H 2S +Cl 2 = S ↓ + 2H + 2Cl氧化剂H 2S ——————→ S ↓实验室制法FeS+ 2H += 2+H 2S ↑ + Fe4.实验室制取 H 2S 、 HBr 、 HI 不可以用 H 2SO 4(浓 )原 因: H 224 (浓) = S ↓ + SO 2 2S + H SO+ 2H O 2HBr + H 2SO 4(浓 ) = Br 2 + SO 2 + 2H 2O2HI + H 2SO 4(浓 ) = I 2 + SO 2 + 2H 2O应当用: H 2SO 4 ( 1:1 体积比 ) 或浓 H 3PO 4(它们氧化性弱,不会氧化H 2 S 、 HBr 、 HI )5.浓 H 2 SO 4物理性质无色油状液体、常用浓 H 2SO 4 为: 98.3%、 1.84g/cm 3、C=18.4 mol/L 、沸点 338℃、难挥发吸水性 H 2SO 4 + nH 2 O = H 2SO 4 ·n H 2O 脱水性C 12H 22O 11 浓硫酸12C + 11H 2O化 与金属反响Cu + 2H 2SO 4 (浓 )△CuSO 4 + SO 2↑ + 2H 2O学性与非金属反响C + 2H 2SO 4 (浓 )△CO 2 ↑+ 2SO 2 ↑ + H2 2O质强氧化性与化合物反响H 2S + H 2SO 4(浓 ) = S ↓ + SO 2+ 2H 2O2HBr + H 2SO 4(浓 ) = Br 2 + SO 2 + 2H 2O2HI + H 2SO 4(浓 ) = I 2 + SO 2 + 2H 2O6.浓 H 2 SO 4 与蔗糖混淆后的现象及原理①现象:白色蔗糖→ 黑色 → 体积膨胀、并放出有刺激性气味的气体、酸雾②原理: C H O浓硫酸12C + 11H O H SO + nH O = H SO ·nH O ( 放热 )2 4 △2↑+ 2SO 2↑+ 2H2 2 2 23 (刺激性气味的气体、酸雾)C + 2H CO O (膨胀)SO (浓 ) SO + H O = H SO7.漂白化学漂白:①永远漂白: Na2O2 HClO O3→强氧化剂、发生氧化复原反响、不行逆②临时漂白: SO2 → 化合成不稳固无色物质、非氧化复原反响、可逆物理吸附:活性炭8. C 与浓 H 2SO4反响产物的鉴识:操作顺仪器中盛装的药品各试剂的作用应出现的现象序①无水 CuSO4 鉴识 H 2O 变蓝②品红溶液鉴识 SO2 红色褪去③酸化的 KMnO 4溶液除掉 SO2 紫色变浅甚至消逝④品红溶液鉴识 SO2能否红色不褪去除净⑤澄清石灰水鉴识 CO2 溶液变污浊注意: H2 O 必定要先鉴识,因为从其余水溶液中出来的气领会带出H2O 9.用 Na2SO3 +2HCl = 2NaCl + SO 2↑+ H 2O 原理制取的 SO2中含有 HCl 和 H2O,怎样除掉:操作顺仪器中盛装的药品各试剂的作用序除掉 HCl 的同时生成 SO2先通入饱和(NaHSO 3 + HCl = Na Cl + SO 2↑+ H 2O)①(不通入 H 2O 除掉 HCl 的原由:SO2也以1:40 溶于 H2O )NaHSO3 溶液(不通入饱和 Na2SO3溶液的原由:Na2SO3 + SO2 + H2O = 2NaHSO 3)②再通入浓 H2 SO4 除掉 H 2O第四章非金属及其化合物复习(练习题)1、能储存在有玻璃塞的磨口试剂瓶里的试剂是()A 、HF 溶液B、 KOH 溶液C、盐酸D、水玻璃2、以下说法中,不正确的选项是()A、光导纤维是以二氧化硅为主要原料制成的B、硅是常温下化学性质的半导体资料C、N 2和 H 2在必定条件下合成氨属于的固定D、焚烧必定要有氧气参加3、以下对氯气的表达正确的选项是()A、氯气可使湿的红布条退色,因此氯气拥有漂白性B、氯气没有漂白性,但通入品红溶液中,品红退色C、在往常状况下,氯气能够和任何金属直接化合D、闻其气味时要当心将集气瓶放在鼻孔下直接闻4、以下对于浓硫酸的性质的说法中,正确的选项是()A、浓硫酸的脱水性属于物理性质,相应的变化过程是物理变化B、是一种干燥剂,能干燥氨气、氢气等多种气体C、在常温下能够和铁、铝等金属反响生成相应的盐D 、CuSO4· 5H 2O 晶体投入到浓硫酸中,固体颜色由蓝变白5、 CO2通入以下溶液中,不行能产生积淀的是()A 、氯化钙溶液B、石灰水C、饱和碳酸钠溶液 D 、硅酸钠溶液6、往常状况下,能大批共存且能用浓硫酸干燥的一组气体是()A 、HCl 、CO2、NH 3B 、 CO、 H 2、NH 3C、O2、 SO2、 NO D 、H 2、 HCl 、 N27、以下有关新制氯水的表达正确的选项是()A 、氯水中氯元素的化合价只有+1 价和 -1 价B 、氯水搁置数天后PH 将变大C、氯水可使蓝色石蕊试纸先变红后退色D、氯水经光照后有气泡放出,该气体是氯气8、生石灰中常常含有碳酸钙和二氧化硅等杂质,要查验能否存在这两种杂质,最好采用()A 、水B、盐酸C、硫酸 D 、烧碱溶液9、能够用于鉴识二氧化碳和二氧化硫的溶液是()A 、澄清石灰水B 、氯化钡溶液C、紫色石蕊试液 D 、品红溶液10、在以下反响中,硝酸只表现氧化性,不表现酸性的是()A 、FeO+浓 HNO 3B 、C+浓 HNO 3C、 Fe2O3+浓 HNO 3D、 Cu+浓 HNO 311、为了除掉二氧化碳中的二氧化硫气体,以下仪器和药品:①洗气瓶、②干燥管、③固体生石灰、④苏打溶液、⑤小苏打溶液。
普通化学赵士铎[第三版]习题答案解析
![普通化学赵士铎[第三版]习题答案解析](https://img.taocdn.com/s3/m/b3723699b0717fd5360cdcc0.png)
普通化学(第三版)习题答案中国农业大学无机及分析化学教研组编第一章 分散系1.1 (1) 溶液的凝固点下降(2) 土壤溶液浓度过大,渗透压大于植物根细胞液的渗透压 (3) 溶液的凝固点下降1.2 沸点不断上升,至溶液达到饱和后,沸点恒定;蒸气凝结温度恒定,等于溶剂的沸点。
1.3%6.1)O H (/1)O H ()O H ()O H ()O H ()O H ()O H (kg mol 91.097.0%mol kg 034.0/%0.3)O H (1)O H (/)O H ()O H (Lmol 88.0mol 34g L g 1000%0.3)O H ()O H ()O H (2222222222221-1-222222221-1--1222222=+=+=⋅=⋅=-=⋅=⋅⋅⨯==M b b n n n x w M w b M w c ρ1.4 凝固点自高至低顺序:葡萄糖溶液、醋酸溶液、氯化钾溶液 1.5b = 1.17 mol ⋅kg -1∆T b = K b b = 0.52K ⋅kg ⋅mol -1⨯1.17 mol ⋅kg -1= 0.61K T b = 373.76K = 100.61℃∆T f = K f b = 1.86K ⋅kg ⋅mol -1⨯1.17 mol ⋅kg -1= 2.18K T f = 270.87K = - 2.18 1.6 π = cRT =RT VMm / 1-4-1-1m ol g 100.2kPa499.0L 10.0K 300K m ol L 8.31kPa g 40.0⋅⨯=⨯⨯⋅⋅⋅⨯==πV mRT M1.721:2: 30 1280.3 : 1610.2 : 15.9= 化合物中C 、H 、O 原子数比为21:30:21--1A b B f mol g 3105.00g0.33K g 100.0mol kg K 12.5⋅=⨯⨯⋅⋅=∆=m T m K M故该化合物的化学式为C 21H 30O 21.81-B 2BB 22222mol g 4.342)O H (/)O H (}CO )NH {(/}CO )NH {(⋅=∴=M m M m m M m第二章化学热力学基础2.1 (1)错误;(2)正确;(3) 错误;(4)错误;(5)正确;(6)正确;(7) 错误;(8)错误2.2 (1/4)[反应式(1)-反应式(2)]得:(1/2)N2(g)+(1/2)O2(g)=NO(g)∴∆f H mθ(NO,g)=(1/4){ ∆r H mθ(1) - ∆r H mθ(2)}=(1/4)[-1107kJ⋅mol-1-(-1150 kJ⋅mol-1)]=90 kJ⋅mol-12.3 (1/4)[反应式(3)-反应式(4)+3⨯反应式(2)- 反应式(1)]得:N2(g)+2H2(g)=N2H4(l) (5)∴∆f H mθ(N2H4,,g)=(1/4){ ∆r H mθ(3) - ∆r H mθ(4)+ 3⨯∆r H mθ(2) - ∆r H mθ(1)} =(1/4){-143kJ⋅mol-1-(-286kJ⋅mol-1+3⨯(-317kJ⋅mol-1)-(-1010kJ⋅mol-1)) =50.5 kJ⋅mol-12⨯反应式(4)-反应式(5)得:N2H4(l)+ )O2(g)= N2(g)+2H2O(l)∆r H mθ=2⨯∆r H mθ(4)- ∆r H mθ(5)=2⨯(-286 kJ⋅mol-1)- 50.5kJ⋅mol-1= -622.5 kJ⋅mol-12.4 ∆r H mθ=2∆f H mθ(CO2,g)+3∆f H mθ(H2O,l)+(-1)⨯∆f H mθ(CH3OCH3,l)+(- 3)∆f H mθ(O2,g)∴∆f H mθ(CH3OCH3,l) =2∆f H mθ(CO2,g) +3∆f H mθ(H2O,l)- ∆r H mθ= -183 kJ⋅mol-1CO(g)+(1/2)O2(g)由题意知,∆r H mθ(1)<0, ∆r H mθ(2)<0, ∆r H mθ(3)<0∆r H mθ(1)= ∆r H mθ(2)+ ∆r H mθ(3)∆r H mθ(1)-∆r H mθ(3)= ∆r H mθ(2)<0即:以碳直接作燃料时放热较多2.6 C(s)+H2O(g)=CO(g)+H2(g)∆r H mθ= ∆f H mθ(CO,g)+ (-1)∆f H mθ(H2O,g)=-110.5 kJ⋅mol-1 -(-)241.8 kJ⋅mol-1=131.3 kJ⋅mol-1(1) CO2(g) +H2O(g)∆r H mθ(2) ∆r H mθ(3)CO(g)+H2(g)+O2(g)∆r H mθ(1)= ∆r H mθ(2)+ ∆r H mθ(3) ∴∆r H mθ(1) - ∆r H mθ(3) = ∆r H mθ(2)>0由题意知,∆r H mθ(1)<0, ∆r H mθ(3)<0 故:以水煤气作燃料时放热较多2.7 均为熵增过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 电化学与金属腐蚀1. 是非题(对的在括号内填“+”号,错的填“-”号)(1)取两根金属铜棒,将一根插入盛有0.13mol dm-⋅4CuSO 溶液的烧杯中,另一根插入盛有13mol dm -⋅4CuSO 溶液的烧杯中,并用盐桥将两支烧杯中的溶液连接起来,可以组成一个浓差原电池。
(+)(2)金属铁可以置换2Cu +,因此三氯化铁不能与金属铜发生反应。
(-) (3)电动势E (或电极电势ϕ)的数值与电池反应(或半反应式)的写法无关,而平衡常数K θ的数值随反应式的写法(即化学计量数不同)而变。
(+)(4)钢铁在大气中的中性或酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。
(+)(5)有下列原电池:3344()(1)(1)()Cd CdSO mol dm CuSO mol dm Cu ---⋅⋅+若往4CdSO 溶液中加入少量2Na S 溶液,或往4CuSO 溶液中加入少量425CuSO H O ⋅晶体,都会使原电池的电动势变小。
(-)2、选择题(将所有正确答案的标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:2233272614267Cr O Fe H Cr Fe H O -++++++=++322422Fe Sn Fe Sn +++++=+它们中间最强的氧化剂和最强的还原剂是 (b) (a )23Sn Fe ++和 (b )2227Cr O Sn -+和 (c )34Cr Sn ++和 (d )2327Cr O Fe -+和(2)有一个原电池由两个氢电极组成,其中一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液2()100p H kPa =⎡⎤⎣⎦设应为 (b)(a )30.1mol dm HCl -⋅(b )330.10.1mol dm HAc mol dm NaAc --⋅+⋅(c )30.1mol dm HAc -⋅ (d )3340.1mol dm H PO -⋅ (3)在下列电池反应中223()()(1.0)()Ni s Cu aq Ni mol dm Cu s ++-+=⋅+当该原电池的电动势为零时,2Cu +的浓度为 (b)(a )2735.0510mol dm --⨯⋅ (b )2135.7110mol dm --⨯⋅ (c )1437.1010mol dm --⨯⋅ (d )1137.5610mol dm --⨯⋅ (4)电镀工艺是将欲镀零件作为电解池的( );阳极氧化是将需要处理的部件作为电解池的( ) (a ,b )(a )阴极 (b )阳极 (c )任意一个极3、填空题(1)有一种含Cl Br I ---、和的溶液,要使I -被氧化,而Cl Br --、不被氧化,则在以下常用的氧化剂中应选( d )为最适宜。
(a )4KMnO 酸性溶液,(b )227K Cr O 酸性溶液,(c )氯水,(d )243()Fe SO 溶液 (2)有下列原电池:23332333()(1),(0.01)(1),(1)()Pt Fe mol dm Fe mol dm Fe mol dm Fe mol dm Pt +-+-+-+--⋅⋅⋅⋅+该原电池得负极反应为(23Fe Fe e ++-=+),正极反应为(32Fe e Fe +-++=)。
(3)电解含有下列金属离子的盐类水溶液:222Li Na K Zn Ca Ba Ag +++++++、、、、、、。
其中(2Zn Ag ++、)能被还原成金属单质,(22Li Na K Ca Ba +++++、、、、)不能被还原成金属单质。
4、根据下列原电池反应,分别写出各原电池中正、负电极的电极反应(须配平)。
(1)22Zn Fe Zn Fe +++=+ (2)322222I Fe I Fe -+++=+ (3)422Ni Sn Ni Sn ++++=+(4)422325854Fe H MnO Mn Fe H O ++-++++=++ 解:(1)负极:2()()2Zn s Zn aq e +-=+ 正极:2()2()Fe aq e Fe s +-+= (2)负极:22()()2I aq I s e --=+ 正极:32()()Fe aq e Fe aq +-++= (3)负极:2()()2Ni s Ni aq e +-=+ 正极:42()2()Sn aq e Sn aq +-++= (4)负极:23()()Fe s Fe aq e ++-=+正极:242()8()5()4()MnO aq H aq e Mn aq H O l -+-+++=+5、将上题各氧化还原反应组成原电池,分别用图示表示各原电池。
解:(1)22()()Zn Zn Fe Fe ++-+ (2)232(),()Pt I I Fe Fe Pt -++-+ (3)224(),()Ni Ni Sn Sn Pt +++-+(4)2324(),,,()Pt Fe Fe Mn MnO H Pt +++-+-+6、参见标准电极电势表,分别选择一种合适的氧化剂,能够氧化:(1)2Cl Cl -成;(2)2Pb Pb +成;(3)23Fe Fe ++成再分别选择一种合适的还原剂,能够还原:(a )32Fe Fe ++成;(b )Ag Ag +成; (c )2NO NO -成 解:合适的氧化剂为:(1)酸化的4MnO -;(2)3HNO ;(3)2Cl 合适的还原剂为:(1)Zn ;(2)2Sn +;(3)I -注:本题答案不单一,同学们可根据原理自行选择。
7、将锡和铅的金属片分别插入含有该金属离子的溶液中并组成原电池(用图示表示,要注明浓度)。
(1)23()0.0100c Sn mol dm +-=⋅;23() 1.00c Pb mol dm +-=⋅ (2)23() 1.00c Sn mol dm +-=⋅;23()0.100c Pb mol dm +-=⋅ 分别计算原电池的电动势,写出原电池的两电极反应和电池总反应式。
解:查教材附录,2(/)0.1375Sn Sn V θϕ+=-,2(/)0.1262Pb Pb V θϕ+=- (1)当23()0.010c Sn mol dm +-=⋅;23() 1.00c Pb mol dm +-=⋅时:22(/)(/)0.1262Pb Pb Pb Pb V θϕϕ++==- 故以锡电极做原电池负极,铅电极做正极。
原电池图示为:2323()(0.0100)(1.00)()Sn Sn mol dm Pb mol dm Pt +-+--⋅⋅+ 正极反应:22Pb e Pb +-+= 负极反应:22Sn Sn e +-=+电池总反应式:22Pb Sn Pb Sn +++=+2220.05917(/)(/)lg ()/VSn Sn Sn Sn c Sn c nθθϕϕ+++=+0.059170.1375lg 0.01000.1972VV V =-+=-原电池电动势:22(/)(/)E Pb Pb Sn Sn ϕϕϕϕ+++-=-=- =-0.1262V-(-0.197)V=0.071V (2)当23() 1.00c Sn mol dm +-=⋅;23()0.100c Pb mol dm +-=⋅时:22(/)(/)0.1375Sn Sn Sn Sn V θϕϕ++==-故以铅电极做原电池负极,锡电极做正极。
原电池图示为:2323()(0.100)(1.00)()Pb Pb mol dm Sn mol dm Sn +-+--⋅⋅+ 正极反应:22Sn e Sn +-+= 负极反应:22Pb Pb e +-=+电池总反应式:22Sn Pb Sn Pb +++=+原电池电动势:22(/)(/)E Sn Sn Pb Pb ϕϕϕϕ+++-=-=- =-0.1375V-(-0.156)V=0.019V8、求反应22()()Zn Fe aq Zn aq Fe +++=+在298.15K 是的标准平衡常数。
若将过量极细的锌粉加入2Fe +溶液中,求平衡时2()Fe aq +浓度对2()Zn aq +浓度的比值。
解: 22()()()()Zn s Fe aq Zn aq Fe s +++=+22(/)(/)E Fe Fe Zn Zn θθθθθϕϕϕϕ+++-=-=-= -0.447V -(-0.7618V )=0.315Vlg /0.0591720.315/0.0591710.6K nE V V V θθ==⨯=故2211()/( 2.310)1/eq eq c Fe c Zn K θ++-⨯==,反应进行得相当完全。
9、将下列反应组成原电池(温度为298.15K ):3222()2()()2()I aq Fe aq I s Fe aq -+++=+(1) 计算原电池的标准电动势;(2) 计算反应的标准摩尔吉布斯函数变; (3) 用图示表示原电池;(4) 计算23() 1.010c I mol dm ---=⨯⋅以及32()()/10c Fe c Fe ++=时原电池的电动势。
解:(1)查阅教材附录:32(/)0.771Fe Fe V θϕ++=;2(/)0.5355I I V θϕ-=。
2220.05917(/)(/)lg ()/VPb Pb Pb Pb c Pb c nθθϕϕ+++=+0.059170.1262lg 0.1000.1562VV V =-+=-2102()/ 4.410()/eq eq c Zn c K c Fe c θθθ++==⨯322(/)(/)E Fe Fe I I θθθθθϕϕϕϕ++-+-=-=-= 0.771V - 0.5355V = 0.236V(2)r mG nFE θθ∆=- 112964850.513456.C mol V kJ mol --=-⨯⋅⨯=-⋅ (3)原电池图示:322(),()Pt I I Fe Fe Pt -++-+ (4)10、当pH=5.00,除()H aq +离子外,其余有关物质均处于标准条件下,下列反应能否自发进行?试通过计算说明之。
24222()16()10()5()2()8()MnO aq H aq Cl aq Cl g Mn aq H O l -+-+++=++解: 由反应24222()16()10()5()2()8()MnO aq H aq Cl aq Cl g Mn aq H O l -+-+++=++组成原电池。
正极:242()8()5()4()MnO aq H aq e Mn aq H O l -+-+++=+ 负极:22()()2Cl aq Cl g e --=+ 当pH=5.00,其他物质均处于标准条件时:22(/)(/) 1.358Cl Cl Cl Cl V θϕϕ--==可见242(/)(/)MnO Mn Cl Cl ϕϕ-+-<,故该反应不能自发进行。
