植物细胞融合(实验)(精选)
第四章细胞融合

2、细胞融合的基本过程
(1)细胞在促融剂或正弦电场 作用下凝集,彼此靠近; (2)两个相邻细胞之间的质膜 相互融合,随后两个亲本细 胞质膜上的受体、糖蛋白、 糖脂等质膜成分也在融合后 的质膜上重新分布; (3)细胞质发生融合; (4)细胞核融合,形成单核融 合细胞。
动植物细胞的融合过程
植物细胞融合过程
生物种类细胞来源成功年代烟草两个种间苷蓝青菜大豆马唐草矮牵牛龙面花大麦花生大麦大豆小麦矮牵牛油菜大豆油菜大豆玉米大豆大豆野豌豆大麦蚕豆大豆草香木犀酵母菌鸡大豆烟草大豆秋水仙人胡萝卜番茄马铃薯人小鼠叶叶叶根愈伤组织叶叶花瓣种子种子叶悬浮细胞叶花瓣叶悬浮细胞叶悬浮细胞叶悬浮细胞悬浮细胞悬浮细胞叶根悬浮细胞叶原生质体血红细胞悬浮细胞叶悬浮细胞叶腹水癌细胞原生质体叶根尖纤维肉瘤细胞畸胎瘤细胞1972197219721972197219721972197219721972197219721972197219721972197219721972几种细胞融合成功的例子植物融合细胞成长状态对比右瓶为地面融合的细胞左瓶中为太空微重力环境下融合的细胞动物细胞融合实验使用的小白鼠白化豚鼠hartley豚鼠?4意义和应用?1可以避开生殖细胞的受精过程在亲缘关系较远甚至毫无亲缘关系的物种间实现基因转移创造出自然界中没有的新物种
(1)将两种不同亲本细胞各5×l06混匀; (2)离心沉淀,吸去上清液; (3)加1ml 50%PEG溶液,用吸管吹打,使之与细胞接触1分钟;
(4)加9ml 培养液,离心沉淀,吸去上清液;
(5)加5ml 培养液,分别接种5个直径60mm平皿,每个平皿加培养 液至 5ml,37℃的CO2培养箱中培养。
叶——叶 叶——根 愈伤组织——叶 叶——花瓣 种子——种子 叶——悬浮细胞 叶——花瓣 叶——悬浮细胞 叶——悬浮细胞 悬浮细胞——悬浮细胞 叶——根 悬浮细胞——叶 原生质体——血红细胞 悬浮细胞——叶 悬浮细胞——叶 腹水癌细胞——原生质体 叶——根尖 纤维肉瘤细胞——畸胎瘤细胞
植物实验(一)植物细胞与细胞后含物

(三)植物细胞后含物 ——1.观察马铃薯淀粉粒
淀粉粒在形成 时,先从一个 点(脐点)开 始,向外层层 沉积,形成许 多同心的层 次——层纹 (直链淀粉和 支链淀粉交替 沉积而成)。
淀粉粒的形式
【操作】
切取马铃薯一小块,用刀片刮少许混浊 液,置于载玻片上,或用马铃薯块直接 涂片,加蒸馏水一滴,盖上盖玻片。
【操作】
2.水合氯醛透化装片:在载玻片中央加水 合氯醛试液1-2滴,用牙签挑取半夏粉末 适量,置于水合氯醛试液中,拌匀,置 酒精灯上微热,并用牙签不断搅拌,稍 干(切勿烧焦),离火微冷,再上法处 理1-2次,最后滴加稀甘油,盖上盖玻片。
半夏草酸钙针晶:存在于薄壁细胞中,成束或散在,针晶 束呈淡黄色或深灰色,散在的则无色透明,有较强的折光 性。
(二)植物细胞基本结构
显微镜下的植物细胞构造
细胞壁 细胞 细胞核
叶绿体 质体 白色体
细胞质
有色体
液泡
(二)植物细胞基本结构 ——1.观察洋葱鳞叶表皮细胞
【操作】制作临时装片
取载玻片和盖玻片各一片,擦净,取蒸馏 水一滴置于载玻片中央,备用。撕取表皮 (约5mm×3mm)→90%酒精固定→置 于水滴中展平→盖上盖玻片,将标本片置 显微镜下观察 。
Байду номын сангаас
【观察】
(三)植物细胞后含物 ——2.观察半夏淀粉粒和草酸钙针晶
草酸钙结晶类型:蔟晶、针晶、方晶、砂晶、柱晶。
簇晶─ ─由许多单晶联合而 成的复式结构,呈球形。
针晶─两端尖锐的针形,常 聚集成束。
【操作】
1.用牙签挑取少许半夏粉末,置于载玻片 的蒸馏水滴中,搅匀,盖上盖玻片,将标 本片置显微镜下观察。
普通光学显微镜 的结构
04-植物原生质体的制备及融合-卢文

原生质体的制备及融合生31 卢文2003012377一、实验目的:a)学习植物原生质体的分离制备技术,观察原生质体形态。
b)学习植物原生质体的融合技术,观察融合原生质体时其形态及变化。
二、实验原理:详见讨论。
三、实验用品:显微镜、擦镜纸、剪子、镊子、小平皿、吸管、直式漏斗、300目尼龙网、10ml离心管、载玻片、盖玻片。
四、试剂:a)洗涤液:甘露醇0.6MCaCl2·2H2O 8mMNaH2PO4·H2O 2mMpH=5.6b)酶混合液:纤维素酶1%果胶酶0.5-0.7%甘露醇0.6MCaCl2·2H2O 8mMNaH2PO4·H2O 7mMMES 3mMpH=5.6c)PEG溶液:PEG-6000 40%CaCl2·2H2O 3.5mMKH2PO4·H2O 0.7mM葡萄糖0.3mMpH=5.8d)高Ca,高pH洗涤液:CaCl2·2H2O 100mMTris 50mM山梨醇100mMpH=10.5e)蔗糖溶液:20%五、实验步骤:a)原生体的制备i.将新鲜花瓣用蒸馏水洗干净,用滤纸吸干表面水分。
ii.用尖头镊剥去木料的下表皮或将其剪成小细条,加入几滴酶液恒温振荡半小时。
iii.酶解好的原生质体混合液经300目尼龙网过滤到10ml离心管,加入少量洗涤液定容至4ml,此时,未被酶解的大块组织留在尼龙网上。
iv.500rpm离心5分钟,弃去上清液,加洗涤液至约2ml吹打均匀。
500rpm5min重复离心一次,彻底去除酶液。
v.加8滴洗涤液,悬浮原生质体。
vi.镜检,检察原生质形态和浓度,看看是否有碎片,本试验中碎片较少,故未做蔗糖漂浮。
b)PEG融合:i.在小平皿内各滴三滴原生质体悬液,静置沉淀。
ii.各缓缓滴加一滴PEG在其中两滴原生质体悬液上,iii.在另一滴上滴加一滴高Ca2+高pH洗液。
iv.镜下观察,1-2分钟后,在原先加入PEG的一滴悬液上加入一滴高Ca2+高pH洗液。
(完整版)植物体细胞杂交技术

局限性:未能让杂种植物按照人们的需要表现出亲代的优
良。
原因是:生物基因的表达不是孤立的,它们之间是相互调控、 相互影响的,不能再像亲本遗传物质一样有序表达,杂交植株 不能地上长番茄、地下结马铃薯。
现学现用
• 如何培育出地上结大豆地下结花生的杂种植株呢?
本节小结
一、植物体细胞杂交的概念
将不同种的植物体细胞,在一定条件下融合成杂种细胞, 并把杂种细胞培育成新的植物体的技术。
(6)从理论上讲,杂种植株的育性为 可育。 若运用传统有性杂交方法能否实现?不能 , 原因是 因为不同种生物之间存在生殖隔离。 因此,这项研究对于培养作物新品种方面 的重大意义在于 克服远源杂交不亲和的障碍。 (7)利用植物体细胞杂交的方法培育作物 新品种过程中,遗传物质的传递是否遵循 孟德尔的遗传规律?为什么? 否
植物体细胞杂交过程示意图
植 物 细 胞 去壁 等量
原
生 质
原 生 质
体体
融
合
再
愈
杂
生杂
伤
种
细 胞 壁
种 细 胞
脱 分
化
组 织
再 分 化
植 株
去壁 纤维素酶
离心、振 动、电刺
筛 选
激、
果胶酶
ቤተ መጻሕፍቲ ባይዱ聚乙二醇
意义:克服远源杂交不亲和的障碍,培育出自然
界中没有的、具有优良品质的新品种。
白 菜
甘
蓝
白菜-甘蓝
生产周期短、耐热、易储藏
小试牛刀
2.植物体细胞杂交技术去除细胞壁的原因是 (C)
A、植物体细胞结构中不包括细胞壁 B、细胞壁使原生质体失去活力 C、细胞壁阻碍了原生质体融合 D、细胞壁不是原生质体的组成成分
植物体细胞融合技术

2.1.1植物细胞工程的基本技术--------植物体细胞融合技术学习目标1、简述植物组织培养和植物体细胞杂交技术。
2、尝试进行植物组织培养。
学习重点1、植物组织培养的原理和过程2、植物体细胞杂交的原理一、 植物体细胞杂交技术1.概念:不同种植物的 ,在一定条件下融合成 ,并把杂种细胞培育成新的 的技术。
2.过程 不同的植物体细胞果胶酶纤维素酶−−−→−不同细胞原生质体−−−→−人工诱导原生质体融合 →杂种细胞→杂种植株。
3.植物体细胞杂交步骤:(1)去掉细胞壁,分离出有活力的 ,目前最常用的去细胞壁的方法是酶解法,也就是在温和条件下用 、 去除植物细胞的细胞壁。
(2)不同植物体细胞原生质体融合,必须通过 法和 法来诱导融合。
方法有: 等促使原生质体融合。
化学法是用(PEG)作为诱导剂来诱导融合。
融合后再生出 。
(3)用植物组织培养方法进行培育,可得到杂种植株。
如图在此过程中需要注意的问题有:①植物体细胞杂交过程中,植物体细胞融合所依据的生物学原理是 ;植物组织培养的理论基础是 。
②体细胞融合成功以后,既有AB 型杂种细胞,还能形成AA 型和BB 型两种融合细胞,但只有AB 型细胞是植物体细胞杂交所形成的杂种细胞,因此在杂种细胞形成后还应有一个 过程。
③目前常用的去除细胞壁的方法是 ,保证了原生质体活性。
植物体细胞融合完成的标志是新细胞壁的形成。
④植物体细胞杂交过程仍以植物组织培养为前提,通过植物组织培养完成杂种植株的培育过程。
⑤植物体细胞杂交的最大突破是克服远缘杂交不亲和的障碍,但是目前仍有许多理论和技术问题没有解决,离推广应用仍有一定距离。
【当堂检测】 1.不能..用于人工诱导原生质体融合的方法是 ( ) A .振动 B .电刺激 C .PEG D .重压 2.与传统的有性杂交法相比,植物体细胞杂交的最大优点是 ( ) A .可使两个亲本的优良性状组合到一起 B .可以克服远缘杂交不亲和的障碍 C .可以培育出高产性状明显的新品种 D .可以降低生成成本,提高接济效益3.植物体细胞杂交的过程实质是 ( )A .细胞质融合的过程B .细胞核融合的过程C .细胞膜融合的过程D .细胞原生质体融合的过程 4.原生质体融合后,需诱导产生细胞壁,参与此过程的细胞器是 ( ) A .叶绿体、高尔基体 B .线粒体、高尔基体 C .叶绿体、线粒体 D .线粒体、内质网 5.高度分化的植物细胞、组织和器官进行组织培养可以形成愈伤组织,下列叙述错误..的是 ( )A .该愈伤组织是细胞经过脱分化和分裂形成的B .该愈伤组织的细胞没有全能性C .该愈伤组织是由排列疏松的薄壁细胞D .该愈伤组织可以形成具有生根发芽能力的胚状结构 6.以下不能..说明细胞具有全能性的实验是 ( ) A .胡萝卜韧皮部细胞培育出植株 B .紫色糯性玉米种子培育出植株 C .转入抗虫基因的棉花细胞培育出植株 D .番茄与马铃薯体细胞杂交后培育出植株7.植物组织培养过程中的脱分化是指 ( )A .植物体的分生组织通过细胞分裂产生新细胞B .未成熟的种子经过长期培养,培养出幼苗的过程C .植物的器官、组织或细胞,通过离体培养产生愈伤组织的过程D .取植物的枝芽培育成一株新植物的过程8.在脱分化形成愈伤组织的过程中,下列各项为非.必要条件的是()A.培养基需要消毒灭菌B.给予适宜的温度C.给予充足的光照D.给予适宜的养料和激素9.通过植物体细胞杂交,获得一个杂种植株需要的步骤是()A.分离原生质体→诱导原生质体融合→组织培养→得到杂种植物B.分离原生质体→原生质体直接融合→组织培养→杂种植株C.获取细胞→原生质体融合→组织培养→杂种植株D.获取细胞→原生质体直接融合→组织培养→杂种植株10.胚状体是在植物组织培养的哪一阶段上获得的()A.愈伤组织B.再分化C.形成完整植株D.取离体组织11.利用植物的茎尖、茎段、花药、花粉等,在无菌的条件下,放在玻璃器皿中人工配制的培养基上,使它发育成完整的植株。
4.原生质体培养与细胞融合(植物组织培养)

原生质体培养与细胞融合第一节原生质体培养一、原生质体的培养概况1、概念:植物的原生质体:指除去细胞壁以后的裸露细胞。
原生质体培养:是将植物细胞游离成原生质体,在适宜的培养条件下,使其再生细胞壁,进而细胞进行持续分裂形成细胞团,进一步生长形成愈伤组织或胚状体,最后分化或发育形成完整植株的过程。
原生质体培养特点是:①比较容易摄取外来的遗传物质,如DNA;②便于进行细胞融合,形成杂交细胞;③与完整细胞一样具有全能性,仍可产生细胞壁,经诱导分化成完整植株。
原生质培养首先在烟草上获得成功。
2、原生质体培养的意义①比较容易摄取外来的遗传物质(壁中有活性很强的核酸酶)—研究植物原生质体培养和再生植株技术,有可能采用细胞遗传工程的方法培育出新品种。
②便于进行细胞融合,形成杂交细胞—可广泛地重组植物界优良遗传性状,创造新物种和新品种(如能固N的禾本科植物,高光效植物,高抗植物)③原生质体可作为遗传理论研究的材料—细胞生物学、植物生理学、遗传学、分子生物学等,如细胞起源、壁生物合成、胞间相互作用、不亲和性、激素作用机理等3、原生质体培养程序取材→预处理→分离→纯化→活力检测→培养→细胞壁再生→细胞分裂分化→愈伤组织→愈伤分化→再生植株取材:大田叶片(消毒灭菌)、无菌试管苗叶片、愈伤组织或悬浮细胞预处理:黑暗、低温、叶片萎蔫处理、预培养、和不同光质照射等,可提高原生质体产量和代谢活力。
二、原生质体的分离和纯化1 原生质体的分离叶肉组织是制备原生质理想的材料,遗传性状一致。
细胞壁主要成分是纤维素、半纤维素、果胶质等。
分离原生质的方法主要有以下两种:机械法和酶解法(1)机械法①首先将细胞放在高渗的糖溶液中(水势低),使细胞发生质壁分离(细胞失水),原生质体收缩成球状;②破碎组织,从伤口处可释放出完整的原生质体。
最早在19世纪末,利用机械法分离藻类原生质。
(缺点)获得的原生质体少、产生的原生质体的细胞类型受到限制。
一般取材局限于具有液泡化程度较大的细胞或长形细胞的组织。
植物细胞工程课件第五章细胞融合

• 用胰蛋白酶、机械法或二者兼用来分离细 胞,对其进行单层或悬浮培养,获得单个分 散的细胞。
5.3 细胞融合的方法
•自发融合 NaNO3 高pH-高Ca离子
仙台病毒
•诱发融合
PEG
电场
……
5.3.1 生物融合法-----仙台病毒法
• 病毒类是研究得最早的促融剂 • 疱疹病毒、天花病毒、副流感型 病毒、副黏液病毒等致癌、致病 病毒,都能诱导细胞融合
不对称杂种:亲本双方原生质体发生部分融
合,或发生了融合,但融合体在分裂过程中一
方的部分核或质被排斥,因而其体细胞染色体
数目达不到双亲之和。其外部形态呈双亲的中
间型或偏一方形态,一般表现为雄性器官退化,
正常花粉粒极少,育性低。
胞质杂种:携带一个亲本的核和两个亲本的
细胞质。
细胞融合的意义
• 实现远缘遗传重组 植 物
P1
融合液
P2
混合静止1min. P1 P2 加入PEG
选 择
融 合 加入稀释液
稀 释 加入培养基
培 养
洗 涤
洋葱根尖原生质体 (40×)
烟草叶肉原生质体 (40×)
烟草叶肉细胞和洋葱根 尖细胞原生质体融合
烟草叶肉和洋葱根尖细 胞原生质体的异源融合
原生质体的 诱导频率;同时 群体密度 与pH 值相关。
德国生理学家 Johannes Müller 1801-1858
• 毒性大,应用受到限制
• 1958 年 , 日 本 学 者 冈 田 善 雄 (Okada)发现了HVJ病毒可促
进细胞融合。
• 仙台病毒(HVJ)毒力低,对人
的危害小
日本学者Okada
• 易被紫外线或 β -丙炔内酯所灭 活
植物细胞工程实验 (1)

植物细胞工程实验一 培养基母液的制备一、实验目的与意义学习和掌握培养基母液的配制方法。
在配制培养基前,为了使用方便和用量准确,常常将大量元素、微量元素、铁盐、有机物质、激素类分别配制成比培养基配方需要量大若干倍的母液。
当配制培养基时,只需要按预先计算好的量吸取母液即可。
二、实验器材电子天平(称量为0.0001g )、电子天平(称量为0.01g )、烧杯(500ml 、100ml 、50ml )、容量瓶(1000ml 、100 ml 、50 ml 、25 ml )、细口瓶(1000 ml 、100 ml 、50 ml 、25 ml )、药勺、玻璃棒、电炉。
三、实验药品NH 4NO 3、KNO 3、CaCl 2·2H 2O 、MgSO 4·7H 2O 、KH 2PO 4、KI 、 H 3BO 3、 MnSO 4·4H 2O 、 ZnSO 4·7H 2O 、 Na 2MoO 4·2H 2O 、CuSO 4·5H 2O 、CoCl 2·6H 2O 、FeSO 4·7H 2O 、Na 2-EDTA·2H 2O 、肌醇 、烟酸、盐酸吡哆醇(维生素B 6)、盐酸硫胺素(维生素B 1)、甘氨酸。
四、实验步骤每种母液均配制500ml ,各成分的质量如下: 1、大量元素母液的配制表1 MS 培养基大量元素母液制备序号 药品名称培养基浓度(mg/L )扩大20称量(mg)备注1 NH 4NO 3 1650 16500 蒸馏水定容至500ml2 KNO3 1900 19000 3 CaCl 2·2H 2O 440 44004 MgSO 4·7H 2O 370 37005 KH 2PO 41701700各成分按照表1培养基浓度含量扩大20倍,用称量为0.01g 的电子天平称取,用蒸馏水分别溶解,按顺序逐步混合。
后用蒸馏水定容到500ml 的容量瓶中,即为20倍的大量元素母液。
植物细胞融合PPT课件

原生质体培养
融合细胞发生第一次分裂后加入400μl 2/2培养基,置于弱光照下培养,以后每隔 3d加400μl 2/2培养基,直到小细胞团形成。 将小细胞团转入1/3固体培养基,在弱光照 下培养5d后,抽掉固体培养基表面的浮液, 进行常温正常光照培养。愈伤组织约5mm 大小转入4/1培养基进行不定芽诱导。20~ 30d后,将不定芽转入MS基本培养基附加 0.02mg·L-1α-萘乙酸(NAA)促进植株生根。
4
概念(补充2)
体细胞杂交:Somatic hybridization 细胞融合:Cell fusion 原生质体融合:Protoplast fusion 无性杂交:asexual hybridization 超性杂交:Parasexual hybridization 超性融合:Parasexual fusion 细胞操作:Cell manipulation 细胞工程(Cell engineering)
• 三白草产河北、山东、河南和长江流域及以南各省区 • 鱼腥草分布于甘肃、陕西以南,东至台湾,西南至云南、
西藏,湖南全省广布;
8
2、试剂及试液
• 2.1 CPW溶液 • 2.2 混合酶液的组成 • 2.3 融合液的组成 • 2.4 原生质体培养基
9
CPW溶液
• 该溶液用于配制酶溶液,或分离原生质体以后纯化原生质 体时作为清洗液用,其常用配方如下:
37
杂种鉴定
• 再生植株形态学鉴定
当再生植株长到3-4片真叶时开始进行形态鉴 定。仔细观察植株的叶片形态,叶片颜色和植株 形态,通过与供受体植株形态进行比较,从形态 上鉴定杂种植株。
• 再生植株同工酶鉴定
利用聚丙烯酰胺等电聚焦电泳技术,参照郑晓鹰的方 法进行过氧化物酶(POX)酶谱分析。实验步骤如下:
植物细胞模型实验报告(3篇)

第1篇一、实验目的1. 理解植物细胞的基本结构和功能;2. 通过模型制作,加深对植物细胞结构的认识;3. 培养学生的动手操作能力和团队协作精神。
二、实验原理植物细胞是构成植物体的基本单位,具有典型的真核细胞结构。
细胞膜是细胞的边界,控制物质进出;细胞壁位于细胞膜外,起保护和支持作用;细胞质含有各种细胞器,如叶绿体、线粒体、内质网等,负责细胞的生命活动;细胞核是遗传信息的储存和复制中心。
三、实验用品1. 模型材料:PVC管、透明胶带、剪刀、彩色卡纸、彩色笔、透明胶、泡沫塑料、橡皮筋等;2. 实验工具:尺子、直尺、铅笔、量角器等;3. 实验药品:细胞壁、细胞膜、细胞质、细胞核、叶绿体、线粒体、内质网等模型材料。
四、实验步骤1. 制作细胞壁:取一段PVC管,剪成适当长度,用透明胶带封口,作为细胞壁;2. 制作细胞膜:取一段透明胶带,剪成适当宽度,包裹在细胞壁上,模拟细胞膜;3. 制作细胞质:取一段泡沫塑料,剪成适当大小,贴在细胞膜上,模拟细胞质;4. 制作细胞核:取一段彩色卡纸,剪成适当形状,涂上黑色,贴在细胞质上,模拟细胞核;5. 制作叶绿体、线粒体、内质网等细胞器:分别取不同颜色的彩色卡纸,剪成适当形状,贴在细胞质上,模拟各种细胞器;6. 制作液泡:取一段透明胶带,剪成适当宽度,包裹在细胞壁上,模拟液泡;7. 组装细胞模型:将所有部件组装在一起,形成一个完整的植物细胞模型。
五、实验结果与分析1. 实验结果:通过制作植物细胞模型,我们成功模拟了植物细胞的基本结构和功能,包括细胞壁、细胞膜、细胞质、细胞核、液泡、叶绿体、线粒体、内质网等;2. 实验分析:通过本次实验,我们加深了对植物细胞结构的认识,了解了各种细胞器的功能和分布。
同时,培养了我们的动手操作能力和团队协作精神。
六、实验总结本次实验通过制作植物细胞模型,让我们更加直观地了解了植物细胞的结构和功能。
在实验过程中,我们学会了如何利用实验用品和工具制作模型,提高了自己的动手操作能力。
植物细胞实验报告总结(3篇)

第1篇一、实验背景植物细胞作为生物学研究的重要对象,其结构、功能和生命周期的研究对于理解生命现象具有重要意义。
本实验旨在通过观察植物细胞的结构,了解其有丝分裂的过程,并分析实验过程中遇到的问题及改进措施。
二、实验目的1. 观察植物细胞的基本结构,包括细胞壁、细胞膜、细胞质、细胞核、叶绿体、液泡和线粒体等。
2. 学习植物细胞有丝分裂的过程,观察分裂各期的特点。
3. 分析实验过程中遇到的问题,并提出改进措施。
三、实验材料与仪器1. 实验材料:洋葱根尖、菠菜叶、辣椒表皮细胞、显微镜、载玻片、盖玻片、吸水纸、盐酸、酒精、碘液等。
2. 实验仪器:显微镜、烧杯、试管、酒精灯、镊子、剪刀等。
四、实验方法与步骤1. 植物细胞临时装片制作a. 将洋葱根尖、菠菜叶、辣椒表皮细胞等材料切成薄片。
b. 将薄片置于载玻片上,用吸水纸吸去多余水分。
c. 滴加适量盐酸和酒精,进行解离。
d. 用吸水纸吸去解离液,滴加碘液进行染色。
e. 盖上盖玻片,用显微镜观察。
2. 观察植物细胞有丝分裂过程a. 观察洋葱根尖压片,找到分裂相细胞。
b. 观察分裂各期的特点,包括间期、前期、中期、后期和末期。
c. 比较洋葱根尖细胞和马蛔虫受精卵细胞的有丝分裂过程。
五、实验结果与分析1. 植物细胞基本结构观察通过观察洋葱根尖压片,发现植物细胞具有以下基本结构:a. 细胞壁:位于细胞最外层,起到支持和保护作用。
b. 细胞膜:位于细胞壁内侧,控制物质的进出。
c. 细胞质:液态的,可以流动,含有各种细胞器。
d. 细胞核:位于细胞中央,贮存和传递遗传信息。
e. 叶绿体:位于细胞质中,进行光合作用的场所。
f. 液泡:位于细胞质中,含有细胞液,维持细胞渗透压。
g. 线粒体:位于细胞质中,进行呼吸作用的场所。
2. 植物细胞有丝分裂过程观察通过观察洋葱根尖压片,发现植物细胞有丝分裂过程包括以下五个阶段:a. 间期:细胞进行生长、代谢和准备分裂。
b. 前期:染色体开始凝缩,核膜逐渐消失,出现纺锤体。
细胞生物学实验报告1-动物细胞融合

【实验目的】1.了解动物细胞融合的常用方法2.学习化学融合和电融合的基本操作3.观察动物细胞融合过程中的行为和变化【实验原理】1.病毒诱导融合仙台病毒、牛痘病毒、新城鸡瘟病毒和疱疹病毒等可以介导细胞的融合。
这类病毒的被膜中含有融合蛋白,可以介导病毒同宿主细胞融合,也可以介导细胞与细胞的融合。
用紫外线灭活后,这些病毒即可诱导细胞发生融合。
2.化学诱导融合很多化学试剂都能诱导细胞融合,如聚乙二醇(PEG),二甲基亚砜、山梨醇、甘油、溶血性卵磷脂,磷脂酰丝氨酸等。
这些物质能够改变细胞膜脂质分子的排列,在去除这些物质之后,细胞膜趋向于恢复原有的有序结构。
在恢复的过程中相接处的细胞由于接口处脂质双分子层的相互亲和与表面张力,细胞膜融合,胞质流通,发生融合。
化学诱导方法,操作方便,诱导融合的概率比较高,效果稳定,适用于动、植物细胞,但对细胞具有一定的毒性。
PEG是被广泛使用的化学融合剂。
3.电击诱导融合包括电诱导、激光诱导等。
其中,电诱导是先使细胞在电场中极化成为偶极子,沿电力线排布成串,再利用高强度、短时程的电脉冲击破细胞膜,细胞膜的脂质分子发生重排,由于表面张力作用,两细胞发生融合。
电诱导方法具有融合过程易控制,融合概率高,作用机制明确,可重复性高等优点。
【实验材料】1.材料鸡血红细胞2.试剂 50%PEG、0.85%氯化钠溶液、GKN缓冲溶液3.器材倒置显微镜、离心机、量筒、注射器、载玻片、盖玻片、离心管等【实验步骤】1.取离心管,加入冷藏的鸡血1ml,加入4ml 0.85%氯化钠溶液,摇匀2.将离心管放入离心机中,以1000-1200r/min的速度离心5分钟左右。
取出离心管,弃掉上清液,再加入4ml氯化钠溶液,重复以上操作。
3.取离心管,弃掉上清液后,按照红细胞沉积的体积,加入1-2mlGKN溶液,摇匀。
4.取以上溶液1ml,加入3mlGKN溶液,再次摇匀5.取以上溶液1ml,加入0.5mlPEG,先静置1-2min,再将溶液摇匀后,静置1-2min。
细胞融合

细胞融合实验一、实验目的:1、了解细胞膜对物质通透性的一般规律。
2、了解溶血现象及其发生机制。
3、了解细胞膜的渗透性及各类物质进入细胞的速度。
二、实验原理:细胞膜是细胞与环境进行物质交换的选择性屏障。
它是一种半透膜,可选择性进行物质进出细胞。
各种物质进出细胞的方式是不同的。
水是生物界最普遍的溶剂,通透性高(肾小管、肠上皮、植物根细胞更高)水快速穿膜之谜:水孔蛋白水分子可以由渗透压低的一侧向渗透压高的一侧扩散,这种现象称为渗透。
将红细胞放在低渗盐溶液中,水分子大量渗到细胞内,可使细胞胀破,血红蛋白释放到介质中,由不透明的红细胞悬液变为红色透明的血红蛋白溶液,这种现象称为溶血。
将红细胞放在某些等渗盐溶液中,由于红细胞膜对各种溶质的通透性不同,膜两侧的渗透压平衡会发生改变,也会发生溶血现象。
因此,发生溶血现象所需时间长短可作为测量物质进入红细胞速度的一种指标。
本实验选用红细胞作为细胞膜通透性的实验材料,将其放入不同的介质溶液中,观察红细胞的变化。
溶血(Hemolysis)红细胞破裂,血红蛋白逸出称红细胞溶解,简称溶血。
可由多种理化因素和毒素引起。
在体外,如低渗溶液、机械性强力振荡、突然低温冷冻(-20℃~—25℃)或突然化冻、过酸或过碱,以及酒精、乙醚、皂碱、胆碱盐等均可引起溶血。
哺乳动物血浆的等渗溶液为0.9%NaCl 溶液,红细胞在低于0.45%NaCl 溶液中,因水渗入,红细胞膨胀而破裂,血红蛋白逸出。
在体内,溶血可为溶血性细菌或某些蛇毒侵入、抗原-抗体反应(如输入配血不合的血液)、各种机械性损伤、红细胞内在(膜、酶)缺陷、某些药物等引起。
溶血性细菌,如某些溶血性链球菌和产气荚膜杆菌可导致败血症。
疟原虫破坏红细胞和某些溶血性蛇毒含卵磷脂酶,使血浆或红细胞的卵磷脂转变为溶血卵磷脂,使红细胞膜分解。
物质穿膜运动符合物理化学规律:物质扩散速率除依赖于浓度梯度的大小外,还同物质的油水分配系数和分子大小有关。
实验二 植物细胞(二)

二、实验材料。 红辣椒、 马铃薯块茎、 蓖麻种子、 花生种子、 牵牛花、 松树木材浸离材料、 喜树皮层切片、 柿胚乳永久性切片、
6、花青素的观察 花青素是植物细胞常 见的代谢产物之一, 是一种色素,通常溶 解在细胞液中,对PH 值十分敏感。在酸性 条件下呈红色,在碱 性条件下呈蓝色,中 性时呈紫色,能使植 物茎、叶和花果呈现 红色、紫色和蓝色。
将牵牛花的花瓣平铺在载玻片上用刀 片轻轻刮去下表皮和部分薄壁组织,剩下 部分进行装片,在显微镜下观察,可见其 薄壁细胞内的细胞液呈红色(或蓝色), 这就是细胞液中花青素显现的颜色,它与 有色体不同的是没有一定的形态,充满整 个含有花青素的植物细胞的液泡里,呈均 匀分布的液体状态。
三、内容方法 1、细胞壁结构的观察
用喜树皮层永久片,置显微镜下观察,仔细辩 认细胞壁的层次,次生壁分为内层、中层、外 层;胞间层和初生壁不易辩别,笼统称为复合 胞间层。
2、单纹孔的观察 撕取新鲜红辣椒的表皮一小块, 用刀片刮去表皮以内的果肉细胞 (沿辣椒表面切取表皮薄片也可 以),然后以表皮的外切向壁朝 上装片,先用低倍镜观察,选择 薄而清晰的区域,换用高倍镜寻 找呈念珠状的两相邻细胞之细胞 壁,其上多处发生相对的凹陷, 即单纹孔对。
四、作业
1、绘二个柿胚乳细胞的胞间连丝图。 2、绘各种形状淀粉粒(单粒、复粒和半复 粒)图。
4.切片时手肘用力,手腕关节不动。
(3)贮藏蛋白质 用蓖麻种子胚乳作徒手切片, 挑选薄片放入盛有100%酒精的 培养皿中或凹玻片的凹处洗涤 数分钟,使切片中的脂肪溶解 在酒精中,然后,取出切片用 蒸馏水装片,置显微镜下观察, 可以看到胚乳细胞内的糊粉粒 存在,它是由贮藏在液泡中一 蛋白拟晶体、球蛋白体的充填 的无定形的胶质共同组成,如 果在切片中加一滴碘液,其蛋 白质会呈黄色。
植物细胞融合(实验)

A Alignment: Cells are brought into close contact by means of dielectrophor esis.
B Fusion pulse: A squarewave pulse of a mere 15 microseconds is applied in order to permeate the membrane. The membranes then fuse.
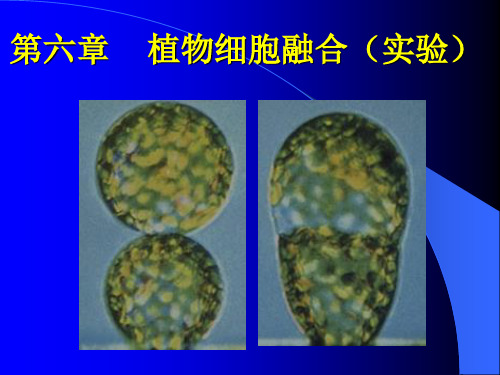
细胞在融合过程中发生的主要变化: 细胞在融合过程中发生的主要变化:
呈致密状态的体细胞在促融合剂的作用 下,细胞膜的性质发生变化。 首先出现 细胞膜的性质发生变化。 细胞凝集现象;然后部分凝集细胞之间的 细胞凝集现象; 膜发生粘连;继而融合形成多核细胞;在 膜发生粘连;继而融合形成多核细胞; 培养过程中多核细胞又进行核的融合而成 为单核的杂种细胞, 为单核的杂种细胞,而那些不能形成单核 的融合细胞在培养过程中逐渐死亡。 的融合细胞在培养过程中逐渐死亡。
(2)使用时再加入: 使用时再加入: 纤维素酶 R-10 果胶酶 R-10 0.8% 1%
因酶制剂经过高压灭菌处理后会失活, 因酶制剂经过高压灭菌处理后会失活, 故先将酶储液灭菌, 故先将酶储液灭菌,待用时再将酶制剂按 比例加入到第一步已灭菌的酶液内。 比例加入到第一步已灭菌的酶液内。
2)配制CaCl2.2H2O 0.16mol/L 配制CaCl (pH5.8-6.2 用于悬浮原生质体) pH5.8用于悬浮原生质体) 3)PEG液 3)PEG液: 30%( 30%(w/v) PEG(MW=6000) CaCl2.2H2O kH2PO4 山梨醇 调pH 5.8-6.2 5.80.01mol/L 0.00074mol/L 0.1 mol/L ;用时现配! 用时现配!
植物细胞融合(实验)
纯化的原生质体图示
完整洋葱原生质体(40×) 完整烟草原生质体(40×)
6.原生质体的密度测定 用血细胞记数板记数。每一样品测定3次,根 据测定结果,将悬浮原生质体密度调整至 5*105个/ml。 7.原生质体的融合 (一)PEG法 1)配制PEG液(5ml) 30%(w/v) PEG(MW=6000) 1.5 g CaCl2.2H2O 0.0074g kH2PO4 0.0005 g 山梨醇 0.0911g 调pH 5.8~6.2
Potato plants growing in a test tube
Freshly isolated potato protoplasts
Two protoplasts ready to fuse together
Fusion products begin to divide on nutrient medium
电融合法优点(与PEG法比较):
1、融合率高; Electrofusion 2、重复性强; 3、诱导仅发生在质膜接触部位,对细胞 或原生质 体伤害小; 4、融合是在同步状态下进行,活细胞数目多; 5、装置精巧,方法简单,可在显微镜下观察或录 像融合过程; 6、免去PEG诱导后的洗涤过程,诱导过程可控制 性强。
活性稳定、使用方便、而且促进细胞融合 的能力更强。PEG是一种多聚化合物。
PEG诱导原生质体融合的机理:
带有大量负电荷的PEG与水之间的氢
键结合,使溶液中自由水消失,由于高度 脱水引起原生质体凝集,形成大小程度不 同的凝集物。原生质体发生皱缩并大大扭 曲变形,邻近原生质体之间紧密接触。
在原生质体细胞膜与膜紧密接触的部 位,膜内蛋白质颗粒易位并凝聚。接着可
(2)使用时再加入: 纤维素酶 R-10 果胶酶 R-10 0.8% 1%
