醚的分类和命名
醚

CH3CH2CH2CHCH3 OC2H5
COOH
2-乙氧基戊烷
4-甲氧基苯甲酸 对甲氧基苯甲酸
OCH3
二、醚的化学性质 1. 盐的形成 . 醚中的氧原子上具有孤电子对 能接受质子, 氧原子上具有孤电子对, 醚中的氧原子上具有孤电子对,能接受质子,但接受质 子的能力较弱,只有与浓强酸中的质子, 子的能力较弱,只有与浓强酸中的质子,才能形成一种不稳 定的盐, 定的盐,称 盐 。
酚是离去基
例 (CH3)3COCH3 + HI
(CH3)3CI + CH3OH
历程 SN1
+ (CH3)3COCH3 H + I(CH3)3C + (CH3)3C + (CH3)3CI CH3OH
3.过氧化物的生成 3.过氧化物的生成
CH3CH2OCH2CH3+ O2 CH3CH2 O CHCH3 OOH
二苯醚不发生此反应。 注:⑴ 二苯醚不发生此反应。 过量, ⑵若HI过量,生成的醇还可以继续反应 过量 生成的醇还可以继续反应。 CH3CH2OH
HI △
CH3CH2I + H2O
SN2
δ+ H δ+ CH3CH2 O CH3 + I -
进攻进攻- C H 3位阻小
δ+
乙醇是离去基 SN2
δ+ H .. O δ+ p- 共轭使 C2H5 + I - , π 共轭 使 O 键加强
KCNS
[Fe(CNS)6]3- 变红
除去方法:加入还原剂 除去方法:加入还原剂Na2SO3 或FeSO4。
4.环氧乙烷 4.环氧乙烷
C
H2O
C
CH2 OH
醚的命名规则及举例

醚的命名规则及举例一、介绍醚是一类有机化合物,由氧原子连接两个烷基基团而组成。
它们广泛存在于自然界和化工领域,并具有多种应用。
在化学领域中,命名规则是非常重要的,它能准确地描述化合物的结构和性质。
本文将详细介绍醚的命名规则,并提供一些举例来帮助读者更好地理解。
二、命名规则醚的命名规则主要涉及到以下三个方面:命名前缀、主体命名和醚的分类。
2.1 命名前缀命名前缀用于描述连接在氧原子上的烷基基团,通常是通过字母“R”表示的。
如果只有一个烷基基团连接在氧原子上,那么命名前缀就是这个烷基基团的名称;如果有两个以上的烷基基团连接在氧原子上,那么需要使用特定的前缀来表示不同的基团数目。
以下是常见的命名前缀及其含义:•单基团:methyl、ethyl、propyl等•两个基团:dimethyl、diethyl、diisopropyl等•三个基团:trimethyl、triethyl、triisopropyl等•四个基团:tetramethyl、tetraethyl、tetraisopropyl等2.2 主体命名主体命名是描述醚分子中氧原子连接的两个烷基基团的主要规则。
根据主体命名的规则,首先列出较大的烷基基团的名称,然后在其前面加上“oxy”作为连接氧原子的表示符,最后再加上较小的烷基基团的名称。
举例来说,如果有一个乙基基团连接在氧原子上,另一个甲基基团连接在氧原子的另一端,那么这个醚的名字就是“methoxyethane”。
2.3 醚的分类根据不同的性质和结构特点,醚可以分为以下几类:1.烷基醚(Alkyl ether):含有烷基基团的醚,是最常见的醚类化合物。
根据烷基基团的数目,可以分为二甲醚(dimethyl ether)、乙基甲醚(ethyl methyl ether)等。
2.芳基醚(Aryl ether):含有芳基基团的醚。
根据芳基基团的结构不同,可以分为苯醚(phenyl ether)、萘醚(naphthyl ether)等。
9.9 醚的分类与命名
9.9 醚的分类与命名
9.9.1 分类
简单醚:R= R’ ,如: 混合醚:R≠ R’,如:
O C2H5 C2H5
环醚:R, R’ 相连即亚烃基与O相连,如:
根据烃基类型: 饱和醚:R, R’ 为饱和烃,如: 不饱和醚:R, R’ 至少一个为不饱和烃,如:
O OBiblioteka 芳香醚:R, R’ 至少一个为芳基,如:
多元醚:含有多个C-O-C醚官能团的化合物,如:
冠醚:以乙二醇为结构单元的环状多醚,含有多个 醚官能团的化合物。由于这类醚的构象外形与西方的王 冠相似,因此,把这类大环多醚称为冠醚。如:
O O O
O O
O
9.9.2 醚的命名 (1)无环单醚:
普通命名法: 两个烃基名称后面+“醚”词尾。 IUPAC命名法:烃为母体,较小的烷氧基为取代基。
1,4,7,10,13,16-六氧杂环十八烷
(2)环醚(环氧化物):
环醚用“环氧某烃”命名,并用数字标明环氧的位置; 环醚也可以用“氧杂环某烃”命名,氧杂表明环上碳原子被 氧原子所取代,如环上有取代基,以氧原子开始沿着环编号。 如:
1,3O 1,4O O 1,4 1,4 O (THF)
(3)冠醚:
命名方法为m-冠-n,m: 环的总原子数,n: 环中的氧原子数。 如:
第九章-醚

醚还可与路易斯酸生成络合物:
2. 醚键的断裂
醚和强酸(HI)形成的 钅羊 盐加热,则醚键断裂:
(过量)
醚键的断裂,总是从含碳原子较少的烷基断裂下来与X结合:
3. 过氧化物的生成
过氧化物的检验:
10.11 环醚
环醚——碳链两端或碳链中间两个碳原子与氧原子形成环
状结构的醚。
1. 环氧乙烷
环氧乙烷的制备:
√
10.9 醚的物理性质
1. 状态 甲醚、甲乙醚为气体,其余大多为液体(d<1) 2. 沸点 比醇低——因分子间不能形成氢键 3. 溶解度 微溶于水——醚可作为氢键接受体与水形成氢键
4. 红外光谱 特征峰:C-O 1060~1300 cm-1(强而宽)
10.10 醚的化学性质:
常温下,醚能溶于强酸,形成 钅羊 盐:
(二) 醚
10.7 醚的构造、分类和命名 1. 醚的构造 通式:R-O-R’、Ar-O-R、Ar-O-Ar
醚键: -O同分异构:烃基异构 官能团位置异构 官能团异构 立体异构
2. 醚的分类
3. 醚的命名:
习惯命名法:烃基名称+“醚”
-O-CH3
可省
苯甲醚
“小”在前
不省
芳基在前
相转移催化剂ຫໍສະໝຸດ 环氧乙烷的性质: 无色有毒气体,bp11o, 化学性质活泼, 易在酸或碱催化下与许多试剂发生开环反应
聚乙二醇
酸催化反应历程:
碱催化反应历程:
2. 1,4-二氧六环
10.12 冠醚
冠醚—— 环状多醚。
命名:
组成大环的原子总数 环中含氧原子数目
冠醚的制备:
冠醚的性质与应用:
醚
24
CH2
浓H2SO4
CH3 RO C CH3 CH3
羟基的 保护基
CH3 C CH3 CH3
H3C
CH3 R OH C CH3 CH3 R O H
CH3
醇与烯烃的加成在合成中应用——羟基的保护
HO Br HO CH3 OH
H2C HO Br H CH3 H3C C O CH3
+
CH3 CH3 CH3 H3C C O CH3 (1) CH3CHO
Mg Br
无水乙醚
CH3
保护羟基
MgBr (2) H2O H3C C O CH3 CH3 + H2C CH3
25
CH3 OH
H2O H
+
HO
CH3 OH
脱保护
⒋烯烃的烷氧汞化-脱汞反应(了解)
RCH=CH2 Hg(OCOCH3)2 R'OH,25 C
CH3
⑷ 芳基烷基醚断裂, 生成卤代烃和酚。
H X Ar Ar O O Ar' H X R
O CH3 + HI
不分解?
Ar
OH + CH3I
O
H
+
RX
OCH2CH3 + HI
OH + CH3CH2I
CH3I + AgNO3
CH3CH2OH
AgI
甲氧基定量测定法
10
应用: 酚羟基的保护
HO CH3 HO COOH
6
CH3OCH2CH2CH3
+
HI
CH3-O-CH2CH2CH3 + IH
有机化学第九章醚

四氢呋喃 tetrahydrofuran
四氢吡喃 tetrahydropyran
二噁烷(1,4-二氧六环) 1,4-dioxane
1,2-环氧丙烷(氧化丙烯) 1,2-epoxypropane
四氢吡喃的 椅式构象
有机化学 (第9版)
一、环氧化合物
(一)结构和命名
系统命名:三元环氧化合物以“氧杂环丙烷”(oxirane)为母体,四元环 氧化合物以“氧杂环丁烷”(oxetane)为母体。
第九章
醚
第一节 醚 第二节 环醚
重点难点
掌握 掌握醚的命名、结构和化学性质;掌握环氧化合物 的命名、结构和化学性质
熟悉 冠醚的结构和命名
了解 冠醚的性质
第一节
醚
有机化学 (第9版)
一、结构和命名
1.醚的结构
甲醚分子的结构
醚键中的氧原子为sp3杂化,其中两个sp3杂化轨道分别与两个烃基碳原子 形成σ键,键角约112°,未成键的两个sp3杂化轨道含两对孤对电子。
有机化学 (第9版)
二、冠醚
含有多个氧原子的大环多醚。通常分子中具有—OCH2CH2—重复单元。立体结构 状似王冠,故称冠醚。冠醚命名时称“m-冠-n”,m代表构成环的碳原子和氧原 子的总数,n代表环中氧原子数。 冠醚的结构特点是随环的大小不同而与不同金属离子形成络合物,从而可以选择
性地识别金属离子。如18-冠-6的空穴直径和K+的直径相近,所以它能与K+离子
(二)开环反应
1. 酸催化开环反应 酸性条件下为具有SN1性质的SN2反应,亲核试剂进攻取代基较多的环碳原 子,这个碳由于取代基的供电效应使正电荷分散而稳定。
更稳定
有机化学 (第9版)
一、环氧化合物
有机化学第8章第三节醚2013
二巯基丙醇(BAL)
CH2 CH CH2 SH SH SO3Na
二巯基丙磺酸钠
HS HC CO2Na HS HC CO2Na
二巯基丁二酸钠
上述解毒剂与金属离子的亲和力较强,它们不仅能 与进入体内的重金属离子结合成不易解离的无毒配合物 由尿排出体外,以保护酶系统,而且还能夺取已经与酶 结合的重金属离子,使酶的活性恢复,从而达到解毒的 目的。但若酶的巯基与重金属离子结合过久,酶的活性 则难以恢复,故重金属中毒需尽早用药抢救。
第8章 8.3 醚(ether) P.195
1 O R 8.3.1 醚的分类与命名
R2
根据醚分子中两个烃基的情况,分为:
• 简单醚(又称对称醚) 此时 R1 = R2
• 混合醚(又称不对称醚)
此时 R1 R2
根据烃基的种类分为饱和醚、不饱和醚、芳香醚
CH3OCH3 CH3CH2OCH2CH CH2 O
CH3CH2OCH2CH3 + O2
CH3CHOCH2CH3 O OH
形成的过氧化物遇热容易爆炸,所以储存时间长的醚在 使用前必须进行检查,若会使湿的KI-淀粉试纸变蓝或使 FeSO4-KCNS 混合液变红,则表明醚中含有过氧化物。 加铁粉或用FeSO4水溶液洗涤,可破坏其中的过氧化物。
8.3.3 醚的制备
1)酸性
RSH + NaOH
RSNa + H2O
C2H5SH > H2O >C2H5OH pKa 10.5 15.7 15.9
2).与重金属作用
与无机硫化物类似,硫醇可与 Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水 的硫醇盐。
醚和环氧化合物

(三)、过氧化物的生成
CH3CH2OCH2CH3 O2 CH3CH O O O H CH2CH3
乙醚
过氧乙醚
除去过氧化物的方法是往醚中加入少量的硫酸 亚铁、亚硫酸钠或碘化钾等还原剂。
五 制备 (一)在浓硫酸作用下,由醇分子间脱水可制备对称 醚:
ROH
浓 H2SO4
ROR
+
H2O
C2H5OH
浓H2SO4 140 C
第四节 硫醚
醚分子中的氧原子被硫置换后的化合物称为硫醚, 通式:R-S-R’ 一 命名 硫醚的命名与醚类似,只需在醚字前加一个 “硫”即可
二.性质 1.硫盐的生成 硫醚与卤代烃可发生亲核取代反应生成锍 盐.
.. RSR + .. .. R`X R .. S R` CH3 例如: :S: CH3 CH3 + CH3I S+ .. CH3 CH3 IR X-
CH3CH2OCH2CH3 乙醚 diethyl ether
+
HI
CH3CH2I
+ HOCH2CH3
HI CH3CH2I
碘乙烷 iodoethane
醚键断裂机制:
CH3CH2-O-CH2CH3 CH3 I H CH2 O + CH2CH3 SN2过渡态 H
+
H+ CH3CH2-O-CH2CH3
I
-
O sp 3 杂化
o CH3
110
图9-1 甲醚的结构
环醚的结构:
O
O
O 1,4-二氧六环 (1,4-dioxane)
四氢呋喃 (tetrahydrofuran)
(二)醚的命名 简单醚:先写出烃基的名称,再加上“醚” 可。 混醚:在两个烃基的名称后加上“醚”既可。 芳香醚:两个烃基至少有一个芳基的醚。
有机化学醚资料

+ C2H5OC2H5
反应历程:
CH3CH2OH
+H+
H2O
+
SN2, -H2O
CH3CH2OH + CH3CH2——OH2
+
CH3CH2-OH-CH2CH3
-H+ CH3CH2OCH2CH3
11
醇失水制醚注意两点: 1、原则上讲,醇在浓H2SO4作用下用于制备结构
对称的醚。 2、1oROH制醚产率较好, 2oROH制醚产率不好,
CH3
CH3 CH3
E2 CH3—C—Cl + NaOCH2CH3
CH3
CH3 CH3 = C-CH3 + HOC2H5 + NaCl
叔卤代烷在醇钠作用下则发生消除反应。
14
第四节 醚的化学性质
醚的化学性质比较稳定,通常条件下与碱、稀酸、 氧化剂、还原剂不发生反应,但在一定条件下也可 进行一些反应:
R
O + BF3
R
气态
R
O BF3 R
溶液
bp:-1010C
R
R 2
R
O + RMgX
R
R
O Mg O
R
R
X
如:格氏试剂在金属镁的表面生成,与醚形成络合物
后脱离金属镁的表面进入溶液,使得格氏试剂的制备
得以进行。
16
二、醚键断裂的反应
醚与浓的HCl、HBr、HI作用,醚键可发生断裂。 HX的反应活性:HI > HBr > HCl 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基
3、醚分子中含有电负性较强的氧,可以与水形成 分子间的氢键,因此在水中有一定的溶解度。乙醚 在水中的溶解度与正丁醇相近~8g/100mL。 四氢呋喃和1,4-二氧六环因氧原子裸露在外面, 可以和水形成较强氢键,因而能与水无限混溶。
第三节 醚

第 三 节 醚
本节要求
1、掌握醚的结构、分类和命名。 2、了解醚性质。
3、了解常见的醚。
醚的概念:
醚:两个烃基通过氧原子相连而成的化合物是醚。 通式: R—O—R/、R—O—Ar、Ar—O—Ar/ 官能团:—O— 称为醚键,是醚的官能团。
一、醚的分类和命名 (一)分类 与氧相连的两个烃基相同,称作单醚 如 C2H5-O-C2H5 与氧相连的两个烃基不同,称作混醚 如 CH3-O-C2H5
乙醚在空气的作用下能氧化成过氧化物、醛和 乙酸,暴露于光线下能促进其氧化。当乙醚中含有 过氧化物时,在蒸发后所分离残留的过氧化物加热 到100℃以上时能引起强烈爆炸; 这些过氧化物可 加5%硫酸亚铁水溶液振摇除去。与无水硝酸、浓硫 酸和浓硝酸的混合物反应也会发生猛烈爆炸。 乙醚对人的麻醉浓度为109.08~196.95g/m3, 当浓度为212.1~303g/m3时可致呼吸停止,当浓度 超过10%时通常可以致命。 乙醚是低毒物质,对皮肤及呼吸道粘膜有轻微 的刺激作用。长期接触低浓度乙醚蒸气时可出现头 痛、头晕、易激动或淡漠、嗜睡、忧郁、体重减轻、 食欲减退、恶心、呕吐、便秘等症状。吸人较高浓 度乙醚蒸气时可出现头晕、癔病样发作、精神错乱、 嗜睡、面色苍白、恶心、呕吐、呼吸不规则等短时 间大量接触后发生的中毒症状,一经脱离现场,稍 待休息,经对症处理后就可恢复。
2-甲氧基-5-氯-3-己醇
二、常见的醚 —— 乙醚
乙醚是最常见的和最重要的醚。它是易挥发的无色透明 液体,有特殊气味,沸点34.5℃。 非常易燃,乙醚蒸气与空气混合达到一定比例时,遇火 可引起爆炸,因此在制备和使用时,周围要避免明火,并采 取必要的安全措施。 乙醚比水轻,微溶于水。其蒸汽比空气重2.5倍。能溶 解多种有机物,是一种良好的有机溶剂,常用于提取中草药 的有效成分。 乙醚有麻醉作用,医用乙醚是高效麻醉药品,只要5到 10秒钟就让人昏迷,曾用作吸入式全身麻醉剂,由于可引起 恶心、呕吐等副作用,现已被更高效、安全的麻醉剂所代替。
醚

能在强酸条件下发生反应。
1.醚的质子化:(oxonium salt)的形成
C2H5
O C2H5
浓 H2SO4
C2H5 O H
C2H5
+
利用该特性,可 区别醚与烷烃或 卤代烃
H2O
C2H5
O
C2H5
例题:下列化合物中,既能溶于强酸又能溶于
强碱的是:
A.间甲氧基苯酚 B.乙醚 C.苯酚 D.苯乙醚
O
R-O-R Ar-O-Ar R-O-RˊAr-O-R Ar-O-Arˊ
O O O
混合醚
3.命名 a 普通命名法(简单的醚) 单醚:先写出两个烃基的名称,再加 上“醚” 即可,习惯上“二”、“基”字省去。
C2H5
O
C2H5
C6H5
O
C6H5
二乙醚(乙醚) diethyl ether (ethyl ether)
2. 醚键的断裂(与氢卤酸反应) 醚用浓氢碘酸(浓氢溴酸)加热处理,醚键 断裂,生成卤代烃和醇。若氢碘酸过量,醇可
继续生成卤代烃。
R O R + HI
R I + ROH
HI(过量)
a.反应活性:HI>HBr>HCl
R
I
b.通常是较小的烃基形成卤代物, 较大的烃基生成醇。
100 C
。
CH3CH2CHCH2OH
O
1,4-二氧六环 1,4-dioxane
冠醚: x-冠-y
x-代表环总原子数; y-代表环
中氧原子数。
O
O O
O O
O O O O O
O
18-冠-6 18-crown-6
第十一章 醚

二乙二醇醚 良好溶剂 三乙二醇醚 农药去泡 剂 去泡剂 多缩乙二醇醚
OH
OH
CH2 O
CH2
CH2 O
CH2
HO ( CH2 CH2 O ) H n
聚乙二醇
化学与材料科学学院
在碱催化下,环氧乙烷可与RO-,NH3,RMgX等反应 生成相应的开环化合物。
C2H5O
-
+
OH -
C2H5OCH2CH2OH
过氧化物不稳定,加热时易分解而发生爆炸,因此,醚类应 尽量避免暴露在空气中,一般应放在棕色玻璃瓶中,避光保存。 蒸馏放置过久的乙醚时,要先检验是否有过氧化物存在,且不 要蒸干。 检验方法:硫酸亚铁和硫氰化钾混合液与醚振摇,有过氧 化物则显红色。
化学与材料科学学院
2 过氧化物 + Fe
Fe
3
SCN
除去过氧化物的方法:
化学与材料科学学院
Br Br2 FeBr3 Mg Et2O
MgBr i)
O
CH2CH2OH
ii) H3O CH2CH2MgBr
PBr3
CH2CH2Br
Mg Et2O
i) CH3CHO TM ii) H3O
OH RCO3H O CH3ONa CH3OH H3CO CrO3 TM
化学与材料科学学院
例3:
RX + NaOR ′ RX + NaO-Ar
例如:
CH 2=CHCH 2Br + CH3CH 2ONa CH 3 CH 3CH 2Br + NaO -C CH 3 CH 3
ROR ′ + NaX R-O-Ar + NaX
CH 2=CHCH 2OCH 2CH 3 + NaBr CH 3 CH 3CH 2-O -C CH 3 + NaBr CH 3
醚的分类和命名.
CH 2=CH OCH 2CH 3 (乙基乙烯基醚) O (CH3 COO) Zn 2 CH 2=CH OCCH 3 (醋酸乙烯酯) 210 ℃~250 ℃
乙基乙烯基醚和醋酸乙烯酯都是重要的化工原料,广泛用来制造粘 合剂、涂料、增塑剂等。
2018/9/13
8
15.6.11 醚的物理性质
除甲醚和甲乙醚为气体外,多为挥发性高、易燃、易流 动的无色液体,有特殊气味,相对密度小于1
O
2
HOCH 2CH 2CH 2CH 2OCHCH 3 CH 3 4-异丙氧基-1-丁醇
CHO OCH 3 4-羟基-2-甲氧基苯甲醛 HO
苯氧基苯
CH3OCH2CH2OCH2CH2OCH3 CH2=CH-CH2-O- (CH3)2CH-O- (CH3)2CH-CH2-O- CH3CH2CH(CH3)-O- (CH3)3C-O-
剂的醚有:乙醚、四氢呋喃、1,4-二氧六环、乙二醇二甲醚
2018/9/13
9
15.6.12 醚的化学性质 概况
——醚键很稳定(小环醚除外)。一般与碱、氧化剂、还原剂都不 作用。故有机反应常用醚作溶剂 ——常温下醚与金属钠也不起反应,因而可用钠干燥醚 ——醚有碱性,遇酸可形成钅羊 盐,甚至醚键断裂 ——简单的环醚性质活泼
C2H5OCH(CH 3)2 CH 3OCH 2CH=CH 2 C6H5OC2H5 乙基异丙基醚 甲基烯丙基醚 苯乙醚 C2H5OC2H5 (二)乙(基)醚 C6H5OC6H5 二苯醚
2018/9/13
2
复杂的醚 系统命名法:取碳链最长的烃基作为母体,以烃氧基
(RO﹣)作为取代基:
CH 3CH 2CH 2CHCH=பைடு நூலகம்H OCH 3 3-甲氧基-1-己烯
醚
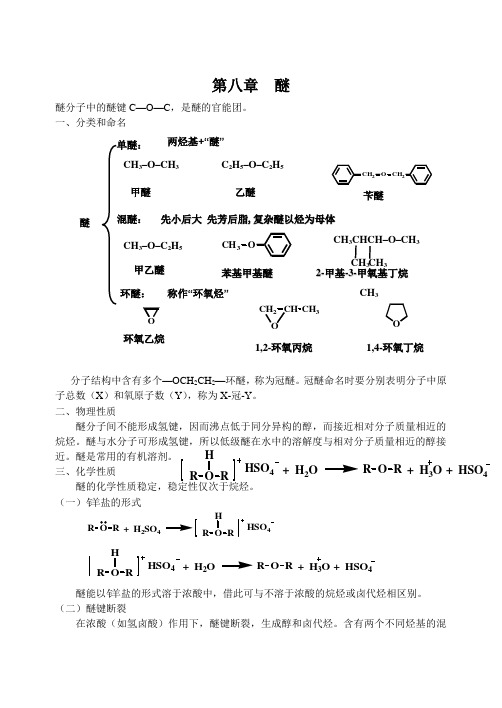
第八章 醚醚分子中的醚键C —O —C ,是醚的官能团。
一、分类和命名分子结构中含有多个—OCH 2CH 2—环醚,称为冠醚。
冠醚命名时要分别表明分子中原子总数(X )和氧原子数(Y ),称为X-冠-Y 。
二、物理性质醚分子间不能形成氢键,因而沸点低于同分异构的醇,而接近相对分子质量相近的烷烃。
醚与水分子可形成氢键,所以低级醚在水中的溶解度与相对分子质量相近的醇接近。
醚是常用的有机溶剂。
三、化学性质醚的化学性质稳定,稳定性仅次于烷烃。
(一)钅羊 盐的形式R O R + H 2SO 4R O RHHSO 4R O R + HSO 4R O RH HSO 4+ H 2O+ H 3O醚能以钅羊 盐的形式溶于浓酸中,借此可与不溶于浓酸的烷烃或卤代烃相区别。
(二)醚键断裂在浓酸(如氢卤酸)作用下,醚键断裂,生成醇和卤代烃。
含有两个不同烃基的混2O CH C H 32CH CH 3混醚:单醚:环醚:C 2H 5–O –C 2H 5两烃基+“醚”先小后大 先芳后脂,复杂醚以烃为母体称作“环氧烃”CH 3–O –CH 3 甲醚乙醚苄醚CH 3–O –C 2H 5甲乙醚 苯基甲基醚1,2-环氧丙烷 环氧乙烷1,4-环氧丁烷醚CH 3CHCH –O –CH 3 CH 32-甲基-3-甲氧基丁烷CH 3 CH 3R O + HSO 4R O RH HSO 4+ H 2O + H 3O醚,通常是较小的烃基生成卤代烃,较大的烃基生成醇。
如果氢卤酸过量并加热,生成的醇可进一步反应生成卤代烃。
含有苯基的混醚,总是生成酚和卤代烃,二苯基的混醚则不发生醚键断裂.。
醚键断裂的机理为亲核取代。
CH 3OCH 2CH(CH 3)2+HI CH 3I +(CH 3)2CHCH 2OH32OCH 3+2HI 2CH 3I +OH CH 2OH(三)环氧化合物环氧化合物是特指含有三元环的醚及其衍生物。
环氧化合物的普通命名法称为氧化某烯,环氧化合物的衍生物有两种命名法: (1) 将环氧化合物的母体命名为环氧乙烷,三元环中的氧原子编号为1,两个碳原子依次编号; (2) 环氧化合物命名为环氧某烷,并标明与氧原子成环后的碳原子的位置。
醚

醚的命名
• 1. 习惯法
• 结构简单的醚一般采用习惯法命名,方法是将 “烃基名”写在“醚”字前,单醚在烃基名前加 “二”(但除芳醚和不饱和醚外,一般可省略)。 如 • CH3CH2OCH2CH3 (二)乙醚 • 若是混醚,则按次序规则中,较大基团在后书写。 如:CH3OCH2CH3 甲乙醚 • CH3OCH2CH=CH2 甲基烯丙基醚 • 芳醚书写时,原则是先写芳基,后写烷基。如: OCH2CH3 OCH3 苯甲醚 茴香醚 苯乙醚
(2)混合醚反应时,碳氧键断裂的顺序:
3o烷基> 2o烷基> 1o烷基>甲基>芳基。
四 1,2环氧化合物的开环反应
1. 环氧化合物在酸性条件下的开环反应
H H O CH 3 CH 2CH 3
H+
H H O+ H
CH3 CH2CH3
H H O + H
H H
+
CH3 CH2CH3
H2O18
H
H
18 +
OH2
-H+
OH
18
CH 3 CH 2CH 3
OH
OH
CH 3 CH 2CH 3
环氧化合物与硼烷的反应
CH 3
H O
H
H
+ B2H6
Hale Waihona Puke CH 3 H B HH
H O H
H
2
H CH 3 O
H
H
(CH3CH2CH2O)3B
H2O
CH3CH2CH2OH
2. 1,2环氧化合物的碱性开环反应
H CH3 O
H
• 措 施 : ① 久 贮 的 醚 在 使 用 前 , 用 FeSO4 或 Na2SO3等还原剂处理后方可蒸馏。 • ② 贮存醚时,可在醚中加入少量的金属 钠或还原铁粉以防止过氧化物的生成。
07-2醚 (1)

应用:合成比原料多两个碳原子的伯醇
CH3CH2CH=CH2
HBr H2O2 O 1)
2) H
+
CH3CH2CH2CH2CH2CH2OH
Mg 干乙醚
CH3CH2CH=CH2
CH3CH2CH2CH2Br
CH3CH2CH2CH2MgBr
CH3CH2CH2CH2CH2CH2OH
7) 环氧乙烷的制备 A、直接氧化法:
+
CH3OH + CH2=C CH3 CH3
CH3OC(CH3)3
MTBE:汽油抗爆剂 催化剂:强酸性阳离子交换树脂
醚的总结 一、化学性质 1、醚的碱性, 盐的生成。
2、醚键的断裂,断裂规律。 3、环氧乙烷的性质: 制备;与水、醇、胺、HX及RMgX反应 二、醇、酚、醚的鉴别
三、醚的制备
1、醇分子间脱水 2、威廉姆逊合成
应用:醚与烃的分离与鉴别
C2H5OC2H5 n-C5H12 油层 H2O 油层 n-C5H12 冷浓H2SO4 H .. + [ C2H5-O-C2H5] HSO4 酸层 .. C2H5OC2H5 H2SO4、 2O H
2、醚键的断裂(强酸:HI>HBr>HCl)
钅 盐的生成使醚“C-O”键变弱, “C-O”键易 羊
断裂。 与强酸如HI、HBr、浓H2SO4等作用,生成盐, 加热后分解,醚键断裂,一般用HI。
HI CH3CH2OH + CH3CH2I
CH3CH2OCH2CH3
HI
CH3CH2I
混合醚与HI酸作用时,其中小的烃基生成卤代 烷,大的烃基生成醇。
CH3-O-C2H5 + HI H CH3-O-C2H5 I CH3I + C2H5OH
第三节 醚

单醚:
CH3-O-CH3 CH3-CH2-O-CH2-CH3
(二)甲醚 (二)乙醚
CH2=CH-O-CH=CH2
O
二乙烯醚
二苯醚
混醚: 混醚:
CH3-O-CH2-CH3
H3C -O-CH2-CH3
甲乙醚
对-甲苯乙醚
二、乙醚 乙醚是最重要的醚。 乙醚是最重要的醚 。 是无色透明的 液体,沸点34. 有特殊的气味, 液体,沸点34.5℃,有特殊的气味, 极易挥发及着火。 极易挥发及着火 。 乙醚在水中溶解度 又比水轻。 乙醚化学性质稳定, 小 , 又比水轻 。 乙醚化学性质稳定 , 又能溶解许多有机物, 又能溶解许多有机物 , 是常用的有机 溶剂。 溶剂。
2. 盐的形成 乙醚不溶于水,但能溶于浓强酸, 乙醚不溶于水,但能溶于浓强酸, 如浓硫酸、浓盐酸等。 如浓硫酸、浓盐酸等。
CH3-CH2-O-CH2-CH3 + HCl H ¨ ]+ Cl[ CH3-CH2-O-CH-CH3
盐(溶于酸) 溶于酸)
第三节 醚 一、醚的分类和命名 (一)分类 醚结构中与氧相连的两个烃基 相同的称为单醚 单醚, 相同的称为单醚,两个烃基不 同的则称为混醚 混醚。 同的则称为混醚。
(二)命名
单醚的命名是在烃基名称后面加“ 单醚的命名是在烃基名称后面加 “ 醚 ” 字 ; 混醚命名时,两个烃基的名称都要写出来, 混醚命名时 , 两个烃基的名称都要写出来 , 较小的烃基的名称放在前面, 较小的烃基的名称放在前面 , 较大的烃基 的名称放在后面, 的名称放在后面 , 但芳香烃基的名称放在 脂肪烃基的前面, 然后再加上“ 脂肪烃基的前面 , 然后再加上 “ 醚 ” 字 。 单醚分子中烃基为烷基时, 往往把“ 单醚分子中烃基为烷基时 , 往往把 “ 二 ” 字省去,例如: 字省去,CH3 + O2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH
O CH 3C+OOC(H 2C H 13H C 0℃ O2O Z~n2) 5C0℃ H 2=CH O3( C醋 CH酸乙烯
乙基乙烯基醚和醋酸乙烯酯都是重要的化工原料,广泛用来制造粘
合剂、涂料、增塑剂等。
04.03.2020
8
15.6.11 醚的物理性质
•状态 除甲醚和甲乙醚为气体外,多为挥发性高、易燃、易流
•消除过氧化物方法
——用还原剂(如FeSO4/稀H2SO4)后摇荡,以破坏它 ——贮藏醚类化合物时,加入少量金属钠或铁屑或抗氧化剂(例: 对苯二酚),避免过氧化物生成
04.03.2020
15
15.6.13 环醚和冠醚
• 定义
脂环烃的环上碳原子被一个或多个氧原子取代后生成的化合物
例
C H2 C H2
04.03.2020
22
4、乙醚 •制法 乙醇脱水 •性质
无色液体,比水轻,可溶于水,易燃,爆炸极限1.85%36.5% 极性小,较稳定,可溶解很多有机物质,是常用的良好的有机 溶剂和萃取剂 乙醚有麻醉作用,医药上用作麻醉剂
04.03.2020
23
5、环氧树脂
•定义和制法
双酚A的制备 苯酚与丙酮在硫酸存在下于40℃缩合生成2,2
RORˊ + NaX
•注意 制备具有叔烃基的混醚时,应使叔醇钠与伯卤代烷作用。
原因:叔卤代烃在醇钠的作用下,主要发生消除反应
(C3)3 H CONa3C2H B +rSN 2C(H C3)3 H CO2C C3H H+ NaBr (C3)3 H CBr 3C +2H ON CE 2 aHC2H =C3 ()2CH + 3C2 C H OH H +
CH2=CH-CH2-O-
-OCH2O- 甲二氧基
(CH3)2CH-O-
-OCH2CH2O-
(CH3)2CH-CH2-O-
C6H5CH2-O-
CH3CH2CH(CH3)-O-
(CH3)3C-O-
04.03.2020
3
•环醚 称为环氧某烃或按杂环化合物命名
C3H CH2 CC H2H CH 2 CH
——不同结构冠醚的空穴大小不同,对金属离子具有较高的配位选 择性。例,18—冠—6空穴直径为0.26nm~0.32nm,只能与离子半径 为0.133nm的K+配合;12-冠-4能与Li+配合——分离金属离子
——用作相转移催化剂 冠醚具有亲油性的亚甲基排列在环的外 侧,可使盐溶于有机溶剂,或使其由水相转移至有机相中。例,固 体氰化钾与卤代烃反应时,因氰化钾不溶于卤代烃使反应难以在固 液两相中进行。当加入18—冠—6后,它与K+生成配离子而溶于卤 代烃,反应在均相系统中很易完成。
(RO﹣)作为取代基:
C3 H C2 H C2 H CHCH 2 =H CO H2C CH 2 H C2 H C2 H OCH3 CHHO CHO
OC3 H
C3 H
OC3 H
3-甲 氧 基 -1-己 4-烯 异 丙 氧 基 -14 -丁 -羟醇基 -2-甲 氧
O
苯氧基苯
CH3OCH2CH2OCH2CH2OCH3 ,’二甲氧基乙醚
断裂。最有效的试剂是氢碘酸(强亲核试剂):
R ˊ O R [+ RHˊ H O +I- △RR] O I H ˊ + R
Ar
OR △+ArHIOH
HI
+
R R
I I2O+
如有过量氢碘酸存在,可与反应中生成的醇作用生成另一分子碘 烷,但酚不能进一步与氢碘酸反应生成芳卤
04.03.2020
12
•机理
伯烷基混醚与HI作用时,按SN2反应,由于空间位阻效应,碳原子 较少的烃基断裂后与碘结合,生成碘代烷
04.03.2020
20
2、甲苯酚
•性质
简称甲酚,有邻、间、对位三种异构体,都存在于煤焦油中,工 业上应用的是三种混合物。邻、对位为无色晶体,间甲酚为无色 或淡黄色
•应用
防腐剂(木材防腐)和消毒剂(含1%5%的肥皂溶液为来苏 尔,广泛用于手、器械和排泄物的消毒)其杀菌力大于苯酚
制造染料、炸药、农药、电木的原料
C H3
——环醚(烃基与氧原子连接成环)
CH2--CH2
——硫醚:硫原子置换氧原子与两个烃基相连:COH3-S-CH3
ቤተ መጻሕፍቲ ባይዱ
04.03.2020
1
2. 醚的命名
•简单的醚 习惯命名法:在醚前冠以两个烃基的名称
——混醚:次序规则中较优的烃基放在后面;芳醚:芳基在前 ——单醚:“二”字和“基”字可省略(芳醚和不饱和醚保留 “二”字)
04.03.2020
10
1. 钅羊 盐的生成
•原理 醚中的氧原子上有孤对电子,是路易斯弱碱(pKb=17.5),
能与强酸(浓盐酸、浓硫酸等)作用生成钅羊盐溶于浓的强酸
R
.. ..
Oˊ
R2SO4+
H
H
[R..
O ˊ+
R-4 ]
HSO
•性质和应用 钅羊盐是弱碱强酸盐,不稳定,遇水很快分解为
原来的醚——从烷烃或卤代烃混合物中分离醚
-(4,4’-二羟基二苯基)丙烷(即双酚A或二酚基丙烷)
H O
C H 3
H+ C = O+ H
O H O H
C H 3 C
O H
C H 3
C H 3
双酚A或其他多元酚都能与环氧氯丙烷进行一系列缩聚反应,
04.03.2020
21
3、对苯二酚 •性质
无色晶体,是强还原剂,极易氧化成醌
•应用
高分子单体防止聚合的阻聚剂 用作显影剂
+ A 2 g B + r O 2 H + H O - O H C r O 3 ,C 0 ℃ H 3 C O O H O == O A 2 g + B 2 r + - H 2 O 2
•应用
生成的碘甲烷蒸入硝酸银的乙醇溶液中,由生成AgI的量,可换算 出碘甲烷的量,计算原来醚分子中甲氧基的含量
•注意
CH3O R + HCI H3I + ROH
氢碘酸不能使二芳基醚的醚键断裂
04.03.2020
13
3. 过氧化物的生成 •概况 醚对氧化剂稳定,但低级醚(如乙醚)与空气长期接触,
其α﹣氢原子会被氧化为过氧化物 CH3CH2OCH2CH3+O2CH3CH-OCH2CH3
15.6.9 醚的分类和命名
1. 醚的定义和分类
•定义 醚是水分子中的两个氢原子都被烃基取代的生成物。
(C)—O—(C)键称为醚键,是醚的官能团
•分类
——饱和醚和不饱和醚 CH3-O-CH2CH=CH2
——单醚 R=R’:CH3-O-CH3
——混醚 RR’:CH3-O-C2H5
O
O
——芳醚(至少有一个烃基为芳烃)
二芳基醚可由酚钠与芳卤在铜催化下加热制得:
ON+ a
Br2C 10u℃
O
+
二苯醚
NaBr
04.03.2020
7
•乙烯基醚的制备
(复习)
炔烃比烯烃不容易进行亲电加成反应,但与含活泼氢的亲核试剂 (如ROH、HCN、RCOOH等)却比烯烃较易进行亲核加成反应:
CH CH 3O+H152C00%℃ HK~O1H C 60H 2℃ =CH 2O CC H 3(H乙基乙烯基
C 2H 5OC3 H )2 C (C 3O HH C 2CH H2= C 6H C 5O H 2H C 5 C 2H 5O2H C 5 C 6H 5O6H C 5 乙基异丙 甲基醚 烯苯 丙乙 基 ( 醚 醚 二)乙 二( 苯
04.03.2020
2
•复杂的醚 系统命名法:取碳链最长的烃基作为母体,以烃氧基
2CH3CH2OHCH3CH2OCH2CH3
04.03.2020
5
2. 威廉森合成法(Williamson synthesis of ether)
•原理 醇钠或酚钠是强亲核试剂,与卤烷作用时,烷氧基按
SN2的机理取代卤烷的卤原子生成醚。与卤代烃反应可制备醚(单 醚和混醚,主要是混醚)
RONa + ˊR X
剂的醚有:乙醚、四氢呋喃、1,4-二氧六环、乙二醇二甲醚
04.03.2020
9
15.6.12 醚的化学性质 •概况
——醚键很稳定(小环醚除外)。一般与碱、氧化剂、还原剂都不 作用。故有机反应常用醚作溶剂 ——常温下醚与金属钠也不起反应,因而可用钠干燥醚 ——醚有碱性,遇酸可形成钅羊 盐,甚至醚键断裂 ——简单的环醚性质活泼
OO
O
O
环氧乙烷 四氢呋喃 二噁烷
1.简单环醚
分子中含 C C 结构的环醚称环氧化合物。
其性质与一般的醚差别很大。 O
•简单环醚的制备
——烯烃直接氧化: CH 2=C2H + 2 O2A5g0℃ CH 2 C2H
04.03.2020
O 16
•简单环醚——环氧乙烷的性质
——常温常压下为无色有毒气体,沸点10.7℃,易液化,能溶于水、 乙醇和乙醚中。通常将环氧乙烷储存在高压钢瓶中 ——环氧乙烷具有三元环结构,存在较大的角张力,化学性质很 活泼,能在酸、碱催化下与含活泼氢的亲核试剂(水、醇、酚、 氢卤酸、氨、格氏试剂)反应 ——重要的有机合成原料
H2O HOCH2CH2OH n O 聚乙二醇
NH3 HOCH2CH2NH2 O HN(C2HCH2OH2) O N(CH2CH2OH3)
CH2 O
C2H R-
乙醇胺 -OH HOCH2CH2O
