第14章氮族元素
氮氮族元素中小学PPT教学课件

③强氧化性:NO2具有强氧化性,如NO2+ SO2=SO3+NO,亦能使湿润的KI淀粉试纸变蓝 (不能用此法鉴别Br2和NO2)。
N2O4的强氧化作用:我国研制的火箭中,使 用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧 化剂,燃烧放出巨大能量,将火箭送入太空。
(3)制法:
① 实 验 室 : Cu 和 HNO3( 浓 ) 制 NO2( 只 能 用 向 上排空气法收集)
(4)X、Y、Z可以形成一种盐,此盐中X、 Y、Z元素的原子的个数比为4∶2∶3,该盐的 化学式(分子式)是______________。
由“X原子的电子层数与它的核外 电子总数相同”可知X是H,由“Z原子的最外 层电子数是次外层电子数的三倍”可知Z是O, 再结合题意可推知Y是N。
(1)氢;氮;氧
(1)X 是 __________ 、 Y 是 __________ 、 Z 是 __________。
(2)由Y和Z组成,且Y和Z质量比为7∶20的 化合物的化学式(分子式)是____________。
(3) 由 X 、 Y 、 Z 中 的 两 种 元 素 组 成 , 且 与 X2Z 分 子 具 有 相 同 电 子 数 的 两 种 离 子 是 ____________和____________。
近代自然科学的集大成者 1.惯性定律 2.加速度的比例定律 3.作用反作用定律
1687年牛顿出版力学经典著作《自然哲学的数学原理》
《自然哲学的数学原理》研究成果:把天体万物的运动,都用运动三定律(誉为是经典物理学 的基础)和万有引力定律予以说明,建立了经典力学的基本体系。影响:为近代自然科学的发展奠
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
氮族元素PPT课件全文

(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
氮族元素ppt 人教课标版

3.NO2 红棕色,有刺激性,有毒的气体,溶于 水,跟水反应。 (l) NO2不能用排水法收集,只能用排空气法。 (2) NO2具有氧化性,可使KI淀粉试纸变蓝, 鉴别NO2和溴蒸气不能用淀粉KI试纸。可用加水 振荡法或加AgNO3溶液法。 (3)氮的氧化物都是大气污染物,其中NO2是 造成光化学污染的主要因素。
二、氮的氧化物 十l +2 +3 +4 +5 +6
1.五种正价,六种氧化物: N2O、NO、N2O3、NO2、N2O4、N2O5,只有N2O3 、
N2O5, 分别属于HNO2 和 HNO3的酸酐。
2.NO 无色有毒的气体,难溶于水,主要表 现还原性。 2NO+O2=2NO2(红棕色)(NO检验方法) 故:NO与 O2不能共存,收集NO只能用排水法 不能用排空气法。
(3)NO、O2混合气体溶于水用方程式 4NO+3O2+2H2O=4HNO3讨论分析计算 (4)NO2、NO、O2三种混合气体通入水中先用方程式: 3NO2+H2O=2HNO3+NO 求出NO2和水反应生成的NO,然后按(3)法进行分析 计算。
三、磷
2.P2O5 白色团体,易吸水,是一种酸性固 体干燥刑,属酸性氧化物
读一本好书,就是和许多高尚的人谈话。 ---歌德 书籍是人类知识的总结。书籍是全世界的营养品。 ---莎士比亚 书籍是巨大的力量。 ---列宁 好的书籍是最贵重的珍宝。 ---别林斯基 任何时候我也不会满足,越是多读书,就越是深刻地感到不满足,越感到自己知识贫乏。 ---马克思 书籍便是这种改造灵魂的工具。人类所需要的,是富有启发性的养料。而阅读,则正是这种养料。 ---雨果 喜欢读书,就等于把生活中寂寞的辰光换成巨大享受的时刻。 ---孟德斯鸠 如果我阅读得和别人一样多,我就知道得和别人一样少。 ---霍伯斯[英国作家] 读书有三种方法:一种是读而不懂,另一种是既读也懂,还有一种是读而懂得书上所没有的东西。 ---克尼雅日宁[俄国剧作家・诗人] 要学会读书,必须首先读的非常慢,直到最后值得你精读的一本书,还是应该很慢地读。 ---法奇(法国科学家) 了解一页书,胜于匆促地阅读一卷书。 ---麦考利[英国作家] 读书而不回想,犹如食物而不消化。 ---伯克[美国想思家] 读书而不能运用,则所读书等于废纸。 ---华盛顿(美国政治家) 书籍使一些人博学多识,但也使一些食而不化的人疯疯颠颠。 ---彼特拉克[意大利诗人] 生活在我们这个世界里,不读书就完全不可能了解人。 ---高尔基 读书越多,越感到腹中空虚。 ---雪莱(英国诗人) 读书是我唯一的娱乐。我不把时间浪费于酒店、赌博或任何一种恶劣的游戏;而我对于事业的勤劳,仍是按照必要,不倦不厌。 ---富兰克林 书读的越多而不加思索,你就会觉得你知道得很多;但当你读书而思考越多的时候,你就会清楚地看到你知道得很少。 ---伏尔泰(法国哲学家、文学家) 读书破万卷,下笔如有神。---杜甫 读万卷书,行万里路。 ---顾炎武 读书之法无他,惟是笃志虚心,反复详玩,为有功耳。 ---朱熹 读书无嗜好,就能尽其多。不先泛览群书,则会无所适从或失之偏好,广然后深,博然后专。 ---鲁迅 读书之法,在循序渐进,熟读而精思。 ---朱煮 读书务在循序渐进;一书已熟,方读一书,勿得卤莽躐等,虽多无益。 ---胡居仁[明] 读书是学习,摘抄是整理,写作是创造。 ---吴晗 看书不能信仰而无思考,要大胆地提出问题,勤于摘录资料,分析资料,找出其中的相互关系,是做学问的一种方法。---顾颉刚 书犹药也,善读之可以医愚。 ---刘向 读书破万卷,胸中无适主,便如暴富儿,颇为用钱苦。 ---郑板桥 知古不知今,谓之落沉。知今不知古,谓之盲瞽。 ---王充 举一纲而万目张,解一卷而众篇明。 ---郑玄
《无机化学(第六版)》电子教案 第十四章 p区元素(二)

白磷 红磷
磷的燃烧
红磷的结构
砷、锑、铋的单质 砷、锑具有两性和准金属性质,而铋则
呈金属性。
As Sb Bi
熔点较低且易挥发。在气态时以多原子分 子形式存在,如 As4,As2,Sb4,Sb2,Bi2。
14.1.3 氮的化合物
1. 氮的氢化物 (1) 氨 (NH3) 结构: N:不等性 sp3 杂化,三角锥形
五氧化 二氮
N2O4 N2O5
气(无) 固(无)
强烈分解为 NO2
不稳定
熔点 沸点 ℃℃
-90.8 -88.5
-163.6 -151.8
-101
2 (升华)
-11.2 21.2
-9.3
21.2 (分解)
30
47 (分解)
(1) 一氧化氮 (NO) 无色气体,微溶于水,不与水反应,
不助燃,有还原性, NO 中有单电子,非 常活泼,常温下与氧立即反应生成红棕色 的 NO2。
As Sb Bi
+5 +5 (+5) +3 +3 +3 -3 (-3)
46
6 66
酸性 酸性 两性 两性 碱性
N氨H3 PH膦3 AsH胂3 SbHS3b HBi3H3B iH 3 碱性减弱,稳定性下降
14.1.2 氮族元素的单质
氮气是无色、无
臭、无味的气体。沸
点为 −°C。微溶于水。
常温下化学性质极不
中最重要的。它是氨氧化制硝酸的必经之路。 在医学上,NO 使血管平滑肌松弛 ,血
管扩张,调节血压。
1986年,美国分子生物学家伊格纳罗、 药理学家弗奇戈特、生理学家穆拉德发现了 NO 在心血管系统中的信息作用,即硝酸甘 油缓慢分解释放出 NO,NO 能使血管扩张而 达到治疗心脏病的目的。这三位科学家因此 获得1998年的诺贝尔生理学和医学奖。
第14章 氮族元素
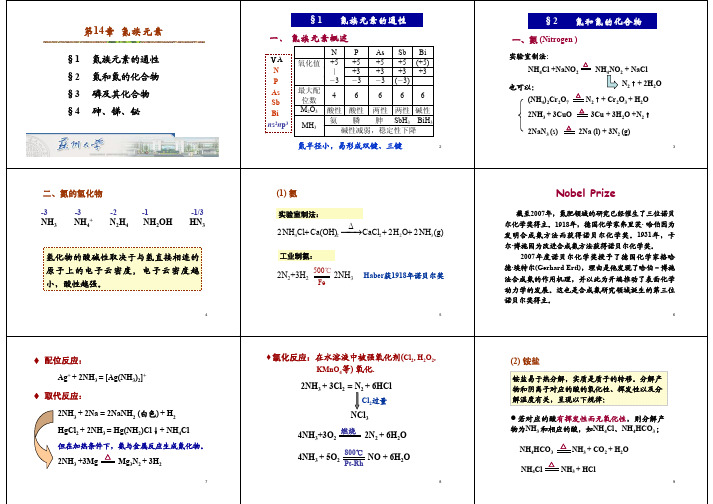
神奇的一氧化氮 —— “两面人”
我们知道汽车尾气中的 NO 会造成大气的公害。大气中的 氧可将NO 氧化为 NO2,但在低浓度条件下的氧化速率极慢。 这使得某些大都市上空的 “光化学烟雾” 长期弥漫,NO 是造 成光化学烟雾的祸首。 “ 天不转地在转 ” ,这个祸首当今竟成 了 “明星”。科学家发现NO可以令血管放松和扩阔,帮助血液 流通;美国 Pfizer 药厂利用这个发现,生产出 Viagra 。 NO 气 体还具有治疗哮喘和关节炎,抵御肿瘤,杀死感性细菌、真 菌和寄生虫的能力。三位美国药理学家由于发现NO的药理作 用而获得1998年诺贝尔医学奖。
28
水解:
δ-
. .
NF3 NCl3 sp3杂化,三角锥形
N F F F
NCl3 + 3H2O = NH3+ 3HClO Cl 原因有二:
·· N
δ+
Cl
Cl
NCl3: NH3 + 3Cl2 = NCl3 + 3HCl 在90℃,爆炸分解: NCl3 = 1/2N2 + 3/2Cl2
△rHmӨ = -295.5 kJ·mol-1
第14章 氮族元素
§1 §2 §3 §4 氮族元素的通性 氮和氮的化合物 磷及其化合物 砷、锑、铋
§1
N +5 | -3
氮族元素的通性
P +5 +3 -3 As +5 +3 -3 Sb Bi +5 (+5) +3 +3 (-3)
§2
氮和氮的化合物
一、 氮族元素概述
ⅤA N P As Sb Bi ns2np3
8
♦ 取代反应:
2NH3 + 2Na = 2NaNH2 (白色) + H2 HgCl2 + 2NH3 = Hg(NH2)Cl↓+ NH4Cl
无机化学[第十四章氮族元素]课程预习
![无机化学[第十四章氮族元素]课程预习](https://img.taocdn.com/s3/m/753880ec5f0e7cd185253620.png)
第十四章氮族元素知识点归纳一、氮的单质单质氮在常况下是一种无色无味的气体,在标准状况下密度为1.25g/dm3。
工业上生产氮一般是由分馏液态空气在15.2MPa压力下装入钢瓶备用,或做成液氮存在于液瓶中,实验室中制备少量氮气。
N2分子是已知的双原子分子中最稳定的.在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:二、氦的成键特征N原子价最子层结构为2s2p3,即有3个成单电子和一个孤电子对,在形成化合物时,其成键特征如下:(1)形成离子键N原子有较高的电负性,它同电负性较低的金属形成一些二元氮化物即能够获得部分负电荷而形成N3-离子。
(2)形成共价键N电子同电负性较高的非金属形成化合物时它总是以不同的共价键同其他原子相结合,这些共价键一般有以下几种:三、氮的氢化物1.氨(1)氨的制备氨是氮的最重要化合物之一,在工业上氨的制备是用氮气和氢气在高温高压和催化剂存在下合成的:(2)氨分子的结构在NH3中,氨采取不等性sp3杂化,有一对孤电子对,分子呈三角锥形结构,键角为107。
18’。
这种结构使得NH3分子有较强的极性。
(3)氨的物理性质和化学性质NH3具有相对高的凝固点、溶解热、蒸发热、溶解度和介电常数,氨极易溶于水。
在水中的溶解度比任何气体都大,237K时1 dm3的水能溶解1200dm3的氨。
氨的主要化学性质有:①还原性KH3和NH4+离子中N的氧化价为+3,因此它们在一定条件下只能有失去电子的倾向而显还原性。
常温下,氨在水溶液中能被Cl2,H2O2,KMnO4等氧化。
例如:③加合反应氨中氮原子上的孤电子对能与其他离子或分子形成配位键,结果形成了各种形式的氨合物,氨能与许多金属离子形成氨配合物如[Ag(NH3)2]+。
④弱碱性氨极易溶于水,它在水中主要是形成水合分子,同时在水中只有一部分水合氨分子发生电离作用。
NH3·H2O的K b=1.8×10—5,可与酸发生中和反应.(4)铵盐氨和酸作用可得到相应的铵盐,铵盐一般是无色晶体,易溶于水,而且是强电解质。
14氮族元素

2、PH3 P2H4(不稳定) Ca3P2+H2O→PH3+Ca(OH)2 P4(g)+H2→4PH3 3、含氧酸 ① H3PO2 一元酸 ② H3PO3 二元酸 P4O6+H2O→H3PO3 P+Br2+H2O→H3PO3+ HBr PCl3+H2O→H3PO3 + HCl
H3PO4 2H3PO4﹣H2O→H4P2O7 焦磷酸 3H3PO4 ﹣2H2O→H5P3H10 三磷酸 4H3PO4﹣4H2O→(HPO3)4 四偏磷酸 注:磷酸正盐,常难溶;二氢盐,常可溶。 检验:H3PO4+Ag+→Ag3PO4↓(黄) H4P2O7+Ag+→Ag4P2O7↓(白) 4、磷卤化物:PCl3、PCl5、 POCl3 易水解,注意NCl3的水解,NF3 呢?
3.氧化物及其水合物酸碱性
_______________碱 Bi2O3 ∣As2O3(砒霜) Sb2O3 ∣两性偏酸 中、碱性 碱性 ↓ As2O5 Sb2O5 (Bi2O5) 酸
均难溶于水: Sb(OH)3 Bi(OH)3 (碱性) H3AsO3 ↓HCl↓OH﹣ ↓HCl ↓OH﹣ ↓HNO3 AsCl3 AsO33﹣ SbCl3 Sb(OH)4﹣ Bi(NO3)3
AsH3(剧毒) SbH3 (BiH3)
Na3As+3H2O→AsH3+3NaOH As2O3+6Zn+6H2SO4→2AsH3+6ZnSO4+3H2O 2AsH3+12AgNO3+3H2O→12Ag↓+As2O3+12HNO3 (古氏试砷法,可检出0.005mgAs2O3) 2AsH3→2As(砷镜)+3H2(绝O2 加热)——马氏 试砷法 SbH3(锑镜)类似 但:2As+5NaClO+3H2O→2H3AsO4+5NaCl Sb则不溶解
第十四章 氮族元素

2°和金属单质的反应 高温下和Mg、Ca、Sr、Ba反应 3Ca + N2---Ca3N2 ( Ca:410℃, Sr:380℃ ,Ba:260 ℃) 和Li反应250℃就很快了 6Li + N2 --- 2Li3N
2 氮气的制备 工业上分馏液态空气制N2,制取高纯N2 需将N2通过灼热铜网以除去O2,通过P2O5除 去H2O之后,储入钢瓶,黑瓶黄字。而O2是蓝 瓶黑字,最危险的是H2瓶,深绿瓶红字。 实验室中制N2,加热亚硝酸铵溶液 NH4NO2(aq) ---2H2O + N2
阳离子Hg, Ag, Au氧化物不稳定,分解 还原性阳离子
NH4NO3--- N2O + H2O
一般硝酸盐分解都有O2放出,故可助燃。 带结晶水的硝酸盐受热发生水解反应
4°硝酸的制备 工业上用NH3氧化法制HNO3。
实验室制法: 硝酸有挥发性,可用NaNO3和浓硫酸反应制取
§2. 磷和磷的化合物
第十四章 氮族元素
N 氮:大气中的N2,动植物体内的含氮
物质,智利硝石NaNO3。0.03% 第18位
P 磷:动植物体内的含磷物质,磷酸钙
Ca3(PO4)2· 2O,其它磷酸盐矿物。 0.11% 第 H
12位
As砷、Sb锑、Bi铋:以硫化物的形式存
在,雄黄As4S4, 雌黄As2S3, 辉锑矿Sb2S3, 辉铋
不论在酸中、碱中,联氨作氧化剂,反应 都非常慢,故只是一个好的还原剂。
N2H4是一种火箭燃料
N2H4 + HNO2 --- 2H2O + HN3 (叠氮酸)
当有 Pb, Ni作催化剂时,发生如下的反应 N2H4 --- N2 + 2H2 3N2H4 --- N2 + 4NH3
14 无机化学 第十四章 氮族元素

ns2 np3
1、最高氧化态为+5价。
其中,Bi(V)不稳定,是强氧化剂
2、基态原子都有半充满的p轨道,与同周期 前后的元素相比,有较大的电离能数据。
除氮外,其它元素的电负性都不太大。因此,本
族元素易和电负性较大的元素形成共价型的化合
物。如: NF3、PCl5、AsF5、SbF5 。
3、最低氧化态为-3价。
:
H
下列化合物热稳定性最高的是(
(A)NaN3 (B)AgN3 (C) Pb(N3)2
)。
(D)Ba(N3)2
用何种原理 来解释?
制备
NaN3+H2SO4===HN3+NaHSO4 N2H4+HNO2===2H2O+HN3
比较HN3、N2H4、 NH2OH的酸碱 性、还原性、 稳定性的大小?
根据HN3有弱酸性,可用强酸和对应的盐制备:
从而降低了弱酸与强酸之间 强度差异,称NH3为强、弱酸 的拉平溶剂。
Na+ +xNH3
e- + yNH3
e(NH3)y-
碱金属可以溶解在液氨中, 并呈现特征颜色
化 (1)还原性: 学 4NH3 + 3O2 (纯氧) === 2N2+6H2O 4NH3 + 5O2 === 4NO + 6H2O 性 2NH3 + 3CuO === 3Cu + N2 + 3H2O 质
由于NH4+与K+(或Rb+)的电荷相等,半径相近,因 此同类型的K+盐(或Rb+盐)与NH4+盐性质相似。
例如: KCl 、 NH4Cl 、 K2SO4 、 (NH4)2SO4 应该具有差不多 的晶格能。
第十四章氮族元素

第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物3B: 杂化,与2也是一种拟卤离子。
反应类似于卤除浅黄色的一般易溶。
盐,生成沉淀物。
但以氧化性为主,N 不等性杂化,大键中电亚硝酸的分子结构阳离子离子电场较弱一个电子形成第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物: 由于动力学原因,这种歧化只有在碱中才能成为现实。
PH轨道相互成键,+2°氧化物的性质离子形成可溶性配合物所以分析中常用做为的掩蔽剂D)缩合性链聚多磷酸的通式B)、Array B) 歧化反应的鸡蛋清溶液,使蛋白溶按顺序X第十四章 氮族元素§本章摘要§ 1.氮和氮的化合物单质 氮的氢化物 氮的含氧化合物 2.磷和磷的化合物单质 磷的氢化物 磷的含氧化合物 磷的卤化物和硫化物3.砷、锑、铋单质 砷锑铋的氢化物 砷、锑、铋的氧化物及其水合物 砷、锑、铋的三卤化物 砷、锑、铋的硫化物可与F 2反应有五价化合物生成。
,在碱性介质中而在强酸中,即] =1时,可以氧化,在酸介质中却弱酸,碱性比,若用浓盐酸抑制水解,体系中会有存在,但用水解,溶液中也不会有。
则要在浓盐酸中通入只有在浓盐酸中才会有存在,通入H无.。
《氮族元素》PPT课件

OH
OH
焦磷酸 四元酸
Kθ a1
3.0×10-2
06.01.2021
P
HO
H
HO
亚磷酸 二元酸
5.0×10-2
整理ppt
P
H
H
HO
次磷酸 一元酸
1.0×10-2
17
T26.怎样鉴别磷酸盐、焦磷酸盐和偏磷酸盐?(思考)
加AgNO3溶液,都有沉淀,但颜色不同:
Ag3PO4
Ag4P2O7
AgPO3
黄
白色 白色
2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金
16
T24.画出H3PO4的结构式,说明磷与非羟基氧的成键特征。(P681)
O
P
HO OH
OH
三元酸
氢键
两个d←pπ键
Kθ a1
=7.6×10-3
属于中强酸,无氧化性。
T25.分别画出H4P2O7、H3PO3、H3PO2的结构式,指出各是几元
酸,比较酸性的强弱。(p682-688)
O
O
O
O
HO P O P OH
属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
武汉大学版无机化学课后习题答案--14氮族元素

武汉大学版无机化学课后习题答案--14氮族元素第十四章 氮族元素1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少? 答:N 2 :2222222*222pp p s s KK σππσσ 键级3 NO :1*22222222*222pp p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P 高,但氮不如P 活泼,这是由俩者单质的结构不同决定的。
N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
特别白磷的P-P-P 键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g)ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。
无机化学下册:第十四章 氮族教学内容

b. 性质:
I. 二聚:
2NO N2O2
II. 易被氧化: 2NO+O2==2NO2
31
III. 形成配位化合物:
NO3-的检验:
在待测溶液中加入FeSO4,在沿着试管壁滴加浓硫酸,若出现棕 色环,则证明有NO3-存在
NO3-+3Fe2+4H+=3Fe3++ NO↑ +2H2O Fe2++NO= [Fe(NO)]2+
26
4. 氮化物 离子型 间充型 共价型
离子型氮化物只存在于固态,水溶液中 水解为氨: 3Mg+N2=Mg3N2 Mg3N2+6H2O=3Mg(OH)2+2NH3
间充型氮化物不服从一般化合价定律,如 TiN、Mn5N2、W2N3等,氮原子填充在金 属晶格的间隙中,化学性质稳定,熔点高, 硬度大,用于作高强度材料。
氮与非金属元素如C,Si,P等可形成共价 型氮化物,这类化合物中,氮元素氧化数 为-3,如AlN, BN, GaN, Si3N4等,它们都 是大分子物质,熔点高。
5. 氢叠氮酸 a. 结构: b. 性质:
I. 易爆炸:
•
•
••
N •• N N
•
••
•
H
纯HN3是无色液体,是一种爆炸物,受热或 受撞击就爆炸,常用于引爆剂。
6
ⅤA
氮(N) 磷(P) 砷(As) 锑(Sb) 铋(Bi)
原子序数
7
15
33
51
83
价层电子构型 典2型s22非p3金属3s23p3 4准s24金p属3 5s25p3金属6s26p3
主要氧化数 金++-313属、、、+0+性24 -+增33、、加+05,-+33非、、+0金5 (+属-33、) 、性+50降(+-33、低) 、+50
第十四章氮族元素
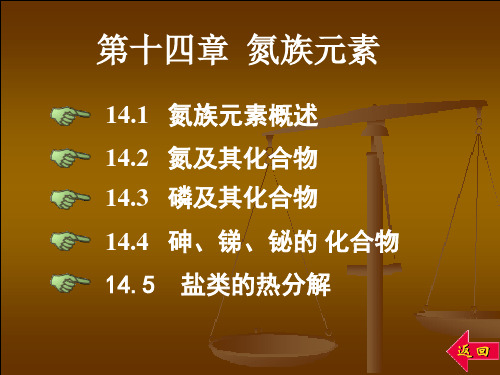
3Zn 8HNO3 (稀1: 2) 3Zn(NO3 )2 2NO 4H 2O
4Zn 10HNO3 (较稀,2mol·L-1)
4Zn(NO3 )2 N2O 5H2O 4Zn 10HNO3 (很稀,1:10)
4Zn(NO3 )2 NH4 NO3 3H2O
规律:HNO3越稀,金属越活泼, HNO3 被还原的氧化值越低。
冷的浓硝酸使Fe, Al, Cr钝化 王水:(氧化配位溶解)
Au HNO3 4HCl H[AuCl4 ] NO 2H2O 3Pt 4HNO3 18HCl 3H2[PtCl6 ] 4NO 8H2O
② 热稳定性差,保存在棕色瓶中
4HNO 3 4NO 2 O2 2H 2O
③ 与有机化合物发生硝化反应
K 223K
1.9 10 33
H2O H2O H3O OH
K
298
1.0 10 14
Na x NH 3 (l) Na e (NH 3 )x 氨合电子,蓝色,可导电
③ 加合反应(NH3为Lewis碱)
H NH3 NH4
Ag 2NH3 [Ag(NH3 )2 ]
④ 取代反应
例如,从N→Bi,+3化合物稳定性↑ N、P不易形成N3+、P3+(易水解) 而Sb、Bi→Sb3+、Bi3+(盐)
+5 含氧阴离子稳定性从P →Bi↓, N、P能以NO3- ,PO43- 存在
Sb
Sb
(OH
)
6
,
As
H
3As
O4
而Bi(Ⅴ)的化合物为强氧化剂
Bi 2O5 , NaBiO 3
成键情况:最高氧化态+5;np轨道半充满,电离势
第14章 氮族元素

1 氨
制 备
2NH
4
结构(略)
Cl Ca(OH)
Fe,Ru
2
CaCl
2
2H
2
O 2NH
3
(g)
2N2+3H2 == 2NH3
Haber F. 获1916年诺贝尔奖
性质
极易溶于水
液氨溶剂 碱金属液氨溶液 重要配位体
Ag
2NH3 = NH4+ + NH2——氨合电子生成
次磷酸
P4+Ba(OH) 2+H2O
△
H3PO3
亚磷酸 P4O6+6H2O(冷)=4H3PO3
△
PH3↑+Ba(H2PO2) 2 ↓H SO H3PO2+BaSO4 ↓
2 4
2 联氨(肼)、羟胺、氢叠氮酸
NH2OH
OH-
无色固体
-NH2
N2H4 无色液体
水溶液为碱性
NH3 + H2 O
>
N2H4 + H2 O
> NH2OH
+ H2 O
K≈10-9
K ≈10-5
K≈10-6
NH4++OH-
N2H5++OH- +H2O
K≈10
-16
NH3OH++OH-
N2H62++OH-
二.氮气的性质
常温下不活泼,用做保护气.
为什么氮的金属性比磷和 硫都强,但常温下不如它 们活泼? N2分子中叁键键能 大,不易破坏
高温下可发生很多反应 N2+3H2=2NH3
第14章 氮族元素
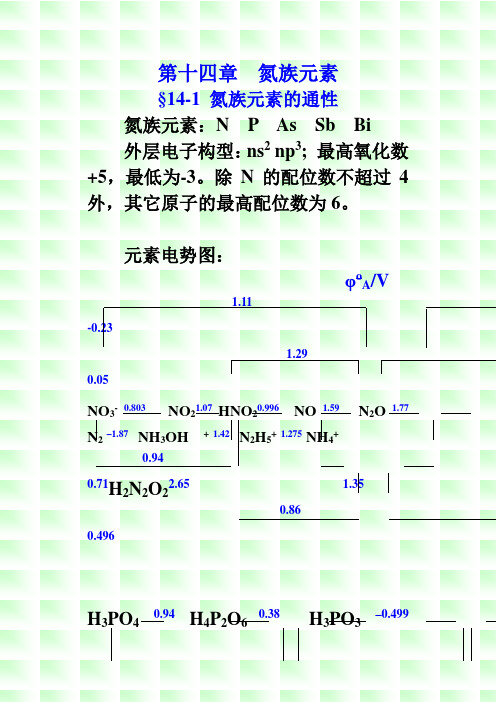
氮族元素§14-1 氮族元素的通性氮族元素:N P As Sb Bi外层电子构型:ns2 np3; 最高氧化数+5,最低为-3。
除N的配位数不超过4外,其它原子的最高配位数为6。
元素电势图:φo A/V1.11-0.231.290.05NO3-0.803NO21.07HNO20.996NO 1.59 N2O 1.77 N2–1.87 NH3OH +1.42 N2H5+1.275NH4+0.940.71HN2O22.65 1.3520.860.496H3PO40.94H4P2O60.38H3PO3–0.499PO2 –0.508 P (-0.1) P2H40.0PH33-0.276 -0.05 -0.063H3AsO40.56HAsO2 0.247As -0.60AsH3Sb2O50.58SbO+0.152Sb-0.51SbH3Bi2O5 1.6 BiO+0.32Bi-0.3BiH3φo B/V-1.160.151.05NO3-0.86 NO20.88 NO2-0.46 NO0.76N2O 0.94 N2–3.04NH2OH 0.73 N2H40.11NH3.H2O0.15N2O22-1.52 0.420.01 -0.14 -0.76 –0.73-1.18PO43- ?H2P2O62-?HPO32-–1.565 H2PO2-–2.05 P (-0.9) P2H4-0.8 PH3-1.12 -0.73 -0.89AsO43--0.68AsO2--0.675As (-1.43)AsH3H3SbO64-(-0.40)SbO2--0.66 Sb (-1.34) SbH3Bi2O4-0.56 Bi2O3-0.46 Bi ?BiH3+5价的化合物在酸性溶液是氧化剂,O5及HNO3均为强氧化剂,但在2碱性溶液中氧化性弱●+3价的化合物中HNO2具明显的氧化性,亚磷酸及其盐为强还原剂,其它元素的+3价化合物为弱还原剂●单质磷在酸、碱性溶液中均歧化,其它单质不歧化●-3价的化合物,除NH3及NH4+为弱还原剂外,其它为强还原剂§14-2 氮和它的化合物一、氮的成键特征和价键结构1. 形成离子键如Li3N、Mg3N2、Ca3N2(极易水解成相应的氢氧化物及NH3)2. 形成共价键(1)SP3不等性杂化,形成三个共价单键。
氮族元素PPT课件

实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
《氮族元素》课件

03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章 氮族元素
一、选择题
1、下列物质的水解产物中既有酸又有碱的是………………………………………… ( )
(A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 3
2、有关H 3PO 4、H 3PO
3、H 3PO 2不正确的论述是…………………………………( )
(A) 氧化态分别是+5,+3,+1
(B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸
3、下列含氧酸根中,属于环状结构的是……………………………………………… ( )
(A) S O 462
- (B) S O 3102- (C) P O 393
- (D) P O 3105-
4、分子中含d —p 反馈π键的是
(A) HNO 3 ; (B) HNO 2; (C) H 3PO 2; (D)NH 3
5、 下列物质酸性最强的是
(A) N 2H 4 ; (B) NH 2OH ; (C) NH 3 ; (D)HN 3
6、 下列酸中为一元酸的是
(A) H 4P 2O 7 ; (B) H 3PO 2 ; (C) H 3PO 3 ; (D)H 3PO 4
7、与AgNO 3溶液作用观察到白色沉淀的是
(A) Na 3PO 4 ; (B) K 2CrO 4 ; (C) KI ; (D) Na 4P 2O 7
8、下列化合物中,最易生发爆炸反应的是
(A) Pb(NO 3)2 ; (B) Pb(N 3)2 ; (C) PbCO 3 ; (D) K 2CrO 4
9、下列物质均有较强的氧化性,其中最强氧化性与惰性电子对有关的是
(A) K 2Cr 2O 7 ; (B) NaBiO 3 ; (C) (NH 4)2S 2O 8 ; (D) H 5IO 6
10、氨、联氨和羟胺具有的共同性质是
(A) 氨的氧化态相同; (B)具有还原性
(C) 具有氧化性; (D)都是一元弱碱
二、填空题
1、NH 3和PH 3的碱性,前者______________后者;
2、在砷分族的氢氧化物(包括含氧酸盐)中酸性以_____________为最强,碱性__________最强,以____________的还原性最强,以____________的氧化性最强,这说明从砷锑到铋氧化数为________的化合物渐趋稳定。
3、在AlCl 3和SbCl 3溶液中各加入适量Na 2S 溶液,将分别产生__________和_________沉淀,使后者与过量的Na 2S 溶液作用,将生成___________而溶解。
4、在Sn(II)的强碱溶液中加入硝酸铋溶液,发生变化的化学方程式为:
________________________________________________________________。
三、简答题
1、氮、磷、铋都是V A族元素,它们都可以形成氯化物,例如:NCl3、PCl3、PCl5和BiCl3。
试问:
(1) 为什么不存在NCl5及BiCl5而有PCl5?
(2) 请你对比NCl3、PCl3、BiCl3水解反应的差异(指水解机理及水解物性质上差异)。
写出有关反应方程式。
2、.在P4分子中P-P-P键的键角约为多少?说明P4分子在常温下具有高反应活性的原因?
3、通常如何存放金属钠和白磷,为什么?
4、试讨论为什么PCl3的水解产物是H3PO3和HCl,而NCl3的水解产物却是HOCl和NH3?
5、.在Na2HPO4和NaH2PO4溶液中加入AgNO3溶液均析出黄色沉淀?而在PCl5完全水解后的产物中,加入AgNO3只有白色沉淀,而无黄色沉淀,试对上述事实加以说明。
