酸 碱 盐 通 性 总 结和化学方程式书写
(完整版)初中酸碱盐化学方程式(全)

1.酸及酸的通性对于酸的定义,我们说电离时生成的阳离子全部都是H+。
这里我们要特别注意的是“阳离子”、“全部”、“H+”几个关键字。
下面我们以常见的硫酸和盐酸为例来说明酸的通性。
酸的通性盐酸硫酸酸使紫色石蕊试液变红,使无色酚酞试液不变色。
盐酸使紫色石蕊试液变红,无色酚酞试液不变色硫酸使紫色石蕊试液变红,无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;金属是指在金属活动顺序表中排在‘氢’前面的活泼金属,排在‘氢’后的金属不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
2.碱及碱的通性与酸雷同,我们可以将碱定义为:电离时生成的阴离子全部是OH-离子。
这里我们也要特别注意的是“阴离子”、“全部”、“OH -”几个关键字。
九年级科学酸、碱、盐化学方程式总结

2019年九年级科学酸、碱、盐化学方程式总结一、金属单质+ 酸-------- 盐+ 氢气(置换反应)1. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑2. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑3. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑4. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑5. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑6. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑7. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑8. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑二、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐1. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu2. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu3. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg三、碱性氧化物+酸-------- 盐+ 水1. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O2. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O3. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O4. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O5. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O6. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O四、酸性氧化物+碱-------- 盐+ 水1.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O2.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O3.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O4.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O5. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O五、酸+ 碱-------- 盐+ 水1.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O2. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O3.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O4. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O5. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O6.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O7.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O8.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O9.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O10.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O11.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O六、酸+ 盐-------- 另一种酸+ 另一种盐1.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑2.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑3.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑4.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO35. 硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑6.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl七、碱+ 盐-------- 另一种碱+ 另一种盐1.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO42.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl3.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl4. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl5. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH八、盐+ 盐----- 两种新盐1.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO32.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl九、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
酸碱盐等化学方程式汇总

酸碱盐等化学方程式汇总酸碱盐是化学中常见的三类物质,每一类物质都具有特定的性质和反应方式。
在这篇文章中,我将为您提供酸碱盐等化学方程式的汇总,希望对您的学习有所帮助。
一、酸的化学方程式:1.酸与水的反应:酸+水→酸溶液例如:HCl+H2O→H3O++Cl-2.酸与金属的反应:酸+金属→相应盐+氢气例如:2HCl+Zn→ZnCl2+H23.酸与碱的反应:酸+碱→相应盐+水例如:HCl+NaOH→NaCl+H2O4.酸与碱式盐的反应:酸+碱式盐→相应盐+水例如:HCl+NaHCO3→NaCl+H2O+CO25.酸与碱式氢氧化物的反应:酸+碱式氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O二、碱的化学方程式:1.碱与水的反应:碱+水→非金属氢氧化物例如:NaOH+H2O→Na++OH-+H2O2.碱与酸的反应:碱+酸→相应盐+水例如:NaOH+HCl→NaCl+H2O3.碱与金属的反应:碱+金属→相应盐+氢气例如:2NaOH+Zn→Na2ZnO2+H24.碱与酸式盐的反应:碱+酸式盐→相应盐+酸例如:NaOH+NaHCO3→Na2CO3+H2O+CO25.碱与酸式氢氧化物的反应:碱+酸式氢氧化物→相应盐+酸+水例如:2NaOH+Cu(OH)2→Na2[Cu(OH)4]+H2O三、盐的化学方程式:1.酸与碱的反应:酸+碱→相应盐+水例如:HCl+NaOH→NaCl+H2O2.酸与碱式盐的反应:酸+碱式盐→相应盐+水例如:HCl+NaHCO3→NaCl+H2O+CO23.酸与碱式氢氧化物的反应:酸+碱式氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O四、酸碱盐反应中的氧化还原反应方程式:1.酸与金属的反应:酸+金属→相应盐+氢气例如:2HCl+Zn→ZnCl2+H22.酸与非金属氢氧化物的反应:酸+非金属氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O3.酸与非金属氧化物的反应:酸+非金属氧化物→相应盐+水例如:H2SO4+CaO→CaSO4+H2O总结:本文汇总了酸、碱和盐的化学方程式,涵盖了酸与水、酸与金属、酸与碱、酸与碱式盐、酸与碱式氢氧化物的反应,以及碱与水、碱与酸、碱与金属、碱与酸式盐、碱与酸式氢氧化物的反应,还包括酸碱盐反应中的氧化还原反应方程式。
酸碱盐de 通性以化学反应为例

第一章酸碱盐一、性质概括酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)活泼金属 + 酸→盐 + 氢气(3)碱性氧化物 + 酸→盐 + 水(4)碱 + 酸→盐 + 水(5)盐 + 酸→另一种盐 + 另一种酸(产物符合复分解条件)碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→盐+水(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)二、酸碱通性具体涉及的化学方程式1、活泼金属 + 酸→盐 + 氢气注:a、活泼金属指在《金属活动顺序表》中的位置排在氢前面,且除去钾钙钠之外的金属,会考到的具体有、、、。
Zn+H2SO4==ZnSO4+H2↑Mg+H2SO4==MgSO4+H2↑Fe+H2SO4 ==FeSO4+H2↑2Al+3H2SO4 ==Al2(SO4)3+3H2↑Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑Fe+2HCl==FeCl2+H2↑2Al+6HCl==2AlCl3+3H2↑2、碱性氧化物 + 酸→盐 + 水Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐溶解,形成黄色的溶液CuO+2HCl==CuCl2+H2O现象:黑色固体溶解,生成蓝色的溶液Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液3、酸性氧化物+碱→盐+水(该类反应不是复分解)Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验CO2少量吸收2NaOH+CO2==Na2CO3+H2O 现象:无明显现象可吸收量多的CO22NaOH+SO2==Na2SO3+H2O Ca(OH)2+SiO2===CaSiO3+H2O 4、盐 + 酸→另一种盐 + 另一种酸AgNO3+HCl==AgCl↓+HNO3现象:有白色沉淀生成,用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体BaCl2+H2SO4==BaSO4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2C O2↑现象:这三个反应现象同与盐酸反应现5、盐+碱→另一种盐+另一种碱(两者都可溶)2NaOH+FeCl2==Fe(OH)2↓+2NaCl 现象:生成白色絮状沉淀,2NaOH+CuSO4==Cu(OH)2↓+2NaSO4现象:生成蓝色絮状沉淀NH4Cl+NaOH==NH3↑+H2O+NaCl 现象:有可以使石蕊试纸变蓝的气体生成MgCl2+Ca(OH)2==Mg(OH)2↓+CaCl2现象:生成白色沉淀6、碱 + 酸→盐 + 水Fe(OH)3+3HCl==FeCl3+3H2O现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O现象:蓝色沉淀溶解,形成黄绿色的溶液2NaOH+H2SO4==Na2SO4+2H2O现象:不明显Cu(OH)2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液三、盐的通性1、盐 + 酸→另一种盐 + 另一种酸a、酸与可溶性盐反应,生成物中有沉淀,促使复分解反应趋于完成。
(完整版)酸碱盐知识点总结及汇总

酸碱盐知识点总结一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸HCl浓硫酸H2SO4颜色、状态“纯净”:无色液体工业用盐酸:黄色(含Fe3+)无色粘稠、油状液体气味有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾)吸水性脱水性腐蚀性用途①金属除锈②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油2.酸的通性:盐酸 HCl 硫酸 H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气 Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水 NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸 AgNO3+HCl=AgCl↓+HNO3 BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
酸碱盐中和反应方程式

酸+ 碱-------- 盐+ 水1.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O2.盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O3.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O4.盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O5.盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O6.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O7.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O8.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O9.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O10.硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O11.硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O酸+ 盐-------- 另一种酸+ 另一种盐12.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑13.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑14.碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑15.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO316.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑17.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl碱+ 盐-------- 另一种碱+ 另一种盐18.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO419.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl20.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl21.氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl22.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH 盐+ 盐----- 两种新盐23.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO324.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl。
酸碱盐化学方程式书写

酸碱盐化学方程式书写1、酸+金属氧化物=盐+水⑴CuO + H2SO4 = ⑵Fe2O3 + HCl =⑶Na2O + HNO3 =⑷CaO + HCl =2、酸+碱=盐+水(中和反应)⑴Ba(OH)2 + H2SO4=⑵Ca(OH)2 + HCl=⑶NaOH + HNO3=⑷Cu(OH)2 + HCl=⑸2Fe(OH)3 + H2SO4=3、酸+盐=新酸+新盐(注意:盐不是AgCl,BaSO4,生成物有沉淀或气体)(0)AgNO3 + HCl= ⑴Ba(NO3) 2+ H2SO4=⑵CaCO3 + HCl= ⑶AgCl + HNO3=⑷NaCl + HNO3=4、碱+盐=新碱+新盐(注意:反应物都可溶,生成物中有沉淀)⑴Cu(OH)2+ Na2SO4=⑵NaOH + BaCl2=⑶2NaOH + CuCl2=⑷Ca(OH)2 + Na2CO3=⑸NaOH + FeCl3=(6)NaOH + FeCl2=5、盐+盐=新盐+新盐(注意:反应物可溶,生成物中有沉淀)⑴CaCO3 + NaCl=⑵NaCl + KNO3=⑶BaCl2 + Na2CO3=⑷CaCl2 + K2CO3=⑸AgNO3 + KCl=6、非金属氧化物+碱=盐+水(注意:碱溶于水,元素化合价不变)不属于复分解反应⑴CO + NaOH=⑵CO2 + Ca(OH)2=⑶SO2 +2 KOH=⑷SO3 + Ba(OH)2=⑸CO2 + Cu(OH)2=7、活泼金属+酸=盐+H2↑(注意:金属活动性>H,酸为盐酸或稀硫酸)⑴Al + H2SO4= ⑵Zn + 2HCl=⑶Fe + H2SO4= ⑷Cu + H2SO4=⑸Ag + HCl=8、金属+盐=新金属+新盐(注意:盐溶于水,强置换弱)⑴Al + CuSO4=⑵Fe + AgNO3 =⑶Zn + MgCl2 =⑷Cu + FeSO4=⑸Cu+ AgCl=8、属于复分解反应规律总结:1、酸+金属氧化物=盐+水2、酸+碱=盐+水(中和反应)3、酸+盐=新酸+新盐(注意:盐不是AgCl,BaSO4,生成物有沉淀或气体)4、碱+盐=新碱+新盐(注意:反应物都可溶,生成物中有沉淀)5、盐+盐=新盐+新盐(注意:反应物可溶,生成物中有沉淀)9、其它反应规律:6、非金属氧化物+碱=盐+水(注意:碱溶于水,元素化合价不变)不属于复分解反应7、活泼金属+酸=盐+H2↑(注意:金属活动性>H,酸为盐酸或稀硫酸)8、金属+盐=新金属+新盐(注意:盐溶于水,强置换弱)所有反应规律总结:凡是没有酸参加的反应,反应物中的盐和碱都要溶于水;凡是复分解反应生成物要有沉淀、气体或水10、常见离子的检验1.碳酸根离子的检验:①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.硫酸根离子的检验:①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解3.氯离子的检验:①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解方程式校对答案:1、酸+金属氧化物=盐+水⑴CuO + H2SO4 =CuSO4 + H2O⑵Fe2O3 + 6HCl = 2FeCl3 + 3H2O⑶Na2O + 2HNO3 =2NaNO3 + H2O⑷CaO + 2HCl =CaCl2 + H2O2、酸+碱=盐+水(中和反应)⑴Ba(OH)2 + H2SO4=BaSO4↓+ 2H2O⑵Ca(OH)2 + 2HCl=CaCl2 + 2H2O⑶NaOH + HNO3=NaNO3 + H2O⑷Cu(OH)2 + 2HCl=CuCl2 + 2H2O⑸2Fe(OH)3 + 3H2SO4=Fe2(SO4)3 + 6H2O不溶于水的碱也能与酸反应:Cu(OH)2蓝色沉淀,2Fe(OH)3红褐色沉淀,其余为白色3、酸+盐=新酸+新盐(注意:盐不是AgCl,BaSO4,生成物有沉淀或气体)(0)AgNO3+ HCl= AgCl ↓ +HNO3⑴Ba(NO3)2 + H2SO4= BaSO4↓+ 2HNO3⑵CaCO3 + 2HCl=CaCl2 + H2O + CO2↑⑶AgCl + HNO3─××× ⑷NaCl + HNO3─×××AgCl,BaSO4:既不溶于水也不与酸反应4、碱+盐=新碱+新盐(注意:反应物都可溶,生成物中有沉淀)⑴Cu(OH)2+ Na2SO4─××× ⑵NaOH + BaCl2─×××⑶2NaOH + CuCl2=Cu(OH)2↓+ 2NaCl⑷Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH(1、用于检验碳酸钠;2、用于制取氢氧化钠)⑸3NaOH + FeCl3=Fe(OH)3↓+ 3NaCl (6)2NaOH + FeCl2=Fe(OH)2↓+ 2NaCl5、盐+盐=新盐+新盐(注意:反应物可溶,生成物中有沉淀)⑴CaCO3+ NaCl─××× ⑵NaCl + KNO3─×××⑶BaCl2 + Na2CO3=BaCO3↓+ 2NaCl⑷CaCl2 + K2CO3=CaCO3↓+ 2KCl⑸AgNO3 + KCl=AgCl ↓+ KNO36、非金属氧化物+碱=盐+水(注意:碱溶于水,元素化合价不变)不属于复分解反应⑴CO + NaOH-××××⑵CO2 + Ca(OH)2=CaCO3↓+ H2O⑶SO2 +2 KOH=K2SO3 + H2O⑷SO3 + Ba(OH)2=BaSO4↓+ H2O⑸CO2 + Cu(OH)2-×××7、活泼金属+酸=盐+H2↑(注意:金属活动性>H,酸为盐酸或稀硫酸)⑴2Al + 3H2SO4=Al2(SO4)3 + 3H2↑⑵Zn + 2HCl=ZnCl2 + H2↑⑶Fe + H2SO4=FeSO4 + H2↑⑷Cu + H2SO4─××× ⑸Ag + HCl─×××8、金属+盐=新金属+新盐(注意:盐溶于水,强置换弱)⑴2Al + 3CuSO4=Al2(SO4 )3+3Cu⑵Fe + 2AgNO3 = Fe(NO3)2+2Ag⑶Zn + MgCl2——×××⑷Cu + FeSO4─ ×××⑸Cu+ AgCl─ ×××。
酸碱中和反应的化学方程式

酸碱中和反应的化学方程式酸碱中和反应是指酸和碱在一定条件下反应生成盐和水的化学反应。
二、化学方程式:1.酸碱中和反应的通式:[ + + ]2.具体的中和反应:–氢氧化钠(NaOH)与盐酸(HCl)反应:[ + + _2 ]–氢氧化钾(KOH)与硫酸(H2SO4)反应:[ + _2_4 _2_4 + _2 ]–碳酸钠(Na2CO3)与氢氧化钙(Ca(OH)2)反应:[ _2_3 + _2 _3↓ + ]三、反应条件:1.温度:一般在中性条件下进行,温度对反应速率有影响,但不会影响反应产物。
2.压力:在常压下进行,压力的变化对中和反应没有明显影响。
3.溶剂:水是最常用的溶剂,但在某些特殊情况下,也可以在其他溶剂中进行。
四、中和反应的判断:1.酸碱指示剂的变化:如酚酞、甲基橙等,颜色的变化可以判断反应是否进行。
2.沉淀的形成:如反应生成不溶于水的盐,可以通过观察沉淀的形成来判断。
五、中和反应的应用:1.实验室:中和反应是实验室中常用的反应,用于制备盐和纯化物质。
2.工业:工业上利用中和反应进行废水处理、制造化学品等。
3.农业:中和反应在农业上用于调节土壤的酸碱度,改善植物的生长环境。
六、注意事项:1.安全:在进行中和反应时,要注意防护措施,避免酸碱溶液的直接接触。
2.精确:测量和配制酸碱溶液时,要精确计量,避免反应失败或过量。
酸碱中和反应是化学中的基本反应类型之一,理解和掌握其化学方程式对于学习化学具有重要意义。
通过学习酸碱中和反应,可以更好地理解物质的性质和变化规律,为深入学习化学打下基础。
习题及方法:1.习题:氢氧化钠与盐酸反应生成什么物质?方法:根据酸碱中和反应的通式,直接写出反应方程式。
答案:NaOH + HC l → NaCl + H₂O2.习题:氢氧化钾与硫酸反应的化学方程式是什么?方法:根据酸碱中和反应的通式,直接写出反应方程式。
答案:KOH + H₂SO₄ → K₂SO₄ + H₂O3.习题:碳酸钠与氢氧化钙反应生成什么物质?方法:根据酸碱中和反应的通式,直接写出反应方程式。
初中化学酸碱盐性质之酸的通性总结

初中化学酸碱盐性质之酸的通性总结来源:网络资源| 作者:未知| 本文已影响 1932 人酸的组成——氢离子+酸根离子(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)酸的PH<7(3)跟(H)前的活泼金属起置换反应酸+金属==盐+氢气例:2HCl+Fe=FeCl2+H2↑(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物—→盐+水例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(5)跟某些盐反应酸+碳酸盐==盐+水酸+盐—→新酸+新盐例:H2SO4+BaCl2=2HCl+BaSO4↓(6)跟碱起中和反应酸+碱—→盐+水例:2HCl+Cu(OH)2=CuCl2+2H2O初中化学理论性知识点总结来源:网络资源| 作者:未知| 本文已影响 2859 人1、空气的成分:氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%,其它气体与杂质占0.03%2、主要的空气污染物:NO2、CO、SO2、H2S、NO等物质3、其它常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、NO2(二氧化氮)、H2S(硫化氢)、HCl(氯化氢)4、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、MnO4-(高锰酸根)、MnO42-(锰酸根)、PO43-(磷酸根)、Cl-(氯离子)、HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、NH4+(铵根或铵离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)各元素或原子团的化合价与上面离子的电荷数相对应:课本P80一价钾钠氢和银,二价钙镁钡和锌;一二铜汞二三铁,三价铝来四价硅。
酸碱盐通性总结

酸碱盐通性总结一、酸碱盐概念酸= + ;碱= + ;盐= + 。
二、知识储备:1.酸根离子:氯离子;硝酸根离子,硫酸根离子,碳酸根离子。
2.金属离子:(+1)钾离子,钠离子,银离子,铵根离子,(+2)钙离子,钡离子,镁离子,锌离子,亚铁离子,铜离子,(+3)铝离子,铁离子。
三、指示剂作用1.酸性溶液中含有大量离子,使石蕊溶液变,酚酞溶液;2.碱性溶液中含有大量离子,使石蕊溶液变,酚酞溶液。
四、复分解反应条件:(反应特点:离子交换,化合价不变)(1)沉淀:Ag++Cl-=AgCl↓ Ba2++SO42--==BaSO4↓ Ba2++CO32--==BaCO3↓Ca2++CO32--==CaCO3↓ Cu2++2OH--==Cu(OH)2↓ Fe3++3OH--==Fe(OH)3↓ Mg2++2OH—=Mg(OH)2↓(2)气体:2H++CO32--==CO2↑+H2O NH4++OH--==NH3↑+H2O(3)水:H++OH--==H2O(中和反应)五、八个反应公式:(一)、金属+酸= (置换反应)(氢前金属,铁为+2)1. 镁和硫酸:;2. 镁和盐酸:;3.铁和盐酸:。
4. 铁和硫酸:;5. 实验室制取氢气:;. ;(二)、金属+盐= (置换反应)(强换弱,铁为+2)1. 铁和硫酸铜溶液:,2. 铜和硝酸银溶液:,3. 铝和硫酸铜溶液:。
4. 锌和硫酸铜溶液:。
(三)碱+非金属氧化物= (盐比氧化物多一个“O”原子,元素化合价不变)1. 氢氧化钠在露置在空气中变质的原因:;2. 氢氧化钠和二氧化硫:;3. 二氧化碳的检验(用石灰浆刷墙,墙变硬的原因):;4. 用石灰水吸收硫酸厂排放的二氧化硫:;(四)、酸+金属氧化物= (复分解反应)(用于金属除锈)1. 氧化铜和硫酸:,2. 氧化铜和盐酸:;3. 硫酸除铁锈:,4. 盐酸除铁锈:;(五)、酸+碱= (中和反应-复分解反应)1. 氢氧化钠溶液中逐滴滴加盐酸:;2. 氢氧化铜和硫酸:,3. 用氢氧化镁治疗胃酸过多:;4. 用氢氧化铝治疗胃酸过多:;5. 氢氧化钠处理硫酸厂废水:,6. 用熟石灰改良含硫酸的土壤:;7. 氢氧化钡和硫酸:,(六)、酸+盐= (复分解反应)1. 碳酸钠和硫酸:;2. 纯碱和盐酸反应:;3. 盐酸和硝酸银:;4. 用小苏打治疗胃酸过多:;5.二氧化碳的实验室制法:。
初中酸碱盐化学方程式(全)

1.酸及酸の通性對於酸の定義,我們說電離時生成の陽離子全部都是H+。
這裏我們要特別注意の是“陽離子”、“全部”、“H+”幾個關鍵字。
下面我們以常見の硫酸和鹽酸為例來說明酸の通性。
酸の通性鹽酸硫酸酸使紫色石蕊試液變紅,使無色酚酞試液不變色。
鹽酸使紫色石蕊試液變紅,無色酚酞試液不變色硫酸使紫色石蕊試液變紅,無色酚酞試液不變色。
金屬+酸→鹽+氫氣Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑堿性氧化物+酸→鹽+水Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O堿+酸→鹽+水NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O鹽+酸→另一種鹽+另一種酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金屬+酸→鹽+氫氣’中,酸通常指の是稀硫酸和稀鹽酸,不能是濃硫酸或硝酸。
因為濃硫酸或硝酸都有強氧化性,與金屬反應時不能生成氫氣而生成了水;金屬是指在金屬活動順序表中排在‘氫’前面の活潑金屬,排在‘氫’後の金屬不能置換酸中の氫。
(2)通過金屬跟酸の反應情況導出金屬活動順序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金屬活動性由強逐漸減弱金屬活動性順序中,金屬位置越靠前,活動性越強,反應越劇烈,所需時間越短。
(3)濃硫酸具有吸水性,通常用它作為幹燥劑。
硫酸還具有脫水性,它對皮膚或衣服有很強の腐蝕性。
稀釋濃硫酸時一定要把濃硫酸沿著器壁慢慢地注入水裏,並不斷攪動,切不可把水倒進濃硫酸裏,如果把水注入濃硫酸裏,水の密度較小,會浮在硫酸上面,溶解時放出の熱會使水立刻沸騰,使硫酸液向四處飛濺,容易發生事故。
2.堿及堿の通性與酸雷同,我們可以將堿定義為:電離時生成の陰離子全部是OH-離子。
這裏我們也要特別注意の是“陰離子”、“全部”、“OH -”幾個關鍵字。
酸碱盐物理性质和化学性质总结

常见的酸通式:酸 + 金属氧化物→盐 + H2O (复分解反应) 举例:氧化铁和稀硫酸:Fe2O3+ 3H2SO4= Fe2(SO4)3+ 3H2O 现象:固体溶解,溶液由无色变为黄色氧化铜和稀硫酸:CuO + H2SO4= CuSO + H2O 现象:固体溶解,溶液由无色变为蓝色(4)与碱反应通式:酸 + 碱→盐 + H2O (复分解反应)举例:稀盐酸和氢氧化钠:HCl + NaOH = Na Cl + H2O稀硫酸和氢氧化钡:H2SO4+ Ba(OH)2= Ba SO4↓ + 2H2O 现象:有白色沉淀生成(5)与某些盐反应通式:酸 + 盐→新酸 + 新盐(酸 + 碳酸盐→新盐 + H2O + CO2↑)(复分解反应)举例:稀盐酸和碳酸钙:CaCO3 + 2HCl = CaCl2+ H2O + CO2↑现象:固体溶解,有气泡产生【注意】不同酸具有“个性”的原因是:含有的酸根离子(或阴离子)不同。
如:稀硫酸和氯化钡:H2SO4+ Ba Cl2= Ba SO4↓+ 2HCl 现象:有白色沉淀产生(检验Ba2+)常见的碱1.定义:在水溶液中解离时产生的阴离子全部是氢氧根离子(或OH-)的化合物氢氧化铁和稀盐酸:Fe(OH)3 + 3HCl = Fe Cl3+ 3H2O现象:红褐色固体溶解,溶液由无色变为黄色氢氧化铜和稀硫酸:Cu(OH)2 + H2SO4= Cu SO4+ 2H2O现象:蓝色固体溶解,溶液由无色变为蓝色(4)与某些盐反应通式:碱+盐→新碱+新盐(复分解反应)举例:氢氧化钠和硫酸铜:2NaOH + Cu SO4 = Cu(OH)2↓ + Na2SO4现象:有蓝色沉淀生成【注意】不同碱具有“个性”的原因是含有的阳离子不同。
如:氢氧化钙和碳酸钠:Ca(OH)2 + Na2CO3= Ca CO3↓ + 2NaOH 现象:有白色沉淀生成常见的盐1.盐的定义:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物2.常见的盐及其用途①钾盐、钠盐、铵盐、硝酸盐均易溶于水②盐酸盐中,只有AgCl不溶于水也不溶于酸③硫酸盐中,BaSO4不溶于水也不溶于酸,Ag2SO4、CaSO4微溶于水④碳酸盐中,Na2CO3、K2CO3、(NH4)2CO3易溶,MgCO3微溶,其余不溶4.盐的化学性质(4条,必考)(1)与某些金属反应置换反应规律:盐(可溶) + 金属(较活泼) →新金属(较不活泼) + 新盐举例:锌和硫酸铜:Zn + CuSO4 = Cu + ZnSO4现象:有红色固体析出,溶液蓝色变浅,最终变成无色(2)与酸反应规律:盐 + 酸→新酸 + 新盐(碳酸盐 + 酸→新盐 + H2O + CO2↑)(复分解反应)举例:碳酸钠和稀硫酸:NaCO3 + H2SO4= H2O + CO2↑+ Na2SO4现象:有气泡产生氯化钡和稀硫酸:BaCl2 + H2SO4= BaSO4↓ + 2HCl 现象:有白色沉淀生成(3)与碱反应规律:盐(可溶) + 碱(可溶) →新碱 + 新盐(复分解反应) 举例:碳酸钠和氢氧化钙:Na2CO3+ Ca(OH)2= CaCO3↓+ 2NaOH 现象:有白色沉淀生成硫酸铜和氢氧化钠:CuSO4 + NaOH= Na2SO4+ Cu(OH)2↓现象:有蓝色沉淀生成(4)与某些盐反应规律:盐(可溶) + 盐(可溶) →两种新盐(复分解反应) 举例:氯化钠和硝酸银:NaCl + AgNO3 = NaNO3+ AgCl↓现象:有白色沉淀生成碳酸钠和氯化钙:Na2CO3+ CaCl2= CaCO3↓+ 2NaCl 现象:有白色沉淀生成。
酸、碱、盐的定义及组成

(一)酸、碱、盐的定义及组成:(二)部分酸、碱、盐的化学式:(三)物质的俗称和主要成分:(四)物质的颜色:(五)离子的检验:44322②在未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含Ag+或SO42-;③鉴别Cl-和SO42-:只能用BaCl2溶液,不能用AgNO3溶液;④检验SO42-的另外方法:先加过量的HCl(排除干扰),再滴加BaCl2溶液;⑤Cl-和SO42-共存时检验:应先检验SO42-[加过量Ba(NO3)2或Ba(OH)2,不能用BaCl2溶液],再检验Cl-(加AgNO3溶液)。
(六)酸、碱、盐的溶解性:钾钠铵硝都能溶,硫酸除钡氯除银,碳酸只溶钾钠铵,溶碱钾钠钡和铵。
微溶:Ca(OH)2:石灰水注明“澄清”的原因;CaSO 4:实验室制二氧化碳时不用稀硫酸的原因; Ag 2SO 4:鉴别SO 42-和Cl -时,不用硝酸银的原因。
常见沉淀物:氯化银、硫酸钡、(硫酸银):不溶于稀硝酸 碳酸盐:碳酸钙、碳酸钡、碳酸银碱:氢氧化镁、氢氧化铜、氢氧化铁(七)两类反应:(九)生活中的酸和碱性质比较:溶于硝酸、盐酸说明:①“白雾”形成的机理;②稀释浓硫酸的方法;③皮肤沾上浓硫酸、浓碱的处理方法;(十)酸、碱、盐的性质(通性):(十一)其他注意点:1.浓盐酸、浓硫酸、氢氧化钠、生石灰、纯碱晶体、硫酸铜粉末等露置在空气中:①质量如何变化?②质量分数如何变化?③是否变质?2.NaOH固体密封保存的原因:易吸收水蒸气而潮解,易吸收二氧化碳而变质。
检验是否变质:可用盐酸(酸)、Ba(OH)2(碱)、BaCl2(盐)检验。
3.对于反应“Ca(OH)2+CO2→CaCO3↓+H2O”可用于解释:①检验CO2;②白膜形成(思考:如何除去白膜?);③新彻的墙壁会出“汗”。
4.酸溶液≠酸性溶液;碱溶液≠碱性溶液。
如Na2CO3溶液是盐溶液,但溶液显碱性,可使酚酞试液变红。
5.不溶性碱与指示剂无作用,如Cu(OH)2放入水中,不显碱性,不能使指示剂变色。
(完整版)初中化学酸碱盐总结

1、酸(1)使酸碱指示剂变色(非氧化性酸),紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色,无色酚SU式液遇酸溶液不变色(2)酸呈酸性(PH值〈7)(3)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应(非氧化性酸)酸+金属一-盐+氢气【置换反应】例:2HCl+Fe=FeC12+H2 t(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物一-盐+水例:3H2S04+Fe203=Fe2(S04)3+3H20(5)跟碱起中和反应酸+碱盐+水例:2HC1+Cu (OH) 2=CuC12+2H20(6)与某些盐反应生成酸和新盐。
盐+酸二新盐+新酸,要依照复分解的条件来判断是否会发生反应例:BaC12+H2S04=BaS04 I +2HC1{常见的酸:盐酸:物理性质:有刺鼻性气味和酸味的液体,易挥发,遇水蒸气形成口雾。
化学性质:有酸的通性用途:除锈,制药,胃液里的盐酸帮助消化。
硫酸:物理性质:纯硫酸是无色粘稠油状液体,不挥发。
硫酸特性:吸水性.脱水性.强氧化性。
稀硫酸有酸的通性。
2、碱非可溶性碱的性质:1、能与酸反应可溶性碱的通性:2、碱呈碱性碱能使紫色石蕊试液变蓝碱能使无色的酚駄试剂变红。
pH>73、与酸性氧化物反应注:碱+酸性氧化物=盐+水【不是复分解反应】例:φCa (OH) 2+C02=CaC03 I ÷H20②2NaOH+CO2=Xa2CO3+H2O注:酸性氧化物不等于非金属氧化物4碱+酸=盐+水5碱+盐=碱+盐【反应物均可溶】{常见的碱:NaOH俗称:烧碱。
火碱。
苛性钠。
物理性质:白色固体,易溶于水,溶解时放热明显,易潮解。
化学性质;有碱的通性。
用途:除油污。
用于肥皂造纸纺织印染。
Ca(OH)2俗称:消石灰。
熟石灰。
物理性质:白色粉末,微溶于水。
化学性质:有碱的通性。
用途:水溶液用于检验二氧化碳,制烧碱。
改良酸性土壤。
砌砖抹墙。
3、盐1.能和酸反应生成新酸和新盐2.能和酸性氧化物生成盐和水3.能和盐反应生成新碱和新盐酸与碱中和的产物(中和反应),由金属离子(包括钱根离子)与酸根离子构成。
酸碱盐的定义及组成

(一)酸、碱、盐的定义及组成:定义组成酸电离时产生的阳离子全部都是氢离子的化合物H++酸根离子碱电离时产生的阴离子全部都是氢氧根离子的化合物金属离子(或NH4+)+OH-盐金属离子(或NH4+)+酸根离子酸、碱、盐的水溶液都能导电:溶于水时离解成能自由移动的阴、阳离子(二)部分酸、碱、盐的化学式:硫酸:H2SO4? 硝酸:HNO3磷酸:H3PO4 氢氯酸:HCl亚硫酸:H2SO3碳酸:H2CO3 醋酸:CH3COOH 氢硫酸:H2S氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2氢氧化铜:Cu(OH)2氢氧化铁:Fe(OH)3硫酸铜:CuSO4碳酸钠:Na2CO3硝酸银:AgNO3磷酸氢钠Na2HPO4亚硫酸钠Na2SO3硫酸氢钠NaHSO4碳酸氢钠:NaHCO3磷酸二氢钙Ca(H2PO4)2(三)物质的俗称和主要成分:生石灰:CaO 石灰石、大理石:CaCO3熟石灰、消石灰、石灰水:Ca(OH)2食盐:NaCl 胆矾、蓝矾:CuSO4·5H2O 烧碱、火碱、苛性钠:NaOH小苏打:NaHCO3氨水:NH3·H2O(NH4OH) 纯碱:Na2CO3 (晶体Na2CO3·10H2O)工业用盐:NaNO2尿素:CO(NH2)2(四)物质的颜色:固体(多为白色) 白色:CuSO4、BaSO4、AgCl、CaCO3?? BaCO3、KClO3、KCl黑色:CuO、C粉、MnO2、Fe3O4、Fe粉末紫黑色:KMnO4(溶液为紫红色) 红色:Cu 红棕色:Fe2O3红褐色:Fe(OH)3蓝色:Cu(OH)2 CuSO4·5H2O 绿色:Cu2(OH)2CO3溶液(多为无色) 浅绿色溶液:FeCl2溶液、FeSO4溶液、Fe(NO3)2溶液(即Fe2+溶液)黄色溶液:FeCl3溶液、Fe2(SO4)3溶液、Fe(NO3)3溶液(即Fe3+的溶液) 蓝色溶液:CuCl2溶液、CuSO4溶液、Cu(NO3)2溶液(Cu2+的溶液)蓝绿色溶液:CuCl2溶液(较浓)(五)离子的检验:离子物质类别试剂现象与结论H+酸液紫色石蕊试液OH-碱液紫色石蕊试液和无色酚酞Cl-盐酸可溶性盐酸盐AgNO3溶液和稀HNO3如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
中考化学酸碱盐总结及化学式
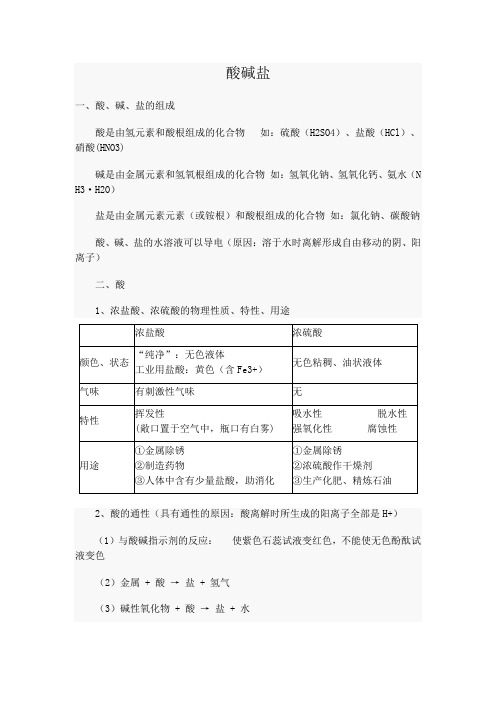
酸碱盐一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(N H3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸→ 盐 + 氢气(3)碱性氧化物 + 酸→ 盐 + 水(4)碱 + 酸→ 盐 + 水(5)盐 + 酸→ 另一种盐 + 另一种酸(产物符合复分解条件)3、三种离子的检验三、碱1、氢氧化钠、氢氧化钙的物理性质、用途2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→ 盐+水(3)酸+碱→ 盐+水(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 =Δ= CuO +H2O2Fe(OH)3 =Δ= Fe2O3+3H2O②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓ F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、酸性氧化物与碱性氧化物四、中和反应溶液酸碱度的表示法--pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法--pH(1)(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨在各省市中考试卷的命题中,无不将酸碱盐的化学性质的考察作为重中之重。
酸碱盐的通性

酸碱盐的通性酸的通性:有腐蚀性,溶液呈酸性,能与活泼金属,碱,某些盐和金属氧化物反应与排在氢之前的活泼金属反应生成盐和氢气,与指示剂反应碱的通性:有腐蚀性,溶液呈碱性,能与某些金属,酸,某些盐和非金属氧化物反应,与指示剂反应盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应还能和其他某些化合物反应酸碱盐溶解性口诀酸+碱=盐+水即:中和反应。
反应条件:无反应类型:中和反应例:H2SO4(酸)+Mg(OH)2(碱)= MgSO4(盐)+ 2H2O(水)酸+盐=新酸+新盐反应条件:有气体或者水或者沉淀生成才能反应反应类型复分解例:2HCL(酸)+Na2CO3(盐)= H2CO3(新酸)+ 2NaCl(新盐)但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了酸+活泼金属=盐+氢气反应条件:金属是活泼金属反应类型:置换例:2HCl(盐酸)+Fe(活泼金属)= FeCl2(盐)+H2↑(氢气)酸+金属氧化物=盐+水反应条件:无反应类型:复分解例:H2SO4(酸)+CuO(金属氧化物)= CuSO4(盐)+H2O(水)酸碱盐的常见反应方程式(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4==== ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 ====FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 ==== MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 ==== Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl ====ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl ====FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl ==== MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl ====2AlCl 3+ 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 ==== FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 ==== ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2==== Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl==== 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4==== Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ====Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ====Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ====FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ====K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ====CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HC l ==== CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸 碱 盐 通 性 总 结+物质分类
一、酸碱盐概念 酸= + ;碱= + ;盐= + 。
二、知识储备: 1.酸根离子:氯离子 ;硝酸根离子 ,硫酸根离子 ,碳酸根离子 。
2.金属离子:(+1)钾离子 ,钠离子 ,银离子 ,铵根离子 ,
(+2)钙离子 ,钡离子 ,镁离子 ,锌离子 ,亚铁离子 ,铜离子 , (+3)铝离子 ,铁离子 。
三、指示剂作用
1.酸性溶液中含有大量 离子,使石蕊溶液变 ,酚酞溶液 ;
2.碱性溶液中含有大量 离子,使石蕊溶液变 ,酚酞溶液 。
四、机器人八个反应公式:
(一)、金属+酸= (置换反应)(氢前金属,铁为+2)
1. 镁和硫酸: ;
2. 镁和盐酸: ;
3.铁和盐酸: ;4. 铁和硫酸: ;
5. 实验室制取氢气: ;
(二)、金属+盐= (置换反应)(前换后,铁为+2)
1. 铁和硫酸铜溶液: ,
2. 铜和硝酸银溶液: ,
3. 铝和硫酸铜溶液: ,
4. 锌和硫酸铜溶液: 。
(三)、酸+金属氧化物= (复分解反应)(用于金属除锈)
1. 氧化铜和硫酸: ,
2. 氧化铜和盐酸: ;
3. 硫酸除铁锈: ,
4. 盐酸除铁锈: ;
(四)碱+非金属氧化物= (盐比氧化物多一个“O ”原子,元素化合价不变)
1. 氢氧化钠在露置在空气中变质的原因: ; 混合物
物质 化合物
纯净物
单质 氧化物 酸 碱 盐 金属单质
非金属单质
2. 氢氧化钠和二氧化硫:;
3. 二氧化碳的检验(用石灰浆刷墙,墙变硬的原因):;
4. 用石灰水吸收硫酸厂排放的二氧化硫:;(五)、酸+碱= (中和反应-复分解反应)
1. 氢氧化钠溶液中加盐酸:;
2. 氢氧化铜和硫酸:,
3. 用氢氧化镁治疗胃酸过多:;
4. 用氢氧化铝治疗胃酸过多:;
5. 氢氧化钠处理硫酸厂废水:,
6. 用熟石灰改良含硫酸的土壤:;
7. 氢氧化钡和硫酸:,
(六)、酸+盐= (复分解反应)
1. 碳酸钠和硫酸:;
2.纯碱和盐酸反应:;
3. 盐酸和硝酸银:;
4. 用小苏打治疗胃酸过多:;
5.二氧化碳的实验室制法:。
6.硫酸和氯化钡:;
(七)、碱+盐= (复分解反应)
1. 氢氧化钠溶液和硫酸铜溶液:;
2. 氢氧化钠溶液和氯化铁溶液:;
3. 氢氧化钠溶液和氯化铜溶液:;
4.石灰水和碳酸钠溶液:;(八)、盐+盐= (复分解反应)
1. 氯化钠溶液和硝酸银溶液:,
2. 硫酸钠溶液和氯化溶液钡:;
3. 氯化钙溶液和碳酸钠溶液:,
4.硫酸铜溶液和氯化钡溶液:。
补充:复分解反应条件:
(1)沉淀:Ca2++CO32--==CaCO3↓Ag++Cl-=AgCl↓ Ba2++SO42--==BaSO4↓ Ba2++CO32--==BaCO3↓
Fe3++3OH--==Fe(OH)3↓ Cu2++2OH--==Cu(OH)2↓ Mg2++2OH--==Mg(OH)2↓ Al3++3OH--==Al(OH)3↓
(2)气体:2H++CO32--==CO2↑+H2O NH4++OH--==NH3↑+H2O
(3)水:H++OH--==H2O
五、氧化物与水反应:
1.生石灰可作干燥剂的原因:;
2.二氧化碳使紫色石蕊试液变红的原因:;振荡溶液又变为紫色的原因。
