第十章 氨基酸
生物制药:第十章 氨基酸药物

第四节 赖氨酸的生产 1、概述 Lys 唯一仅L-型能有效利用,广泛存在于动物Pr中 发酵生产菌种:黄色短杆菌、谷氨酸棒杆菌 作用:治疗脑损伤、抗惊厥 药物:L-Lys盐酸盐颗粒、复方Lys颗粒、盐酸Lys注射液
2、性质
Lys 易吸收CO2 不易制取结晶 e
a Lys口服半致死量LD50为4.0 g/kg 体重
b、分类
(1)Aa在pH5.5溶液中的带电状况:酸性、中性、碱性 脂肪族 芳香族
(2)侧链的化学结构 杂环族 亚氨基酸
(3)侧链基团的极性:极性、非极性
(4)人体需求:必须、非必须
第二节 氨基酸的生产方法
生产方法
直接发酵法 微生物生物转化法
酶法 化学合成法 蛋白质水解提取法
发酵法
1、蛋白水解法
毛发 血粉 废蚕丝
DL-Lys 乙酰化 乙酰-DL-Lys 酰化酶
水解
L-Lys 乙酰-D-Lys
拆分工艺:
N-乙酰-DL-Lys
pH7.0,38 ℃ 酰化酶,24h
水解液 pH5.0,70 ℃ 脱色液
活性炭
过浓
L-Lys D-Lys 6mol/L HCl水解 乙酰-D-Lys
滤缩 有机溶剂
浓缩液
6、水解法生产赖氨酸
原料:血粉/乳酪素
血粉 酸水解
浓缩
除去HCl 滤去不溶性Aa 离子交换
L-Lys
第五节 赖氨酸的提取和精制 赖氨酸的提炼过程包括:发酵液的预处理、
提取和精制三个阶段。
氨基酸:Lys、少量其他Aa 菌体 培养基残留物:残糖、无机离子(NH4+) 色素
发酵液的预处理:
离心分离:4500~6000r/min,成本高
N-乙酰-γ-谷氨酰磷酸
第十章兴奋性氨基酸类递质第一节谷氨酸能神经元的分布及纤

第十章兴奋性氨基酸类递质第一节 谷氨酸能神经元的分布及纤维联系谷氨酸广泛分布于哺乳动物的CNS中,是CNS中含量最高的一种氨基酸,在人类大脑皮层中可达9~11μmol/g。
一. 谷氨酸能神经元的分布谷氨酸在中枢神经系统中的分布不均,以大脑皮层、小脑和纹状体的含量最高,脑干和下丘脑的含量较低。
二. 谷氨酸能神经元的纤维联系㈠大脑皮质的传出性联系㈡与海马有关的神经联系㈢其它嗅球发出的纤维经外侧嗅束止于前梨状皮质。
下橄榄核的纤维,可投射于小脑浦肯野细胞小脑的颗粒细胞发出的纤维,终止于浦肯野细胞的树突。
第二节 谷氨酸的生物合成、降解、释放与再摄取一.谷氨酸的合成和储存谷氨酸是组成蛋白质的20种氨基酸之一,在脑内有其合成的酶系统。
目前已知谷氨酸在脑内的合成主要有两个途径:㈠作为三羧酸循环的一个分支,由于三羧酸循环存在于线粒体中,合成的谷氨酸需要进行运输,因此主要跟代谢作用有关。
㈡谷氨酰胺在谷氨酰胺酶的作用下水解成谷氨酸。
由于谷氨酰胺酶可以由胞体运输到突触末梢,因此可以在突触末梢内合成谷氨酸。
该途径是谷氨酸合成的主要途径。
目前已经证明在中枢神经系统中突触末梢存在储存谷氨酸的囊泡。
而且谷氨酸在囊泡中的富集是由囊泡膜上的谷氨酸转运体(Vesicular glutamate transporters VGLUTs)来完成的。
这是一种低亲和力的谷氨酸转运体,目前已经克隆得到三种VGLUTs。
二.谷氨酸的释放谷氨酸的释放是具有Ca2+离子依赖性的。
但是在胶质细胞中,去极化虽然可以使胶质细胞释放谷氨酸,但并不依赖于Ca2+离子的存在。
三. 谷氨酸的重摄取㈠神经元重摄取和神经胶质细胞重摄取谷氨酸递质被消除的方式主要是通过重摄取。
㈡摄取机制谷氨酸的重摄取依赖于突触前膜上的高亲和力谷氨酸转运体(GluTs)来完成。
该转运体是生电性的,五种GluTs在分子结构特征上具有一些共性。
高亲和力和低亲和力谷氨酸转运体无论在分布还是功能上都有显著的差别,其比较见(表11-1)表11-1低亲和力与高亲和力谷氨酸转运体的比较低亲和力转运体高亲和力转运体分布部位突触囊泡膜突触质膜亲和性(K m) 1.6mmol/l 2-20μmol/lNa+依赖性无依赖依赖Cl-依赖性依赖无依赖专一性 L-GluL,D-Glu,L,D-Asp等生理功能将谷氨酸富集入囊泡以备释放降低胞外谷氨酸浓度(灭活)四. 谷氨酸的代谢谷氨酸-谷氨酰胺循环:第三节谷氨酸受体分类及其调节剂谷氨酸受体分为五型:即NMDA受体、AMPA受体、KA受体、L-AP4受体和代谢性谷氨酸受体。
发酵工程-第十章-氨基酸

4.谷氨酸产生菌(全是细菌)
棒杆菌属
Corynebacterium
短杆菌属
北京棒杆菌 C. pekinense 钝齿棒杆菌 C. crenatum 谷氨酸棒杆菌 C. glutamicum 黄色短杆菌 B. flvum 产氨短杆菌 B. ammoniagenes
Brevibacterium
小杆菌属
应采用的最好方法是(
)
A.加大菌种密度
B.改变碳源和氮源比例 C.改变菌体细胞膜通透性
D.加大葡萄糖释放量
为什么添加适量生物素或青霉素可提高谷氨酸产量?
控制生物素含量,可改变细胞膜的成分,改变膜的透性、谷氨
生物素:乙酰-CoA羧化酶的辅酶,与脂肪酸及磷脂合成有关。
酸的分泌和反馈调节。
生物素含量高时,细胞膜致密,阻碍Glu分泌,并引起反馈 抑制,加适量青霉素可提高Glu产量。
另外,组氨酸的合成为单独的一条途径。
氨基酸的生物合成
1、天冬氨酸族生物合成途径
合成苏氨酸、蛋氨酸和异亮氨酸。
天冬酰氨 甲硫氨酸 琥珀酰高丝氨酸 →异亮氨酸 DAP合成酶 二氨基庚二酸→赖氨酸 合成酶
天冬氨酸族氨基酸合成可以以草酰乙酸或天冬氨酸为原料,
草酰乙酸→天冬氨酸→天冬氨酸磷酸→天冬氨酸-β-半醛→高丝氨酸→苏氨酸
因而用阳离子交换树脂。
理论上讲发酵液上柱的pH值应低于3.22, 但实际上控制在5.0 6.0之间,因Na+、 NH4+交换能力>谷氨酸,优先交换,臵换出
H+使pH值低于3.2,使谷氨酸成为阳离子,
但不能>6.0。
4.电渗析法
膜分离过程,利用的是电位差。
二次电渗析法:
pH3.2:除去各种盐类。 pH3.2:除去蛋白质、残糖和色素等非电解质。
东北师范大学生物化学 第十章氨基酸代谢

必需氨基酸
(氨基酸和糖的转 变是不可逆的)
酮体
生酮兼生糖氨基酸
Tyr(酪),Phe(苯),Ile(异), Trp(色)
生酮氨基酸 Lys Leu 生糖氨基酸:
三 氨基酸合成代谢 非必需氨基酸(10) 必需氨基酸(8):
Phe 、Met 、 Thr、 Val、 Leu、 Lys、Trp、Ile
半必需氨基酸:His Arg
NAD+ + H2O + (NADP+)
+ NH4+ + NADH +H+ (NADPH)
在动物体内辅酶为NAD+,在植物体内辅酶为NADP+
非必需氨基酸由相应的α -酮酸氨基化生成
八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相 应的α-酮酸加氨生成。但和必需氨基酸相对应的α-酮酸不能 在体内合成,所以必需氨基酸依赖于食物供应。
一 蛋白质的酶促降解
(一)外源蛋白质的降解
(二)内源蛋白质的降解
(一)外源蛋白质的降解(细胞外途径)
1 蛋白质的消化
胃蛋白酶:水解芳香族氨基酸的羧基形成的肽键
胰蛋白酶:水解碱性氨基酸羧基形成的肽键
肽链内切酶
胰凝乳蛋白酶:水解芳香族氨基酸的羧基形成 的肽键
弹性蛋白酶:脂肪族氨基酸的羧基形成的肽键 氨肽酶
肝脏是合成尿素的主要器官,肾脏是排出尿素的主要器官
氨基甲酰磷酸合成酶
一种在线粒体中参与尿素的合成
一种在细胞质中参与嘧啶的从头合成
尿素合成的特点: 主要在肝脏的线粒体和胞液中进行 一分子尿素需消耗4个 高能磷酸键 精氨琥珀酸合成酶是尿素合成的关键酶 尿素分子中的两个氮原子,一个来源于NH3, 一个来源于天冬氨酸
氨基酸代谢A

6
二、氨基酸的吸收
主要在小肠进行,是一种主动转运 过程,需由特殊载体携带。转运氨 基酸进入细胞时,同时转运入Na+。
除此之外,也可经γ-谷氨酰循环进 行。需由γ-谷氨酰基转移酶催化, 利用谷胱甘肽(GSH),合成γ-谷 氨酰氨基酸进行转运。消耗的GSH可 重新再合成。
氨基酸的
分解代谢
脱羧基作用 → CO2 + 胺 一般分解代谢→
酮酸
脱氨基作用 → NH3 + α-
9
一、氨基酸的脱氨基作用
氨基酸主要通过三种方式脱氨基,即
氧化脱氨基,联合脱氨基和非氧化脱 氨基。
(一)氧化脱氨基:反应过程包括脱氢 和水解两步。
-2H
+H2O
R-CCOHC(OONHH2)+ CNOHO3H → R-C(=NH)COOH → R-
41
二、一碳单位的代谢
Metabolism of one carbon unit (一)一碳单位的定义和化学结构: 一碳单位(one carbon unit)是指只含一个
碳原子的有机基团,这些基团通常由其载 体携带参加代谢反应。 常见的一碳单位有甲基(-CH3)、亚甲基或 甲烯基(-CH2-)、次甲基或甲炔基(=CH) 、 甲 酰 基 ( -CHO ) 、 亚 氨 甲 基 ( CH=NH)、羟甲基(-CH2OH)等。
Leu 由于酪氨酸在体内需由苯丙氨酸
为原料来合成,半胱氨酸必需以 蛋氨酸为原料来合成,故这两种 氨基酸被称为半必需氨基酸。
4
第二节 蛋白质的消化、吸收
5
一、蛋白质的消化 (一)胃中的消化: 胃蛋白酶水解食物蛋白质为多肽、
第十章蛋白质降解与氨基酸代谢

三、氨的转运
氨对生物机体有毒,特别是高等动物的脑对 氨极敏感,血中1%的氨会引起中枢神经中毒, 因此,脱去的氨必须排出体外。
(一)氨的转运
1、丙氨酸-葡萄糖循环 (Alanine- glucose cycle)
① 肌肉中氨以无毒的丙氨酸形式运输到肝。 ② 肝为肌肉提供葡萄糖。
在肌肉中,糖酵解提供丙酮酸,在肝中,丙酮 酸又可生成Glc。肌肉运动产生大量的氨和丙酮 酸,两者都要运回肝脏进一步转化,而以Ala的 形式运送,一举两得。
二酸、琥珀酰CoA、延胡索酸、草酰乙酸。 最后集中为5种物质进入TCA: 乙酰CoA、α-酮戊二酸、琥珀酰CoA、延胡
索酸、草酰乙酸。
糖 葡萄糖或糖原
甘油三酯
脂肪
氨
磷酸丙糖
基
α-磷酸甘油
脂肪酸
酸
PEP
ቤተ መጻሕፍቲ ባይዱ、 糖
丙氨酸 半胱氨酸
丙酮酸
及 丝氨酸
异亮氨酸 乙酰CoA
乙酰乙酰CoA
酮体
脂 苏氨酸
亮氨酸
肪 色氨酸 代 谢
鸟氨酸转氨甲酰酶存在于线粒体中,需要Mg2+作为 辅因子。
瓜氨酸形成后就离开线粒体,进入细胞液。
此时Asp的氨基转移到Arg上。
来自Asp的碳架被保留下来,生成延胡索酸。延胡 索酸可以经苹果酸、草酰乙酸再生为天冬氨酸。
尿素形成后由血液运到肾脏随尿排出。
尿素循环小结
总反应式:NH4+ + 2ADP + AMP + 2Pi
排尿素动物在肝脏中合成尿素的过程称 尿素循环。
CO2 + NH3 + H2O
鸟
2ATP
N-乙酰谷氨酸
第十章 氨基酸发酵生产工艺学

2.饲料工业: 甲硫氨酸等必需氨基酸可用于制造动物饲料 3.医药工业: 多种复合氨基酸制剂可通过输液治疗营养或代 谢失调 苯丙氨酸与氮芥子气合成的苯丙氨酸氮芥子气 对骨髓肿瘤治疗有效,且副作用低. 4.化学工业:谷氨基钠作洗涤剂,丙氨酸制造丙 氨酸纤维.
氨基酸的生产方法
发酵法: 直接发酵法:野生菌株发酵,营养 缺陷型突变发酵,抗氨基酸结构类似物 突变株发酵,抗氨基酸结构类似物突变 株的营养缺陷型菌株发酵和营养缺陷型 回复突变株发酵. 添加前体法
酶法:利用微生物细胞或微生物产生的酶来制 造氨基酸. 提取法:蛋白质水解,从水解液中提取.胱氨 酸,半胱氨酸和酪氨酸 合成法:DL-蛋氨酸,丙氨酸,甘氨酸,苯丙 氨酸. 传统的提取法,酶法和化学合成法由于前体物 的成本高,工艺复杂,难以达到工业化生产的目 的.
生产氨基酸的大国为日本和德国. 日本的味之素,协和发酵及德国的德固 沙是世界氨基酸生产的三巨头.它们能 生产高品质的氨基酸,可直接用于输液制 , 剂的生产. 日本在美国,法国等建立了合资的氨基 酸生产厂家,生产氨基酸和天冬甜精等衍 生物.
3.1.2 载体的构建
有效的载体需要有在受体菌中可启动的 复制起始位点,这可从棒状杆菌家族内 源小质粒中获得; 载体所需的筛选标记及外源基因插入的 多克隆位点,可从常用的克隆载体中获 得.
3.1.3 基因转移手段
由于棒状杆菌是革兰氏阳性菌,CaCl2转化法对它 不适用. 通常采用的方法有:原生质体转化,转导,电转化, 接合转移. 原生质体转化的方法是较早采用的方法,由于受 到原生质体再生条件的局限,效率不高; 电转化方法由于高效,快速被广泛使用,目前它 的转化效率可达到原生质体转化法的100~1000倍. 接合转移可用于基因在亲缘关系远的物种之间的 转移,并且可将外源基因整合于染色体上,易于 稳定遗传.
第十章 蛋白质的酶促降解及氨基酸代谢

第十章蛋白质的酶促降解及氨基酸代谢一、名词解释1、氨基酸代谢库2、必需氨基酸、非必需氨基酸、半必需氨基酸3、氧化脱氨基作用4、转氨基作用5、联合脱氨基作用6、嘌呤核苷酸循环7、鸟氨酸循环8、生糖氨基酸、生酮氨基酸、生糖兼生酮氨基酸9、泛素10、S-腺苷甲硫氨酸11、一碳单位二、填空1、氨基酸代谢库中的内源氨基酸是由和组成。
2、多肽链经胰蛋白酶降解后,产生新肽段羧基端主要是和氨基酸残基。
3、胰凝乳蛋白酶专一性水解多肽链由氨基酸端形成的肽键。
4、氨基酸的最主要脱氨基方式是。
5、转氨酶和脱羧酶的辅酶通常是。
6、谷氨酸经脱氨后产生和氨,前者进入进一步代谢。
7、尿素循环中产生的和两种氨基酸不是蛋白质氨基酸。
8、尿素分子中两个N原子,分别来自和。
9、在人体中氨在中通过循环生成经排泄。
10、体内最重要的转氨酶有和。
11、肝细胞线粒体中的氨基甲酰磷酸合成酶Ⅰ的催化作用需要______﹑_____,______参与。
12、精氨酸在的催化下,生成尿素和。
13、氨基酸脱下氨的主要去路有、和。
14、不同氨基酸与之间通过作用生成谷氨酸,这是氨基酸分解代谢反应,催化这一反应的酶叫酶,其辅酶是。
15、嘌呤核苷酸循环将氨基酸的和结合,生成,随后裂解为和延胡索酸。
16、人体内合成尿素的直接前体是,它水解后生成尿素和,后者又与反应,生成,这一产物再与反应,最终合成尿素,这就是尿素循环,尿素循环的后半部是在中进行的。
17、嘌呤核苷酸循环最终将氨释放出的化合物称,催化此反应的酶是。
18、氨甲酰磷酸合成酶Ⅰ定位于细胞内的,它催化和合成氨甲酰磷酸。
19、人体内不能合成而需要从食物供应的氨基酸称为。
20、是除氨的主要器官,它可通过将NH3和CO2合成无毒的,而禽类则合成的是。
21、合成一分子尿素需消耗分子的高能键。
22、生酮氨基酸经代谢后可产生,它是合成酮体的原料。
23、提供一碳单位的氨基酸有、、和等。
常见的一碳单位有、、、、和等。
24、生物体中活性蛋氨酸是,它是活泼的供应者。
氨基酸代谢习题

氨基酸代谢习题第十章氨基酸代谢习题一、是非题1.在一般的情况下,氨基酸不用来作为能源物质。
2.组氨酸脱羧产生的组胺可使血管舒张、血压降低。
3.酪氨酸脱羧产生的酪胺可使血管收缩、血压升高。
4.芳香族氨基酸生物合成的前体是酵解和柠檬酸循环途径的中间物。
5.酪氨酸可以由苯丙氨酸直接生成,所以不是必需氨基酸。
6.苯丙氨酸的分解主要是通过酪氨酸分解途径来完成。
7.植物可以直接吸收空气中的氮。
8.氨基酸通过氧化脱去α-氨基的过程中都生成FADH2。
9.必需氨基酸是指在生活细胞中不能合成,需要人工合成的氨基酸。
10.“代谢库”是指细胞、组织或生物个体内储存某种物质的总量。
11.所有氨基酸的转氨反应,都需要磷酸吡哆醛作辅酶。
12.尿素在肾脏细胞内合成,由肾小管排出。
13.肌酸是指肌肉中的有机酸,是糖类分解代谢的中间物。
14.血红素、细胞色素和叶绿素分子中的卟琳环是由甘氨酸和琥珀酰CoA合成的。
15.去甲肾上腺素和肾上腺素都是酪氨酸的衍生物。
二、填空题1.Ala、Ap和Glu都是生糖氨基酸,它们脱去氨基分别生成、和2.Trp脱羧后生成,其生理作用是;在脑组织中,在外周组织中3.分解生成丙酮酸的氨基酸有、、、和五种。
4.分解生成乙酰乙酰辅酶A的氨基酸有、、、和五种。
6.分解生成琥珀酰辅酶A的氨基酸有、和三种。
7.通过生成草酸乙酸进行分解的氨基酸有和两种。
8.多巴(二羟苯丙氨酸)和多巴醌(苯丙氨酸3,4醌)是酪氨酸在酶的作用下转变为的中间产物。
9.参与肌酸合成的三种氨基酸是、和10.谷氨酸脱去羧基后生成,它的生理作用是11.亮氨酸、和是三种分枝氨基酸,它们分解的过程是先生成相应的酮酸,然后由酶催化脱氢,生成相应的酰基CoA。
12.腐胺是、脱羧后的产物,由腐胺衍生的精胺和亚精胺合称多胺,这是因为。
13.人体尿素的合成在脏中进行。
14.三种芳香族氨基酸有一段共同的合成途径,起始物是和,经过若干步骤生成莽草酸,然后在转变为15.脯氨酸的合成是由通过几步反应后,而成。
食品检验与分析第十章蛋白质和氨基酸的测定

食品检验与分析第十章蛋白质和氨基酸的测定蛋白质是生命体内非常重要的一类生物大分子,它在细胞结构和机能维持、代谢调控以及免疫防御等方面起着重要作用。
因此,对蛋白质的准确测定和定量分析具有极其重要的意义。
本章主要介绍蛋白质和氨基酸的测定方法。
蛋白质的测定方法主要分为定性测定和定量测定两大类。
定性测定方法包括生物试验法、电泳法、免疫学方法和核磁共振法等。
定量测定方法包括比色法、碱液法、生物试验法、紫外分光光度法和蛋白质序列测定法等。
比色法是常用的蛋白质定量方法之一,它利用蛋白质与试剂形成复合物,复合物在特定波长下具有特异性吸光度。
根据吸光度与蛋白质浓度的线性关系,就可以测定蛋白质的含量。
常用的比色法有布拉德福法、Lowry法和BCA法等。
布拉德福法是最常用的蛋白质定量方法之一、该法利用菜酶素染色反应,使蛋白质呈现紫色,然后通过比色法测定溶液的吸光度,从而测定蛋白质的含量。
布拉德福法的优点是灵敏度高,适用于各种类型的蛋白质测定。
Lowry法是另一种常用的蛋白质定量方法,该法利用碱液将蛋白质氢氧化,生成肽链片段,然后与Folin-Phenol试剂发生酸碱反应,生成蓝色产物,通过比色法测定吸光度,从而得到蛋白质的含量。
BCA法是一种基于比色法的蛋白质定量方法,该法利用铜离子和双酚试剂反应生成复合物,复合物在特定波长下具有最大吸光度,通过测定吸光度可以得到蛋白质的含量。
BCA法的优点是灵敏度高,适用于各种类型的蛋白质测定。
氨基酸是构成蛋白质的基本单位,对氨基酸的快速准确测定具有重要意义。
氨基酸的测定方法主要分为色谱法和比色法两大类。
色谱法是氨基酸测定的常用方法之一,主要包括气相色谱法和高效液相色谱法。
气相色谱法将氨基酸转化为甲醯基衍生物,然后通过气相色谱进行分离和定量。
高效液相色谱法使用分离柱进行分离,可以达到更高的分离效率和灵敏度。
比色法是氨基酸测定的另一种常用方法,主要有二色法和氨基酸定量方法。
二色法利用氨基酸与染料之间的化学反应产生色素,通过比色法测定吸光度,从而确定氨基酸的含量。
第十章 氨基酸、多肽和蛋白质类药品检验
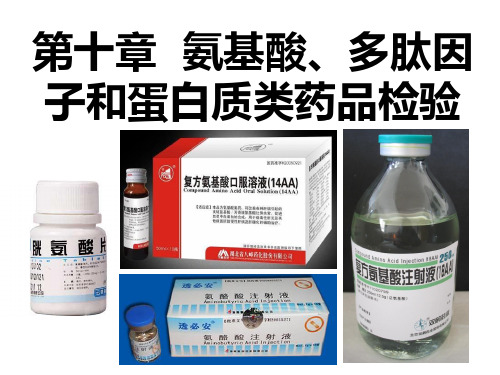
第一节
氨基酸类药品检验
• 这三种氨基酸可以通过紫外 吸收光谱加以鉴别。 • 精密称取酪氨酸、色氨酸、 苯丙氢酸各适量。 • 用水制成每1mL含20μg(色 氨酸)、40μg(酪氨酸) 、200μg(苯丙氨酸)。 • 在波长230~300nm测定各氨 基酸的吸收光谱,如右图。
1:酪氨酸 2:色氨酸 3:苯丙氨酸。
OH
NH2 HC + NH (H2C)3 CHNH2 HOOC
O
+ NH3
2NH3 + 3NaBrO
N2 + 3H2O + 3NaBr
第一节
加热
氨基酸类药品检验
.S 20mgL 色氨酸样品10 mL水 2mL二甲氨基苯甲醛 T . (5)
蓝紫色溶液
第一节
氨基酸类药品检验
• 氨基酸为白色晶状体,熔点很高,多在熔融时分解, 都能溶解在强酸强碱中,形成的盐多能溶于水。 • 氨基酸在等电点(pI)时溶解度最小,最稳定。 • 中性pI值在5~6.3左右。 • 酸性pI值在2.8~3.2左右。 • 碱性氨基酸的pI值在7.6~10.8左右。
第一节
氨基酸类药品检验
第一节
氨基酸类药品检验
3、薄层色谱鉴别法 • 在薄层板上点样,通过与标准氨基酸对照而鉴别氨基 酸。 (1)薄层板的制备
2 5g微晶纤维素样品20mL无水乙醇,. 拌成糊状 5mL水
待用
均匀涂板
溶剂挥发完毕后
重氮试剂 H2 H C C C COOH NH2 HO3S N N C HN CH N N SO3H H2 H C C C COOH NH NH2
HC
NH2 NH2
第一节
第十章蛋白质和氨基酸测定

三、蛋白质含量测定常用的方法
1. 凯氏定氮法 由Kieldhl于1833年提出,现发展为常量、微量、自动
物,目前各种氨基酸已达175种以上,
但是构成pro的氨基酸主要有20种。
缬氨酸
丝氨酸
第十章蛋白
Pro的基本组成单位是氨基酸 几种常见的氨基酸
那什么是 氨基酸呢?
第十章蛋白
几种常见的氨基酸
这些氨基酸 结构上有什 么共同点?
羧基和氨基 连接在同一 个碳原子上
蛋白质的基石物质:α-氨基酸
第十章蛋白
氨基酸的缩合
食品中蛋白质的含量
乳制品
牛乳(全脂,液体)
3.3
牛乳(脱脂、干)
36.2
切达干酪
24.9
酸奶(普通的、低脂) 5.3
水果和蔬菜
苹果(生、带皮)
0.2
芦笋(生)
2.3
草莓(生)
0.6
莴苣(冰、生)
1.0
土豆(整粒、肉和皮) 2.1
肉、家禽、鱼
牛肉(颈肉、烤前腿)
18.5
牛肉(腌制、干牛肉)
29.1
鸡(可供煎炸的鸡胸肉)
二、蛋白质系数
不同的蛋白质其氨基酸构成比例及方式不同,故各种 不同的蛋白质其含氮量也不同,一般蛋白质含氮量为16%
,即一份氮素相当于6.25份蛋白质,此数值(6.25)称为
蛋白质系数。 不同种类食品的蛋白质系数有所不同,如玉米、荞麦
、青豆、鸡蛋等为6.25,花生为5.46,大米为5.95,大豆及 其制品为5.71,小麦粉为5.70,牛乳及其制品为6.38。
2.重点 3.
1、蛋白质的测定原理、测定方法、注意事项。 2、氨基酸的测定原理、测定方法、注意事项。 3、乳与乳制品中非蛋白氮含量的测定原理
氨基酸的生物习题答案

第十章氨基酸的生物习题答案1. 解释下列名词:(1)固氮生物——能够在常温常压下将氮气转变为氨的生物,主要指微生物。
(2)生物固氮——微生物、藻类和与高等植物共生的微生物通过自身的固氮酶复合物把分子氮变成氨的过程。
(3)硝酸还原作用——硝酸态氮在硝酸还原酶和亚硝酸还原酶催化下还原为氨的过程。
(4)硫酸还原——硫酸盐在A TP硫酸化酶作用下与A TP反应生成APS,后者在激酶作用下生成PAPS。
APS或PAPS可将其中S还原为Cys或Met,这是含硫氨基酸的硫的来源。
(5)SAM——S-腺苷甲硫氨酸,是重要的活化甲基供体。
(6)PAPS——磷酸腺苷酰硫酸(7)THFA或FH4——四氢叶酸2. 填空题:(1)铁蛋白钼铁蛋白铁蛋白钼铁蛋白(2)A TP CO A TP CO (3)NO2-铁氧还蛋白NAD(P)H (4)NH4+铁氧还蛋白NAD(P)H (5)谷氨酰胺合成酶谷氨酸合成酶α-酮戊二酸(6)谷氨酸天冬氨酸丙氨酸(7)鸟氨酸瓜氨酸(8)丙酮酸草酰乙酸α-酮戊二酸(9)PRPP(10)硫酸盐活化活化硫酸盐还原A TP 载体蛋白X-SH Cys3. 单项选择:(1)a(2)c(3)b(4)a(5)a(6)c(7)c(8)c4. 问答题:(1)合成氨基酸的氮可通过生物固氮、大气固氮、工业固氮转变为氨或硝酸盐,进入土壤,被植物吸收后用于氨基酸的合成。
合成氨基酸的碳架直接或间接来自糖代谢、光合碳循环等过程中产生的酮酸及其他有机酸,如α-酮戊二酸、草酰乙酸、丙酮酸等。
(2)微生物、藻类和与高等植物共生的微生物通过自身的固氮酶复合物把分子氮变成氨,从而被植物利用的过程,为生物固氮。
固氮酶是由含铁的铁蛋白和含钼的铁蛋白两种铁硫蛋白组成,二者形成复合体才具有固氮活性。
固氮酶催化的主要底物是N2,要求铁氧还蛋白(Fd)等作为还原剂,要求A TP与Mg复合物以及厌氧环境。
其催化反应是:N2 + 6H+ + 6e ——→2NH3(3)硝酸盐是由硝酸还原酶和亚硝酸还原酶还原成NH3(或NH4+)的其反应为:2e6eNO3-——————→NO2-——————→NH4+硝酸还原酶亚硝酸还原酶(4)氨基酸可以通过直接氨基化,转氨作用和氨基酸互变合成:A TP ADP + Pi直接氨基化:α-酮戊二酸+ NH3——————————→Glu + H2ONADH NAD+转氨作用:丙酮酸+ Glu ——————→-酮戊二酸+ AlaPro→Hyp Lys氨基酸互变:Gln ←Glu Asn ←Asp →MetArg Thr→Ile(5)芳香族氨基酸包括苯丙氨酸、酪氨酸和色氨酸,只能由植物和微生物合成。
第十章 氨基酸

肝昏迷(血氨升高,使α-酮戊二酸下降,TCA受阻)可加Asp或Arg缓解。
3、 生成尿酸(见核苷酸代谢)
尿酸(包括尿素)也是嘌呤代谢的终产物。
四、 氨基酸碳架的去向
20种aa有三种去路
(1)氨基化还原成氨基酸。
因此当ATP、GTP不足时,Glu的氧化脱氨会加速进行,有利于a.a分解供能(动物体内有10%的能量来自a.a氧化)。
(二) 非氧化脱氨基作用(大多数在微生物的中进行)
P 221
①还原脱氨基(严格无氧条件下)
图
②水解脱氨基
图
P226 图16-4通过嘌呤核苷酸循环的联合脱氨基做用
骨骼肌、心肌、肝脏、脑都是以嘌呤核苷酸循环的方式为主
二、 脱羧作用
生物体内大部分a.a可进行脱羧作用,生成相应的一级胺。
a.a脱羧酶专一性很强,每一种a.a都有一种脱羧酶,辅酶都是磷酸吡哆醛。
a.a脱羧反应广泛存在于动、植物和微生物中,有些产物具有重要生理功能,如脑组织中L-Glu脱羧生成r-氨基丁酸,是重要的神经介质。His脱羧生成组胺(又称组织胺),有降低血压的作用。Tyr脱羧生成酪胺,有升高血压的作用。
一、 脱氨基作用
主要在肝脏中进行
(一) 氧化脱氨基
第一步,脱氢,生成亚胺。第二步,水解。
P219 反应式:
生成的H2O2有毒,在过氧化氢酶催化下,生成H2O+O2↑,解除对细胞的毒害。
1、 催化氧化脱氨基反应的酶(氨基酸氧化酶)
(1)、 L—氨基酸氧化酶
(2)氧化成CO2和水(TCA)。
转氨作用机制 P224 图16-2
生物化学[第十章氨基酸代谢]课程复习
![生物化学[第十章氨基酸代谢]课程复习](https://img.taocdn.com/s3/m/6332a01d55270722192ef747.png)
第十章氨基酸代谢氨基酸代谢包括氨基酸的分解代谢和合成代谢。
氨基酸分解代谢总是先脱去氨基。
L-谷氨酸脱氢酶催化的氧化脱氨基作用普遍存在于动植物中。
转氨基作用是氨基酸脱去氨基的一种重要方式。
转氨酶以磷酸吡哆醛为辅酶。
氨基酸的氧化脱氨基作用和嘌呤核苷酸循环与转氨基作用相偶联,称为联合脱氨基作用,它是生物体内脱去氨基的主要方式。
氨的运输方式是谷氨酰胺。
在哺乳动物中,氨以尿素的形式排出体外。
谷氨酰胺在肝脏中脱下的氨与二氧化碳、ATP合成氨甲酰磷酸,然后与鸟氨酸作用生成瓜氨酸。
瓜氨酸在天冬氨酸参与下形成精氨酸,精氨酸水解形成鸟氨酸和尿素。
尿素随尿排出体外。
氨基酸碳骨架氧化分解时,可通过形成5种产物进入三羧酸循环,最后氧化为二氧化碳和水。
这5种物质是:乙酰-CoA、α-酮戊二酸、琥珀酰-CoA、延胡索酸和草酰乙酸。
大多数氨基酸都是生糖氨基酸,两种是生酮氨基酸,少数是生酮生糖氨基酸。
不同生物合成氨基酸的能力和种类都有所不同。
机体维持正常生长所必需,又不能自身合成,需从外界摄入的氨基酸称必需氨基酸。
人和大白鼠需10种必需氨基酸。
氨基酸生物合成中,氮的来源起始于无机氮的生物固氮和氨的同化作用。
碳骨架来源于柠檬酸循环、糖酵解及磷酸戊糖途径这几条主要的代谢途径。
按碳来源的不同,氨基酸的生物合成可归为五族:丙酮酸族、谷氨酸:唉、天冬氨酸族、丝氨酸族、芳香氨基酸及组氨酸族。
氨基酸的生物合成根据需要有严格的调控机制。
其中最有效的是终产物对反应系列第一个酶活性的抑制作用。
氨基酸是一碳单位的直接提供者,同时也是多种生物活性物质的前体。
第十章 氨基酸代谢

P217
此反应发生在线粒体中; 鸟氨酸转氨甲酰酶(ornithine transcarbamoylase)催 化该反应;
鸟氨酸产生于细胞溶胶,所以它必须通过一个特异的运 送体系进入线粒体;
尿素循环的以后几步都在细胞溶胶中进行,瓜氨酸必须 从线粒体中脱出。
(3)尿素第二个氮原子的获取
不同生物其合成蛋白质的能力不同,所摄取的氮源也不
同,但要合成蛋白质,必须先合成氨基酸;
蛋白质代谢的概念(阅读)2-2
蛋白质的代谢主要是讨论生物机体内氨基酸和蛋白质的
合成、分解和转变的化学过程,以及这些过程与生物机
体的生殖、发育和一切生理之间的关系;
微生物、植物与动物的蛋白质代谢途径有其相同的一面,
(1)尿素第一个氮原子的获取
P216
反应发生于细胞溶胶; NH4+在ATP、Mg2+存在下与HCO3-缩合: 形成氨甲酰磷酸;
氨甲酰磷酸合成酶(carbamoylphosphate synthetase, CPS) (该酶不属于尿素循环的一员)催化该反应;
反应伴随有两个ATP的水解。
(2)氨甲酰磷酸的氨甲酰基转移到鸟氨酸上形成瓜氨酸
在柠檬酸循环中形成的草酰乙酸(经转氨基反应形成天 冬氨酸)将两循环连接在一起;
鸟氨酸循环把两个氨基和一个碳原子(CO2)转化为非 毒性的排泄物尿素;
每生成1mol尿素消耗3molATP;
尿素是哺乳动物的蛋白质代谢的最终产物;
尿素循环中的能量变化
循环中使用了4个“高能”磷酸键(3个ATP水解为两个
合成的尿素进入血液,再被肾脏汇集,从尿中排除;
第十章 氨基酸及核苷酸的代谢

具有很强的专一性, 有特异的识别位点,通常具有 二重旋转对称性的回文序列
常用的DNA限制性内切酶的专一性
酶
辨认的序列和切口
说明
Alu I Bam H I Bgl I
‥ ‥A G C T ‥‥ ‥ ‥T C G A ‥ ‥
‥ ‥G G A T C C ‥‥ ‥ ‥C C T A G G ‥‥
‥ ‥A G A T C T ‥‥ ‥ ‥T C T A G A ‥‥
四核苷酸,平端切口 六核苷酸,粘端切口 六核苷酸,粘端切口
Eco R I Hind Ⅲ
‥ ‥G A A T T C ‥‥ ‥ ‥C T T A A G ‥‥
5
精氨酸
延胡索酸
4
精氨琥珀酸
谷氨酸
谷氨酸
2ATP+CO2+NH3+H2O
鸟氨酸 1 2ADP+Pi
氨甲酰磷酸 线
2
粒
体
瓜氨酸
AMP+PPi
3
ATP
瓜氨酸
基质
天冬氨酸
-酮戊二酸
草酰乙酸
谷氨酸
氨基酸
(二)α-酮酸的代谢转变
氨基酸碳骨架
葡萄糖
磷酸烯醇 式丙酮酸
丙氨酸 苏氨酸 甘氨酸 丝氨酸 半胱氨酸
丙酮酸
一、 核酸的酶促降解
核酸酶
核苷酸酶 核苷酸磷酸化酶
核酸
核苷酸
核苷 磷酸
碱基+戊糖
一、核 酸 酶
1、核酸酶的分类
(1)根据对底物的 专一性分为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章氨基酸代谢植物、微生物从环境中吸收氨、铵盐、亚硝酸盐、硝酸盐等无机氮,合成各种氨基酸、蛋白质、含氮化合物。
人和动物消化吸收动、植物蛋白质,得到氨基酸,合成蛋白质及含氮物质。
有些微生物能把空气中的N2转变成氨态氮,合成氨基酸。
第一节蛋白质消化、降解及氮平衡一、蛋白质消化吸收哺乳动物的胃、小肠中含有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、弹性蛋白酶。
经上述酶的作用,蛋白质水解成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用在小肠的近端较强,因此肽的吸收先于游离氨基酸。
二、蛋白质的降解人及动物体内蛋白质处于不断降解和合成的动态平衡。
成人每天有总体蛋白的1%~2%被降解、更新。
不同蛋白的半寿期差异很大,人血浆蛋白质的t1/2约10天,肝脏的t1/2约1~8天,结缔组织蛋白的t1/2约180天,许多关键性的调节酶的t1/2均很短。
真核细胞中蛋白质的降解有两条途径:一条是不依赖A TP的途径,在溶酶体中进行,主要降解外源蛋白、膜蛋白及长寿命的细胞内蛋白。
另一条是依赖A TP和泛素的途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白,此途径在不含溶酶体的红细胞中尤为重要。
泛素是一种8.5KD(76a.a.残基)的小分子蛋白质,普遍存在于真核细胞内。
一级结构高度保守,酵母与人只相差3个a.a残基,它能与被降解的蛋白质共价结合,使后者活化,然后被蛋白酶降解。
三、氨基酸代谢库食物蛋白中,经消化而被吸收的氨基酸(外源性a.a)与体内组织蛋白降解产生的氨基酸(内源性a.a)混在一起,分布于体内各处,参与代谢,称为氨基酸代谢库。
氨基酸代谢库以游离a.a总量计算。
肌肉中a.a占代谢库的50%以上。
肝脏中a.a占代谢库的10%。
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体内各组织之间a.a转运的主要形式。
氨基酸代谢库图四、氮平衡食物中的含氮物质,绝大部分是蛋白质,非蛋白质的含氮物质含量很少,可以忽略不计。
氮平衡:机体摄入的氮量和排出量,在正常情况下处于平衡状态。
即,摄入氮=排出氮。
氮正平衡:摄入氮>排出氮,部分摄入的氮用于合成体内蛋白质,儿童、孕妇。
氮负平衡:摄入氮<排出氮。
饥锇、疾病。
第二节氨基酸分解代谢氨基酸的分解代谢主要在肝脏中进行。
氨基酸的分解代谢一般是先脱去氨基,形成的碳骨架可以被氧化成CO2和H2O,产生A TP ,也可以为糖、脂肪酸的合成提供碳架。
一、脱氨基作用主要在肝脏中进行(一)氧化脱氨基第一步,脱氢,生成亚胺。
第二步,水解。
P219 反应式:生成的H2O2有毒,在过氧化氢酶催化下,生成H2O+O2↑,解除对细胞的毒害。
1、催化氧化脱氨基反应的酶(氨基酸氧化酶)(1)、L—氨基酸氧化酶有两类辅酶,E—FMNE—FAD(人和动物)对下列a.a不起作用:Gly、β-羟氨酸(Ser、Thr)、二羧a.a(Glu、Asp)、二氨a.a (Lys、Arg)真核生物中,真正起作用的不是L-a.a氧化酶,而是谷氨酸脱氢酶。
(2)、D-氨基酸氧化酶 E-FAD有些细菌、霉菌和动物肝、肾细胞中有此酶,可催化D-a.a脱氨。
(3)、Gly氧化酶 E-FAD使Gly脱氨生成乙醛酸。
(4)、D-Asp氧化酶 E-FADE-FAD 兔肾中有D-Asp氧化酶,D-Asp脱氨,生成草酰乙酸。
(5)、L-Glu脱氢酶 E-NAD+ E-NADP+P220 反应式:真核细胞的Glu脱氢酶,大部分存在于线粒体基质中,是一种不需O2的脱氢酶。
此酶是能使a.a直接脱去氨基的活力最强的酶,是一个结构很复杂的别构酶。
在动、植、微生物体内都有。
A TP、GTP、NADH可抑制此酶活性。
ADP、GDP及某些a.a可激活此酶活性。
因此当A TP、GTP不足时,Glu的氧化脱氨会加速进行,有利于a.a分解供能(动物体内有10%的能量来自a.a氧化)。
(二)非氧化脱氨基作用(大多数在微生物的中进行)P 221①还原脱氨基(严格无氧条件下)图②水解脱氨基图③脱水脱氨基图④脱巯基脱氨基⑤氧化-还原脱氨基两个氨基酸互相发生氧化还原反应,生成有机酸、酮酸、氨。
⑥脱酰胺基作用谷胺酰胺酶:谷胺酰胺+ H2O →谷氨酸+ NH3天冬酰胺酶:天冬酰胺+ H2O →天冬氨酸+ NH3谷胺酰胺酶、天冬酰胺酶广泛存在于动植物和微生物中(三)转氨基作用转氨作用是a.a脱氨的重要方式,除Gly、Lys、Thr、Pro外,a.a都能参与转氨基作用。
转氨基作用由转氨酶催化,辅酶是维生素B6(磷酸吡哆醛、磷酸吡哆胺)。
转氨酶在真核细胞的胞质、线粒体中都存在。
转氨基作用:是α-氨基酸和α-酮酸之间氨基转移作用,结果是原来的a.a生成相应的酮酸,而原来的酮酸生成相应的氨基酸。
P223 结构式:不同的转氨酶催化不同的转氨反应。
大多数转氨酶,优先利用α-酮戊二酸作为氨基的受体,生成Glu。
如丙氨酸转氨酶,可生成Glu,叫谷丙转氨酶(GPT)。
肝细胞受损后,血中此酶含量大增,活性高。
肝细胞正常,血中此酶含量很低。
动物组织中,Asp转氨酶的活性最大。
在大多数细胞中含量高,Asp是合成尿素时氮的供体,通过转氨作用解决氨的去向。
转氨作用机制P224 图16-2此图只画出转氨反应的一半。
(四)联合脱氨基单靠转氨基作用不能最终脱掉氨基,单靠氧化脱氨基作用也不能满足机体脱氨基的需要,因为只有Glu 脱氢酶活力最高,其余L-氨基酸氧化酶的活力都低。
机体借助联合脱氨基作用可以迅速脱去氨基。
1、以谷氨酸脱氢酶为中心的联合脱氨基作用氨基酸的α-氨基先转到α-酮戊二酸上,生成相应的α-酮酸和Glu,然后在L-Glu脱氨酶催化下,脱氨基生成α-酮戊二酸,并释放出氨。
P225 图16-3 以谷氨酸脱氢酶为中心的联合脱氨基作用2、通过嘌呤核苷酸循环的联合脱氨基做用P 225结构式:次黄嘌呤核苷一磷酸(IMP)、腺苷酸代琥珀酸、腺苷酸P226 图16-4通过嘌呤核苷酸循环的联合脱氨基做用骨骼肌、心肌、肝脏、脑都是以嘌呤核苷酸循环的方式为主二、脱羧作用生物体内大部分a.a可进行脱羧作用,生成相应的一级胺。
a.a脱羧酶专一性很强,每一种a.a都有一种脱羧酶,辅酶都是磷酸吡哆醛。
a.a脱羧反应广泛存在于动、植物和微生物中,有些产物具有重要生理功能,如脑组织中L-Glu脱羧生成r-氨基丁酸,是重要的神经介质。
His脱羧生成组胺(又称组织胺),有降低血压的作用。
Tyr脱羧生成酪胺,有升高血压的作用。
但大多数胺类对动物有毒,体内有胺氧化酶,能将胺氧化为醛和氨。
三、氨的去向氨对生物机体有毒,特别是高等动物的脑对氨极敏感,血中1%的氨会引起中枢神经中毒,因此,脱去的氨必须排出体外。
氨中毒的机理:脑细胞的线粒体可将氨与α-酮戊二酸作用生成Glu,大量消耗α-酮戊二酸,影响TCA,同时大量消耗NADPH,产生肝昏迷。
氨的去向:(1)重新利用合成a.a、核酸。
(2)贮存Gln,Asn高等植物将氨基氮以Gln,Asn的形式储存在体内。
(3)排出体外排氨动物:水生、海洋动物,以氨的形式排出。
排尿酸动物:鸟类、爬虫类,以尿酸形式排出。
排尿动物:以尿素形式排出。
(一)氨的转运(肝外→肝脏)1、Gln转运Gln合成酶、Gln酶(在肝中分解Gln)Gln合成酶,催化Glu与氨结合,生成Gln。
Gln中性无毒,易透过细胞膜,是氨的主要运输形式。
Gln经血液进入肝中,经Gln酶分解,生成Glu和NH3。
2、 丙氨酸转运(Glc-Ala 循环)肌肉可利用Ala 将氨运至肝脏,这一过程称Glc-Ala 循环。
丙氨酸在PH7时接近中性,不带电荷,经血液运到肝脏在肌肉中,糖酵解提供丙酮酸,在肝中,丙酮酸又可生成Glc 。
肌肉运动产生大量的氨和丙酮酸,两者都要运回肝脏,而以Ala 的形式运送,一举两得。
(二)氨的排泄1、 直接排氨排氨动物将氨以Gln 形式运至排泄部位,经Gln酶分解,直接释放NH 3。
游离的NH3借助扩散作用直接排除体外。
2、尿素的生成(尿素循环)排尿素动物在肝脏中合成尿素的过程称尿素循环1932年,Krebs 发现,向悬浮有肝切片的缓冲液中,加入鸟氨酸、瓜氨酸、Arg 中的任一种,都可促使尿素的合成。
尿素循环途径(鸟氨酸循环):P230图16-6(1)、 氨甲酰磷酸的生成(氨甲酰磷酸合酶I )肝细胞液中的a.a 经转氨作用,与α-酮戊二酸生成Glu ,Glu 进入线粒体基质,经Glu 脱氢酶作用脱下氨基,游离的氨(NH 4+)与TCA 循环产生的CO 2反应生成氨甲酰磷酸。
