物化实验报告燃烧热的测定苯甲酸萘
物化实验报告:燃烧热的测定_苯甲酸_萘

华南师范大学实验报告课程名称 物理化学实验 实验项目 燃烧热的测定【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
②掌握量热技术的基本原理,学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(O v ),恒容燃烧热这个过程的内能变化(ΔU )。
在恒压条件下测得的燃烧热称为恒压燃烧热(Q p ),恒压燃烧热等于这个过程的热焓变化(ΔH )。
若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:∆c H m = Q p =Q v +Δn RT (1)本实验采用氧弹式量热计测量蔗糖的燃烧热。
测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为:nT T C Q m V )(12,--= (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。
燃烧热的测定

答:在本实验装置中,氧弹的内部是被测物质的燃烧空间,也就是燃烧反应体系。氧弹壳及环境恒温式量热计及内外筒内的水为环境。盛水桶、3000ml水和氧弹三部分组成了测量体系.
八、实验总结
这次试验是成功的,但实验做的不够精密,以致有误差。
同组成员:李灿、李长福、马明亮
2.装置氧弾
①拧开氧弾盖②小心将压好的样品放在燃烧杯内。③将点火丝的两端分别紧绕在电极的下端。④用万用表检查两极是否通路,若通路,则旋紧氧弾出气口后既可以充氧气
3.充气
①将氧弾进气管口的螺栓卸下②将高压钢瓶导气管与进气孔相连③打开钢瓶总开关
④顺时针转动低压表力调节螺杆,使低压表显示值为0.5MPa
4.测温、点火燃烧和升温的测量
二、实验仪器和试剂
氧弾量热计、压片机、万用表、恒温式热量计(型号:ZR-15)、恒温槽(型号:ZR-15)
精密温度差测量仪(型号:ZT-ZTC)、数显贝克曼温度计、容量瓶(1000ml)、氧气钢瓶
减压阀、点火丝、萘(A.R.) 生产公司:天津市福晨化学试剂厂 规格:250g
苯甲酸(A.R.) 生产公司:天津市德恩市化学试剂有限公司 规格:250g
T—反应前后的绝对温度,K(取反应前后的平均值)。
2.测量
弾式量热计测量燃烧热的基本原理是:
假设环境与量热体系没有热量交换,样品完全燃烧所放出的热量全部用于量热体系的温度改变,那么,如果测得温度改变值Δt和量热体系的水当量(即量热体系温度升高1℃时所需的热量),根据下式就可以计算样品的燃烧热。
根据能量守恒原理,用苯甲酸标定量热体系的水当量W或( ):
2.为什么要进行雷诺校正?
答:因为热量计与周围环境的热交换无法完全避免,它对温度测量值的影响可用雷诺温度校正图校正。
燃烧热的测定_苯甲酸_萘

(1)什么是燃烧热?它在化学计算中有何应用?答:在101 kPa 时,1 mol 可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol 。
反应热中ΔH 为负,则为放热反应;为正,则为吸热反应,燃烧热为反应热的一种,其ΔH 为负值含相同碳原子数的烷烃异构体中,直链烷烃的燃烧热最大,支链越多燃烧热越小。
(2)什么是卡计和水的热当量?如何测得?答:卡计和水当量就是量热仪内筒水温每升高一度所吸收的热量(即量热计的热容量)。
单位是 :焦耳/度测法:用已知燃烧焓的物质(如本实验用的苯甲酸),放在量热计中燃烧,测量其始、末温度,经雷诺校正后,按下式:ΔT 点火丝,C Q m nQ m V =--点火丝即可求出。
(3)测量燃烧热两个关键要求是什么?如何保证达到这两个要求?答:实验关键:点火成功、试样完全燃烧是实验成败关键,可以考虑以下几项技术措施:①试样应进行磨细、烘干、干燥器恒重等前处理,潮湿样品不易燃烧且有误差。
压片紧实度:一般硬到表面有较细密的光洁度,棱角无粗粒,使能燃烧又不至于引起爆炸性燃烧残剩黑糊等状。
②点火丝与电极接触电阻要尽可能小,注意电极松动和铁丝碰杯短路问题。
③充足氧(2MPa)并保证氧弹不漏氧,保证充分燃烧。
燃烧不完全,还时常形成灰白相间如散棉絮状。
④注意点火前才将二电极插上氧弹再按点火钮,否则因仪器未设互锁功能,极易发生(按搅拌钮或置0时)误点火,样品先已燃烧的事故。
(4)实验测量到的温度差值为何要经过雷诺作图法校正,还有哪些误差来源会影响测量的结果?答:实际上,热量计与周围环境的热交换无法完全避免,它对温度测量值的影响可用雷诺温度校正图校正。
还可能带来误差的可能有:①实验过程中的系统误差;②可能与当天的温度和气压有关;③样品可能受潮使称量时产生误差;④样品可能中可能含有杂质。
物化实验 燃烧热的测定

USTC物理化学
实验报告
2013年第二学期实验报告实验三
EXPERIMENT 3
张付瑞
化学与材料科学学院
Department of Materials Science & Engineering
Materials Science
C
由热力学第一定律,恒容过程的热效应。
恒压过程的热
本实验通过测定萘完全燃烧时的恒容燃烧热,恒压燃烧∆H 。
在计算萘的恒压燃烧热时,
∂∂∆⎛⎝ (3)
是反应前后的恒压热容之差,反应的热效应随温度的变化不是很大,在较小的温度范围内
热是一个很难测定的物理量,而温度却很容易测量。
如果有一种仪器,
为了确定量热卡计每升高一度所需要的热量,
C 卡=
=++Q T mQ l V T V ∆∆29598.. 为消耗1mL0.1 mol ·dm -3的NaOH 所相当的热量尽管在仪器上进行了各种改进,但在实验过程中仍不可避免环境。
苯甲酸和萘的燃烧热实验报告

燃烧热数据处理外界压力:97.58kpa 温度:19.8℃ 湿度:96%1)苯甲酸测定 外筒温度:21.18℃ 内筒温度:20.44℃ 相差在0.5~1.2℃之间。
2)萘的测定 外筒温度:21.18℃ 内筒温度:20.08℃ 相差在0.5~1.2℃之间。
表1.实验药品及燃烧丝记录表2.0.1mol/L 的NaOH 滴定用量一、量热计常数的计算图1.苯甲酸燃烧数据绘图水当量的测定:由图可测知:表3.ΔT数据记录表T1T2T3-0.3580.381 1.325403ΔT 1.683403则可知△T=1.68K由反应方程式可知△n = 7 – 15/2 = -0.5 mol所以Q V = Q P-△nRT = △H-△nRT = -3226.9*103 +0.5*8.314*(20+273.15)= -3.2257×106J•mol-1K=(-26430J•g-1 X m1-3242.6J•g-1 X m2 -5980J•mol-1X n)/△T= --1.4336712005*104J•K-1式中m1 m2 n分别为苯甲酸,已燃镍丝的质量及生成硝酸的物质的量。
△T为量热系统温度的升高。
可知道量热计常数为K= --1.4336712005*104J•K-1二、萘的定容和定压燃烧热计算图2.萘燃烧数据绘图萘燃烧热的测定:如图知,AA’ CC’近似重合则可测知△T=1.6369K表4.萘燃烧ΔT处理T1T2T31.10004287 1.680992.736977ΔT 1.6369 由反应方程式可知△n = 10 – 12 = -2 mol则由Q总热量= Q V (m/M) + Q燃丝•m燃丝= K•△T。
燃烧热的测定实验报告

实验三燃烧热的测定【摘要】本文的目的是充分认识和掌握恒压热效应与恒容热效应的区别及相互关系;了解氧弹量热计的构造和测量原理,掌握燃烧热的测定技术。
采用雷诺图解法测定了苯甲酸和萘的燃烧热。
实验结果表明,在恒容条件下测得的摩尔燃烧热=-5857.83,在恒压条件下测得的摩尔燃烧热-5826.69结果说明, 22.4℃左右时,实验测定萘的燃烧热为-5826.69KJ/mol。
【前言】摩尔燃烧热是指在一定温度下,1 mol物质完全燃烧时的反应热。
摩尔燃烧热的测定,除了其实际应用价值外,还广泛应用于各种热化学计算。
燃烧热的测定既可在恒压条件下进行,也可在恒容条件下进行。
根据热力学第一定律,如果没有非体积功则在恒容条件下测得的摩尔燃烧热等于摩尔反应内能;在恒压条件下测得的摩尔燃烧热等于摩尔反应焓变。
如果把参与反应的所有气体都作为理想气体来处理,则等压摩尔燃烧热与等容摩尔燃烧热满足如下关系式:=+物质的燃烧热通常用氧弹量热计来测量。
氧弹量热计是一种重要的热化学仪器,广泛应用于测定煤炭、石油、食品、木材、炸药等物质的发热量。
氧弹量热计的基本原理是能量守恒定律。
将一定量待测物质在氧弹中完全燃烧,释放的能量会使氧弹本身、氧弹周围的介质及其他有关附件的温度同时升高。
测量介质在燃烧前后温度的变化,就可以求算出样品的恒容摩尔燃烧热,其关系式如下:-()=实际上,量热计与周围环境的热交换是无法完全避免的,因此燃烧前后温度的变化值不能直接准确地测定,而必须对实验测读的数据进行适当校正。
常用的校正方法是雷诺(Renolds)温度校正图法。
【正文】一、仪器和试剂氧弹式量热计、数显贝克曼温度计、水银温度计、氧气钢瓶、氧气减压阀、压片机、秒表、量筒、扳手、镊子、燃烧丝万用表、电子天平、苯甲酸、萘。
二、实验方法三、1.测定弹式量热计的热容(1)样品压片及称量。
用台科称取大约1 g苯甲酸,在压片机上压成圆片。
样品压片时,不宜太紧,也不宜太松。
物化实验报告:燃烧热的测定_苯甲酸_萘剖析

物化实验报告:燃烧热的测定_苯甲酸_萘剖析摘要本实验旨在测定燃烧热,通过苯甲酸(BBA)和萘甲酸(NAA)共同反应得出实验结果。
本实验采用了恒定温度连续重复技术(CRT)。
实验中,每次反应后结果与上一次反应的对比,可以很好地看出实验结果的差距,从而得到燃烧热的准确值。
反应体系通过CRT技术采用预先确定的温度,经过调整以达到实验要求。
反应结果显示,燃烧热H=-2.660kJ/mol,符合预期的结果。
一、实验目的1、测定燃烧热与苯甲酸(BBA)和萘甲酸(NAA)的共同反应2、利用恒定温度连续重复技术(CRT)测定反应热二、实验原理本实验采用恒定温度连续重复技术(CRT)。
该技术以预定的高温作为反应体系恒定的温度,持续反应苯甲酸(BBA)和萘甲酸(NAA)。
实验结果显示,随着反应次数的增多,反应温度逐渐上升,从而变暖。
所有实验结果使用CRT技术,绘出的图像可以测定反应的燃烧热,并可以得出本实验的结论。
三、实验步骤1、准备实验器材和试剂:(1)主要设备:恒温热浴、恒流泵、恒温温度控制单元、CRT、调节器、容量瓶等。
(2)试剂:苯甲酸(BBA)、萘甲酸(NAA)等。
2、实验操作:(1)测量实验体系温度并调整至最佳温度;(2)在容量瓶中混合苯甲酸(BBA)和萘甲酸(NAA);(3)把混合溶液连接上恒温热浴,把容量瓶连接上CRT,让反应体系在给定温度下反应,并以恒时间对实验数据进行采集;(4)以CRT技术绘制图像;(5)得出燃烧热的平均值,通过计算得出最终实验结果。
四、实验结果通过实验可以得出燃烧热的平均值为H=-2660kJ/mol。
五、实验结论通过本实验,可以得出苯甲酸(BBA)和萘甲酸(NAA)的燃烧热为H=-2.660kJ/mol。
实验结果接近预期的结果,表明实验步骤的控制合理,实验数据可靠,结果得出可信。
苯甲酸和萘的燃烧热实验报告

燃烧热数据处理外界压力:97.58kpa 温度:19.8℃湿度:96% 1)苯甲酸测定外筒温度:21.18℃内筒温度:20.44℃相差在0.5~1.2℃之间。
2)萘的测定外筒温度:21.18℃内筒温度:20.08℃相差在0.5~1.2℃之间。
表1.实验药品及燃烧丝记录药品质量燃烧丝质量剩余燃烧丝质量苯甲酸的测定/g 0.9113 0.0156 0.0016萘的测定/g 0.5908 0.0160 0.0037表2.0.1mol/L的NaOH滴定用量燃烧后滴定用NaOH量苯甲酸萘5.70mL 7.23mL一、量热计常数的计算图1.苯甲酸燃烧数据绘图由图可测知:表3.ΔT数据记录表T1T2T3-0.3580.381 1.325403ΔT 1.683403则可知△T=1.68K由反应方程式可知△n = 7 – 15/2 = -0.5 mol所以Q V = Q P-△nRT = △H-△nRT = -3226.9*103 +0.5*8.314*(20+273.15)= -3.2257×106J•mol-1K=(-26430J•g-1 X m1-3242.6J•g-1 X m2 -5980J•mol-1X n)/△T= --1.4336712005*104J•K-1 式中m1 m2 n分别为苯甲酸,已燃镍丝的质量及生成硝酸的物质的量。
△T为量热系统温度的升高。
可知道量热计常数为K= --1.4336712005*104J•K-1二、萘的定容和定压燃烧热计算图2.萘燃烧数据绘图如图知,AA’ CC’近似重合 则可测知 △T=1.6369K表4.萘燃烧ΔT 处理由反应方程式可知 △n = 10 – 12 = -2 mol则由Q 总热量 = Q V (m/M) + Q 燃丝•m 燃丝 = K•△T 由图一计算得水当量K=-1.4336712005*104J•K -1带入上述计算Q 总热量 = Q V (m/M) + Q 燃丝•m 燃丝 = K•△T Q V = [K•△T —(Q 燃丝•m 燃丝 )] ×M/m=[-1.4336712005*104*1.6369+1.4008*106*0.0160-0.0037)/1000]*128.18/0.5908 =-5087829.1357J•mol -1Q P = Q V + △nRT = -5087829.1357J•mol -1 +(-2)*8.314*(273.15+20)=-5092.7036339 kJ•mol -1标准值为 -5153.8 kJ•mol -1 误差为 -1.185%20091161034 文昊2011年12月25日10:53 整理于16#405寝室T 1 T 2 T 3 1.10004287 1.68099 2.736977ΔT1.6369。
实验1。燃烧热实验报告-萘,苯甲酸

实验5 燃烧热的测定一、实验目的1、用氧弹量热计测定萘的燃烧热,明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别与相互关系2、了解氧弹量热计的原理、构造及其使用方法,掌握有关热化学实验的一般知识和测量技术。
3、掌握用雷诺图解法校正温度的改变值。
二、实验原理燃烧热是1mol 物质完全氧化时的反应热效应。
“完全氧化”的意思是化合物中的元素生成较高级的稳定氧化物,如在碳被氧化成CO 2(气),氢被氧化成H 2O (液),硫被氧化成SO 2对于有机化合物,通常利用燃烧热的基本数据求算反应热。
燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热Q (气)等。
V =ΔU ,恒压燃烧热Q P =ΔH 。
在体积恒定的氧弹式量热计中测得的燃烧热为Q V ,而通常从手册上查得的数据为Q P p V Q Q RT n =+∆,这两者可按下列公式进行换算式中,△n(g)——反应前后生成物和反应物中气体的物质的量之差; R——气体常数;T——反应温度,用绝对温度表示。
通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。
一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值ΔT ,就能计算出该样品的燃烧热。
在盛有水的容器中,放入内装有一定量的样品和氧气的密闭氧弹,然后使样品完全燃烧,放出的热量传给水及仪器,引起温度上升。
若已知水量Wg ,水的比热为c ,仪器的水当量为W ˊ(量热计每升高一度所需的热量),燃烧前后的温度变化为ΔT ,则mg 物质的燃烧热为:,() (2)V L m Q lQ cW W T M−−=+∆样 式中:M 为样品的相对分子质量;Q V 为样品的恒容燃烧热;l 和Ql 是引燃用金属丝的长度和单位长度燃烧热。
水当量WWˊ的求法是:用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T∆,便可据式(2)求出WWˊ。
苯甲酸和萘燃烧热的测定实验报告

苯甲酸和萘燃烧热的测定实验报告一、实验目的1、用氧弹量热计测定苯甲酸和萘的燃烧热。
2、了解氧弹量热计的原理、构造及使用方法。
3、掌握恒温式热量计中有关热容量和测量体系温度变化的操作技术。
二、实验原理燃烧热是指 1 摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),恒容燃烧热等于这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),恒压燃烧热等于这个过程的焓变(ΔH)。
若把参加反应的气体和反应生成的气体都作为理想气体处理,则存在以下关系式:Qp = Qv +ΔnRT式中,Δn 为反应前后气体物质的量之差;R 为摩尔气体常数;T 为反应的绝对温度。
本实验采用氧弹量热计测量物质的燃烧热。
氧弹是一个封闭的容器,内部充有氧气。
将一定量的待测物质放入氧弹中,使其在氧气中完全燃烧。
燃烧放出的热量使量热计及周围介质温度升高。
通过测量介质在燃烧前后温度的变化值,就可以计算出物质的燃烧热。
量热计的热容量 C 是指量热计本身每升高 1℃所吸收的热量。
测量热容量 C 后,再测量样品燃烧使量热计温度升高的数值,就可以计算出样品的燃烧热。
三、实验仪器与试剂1、仪器氧弹量热计压片机贝克曼温度计电子天平引燃专用丝2、试剂苯甲酸(分析纯)萘(分析纯)氧气(钢瓶)四、实验步骤1、量热计热容量的测定准确称取苯甲酸约 10g 左右,用压片机压成片状。
用电子天平准确称取引燃丝的质量。
将引燃丝固定在苯甲酸片上,放入氧弹中。
向氧弹中充入约 2MPa 的氧气,放置一段时间,以检查氧弹是否漏气。
将氧弹放入量热计的内筒中,加入适量的水,使氧弹浸没在水中。
安装好贝克曼温度计,调节搅拌器的速度,使水温均匀。
点火,记录贝克曼温度计的读数,每隔 30 秒记录一次,直至温度不再升高,继续记录 10 分钟左右。
2、萘燃烧热的测定称取约 06g 左右的萘,重复上述步骤进行实验。
五、实验数据处理1、温度校正绘制温度时间曲线,根据雷诺校正法对温度进行校正,以消除热散失的影响。
物化实验报告:燃烧热的测定_苯甲酸_萘(优选.)

最新文件---------------- 仅供参考--------------------已改成-----------word文本 --------------------- 方便更改赠人玫瑰,手留余香。
华南师范大学实验报告课程名称物理化学实验实验项目燃烧热的测定【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
②掌握量热技术的基本原理,学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程的热焓变化(ΔH)。
若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:c H m = Q p=Q v +Δn RT(1)本实验采用氧弹式量热计测量蔗糖的燃烧热。
测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为:nT T C Q m V )(12,--= (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。
物化实验-燃烧热的测定数据处理

3
4
5
6
7
8
9
10
温度读数
0.000
0.002
0.002
0.003
0.004
0.004
0.005
0.005
0.006
0.006
0.007
读数序号
(每半分钟)
11
(点火)
12
13
14
15
16
17
18
19
20
21
温度读数
0.257
0.905
1.492
1.939
2.204
2.372
2.491
2.575
2.634
1.702
V= =-0.0013℃V1= =0.0009℃,m=3,r=19
△t校正=
K= 14.80kJ/K
萘燃烧值测定:
铁丝质量:0.0186g,萘0334g,剩余铁丝质量:0.0140g,燃掉的铁丝质量:0.0046g
读数序号
(每半分钟)
0
1
量热计常数的测定:
铁丝质量:0.0209g,苯甲酸+铁丝的质量:0.9785g,参与燃烧的苯甲酸质量:0.9576g,剩余铁丝质量:0.0145g,燃掉的铁丝质量:0.0064g,苯甲酸热值Qv=-26.43kJ/g
读数序号
(每半分钟)
0
1
2
3
4
5
6
7
8
9
10
温度读数
0.001
0.004
0.006
0.008
2.676
2.711
读数序号
(每半分钟)
22
23
燃烧热的测定(华南师范大学物化实验)

华南师范大学实验报告燃烧热的测定一、实验目的(1)明确燃烧热的定义,了解恒压燃烧热与恒容燃烧烧热的差别与联系。
(2)测定萘的燃烧热,掌握量热技术基本原理。
(3)了解氧弹卡计的基本原理,掌握氧弹卡计的基本实验技术。
(4)使用雷诺校正法对温度进行校正。
二、实验原理2.1基本概念1mol物质在标准压力下完全燃烧所放出的热量,即为物质的标准摩尔燃烧焓,用表示。
若在恒容条件下,所测得的1mol物质的燃烧热则称为恒容摩表示,此时该数值亦等于这个燃烧反应过程的热力学能变尔燃烧热,用Q V,mΔr U m。
同理,在恒压条件下可得到恒压燃烧热,用Q p,m表示,此时该数值亦等于这个燃烧反应过程的摩尔焓变Δr H m。
化学反应的热效应通常用恒压热效应Δr H m来表示。
假若1mol物质在标准压力下参加燃烧反应,恒压热效应即为该有机物的标准摩尔燃烧热。
把燃烧反应中涉及的气体看做是理想气体,遵循以下关系式:Q p,m=Q V,m+(ΣV B)RT ①2.2氧弹量热计本实验采用外槽恒温式量热计,为高度抛光刚性容器,耐高压,密封性好。
量热计的内筒,包括其内部的水、氧弹及其搅拌棒等近似构成一个绝热体系。
为了尽可能将热量全部传递给体系,而不与内筒以外的部分发生热交换,量热计在设计上采取了一系列措施。
为了减少热传导,在量热计外面设置一个套壳。
内筒与外筒空气层绝热,并且设置了挡板以减少空气对流。
量热计壁高度抛光,以减少热辐射。
为了保证样品在氧弹内燃烧完全,必须往氧弹中充入高压氧气,这就要求要把粉末状样品压成片状,以免充气时或燃烧时冲散样品。
2.3量热反应测量的基本原理量热反应测量的基本原理是能量守恒定律。
通过数字式贝克曼温度计测量出燃烧反应前后的温度该表ΔT,若已知量热计的热容C,则总共产生的热量即为Q V=CΔT。
那么,此样品的摩尔恒容燃烧热为②式是最理想的情况。
但由能量守恒原理可知,此热量Q V的来源包括样品燃烧放热和点火丝放热两部分。
物理化学实验报告-燃烧热的测定

实验四燃烧热的测定摘要:本实验采用氧弹量热计测定萘的恒容燃烧热,并计算萘的恒压燃烧热。
在测量过程中先用标准物质苯甲酸标定量热计的热容,通过雷诺校正图的方法校正过程的温度变化,以获得同绝热系统相近的测量效果,然后用相同的方法进行萘的燃烧测定关键词:氧弹量热计燃烧热雷诺校正图The Determination of The Combustion Heat of AlbocarbonAbstract:In this experiment, we determined the combustion heat of Albocarbon at a constant volume by using Oxygen-bomb calorimeter and then calculated thecombustion heat at a constant pressure. Benzoic acid, as standard substance,is used at the process of the experience first, and then we calculated the heatcapacity of the whole instrument. Through the method of Renault correctfigure we can measure the temperature variance to simulate a perfectinsulator-system in the actual system. After that, we got the albocarbon’scombustion heat at a constant volume.Key words:Oxygen-bomb calorimeter Combustion heat Renault correct figure1.序言摩尔燃烧热是指一摩尔纯净物完全燃烧时所放出的热量。
燃烧热的测定
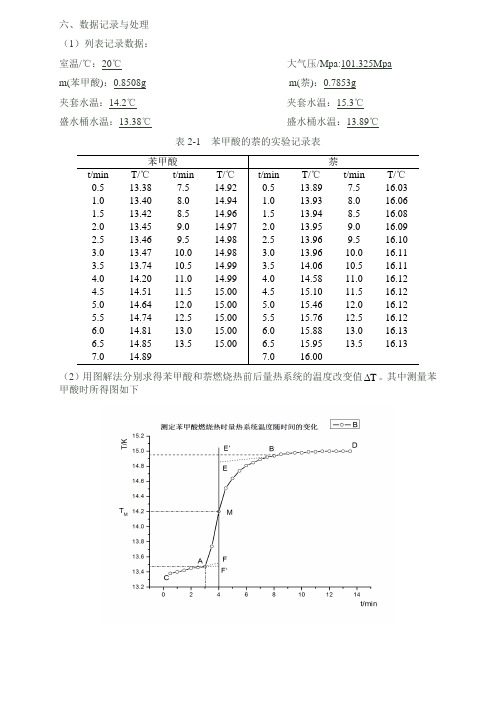
六、数据记录与处理(1)列表记录数据:室温/℃:20℃大气压/Mpa:101.325Mpam(苯甲酸):0.8508g m(萘):0.7853g夹套水温:14.2℃夹套水温:15.3℃盛水桶水温:13.38℃盛水桶水温:13.89℃表2-1 苯甲酸的萘的实验记录表(2)用图解法分别求得苯甲酸和萘燃烧热前后量热系统的温度改变值T。
其中测量苯甲酸时所得图如下则在测量苯甲酸燃烧热时的量热系统的改变值苯甲酸T ∆为1.39℃,另外,测定萘的燃烧热时所得图如下故在测定萘的燃烧热时量热系统的改变值萘T ∆为1.92℃。
(3)由(2)式计算W'的值。
据式T W W c Q l Q m l v ∆+=--)'*(*M样其中样m =0.8508g ,M=122g*mol -1,Q V =-26460J/g ,l=0.2m ,Q l =3158.9J/g ,c=4.183KJ/kg*K , W=3kg ,苯甲酸T ∆=1.39℃。
所以W ’=3638.37J/K(4)计算萘在恒容下完全燃烧的Q V 和萘的燃烧热Q P同样由上式,这时,样m =0.7853g ,M=128g*mol -1, l=0.2m ,Q l =3158.9J/g ,c=4.183KJ/kg*K , W=3kg ,W ’=3638.37J/K ,萘T ∆=1.92℃ 则萘的恒压燃烧热Q V =39581.74 J/g=5.0664*10^6J/mol萘的恒压燃烧热Q p =nRT Q V ∆+=5.066*10^6+0.00613*8.314*287.04=5.0664*10^6J/mol 查资料得萘的恒压Q V 标=5.153810^6J/mol故误差%69.1%100*1538.51538.50664.5%100*Q Q Q VV V =-=-=标ω。
燃烧热的测定

华南师范大学实验报告学生姓名学号专业化学(师范)年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型□验证□设计√综合实验时间2013年11月12日实验指导老师李国良实验评分【实验目的】1、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别与联系。
2、掌握量热技术的基本原理;学会测定萘的燃烧热。
3、了解氧弹量热计的主要组成及作用,掌握氧弹量热计的实验技术。
4、学会雷诺图解法校正温度改变值。
【实验原理】物质的标准摩尔燃烧热(焓)∆c H m 是指1mol物质在标准压力下完全燃烧所放出的热量。
在恒容条件下测得的1mol物质的燃烧热称为恒容摩尔燃烧热Q V,m,数值上等于这个燃烧反应过程的热力学能变化∆r U m;恒压条件下测得的1mol物质的燃烧热称为恒压摩尔燃烧热Q p,m,数值上等于这个燃烧热反应过程的摩尔焓变∆r H m,化学反应热效应通常是用恒压热效应∆r H m来表示。
若参加燃烧反应的是标准压力下的1mol物质,则恒压热效应∆r H m 即为该有机物的标准摩尔燃烧热∆c H m 。
若把参加反应的气体与生成的气体作为理想气体处理,则存在下列关系式Q p,m= Q V,m + ∑νB(g)RT (1)其中∑νB(g)指燃烧反应计量方程式中气体物质B的计量系数之代数和。
本实验所用测量仪器为氧弹量热计。
量热反应测量的基本原理是能量守恒定律。
热是一个很难测定的物理量,热量的测定往往表现为温度的改变,而温度却很容易测量。
在盛有定量水的容器中,样品的物质的量为nmol,放入密闭氧弹,充氧,然后使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶、氧弹、测温器件、搅拌器和水)的总热容为C(即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为Q V,m =-C(T2-T1)/n (2)其中C为仪器的总热容,J/K或J/℃。
大学物理化学实验燃烧热的测定实验报告

大学物理化学实验燃烧热的测定实验报告一、实验目的1、用氧弹量热计测定萘的燃烧热。
2、了解氧弹量热计的原理、构造及使用方法。
3、掌握温差测量和雷诺温度校正图的使用。
二、实验原理燃烧热是指 1 摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),在恒压条件下测得的燃烧热称为恒压燃烧热(Qp)。
Qp = Qv +ΔnRT,其中Δn 为反应前后气体物质的量之差,R 为摩尔气体常数,T 为反应温度。
本实验采用氧弹量热计测量物质的燃烧热。
氧弹量热计的基本原理是能量守恒定律。
样品在氧弹中完全燃烧所释放的能量使得量热计本身及周围介质(包括内筒水、氧弹、搅拌器等)温度升高。
通过测量燃烧前后介质温度的变化,就可以计算出样品的燃烧热。
量热计与周围环境的热交换无法完全避免,这会给测量结果带来误差。
因此,需要进行雷诺温度校正,以消除热交换的影响。
三、实验仪器与试剂1、仪器氧弹量热计压片机电子天平贝克曼温度计点火丝氧气钢瓶2、试剂萘(分析纯)引燃用铁丝四、实验步骤1、样品准备用电子天平称取约 10g 左右的萘,精确至 00001g,将其在压片机上压成片状。
2、装样拧开氧弹盖,将样品片放在坩埚中,将点火丝的两端分别紧绕在坩埚上方和下方。
用移液管准确量取 1000mL 去离子水注入内筒。
3、充氧将氧弹放在充氧架上,接上氧气钢瓶,缓慢充入氧气至压力约为20MPa。
4、测量初始温度安装好氧弹,将贝克曼温度计插入内筒,搅拌均匀,每分钟记录一次温度,连续记录 5 分钟,得到初始温度 T1。
5、点火燃烧按下点火按钮,点火丝通电引燃样品,继续搅拌并记录温度,直至温度不再上升,每隔半分钟记录一次温度,记录 10 分钟左右。
6、测量终了温度实验结束后,取出贝克曼温度计,继续搅拌内筒水,每隔半分钟记录一次温度,记录 5 分钟,得到终了温度 T2。
7、整理仪器放掉氧气,取出氧弹,打开氧弹,检查燃烧是否完全,倒掉剩余的水,清洗仪器。
物理化学实验报告-燃烧热的测定(2)

2)参与反应的气体均视为理想气体,则Q p =Q V +ΔnRT 。
Q V 为恒容燃烧热,Q p 为恒压燃烧热,Δn 为反应前后产物与反应物中气体的物质的量之差,R 为摩尔气体常量,T 为反应的热力学温度。
3)化学反应的热效应(包括燃烧热)通常用恒压热效应ΔH 来表示。
2.氧弹热量计和装置原理1)本实验采用恒温式氧弹热量计。
在下面的氧弹热量计装置图中,贝克曼温度计和外筒温度计在本实验中采用精密温差测定仪来代替。
2)测燃烧热原理:样品在纯氧气氛中完全燃烧放出的热量使氧弹周围介质温度升高,若已知仪器常数,测量其温差即可求算样品的恒容燃烧热。
燃烧热计算式:Q V W + q 1x + q 2 ≈ Q V W + q 1x = KΔh式中Q V (J/g )为萘(被测物质)的恒容燃烧热;W (g )为萘的质量;x (g )为烧掉点火丝(铜丝)的质量;已知铜丝的燃烧热q 1=-2510J/g ,此实验中由于q 2(即氧弹内的N 2生成硝酸时放出的热量)太小则可以忽略。
一般用已知燃烧热的标准物质苯甲酸来标定氧弹热量计的仪器常数K (J/mm ),已知苯甲酸的恒容燃烧热Q V =-3231.3KJ/mol 。
Δh (mm )为记录纸上曲线的峰高。
设苯甲酸和萘的恒容燃烧热分别为Q V1和Q V2,烧掉铜丝的质量分别为x 1和x 2,消耗样品质量分别为W 1和W 2,曲线记录的峰值分别为Δh 1和Δh 2,则萘的恒容燃烧热可由下式计算得:Q V2= Q V1W 1+q 1x 1 ∆h 2−q 1x 2∆h 1∆h 1W 2 此处燃烧热的单位为KJ/g ,注意单位的换算。
3)为了保证样品完全燃烧,氧弹中必须充足高压氧气(本实验要求在1.2-1.4MPa 之间)。
因此要求氧弹必须耐高压、密封、耐腐蚀,同时粉末样品必须压成片状,以免充气时冲散样品,使样品燃烧不完全。
必须使燃烧后放出的热量尽可能传递给介质,使水温升高,因此应尽量避免和减小由于辐射、对流以及传导等引起的能量散失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南师范大学实验报告课程名称物理化学实验实验项目燃烧热的测定【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
②掌握量热技术的基本原理,学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程的热焓变化(ΔH)。
若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:c H m = Q p=Q v +Δn RT(1)本实验采用氧弹式量热计测量蔗糖的燃烧热。
测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为:nT T C Q m V )(12,--= (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。
上述公式是最理想、最简单的情况。
图 1 氧弹量热计构造示意图图 2 氧弹构造示意图1、氧弹 1-厚壁圆筒;2-弹盖2、内水桶(量热容器) 3-螺帽; 4-进气孔3、电极4、温度计 5-排气孔;6-电极5、搅拌器6、恒温外套 8-电极(也是进气管)但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。
因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。
(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去就如等式(3):ΔT 点火丝,C Q m nQ m V =--点火丝 (3)式中:m 点火丝为点火丝的质量,Q 点火丝为点火丝的燃烧热,为 J / g ,T 为校正后的温度升高值。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C 。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。
方法:将燃烧前后历次观察的贝氏温度计读数对时间作图,联成FHDG 线如图2-1-2。
图中H 相当于开始燃烧之点,D 点为观察到最高温度读数点,将H 所对应的温度T 1,D 所对应的温度T 2,计算其平均温度,过T点作横坐标的平行线,交FHDG 线于一点,过该点作横坐标的垂线a,然后将FH 线和GD 线外延交a 线于A 、C 两点,A 点与C 点所表示的温度差即为欲求温度的升高T 。
图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。
CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC 两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值有时卡计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进热量,使得燃烧后的最高点不出现,如图2-1-3,这种情况下T 仍可以按同法校正之。
【实验仪器与药品】外槽恒温式氧弹卡计(一个);氧气钢瓶(一瓶);压片机 (2台);数字式贝克曼温度计(一台);0~100℃温度计(一支);万用电表(一个);扳手(一把);萘(A .R);苯甲酸(或燃烧热专用);铁丝(10cm长);【实验步骤】一、量热计常数K的测定。
1、苯甲酸约,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 。
2、苯甲酸约,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 。
3、把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线。
4、盖好氧弹,与减压阀相连,充气到弹内压力为为止。
6、把氧弹放入量热容器中,加入3000ml水。
7、插入数显贝克曼温度计的温度探头。
8、接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。
约10min后,若温度变化均匀,开始读取温度。
读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。
9、在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。
加大点火电流使点火指示灯熄灭,样品燃烧。
灯灭时读取温度。
10、温度变化率降为°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。
先取出贝克曼温度计,再取氧弹,旋松放气口排除废气。
11、称量剩余点火丝质量。
清洗氧弹内部及坩埚。
二、萘的恒容燃烧热的测定1、取萘压片,重复上述步骤进行实验,记录燃烧过程中温度随时间变化的数据。
【注意事项】①为避免腐蚀,必须清洗氧弹②点火成败是实验关键。
应仔细安装点火丝和坩埚。
点火丝不应与弹体内壁接触,坩埚支持架不应与另一电极接触。
③每次实验前均应称量坩埚。
【文献值】【实验数据与处理】[实验原始数据]第一组测定的数据:苯甲酸①第二组测定的数据:苯甲酸②第三组测定的数据:萘①[实验数据的处理]①雷诺校正作图②计算卡计的热容C,并求出两次实验所得水当量的平均值。
苯甲酸的燃烧反应方程式为:根据基尔霍夫定律:∴ΔCp,m =7×Cp,m(CO2,g)+3×Cp,m(H2O,l)-Cp,m(苯甲酸,s)-215Cp,m(O2,g)= J/molK∴当室温为℃时苯甲酸的燃烧焓为:△c Hm(℃)=△cHm(℃)+△Cp×△T=+×= kJ/mol则:苯甲酸的恒容摩尔燃烧热为:QV =△cUm=△cHm- RT∑BVB(g) =-××(7-×10-3= kJ/mol又:nQV =-C△T -QV点火线·m点火线∴(Ⅰ)苯甲酸①燃烧的数据处理:QV点火丝·m点火丝=×10-3××10-3 = kJ ,nQ-T mQmvC∆•-=丝丝=1.29931.29)-0.02477()-3224.6(122.120.4874--⨯-= kJ/℃(Ⅱ)苯甲酸②燃烧的数据处理:QV点火丝·m点火丝=×10-3×9×10-4 =×10-3 kJ ,nQ-T mQmvC∆•-=丝丝=648.30373.31)-0.006025()-3224.6(122.120.4354--⨯-= kJ/℃(Ⅲ)两次实验所得水当量的平均值为:C=+)÷2= kJ/℃③计算萘的恒容摩尔燃烧热Q V,m根据公式:nQV =-C△T -QV点火线·m点火线则:(Ⅰ)萘①燃烧的数据处理:QV点火丝·m点火丝=×10-3××10-3 = kJQ V ,m =(-C △T -Q V 点火线·m 点火线)/n=()128.180.47310.0361547.28695.2915.692---⨯=- kJ/mol (Ⅱ)萘②燃烧的数据处理:Q V 点火丝·m 点火丝= ×10-3××10-3 = kJQ V ,m =(-C △T -Q V 点火线·m 点火线)/n=()128.180.48190.01138627.27867.2815.692---⨯=-5178 kJ/mol (Ⅲ)萘的恒容摩尔燃烧热平均值为m v,Q =(--5178) ÷2=- kJ/mol④求萘的恒压摩尔燃烧热Q p ,m (即△c H m )萘燃烧的化学方程式为:()()()()10822212104C H s O g CO g H O l +→+ ()2B Bg ν=-∑,根据基尔霍夫定律:∴ΔC p ,m =10×C p ,m (CO 2,g )+4×C p ,m (H 2O,l )-C p ,m (萘,s )-12C p ,m (O 2,g )= J/molK∴℃ 时萘的燃烧焓为:△c H m (℃)=△c U m + RT ∑B V B (g)=-+××(-2)×10-3=- kJ/mol⑤由基尔霍夫定律将△c H m (T )换成△c H m (),并与文献比较△c H m (℃)=△c H m (℃)+△C p ×△T=-+×- ×10-3=- kJ/mol相对误差:%1008.5153|)8.5153(758.5211|⨯---=∆=% 【实验结果与讨论】实验求得萘的燃烧热Q P,实与文献值Q P ,标= kJmol 1的误差为%(小于3%)。
可见本实验温度对萘的燃烧焓值影响很小,实验结果较为准确。
产生误差的原因除了仪器误差之外,主要还有以下几个方面:①使用雷诺图解法时,要做切线,切线分别表示正常温度上升和量热系统温度降低,切线拟合的结果对ΔT 的影响很大,此次实验结果很大程度上取决于这一步数据处理。
②在实验进行过程中,夹套水温也不可能恒定,这会对ΔT 的求算造成影响。
但是夹套中水很多,且为了调零水温只比夹套水温1K 左右,所以此误差可以忽略,这也是步骤中调整水温的原因。
③萘为易挥发性物质,压片称量后应该迅速放入氧弹中,以免因挥发而损失过多的质量,给实验带来误差,使实验结果偏大。
④氧弹内可能存在少量空气,空气中N 2的氧化会产生热效应。
⑤若试样未完全燃烧,造成的影响很大,若有明显的黑色残渣,实验应重做。
⑥量取3000mL 水使用的2000mL 量筒的称量误差很大。
