沈阳药科大学高等有机化学课件(胡春版)——第三章 有机反应总论
合集下载
沈阳药科有机化学课件

有机反应历程的分类
有机反应的实质是旧键的断裂和新键的形成过程。 有机反应的实质是旧键的断裂和新键的形成过程。共 价键的断裂方式有三种: 价键的断裂方式有三种: (1)均裂:A:B → A· + B· )均裂: : 即构成共价键的电子对在断裂时平均分配到两个原子上, 即构成共价键的电子对在断裂时平均分配到两个原子上, 形成带有单电子的活泼原子或基团——游离基(又叫自由 游离基( 形成带有单电子的活泼原子或基团 游离基 ),这种断裂方式称为共价键的均裂 这种断裂方式称为共价键的均裂。 基),这种断裂方式称为共价键的均裂。 (2)异裂:A:B → A- + B+(或A+ + B- ) )异裂: : 即构成共价键的电子对在断裂时完全转移到1个原子上 个原子上, 即构成共价键的电子对在断裂时完全转移到 个原子上, 形成正负2个离子 这冲断裂方式称为共价键的异裂。 个离子, 形成正负 个离子,这冲断裂方式称为共价键的异裂。 (3)协同反应 ) 共价键的断裂方式决定于分子结构和反应条件, 共价键的断裂方式决定于分子结构和反应条件,由此 而产生的两种反应历程,即游离基反应和离子型反应, 而产生的两种反应历程,即游离基反应和离子型反应,是 有机化学反应的三大基本类型。 有机化学反应的三大基本类型。
有机反应的动力学
• 动力学数据只提供关于决定速度步骤和在它以 前各步的情况, 前各步的情况,当有机反应由两步或两步以上 的基元反应组成时, 的基元反应组成时,则反应速度定律的确定一 般比较复杂, 般比较复杂,通过平衡近似和定态近似法等简 化方法可求得反应的表观速度常数。 化方法可求得反应的表观速度常数。 动力学研究反应机理的常规顺序是: 动力学研究反应机理的常规顺序是:提出可能 的机理, 的机理,并把实验得出的速度定律与根据不同 可能性推导得到的速度定律作比较。 可能性推导得到的速度定律作比较。从而排除 与观测到的动力学不相符的机理。 与观测到的动力学不相符的机理。
高等有机化学 课件(3)

2013-8-6
2、消除反应(elimination reaction)
消除反应是与取代反应竞争的一类重要反应。
C C Y Z
消除反应 (-YZ)
C
C
在消除反应中,应用最多的是脱卤化氢反应。 类似亲核取代反应,消除反应也有双分子和单分子消除 反应之分,分别略称为E2和E1反应。一般说来,强碱性、 弱亲核性、高温有利于消除反应的进行。
H
快
H3C
+
H
2013-8-6
当SN1反应发生在立体中心C原子上时,一般得到的是外 消旋产物。 由于在SN1反应过程中出现C正离子过渡态,超共扼效应 使得叔碳正离子更趋稳定,具有R3C-X结构的卤代烃更易发 生SN1反应。 其它的SN1反应例子: (CH3) 3C-Br + H2O→(CH3) 3C-OH + HBr (CH3) 3C-Cl + CH3OH→(CH3) 3C-OCH3 + HCl (CH3) 3C-Cl + HCOOH→(CH3) 3C-OOCH + HCl 这些反应由于是和溶剂反应,因此又称溶剂分解反应 (solvolysis)。
后者的反应机理可表示如下:
CH3 H3C C Cl CH3 慢 H2O H3C CH3 C+ + CH3 CH3 H 3C C CH3 .. O H 快 H3C + O H H CH3 C OH + H3O+ CH3 Cl-
H3C
CH3 .. C+ + O CH3 H CH3 C CH3 + O H H
3(CH3)2CHCH2OH + PBr3 CH2OH + SOCl2 OCH3 -10 to 0oC 4h 3(CH3)2CHCH2Br + H3PO3 CH2Cl + SO2 + HCl OCH3 (91%) (forms a salt with pyridine )
高等有机化学第三部分3-3.ppt
R-X + Y
. . R X
R +Y
R-X + Y(自由基离子形成)
.R + X
(电子转移)
RY
. or: R + Y-
RY
R Y +R X
R Y+ R X
10
SET的例证之一
.
Y
X +Y
.
(X=I, NO2等)
11
(四) 邻基参与机理(Neighboring-Group) 常有这样的情况: a.反应速度比预期的快 b.构型保留
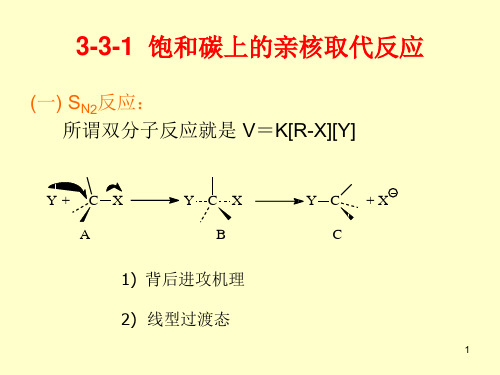
3-3-1 饱和碳上的亲核取代反应
(一) SN2反应: 所谓双分子反应就是 V=K[R-X][Y]
Y+ C X A
YCX B
Y C +X C
1) 背后进攻机理 2) 线型过渡态
1
1) 背后进攻机理
虽然SN2机理是在1937年由Hughs和Ingold 等人正式提出,但早在1893年Walden就发现了 这个取代反应中的构型翻转,所以现在人们又 称Walden翻转。
RX
RX
RX
R +X
紧密
松散
游离的离子
部分构型保留
消旋化
(溶液分隔)
部分保留和彻底的消旋化是SN1的特点。
注意:实际上很少纯粹的SN1或SN2反应,很多是二者都有。
9
(三)SET机理(Single Electron Transfer) 在亲核取代反应中有一类含有自由基或自由基
离子中间体,这类反应是通过SET机理进行的。
Allyl
40
Bn
120
* 位阻小的反应快,烯丙基反应快。
25
沈阳药科大学高等有机化学课件胡春版——第一章绪论

• 分子轨道即分子中价电子的运动状态,可用波函数ψ来描述。 分子轨道理论的基本要点:
(1)分子轨道是由原子轨道通过线性组合而成; (2)组合前后的轨道数守恒:即有几个原子轨道就可以组合 成几个分子轨道。
(3)原子轨道组合成分子轨道遵守最大重叠原则,能量近似 原则,对称性匹配原则。
(4)电子在分子轨道中的排布与原子中电子在核外排布类似。
(1915) • 1912, F. Pregl有机化合物微量分析方法(1923) • 1901-1903, A Windaus甾体化合物的结构和与维生素D的关系
(1928) • 1924-1940, R. Robinson生物碱、青霉素结构 (1947) • 1948-1956, D. C. Hodgkin维生素B12结构(1964) • 1953, F. Sanger蛋白质结构(1958) • 1953, J. D. Watson和 F. H. C. Crick发现DNA双螺旋结构(1962)
高等有机化学电子教案1胡春高等有机化学物理有机化学2有机立体化学有机合成化学高等有机化学高等有机化学第1章概论第2章立体化学第3章第3章有机反应总论有机反应总论3第4章饱和碳原子的亲核取代反应第5章烯烃的加成反应第6章消除反应第7章芳香性高等有机化学第8章芳香亲电取代反应第9章羰基的加成反应及相关反应第10章第0章分子重排反应分子重排反应4第11章协同反应第12章自由基反应第13章有机光化学第一章概论511有机化学发展概况一有机化学的研究范畴1
学
12
§1-2 现代共价键理论
一、原子轨道和化学键
1. 原子轨道和电子云 • 共价键由成键电子所在原子轨道重叠形成。 • 原子轨道(φ):电子在原子核外空间运动状态函数。 • 电子云(φ2) :电子在核外空间运动出现的几率密度。 • s轨道围绕原子核呈球形对称,p轨道呈哑铃形。 • 原子轨道图中“+”、“-”表示波函数位相,并不代表 电荷。 • 原子轨道中电子排布遵守Pauli不相容原理,能量最低原 理,Hund规则。
(1)分子轨道是由原子轨道通过线性组合而成; (2)组合前后的轨道数守恒:即有几个原子轨道就可以组合 成几个分子轨道。
(3)原子轨道组合成分子轨道遵守最大重叠原则,能量近似 原则,对称性匹配原则。
(4)电子在分子轨道中的排布与原子中电子在核外排布类似。
(1915) • 1912, F. Pregl有机化合物微量分析方法(1923) • 1901-1903, A Windaus甾体化合物的结构和与维生素D的关系
(1928) • 1924-1940, R. Robinson生物碱、青霉素结构 (1947) • 1948-1956, D. C. Hodgkin维生素B12结构(1964) • 1953, F. Sanger蛋白质结构(1958) • 1953, J. D. Watson和 F. H. C. Crick发现DNA双螺旋结构(1962)
高等有机化学电子教案1胡春高等有机化学物理有机化学2有机立体化学有机合成化学高等有机化学高等有机化学第1章概论第2章立体化学第3章第3章有机反应总论有机反应总论3第4章饱和碳原子的亲核取代反应第5章烯烃的加成反应第6章消除反应第7章芳香性高等有机化学第8章芳香亲电取代反应第9章羰基的加成反应及相关反应第10章第0章分子重排反应分子重排反应4第11章协同反应第12章自由基反应第13章有机光化学第一章概论511有机化学发展概况一有机化学的研究范畴1
学
12
§1-2 现代共价键理论
一、原子轨道和化学键
1. 原子轨道和电子云 • 共价键由成键电子所在原子轨道重叠形成。 • 原子轨道(φ):电子在原子核外空间运动状态函数。 • 电子云(φ2) :电子在核外空间运动出现的几率密度。 • s轨道围绕原子核呈球形对称,p轨道呈哑铃形。 • 原子轨道图中“+”、“-”表示波函数位相,并不代表 电荷。 • 原子轨道中电子排布遵守Pauli不相容原理,能量最低原 理,Hund规则。
沈阳药科大学高等有机化学胡春版——绪论

13
§1-2 现代共价键理论
一、原子轨道和化学键
2. 价键法(VB法) • 1927年Heiter和London提出处理化学键的量子力学方法, 后来经过Pauling等进一步完善。 • 价键法(VB法),又称为电子配对法 。基本要点: (1) 形成共价键的两个原子均具有未成对电子,并且自旋 方向相反;每一对电子形成一个共价键。 (2) 原子价数:原子的未成对电子数。 (3) 共价键具有饱和性。 (4) 共价键具有方向性。 。 (5) 能量相近的轨道可进行杂化,形成能量相等的杂化轨 道。
(二茂铁结构)(1973)Βιβλιοθήκη 10§1-1 有机化学发展概况
二、有机化学的发展概况
3. 有机结构理论和反应机理 • 1945-1969, J. W. Cornforth, V. Prelog立体化学(1975) • 1951-1971, 福井谦一, R. Hoffmann化学反应过程理论
(1981) • 1967, E. J. Corey有机合成理论 (1990) • 1962-现在, G. A. Olah碳正离子化学(1994) • 1987-现在, A. H. Zewail飞秒化学(1999)
16
§1-2 现代共价键理论 二、分子轨道理论
ψ1 = φ 1 + φ2
ψ
ψ2= φ 1 φ2
“+”与“ ”表示波的位相
反键轨道
ψ2 = φ 1 φ2
φ1
φ2
能量
ψ1 = φ 1 + φ2
成键轨道
17
§1-2 现代共价键理论 二、分子轨道理论
节面
18
§1-2 现代共价键理论 二、分子轨道理论
2pZ,A 原子轨道
14
§1-2 现代共价键理论
一、原子轨道和化学键
2. 价键法(VB法) • 1927年Heiter和London提出处理化学键的量子力学方法, 后来经过Pauling等进一步完善。 • 价键法(VB法),又称为电子配对法 。基本要点: (1) 形成共价键的两个原子均具有未成对电子,并且自旋 方向相反;每一对电子形成一个共价键。 (2) 原子价数:原子的未成对电子数。 (3) 共价键具有饱和性。 (4) 共价键具有方向性。 。 (5) 能量相近的轨道可进行杂化,形成能量相等的杂化轨 道。
(二茂铁结构)(1973)Βιβλιοθήκη 10§1-1 有机化学发展概况
二、有机化学的发展概况
3. 有机结构理论和反应机理 • 1945-1969, J. W. Cornforth, V. Prelog立体化学(1975) • 1951-1971, 福井谦一, R. Hoffmann化学反应过程理论
(1981) • 1967, E. J. Corey有机合成理论 (1990) • 1962-现在, G. A. Olah碳正离子化学(1994) • 1987-现在, A. H. Zewail飞秒化学(1999)
16
§1-2 现代共价键理论 二、分子轨道理论
ψ1 = φ 1 + φ2
ψ
ψ2= φ 1 φ2
“+”与“ ”表示波的位相
反键轨道
ψ2 = φ 1 φ2
φ1
φ2
能量
ψ1 = φ 1 + φ2
成键轨道
17
§1-2 现代共价键理论 二、分子轨道理论
节面
18
§1-2 现代共价键理论 二、分子轨道理论
2pZ,A 原子轨道
14
高等有机化学——反应机理PPT课件

亲核性和碱性
1. 亲核性强,碱性弱的基团, 如:Br-, I-, R2S, RS, R3P, CN-, 丙二酸酯负离子 等基团。 2. 亲核性强,碱性强的基团,如:RO-, R2N-, RC≡C-, Cl-。 3. 亲核性弱,碱性强的基团,如:t-BuO, i-Pr2NLi (LDA), (Me3Si)2NK (KHMDS), i-Pr2NEt,DBU, DBN, TMG.
在此要注意两条规则: ⅰ.在吸电子基团的β位的C原子上具有亲电性。不是α位上的C原子。如:
β α
βα
第21页/共82页
独特的C=C键(变色龙)
ⅱ.不要把正电荷与亲电性混淆
+
CH2=OCH3
+
CH2-OCH3
亲电性的原子是C原子,不是O原子。
+
Me2N=CH2
+
Me2N-CH2
第22页/共82页
酸性条件和碱性条件:pKa值
亲核试剂是具有能量较高的电子的化合物,能够形成新 的化合键。 具有亲核性的原子可以是中性的,也可以带有负电荷。
第3页/共82页
亲核试剂(Nucleophiles)
亲核试剂可以分为三种类型:
孤对电子亲核试剂; σ键亲核试剂; π键亲核试剂。
第4页/共82页
孤对电子亲核试剂
孤对电 子亲核
试剂 第5页/共82页
第9页/共82页
亲核性
ⅱ. 当亲核性原子的位阻变大时,亲核性大大下降,而碱性 稍有增加。
亲核性:t-BuO- << EtO-
碱性:t-BuO- > EtO-;
第10页/共82页
iii 负电荷的离域使碱性大大下降;相对而言,亲核性则只 是部分下降
沈阳药科大学高等有机化学胡春——周环反应PPT课件

第16页/共62页
三、 电环化反应的理论解释
1. 能级相关理论
S
A
S
A
丁二烯
A
S
A
S
环丁烯
1,3-丁二烯顺旋环化为环丁烯的能级相关图
第17页/共62页
三、 电环化反应的理论解释
1. 能级相关理论
A
S
A
S
丁二烯
A
A
S
S
环丁烯
1,3-丁二烯对旋环化为环丁烯的能级相关图
第18页/共62页
三、 电环化反应的理论解释
1952年他首先提出二茂铁的夹心式结构,这在当时是很难想象的。他参加 测定过青霉素、马钱子碱、土霉素和金霉素等有机化合物的结构,并 合成了奎宁、胆甾醇、皮质酮、马钱子碱、利血平、叶绿素、四环素、 维生素B12等,这些合成工作代表了当今有机合成的最高水平,特别 是维生素B12的合成是有划时代意义的。在有机化学理论方面,1965 年他和量子化学家霍夫曼合作发表分子轨道对称守恒原理。这是近几 十年来化学理论方面的最大成就,对有机合成有重要的指导作用。 1965年因在有机合成上的重大贡献,荣获诺贝尔化学奖。他毕生致力 于有机化学的教学与研究,他工作作风严谨,是个不知疲倦的科学探 索者。他在哈佛大学执教四十余年,共培养研究生和进修生500多人, 其中许多已成为世界闻名的化学家。
3. 芳香过渡态理论
二十世纪六十年代后期M. J. S. Dewar和H. E. Zimmerman提 出了芳香过渡态理论。芳香过渡态理论认为,一个协同反应能形成 具有芳香性的过渡态,则可在加热条件下顺利进行;如果是光照条 件下的协同反应,则通过反芳香性过渡态的激发态的形式进行。
第26页/共62页
丁二烯的π分子轨道图形
三、 电环化反应的理论解释
1. 能级相关理论
S
A
S
A
丁二烯
A
S
A
S
环丁烯
1,3-丁二烯顺旋环化为环丁烯的能级相关图
第17页/共62页
三、 电环化反应的理论解释
1. 能级相关理论
A
S
A
S
丁二烯
A
A
S
S
环丁烯
1,3-丁二烯对旋环化为环丁烯的能级相关图
第18页/共62页
三、 电环化反应的理论解释
1952年他首先提出二茂铁的夹心式结构,这在当时是很难想象的。他参加 测定过青霉素、马钱子碱、土霉素和金霉素等有机化合物的结构,并 合成了奎宁、胆甾醇、皮质酮、马钱子碱、利血平、叶绿素、四环素、 维生素B12等,这些合成工作代表了当今有机合成的最高水平,特别 是维生素B12的合成是有划时代意义的。在有机化学理论方面,1965 年他和量子化学家霍夫曼合作发表分子轨道对称守恒原理。这是近几 十年来化学理论方面的最大成就,对有机合成有重要的指导作用。 1965年因在有机合成上的重大贡献,荣获诺贝尔化学奖。他毕生致力 于有机化学的教学与研究,他工作作风严谨,是个不知疲倦的科学探 索者。他在哈佛大学执教四十余年,共培养研究生和进修生500多人, 其中许多已成为世界闻名的化学家。
3. 芳香过渡态理论
二十世纪六十年代后期M. J. S. Dewar和H. E. Zimmerman提 出了芳香过渡态理论。芳香过渡态理论认为,一个协同反应能形成 具有芳香性的过渡态,则可在加热条件下顺利进行;如果是光照条 件下的协同反应,则通过反芳香性过渡态的激发态的形式进行。
第26页/共62页
丁二烯的π分子轨道图形
沈阳药科大学有机化学

没有电荷分离的极限式较稳定ch较稳定的极限式较不稳定的极限式两个电荷分离的极限式电负性强的带负电荷的稳定chnnchnn较稳定的极限式具有能量完全相等的极限式时特别稳定ch12加成与14加成chbrbr冰醋酸12加成14加成chclhcl12加成14加成亲电试剂溴加到c1和c4上即共轭体系的两端双键移到中间称14加成或共轭加成
C2H5
C2H5
CC
H
H
顺式加氢
用林德拉催化剂还原的特点是顺式加氢
用碱金属在液氨中还原
反应式
R-C C-R' Na, NH3
R
H
H C C R'
反应机理 R-C C-R'
_
R C C R'
NH3
R H CC
e- R
R'
H
CC
NH3 R
H
R'
H C C R'
相当于反式
反式的烯基负 离子较稳定
加氢,生成 反式烯烃
2. 伯卤代烷与炔钠反应
HC CH NaNH2
C3H7Br HC CNa
CCH2CH3 C3H7C CH
HC CH NaNH2
HC CNa C2H5Br C2H5C CH
NaNH2 C2H5C C Na CH3Br C2H5C CCH3
第二节 二烯烃(dienes)
(一)分类和命名
含有两个双键的碳氢化合物称为双烯烃或二烯烃。
说明
*1 钠的液氨溶液的制备
Na + NH3(l) 低温
Li ,K C2H5NH2
Na + + e- (N蓝电H色子3是引) 溶起的剂。化 蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
C2H5
C2H5
CC
H
H
顺式加氢
用林德拉催化剂还原的特点是顺式加氢
用碱金属在液氨中还原
反应式
R-C C-R' Na, NH3
R
H
H C C R'
反应机理 R-C C-R'
_
R C C R'
NH3
R H CC
e- R
R'
H
CC
NH3 R
H
R'
H C C R'
相当于反式
反式的烯基负 离子较稳定
加氢,生成 反式烯烃
2. 伯卤代烷与炔钠反应
HC CH NaNH2
C3H7Br HC CNa
CCH2CH3 C3H7C CH
HC CH NaNH2
HC CNa C2H5Br C2H5C CH
NaNH2 C2H5C C Na CH3Br C2H5C CCH3
第二节 二烯烃(dienes)
(一)分类和命名
含有两个双键的碳氢化合物称为双烯烃或二烯烃。
说明
*1 钠的液氨溶液的制备
Na + NH3(l) 低温
Li ,K C2H5NH2
Na + + e- (N蓝电H色子3是引) 溶起的剂。化 蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
沈阳药科大学有机化学课程

OH R C R'
R'
R'
如何控制至酮?
* 利用酰氯羰基的活性 * 利用反应中间体 A 的一定的稳定性
(2) 与 R2Cd 和 与 R2CuLi (不活泼金属试剂)的反应
O R C Cl
R'2Cd
H2O
R'2CuLi
H2O
O R C R'
O R C R'
or
O R C OR'
R'2Cd or R'2CuLi
R CO CR
R C NHR' + R C OHNEt3
Et3N or其它 叔胺
• 酰氯和酸酐的胺解是制备酰胺的主要方法 • 比较: 直接由羧酸制备酰胺
O
O
R'NH2
R C OH
R C ONH3R'
- H2O
O R C NHR'
反应产率较差
例:
Ar NH2
CH3COCl or (CH3CO)2O
Ar NHCOCH3 氨基的保护
NC(CH2)4CN
3-Methylpentanenitrile 2-Cyanobutanoic acid 1,6-Hexanedinitrile
普通命名法:
-甲基戊腈 IUPAC 命名法:
3-甲基戊腈
-氰基丁酸 2-氰基丁酸
己二腈 己二腈
第二节 羧酸衍生物的物理性质
低级的酰氯和酸酐是有刺鼻气味的液体,高级的为固体; 低级的酯具有芳香的气味,可作为香料;十四碳酸以下 的甲酯和乙酯均为液体; 酰胺除甲酰胺外,由于分子内形成氢键,均是固体; 而当酰胺的氮上有取代基时为液体; 羧酸衍生物可溶于有机溶剂; 酰氯和酸酐不溶于水,低级的遇水分解; 酯在水中溶解度很小; 低级酰胺可溶于水。
沈阳药科大学有机化学

+ + N 2 O+ H N 2 O H 4 -SO N 2+ O H 2 S 4O
3.磺化反应
O δ +δSO δ
O
δ
+H S3 -OH4 -SO
S3 -O H 3 O +
( - H 2 O )
S3 H O
之所以认为SO3是磺化剂,是因为苯用浓H2SO4磺化,反应 很慢,而用发烟H2SO4(含10%的SO3)磺化,反应在室温下 即可进行。
C6H5-G(m) 邻,对
反应的速控步骤是形成 -络合物,该步过渡态 的能量与-络合物较接 近,-络合物越稳定, 活化能越低。所以, 可以通过判别-络合物 的稳定性来判别速度的 快慢和定位效应。
势
过渡态
能
E
+
H
+ E+
医学ppt
E
反应进程
35
N O 2 H
+E
硝基苯的情况分析
N O 2 H E
+
N O 2 H
31
+ HNO3 (浓) + H2S O4(浓) 1 :1
55-60oC 98%
NO2
N O 2 95oC
+H N O 3( 发 烟 ) + H 2S4 O ( 浓 )
NO2 NO2
+
NO2
NO2
+
NO2
NO2
6%
93%
1%
医学ppt
32
C H 3
+H N O 3( 浓 )+H 2S4 O ( 浓 )
所以,可以根据取代基的电子效应来 判断它们的分类情况。
沈阳药科大学-有机化学 ln

2020/6/5
维生素B12
2020/6/5
维生素B12
Ferrocene is the organometallic compound with the formula Fe(C5H5)2.
2020/6/5
第一章 绪 论
§1-1 有机化学和有机化合物 二、有机化学的产生与发展(续)
有机化学正在成为是一门迅速发展的学科,其分支学科 有:天然有机化学,有机合成化学,生物有机化学,金属有 机化学(元素有机化学),物理 有机化学(理论有机化学), 有机分析化学,有机立体化学等。
2020/6/5
第一章 绪 论
§1-2 有机化学结构理论 三、现代共价键理论(续)2. 价键法(VB)+1s
1s
2p 1s +
分子轨道
2p
1s
+
2020/6/5
氢分子
2p + 1s
第一章 绪 论
§1-2 有机化学结构理论 三、现代共价键理论(续)
3. 杂化轨道理论 • Pauling于20世纪30年代提出杂化轨道理论。 • 基本要点: (1) 原子在成键时,可以变成激发态;而且能量相近的原 子轨道可以重新组合形成新的原子轨道,既杂化轨道。 (2) 杂化轨道的数目等于参加杂化的原子轨道的数目。 (3) 杂化轨道的方向性更强,成键能力更大。
2. 截止到2008年3月2日21:41:37,美国《化学 文摘》社已经登录的化合物的数量为34,062,816 种,最新化合物登记号码为 1006104-32-0。
3. 截止到2009年2月28日09:54:25,美国《化学 文摘》社已经登录的化合物的数量为43,650,433
2020/6/5 种,最新化合物登记号码为 1112527-79-3。
沈阳药科大学有机化学教学大纲(适用于药学专业的)★

掌握旋光度α、比旋光度[α]、手性分子,对映体、非对映体、内消旋 体和外消旋体的概念;含一个手性碳的光学异构,手性分子的旋光性、手性分 子的表示方法、费歇尔投影式;用 D/L 和 R/S 标示构型的次序规则。含二个 手性碳的光学异构和构型的标示。
熟悉绝对构型、相对构型、赤型、苏型和差向异构的概念。 了解含更多个手性碳的光学异构,外消旋体拆分,烷烃卤代反应中手性分 子的立体化学。
掌握苯的结构和表示法,芳香大π键及苯的稳定性;苯及其同系物的命 名;苯环上的亲电取代反应:卤代、硝化、磺化和傅-克反应;苯环侧链的卤代 和氧化反应;苯环亲电取代反应的历程,定位规律和应用;芳卤烃卤原子的稳 定性及其原因。
了解苯环的加成反应;芳卤烃的亲核取代;苯炔。
二、 多环芳烃
[基本内容] 萘及其衍生物的结构、同分异构和命名。萘的化学反应。蒽和菲的结构。
《有机化学》教学大纲
课程编码:化-0202-基 适用对象:药学类各专业
一、前言
《有机化学》是研究各类有机化合物的结构、性质、相互转化及其规律的一 门学科。生命的运动从分子水平上来说就是有机化合物的运动,因此有机化学 与生命现象,有着密切关系。
本课程要求学生掌握有机化合物(不含杂环、糖类、萜类和甾体化合物) 的结构、命名、性质、官能团化合物之间的相互转换及其规律和立体化学特 征,熟悉典型的有机化学反应历程和有机化学研究的一般方法。了解各类代表 性有机化合物及其应用。实验课要求掌握有机化学基本操作技能,官能团的性 质和典型有机化学反应。熟悉常规仪器的使用。
第九章 醇、酚和醚
(10 学时)
一、 醇
[基本内容] 醇的结构、分类、命名和来源。 物理性质:结构和沸点、水溶解度的关系,氢键的影响。 化学性质:取代反应,羟基氢的酸性,金属和酸的反应。羟基的取代,与
熟悉绝对构型、相对构型、赤型、苏型和差向异构的概念。 了解含更多个手性碳的光学异构,外消旋体拆分,烷烃卤代反应中手性分 子的立体化学。
掌握苯的结构和表示法,芳香大π键及苯的稳定性;苯及其同系物的命 名;苯环上的亲电取代反应:卤代、硝化、磺化和傅-克反应;苯环侧链的卤代 和氧化反应;苯环亲电取代反应的历程,定位规律和应用;芳卤烃卤原子的稳 定性及其原因。
了解苯环的加成反应;芳卤烃的亲核取代;苯炔。
二、 多环芳烃
[基本内容] 萘及其衍生物的结构、同分异构和命名。萘的化学反应。蒽和菲的结构。
《有机化学》教学大纲
课程编码:化-0202-基 适用对象:药学类各专业
一、前言
《有机化学》是研究各类有机化合物的结构、性质、相互转化及其规律的一 门学科。生命的运动从分子水平上来说就是有机化合物的运动,因此有机化学 与生命现象,有着密切关系。
本课程要求学生掌握有机化合物(不含杂环、糖类、萜类和甾体化合物) 的结构、命名、性质、官能团化合物之间的相互转换及其规律和立体化学特 征,熟悉典型的有机化学反应历程和有机化学研究的一般方法。了解各类代表 性有机化合物及其应用。实验课要求掌握有机化学基本操作技能,官能团的性 质和典型有机化学反应。熟悉常规仪器的使用。
第九章 醇、酚和醚
(10 学时)
一、 醇
[基本内容] 醇的结构、分类、命名和来源。 物理性质:结构和沸点、水溶解度的关系,氢键的影响。 化学性质:取代反应,羟基氢的酸性,金属和酸的反应。羟基的取代,与
沈阳药科大学高等有机化学课件(胡春版)——第四章 芳香性

+ +
ph
O
O
+
+
.
ph
BF4-
ph
Cl
SbF5, SO2
+ +
-75oC,
-2Cl
离子体系的芳香性
CH3 CH3 CH3 Cl Cl CH3
CH3
SbF5, SO2 -75oC, -2Cl-
CH3 ++
+ 2SbF5Cl
CH3
CH3
..
Na -H2
+
Na+
O
_
2
_
+
FeCl2
Fe
2+ +
_
CH3COCl FeCl3 Fe
化学家Willstatter历时八年(19031911年),以伪石榴碱为原料经12步 反应,合成了一克多环辛四烯。
[10]轮烯,环癸五烯,无芳香性。
因环内氢的作用,发生了扭曲非 平面。
H H
[14]轮烯,14个π电子 ,无芳香性。 因环内氢的作用,发生了扭曲非平面。
HH HH
[18]轮烯,18个π电子,符合4n+2规则。经 X-射线衍射,环中碳碳键长几乎相等。整 个分子基本是处于同一平面上,说明了轮 烯内氢原子的排斥力是很微弱的,具有一 定芳香性。
2+
CCH3
_
_
H H
+ Ph3C+Br夺取负氢离子
+
Br-
AgNO3
+
+ AgBr
环庚三烯正离子 1891年合成
7 6
H O 1 2 O
O +
ph
O
O
+
+
.
ph
BF4-
ph
Cl
SbF5, SO2
+ +
-75oC,
-2Cl
离子体系的芳香性
CH3 CH3 CH3 Cl Cl CH3
CH3
SbF5, SO2 -75oC, -2Cl-
CH3 ++
+ 2SbF5Cl
CH3
CH3
..
Na -H2
+
Na+
O
_
2
_
+
FeCl2
Fe
2+ +
_
CH3COCl FeCl3 Fe
化学家Willstatter历时八年(19031911年),以伪石榴碱为原料经12步 反应,合成了一克多环辛四烯。
[10]轮烯,环癸五烯,无芳香性。
因环内氢的作用,发生了扭曲非 平面。
H H
[14]轮烯,14个π电子 ,无芳香性。 因环内氢的作用,发生了扭曲非平面。
HH HH
[18]轮烯,18个π电子,符合4n+2规则。经 X-射线衍射,环中碳碳键长几乎相等。整 个分子基本是处于同一平面上,说明了轮 烯内氢原子的排斥力是很微弱的,具有一 定芳香性。
2+
CCH3
_
_
H H
+ Ph3C+Br夺取负氢离子
+
Br-
AgNO3
+
+ AgBr
环庚三烯正离子 1891年合成
7 6
H O 1 2 O
O +
沈阳药科大学高等有机化学课件(胡春版)——第三章 有机反应总论

三、反应机理的研究方法 3. 同位素标记
在机理研究中常常用同位素效应和同位数标记来 确定反应历程。
三、反应机理的研究方法 3. 同位素标记
(1)同位素效应
最常用的是用氘来代替氕,当反应底物中的 一个原子被它的同位素取代后,对它的化学反应 性没有影响,但反应速度有显著的影响。同位素 效应分一级同位素效应和二级同位素效应。 一级同位素效应:在决定速度步骤中与同位 素直接相连的键发生断裂的反应中所观察到的效 应, 其值通常在KH/KD 为2或更高。 二级同位素效应:在反应中与同位素直接相 连的键不发生变化,而是分子中其它化学键变化 所观察到的效应,其值通常在KH/KD = 0.7-1.5范 围内。
N
CN
-
-
O
+
O C-
O N
O C N H
N
hydrolysis ( NH
3
)
H OH O H
+
O H C O
-
N
O C
N O
O hydrolysis COOH + NO 2
-
an acyl nit rit e
Rosenblum Observations (1960)
Observation I: Inst ead of nit rite, molecular nit rogen was a by-product of t he von Richt er reaction. Apparent ly, in t he 1871 von Richt er paper, nitrit e had never been demonstrated to be a by-product. It had been deduced based on stoichiometry considerations. In t he revised Bunnet t mechanism, amm onia and nit rit e are stipulat ed by-products of the von Richter reaction. Ammonia and nit rit e can react t o form ammonium nitrit e which, upon heat ing, decom poses t o give molecular nitrogen and wat er. NH 3 t o an on-going von Richt er reaction, Upon addit ion of t he only molecular nit rogen obt ained contained no nitrogen-15! If t he revised Bunnet t mechanism were correct , the added NH 3 and the expelled NO 2 (from t he last st ep) should have produced N
沈阳药科大学高等有机化学课件(胡春版)——第四章 芳香性

沈阳药科大学
芳香性
1. 芳香性定义
2. 芳香性的描述
3. 芳香性的实验判据
4. 轮烯的芳香性
5. 离子体系的芳香性
6. 稠环体系的芳香性
7. 同芳性
8. Y芳性
引言
由于苯具有香味且最初是从苯甲酸脱羧制得, 而苯甲酸是从天然安息香胶得到的,故出现了芳香 化合物这个名词。随着人们对于芳香化合物的认识 的不断深入,芳香化合物的范围日益扩大,由苯系 化合物扩充到非苯系化合物:由中性分子扩充到离 子,由碳环化合物扩充到含杂原子的环状有机物, 乃至不含碳的无机环化合物。而对于芳香性这个名 词的理解也逐步从化学性质转向物理性质,从朴素 直观走向本质深入。
芳香性的定义
随着量子力学在化学中的应用,进一步从结构上揭开了芳 香性的秘密。在芳香烃分子的芳环上,每个碳原子都以SP2杂 化轨道相互交盖,构成环状平面,处在同一个环平面上的每个 碳原子还剩下一个未杂化的P轨道,这些P轨道轴相互平行,于 是相互间发生交盖重叠,形成“芳香大π 键”,所有的π 电子 成为环绕整个环平面运动的电子流,完全失去了它们的定域性 。这种芳香大π 键又称为非定域键(离域键)。由于π 电子离 域的结果,导致体系能量降低,热稳定性增加,键长趋于平均 化,芳环上所有碳碳键都完全相同,键长也完全相等( 0.139nm),它们既不是一般的碳碳单键(0.154nm),也不是 一般的碳碳双键(0.133nm),而是每个碳碳键都具有这种闭 合大π 键的特殊性质,在核磁共振光谱上表现出较大的化学位 移(δ 值)。目前人们将芳香性跟分子能量较低这个性质联系 起来。人们一直将芳香性化合物所具有特殊的结构稳定性归结 于电子的离域作用,但这种离域作用并不能使共轭多烯有明显 的芳香性。
芳香性的定义
沈阳药科大学高等有机化学课件(胡春版)——第二章 立体化学
31
§2.3 旋光异构
七、不对称合成
术语“不对称合成”在1894年首次由E.Fischer提出,其后被 Marckwald定义为“从对称构造的化合物产生光学活性物质的反 应,使用光学活性材料作为中间体,但不包括使用任何分析过 程作为手段”。 接着Morrison和Mosher提出了一个广义的定义,将不对称合成 定义为“一种反应,其中底物分子整体中的非手性部分经过反 应试剂作用,不等量地生成立体异构体产物的手性单元。也就 是说,不对称合成是这样一个过程,它将潜手性单元转化为手 性单元,使得产生不等量的立体异构产物。最早的不对称反应 实例可以追溯到1890年。当时,E.Fischer将L—阿拉伯糖和 HCN进行羟腈化反应,得到多一个碳的腈化合物,然后经腈水 解,得到3:1量的L—甘露糖酸和L—葡萄糖酸。这证明了从不 对称的化合物(手性源化合物)出发进行的反应,其反应可按不对 称的方式发生。
41
化 合 物 杂原子取代物 CH3—SiH3 CH3—NH2 CH3—NHCH3 CH3—OH CH3—OCH3
旋 转 能 障(KJ/mol)
7.1 8.3 15.1 4.5 11.3
42
邻位交叉效应:
若只从范德华排斥作用考虑,对位交叉 式构象Ⅰ应占优势,但事实上却是邻位 交叉式构象Ⅱ占优势。有人认为Ⅱ中有 氢键生成产生的稳定作用,但这种解释 尚难以被普遍接受。2-氟乙醇和1,2-二 氟乙烷等几乎全以邻位交叉式构象存在, 后者并不能形成分子内氢键。将这种有 利于形成邻位交叉式优势构象为优势构 象的效应称为邻位交叉效应。
10
§2.3 旋光异构
二、旋光谱和圆二色谱
许多有机化合物具有光学活性,能使偏振光的偏 振平面发生旋转,这种现象称为旋光。化合物的 旋光度和光的波长有关,亦即一个化合物的比旋 度随着波长而改变。测定在紫外及可见光(200700nm)内的旋光,然后将比旋度对波长作图, 所得的谱线即旋光谱。
沈阳药科大学生物化学课件——第3章 酶

目录
五、抑制剂对反应速度的影响
酶的抑制剂(inhibitor)
整理得:
([Et]-[ES])[S] [ES]
= K2+K3 K1
(2)
令:
K2+K3 = Km (米氏常数) K1
则(2)变为: ([Et]-[ES]) [S] =Km [ES]
目录
整理得:
[ES]=[─Et─][─S]
(3)
Km + [S]
将(3)代入(1) 得
V=─KK─3m[─E+─t][[SS]]
目录
第一节
酶的分子结构与功能
The Molecular Structure and Function of Enzyme
目录
酶的不同形式
单体酶(monomeric enzyme):仅具有三级结 构的酶。
寡聚酶(oligomeric enzyme):由多个相同或 不同亚基以非共价键连接组成的酶。
FAD(黄素腺嘌呤二核苷酸)
醛基
TPP(焦磷酸硫胺素)
酰基
辅酶A(CoA)
硫辛酸
烷基
钴胺素辅酶类
二氧化碳
生物素
氨基
磷酸吡哆醛
甲基、甲烯基、 四氢叶酸
甲炔基、甲酰基
等一碳单位
尼克酰胺(维生素PP之一)
尼克酰胺(维生素PP之一)
维生素B2 (核黄素) 维生素B2 (核黄素) 维生素B1(硫胺素) 泛酸 硫辛酸 维生素B12 生物素 吡哆醛(维生素B6之一) 叶酸
E+S
k1 ES k3 E + P
k2
中间产物
目录
※1913年Michaelis和Menten提出反应速度与底
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3-2 反应机理及其研究方法
一、什么是反应机理?
反应机理,又称反应历程,反应物通过化学 反应形成产物所经历的全部途径和过程。
3-2 反应机理及其研究方法
二、反应机理的一般研究步骤
对一个反应提出理论假设:在已有实验事 实基础上并与现有理论相符; 设计并进行实验,检验假设; 如果新的实验结果与假设相符,在假设中 所有可供检验因素均已被实验证实后,对 假设作出推断,可作为该反应的机理;显 然该机理要能解释得到的所有产物及其有 关性质,包括由副反应形成的产物在内。 如果新的实验结果与假设不符,可重新提 出假设。
3. 同位素标记
(1)同位素效应
过渡态 Δ GH ≠ Δ GD ≠
R R
H D
一级动力学同位素效应氕取代和氘取代的零点振动能
3. 同位素标记
CHCH3
+
CH2
CCH2CH3 CH3
三、反应机理的研究方法 1. 反应产物和副产物的鉴定
例3:von Richter反应
The von Richter Reaction: A Case History
In 1871, von Richt er reported t he following observat ions: NO 2 KCN EtO H/H 2 O reflux COOH + KNO 2
三、反应机理的研究方法 2. 反应活性中间体的研究
(1)反应活性中间体的分离 在反应活性中间体具有一定的稳定 性,可在低温下或其它可控制的条 件下使反应停留在中间体阶段一定 时间而不立即变为产物,以适当的 手段将中间体分离出来。
CF3 NO2F, BF3
CF3
+
CF3 BF4H NO2 > -50℃ NO2
Z
NO 2
KCN EtO H/H 2 O reflux Z
COOH + " acidic tars" + KNO 2
5%-50% yields Based on the above: 1. Direct displacement of t he nit ro group is eliminat ed from consideration. 2. A benzyne int ermediate is ruled out . In t he case of para-subst itut ed nitrobenzenes, benzyne interm ediat es would give bot h met a- and para-subst it ut ed benzoic acids.
CN COOH N2 + H 2O COOH
Supporting Evidence for the Rosenblum Mechanism
Ullman & Bartkus (1962): NH NH C O hydrazide P b(OAc)4 C O diazene N N KCN EtO H/H 2 O reflux COOH + N2
N
CN
-
-
O
+
O C O
-
-
O N
O C O
-
O N
O C N H
N
hydrolysis ( NH
3
)
H OH O H
+
O H C O
-
N
O C
N O
O hydrolysis COOH + NO 2
-
an acyl nit rit e
Rosenblum Observations (1960)
Observation I: Inst ead of nit rite, molecular nit rogen was a by-product of t he von Richt er reaction. Apparent ly, in t he 1871 von Richt er paper, nitrit e had never been demonstrated to be a by-product. It had been deduced based on stoichiometry considerations. In t he revised Bunnet t mechanism, amm onia and nit rit e are stipulat ed by-products of the von Richter reaction. Ammonia and nit rit e can react t o form ammonium nitrit e which, upon heat ing, decom poses t o give molecular nitrogen and wat er. NH 3 t o an on-going von Richt er reaction, Upon addit ion of t he only molecular nit rogen obt ained contained no nitrogen-15! If t he revised Bunnet t mechanism were correct , the added NH 3 and the expelled NO 2 (from t he last st ep) should have produced N
三、反应机理的研究方法 1. 反应产物和副产物的鉴定
对反应提出的任何一个机理,显然要能 解释得到的所有产物及其有关性质,包括由 副反应形成的产物在内。
三、反应机理的研究方法 1. 反应产物和副产物的鉴定
例1:Gomberg 1900年认为Ph3C. 自由基所 形成的无色二聚体为Ph3C-C Ph3,直到1968 年Lanhamp采用NMR和UV-Vis技术确定了 该二聚体的结构。
Accepted Mechanism for the von Richter Reaction
-
O
+
O
-
O
+
O
-
-
O
+
O C NH H CN -
-
O N
N + CN
-
N C N H H OH
N
O C NH
O N N C O H H 2O H 2O OH N N C O HO N NH C O HO H N O C NH
von Richter Reaction: Bunnett Mechanism (1954)
In 1954, Bunnett et al. proposed the following mechanism t o account for the known facts pert aining t o the von Richter react ion: H Z NO 2 + CN H OH Z H CN NO 2
14 15 15
P oint of Interest:
However:
15
N.
Observation II: COOH
15
Cl
NO 2
KCN EtO H/H 2 O reflux
Cl
+
15
N
14
N
Conclusion:
One nit rogen at om must come from the nit ro group, and t he second must com e from t he cyano group!
三、反应机理的研究方法 1. 反应产物和副产物的鉴定
例2:
(CH3)3CCH2Br
+
C2H5ONa
C2H5OH 55℃
(CH3)3CCH2OC2H5
+
NaBr
(CH3)3CCH2Br
+
H2O
C2H5OH 95℃
(CH3)2CCH2CH3 OH
+
+
(CH3)2CCH2CH3 OC2H5
(CH3)2C
Question:
W hat can one conclude from t he above observat ions?
von Richter Reaction: Revised Bunnett Mechanism
-
O
+
O
-
O
+
O
-
-
O
+
O C N H H
N + CN -
N C N H H OH
Cl
NaNH2
NH3
NH2
O
O
Br+ CH2 CH2 Br2 H2C CH2 ClBrCH2CH2Cl NO3BrCH2CH2ห้องสมุดไป่ตู้NO2 BrCH2CH2Br
三、反应机理的研究方法 2. 反应活性中间体的研究
(4)可疑反应活性中间体的否定 对于可疑的活性中间体,若能用其他 方法得到,那么在同样条件下应该得 到同样的产物,这种方法可以提供结 论性的否定证据:如果得不到同一产 物,既可以断定可疑中间体并非反应 活性中间体;但是若得到了同一产物, 还或许是巧合产生的,故不能作为结 论性证明。
Ibne-Rasa & Koubek (1963): NH 2 C NH 2 O
N RCO 3 H O C NH 2 O o-nitrosobenzamide
KCN EtO H/H 2 O reflux COOH
+
N2
三、反应机理的研究方法 2. 反应活性中间体的研究
在许多反应过程中会出现一个或多 个反应活性中间体,它们稳定性是 不同的,有的可以分离,大多数中 间体非常活泼,无法分离。中间体 的确认,可为反应机理提供最有力 的证据。
