树突状细胞
树突状细胞

谢谢观看
DC与肿瘤的发生、发展有着密切关系,大部分实体瘤内浸润的DC数量多则患者预后好。有效的抗肿瘤免疫反 应的核心是产生以CD8+ T细胞为主体的细胞免疫应答,这也是DC作为免疫治疗手段的基础。
树突状细胞(17张)DC抗肿瘤的机制如下:①DC可以高表达MHC-Ⅰ类和MHC-Ⅱ类分子,MHC分子与其捕获加工 的肿瘤抗原结合,形成肽-MHC分子复合物,并递呈给T细胞,从而启动MHC-I类限制性CTL反应和MHC-Ⅱ类限制性 的CD4+ Thl反应。同时,DC还通过其高表达的共刺激分子(CD80/B7-1、CD86/B7-2、CD40等)提供T细胞活化所 必须的第二信号,启动了免疫应答。②DC与T细胞结合可大量分泌IL-12、IL-18激活T细胞增殖,诱导CTL生成, 主导Th1型免疫应答,利于肿瘤清除;激活穿孔素P颗粒酶B和FasL/Fas介导的途径增强NK细胞毒作用;③DC分泌 趋化因子(Chemotactic Cytokines, CCK)专一趋化初始型T细胞促进T细胞聚集,增强了T细胞的激发。保持效 应T细胞在肿瘤部位长期存在,可能通过释放某些抗血管生成物质(如IL-12、IFN-γ)及前血管生成因子而影响肿 瘤血管的形成。
树突状细胞
血液细胞
01 简介
03 来源 05 荣誉
目录
02 分布 04 功能
树突状细胞(也称DC细胞)是由加拿大学者Steinman于1973年发现的,是功能最强的抗原提呈细胞,因其成 熟时伸出许多树突样或伪足样突起而得名。
树突状细胞

树突状细胞的生物学功能的研究进展树突状细胞(dendritic cells,DC)是目前人体内最活跃,功能最强大的专职抗原呈递细胞,是人体对免疫原产生免疫应答的重要细胞之一。
DC 广泛存在于血液、淋巴、肝脾及皮肤黏膜等组织,能激活功能性淋巴细胞,并产生细胞毒作用,提高机体免疫水平。
DC对抗原和弱抗原都有很高的呈递效率,只需少量的抗原及DC即可激活T细胞,因此成为抗肿瘤和抗病毒免疫研究中的热点。
1DC的来源与分化发育DC 的产生分两个阶段:从祖细胞分化为未成熟DC和未成熟DC受外界刺激( 如细菌产物、坏死物及及各种细胞因子) 分化成熟。
1.1DC的分化体内DC 起源于多能造血干细胞,按来源其分化途径分为两条: ①髓系分化途径。
称为髓系DC( myebiod,DC1) ,最终分化为朗格汉斯细胞和间质DC两个亚群。
DC1 由髓样干细胞在粒细胞巨噬细胞集落刺激因子( granulocyte-macrophagecolony stimulati ng factor,GM-CSF) 、肿瘤坏死因子α刺激下诱生为DC。
亦有来源于外周血单核细胞,也称为DC1 前体细胞,在GM-CSF、白细胞介素4( interleukin-4,IL-4) 作用下或穿越内皮细胞并吞噬异物后分化为DC。
②淋巴系分化途径。
为淋巴系DC( lymphoid,DC2) ,最终分化为类浆细胞DC。
DC2 的前体细胞不表达髓系抗原,也无吞噬、吞饮抗原能力,低表达GM-CSF,高表达IL-3 受体,在IL-3 刺激下分化为DC2。
目前对DC 亚群及分化的研究主要来源于体外培养的方法,体内天然DC 亚群的分类仍有待于进一步研究[1]。
1.2DC的表型变化DC的发育分为成熟与未成熟阶段,两者具有不同的生物学特征和细胞表型。
正常情况下,体内多数DC 处于未成熟阶段,其广泛分布于全身各外周组织,高表达吞噬相关受体( Fc 受体、补体受体、甘露糖受体) ,而不表达或低表达共刺激分子和黏附分子( CD14、CD54、CD40、CD80) 。
血液肿瘤树突状细胞

02
血液肿瘤树突状细胞的生物学 特性
形态结构
细胞形态
血液肿瘤树突状细胞具有典型的 树突状形态,细胞表面有许多细 长的突起。
细胞大小
血液肿瘤树突状细胞的大小通常 比其他类型的白细胞大,直径在 10-20微米之间。
表面标志
CD抗原
血液肿瘤树突状细胞表面表达多种CD 抗原,如CD11c、CD123、CD303等 ,这些抗原有助于区分不同类型的树 突状细胞。
血液肿瘤树突状细胞的分类
根据来源分类
根据HTDCs的来源,可分为髓源性树突状细胞(Myeloid Dendritic Cells, MDCs)和淋巴源性树突状细胞( Lymphoid Dendritic Cells, LDCs)。
根据功能分类
根据HTDCs的功能,可分为专职抗原提呈树突状细胞( Antigen Presenting Dendritic Cells, APCs)和其他具有辅 助功能的树突状细胞(如调节性树突状细胞等)。
细胞疗法
02
探讨利用改造后的血液肿瘤树突状细胞作为载体,输送治疗性
基因或药物,以直接针对肿瘤细胞进行治疗。
疫苗开发
03
研究血液肿瘤树突状细胞在肿瘤抗原呈递中的作用,以开发基
于这些细胞的肿瘤疫苗。
THANKS
谢谢您的观看
疫应答。
02
促进免疫抑制性细胞因子分泌
血液肿瘤树突状细胞能够促进免疫抑制性细胞因子的分泌,如IL-10、
TGF-β等,进一步抑制机体对肿瘤的免疫应答。
03
促进肿瘤细胞的免疫逃逸
血液肿瘤树突状细胞能够促进肿瘤细胞的免疫逃逸,使肿瘤细胞能够逃
避机体的免疫攻击。
血液肿瘤树突状细胞与肿瘤免疫治疗的关系
2.树突状细胞 Microsoft PowerPoint 演示文稿 (2)

共同特征 * 形态上呈树突状 * 高表达 高表达MHC-II类抗原和多种粘附分子 类抗原和多种粘附分子 * 胞浆内存在特异性 胞浆内存在特异性Birbeck颗粒状结构 颗粒状结构 * 吞噬功能较低 * 可有效诱导静息 细胞活化 可有效诱导静息T细胞活化
2、分布与分类 、
广泛分布于脑以外的全身组织和脏器. 广泛分布于脑以外的全身组织和脏器 * 淋巴样组织中的 淋巴样组织中的DC: FDC、 IDC 、TDC; 、 ; * 非淋巴样组织中的 :包括 、 间质 ; 非淋巴样组织中的DC:包括LC、 间质DC * 循环 。 循环DC。
分布
• 脑以外的全身各脏器。 脑以外的全身各脏器。 • 淋巴样组织中的DC——并指状DC(interdigitating 淋巴样组织中的DC 并指状DC( DC 并指状DC IDC) 位 淋巴组T细胞区边缘区DC DC。 cell IDC)—位 淋巴组T细胞区边缘区DC。 • 非淋巴样组织中的DC 间质性DC, 非淋巴样组织中的DC——间质性DC, DC 间质性DC • 朗格汉斯细胞 ( Langerhans cell LC ) —移至淋 朗格汉斯细胞( LC) 移至淋 巴结高表达MHCⅠ 分子和Ⅱ 类分子缺乏FcR CR不 MHCⅠ分子和 FcR, 巴结高表达 MHCⅠ 分子和 Ⅱ 类分子缺乏 FcR , CR 不 成熟DC 高表达FcR CR、MHCⅠ、 DC, FcR, 成熟DC,高表达FcR,CR、MHCⅠ、Ⅱ分子 • BirBeck颗粒的特征性细胞器,可用于LC的鉴定。 BirBeck颗粒的特征性细胞器 可用于LC的鉴定。 颗粒的特征性细胞器, LC的鉴定 体液中的DC 隐蔽细胞和血液DC DC——隐蔽细胞和血液DC。 体液中的DC 隐蔽细胞和血液DC。
树突状细胞的研究进展

利用树突状细胞治疗癌症的研究进展
肿瘤疫苗
利用树突状细胞制备肿瘤疫苗,通过激活机体免疫系统来攻 击肿瘤细胞,是目前癌症免疫治疗的重要研究方向。多项临 床试验已证明肿瘤疫苗在部分癌症治疗中具有一定的疗效。
免疫疗法联合治疗
树突状细胞与其他免疫疗法药物或手段联合使用,如与PD-1 抑制剂、CAR-T细胞疗法等联合,可提高癌症治疗的疗效和 生存率。
伦理问题
关于树突状细胞的研究涉及到 伦理问题,例如从胚胎或干细
胞中提取树突状细胞。
对未来研究的建议与展望
发展新技术
需要发展更先进的技术来分离、培养 和检测树突状细胞,以提高研究的敏 感性和特异性。
深入研究功能
需要进一步深入研究树突状细胞的功 能和异质性,以更好地理解其在免疫 系统中的作用。
促进临床应用
树突状细胞与其他疾病治疗的研究进展
自身免疫性疾病
树突状细胞在自身免疫性疾病中发挥重要作用,研究显示利用树突状细胞治疗 类风湿性关节炎、系统性红斑狼疮等疾病具有一定的疗效。
感染性疾病
树突状细胞在感染性疾病中具有免疫调节作用,研究显示利用树突状细胞治疗 某些细菌感染、真菌感染等疾病具有一定的疗效。
05
树突状细胞与癌症
1 2
癌症免疫逃逸
树突状细胞在癌症免疫逃逸中发挥重要作用,它 们能够通过调节T细胞活性,促进肿瘤生长和扩 散。
肿瘤抗原提呈
树突状细胞能够摄取并加工肿瘤抗原,将其呈递 给T细胞,激活抗肿瘤免疫反应。
3
肿瘤免疫治疗
利用树突状细胞的抗原提呈功能,开发肿瘤免疫 治疗方法,如DC疫苗,以激发机体抗肿瘤免疫 应答。
04
树突状细胞的最新研究成果
树突状细胞在免疫疗法中的应用
树突状细胞简介(共34张PPT)

2. 未成熟期DC
髓系DC在从前体发育为具有强免疫刺激功能的成熟DC的过 程中,需经过一个未成熟阶段,此阶段DC的功能对免疫应答十 分重要。
未成熟DC主要存在于多种器官及非淋巴组织上皮,能表达一 些膜受体如FcRII、甘露糖受体等,介导DC摄取抗原。未成熟 DC也能通过吞饮和吞噬作用摄取抗原。未成熟DC内含有一些重 要的细胞器包括内体、MIIC和溶酶体等,能合成MHC-I类分子 。
IDC是分布于淋巴组织胸腺依赖区和次级淋巴组织中的 重要APC,其表面缺乏FcR和C3bR,但富含MHC-I类和II类抗 原,现认为IDC是由皮肤内朗格汉斯细胞移行至淋巴结衍生 而来的一种细胞。
IDC通过其突起与周围T淋巴细胞密切接触,可有效地将 抗原提呈给特异性T细胞。大多数IDC易发生调亡,为短寿命 ;少量IDC为长寿APC,在维持T细胞的免疫记忆中发挥作用 。
淋巴样DC主要分布于淋巴结、脾脏、粘膜相关组织中的淋巴滤 泡生发中心,主要与B淋巴细胞功能有关。
髓样DC主要分布于T细胞富含区,与T细胞功能有关。按其 分布部位又可分为:
❖ Langhams细胞,主要分布于皮肤和粘膜。 ❖ 间质性DC,分布于心、肺、肝、肾、胃肠道等。
❖ 并指状DC,主要分布于脾脏、淋巴结和胸腺等T细胞富 含区。
疫应答的始动者,在免疫应答的诱导中具有独特的地位。
对DC的研究不仅有助于深刻了解机体免疫应答的调控机制,而且可以 通过调节DC的功能来调节机体的免疫应答,对感染、肿瘤、移植排斥、自 身免疫性疾病的发生机制的认识和防治措施的制定,具有重要意义。
因此,DC在机体免疫应答中的作用及其与某些疾病发生和防治 的关系,正受到高度关注。
1. 前体阶段DC
目前从人胎肝、脐血、骨髓、成人外周血以及小鼠的骨髓 和外周血中均分离出髓系前体,其功能在于产生各种髓系DC。 在体内,这些前体的作用可能是维持非淋巴组织内DC的数量达 到一定水平。
黎衍敏树突状细胞的研究1

鼓励多学科交叉研究,利用其他学科的先进技术和方法,推动黎 衍敏树突状细胞研究的快速发展。
THANKS
感谢观看
,避免不必要的免疫反应。
04
黎衍敏树突状细胞在疾病中的作 用
在自身免疫性疾病中的作用
辅助T细胞分化
树突状细胞能够通过表达特定的 分子,辅助T细胞分化为Th1或 Th2细胞,影响自身免疫性疾病
的发展。
参与炎症反应
树突状细胞在自身免疫性疾病的 炎症反应中发挥重要作用,它们 可以分泌促炎因子,促进炎症的
分类
根据其发育来源和表型,树突状细胞可分为两类:骨髓来源的髓系DCs和淋巴组 织来源的淋巴系DCs。
树突状细胞的功能
01
02
03
抗原呈递
树突状细胞能够摄取并加 工处理抗原,将其呈递给 T细胞,激活适应性免疫 应答。
免疫调节
树突状细胞能够分泌多种 细胞因子和炎症介质,调 节免疫应答的强度和方向 。
诱导免疫耐受
黎衍敏树突状细胞具有抗原提呈作用,能够摄取并加工处理抗原,将抗原信息暴露在细胞表面,供T 细胞识别。
详细描述
在免疫应答中,树突状细胞扮演着关键角色,它们能够高效地摄取和加工处理抗原,将抗原信息暴露 在细胞表面,从而激活T细胞。这种抗原提呈作用是树突状细胞的核心功能之一,有助于触发适应性 免疫应答。
免疫调节作用
其生物学特性。
阐明细胞命运的决定机制
03
解析黎衍敏树突状细胞命运决定的分子机制,为干预其功能提
供理论依据。
探索黎衍敏树突状细胞在疾病治疗中的应用
1 2
开发新的治疗策略
基于对黎衍敏树突状细胞的深入理解,开发新的 治疗策略,为疾病的治疗提供新的思路。
树突状细胞流式标记方案

树突状细胞流式标记方案
树突状细胞是免疫系统中非常重要的细胞类型,它们能够启动和调控
免疫应答。
为了深入研究树突状细胞的功能,我们需要对其进行准确
的鉴定和流式标记。
以下是一个常用的树突状细胞流式标记方案:
1. 细胞表面标记
树突状细胞的细胞表面通常表达CD11c、CD11b、CD103和MHC-II 等标记物。
其中,CD11c是树突状细胞的常见标志,常与其他标记物
结合使用,比如CD11c+ CD8+代表胸腺型树突状细胞,CD11c+
CD11b+代表外周型树突状细胞。
2. 胞浆标记
树突状细胞具有特殊的细胞形态学特征,可以通过荧光染料或抗体进
行标记。
例如,一些标记可用来检测树突状细胞分泌细胞因子的能力,如IL-12、TNF-α和IL-6等。
3. 核标记
核标记用于鉴定树突状细胞的核型形态,常用的核标记包括DAPI、
Propidium iodide (PI)和Hoechst 33342等。
总结起来,树突状细胞流式标记方案需要对细胞表面标记、胞浆标记和核标记进行综合考虑,才能准确的鉴定和分离树突状细胞。
此外,由于树突状细胞具有很强的多样性,所以在流式标记时需要注意选择适当的标记物组合来进行分析。
树突状细胞的临床特点

树突状细胞的临床特点
树突状细胞是一类形状不规则的非单核吞噬系统细胞,特点是胞浆有
许多长突起呈触须状,使整个细胞的形态象一个蜘蛛。
树突状细胞分
散于全身的上皮组织和实质性器官,其细胞数量不超过局部细胞总数
的1%;也可迁移到血液和淋巴,其数量不超过血液有核细胞总数的0.1%.在不同组织中,树突状细胞有不同名称,例如血液中的树突状细胞、
皮肤中的Langerhans细胞、淋巴液中的帆状细胞、外周淋巴器官中胸
腺依赖区的并指状细胞等。
树突状细胞来源于骨髓的前体细胞,与单
核吞噬细胞系统有不同的祖细胞,但是对其发育过程目前尚了解不多。
树突状细胞的吞噬能力较弱,但细胞表面积大,且有丰富的MHCⅡ
类分子,所以捕获抗原和递呈抗原的能力很强。
树突状细胞有运动能力,所以能在体内搜寻罕见的特异性T细胞经递呈抗原,因此树突状细
胞在启动免疫应答方面有重要的意义。
另外,淋巴结皮质区内含有较多的滤泡树突状细胞,这类细胞不
表达MHCⅡ类分子,不能向TH递呈抗原;但富含Fc受体,能够通过结合
抗体以免疫复合物的方式捕获抗原。
所以FDC与B细胞的活化和再次抗
体应答相关。
名词解释dc树突状细胞

名词解释dc树突状细胞
DC树突状细胞是一种极其重要的免疫系统细胞,它是体内专职的抗原提呈细胞,在免疫应答启动和调节过程中扮演关键角色。
树突状细胞因其成熟时形态特征而得名,具有许多分支状突起,类似于神经元的树突,故称“树突状细胞”。
DC细胞广泛分布于身体各组织中,包括皮肤、黏膜、血液以及淋巴器官等,并且它们可以从这些部位捕获抗原(如病原体、肿瘤抗原等)。
一旦吞噬了抗原,DC会将其处理并结合到主要组织相容性复合体分子上,然后迁移至淋巴结,在那里与初始T细胞接触,激活T细胞并指导其分化为效应T细胞或记忆T细胞,从而触发适应性免疫反应。
树突状细胞可以根据其来源和功能进一步细分为不同的亚群,例如髓样DC、淋巴样DC、浆细胞样DC等,每种类型的DC都有独特的生物学特性和功能。
通过研究和利用DC的功能特性,科学家们开发出了DC疫苗等免疫疗法,用于治疗癌症和其他疾病。
医学免疫学课件:树突状细胞
来源于 骨髓
胸腺中 分化
外周 激活
细胞 免疫
20
获得功能 TCR基 性TCR 因重排
获得MHC 限制性识 别能力 阳性选择
CD4-CD8+/ CD4+CD8单阳性细胞(SP)
成熟的 CD4+/CD8+
T细胞 <2%
双阴性细胞(DN)
CD4+CD8+双 阳性细胞(DP)
皮质
建立自身 皮髓质 阴性选择 抗原耐受 交界
4
树突状细胞(dentritic cell, DC医)学免疫学
成熟的DC具有树突样突起
免疫系统中的“哨兵”
5
树突状细胞(dentritic cell, DC医)学免疫学
2011
拉尔夫·马文·斯坦曼 Ralph Marvin Steinman
1943.1-2011.9
6
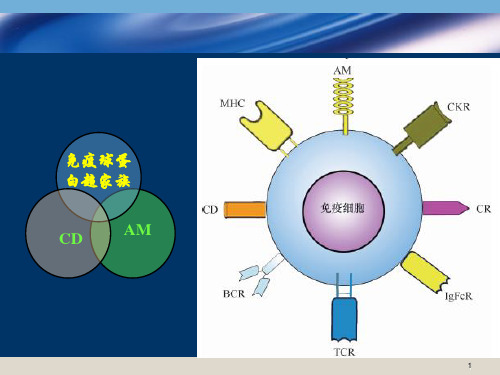
树突状细胞(dentritic cell, DC医)学免疫学
❖诱导型表达B7(CD80/CD86)
13
医学免疫学
14
自然杀伤细胞(natural killer,NK医)学免疫学
•大颗粒淋巴细胞:胞质含大嗜苯胺颗粒 •生物学特征:CD3CD19CD56+CD16+
能被IL-2、IL-12等细胞因子激活; 活化后可分泌IFN-γ和TNF-α等
•作用特点:无需抗原预先致敏即可杀 伤某些靶细胞(肿瘤细胞、病毒感染的细胞等异常细胞) •来源、分布:骨髓中淋巴样祖细胞分化而来;
❖单核/巨噬细胞具有吞噬、杀伤、分泌生物活 性分子及提呈抗原等功能。
3
The Long Arm of the Immune System 医学免疫学
Jacques Banchereau
树突状细胞的研究进展

树突状细胞的研究进展
其次,树突状细胞具有重要的抗原提呈功能。
树突状细胞通过捕获、处理和展示抗原,引发免疫系统的免疫应答。
研究表明,树突状细胞能够通过不同的抗原提呈通路来激活不同的免疫细胞,如T细胞和B细胞。
此外,树突状细胞还参与调节免疫应答的平衡,通过调节T细胞的分化和功能来控制免疫应答的程度和方向。
树突状细胞的研究还包括其分类与表观遗传调控。
研究人员通过对树突状细胞的表面标记物和功能特性的分析,将其分为多个亚群。
不同亚群的树突状细胞在免疫应答过程中具有不同的功能。
此外,近年来,科学家还发现树突状细胞的表观遗传调控在其发育和功能中起着重要的作用。
研究表明,一些表观遗传修饰可以调节树突状细胞的分化和活化过程。
树突状细胞的研究还涉及其在临床应用中的潜力。
由于树突状细胞在免疫应答中的重要性,科学家们试图利用树突状细胞来改善疫苗效果和免疫治疗效果。
研究表明,通过将抗原递呈给树突状细胞,可以提高疫苗的免疫保护效果。
此外,树突状细胞疫苗在癌症治疗中也显示出了潜力。
通过提取患者自身的树突状细胞并对其进行活化和负载肿瘤抗原,可以诱导患者产生特异性免疫应答来抑制肿瘤的生长。
树突状细胞

树突状细胞的生物学功能的研究进展树突状细胞(dendriticcells,DC)是目前人体内最活跃,功能最强大的专职抗原呈递细胞,是人体对免疫原产生免疫应答的重要细胞之一。
DC广泛存在于血液、淋巴、肝脾及皮肤黏膜等组织,能激活功能性淋巴细胞,并产生细胞毒作用,提高机体免疫水平。
DC对抗原和弱抗原都有很高的呈递效率,只需少量的抗原及DC即可激活T细胞,因此成为抗肿瘤和抗病毒免疫研究中的热点。
1DC的来源与分化发育DC的产生分两个阶段:从祖细胞分化为未成熟DC和未成熟DC受外界刺激(如细菌产物、坏死物及及各种细胞因子)分化成熟。
1.1DC的分化体内DC起源于多能造血干细胞,按来源其分化途径分为两条:①髓系分化途径。
称为髓系DC(myebiod,DC1),最终分化为朗格汉斯细胞和间质DC两个亚群。
DC1由髓样干细胞在粒细胞巨噬细胞集落刺激因子(granulocyte-macrophagecolonystimulatingfactor,GM-CSF)、肿瘤坏死因子α刺激下诱生为DC。
亦有来源于外周血单核细胞,也称为DC1前体细胞,在GM-CSF、白细胞介素4(interleukin-4,IL-4)作用下或穿越内皮细胞并吞噬异物后分化为DC。
②淋巴系分化途径。
为淋巴系DC(lymphoid,DC2),最终分化为类浆细胞DC。
DC2的前体细胞不表达髓系抗原,也无吞噬、吞饮抗原能力,低表达GM-CSF,高表达IL-3受体,在IL-3刺激下分化为DC2。
目前对DC亚群及分化[1]。
的研究主要来源于体外培养的方法,体内天然DC亚群的分类仍有待于进一步研究1.2DC的表型变化DC的发育分为成熟与未成熟阶段,两者具有不同的生物学特征和细胞表型。
正常情况下,体内多数DC处于未成熟阶段,其广泛分布于全身各外周组织,高表达吞噬相关受体(Fc受体、补体受体、甘露糖受体),而不表达或低表达共刺激分子和黏附分子(CD14、CD54、CD40、CD80)。
树突状细胞讲解

1.是免疫调节的核心角色之一,它能够识别和捕获外来抗原,并将其转化为适合T细胞识别的形式,使T细胞得以活化,从而加强身体的免疫应答能力。
2.树突状细胞的T细胞激活功能主要是通过表达共刺激分子、分泌细胞因子等方式实现的,这些机制能够促进T细胞的扩增、增强其杀伤力等,进而对抗各类病原体。
树突状细胞的结构与功能
02
树突状细胞在免疫调节中的作用机制
The mechanism of dendritic cells in immune regulation.
树突状细胞识别并展示抗原
3个Biblioteka 激活和招募免疫细胞诱导T细胞功能活化
树突状细胞在中发挥着重要的作用。具体来说,树突状细胞可以通过表达共刺激分子和分泌多种细胞因子,使得T细胞得到激活和增殖,并分化为不同类型的效应T细胞,如细胞毒性T细胞、辅助T细胞等,从而发挥不同的免疫调节功能。此外,树突状细胞还可以通过捕获、处理并呈递抗原,引导T细胞进行特异性免疫反应,依据受体多样性和不同种类的抗原处理途径,引导T细胞分化为特定亚型,并形成记忆T细胞。这些过程的顺利进行对于免疫机体的正常运作和捍卫机体免疫平衡至关重要。
2. 树突状细胞与CAR-T细胞联合治疗的适应症:该治疗方法适用于多种恶性肿瘤,包括淋巴瘤、白血病和实体瘤等。尤其是一些难治性疾病,如转移性肿瘤和复发性肿瘤,其治疗效果更为突出。
3. 树突状细胞与CAR-T细胞联合治疗的应用前景:随着细胞治疗技术的不断发展和完善,该治疗方法在临床应用中已经取得了一些成功。而且由于该治疗方法的特殊性质,其治疗效果相对持久,疗效持续时间较长,患者生存期明显延长。因此,该治疗方法具有广阔的应用前景,也是近年来细胞治疗领域的一个重要研究方向。
树突状细胞分子标识

树突状细胞分子标识树突状细胞(dendritic cells)是一类免疫细胞,它们在人体免疫系统中起着重要的作用。
树突状细胞主要存在于皮肤、黏膜和淋巴组织等处,它们的主要功能是识别和呈递抗原,激活和调节免疫应答。
本文将从树突状细胞的结构、功能和调控等方面来介绍这一重要的细胞类型。
树突状细胞的形态特征是其具有丰富的突起状突触,这些突起使得细胞表面增大,从而提高了其与其他细胞的接触面积。
树突状细胞的突起主要分为两种类型:短突和长突。
短突主要用于与其他细胞进行接触和识别,而长突则用于与其他免疫细胞进行信息传递。
树突状细胞的主要功能是识别和呈递抗原。
当人体受到外来抗原的侵袭时,树突状细胞会通过突触与抗原发生接触,并将其摄取和加工。
然后,树突状细胞会将加工后的抗原展示在其表面的特殊分子上,称为主要组织相容性复合物(MHC)分子。
这样,树突状细胞就可以将抗原呈递给其他免疫细胞,如T细胞和B细胞,从而引发免疫应答。
树突状细胞的活化和调控是免疫应答中的重要环节。
在抗原摄取和加工后,树突状细胞会通过分泌细胞因子和表面分子的改变来激活其他免疫细胞。
同时,树突状细胞还可以被多种细胞因子和信号分子所调控。
例如,炎症因子可以促使树突状细胞从组织中迁移到淋巴结,从而增加其呈递抗原的机会。
此外,树突状细胞还受到其他细胞类型的调控,如T细胞和B细胞等。
树突状细胞在免疫系统中的作用不仅限于抗原呈递,它们还可以调节免疫应答的强度和方向。
在感染或炎症等免疫应答过程中,树突状细胞可以通过与其他免疫细胞的相互作用来调节免疫细胞的活化和功能。
此外,树突状细胞还可以通过分泌细胞因子和表达共刺激分子来影响T细胞的分化和功能,从而调节免疫应答的类型和强度。
树突状细胞作为免疫系统中重要的细胞类型,其在抗原识别和呈递、免疫应答调控等方面发挥着重要的作用。
对于树突状细胞的研究,不仅有助于我们深入了解免疫应答的机制,还为免疫相关疾病的预防和治疗提供了新的思路。
免疫细胞-树突状细胞PPT课件

受体 (FcRIII) CD56(又称Leu19或NKH-1抗原) CD57(HNK-1、Leu-7) CD2(OKT-11、Leu-5)、CD8-、P58、P70、P30等。 24
3. NK细胞的活化受体和抑制受体
MHC抗原 MHCI(所有T细胞)、MHCII(活化T细胞)
分化抗原
CD3、CD4、CD8、- CD25、CD28、CD45等
9
3. T细胞亚群
❖ TCR双肽链的构成不同:TCR、 TCR
❖ CD分子表达情况不同:CD4+(MHCII )、 CD8+
(MHCI)
❖ TCR+T细胞的功能不同:调节性T细胞(Th、Ts)
(1ymphokine activated killer cell, LAK)
其主要特征为:
具有LGL的形态特征;
能杀伤对NK细胞不敏感的实体瘤细胞,具有广泛的杀瘤谱;
仅能被IL—2等细胞因子诱导而产生;
LAK细胞前体及效应细胞均为非黏附细胞;
对放射线敏感。
-
29
目前尚未发现LAK细胞特有的表面标志。许多实验表 明,LAK细胞的前体细胞主要是NK细胞。
一、淋巴细胞
-
4
(一)T淋巴细胞(thymus-dependent lymphocyte)
1. T细胞的分化发育
多能造血干细胞
Three phase
CD4-CD8-(DN) CD4+CD8+(DP) CD4+/CD8+(SP)
淋巴样干细胞 胸腺外
前T 胸腺
成熟T
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
器材
(1)水平式离心机(2)显微镜(3)血 )水平式离心机(2)显微镜(3 球计数板、血盖片(4 球计数板、血盖片(4)载玻片、盖玻 片(5)定量移液器、洗耳球(6 片(5)定量移液器、洗耳球(6)刻度 离心管(7)试管、滴管、橡皮滴头(8 离心管(7)试管、滴管、橡皮滴头(8) 小滤纸、擦镜纸
试剂
3、培基第3 天换液,轻轻吸去原培养液,加入 、培基第3 等量含有IL等量含有IL-4 和GM-CSF 的新鲜1640 培氧液, GM的新鲜1640 继续置CO2 继续置CO2 孵箱中培养。 4、 促树突状细胞成熟:单核细胞经与IL-4 和 促树突状细胞成熟:单核细胞经与ILGM-CSF 的共同孵育,7 天左右使其分化成树突 GM的共同孵育,7 状细胞,但并未成熟。此时轻轻吸去含有IL状细胞,但并未成熟。此时轻轻吸去含有IL-4 和GM-CSF 的1640 培养液,更换等量的含有 GMIFNIFN-α的RPMI1640 培养液,继续置5%CO2 孵箱 培养液,继续置5%CO2 中,37℃培养,至第9 中,37℃培养,至第9 天时可获得成熟的树突 状细胞。
基本原理 细胞因子GM细胞因子GM-CSF 和IL-4 使血液中单核细胞分化成树突状细 IL胞,并用IFN胞,并用IFN-α促进树突状细胞的成熟。 试剂和材料 ● 新鲜的外周(肝素)抗凝血液 ● 淋巴细胞分离液。无钙镁HanKs(CMF-HanKs)液 淋巴细胞分离液。无钙镁HanKs(CMF-HanKs)液 ● 制剂:人重组GM-CSF(hrGM-CSF)、hrIL-4、hrIFN-α。 制剂:人重组GM-CSF(hrGM-CSF)、hrILhrIFN●培养液: (1) RPMI1640 全培基:RPMI1640+10% 胎牛血清( FCS、 全培基:RPMI1640+10% FCS、 热灭活)+2mmol/LL-谷氨酰胺+100IU/ml 青霉素+100μg/ml 热灭活)+2mmol/LL-谷氨酰胺+100IU/ml 青霉素+100μg/ml 链霉素+1g/L 非必需氨基酸+1 链霉素+1g/L 非必需氨基酸+1 mmol/L 丙酮酸钠+5×105 丙酮酸钠+5× mol/L 2 巯基乙醇。 (2) RPMI1640/IL-4/GM-CSF:即RPMI 全培基+ILRPMI1640/IL-4/GM-CSF:即 全培基+IL4(40ng/ml)+GM4(40ng/ml)+GM-CSF(50ng/ml). (3) RPMI1640/IFN-α:即RPMI 全培基+ IFN-α(1 RPMI1640/IFN-α:即 全培基+ IFN10ng/ml)。 10ng/ml)。
树突状细胞(dendritic 树突状细胞(dendritic cell,DC) 是一 类具有树枝状突起的抗原呈递细胞,其分布 广泛,由骨髓中的髓性多能干细胞发育而成, 在免疫应答过程中至关重要。它是原发性混 合淋巴细胞反应中的主要刺激细胞,可激活 Th 细胞发生增殖反应,而且还能刺激产生TC 细胞发生增殖反应,而且还能刺激产生TC 细胞。树突状细胞呈递抗原给T 细胞。树突状细胞呈递抗原给T 细胞提供稳 定的微环境。
检查细胞活力:取细胞悬液一滴加入等 量锥兰溶液于另一试管中充分混匀,用 载玻片在显微镜下计数100~200个单个 载玻片在显微镜下计数100~200个单个 核细胞中着色的死细胞数。
实验结果记录与分析
1.计算细胞回收率(%) 1.计算细胞回收率 计算细胞回收率( 分离后单个核细胞总数×100%分离前单个核细胞总 分离后单个核细胞总数×100%分离前单个核细胞总 数 2.计算单个核细胞纯度(%) 2.计算单个核细胞纯度 计算单个核细胞纯度( 分离后单个核细胞总数× 分离后单个核细胞总数×100% 分离后白细胞总数 3.计算细胞活力(%) 3.计算细胞活力 计算细胞活力( 分离后活细胞数×100%分离后细胞总数 分离后活细胞数×100%分离后细胞总数
(1)抗凝全血(临时抽取)、40倍稀释 )抗凝全血(临时抽取)、40倍稀释 的全血,比重:1.077±0.001)(3 液(市售,比重:1.077±0.001)(3) Hanks液(4)白细胞稀释液(5 Hanks液(4)白细胞稀释液(5)0.5% 胎盘蓝
小鼠淋巴细胞的分离与培养
1. 拉颈处死小鼠,置70%酒精中浸泡5分钟消毒,然后移入超 拉颈处死小鼠,置70%酒精中浸泡5 净台。 2. 打开腹腔,无菌取出小鼠脾脏,放入盛有5-10mlDMEM不完 打开腹腔,无菌取出小鼠脾脏,放入盛有5 10mlDMEM不完 全培养液的平皿中轻轻漂洗,并细心剥除脾脏周围的结缔组 织。 3. 将脾脏移入另一个盛有5-10ml DMEM不完全培养液的平皿中, 将脾脏移入另一个盛有5 DMEM不完全培养液的平皿中, 轻轻漂洗后置于100目细胞筛用滴管拉碎,使脾细胞通过筛 轻轻漂洗后置于100目细胞筛用滴管拉碎,使脾细胞通过筛 孔被挤压入培养液中,反复冲洗,以取得单个细胞悬液。
DC细胞培养
1.制备单个核细胞; 1.制备单个核细胞; 2.调整单个核细胞浓度为1*106/ml,加入 2.调整单个核细胞浓度为1*10 /ml,加入 含hrIL-4、GM-CSF的RPMI1640进行 hrIL- GM-CSF的RPMI1640进行
培养,5%CO2,37℃,3天。 培养,5%CO2,37℃,3天。
用滴管小心地直接插入白色絮状的细胞层 (含单个核细胞),吸出界面层细胞,移入 刻度离心管内。 在该细胞收集管内(即刻度离心管)加入 Hanks液,用滴管轻轻上下冲洗混匀,然后在 Hanks液,用滴管轻轻上下冲洗混匀,然后在 离心(1000rpm)10分钟,弃去上清液,将沉 离心(1000rpm)10分钟,弃去上清液,将沉 淀细胞充分摇匀,再用Hanks液洗涤2 淀细胞充分摇匀,再用Hanks液洗涤2次。 用0.5ml Hanks液将沉淀细胞稀释,摇匀。 Hanks液将沉淀细胞稀释,摇匀。 取细胞悬液一滴加入等量白细胞稀释液于另 一试管中充分混匀,用计数板在显微镜下计 数,计算出白细胞总数(/ml)及单个核细胞 数,计算出白细胞总数(/ml)及单个核细胞 数(/ml)。 数(/ml)。
操作步骤
1.在已含1ml抗凝全血的试管内加入1ml Hanks 1.在已含1ml抗凝全血的试管内加入1ml 液,混匀,然后用滴管将此稀释全血沿盛有 1ml淋巴细胞分离液的试管壁轻轻铺于分离液 1ml淋巴细胞分离液的试管壁轻轻铺于分离液 面上。 2.将该试管置水平式离心机中离心(2000rpm) 2.将该试管置水平式离心机中离心(2000rpm) 20分钟。 20分钟。 3.用计数板在显微镜下计数40倍稀释的全血, 3.用计数板在显微镜下计数40倍稀释的全血, 计算出其中的白细胞总数(/ml)及单个核细 计算出其中的白细胞总数(/ml)及单个核细 胞总数(/ml)。 胞总数(/ml)。
小鼠淋巴细胞的分离与培养
4. 将脾细胞悬液缓缓加入到已装有淋巴细胞分离液的10ml 将脾细胞悬液缓缓加入到已装有淋巴细胞分离液的10ml 离心管中(脾细胞悬液与淋巴细胞分离液体积比为1:1), 离心管中(脾细胞悬液与淋巴细胞分离液体积比为1:1), 然后2000rpm/min离心20分钟; 然后2000rpm/min离心20分钟; 5. 收集分离出的脾细胞,置于10ml的离心管内加入DMEM不 收集分离出的脾细胞,置于10ml的离心管内加入DMEM不 完全培养液吹打。取少量用于显微镜下计数,同时 1500rpm/min离心10分钟,弃上清; 1500rpm/min离心10分钟,弃上清; 加入适量完全培养液 (DMEM液+10%小牛血清),将细胞重悬,调整细胞浓度 DMEM液+10%小牛血清),将细胞重悬,调整细胞浓度 为1×106/ml。 106/ml。 6. 然后移入培养瓶,放入37oC ,5%CO2培养箱培养。 然后移入培养瓶,放入37oC 5%CO2培养箱培养。
外周血单个核细胞的分离— 外周血单个核细胞的分离—密度梯度离心法
原理 根据物理学中颗粒沉降原理,不同密度的物质颗粒在 其沉降运动中可因其比重的差别而处于不同的分布位 置。利用此原理可设计一定比重的液体界面,将外周 血中各种不同比重的细胞通过离心沉降而达到使其彼 此分离的目的。已知人类淋巴细胞和单核细胞的比重 大约在1.075~1.090之间,而红细胞与粒细胞的比重 大约在1.075~1.090之间,而红细胞与粒细胞的比重 均大于1.090。因此,若用比重为1.077±0.001的分 均大于1.090。因此,若用比重为1.077±0.001的分 离液则可通过密度梯度离心方法,在分离液界面上收 集外周血单个核细胞。
