物理化学(南京大学)06章_化学平衡
物理化学(南大五版)第六章化学平衡
fB νB K = ∏( θ )e p B
θ f
1. 用压力表示的经验平衡常数 K p
pB νB Kp = ∏( θ ) p B
θ
Kp = ∏pνB B
B
Kγ = ∏γ νB B
B
K f = Kp ⋅ Kγ = Kp ⋅ Kγ ( p )
θ
θ
θ
−
∑νB
B
理想气体: Kθ = Kθ = Kp ( pθ ) f p
6.1 化学反应的平衡条件
热力学基本方程 化学反应的方向与限度 为什么化学反应通常不能进行到底
一、热力学基本方程
任意的封闭系统,不作非膨胀功,热力学基本方程: dU = TdS − pdV + ∑ µ B dnB = TdS − pdV + ∑ν B µ B dξ
B
B
dH = TdS + Vdp + ∑ µ B dnB = TdS + Vdp + ∑ν B µ B dξ
θ
( pG / pθ )g ( pH / pθ )h L ( pD / pθ )d ( pE / pθ )e L
pB νB Qp = ∏( θ ) p B
∆ r G m = ∆ r G m (T ) + RT ln Q p
压力商
理想液态混合物反应系统:
* µB (l) = µB (l,T, p) + RT ln xB
B
非理想液态混合物反应系统:
0 ∆rGm = ∆rGm(T) + RT ln ∏aν B B
B
二、标准平衡常数的定义
对任意化学反应,标准平衡常数的定义为: Kθ
标准平衡常数 标准平衡常数 热力学平衡常数 热力学平衡常数
物理化学第5-6章课后答案傅献彩_第五版(南京大学化学化工学院)

第五章相平衡I- ⅛,□(s)分解的反应方程为⅛O(s)-Ξ⅛(s) + γ<λ<gλ当用⅛O(s)进行分無达平衡时•系统的组分数、自由度数和可能平衡共存的最大相数各为多少?解:S=31C=S-R=2Φ-3t f~ C÷2-Φ=l/=0时4最大为4-2.搭出如下各系统的组分数、相数和自曲度数各为多少?(1)NH4CKs)在抽空容器中,部分分解为NH^⅛),HCKg)达平衡:(2)NKCiCS)在含有一定量NHNE的容器中,部分分解为NH√g)τHCKgJ达平衡;(3)NH i HS(S)与任竜量的NH3(g}和H J SCg)^合,达分解平衡;(4)在900K 时Cx叮与CO(g),CO⅛Cg) ∕λ (G达平翫解:NHKnNHa Cg) + HCKg)门)呂=3* C=S-R-R, {R=l f R f = ∖) [NH s]=[HCl]-C=I TΦ=2∙t /=C-Φ+2 = lC2)S=3t C=S-R-R'=2 Φ=2,f=C~Φ~∖~2=2C3)S=3, C=S-R-R, =3-1-0=2. Φ=2f=OM2=2(同2)C<s)+yQCg)-COCg)①<4)9t>0K 时’CXXg)+⅛ (g)-α⅛ (g)②$=4, C^R-R f(◎中KxxI 的慑不定龙=0、C=S-R-R f = 4-2-0=2Φ=2 Γ ^C+i-φ^l.玉在制水煤气的过稈中,有五种物质,CCs)τCX)(g),CC⅛Cg}Λ⅛⅛)和H2OCgJ建立如下三牛平衡,试求该系统的独立组分数.CCs> + H- 0(g)^=⅛(g)÷CO(g)(1>C0⅛(g) + H? ⅛)-H3 0(fi) +CO(g) ¢2)Ce⅛(g)+CCs>-2Co(g> <3)解:建立3个平衡,(3)式可⅛¢1)+(2)得到RT S= 5C^S-R-R f=^二已知T‰CαS和H2O(I)可以生成如下三种水合物:Na a CQ ∙ H S O(S) ,N¾C0⅛・7H2OCs)和Na2CC⅛ * IOH2 O(s)试求门)在大气压下•与Na S CQ J水溶液和冰平衡共存的忒合盐的最大值;<2)在298K时,与水蒸气平衡共存的水合盐的最大值.解:(1〉S=5.R=3IJ R Z^O C=S-R~R f^=2每生咸一种含水盐+ R增加1.S增加1:匚、值不变.在∕⅛∙τ√* =C+1-Φ Γ =0时血绘大为3.已知有NamEQ水陪揪和H2O(≡)两相•则还能生成一种含水盐.(2)同样地τ∕* =C+I^Φei⅛大为3故还可最多有两种含水盐主成-5∙在不同温度下•测得Ag2O(S)分解时氧气的分压如下:T/K 401 417 443 463 486P(Co2)∕kPa10 20 51 101 203试问(1)分别于413K和423K时,在空气中加热银粉,是否有Ag2O(S)生成?(2)如何才能使Ag2O(S)加热到443K时而不分解?△ 1解:⑴ Ag2O(s)^=i2Ag(s)÷-∣-θ2(g)空气中O2的分压为0. 21 ×po=0. 21X101. 325kPa=21. 3Pa当空气中Q的分压大于或等于Ag2O的分解压力时,能生成Ag2O,否则不能,作PJ -T图,可以看出413K时P OZ的压力V空气中O Z的分压,能生成Ag"),而在423K时如=25kPa>O. 21Pa不能生成Ag2O.(图略)(2)从所给数据可知,在443K时,如解的平衡压力为5IkPa故当O2的分压大于51kPa时Ag2O不分钟.6・通常在大气压力为101. 3kPa时,水的沸点为373K,而在海拔很高的高原上,当大气压力降为66. 9kPa时,这时水的沸点为多少?已知水的标准摩尔气化焙为40. 67kJ・moΓ1,并设其与温度无关.解:根据ClaUniUS-CIaPeyrOn 方程式—H lf与温度无关时•%=鬻G卡66.9 _40. 67 × IO3z 1 1、Iln10L3(丽飞)T2=361. 56K.7.某种溜冰鞋下面冰刀与冰的接触面为:长7. 62cm,宽2. 45X 10~3cm.若某运动员的体重为60kg,试求<1)⅛动员施加于冰面的总压力.(2)在该压力下冰的熔点.已知冰的摩尔熔化熔为6∙ OIkJ ∙ moΓ1•冰的正常熔点为273K,冰和水的密度分别为920和IOOOkg •解:PA = P e÷P⅛P运=Gs = τng∕S= 2X7. ^×2.4^<10^3= 1.58×109PaP运》护 * P总=P远=1∙ 58 × IO R Pa 根据克拉贝龙方程•CIft . _ △汕Hm臥L T ∙ Δfu9V m皿Vm=I8X10-3(誌δ-禽)= -1.556×10^6m3∙ kg~1L58X10«Pa-l. OlXlO5Pa≡占诰労君r⅞, InT加-0∙ 04114≡lnτ^73κE =262. 2K.8.已知在1013kPa时.正已烷的正常沸点为342K,假事实上它符合TrOUton规则,即Δv.p‰ZT b¾ 88J ・KT・moΓ,,试求298K时正已烷的蒸气压.解:根据TrOUtOn规则Δvv H n∕Tb≈88J ・ K-】・moΓ1ΔvH>H m=88×342=116. 964kJ ・moΓ1根据克拉贝龙方程Δrtt>Hm与温度无关时•叱刖譬(*~⅜I 4 _ ]血964kJ ∙ rpoL( __________ 1 X I-I rl lnI 2VP QInA -8. 314J ∙ K^l∙ moΓ1( 342K 298K)+ lnl°1* 3kPp2=0∙ 41kPa.9.从实验测得乙烯的蒸气压与温度的关系为In 瓷=-号竖+1. 75In-^-1. 928×10~2-^ + 12. 26试求乙烯在正常沸点169. 5K时的摩尔蒸发熔变.解:根据克拉贝龙方程•当V e»Vi从乙烤蒸气压与温度关系式得•dln%p= 1921 K/ Γ5 +1. 75/ 丁一1. 928 X10一2在乙烤的正常沸点T=I69. 5K时d∣n%τ=0∙C胡=伶学πXPH In=8. 314×0. O58X169.5X=81.73J ・moΓ,.10・已知液态碑AS(I)的蒸气压与温度的关系为In 育=-等^+20. 30固态碑AS(S)的蒸气压与温度的关系为In 盘=-翌泮+ 29. 76试料的三相鮒温度和氐丸.解:在三相点上,固态与液态碑的F相等.(ln%a=-3^K+20. 30jln^p a=~15^9κ+29.76解得:T=IO92. 4K, p=3664. 38kPa.11.在298K时,纯水的饱和蒸气压为3167. 4Pa,若在外压为101. 3kPa的空气中,求水的饱和蒸气压为多少?空气在水中溶解的影响可忽略不计.解:外压与蒸气压的关系,空气不溶解于水,可看成是不活泼气体,lnP%∙=呂*(以_九)p;是无惰性气依时的蒸气压,久是当外压为P t时•有惰性气体存在时的蒸气压依题意得等温∖"P fξ∕p;=漲# (P ・_P ;)⅛67.4 = 8⅛⅜98(IOI ∙3×1°3~3167M)V W (I) = Ig£ *I mPrI ⅞1 m °1 ≈ 18cm 3 = 1. 8 × 10~5 m 3%=3169. 66Pa可以看出影响很小,因为V(g)»V(l).12. 在36OK 时,水(A)与异丁醇(B)部分互溶,异丁醇在水相中的摩尔分数为刘=0. 021.已知水相中 的异丁醇符合Henry 定律,Henry 系数HB=I ・58X 疔Pa.试计算在与之平衡的气相中,水与异丁醇的分 压•已知水的摩尔蒸发熔为40. 66kJ ・mol~1 ,且不随温度而变化.设气体为理想气体.解:水相中的异丁醇符合Henry 定律有 PB=It 小・ X B = I. 58× 106Pa×0. 021=≡33180Pa 水的分压 AA=Z —如= (IOl300—33180>Pa=68120Pa. 13. 根据所示碳的相图(图5-4),回答如下问题: ⑴曲线OA,OB,OC 分别代表什么意思? (2) 指出O 点的含义,(3) 碳在常温、常压下的稳定状态是什么?(4) 在2000K 时•增加压力,使石墨转变为金刚石是一个放热 反应,试从相图判断两者的摩尔体积哪个大?(5) 试从相图上估计,在2000K 时,将石墨转变为金刚石至少 夏加多大压力?解:(1)OA'代表,金刚石与石墨的两相平衡线,OB 表示液态 C 与石蜃的两相平衡线,OC 代表金刚石与液相C 的两相平衡线.(2) 0点代表液态C,金刚石和石墨的三相点是QA,OB,OC 的交点・此点2=3,/=0,三相点的温度 压力皆由系统确定.(3) 碳任常温,常压下稳定状态是石墨. (4) 根据克拉贝龙方程. d%τ= 邈;・石墨(s)" 金刚石(S)d%τ即为OA 线的斜率为正. 龛卷 >0 ∆H ra <0,7>0Λ∆⅛1<0即由石墨变成金刚石体积滅小,石墨的摩尔体积较大. (5) 估汁53XlO 8Pa 时可以将石最转变为金刚石.14. 在外压为101.3kPa 的空气中,将水蒸气通入固体碘I 2 (s)与水的混合物中,进行蒸汽蒸倔.在 371. 6K 时收集谐出蒸汽冷凝,分析他岀物的组成得知,生IOog 水中含碘81. 9g.试计算在371. 6K 时碘的 蒸气压.而R 2 ∕Z P H 2O =叫 /∏H 2O P I 2 + P H 2O = P解出汐S =5556. 87PaP H 2O =5556. 9Pa图5-4 解:1,-Z ∏H 2OTAQ 3K15. 水(A)与氯苯(B)互溶度极小,故对氯苯进行蒸汽蒸谓.在101. 3kPa 的空气中,系统的共沸点为 365K,这时氯苯的蒸气分压为29kPa.试求(1) 气相中氯苯的含凰加(2) 欲蒸出IoOO kg 纯氯苯,需消耗多少水蒸气?已知氯苯的摩尔质量为112. 5g ・moΓ1. 解:⑴在“°空气中•氯苯的蒸气压为29kPa,则水的蒸气压为,P H 2OOQ刃=伽/P 总=PC 6H S C ∣∕P e=JQ2~2=O- 286Hn Wy/MB = 29 卩:町/M 厂(IoI ・3-29)IOoOKg/112・ 5g ∙ mo 「= 39kPaVV A Z18g ∙ moΓl ^7Γ3id⅛ 叭=WH 2o =398. 9kg 希消耗水,398. 9kg.16. 在273K 和292K 时,固体苯的蒸气压分别为3. 27kPa 和12. 30kPa,液体苯在293K 时的蒸气压为 10. 02kPa.液体苯的摩尔蒸发熔为34.14 kJ ・moΓ1.试求(D303K 时液体苯的蒸气压; (2) 固体苯的摩尔升华焙; (3) 固体苯的摩尔熔化焙. 解:(1)克拉贝龙方程式: InA/»=爷(*-*)I、ZIA AOl n _ 34・ 17kJ ∙ / 1 1 、“化 / °∙ 02kl a一 & 314J ・ KT ・ moiτ( 293K _ 303K )∕>2≡15. 92kPa.⑵同理 Jn√2∕√ι=^=(γr~γr) I n 30 = A⅛L X ( —1 -------- 1— \ n3.27 & 314 k 273K 393K 7 ∆H m =44.05kJ ∙ moL∙ (3) Δ⅛ H nl =ΔΛ H rn -» H m= 44∙ 05-34. 17≡9. 88kJ ∙ moΓ1.17. 在298K 时,水(A)与丙醇(B)的二组分液相系统的蒸气压与组成的关系如下页表所示,总蒸气压 在X B =O. 4时出现极大值:(1) 请画岀p-χ~y 图•并指岀各点、线和面的含义和自由度;(2〉将x tt =0. 56的丙醇水溶液进行精協•精懈塔的顶部和底部分别得到什么产品? (3)若以298K 时的纯丙醇为标准态,求X B =O. 2的水溶液中,丙醇的相对活度和活度因子•(2)nc 6H 5αX ∏H 2O =吋5。
物理化学第六章化学平衡

第八页,共29页。
(二)平衡常数
6、复相化学反应(huàxué fǎnyìng)平衡常数
对于复相化学反应,凝聚(níngjù)相是纯态时平衡常数
表达式中只出现气体项
离解压力
K
n B1
(
pB p
)B
某固体物质发生离解反应时,所产生气体的压 力,称为(chēnɡ wéi)离解压力,也叫分解压力
如果产生的气体不止一种,则所有气体压力的总和 称为解离压。
(四)温度(wēndù)对化学平衡的影响
反应C(石墨)+2H2(气)=CH4(气)在1000K时CH4(气))的标准(biāozhǔn)生成热为-89.
⑶近似计算标准压力下液态溴的沸点 (四)温度对化学平衡(huàxuépínghéng)的影响
p B
Kn
(
p
) n
B
当 B 0 时
B
KpKpK cKxK n
当 p p 时
Kp Kx
第五页,共29页。
(二)平衡常数
•
K
p
没有量纲,对于给定的反应,标准态选定后,
仅仅是温度的函数。
•
当
B 0
B
时, K
c
和
Kp
都有量纲, K
的单位
p
是
B (Pa) B
,K
c
的单位是
(molm3)B B
,对于理
rG m H 0 alT T n 2 b T 2 6 c T 3 IRT
当理想气体用浓度表示时,可以(kěyǐ)得到
dlnKc rUm
dT
RT2
lnKc (T2)rUm(11) Kc (T1) R T1 T2
南大物理化学课件-ch5相律和多相平衡

相图是利用图形方式表示物质相态之间关系的图表,通常包括温度、压力、相态 等参数。通过相图,可以了解物质在不同温度、压力条件下的相态变化,包括气 态、液态、固态等。
相图的绘制方法
总结词
相图的绘制需要实验数据,通过实验测定物质的物性数据,然后利用数学方法进行计算 和绘制。
详细描述
相图的绘制需要大量的实验数据,这些数据包括物质的物性参数,如密度、蒸气压、溶 解度等。通过实验测定这些数据,再利用数学方法进行计算和绘制,最终可以得到物质
理论计算
利用热力学和统计力学的基本原理, 通过计算模拟相变过程,预测物质的 性质变化。
05
相变与热力学
热力学在相变中的应用
热力学第一定律
描述了能量守恒和转换的关系, 在相变过程中,系统吸收或释放
的热量与系统熵的变化有关。
热力学第二定律
揭示了自发过程的不可逆性,即 自发过程总是向着熵增加的方向 进行。在相变过程中,自发相变
相变过程的热力学计算
01
相变过程中,需要计算系统的焓 变、熵变和自由能变化等热力学 参数。这些参数有助于了解相变 过程的能量变化和自发方向。
ቤተ መጻሕፍቲ ባይዱ02
通过热力学计算,可以确定相变 的温度、压力等条件,以及不同 相之间的平衡关系。这对于研究 和应用多相平衡具有重要意义。
THANKS
感谢观看
确定相数和组分数
根据相律可以确定多相平衡系统中可能的相数和独立组分 数。如果独立组分数小于相数,则系统无法达到平衡。
指导实验设计和分析
在化学实验中,相律可以指导实验设计和结果分析。例如, 通过控制温度、压力等实验条件,可以改变系统的自由度 数,从而改变系统的平衡状态。
相律的推导
2014南京大学物理化学考研复习真题与解析

图书描述【出版日期】2013年6月5日【教材名称】《2014南京大学物理化学考研复习精编》全程备考首选精品【编著】硕考官方、南大考研研究中心编【开本】大16开【字数】127千字【页数】267页《2014南京大学物理化学考研复习精编》《复习精编》是励学南大精品考研专业课系列辅导材料中的核心产品。
本书严格依据学校官方最新指定参考书目,并结合考研的精华笔记、题库和内部考研资讯进行编写,是励学南大老师的倾力之作。
通过本书,考生可以更好地把握复习的深度广度,核心考点的联系区分,知识体系的重点难点,解题技巧的要点运用,从而高效复习、夺取高分。
考试分析——解析考题难度、考试题型、章节考点分布以及最新试题,作出考试展望等;复习之初即可对专业课有深度把握和宏观了解。
复习提示——揭示各章节复习要点、总结各章节常见考查题型、提示各章节复习重难点与方法。
知识框架图——构建章节主要考点框架、梳理全章主体内容与结构,可达到高屋建瓴和提纲挈领的作用。
核心考点解析——去繁取精、高度浓缩初试参考书目各章节核心考点要点并进行详细展开解析、以星级多寡标注知识点重次要程度便于高效复习历年真题与答案解析——反复研究近年真题,洞悉考试出题难度和题型;了解常考章节与重次要章节,有效指明复习方向。
《复习精编》具有以下特点:(1)立足教材,夯实基础。
以指定教材为依据,全面梳理知识,注意知识结构的重组与概括。
让考生对基本概念、基本定理等学科基础知识有全面、扎实、系统的理解、把握。
(2)注重联系,强化记忆。
复习指南分析各章节在考试中的地位和作用,并将各章节的知识体系框架化、网络化,帮助考生构建学科知识网络,串联零散的知识点,更好地实现对知识的存储,提取和应用。
(3)深入研究,洞悉规律。
深入考研专业课考试命题思路,破解考研密码,为考生点拨答题技巧。
1、全面了解,宏观把握。
备考初期,考生需要对《复习精编》中的考前必知列出的院校介绍、师资力量、就业情况、历年报录情况等考研信息进行全面了解,合理估量自身水平,结合自身研究兴趣,科学选择适合自己的研究方向,为考研增加胜算。
化学平衡原理

安徽科技学院理学院《普通化学》教案(三)第四章 化学平衡[引言]化学平衡主要研究反应进行的程度和决定反应限度的因素、外界条件对反应限度影响。
3.1 平衡常数 3.1.1 化学平衡1可逆反应:在一定条件下既可正向进行又可逆向进行的化学反应。
大多数化学反应都是可逆的。
对于任一可逆反应aA + bB eE + fF2化学平衡:正反应速率等于逆反应速率时,体系所处的状态。
(图3-1) 特点:(1)化学平衡是动态平衡,化学反应达到平衡时反应并未停止,υ正 = υ逆。
(2)反应达到最大限度,υ正和υ逆不再随时间的变化而改变。
(3)平衡体系中,各物质平衡浓度之间存在确定的定量关系。
3.1.2 平衡常数1实验平衡常数(K )对于任一可逆反应 aA+bB fF +hH (1)浓度平衡常数(K c ):K c = (B)(A)(H)(F)eq eq eq eq ba h f c c c c ⋅⋅(3-1) (2)压力平衡常数(K p ):K p =(B)(A)(H)(F)eqeq eq eq b a hf p p p p ⋅⋅ (3-2)2标准平衡常数K θ 标准平衡常数K θ又称为热力学平衡常数,简称平衡常数。
对任一气体反应:aA(g) +bB(g) fF(g)+ hH(g)在标准状态(压力为101.325kPa)下,标准平衡常数K Ө的表达式为:θp K =ba h f p p p p p p p p ](B)/[](A)/[](H)/[](F)/[θeq θeq θeq θeq ⋅⋅ (3-3) 式中,θeq (A)/p p 、θeq (B)/p p 、θeq (F)/p p 、θeq (H)/p p 分别为A 、B 、F 、H组分平衡时的相对分压。
则θp K 是无量纲的量。
对溶液中的反应,标准状态(压力p θ=101.325kPa)下,对任一反应: a A(l) +b B(l) f F(l)+hH(l)t图4-1正逆反应速率示意图υ正 υ逆=其标准平衡常数表达式为:θcK =ba hf c c c c c c c c ](B)/[](A)/[](H)/[](F)/[θeq θeq θeq θeq ⋅⋅ (3-4) 式中,θeq (A)/c c 、θeq (B)/c c 、θeq (F)/c c 、θeq (H)/c c 分别为A 、B 、F 、H 组分平衡时的相对浓度(c θ= 1mol ·dm -3),θc K 无量纲。
理学南京大学物理化学PPT课件

2021/7/1
第22页/共205页
第一定律的数学表达式 U = Q + W
对微小变化: dU =Q +W
因为热力学能是状态函数,数学上具有全微分性质,微小变化可用dU表 示;Q和W不是状态函数,微小变化用表示,以示区别。
也可用U = Q - W表示,两种表达式完全等效,只是W的取号不同。用该 式表示的W的取号为:环境对体系作功, W<0 ;体系对环境作功, W>0 。
2.等外压膨胀(pe保持不变)
We,2 pe (V2 V1)
体系所作的功如阴影面积所示。
pe 0
2021/7/1
第25页/共205页
功与过程
2021/7/1
第26页/共205页
功与过程
3.多次等外压膨胀
(1)克服外压为 ,体积从p '膨胀到 ; V1
V'
(2)克服外压为 ,体积从p "膨胀到 ; V '
2021/7/1
第6页/共205页
体系分类
根据体系与环境之间的关系,把体系分为三类:
(1)敞开体系(open system) 体系与环境之间既有物质交换,又有能量交换。
2021/7/1
第7页/共205页
体系分类
根据体系与环境之间的关系,把体系分为三类:
(2)封闭体系(closed system) 体系与环境之间无物质交换,但有能量交换。
第10页/共205页
体系的性质
用宏观可测性质来描述体系的热力学状态,故这些性质又称为热力学变 量。可分为两类:
广度性质(extensive properties) 又称为容量性质,它的数值与体系的物质的量成正比,如体积、质量、
物理化学之化学平衡

时,
§5-7 真实气体反应的化学平衡
• 对于真实气体:
说明:
§5-9 混合物中的化学平衡
• 设在混合系统中,参与反应的各组分的 标准态相同,
物理化学之化学平衡
李庚英
E-mail: gyli@ 电话:8367533
汕头大学土木工程系
§2-1 化学反应的Gibbs函数变化
• 一、化学反应的Gibbs自由能
设有化学反应: 对于多组分系统
在()T,p下,-ΔrGm为反应的推动力,常称为化学亲合势
二、化学反应的限度
图1.1反应系统Gibbs自由能变化示意图
结果表明,在有凝聚相物质参与的理想气体反应中,标 准平衡常数K0中不出现凝聚相物质。
⑴分解压力:固体物质分解产生气体物质的化学平衡中, 气相的总压力称为分解压力。
⑵分解温度:当分解压力p(分解)=p(外压)时分解 反应明显发生时的温度称为分解温度。
§2-4 标准摩尔反应函数的计算
稳定单质的标准生成吉布斯自由能为0。
在一定的温度和压力下,总Gibbs自由能最 低的状态就是反应系统的平衡状态。亦即 反应进行的最大限度。Δ rGm=0为化学反应 的平衡条件。
§2-2 等温反应及标准平衡常数为:
二、理想气体反应的标准平衡常数
⑸标准态压力对标准平衡常数的影响
—化学反的等压方程
• 一、Gibbs Helmhotz . 方程
二、化学反应的等压方程
2. 等压方程的应用
• ⑴ 定性地判断温度对平衡常数的影响。 • ⑵ 定量地进行计算
§5-6 其它因素对理想气体反应 平衡的影响 • 一、压力对平衡转化率的影响
二、反应物配比对平衡转化率的影响
• 对于化学反应 • 当反应物起始浓度之比 平衡转化率最大。
(完整word版)南京大学《物理化学》每章典型例题课件

第一章 热力学第一定律与热化学例题1 1mol 理想气体于27℃ 、101325Pa 状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97 ℃ ,则压力升到1013.25kPa 。
求整个过程的W 、Q 、△U 及△H 。
已知该气体的C V ,m 恒定为20.92J •mol -1•K -1。
解题思路:需先利用理想气体状态方程计算有关状态: (T 1=27℃, p 1=101325Pa ,V 1)→(T 2=27℃, p 2=p 外=?,V 2=?) →(T 3=97℃, p 3=1013.25kPa ,V 3= V 2)例题2水在 -5℃ 的结冰过程为不可逆过程,计算时要利用0℃ 结冰的可逆相变过程,即H 2O (l ,1 mol ,-5℃ ,θp)2O(s ,1 mol ,-5℃,θp ) ↓△H 2 ↑△H 4H 2O (l,1 mol , 0℃,θp 2O (s ,1 mol ,0℃,θp ) ∴ △H 1=△H 2+△H 3+△H 4例题3 在 298。
15K 时,使 5。
27 克的甲醇(摩尔质量为32克) 在弹式量热计中恒容燃烧,放出 119。
50kJ 的热量。
忽略压力对焓的影响。
(1) 计算甲醇的标准燃烧焓 θm c H ∆.(2) 已知298.15K 时 H 2O (l) 和CO 2(g )的标准摩尔生成焓分别为-285.83 kJ·mol-1、-393.51 kJ·mol-1,计算CH 3OH(l)的θm f H ∆。
(3) 如果甲醇的标准蒸发焓为 35。
27kJ·mol -1,计算CH 3OH (g) 的θm f H ∆。
解:(1) 甲醇燃烧反应:CH 3OH (l ) +23O 2(g) → CO 2(g ) + 2H 2O(l ) Q V =θm c U ∆=-119.50 kJ/(5。
27/32)mol =-725.62 kJ·mol -1Q p =θm c H ∆=θm c U ∆+∑RT v)g (B= (-725。
物理化学 第六章 相平衡

S = 6, R =2, R′= 2 C = S – R - R’ = 6 –2 -2 = 2 若 NaCl 溶解完,则只存在一个化学平衡 H2O = H+ + OH S = 5, R =1, R′= 2
C =S –R -R’ = 5 –1 -2 = 2
一、理想液态混合物的气—液平衡相图
1)蒸气压-组成图 因是理想液态混合物,任一组分都服从拉乌尔定律,即
p = pA*xA + pB*xB p = pA* ( 1- xB ) + pB*xB =pA* + ( pB* - pA* ) xB
即系统总压与液相组成xB 成线性关系,在p - x图中是一直线, 这是理想双液系相图的一个特点。
解:
(1) C = S - R - R´= 3 - 1 - 1=1
F=C-P +2= 1-2+2=1 (2) C = S - R - R´= 3 - 1 - 0 =2
F =C-P+2= 2-2+2=2
例2 (1) 仅由CaCO3(s)部分分解,建立如下反应平衡: CaCO3 (s) = CaO(s) + CO2(g) (2) 由任意量的 CaCO3 (s), CaO (s), CO2 (g)建立如下反应平衡:
2 相律(Phase rule)的推导
①系统中的变量总数 设系统中有 S 个物种,分布在 P 个相中,在温度T、压力p下 达到平衡。 在α 相中的变量为:T,p,xα 1,xα 2,…, xα S-1 在β 相中的变量为:T,p,xβ 1,xβ 2,…, xβ S-1 ………… 在P 相中的变量为:T,p,xP1,xP2,…, xPS-1
南京大学-无机及分析化学-化学平衡和化学反应速率

34
3.4.1 基元反应和非基元反应
1、化学方程式:表示反应的总结果,即表示起始 反应物和最终反应物之间的定量关系。不代表反应 进行的实际过程。
2、基元反应:一步就能完成的反应叫做~或简单 反应。
如: NO2+CO→NO+CO2 3、非基元反应:由两个或两个以上的基元反应构 成的化学反应称为复杂反应或非基元反应。
u 1 c
n t 28
随反应的不断进行,由于反应物的浓度不断减少, 生成物的浓度不断增加,因此,大部分化学反应都不是 等速进行的,因此上述所计算的反应速度是该段时间内 的平均反应速度。
平均速度不能代表反应的真正速度,为此我们需 要引入反应在某一瞬间的速度。称为瞬时速度。瞬时速 度可以表示为:
rH m
R
RT 1
ln K2 rSm rH m
R
RT 2
这里,近似地认为 rHm 和 rSm 不随温度变化。
(1) (2)
24
3.2.2 化学平衡移动程度的计算
温度对化学平衡的影响表现为K随温度而变。
升高温度,使平衡向吸热方向移动;降低温度,使平衡向放热方向移动。
温度使化学平衡常数发生变化:
19
氧与血红蛋白(Hb)的结合
拓展知识
组织中酸度会影响Hb和肌 红蛋白(Mb)与氧的结合, 右图是Hb和Mb与氧结合的 饱和度与氧分压的关系。
20
3.2.2 化学平衡移动程度的计算
浓度和压力改变不会影响K值,利用K可对平衡移动
作定量计算。
例3-5 已知以下反应在523 K时, K = 27。求: (1)0.70 mol PCl5注入 2.0 L密闭容器中,平衡时PCl5分解百分 率为多少? (2)若在上述容器中再注入0.20 mol Cl2, PCl5分解百分率又为 多少?
南大物化 第六章 化学平衡

Qa>Kaθ, rGm >0, 逆向自发。
10
例:有理想气体反应2H2(g)+O2(g)=2H2O(g),在2000K时 Kpθ=1.55×107。(1)计算H2和O2分压各为1.00×104Pa,水蒸气 分压为1.00×105Pa的混合气中,进行上述反应的rGm ,并判断反 应自发进行的方向?(2)当H2和O2的分压仍分别为1.00×104Pa, 欲使反应不能正向自发进行,水蒸汽的分压最少需要多大? 解: (1)
rGmθ(pθ) ≠rGmθ(cθ) 二、 rGmθ的求算
rGmθ=∑BBθ
同一反应计量方程式,标准态不同, rGmθ不同
(1)可从某些反应的rGmθ计算另一些反应的rGmθ
θ (1) C(s) O2 (g) CO2 (g) rGm (1) 1 θ (2) CO(g) O 2 (g) CO 2 (g) r Gm (2) 2 1 θ 求: C(s) O 2 (g) CO(g) r Gm (3) (3) 2
;
fGmθ( C2H2(g) )=209.2kJmol-1
解:(1) rGmθ=fGmθ( C6H6(g) )-0-0=129.7kJmol-1
(2) rGmθ=fGmθ( C6H6(g) )- 3fGmθ( C2H2(g) )
= -498kJmol-1
18
小结:
1. rGmθ与反应系统中物质的活度无关;与计量方程 式的写法有关;与标准态的选择有关。 2. rGmθ的计算:
3
若混合,则混合过程自由能:
mixG =RTΣnBlnxB=nARTlnxA + nBRTlnxB = (1- )RTln(1- )+ RTln 实际此时的体系自由能为: G=G*+mixG=μAθ+ (μBθ-μAθ) +(1- )RTln(1- )+ RTln
南京大学物理化学6

dp vap H m OC液-气平衡线 斜率 dT = T V > 0 气平衡线,斜率 液 气平衡线 vap m
三相平衡f=1- 三相平衡 -3+2=0 , T,p不可变 不可变 三相平衡点O点 三相平衡点 点:t=0.0098℃ , p=609Pa ℃ 思考题:在 点升温至Y点 系统将经历怎样 思考题 在pθ时, 由X点升温至 点,系统将经历怎样 点升温至 的变化?自由度 分别为多少? 自由度f分别为多少 的变化 自由度 分别为多少 热力学温标:0K→水的三相点的 水的三相点的1/273.16为1K,所以 热力学温标 水的三相点的 为 所以 水的三相点为273.16K,三相点的摄氏温度为 水的三相点为 三相点的摄氏温度为 0.0098℃≈0.01℃ , 所以 ℃ ℃ T/℃=T/K-273.15 ℃ -
6.2相律 相律
相律:平衡系统中 联系系统内相数 相律 平衡系统中,联系系统内相数 ,组分数 , 平衡系统中 联系系统内相数π,组分数K', 自由度数f及影响物质性质的外界因素 如温度, 及影响物质性质的外界因素(如温度 自由度数 及影响物质性质的外界因素 如温度,压 力等)之间关系的规律 力等 之间关系的规律 f=K'-π+n - 如果只考虑温度压力两个外因 f=K'-π+2 -
对于可逆相变 克拉佩龙方程
Sm H m = T
H m dp = dT T Vm
1.液-气平衡 液 气平衡 Vm(g)-Vm(l)≈ Vm(g)=RT/p -
d ln p vap H m = dT RT 2
(完整版)南京大学物理化学选择题答案完整版

第一章热力学第一定律及其应用物化试卷(一)1.物质的量为n的纯理想气体,该气体在如下的哪一组物理量确定之后,其它状态函数方有定值。
( )(A) p (B) V (C) T,U (D) T, p2. 下述说法哪一个正确? ( )(A) 热是体系中微观粒子平均平动能的量度 (B) 温度是体系所储存热量的量度(C) 温度是体系中微观粒子平均能量的量度 (D) 温度是体系中微观粒子平均平动能的量度3. 有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将: ( )(A)不变 (B)升高 (C)降低 (D)无法判定4. 1 mol 373 K,标准压力下的水经下列两个不同过程变成373 K,标准压力下的水气, (1) 等温等压可逆蒸发, (2) 真空蒸发这两个过程中功和热的关系为: ( )(A) |W1|> |W2| Q1> Q2 (B)|W1|< |W2| Q1< Q2(C) |W1|= |W2| Q1= Q2 (D)|W1|> |W2| Q1< Q25. 恒容下,一定量的理想气体,当温度升高时热力学能将:( )(A)降低 (B)增加 (C)不变 (D)增加、减少不能确定6. 在体系温度恒定的变化中,体系与环境之间: ( )(A) 一定产生热交换 (B) 一定不产生热交换(C) 不一定产生热交换 (D) 温度恒定与热交换无关7. 一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机拖动的列车运行的速度:( )(A) 较快 (B) 较慢 (C) 一样 (D) 不一定8. 始态完全相同(p1,V1,T1)的一个理想气体体系,和另一个范德华气体体系,分别进行绝热恒外压(p0)膨胀。
当膨胀相同体积之后,下述哪一种说法正确?( )(A) 范德华气体的热力学能减少量比理想气体多 (B) 范德华气体的终态温度比理想气体低(C) 范德华气体所做的功比理想气体少 (D) 范德华气体的焓变与理想气体的焓变相等9.ΔH =Qp , 此式适用于下列哪个过程:( )(A) 理想气体从106 Pa反抗恒外压105 Pa膨胀到105 Pa (B) 0℃ , 105 Pa 下冰融化成水(C) 电解 CuSO4水溶液 (D) 气体从(298 K, 105 Pa)可逆变化到(373 K, 104 Pa)10.在100℃和25℃之间工作的热机,其最大效率为: ( )(A) 100 % (B) 75 % (C) 25 % (D) 20 %11.对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条 (B) 二条 (C) 三条 (D) 三条以上12.某理想气体的γ =C p/Cv =1.40,则该气体为几原子分子气体? ( )(A) 单原子分子气体 (B) 双原子分子气体(C) 三原子分子气体 (D) 四原子分子气体13.实际气体绝热恒外压膨胀时,其温度将: ( )(A) 升高 (B) 降低 (C) 不变 (D) 不确定14.当以5 mol H2气与4 mol Cl2气混合,最后生成2 mol HCl气。
物理化学第五版南京大学傅献彩相平衡ppt课件

p / Pa
C
水f
E
超 临
A
界 水
F
冰
P
610.62 D O
q
B
水蒸气
273.16
TC T / K
过冷水处于不稳定状态,一旦有凝聚中心出现, 就立即全部变成冰。
两相平衡线上的任 何一点都可能有三种情 况。如OA线上的P点:
d ln p sub Hm
dT
RT 2
sub Hm 0 斜率为正。
OC线 dp H fus m
dT T V fus
E超
p / Pa
C
水f
A
临 界
F
水
fus H 0, fusV 0
斜率为负。
冰
P
O
610.ቤተ መጻሕፍቲ ባይዱ2D
q
B
水蒸气
273.16
TC T / K
OD 是AO的延长线 是过冷水和水蒸气
的介稳平衡线。
Φ(S 1) 2
根据化学势相等导出联系浓度变量的方程式数为
S(Φ 1)
§5.3 相 律
根据自由度的定义
f (S 1) 2S( 1)
f S2
这是相律的一种表示形式
(1)若化学反应中有R个独立的化学平衡
(2)系统的强度性质还要满足R‘ 附加条件,例 如浓度限制条件
§5.3 相 律
则相律表示式为
水的相 图是根 据实验 绘制的
水的相图
水的相图
p / Pa
C
水
A
f
610.62
冰
D B
P O
q
水蒸气
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K f ,2 = ( K f ,1 ) 2
返回
经验平衡常数
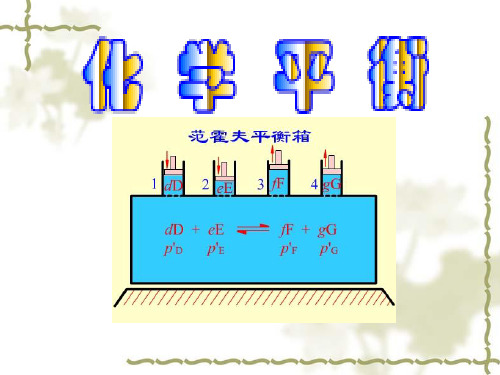
反应达平衡时,用反应物和生成物的实际压力、 摩尔分数或浓度代入计算,得到的平衡常数称为经 验平衡常数,一般有单位。例如,对任意反应:
dD + eE +⋯ → gG + hH +⋯
1. 用压力表示的经验平衡常数 K p
p (NH 3 ) p (H 2S) Kp = ⋅ p p
上一内容 下一内容 回主目录
= (p/ p )
1 4
返回
2
6.5 平衡常数的测定和平衡转化率的计算
平衡常数的测定 平衡转化率的计算
上一内容
下一内容
回主目录
返回
平衡常数的测定
(1)物理方法 直接测定与浓度或压力呈线性 关系的物理量,如折光率、电导率、颜色、光的吸收、 定量的色谱图谱和磁共振谱等,求出平衡的组成。这 种方法不干扰体系的平衡状态。 (2)化学方法 成。 用骤冷、抽去催化剂或冲稀等方
(dnB = ν B dξ )
∂G ( )T , p = ∑ν B µ B ∂ξ B
当 ξ = 1 mol 时:
B
B
(a)
(∆ r Gm), p = ∑ν B µ B T
B
上一内容 下一内容 回主目录
(b)
返回
热力学基本方程
这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 µ B保持不变。 公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等 于1 mol的变化。这时各物质的浓度基本不变,化学势 也保持不变。
Dalton 对理想气体,符合Dalton分压定律, pB = pxB
Kx = K p p
上一内容 下一内容
−
∑ν B
B
回主目录
返回
经验平衡常数
3.用物质的量浓度表示的平衡常数 K c
g h cG ⋅ cH ⋯ νB Kc = d e = Π cB cD ⋅ cE ⋯ B
对理想气体, p = cRT
上一内容 下一内容 回主目录
返回
为什么化学反应通常不能进行到底?
R P
因D、E混合 使自由能降低
G
因生成F后 D、E 、F混合 后的自由能降低
S
T
1
体系的自由能在反应 过程中的变化(示意图)
上一内容 下一内容 回主目录nD0返回
为什么化学反应通常不能进行到底?
若要使反应进行到底,须在van’t Hoff 平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点。
上一内容 下一内容 回主目录
返回
化学反应的方向与限度
∂G 用 ( ∂ξ )T , p ,
∑ν
B
B
µ B 或 (∆ r Gm )T , p 判断都是等效的。
(∆ r Gm )T , p < 0 反应自发地向右进行
(∆ r Gm )T , p > 0
(∆ r Gm )T , p = 0
反应自发地向左进行,不可能自发 向右进行 反应达到平衡
上一内容
下一内容
回主目录
返回
为什么化学反应通常不能进行到底?
将反应 D + E ⇌ 2F 为例,在反应过程中吉布斯自 由能随反应过程的变化如图所示。 R点,D和E未混合时吉布 斯自由能之和; P点,D和E混合后吉布斯 自由能之和; T点,反应达平衡时,所有 物质的吉布斯自由能之总 和,包括混合吉布斯自由 能; S点,纯产物F的吉布斯自由能。
上一内容
下一内容
回主目录
返回
什么叫复相化学反应?
有气相和凝聚相(液相、固体)共同参与的反 应称为复相化学反应。只考虑凝聚相是纯态的情况, 纯态的化学势就是它的标准态化学势,所以复相反 应的热力学平衡常数只与气态物质的压力有关。 例如,有下述反应,并设气体为理想气体:
CaCO3 (s) ⇌ CaO(s) + CO 2 (g)
上一内容 下一内容 回主目录
返回
用化学反应等温式判断反应方向
化学反应等温式也可表示为:
∆ r Gm = − RT ln K f + RT ln Q f
对理想气体
∆ r Gm = − RT ln K p + RT ln Q p
K p > Qp K p < Qp K p = Qp
上一内容 下一内容
∆ r Gm < 0 ∆ r Gm > 0 ∆ r Gm = 0
上一内容
下一内容
回主目录
返回
为什么化学反应通常不能进行到底?
上一内容
下一内容
回主目录
返回
化学反应亲和势(affinity of chemical reaction)
1922年,比利时热力学专家德唐德(De donder)首 先引进了化学反应亲和势的概念。他定义化学亲和势A为: def ∂G A − ( )T , p = −∑ν B µB ∂ξ B 或 A = -∆ r Gm A是状态函数,体系的强度性质。用A判断化学反 应的方向具有“势”的性质,即: A>0 反应正向进行 A<0 A=0
下一内容 回主目录
返回
化学反应的方向与限度
∂G ( )T , p < 0 ∂ξ
G
(
∂G )T , p > 0 ∂ξ
∂G ( )T , p = 0 ∂ξ
0
ξ
1
体系的吉布斯自由能和ξ的关系
上一内容 下一内容 回主目录
返回
为什么化学反应通常不能进行到底?
严格讲,反应物与产物处于同一体系的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合吉布斯自由能的缘故。
物理化学电子教案—第六章
上一内容
下一内容
回主目录
返回
第六章 化学平衡
6.1 化学平衡的条件和反应的亲和势 6.2 化学反应的平衡常数和等温方程式 6.3 平衡常数与化学方程式的关系 6.4 复相化学平衡 6.5 平衡常数的测定和平衡转化率的计算 6.6 标准生成吉布斯自由能 6.7 用配分函数计算∆ r Gm 和平衡常数 6.8 温度、压力及惰性气体对化学平衡的影响 6.9 同时平衡 6.10 反应的耦合 6.11 近似计算
回主目录
反应向右自发进行 反应向左自发进行 反应达平衡
返回
6.3 平衡常数与化学方程式的关系
平衡常数与化学方程式的关系 经验平衡常数
1. K p 2. K x 3. K c 4. K a
上一内容 下一内容 回主目录
返回
平衡常数与化学方程式的关系
∆ r Gm (T ) = − RT ln K f
下标 m 表示反应进度为 1 mol 时的标准Gibbs自 由能的变化值。显然,化学反应方程中计量系数呈 ∆ 倍数关系, r Gm (T ) 的值也呈倍数关系,而 K f 值则 呈指数的关系。 例如: (1) 1 H 2 (g) + 1 I 2 (g) = HI(g) ∆ r Gm,2 = 2∆ r Gm,1 2 2 (2) H 2 (g) + I 2 (g) = 2HI(g)
( f G / p )g ( f H / p ) h ⋯ ∆ r Gm (T ) = − RT ln ( f D / p )d ( f E / p )e ⋯
= − RT ln K f K f 称为热力学平衡常数,它仅是温度的函数。
在数值上等于平衡时的“逸度商”,是量纲1的量, 单位为1。因为它与标准化学势有关,所以又称为 标准平衡常数。
式中 f B 为逸度,如果气体 是理想气体,则 f B = pB 。
将化学势表示式代入 (∆ r Gm )T , p 的计算式,得:
( ∆ r Gm ) T , p
fB = ∑ν B µ B = ∑ν B µ B (T ) + ∑ν B RT ln B p B B
令: ∆ r Gm (T ) = ∑ν B µ B (T )
法使反应停止,然后用化学分析的方法求出平衡的组
上一内容
下一内容
回主目录
返回
平衡转化率的计算
平衡转化率又称为理论转化率,是达到平衡后, 反应物转化为产物的百分数。
达平衡后原料转化为产物的量 平衡转化率 = × 100% 投入原料的量
工业生产中称的转化率是指反应结束时,反应物 转化为产物的百分数,因这时反应未必达到平衡,所 以实际转化率往往小于平衡转化率。
g h pG ⋅ pH ⋯ νB K p = d e = Π pB pD ⋅ pE ⋯ B
当 ∑ν B = 0 时, K p 的单位为1。
上一内容 下一内容 回主目录
返回
经验平衡常数
2.用摩尔分数表示的平衡常数 K x
g h xG ⋅ xH ⋯ νB K x = d e = Π xB xD ⋅ xE ⋯ B
K p = p (CO 2 ) / p
p (CO 2 ) 称为 CaCO 3 (s) 的解离压力。
上一内容 下一内容 回主目录
返回
解离压力(dissociation pressure)
某固体物质发生解离反应时,所产生气体的压 力,称为解离压力,显然这压力在定温下有定值。 如果产生的气体不止一种,则所有气体压力的总 和称为解离压。 例如: NH 4 HS(s) = NH 3 (g) + H 2S(g) 解离压力 p = p ( NH 3 ) + p (H 2S) 则热力学平衡常数:
各物质的变化量必须满足:
0 = ∑ν B B
B
