蛋白质组学作业
高二生物专题 蛋白质的结构和功能及相关计算暑假作业(含解析)
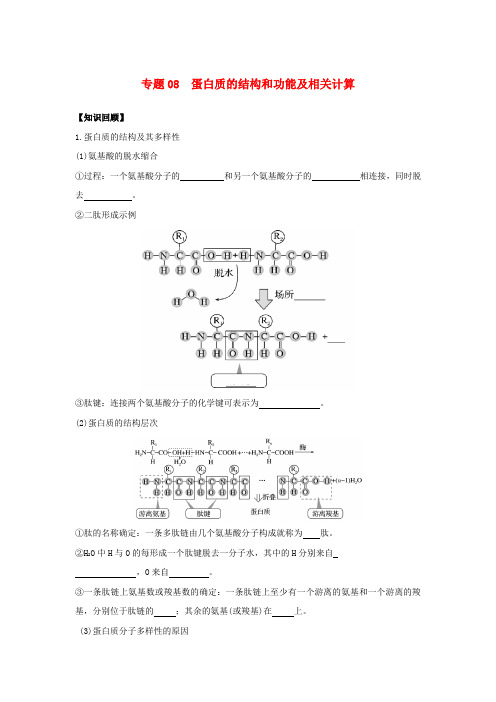
专题08 蛋白质的结构和功能及相关计算【知识回顾】1.蛋白质的结构及其多样性(1)氨基酸的脱水缩合①过程:一个氨基酸分子的和另一个氨基酸分子的相连接,同时脱去。
②二肽形成示例③肽键:连接两个氨基酸分子的化学键可表示为。
(2)蛋白质的结构层次①肽的名称确定:一条多肽链由几个氨基酸分子构成就称为肽。
②H2O中H与O的每形成一个肽键脱去一分子水,其中的H分别来自,O来自。
③一条肽链上氨基数或羧基数的确定:一条肽链上至少有一个游离的氨基和一个游离的羧基,分别位于肽链的;其余的氨基(或羧基)在上。
(3)蛋白质分子多样性的原因②多肽链的盘曲、折叠方式及其形成的 。
2.氨基酸缩合与相关计算(1)蛋白质相对分子质量、氨基酸数、肽链数、肽键数和失去水分子数的关系①肽键数=失去水分子数=氨基酸数- ;②蛋白质相对分子质量=氨基酸数目×氨基酸平均相对分子质量- 。
(不考虑形成二硫键)注:氨基酸平均分子质量为a 。
(2)蛋白质中游离氨基或羧基数目的计算①至少含有的游离氨基或羧基数=肽链数×1。
②游离氨基或羧基数目=肽链数×1+ 。
(3)利用原子守恒法计算肽链中的原子数①N 原子数=肽键数+肽链数+ =各氨基酸中N 原子总数。
②O 原子数=肽键数+2×肽链数+ =各氨基酸中O 原子总数-脱去水分子数。
【想一想】例1.下图是某多肽的结构式,下列说法正确的是( )A.该多肽具有三个氨基和三个羧基B.该多肽具有三个肽键,所以该物质属于三肽C.该多肽中的R 基有②、④、⑥、⑧、⑨D.将该多肽水解成氨基酸需要三个水分子例2.如图为某蛋白质的结构示意图,其中“—S—S—”为由两个“—SH”(巯基)构成的二硫键,其作用是连接两个相邻肽链。
若该蛋白质分子共由m个氨基酸组成,则形成一个该蛋白质分子时生成的水分子数和减少的相对分子质量分别为( )A.m,18mB.(m-4),18(m-4)C.(m-3),18(m-3)+4D.(m-2),18(m-2)+4例3. 有关生物体内蛋白质的叙述正确的是A.不同氨基酸之间的差异是由DNA决定的B.蛋白质中N原子数目与肽键数目相等C.在m个氨基酸参与合成的n条肽链中,至少含有m+n个氧原子D.氨基酸之间的脱水缩合作用发生在核糖体、内质网和高尔基体等细胞器中【练一练】1.下图为氨基酸分子的结构通式,下列叙述正确的是( )A.结构④在生物体内约有20种B.氨基酸脱水缩合产生水,水中的氢来自于②和③C.结构④中含有的氨基或羧基一般不参与脱水缩合D.生物体内n个氨基酸形成一条多肽链需要n种密码子2.下列关于氨基酸的叙述中,正确的是( )A.组成蛋白质的氨基酸之间可按不同的方式脱水缩合B.生物体内组成蛋白质的氨基酸中,不同氨基酸之间的差异是由R基引起的C.生物体内组成蛋白质的氨基酸均可以在人体细胞中合成D.细胞中氨基酸种类和数目相同的蛋白质是同一种蛋白质3.层粘连蛋白由一条重链(α)和两条轻链(β1、β2)经二硫键交联而成,外形呈十字形。
《蛋白质作业设计方案》

《蛋白质》作业设计方案一、作业目标:通过本次作业设计,学生将能够:1. 理解蛋白质的结构和功能;2. 掌握蛋白质的合成和降解过程;3. 了解蛋白质在生物体内的重要作用;4. 提高学生的实验设计和数据分析能力。
二、作业内容:1. 理论部分:(1)蛋白质的结构和功能:介绍蛋白质的基本结构、氨基酸组成和功能分类;(2)蛋白质的合成和降解:阐述蛋白质的合成和降解机制及影响因素;(3)蛋白质在生物体内的作用:探讨蛋白质在生物体内的重要作用及相关钻研进展。
2. 实验设计:(1)实验目标:通过实验,观察蛋白质的合成和降解过程,探究蛋白质在生物体内的作用;(2)实验材料:蛋白质提取试剂盒、细胞培养基、细胞系等;(3)实验步骤:包括蛋白质提取、SDS-PAGE电泳、Western blot等步骤;(4)实验数据分析:分析实验结果,探讨蛋白质合成和降解的特点及影响因素。
三、作业要求:1. 撰写实验报告:包括实验目标、材料和方法、结果分析及结论等内容;2. 提交实验数据:包括实验记录、图片、图表等;3. 参与讨论:参与教室讨论,分享实验心得和思考;4. 准时提交作业:按时提交实验报告和数据。
四、评分标准:1. 实验报告撰写规范:包括格式、内容完备性、语言表达等方面;2. 实验数据准确性:实验数据的准确性和可靠性;3. 实验结果分析能力:对实验结果进行合理分析和讨论的能力;4. 参与讨论情况:积极参与教室讨论,分享实验心得和思考。
五、参考资料:1. 《蛋白质化学与蛋白质组学》(王明昊著,科学出版社)2. 《蛋白质生物化学》(张三、李四著,高等教育出版社)六、作业安排:1. 作业安置时间:第一周;2. 实验进行时间:第二周至第四周;3. 作业提交时间:第五周。
七、备注:本次作业设计旨在培养学生的实验设计和数据分析能力,希望学生能够认真完成实验,并按时提交作业。
如有任何疑问,可随时与老师联系。
祝学生们在本次作业中取得好成绩!。
第一次作业--静态生化 (1)

第一章蛋白质化学一、选择题1、为获得不变性的蛋白质,常用的方法有( D )A 用三氯醋酸沉淀B 用苦味酸沉淀C 用重金属盐沉淀D 低温盐析E 常温醇沉淀2、蛋白质一级结构的主要化学键是( B ) --强调主要A 氢键B 肽键C 盐键D 二硫键3、维持蛋白质胶体稳定性的因素是:( C )A . 水化膜 B. 电荷 C A+B D 以上都不是4、各种蛋白质含氮量很接近,平均为:( C )A 24%B 55%C 16%D 6.25%5、蛋白质不同于氨基酸的理化性质为:( D )A 等电点B 两性电离C 呈色反应D 胶体性6、某一豆类种子5.00克,测得其蛋白氮为0.288克,其蛋白质的含为( D )A 5.76%B 18.0 %C 28.8 %D 36.0 %7、蛋白质的组成成分中,在280nm处有最大吸收值的最主要成分是:AA.酪氨酸的酚环B.半胱氨酸的硫原子C.肽键D.苯丙氨酸8、下列哪一项不是蛋白质α-螺旋结构的特点?BA.天然蛋白质多为右手螺旋B.肽链平面充分伸展C.每隔3.6个氨基酸螺旋上升一圈。
D.每个氨基酸残基上升高度为0.15nm.9、下列哪一项不是蛋白质的性质之一?CA.处于等电状态时溶解度最小B.加入少量中性盐溶解度增加C.变性蛋白质的溶解度增加D.有紫外吸收特性10、下列氨基酸中哪一种不具有旋光性?CA.Leu B.Ala C.Gly D.Ser E.Val11、下列有关蛋白质的叙述哪项是正确的?AA.蛋白质分子的净电荷为零时的pH值是它的等电点B.大多数蛋白质在含有中性盐的溶液中会沉淀析出C.由于蛋白质在等电点时溶解度最大,所以沉淀蛋白质时应远离等电点D.以上各项均不正确12、下列关于蛋白质结构的叙述,哪一项是错误的?AA.氨基酸的疏水侧链很少埋在分子的中心部位B.电荷的氨基酸侧链常在分子的外侧,面向水相C.白质的一级结构在决定高级结构方面是重要因素之一D.白质的空间结构主要靠次级键维持13、下列哪项与蛋白质的变性无关?AA. 肽键断裂B.氢键被破坏C.离子键被破坏D.疏水键被破坏15、下列哪个性质是氨基酸和蛋白质所共有的?BA.胶体性质B.两性性质C.沉淀反应D.变性性质E.双缩脲反应16、蛋白质空间构象的特征主要取决于下列哪一项?AA.多肽链中氨基酸的排列顺序B.次级键C.链内及链间的二硫键D.温度及pH17、蛋白质二级结构的维持键是:( C )A 肽键 B. 二硫键 C .氢键 D .共价键18、下列氨基酸制成溶液,在25℃pH=7.00的条件下进行电泳,移向阴极的是( A )。
蛋白质化学作业-答案

蛋⽩质化学作业-答案蛋⽩质化学作业⼀:名词解释:等电点:在某⼀种特定PH的溶液中,某物质以两性离⼦形式存在,所带的正负电荷总数相等,静电荷数为零,在电场中它即不向正极移动也不向负极移动,此时的PH值为该物质的等电点。
盐析和盐溶:蛋⽩质溶液中加⼊中性盐后,因盐的浓度不同可产⽣不同的反应。
低盐浓度时,随盐浓度的增加,蛋⽩质溶解度增加的现象,称为盐溶。
⽽⾼浓度中性盐可使蛋⽩质分⼦脱⽔并中和其电荷,从⽽使蛋⽩质从溶液中沉淀出来,称为盐析。
蛋⽩质变性:天然蛋⽩质分⼦由于受到物理或化学因素的影响使次级键断裂,引起天然构象的改变,导致其⽣物活性的丧失及⼀些理化性质的改变,但未引起肽键的断裂,这种现象称为蛋⽩质的变性。
结合蛋⽩:由简单蛋⽩质即只有氨基酸成分的蛋⽩质与⾮蛋⽩质组分结合⽽成,其⾮蛋⽩质组分通常称为辅基。
蛋⽩质亚基:是组成蛋⽩质四级结构最⼩的共价单位。
在具有四级机构的蛋⽩质中有三级机构的球蛋⽩称为亚基。
它可由⼀条肽链组成,也可由⼏条肽链通过⼆硫键和次级键连接在⼀起组成。
酰胺平⾯:肽键中C-N具有双键的性质,因⽽C-N不能⾃由旋转,这样使得与它相连的原⼦都固定在⼀个平⾯,这个平⾯就称为酰胺平⾯。
诱导契合:酶分⼦活性中⼼的结构原来并⾮和底物的结构互相吻合,但酶的活性中⼼是亲性的⽽⾮刚性的,当底物与酶相遇时,可诱导酶活性中⼼的构象发⽣相应的变化,其上有关的各个集团达到正确的排列和定向,因⽽使酶和底物契合⽽结合成中间络合物,并引起底物发⽣反应。
反应结束当产物从原酶上脱落下来后,酶的活性中⼼有恢复了原来的构象。
⼆:判断题:2题对,其余错三:填空题:1. ⾊氨酸、酪氨酸2. ①⼆硫键②疏⽔键③范得华⼒3. ①协同②变构4. ①α--氨基②α-羧基③侧链可解离基团四:选择题:(1):1;(2):3;(3):2五:问答题:1,什么叫蛋⽩质的⼀级、⼆级、三级、四级结构?维持以上各层次结构的作⽤⼒有哪些?蛋⽩质⼀级结构:由氨基酸在多肽链中的数⽬、类型和顺序所描述的多肽链的基本结构。
2.2蛋白质作业1(普通)
一、单项选择题1.(原创Lf)活细胞内最多的有机物、无机物、化学元素、占细胞干重最多化学元素依次是A.蛋白质、水氧碳 B.蛋白质、无机盐氧碳C.核酸、水碳氧 D.脂质、水、碳、氧2.不法商家将含“伪蛋白氮”较高的三聚氰胺掺入奶粉,提高检测时蛋白质数值,大大降低生产成本。
蛋白质含量检测通常不是直接测定蛋白质含量,而是通过测氮含量来推算蛋白质含量。
一般说来,每100克蛋白质平均含氮16克,这些氮主要存在于蛋白质的A.R基 B.游离的氨基 C.游离的羧基D.—CO—NH—3.同为组成生物体蛋白质的氨基酸,酪氨酸几乎不溶于水,精氨酸易溶于水,这种差异取决于A. 酪氨酸的氨基多B.两者的结构完全不同C.两者R基团组成的不同D.精氨酸的羧基多4.下列有关蛋白质和氨基酸的叙述中,全部正确的组合是()①氨基酸是组成蛋白质的基本单位②必需从食物中获取的氨基酸为必需氨基酸,成人共8种③生物体内的氨基酸约有20种④非必需氨基酸是人体不需要的氨基酸,故自身不能合成⑤蛋白质必须经过消化成为氨基酸才能被人体吸收利用A.①②③④ B.①③④⑤ C.②③④⑤ D.①②③⑤5.下列化合物中,不是组成蛋白质的氨基酸的是()6.(改编lf)赖氨酸的分子式为 C6 H14O2N2 , 甲硫氨酸的R基是-CH2-CH2-S-CH3,则赖氨酸的R 基、甲硫氨酸的分子式分别为()A.-C4H10 N C5H11O2NS B.-C4H10 O C5H11O2NSC.-C4H10 ON C4H11O2S D.-C5H11 N C5H10O2N7.R基为—C3 H 5 O2的一个谷氨酸分子中,含有C、H、O、N的原子数分别为()A.5、9、4、1 B.4、8、5、2 C.5、8、4、1 D.4、9、4、1 8.两个氨基酸脱水缩合成二肽并生成水,这个水分子中的氢原子来自氨基酸的()A.氨基 B.氨基和羧基 C.R基 D.羧基9.有两种氨基酸,它们在形成二肽时可能缩合的基团是( )A.①④B.①③C.②④D.②③10.(10广东)组成蛋白质的氨基酸之间的肽键结构式是( )A.NH—COB.—NH—CO—C.—NH2—COOH—D.NH2—COOH11.脑啡肽是一种具有镇痛作用的药物,它的基本组成单位是氨基酸。
高一生物蛋白质练习题

生物假期作业1组成蛋白质的基本单位是_______________ ,其结构通式: ___________________ ,在生物体中约有___________ 种。
人体细胞不能合成的,必须从外界环境中直接获取的氨基酸叫做_____________ ,有 _____________________ 种;人体细胞能够合成的,叫做 ____________ 。
有_____________ 种 2 .一个氨基酸分子的___ 和另一个氨基酸分子的 ____________________ 相连接,同时脱去___________ 分子的水,这种结合方式叫做_____________________ ,连接两个氨基酸分子的化学键( _________________ )叫做___________________ 。
3. ___________________________________ 由两个氨基酸分子缩合(失去______________ 分子水)而成的化合物,叫做 __________________ 。
由三个氨基酸分子缩合(失去 _________ 分子水)而成的化合物,叫做三肽。
由多个(n个)氨基酸分子缩合(失去 ___________ 分子水)而成的化合物,叫做________________ ,通常呈_____________ 状结构,叫做______________________ 。
4. ________________________________________ 在细胞内,每种氨基酸的数目_________ ,氨基酸形成多肽链时, ____________________________ 氨基酸的______________ 千变万化,多肽链的盘曲、折叠方式及其形成的___________________ 千差万别,因此蛋白质分子的结构是相其多样的。
5•蛋白质分子在细胞中承担着多种重要功能。
第十五蛋白质生物合成作业及答案

E.先从5‘-末端阅读,然后再从3’-末端阅读
40.AUG的重要性在于:
A.作为附着于30S核糖体位点B.作为tRNA的识别位点C.作为肽链的释放因子
D.作为肽链合成的终止密码子E.作为肽链的起始密码子
41.摆动配对是指下列哪些碱基之间配对不严格:
37.核蛋白体的结构特点是:
A.单链蛋白质B.由大、小亚基组成C.四个亚基组成D.三个亚基组成E.亚基与NAD构成
38.翻译的含义是指:A.mRNA的合成B.tRNA的合成
C.tRNA运输氨基酸D.核蛋白体大,小亚基的聚合与解聚E.以mRNA为模板合成蛋白质的过程
39.mRNA的信息阅读方式是:
A.从多核苷酸链的5‘末端向3’末端进行B.从多核苷酸链的3‘-末端向5’-末端进行
8.反密码子是指
A.DNA中的遗传信息B.tRNA中的某些部分C.mRNA中除密码子以外的其他部分
D.rRNA中的某些部分E.密码子的相应氨基酸
9.密码GGC的对应反密码子是CD.CGCE.GGC
10.在蛋白质生物合成中转运氨基酸作用的物质是A.mRNAB.rRNAC.hnRNAD.DNAE.tRNA
6.蛋白质生物合成过程特点是
A.蛋白质水解的逆反应B.肽键合成的化学反应C.遗传信息的逆向传递
D.在核蛋白体上以mRNA为模板的多肽链合成过程E.氨基酸的自发反应
7.关于mRNA,错误的叙述是
A.一个mRNA分子只能指导一种多肽链生成B.mRNA通过转录生成
C.mRNA与核蛋白体结合才能起作用D.mRNA极易降解E.一个tRNA分子只能指导一分于多肽链生成
11.凡AUG三联密码都是
《蛋白质》 学习任务单

《蛋白质》学习任务单一、学习目标1、了解蛋白质的组成和结构(1)掌握蛋白质的基本组成单位——氨基酸的结构和分类。
(2)理解氨基酸通过肽键形成多肽链的过程。
(3)认识蛋白质的一级、二级、三级和四级结构。
2、掌握蛋白质的性质(1)熟悉蛋白质的两性电离和等电点。
(2)了解蛋白质的胶体性质、沉淀、变性和复性。
3、理解蛋白质的功能(1)认识蛋白质在生物体中的结构支持作用。
(2)掌握蛋白质作为酶的催化功能。
(3)明白蛋白质在免疫、运输、调节等方面的重要作用。
4、了解蛋白质的代谢(1)知道蛋白质的合成过程和所需的条件。
(2)明白蛋白质的分解代谢途径和终产物。
5、能够运用蛋白质的知识解决实际问题(1)解释日常生活中与蛋白质相关的现象,如食物的烹饪和保存。
(2)分析蛋白质在疾病诊断和治疗中的应用。
二、学习内容(一)蛋白质的组成1、氨基酸结构特点:每个氨基酸分子至少含有一个氨基(NH₂)和一个羧基(COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上。
分类:根据氨基酸分子中所含氨基和羧基的数目、位置以及侧链基团的不同,可以分为酸性氨基酸、碱性氨基酸和中性氨基酸。
必需氨基酸和非必需氨基酸:人体不能合成或合成速度不能满足机体需要,必须从食物中摄取的氨基酸称为必需氨基酸,共 8 种;人体能够自身合成的氨基酸称为非必需氨基酸。
2、肽键和多肽链肽键:一个氨基酸的羧基与另一个氨基酸的氨基脱去一分子水形成的化学键称为肽键。
多肽链:多个氨基酸通过肽键连接形成的链状结构称为多肽链。
多肽链有一定的方向性,一端是氨基末端(N 端),另一端是羧基末端(C 端)。
(二)蛋白质的结构1、一级结构定义:蛋白质的一级结构是指多肽链中氨基酸的排列顺序。
意义:一级结构是蛋白质的基础,决定了蛋白质的高级结构和功能。
2、二级结构定义:蛋白质的二级结构是指多肽链主链在一级结构的基础上进一步盘旋、折叠形成的周期性结构。
主要形式:包括α螺旋、β折叠、β转角和无规卷曲等。
《蛋白质的结构与功能》 作业设计方案

《蛋白质的结构与功能》作业设计方案一、作业目标1、让学生深入理解蛋白质的各级结构及其特点。
2、掌握蛋白质结构与功能之间的关系。
3、培养学生运用所学知识分析和解决实际问题的能力。
二、作业内容(一)基础知识巩固1、简述蛋白质的一级结构,并举例说明其对蛋白质功能的影响。
2、描述蛋白质的二级结构的主要类型(α螺旋、β折叠等),并阐述其形成的条件和特点。
(二)结构分析1、给出一种蛋白质的氨基酸序列,要求学生预测其可能形成的二级结构,并说明理由。
2、展示几种蛋白质的三维结构图片,让学生指出其结构中的关键部位(如活性中心、结合位点等),并解释其功能。
(三)功能探究1、分析某些疾病(如镰状细胞贫血)与蛋白质结构异常之间的关系,探讨蛋白质结构改变如何影响其功能。
2、研究一种酶的作用机制,解释其活性部位的结构特点如何决定了酶的催化功能。
(四)综合应用1、假设要设计一种具有特定功能的蛋白质,学生需要提出可能的氨基酸序列和预期的结构。
2、给定一种新发现的蛋白质,要求学生通过查阅资料和分析结构,推测其可能的功能。
三、作业形式1、书面作业完成简答题和论述题,要求逻辑清晰、表达准确。
绘制蛋白质结构示意图,并标注关键部位。
2、小组作业分组讨论疾病与蛋白质结构异常的案例,形成报告。
共同设计具有特定功能的蛋白质,制作 PPT 进行展示。
3、在线作业利用在线学习平台进行知识点的小测验,及时反馈学习情况。
参与相关的论坛讨论,与其他同学交流对蛋白质结构与功能的理解。
四、作业时间安排1、基础知识巩固:在课程学习后的当天完成,预计耗时 1 小时。
2、结构分析:在基础知识巩固作业完成后的两天内完成,预计耗时 2 小时。
3、功能探究:在结构分析作业完成后的三天内完成,预计耗时 3小时。
4、综合应用:在功能探究作业完成后的一周内完成,预计耗时 4小时(包括小组讨论和准备展示的时间)。
五、作业评价1、书面作业:根据答案的准确性、完整性和逻辑性进行评分。
2019精选医学蛋白质化学习题.doc

第一章蛋白质化学习题作业题部分:一.选择题:1.下列哪种蛋白质结构成分对280nm波长处光吸收的作用最大?()⑴Trp的吲哚环⑵Tyr的苯酚环⑶Phe的苯环⑷肽键⑸Cys的硫原子2.下列哪种氨基酸可解离侧链的pK值最接近于生理pH?(4 )⑴Cys ⑵Glu ⑶Gln ⑷His ⑸Lys3.茚三酮是以下列哪种方式与氨基酸反应的?(5 )⑴脱氢作用⑵氨基还原作用⑶特定肽键的断裂⑷侧链的裂解⑸氧化脱羧脱氨的作用4.下列哪种氨基酸只有当其前体参入多肽后才能被合成?(3 )胶原蛋白⑴Phe ⑵Lys ⑶Hyp ⑷Glu ⑸Ser5.用下列哪些实验可检测氨基酸混合物中的酪氨酸?()⑴坂口反应⑵福林试剂反应⑶乙醛酸反应⑷米伦反应6.用下列方法中测定蛋白质含量,哪一种需要完整的多肽?(1 )⑴双缩脲反应⑵凯氏定氮法⑶紫外吸收⑷茚三酮反应7.关于Phe-Leu-Ala-Val-Phe-Leu-Lys的叙述哪些是正确的?(3.5)⑴是具有7个肽键的分子⑵是一个六肽⑶对脂类表面有亲和力⑷可被胰蛋白酶水解⑸是一个碱性多肽,等电点大于pH 88.下列哪些蛋白质是结合蛋白?()⑴粘蛋白⑵细胞色素C ⑶血红蛋白⑷清蛋白⑸组蛋白9.下列关于α-螺旋的叙述中,哪些是正确的?(除3 )⑴它是靠分子内氢键来达到稳定的⑵它是通过最大限度减弱不利的R基相互作用来达到稳定的⑶它是借疏水交互作用来达到稳定的⑷它是存在于某些蛋白质中的二级结构的一种类型⑸Pro和Gly可中断α-螺旋10.下列关于蛋白质结构的叙述哪些是正确的?(除4)⑴二硫键对稳定蛋白质的构象起重要作用⑵带电荷的氨基酸侧链在水中趋向排列在分子的外侧⑶蛋白质的一级结构决定其高级结构⑷氨基酸的疏水侧链很少埋在蛋白质分子的内部11.有一糖蛋白,经测定其蛋白氮含量为0.5mol ,那么其粗蛋白含量为多少?(1 )⑴43.75g ⑵45.64g ⑶1.12g ⑷无法计算12.下列关于血红蛋白的叙述哪些是正确的?(4.5)⑴四个血红素都能找到互不依赖的结合氧⑵结合氧的百分数对氧分压作图时图象呈双曲线⑶O2较CO更易与血红蛋白结合⑷O2和血红蛋白的结合并不导致血红素铁化合价的改变⑸酸中毒、提高CO2的水平都会导致Hb与氧亲和力的下降,从而降低DPG水平可提高Hb的氧亲和力13.生理状态下,血红蛋白与氧可逆结合的铁离子处于什么状态?(1 )⑴还原性的二价状态⑵氧化性的三价状态⑶与氧结合时是三价,去氧后成二价⑷与氧结合时是二价,去氧后成三价14.血红蛋白的氧合曲线呈(3 )⑴双曲线⑵抛物线⑶S型曲线⑷直线⑸钟罩形15.SDS凝胶电泳测定蛋白质的分子量是根据各种蛋白质(2 )⑴在一定pH条件下所带电荷的不同⑵分子大小不同⑶分子极性不同⑷溶解度不同16.下列有关肌红蛋白的叙述,哪些是正确的?(除4)⑴肌红蛋白是由一条多肽链和一个血红素连接而成的紧密球状结构⑵多肽链含有高比例的α-螺旋构象⑶血红素位于二个组氨酸残基之间⑷大部分非极性基团位于球状结构的外部二.填空题:1.组成蛋白质分子的碱性氨基酸有、、和。
1 第二章 蛋白质化学作业及答案.

班级学号姓名第二章《蛋白质化学》作业及参考答案第一部分试题1.氨基酸的侧链对多肽或蛋白质的结构和生物学功能非常重要。
用三字母缩写形式列出其侧链为如下要求的氨基酸:(a)含有一个羟基;b)含有一个氨基;c)含有一个具有芳香族性质的基团;(d)含有分支的脂肪族烃链;(e)含有硫;(f)含有一个在pH 7-10范围内可作为亲核体的基团或原子,指出该亲核基团或原子。
2.某种溶液中含有三种三肽:Tyr - Arg - Ser , Glu - Met - Phe 和Asp - Pro - Lys , α- COOH基团的pKa 为3.8; α-NH3基团的pKa为8.5。
在哪种pH(2.0,6.0或13.0)下,通过电泳分离这三种多肽的效果最好?3.利用阳离子交换层析分离下列每一对氨基酸,哪一种氨基酸首先被pH7缓冲液从离子交换柱上洗脱出来。
(a)Asp和Lys;(b)Arg和Met;c)Glu和Val;(d)Gly和Leu(e)Ser和Ala4.胃液(pH=1.5)的胃蛋白酶的等电点约为1,远比其它蛋白质低。
试问等电点如此低的胃蛋白酶必须存在有大量的什么样的官能团?什么样的氨基酸才能提供这样的基团?5.一个含有13个氨基酸残基的十三肽的氨基酸组成为:Ala, Arg,2 Asp, 2Glu, 3Gly, Leu, 3Val。
部分酸水解后得到以下肽段,其序列由Edman降解确定,试推断原始寡肽的序列。
(a)Asp - Glu - Val - Gly - Gly - Glu - Ala(b)Val - Asp - Val - Asp - Glu(c)Val - Asp - Val(d)Glu - Ala -Leu - Gly -Arg(e)Val - Gly - Gly - Glu - Ala - Leu(f)Leu - Gly - Arg6.由下列信息求八肽的序列。
(a)酸水解得Ala,Arg,Leu,Met,Phe,Thr,2Val(b)Sanger试剂处理得DNP-Ala。
蛋白质作业

Chromatography is the collective term for a set of laboratory techniques for the separation of mixtures. The various constituents of the mixture travel at different speeds, causing them to separate. The separation is based on differential partitioning between the mobile and stationary phases. Subtle differences in a compound's partition coefficient result in differential retention on the stationary phase and thus changing the separation.Inclusion bodies are nuclear or cytoplasmic aggregates of stainable substances, usually proteins. They have a non-unit lipid membrane. Protein inclusion bodies are classically thought to contain misfolded protein.Western blot is a widely used analytical technique used to detect specific proteins in the given sample of tissue homogenate or extract. It uses gel electrophoresis to separate native proteins by 3-D structure or denatured proteins by the length of the polypeptide. The proteins are then transferred to a membrane, where they are probed using antibodies specific to the target protein.SDS-PAGE,sodium dodecyl sulfate polyacrylamide gel electrophoresis, describes a technique widely used to separate proteins according to their electrophoretic mobility. SDS is an anionic detergent applied to protein sample to linearize proteins and to impart a negative charge to linearizedproteins.In most proteins, the binding of SDS to the polypeptide chain imparts an even distribution of charge per unit mass, thereby resulting in a fractionation by approximate size during electrophoresis.Stationary phase is the substance which is fixed in place for the chromatography procedure. Examples include the silica layer in thin layer chromatography.Mobile phase is the phase which moves in a definite direction. The mobile phase consists of the sample being separated or analyzed and the solvent that moves the sample through the column. The mobile phase moves through the chromatography column where the sample interacts with the stationary phase and is separated.Salting out is a method of separating proteins based on the principle that proteins are less soluble at high salt concentrations. The salt concentration needed for the protein to precipitate out of the solution differs from protein to protein.HPLC, high-performance liquid chromatography, is a chromatographic technique used to separate a mixture of compounds in analytical chemistry and biochemistry with the purpose of identifying, quantifying and purifying the individual components of the mixture.1.蛋白质序列的测定主要有传统的Edamn降解法测定接质谱测序技术Edman降解法测序基本策略:先确定蛋白质分子由几条肽链构成,将肽链拆开分离出单条肽链,然后用化学法或酶解法水解成肽段,再对肽段进行氨基酸序列测定。
982-习题作业-蛋白质性质实验

氨基酸和
氨基酸。
2.紫外吸收法(280nm)定量测定蛋白质时其主要依据是因为大多数可溶性蛋白质分子中含
有 氨基酸、
氨基酸或
氨基酸。
4.氨基酸与水合印三酮反应的基团是 ,除脯氨酸以外反应产物的颜色是 ;因为脯氨
酸是 a—亚氨基酸,它与水合印三酮的反应则显示 色。
6.镰刀状贫血症是最早认识的一种分子病,患者的血红蛋白分子 b 亚基的第六位
B、主肽链的折叠单位~肽平面之间相关一个 Ca 碳原子 C、蛋白质变性过程中空间结构和一级结构被破坏,因而丧失了原有生物活性
D、维持蛋白质三维结构的次级键有氢键、盐键、二硫键、疏水力和范德华力
11.蛋白质变性过程中与下列哪项无关( )
A、理化因素致使氢键破坏 B、疏水作用破坏
C、蛋白质空间结构破坏
D、蛋白质一级结构破坏,分子量变小
C、1/2(2.19+4.25)
D、1/3(2.17+9.04+9.67)
5.氨基酸不具有的化学反应是( )
A、肼反应 B、异硫氰酸苯酯反应 C、茚三酮反应 D、双缩脲反应
6.当层析系统为正丁醇∶冰醋酸∶水=4∶1∶5 时,用纸层析法分离苯丙氨酸(F)、丙氨酸
(A)和苏氨酸(T)时则它们的 Rf 值之间关系应为:( ) A、F>A>T B、F>T>A C、A>F>T D、T>A>F
和
。
二、选择填空题
1.侧链含有咪唑基的氨基酸是( )
A、甲硫氨酸 B、半胱氨酸 C、精氨酸 D、组氨酸
2.pH 为 8 时,荷正电的氨基酸为( )
A、Glu B、Lys
C、Ser D、Asn
3.精氨酸的 Pk1=2.17、Pk2=9.04(a-NH3)Pk3=12.48(胍基)PI=( )
14 第十五蛋白质生物合成作业及答案

班级学号姓名第十三章蛋白质生物合成作业及参考答案单选题1.真核生物在蛋白质生物合成中的启始tRNA是A.亮氨酸TrnAB.丙氨酸tRNAC.赖氨酸tRNAD.甲酰蛋氨酸tRNAE.蛋氨酸tRNA2.原核生物蛋白质生物合成中肽链延长所需的能量来源于A.A TPB.GTPC.GDPD.UTPE.CTP3.哺乳动物核蛋白体大亚基的沉降常数是A.40S B.70S C.30S D.80S E.60S4.下列关于氨基酸密码的叙述哪一项是正确的A.由DNA链中相邻的三个核苷酸组成B.由tRNA链中相邻的三个核苷酸组成C.由mRNA链中相邻的三个核苷酸组成D.由rRNA链中相邻的三个核苷酸组成E.由多肽链中相邻的三个氨基酸组成5.mRNA作为蛋白质合成的模板,根本上是由于A.含有核糖核苷酸B.代谢快C.含量少D.由DNA转录而来E.含有密码子6.蛋白质生物合成过程特点是A.蛋白质水解的逆反应B.肽键合成的化学反应C.遗传信息的逆向传递D.在核蛋白体上以mRNA为模板的多肽链合成过程E.氨基酸的自发反应7.关于mRNA,错误的叙述是A.一个mRNA分子只能指导一种多肽链生成B.mRNA通过转录生成C.mRNA与核蛋白体结合才能起作用D.mRNA极易降解E.一个tRNA分子只能指导一分于多肽链生成8.反密码子是指A.DNA中的遗传信息B.tRNA中的某些部分C.mRNA中除密码子以外的其他部分D.rRNA中的某些部分E.密码子的相应氨基酸9.密码GGC的对应反密码子是 A.GCC G C D.CGC E.GGC10.在蛋白质生物合成中转运氨基酸作用的物质是 A.mRNA B.rRNA C.hnRNA D.DNA E.tRNA11.凡AUG三联密码都是A.蛋白质合成的终止信号B.线粒体蛋白质合成启动信号C.启动tRNA的反密码D.代表蛋氨酸或甲酰蛋氨酸E.蛋白质合成的启动信号12.蛋白质合成时,氨基酸的被活化部位是 A.烷基B.羧基C.氨基D.硫氢基 E.羟基13.多核蛋白体指A.多个核蛋白体B.多个核蛋白体小亚基C.多个核蛋白体附着在一条mRNA上合成多肽链的复合物D.多个核蛋白体大亚基E.多个携有氨基酰tRNA的核蛋白体小亚基医学教育网搜集整理14.关于密码子,错误的叙述是A.每一密码子代表一种氨基酸B.某些密码子不代表氨基酸C.一种氨基酸只有一种密码子D.蛋氨酸只有一种密码子E.密码子无种族特异性15.氨基酸活化的特异性取决于 A.rRNA B.tRNA C.转肽酶 D.核蛋白体 E.氨基酰-tRNA合成酶16.氨基酰-tRNA合成酶的特点是A.只对氨基酸有特异性B.只对tRNA有特异性C.对氨基酸和tRNA都有特异性D.对GTP有特异性E.对A TP有特异性17.反密码子中的哪个碱基在密码子阅读中摆动?A.第一个B.第二个C.第一和第二个D.第二和第三个E.第三个18.关于蛋白质合成的终止阶段,正确的叙述是A.某种蛋白质因子可识别终止密码子B.终止密码子都由U、G、A三种脱氧核苷酸构成C.一种特异的tRNA可识别终止密码子D.终止密码子有两种E.肽酰-tRNA在核蛋白体"A位"上脱落19.真核生物蛋白质生物合成的特异抑制剂是A.嘌呤霉素B.氯霉素C.利福霉素D.环己酰亚胺E.青霉素20.氨基酸活化所需的酶是 A.信号肽酶 B.氨基酰-tRNA合成酶 C.磷酸酶 D.蛋白激酶 E.GTP酶活性21.高等动物中代表蛋氨酸的密码子是 A.AUG B.UGA C.AAA D.UGG E.启动部位的AUG22.氨基酸搬运所需要的物质是A.多作用子(或多顺反子)的mRNA B.转肽酶 C.tRNAD.70S核蛋白体E.含7甲基三磷酸鸟苷"帽"的mRNA23.tRNA与氨基酸相连的核苷酸是 A.U B.G C.C D.T E.A24.终止密码子5’端第一个核苷酸是 A.U B.G C.C D.T E.A25.细胞内的固有蛋白质,合成场所在A.粗面内质网上 B.核仁内 C.溶酶体内 D.高尔基氏体内 E.胞液内26.多肽链的合成开始于A.甘氨酸 B.酪氨酸 C.脯氨酸 D.C端氨基酸 E.甲酰蛋氨酸或蛋氨酸27.多肽链的合成结束于A.甘氨酸 B.酪氨酸 C.脯氨酸 D.C端氨基酸 E.甲酰蛋氨酸或蛋氨酸28.多肽链上可磷酸化的氨基酸是A.甘氨酸 B.酪氨酸 C.脯氨酸 D.C端氨基酸 E.甲酰蛋氨酸或蛋氨酸29.大肠杆菌中多肽链合成时,其氨基末端都是下列哪个氨基酸残基?A.蛋氨酸B.丝氨酸C.N-甲酰蛋氨酸D.N-甲酰丝氨酸E.谷氨酸30.在蛋白质生物合成中,mRNA起着十分重要的作用,原因是它带有:A.蛋白质生物合成的遣传信息B.氨基酸C.高能键D.识别密码的结构E.各种辅因子31.组成mRNA分子只有四种单核苷酸,但却能组成多少种密码子?A.64种B.20种C.32种D.75种E.16种32.mRNA分子中的起始密码位于:A.3‘末端B.5‘末端C.中间D.由3‘端向5’端不断移动E.由5‘端向3’端移动33.mRNA分子中的起始密码是A.UAA B.UGA C.UAG D.AUG E.UUU34.合成蛋白质的氨基酸必须活化,其活化部位是:A.α羧基B.α氨基C.α羧基与α氨基同时活化D.其他基团E.整个分子35.氨基酸活化需要哪种酶参加?A.α氨基酸激酶B.氨基酰-tRNA合成酶C.磷酸酶D.A TP酶E.A TP合成酶36.氨基酸活化需要消耗A.A TP B.GTP C.CTP D.UTP E.TTP37.核蛋白体的结构特点是:A.单链蛋白质B.由大、小亚基组成C.四个亚基组成D.三个亚基组成E.亚基与NAD构成38.翻译的含义是指: A.mRNA的合成 B.tRNA的合成C.tRNA运输氨基酸D.核蛋白体大,小亚基的聚合与解聚E.以mRNA为模板合成蛋白质的过程39.mRNA的信息阅读方式是:A.从多核苷酸链的5‘末端向3’末端进行B.从多核苷酸链的3‘-末端向5’-末端进行C.从多核苷酸链的多个位点阅读D.5‘-末端及3’末端同时进行E.先从5‘-末端阅读,然后再从3’-末端阅读40.AUG的重要性在于:A.作为附着于30S核糖体位点B.作为tRNA的识别位点C.作为肽链的释放因子D.作为肽链合成的终止密码子E.作为肽链的起始密码子41.摆动配对是指下列哪些碱基之间配对不严格:A.反密码子第一个碱基与密码子第三个碱基B.反密码子第三个碱基与密码子第一个碱基C.反密码子和密码子的第二个碱基D.反密码子和密码子的第一个碱基E.反密码子和密码子的第三个碱基42.有关蛋白质中多肽链合成起动信号的叙述,哪项是错误的?A.它位于mRNA的5‘-末端B.它位于mRNA的3‘末端医学教育网搜集整理C.它能被起动作用的蛋氨酰- tRNA所识别D.在起始复合物中的位置相当大亚基的受位E.本身代表蛋氨酸43.蛋白质合成的起动信号是:A.UGA B.UAA C.UAG D.AUG E.AUU44.哺乳动物细胞中蛋白质合成的主要部位是 A.细胞核B.核仁C.溶酶体D.高尔基复合体E.粗面内质网45.氨基酸是通过下列哪种化学键与tRNA结合的?A.糖苷键B.酯键C.酰胺键D.磷酸酯键E.氢键46.生物体编码20种氨基酸的密码子个数A.16 B.61 C.20 D.64 E.6047.下列关于氨基酸密码的描述哪一项是错误的?A.密码有种属特异性,所以不同生物合成不同的蛋白质B.密码阅读有方向性,5‘端起始,3’端终止C.一种氨基酸可有一组以上的密码D.一组密码只代表一种氨基酸E.密码第3位(即3‘端)碱基在决定掺入氨基酸的特异性方面重要性较小48.下列哪一项叙述说明遗传密码是不重叠的?A.多聚U-G指导多聚Cys-V al的合成B.单个碱基突变只改变生成蛋白质的一个氨基酸C.大多数氨基酸是由一组以上的密码编码的D.原核生物和真核生物多肽链合成的起动信号均为AUGE.已经发现了3组终止密码49.遗传密码的简并性指的是:A.一些三联体密码可缺少一个嘌呤碱或嘧啶碱B.密码中有许多稀有碱基C.大多数氨基酸有一组以上的密码D.一些密码适用于一种以上的氨基酸E.以上都不是50.摆动(Wobble)的正确含义是A.一种反密码子能与第三位碱基不同的几种密码子配对B.使肽键在核蛋白体大亚基中得以伸展的一种机制C.在翻译中由链霉素诱发的一种错误D.指核蛋白体沿着mRNA从其5‘端向3’端的移动E.热运动所导致的DNA双螺旋局部变性51.氨酰-tRNA促进多少个核糖核苷酸三联体的翻译?A.1 B.2 C.3 D.20 E.6152.能出现在蛋白质分子中的下列氨基酸哪一种没有遗传密码?A.酪氨酸B.苯丙氨酸C.异亮氨酸D.羟赖氨酸E.亮氨酸53.下列关于多核蛋白体正确的描述是A.是一种多顺反子B.是mRNA的前体C.是mRNA与核蛋白体小亚基的结合物D.是一组核蛋白体与一个mRNA不同区段的结合物E.以上都不是54.蛋白质生物合成时A.由tRNA识别DNA上的三密码B.氨基酸能直接与其特异的三联体密码连接C.tRNA的反密码子能与mRNA上相应密码子形成碱基对D.在合成蛋白质之前,氨基酸密码中碱基全部改变,才会出现由一种氨基酸置换另一种氨基酸E.核蛋白体从mRNA的5‘端向3’端滑动时,相当于蛋白质从C端向N端延伸55.下列关于蛋白质生物合成的描述哪一项是错误的?A.活化氨基酸的羧基与相应tRNA5’端核苷酸中核糖上的3‘-OH以酯键连接B.原核生物完成多肽链合成以前,甲酰蛋氨酸残基就从N端切掉C.mRNA上密码的阅读方向是由5‘-3’端D.多肽链从N端→C端延伸E.新合成的多肽链需经加工修饰才具生理活性56.关于蛋白质生物合成中的肽链延长阶段,正确的描述是A.核蛋白体向mRNA5‘端移动3个核苷酸的距离B.肽酰基移位到核蛋白体大亚基的给位上C.GTP转变成GDP和无机磷酸供给能量 E.A TP直接供能D.核蛋白体上的tRNA从给位向受位移动医学教育网搜集整理57.原核生物多肽链的延长与下列何种物质无关?A.转肽酶B.GTPC.EFTu、EFTs EFGD.甲酰蛋氨酰-tRNAE.mRNA58.原核生物蛋白质生物合成中肽链延长所需要的能量来源于A.A TP B.GTP C.GDP D.UTP E.CTP59.蛋白质生物合成时转肽酶活性存在于 A.EFTu B.EFG C.IF3 D.核蛋白体大亚基 E.核蛋白体小亚基60.下列哪一项不适用于蛋白质生物合成的肽链延长阶段A.新的蛋氨酰-tRNA进入受位B.大亚基“受位”有转肽酶活性C.转肽后“给位”上的tRNA脱落D.核蛋白体向mRNA3‘端移动一个密码距离E.每合成一个肽键需要消耗2分子GTP61.下述蛋白质合成过程中核蛋白体上的移位应是A.空载tRNA的脱落发生在A位上B.肽酰-tRNA的移位消耗A TPC.核蛋白体沿mRNA5‘-3’方向作相对移动D.核蛋白体在mRNA上移动距离相当于一个核苷酸的长度E.肽酰-tRNA由P位移至A位63.蛋白质生物合成中每生成一个肽键消耗的高能磷酸键数是 A.5 B.2 C.3 D.1 E.464.大肠杆菌合成的所有未修饰的多肽链,其N末端应是哪种氨基酸?A.蛋氨酸B.丝氨酸C.甲酰蛋氨酸D.甲酰丝氨酸E.谷氨酸65.转肽酶存在于A.核蛋白体大亚基B.核蛋白体小亚基C.mRNA分子内D.tRNA分子内E.胞液中66.转肽酶的作用是:A.促进“P”位上肽酰-tRNA中的肽酰基转移至“A”位B.使“A”位上的氨基酰-tRNA的氨基酰基转移至“P”位C.使胞液中的氨基酸形成肽链D.水解肽键E.连接两条多肽链68.镰刀形细胞贫血病人的血红蛋白的氨基酸被取代是由于:A.DNA的核苷酸顺序改变B.mRNA降解C.氨基酰-tRNA合成酶活性降低D.rRNA的大,小亚基结构改变E.rRNA的大,小亚基不能聚合69.下面哪些是不正确的?A.20种不同的密码子代表着遗传密码B.色氨酸(Trp)和蛋氨酸(Met)仅仅由一个密码子所编码C.每三个核苷酸编码一个氨基酸D.不同的密码子可能编码同种氨基酸E.密码子中的第三位是高度可变的70.氨酰-tRNA的功能主要决定于:A.氨基酸B.反密码子C.不变区D.氨基酸和反密码子之间的距离E.氨酰-tRNA合成酶活性71.可识别分泌蛋白新生肽链N端的物质是A.转肽酶B.信号肽识别颗粒C.GTP酶D.RNA酶E.mRNA的聚A尾部72.信号肽位于A.分泌蛋白新生链的中段B.成熟的分泌蛋白N端C.分泌蛋白新生链的C端D.成熟的分泌蛋白C端E.分泌蛋白新生链的N端73.信号肽段作用是A.指导DNA合成起动B.指导多肽链糖基化C.引导多肽链通过内质网D.指导RNA合成起动E.指导蛋白质合成起动74.细胞中分泌性蛋白质的合成与分泌所依赖的重要酶是A.信号肽酶B.氨基酰-tRNA合成酶C.磷酸酶D.蛋白激酶E.GTP酶活性75.多肽链合成后加工所需的酶是A.核酸酶B.氨基酰-tRNA合成酶C.磷酸酶D.蛋白激酶E.GTP酶活性76.mRNA的前体又名A.赖氨酸tRNAB.18SrRNAC.28SrRNAD.hnRNAE.蛋氨酰-TrnA77.多肽链上可羟化的氨基酸是 A.甘氨酸 B.酪氨酸 C.脯氨酸 D.C端氨基酸 E.甲酰蛋氨酸或蛋氨酸78.与真核生物蛋白质合成起始阶段有关的物质是A.核蛋白体的小亚基B.mRNA上的丙氨酸密码C.mRNA的多聚腺苷酸与核蛋白体大亚基结合D.N-甲酰蛋氨酸tRNAE.延长因子EFTu和EFTs79.下列干扰素的叙述哪一项是正确的?A.是病毒特有的物质B.是细菌的产物C.是化学合成的抗病毒药物D.对细胞内病毒增殖无影响E.其生成需要细胞基因的表达80.下列哪一种核苷酸类化合物与干扰素作用机制有关:A.ppGppB.2‘5’pppA(pA)nC.A5‘pppp5’AD.m7O5‘ppp5’N5‘PE.Poly A参考答案1.E2.B3.E4.C5.E6.D7.E8.B9.A10.E11.D12.B13.C14.C15.E16.C17.A18.A19.D 20.B21.A22.C23.E24.A25.E26.E27.D28.B29.C30.A31.A32.B33.D 34.A35.B36.A37.B38.E39.A40.E41.A42.B43.D44.E45.B46.B47.A48.B49.C50.A51.E52.D53.D54.C55.A56.C57.D58.B59.D60.B61.C62.D63.E64.C65.A66.A67.A68.A69.A70.B71.B72.E73.C74.A75.D76.D77.C78.A79.E80.B。
人教版教学教案基因指导蛋白质的合成作业学案

生物必修 1 遗传信息转录与翻译的作业
班级 ( )组
知识点一 复习转录翻译的比较
知识点二基因表达的有关数量计算
由此转录、翻译过程中,得出:
DNA(基因)碱基数︰m RNA碱基数︰多肽链氨基酸数=6︰3︰1
1.某一多肽链有99个肽键,则控制合成该肽键的基因中碱基数至少有()
A. 600 B . 300 C. 297 D594
2.组成人体蛋白质的20种氨基酸所对应的密码子共有()个
A. 4
B. 20
C. 61
D. 64
3.某蛋白质由n条肽链组成,氨基酸的平均相对分子质量为a,控制该蛋白质合成的碱基含b个碱
基对,则该蛋白质相对分子质量约为:
2
生物必修
3
生物必修。
《主题六 第二节 蛋白质》作业设计方案

《蛋白质》作业设计方案(第一课时)一、作业目标本次作业旨在帮助学生深入理解蛋白质的基本概念和性质,掌握蛋白质的分类、结构和功能,同时培养学生的实验技能和科学探究能力。
二、作业内容1. 课堂笔记:请学生整理本节课的课堂笔记,包括蛋白质的定义、分类、结构和功能等基础知识。
2. 蛋白质检测:a. 实验材料:鸡蛋白、双缩脲试剂、试管、滴管等实验器材。
b. 实验步骤:取鸡蛋白样品,加入适量双缩脲试剂,观察颜色变化,记录实验现象。
c. 实验分析:解释实验现象,总结蛋白质的特征性质。
3. 蛋白质分类:请学生根据蛋白质的组成和结构特点,将其分为不同的类型,并解释分类依据。
4. 蛋白质功能应用:列举几种与蛋白质相关的实际应用,如生物医药、食品工业等。
5. 家庭作业:完成一篇与蛋白质相关的短文,介绍蛋白质在人体健康中的作用及如何合理摄取蛋白质。
三、作业要求1. 课堂笔记:要求学生在笔记本上详细记录课堂内容,并整理成电子版笔记。
2. 蛋白质检测和分类:要求学生在实验过程中仔细观察、认真记录实验现象,并进行分析总结。
3. 蛋白质功能应用:鼓励学生通过互联网、图书馆等途径收集相关资料,了解蛋白质的实际应用。
4. 家庭作业:要求学生在规定时间内完成短文写作,注意语言表达清晰、逻辑严密。
四、作业评价1. 课堂笔记评价:根据笔记内容的完整性和准确性,给予学生相应的评分。
2. 蛋白质检测和分类评价:根据实验现象的描述、分析和总结,给予学生相应的评分。
3. 作业完成情况评价:根据短文写作的逻辑性、语言表达和知识运用能力,给予学生相应的评分。
4. 小组讨论评价:鼓励学生在小组讨论中分享学习心得和体会,对其他同学的回答进行点评和补充,培养其团队合作精神和交流能力。
五、作业反馈1. 学生提交作业后,教师将对作业进行批改,并针对学生存在的问题和不足进行反馈。
2. 对于普遍存在的问题,教师将在下次课堂上进行集中讲解和答疑。
3. 学生根据教师反馈和建议,及时调整学习方法和策略,提高学习效果。
《主题六 第二节 蛋白质》作业设计方案-中职化学高教版2021通用类

《蛋白质》作业设计方案(第一课时)一、作业目标本次作业旨在帮助学生深入理解蛋白质的基本概念和性质,掌握蛋白质的分类、结构和功能,并通过实践操作,提高实验技能和数据分析能力。
二、作业内容1. 阅读理解:学生需仔细阅读教材和相关文献,了解蛋白质的分类、结构和功能等基础知识,并回答以下问题:* 蛋白质的基本组成单位是什么?* 蛋白质有哪些主要类型?它们在生物体内有何功能?* 蛋白质的结构是怎样的?其重要性如何?2. 实验操作:学生需按照实验指导书完成蛋白质的定性检测实验,包括样品处理、试剂配制和实验操作步骤。
要求他们观察并记录实验结果,分析误差并讨论改进措施。
3. 小组讨论:学生以小组形式,选择一种常见蛋白质(如鸡蛋蛋白质、大豆蛋白质等)进行调研,了解其在食品、医药等领域的实际应用,并讨论蛋白质的营养价值及与健康的关系。
三、作业要求1. 独立完成阅读理解作业,字迹工整,表述清晰。
2. 实验操作过程中要严格按照实验指导书进行,确保数据记录和实验报告的准确性。
3. 小组讨论需充分讨论,观点明确,逻辑清晰,字数不少于300字。
4. 按时提交作业,作业质量将作为期末成绩评定的参考之一。
四、作业评价1. 阅读理解作业将根据回答的质量和完整性进行评价,回答应覆盖所有问题,表述清晰。
2. 实验操作部分将根据实验报告、数据记录和误差分析进行评价,确保学生掌握了蛋白质定性检测的基本技能。
3. 小组讨论将根据调研报告、讨论内容及团队协作进行评价,关注学生是否了解了蛋白质的实际应用及营养价值。
五、作业反馈我们将根据学生的作业完成情况、质量及反馈进行综合评价,并在课堂上进行反馈和指导。
对于作业中存在的问题,我们将及时指出并给出解决方案,帮助学生更好地理解和掌握蛋白质相关知识。
同时,我们也将根据学生的反馈,对作业设计方案进行优化和改进,以更好地满足学生的学习需求。
通过本次作业,我们期望学生能够深入理解蛋白质的基本概念和性质,掌握蛋白质的分类、结构和功能,并通过实践操作和小组讨论,提高实验技能、分析问题和团队协作的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质组学学院:专业班级:学号:姓名:第一章绪论2.蛋白质组学的目的是什么?蛋白质组学是在人类基因组计划研究发展的基础上形成的新型学科,主要是在整体水平上研究细胞内蛋白质的组成及其活动规律。
具体讲,它的最终目的是阐明生命细胞代谢、信号传导和调控网络的组织结构和动力学,并解释这些网络如何在病理或是生理中执行和失去功能,又如何通过干预改变他们的功能。
毋庸置疑,蛋白质是生理功能的执行者,是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。
蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用以及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。
虽然蛋白质的可变性和多样性等特殊性质导致了蛋白质研究技术远远比核酸技术要复杂和困难得多,但正是这些特性参与和影响着整个生命过程。
3.分别论述基因组与蛋白质组的含义?基因组:基因组,Genome,一般的定义是单倍体细胞中的全套染色体为一个基因组,或是单倍体细胞中的全部基因为一个基因组。
可是基因组测序的结果发现基因编码序列只占整个基因组序列的很小一部分。
因此,基因组应该指单倍体细胞中包括编码序列和非编码序列在内的全部DNA分子。
说的更确切些,核基因组是单倍体细胞核内的全部DNA分子;线粒体基因组则是一个线粒体所包含的全部DNA分子;叶绿体基因组则是一个叶绿体所包含的全部DNA分子。
蛋白质组:蛋白质组(Proteome)的概念最先由Marc Wilkins提出,指由一个基因组(genOME),或一个细胞、组织表达的所有蛋白质(PROTein). 蛋白质组的概念与基因组的概念有许多差别,它随着组织、甚至环境状态的不同而改变. 在转录时,一个基因可以多种mRNA形式剪接,一个蛋白质组不是一个基因组的直接产物,蛋白质组中蛋白质的数目有时可以超过基因组的数目. 蛋白质组学(Proteomics)处于早期“发育”状态,这个领域的专家否认它是单纯的方法学,就像基因组学一样,不是一个封闭的、概念化的稳定的知识体系,而是一个领域.4.从整体上看,蛋白质组研究主要包括哪两个方面的内容?通常可采用细胞或组织中的全蛋白质组分进行蛋白质组分析。
也可以进行样品预分级,即采用各种方法将细胞或组织中的全体蛋白质分成几部分,分别进行蛋白质组研究。
样品预分级的主要方法包括根据蛋白质溶解性和蛋白质在细胞中不同的细胞器定位进行分级,如专门分离出细胞核、线粒体或高尔基体等细胞器的蛋白质成分。
样品预分级不仅可以提高低丰度蛋白质的上样量和检测,还可以针对某一细胞器的蛋白质组进行研究。
蛋白质组研究设备对临床组织样本进行研究,寻找疾病标记,是蛋白质组研究的重要方向之一。
但临床样本都是各种细胞或组织混杂,而且状态不一。
如肿瘤组织中,发生癌变的往往是上皮类细胞,而这类细胞在肿瘤中总是与血管、基质细胞等混杂。
所以,常规采用的癌和癌旁组织或肿瘤与正常组织进行差异比较,实际上是多种细胞甚至组织蛋白质组混合物的比较。
而蛋白质组研究需要的通常是单一的细胞类型。
最近在组织水平上的蛋白质组样品制备方面也有新的进展,如采用激光捕获微解剖(Laser Capture Microdissection, LCM) 方法分离癌变上皮类细胞。
5.蛋白质组学研究的任务是什么?蛋白质研究1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。
2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。
翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。
3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。
可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。
另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。
Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。
蛋白质生物合成4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。
如寻找药物的靶分子。
很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。
药物也可以干预蛋白质-蛋白质相互作用。
在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。
这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。
细胞甚至亚细胞研究不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。
可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。
LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。
取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。
很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。
虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。
因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。
LCM技术获得的细胞可以用于蛋白质样品的制备。
可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。
相关试剂盒均有厂商提供。
二维电泳分离蛋白质蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。
二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。
成功的二维电泳可以将2000到3000种蛋白质进行分离。
电泳后对胶进行高灵敏度的染色如银染和荧光染色。
如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。
也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。
胶染色后可以利用凝胶图像分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。
通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。
接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。
最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。
LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。
即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。
Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。
该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。
对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。
Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。
Science,Vol. 293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。
该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子.最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组吸血虫蛋白质组学研究学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。
因此蛋白质组学的研究通常是高通量的。
适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据第三章双向电泳技术2.蛋白质电泳技术有一向电泳技术发展为双向电泳技术,应用了蛋白质的哪些特性或者参数?2-DE面临的挑战是高分辨率和重复性. 高分辨率确保蛋白最大程度的分离,高重复性允许进行凝胶间配比(match). 对2-DE而言,有3种方法分离蛋白:1)ISO-DALT(isoelectric focus)以O’Farrell’s技术为基础. 第一向应用载体两性电解质(carrier ampholyte, CA),在管胶内建立pH梯度. 随着聚焦时间的延长,pH梯度不稳,易产生阴极漂移. 2) NEPHGE(non-equilibrium pH gradient electrophoresis)用于分离碱性蛋白(pH>7.0). 如果聚焦达到平衡状态,碱性蛋白会离开凝胶基质而丢失. 因此,在等电区域的迁移须在平衡状态之前完成,但很难控制. 3)IPG-DALT发展于80年代早期. 由于固相pH梯度(Immobilized pH gradient, IPG)的出现解决了pH梯度不稳的问题. IPG通过immobiline共价偶联于丙烯酰胺产生固定的pH梯度,克服了IEF的缺点,从而达到高度的重复性. 目前可以精确制作线性、渐进性和S型曲线,范围或宽或窄的pH梯度. 新的酸性pH 3~5或碱性pH 6~11的IPG凝胶梯度联合商品化的pH 4~7的梯度可对蛋白质形成蛋白质组重叠群(proteomic contigs)从而有效分离.4.常规聚丙烯酰胺凝胶电泳的基本原理是什么?SDS 作用是什么?聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术。
聚丙烯酰胺凝胶由单体丙烯酰胺和甲叉双丙烯酰胺聚合而成,聚合过程由自由基催化完成。
催化聚合的常用方法有两种:化学聚合法和光聚合法。
化学聚合以过硫酸铵(AP)为催化剂,以四甲基乙二胺(TEMED)为加速剂。
