硫脲的作用,硫脲化学性质
硫脲平面结构

硫脲平面结构
硫脲是一种有机化合物,也称为硫代脲。
硫脲分子由一个硫原子和两个氮原子组成,它的化学式为CS(NH2)2。
硫脲是一种白色结晶体,无味且不挥发。
硫脲在生物学和医药领域有着广泛的应用,例如用作镇痛和抗炎药物等。
硫脲的平面结构是指硫原子和两个氮原子在同一平面上排列的结构。
硫脲分子中的硫原子和两个氮原子分别位于三个顶点上,形成了一个三角形。
硫脲分子的平面结构对其物理和化学性质有着重要的影响。
硫脲的平面结构使其具有较高的电子亲和性和亲核性。
硫脲可以通过硫原子上的孤对电子与其他原子或分子形成化学键。
在生物学中,硫脲的平面结构使其能够与蛋白质中的半胱氨酸形成二硫键,从而稳定蛋白质的结构。
此外,硫脲还可以与金属离子形成络合物,用于催化有机合成反应。
硫脲的平面结构还影响着其光学性质。
硫脲分子中的硫原子和两个氮原子在同一平面上排列,使得硫脲具有较高的平面对称性。
因此,硫脲分子不具有旋光性,即不会使偏振光旋转。
这种特殊的光学性质对硫脲在药物合成和光学器件中的应用具有重要意义。
硫脲的平面结构对其化学和物理性质有着重要的影响。
硫脲分子中
的硫原子和两个氮原子在同一平面上排列,使其具有较高的电子亲和性和亲核性,能够与其他原子或分子形成化学键。
硫脲的平面对称性还使其不具有旋光性,对其在药物合成和光学器件中的应用具有重要意义。
硫脲平面结构

硫脲平面结构硫脲是一种有机化合物,化学式为CH4N2S,属于硫醚类化合物。
它具有平面结构,本文将详细介绍硫脲的结构特点、性质以及应用。
1. 硫脲的结构特点硫脲的分子式为CH4N2S,它由一个碳原子、两个氮原子和一个硫原子组成。
硫脲的基本结构是一个平面分子,其中碳原子与两个氮原子通过共价键相连,形成了一个三角形的平面。
硫原子与碳原子通过双键相连,并位于这个三角形的中心。
2. 硫脲的性质2.1 物理性质硫脲是无色晶体,具有特殊的臭味。
它在常温下稳定,不溶于水,但能溶于一些有机溶剂如乙醇和醚类溶剂。
2.2 化学性质硫脲具有亲电性和亲核性,在化学反应中表现出多样性。
2.2.1 氧化反应当硫脲与强氧化剂如过氧化氢反应时,会发生氧化反应,生成硫酸和二氧化碳等产物。
CH4N2S + 3H2O2 → H2SO4 + CO2 + 3H2O2.2.2 还原反应硫脲可以被还原剂还原为对应的胺类化合物。
例如,硫脲与亚砜反应可以得到二甲基胺和二硫化碳。
CH4N2S + (CH3)2SO → (CH3)2NH + CS22.2.3 缩合反应硫脲具有与醛、酮等化合物发生缩合反应的能力。
在碱性条件下,硫脲与醛或酮反应生成相应的硫脲缩合物。
3. 硫脲的应用由于硫脲具有特殊的结构和性质,它在许多领域都有广泛的应用。
3.1 化学工业硫脲是一种重要的中间体化合物,在染料、农药、医药等领域中被广泛用作原料。
例如,在染料工业中,硫脲可以用于制备各种颜料和染料;在农药工业中,它可以作为杀虫剂和除草剂的原料。
3.2 医药领域硫脲及其衍生物在医药领域中具有重要的应用价值。
它们可以用于合成抗生素、抗肿瘤药物等。
此外,硫脲还具有一定的抗氧化和抗菌作用,因此也被广泛应用于皮肤疾病的治疗。
3.3 分析化学硫脲可以作为配体与金属离子形成络合物,这种络合物对分析化学中的金属离子检测和分离具有重要意义。
例如,硫脲可以与铜离子形成稳定的络合物,可用于铜离子的分析检测。
硫脲的分子量

硫脲的分子量硫脲(Thiourea)是一种有机化合物,其分子式为CH4N2S,分子量为 76.12 g/mol。
它是一种白色结晶固体,可溶于水和大多数有机溶剂中。
硫脲具有许多重要的应用,包括作为化学试剂、催化剂和农药等。
本文将从不同的角度介绍硫脲的分子量及其相关特性。
1. 硫脲的化学结构硫脲的化学结构中包含了一个硫原子和两个氮原子。
硫原子与两个氮原子相连,形成了一个类似于尿素的结构。
硫脲的分子式为CH4N2S,其中C表示碳原子,H表示氢原子,N表示氮原子,S表示硫原子。
2. 硫脲的物理性质硫脲是一种白色结晶固体,具有特殊的臭味。
其熔点为170-180℃,沸点为172-175℃。
硫脲可溶于水和大多数有机溶剂,如醇类、醚类和酮类等。
在水中的溶解度随温度的升高而增加。
3. 硫脲的化学性质硫脲是一种相对稳定的化合物,但在一些条件下也会发生化学反应。
例如,硫脲可以与酸反应生成硫脲酸,与碱反应生成硫脲酸盐。
硫脲还可以与许多化合物发生取代反应,形成不同的衍生物。
4. 硫脲的应用领域硫脲具有许多重要的应用。
首先,硫脲广泛用作化学试剂,例如用于测定金属离子、有机物的分析等。
其次,硫脲还可以作为一种催化剂,参与多种有机反应,如氧化、还原和羟基化反应等。
此外,硫脲还被用作农药的原料,具有抗菌、杀虫等作用。
5. 硫脲的生产和用途硫脲的生产主要通过硫氰酸铵和氨水的反应得到。
硫脲的用途非常广泛,不仅在化学实验室中被广泛使用,还广泛应用于农业、医药、染料、橡胶等领域。
例如,在农业中,硫脲可以用作杀虫剂,对一些害虫具有较好的杀灭效果。
在医药领域,硫脲可以用于合成一些药物,如降压药和抗肿瘤药物等。
总结:硫脲是一种重要的有机化合物,具有丰富的应用价值。
它的分子量为76.12 g/mol,化学结构中含有硫原子和两个氮原子。
硫脲是一种白色结晶固体,可溶于水和大多数有机溶剂。
它具有特殊的物理性质和化学性质,可以用作化学试剂、催化剂和农药等。
硫脲分解温度

硫脲分解温度硫脲是一种重要的有机化合物,广泛应用于化学、医药、农业等领域。
硫脲的分解温度是指在一定条件下,硫脲开始分解的温度。
硫脲分解温度的研究对于了解硫脲的性质和应用具有重要意义。
一、硫脲的基本性质硫脲,化学式为CH4N2S,是一种无色、无臭、结晶性固体。
硫脲在水中微溶,易溶于醇、乙醇、甲醇、乙醚等有机溶剂。
硫脲是一种重要的有机化合物,在化学、医药、农业等领域广泛应用。
二、硫脲的分解反应硫脲在高温下会发生分解反应,生成氨气和二硫化碳。
硫脲的分解反应可以用以下化学方程式表示:CH4N2S → CS2 + 2NH3硫脲的分解反应是一个放热反应,放出的热量可以用来加热反应体系。
三、硫脲分解温度的影响因素硫脲分解温度受多种因素的影响,主要包括以下几个方面:1. 硫脲的纯度:硫脲的纯度越高,分解温度越高。
2. 分解反应的速率:分解反应速率越快,分解温度越高。
3. 外界环境的温度:外界环境温度越高,分解温度越低。
4. 反应体系的压力:反应体系的压力越高,分解温度越高。
5. 反应体系的溶剂:不同的溶剂对于硫脲分解温度的影响不同。
四、硫脲分解温度的测定方法硫脲分解温度的测定方法有多种,常用的方法包括以下几种:1. 差热分析法:差热分析法是一种利用反应体系吸热或放热的特性来测定分解温度的方法。
通过测定反应体系的放热量随温度变化的曲线,可以确定硫脲的分解温度。
2. 热重分析法:热重分析法是一种利用样品在升温过程中失重的特性来测定分解温度的方法。
通过测定样品在升温过程中的失重率随温度变化的曲线,可以确定硫脲的分解温度。
3. 热差法:热差法是一种利用两个反应体系之间的温度差来测定分解温度的方法。
通过测定两个反应体系之间的温度差随温度变化的曲线,可以确定硫脲的分解温度。
五、硫脲分解温度的应用硫脲分解温度的研究对于了解硫脲的性质和应用具有重要意义。
硫脲分解温度的应用主要包括以下几个方面:1. 硫脲的生产和加工:硫脲的分解温度可以用来确定硫脲的生产和加工条件,以保证硫脲的质量和产量。
硫脲相关

硫脲产品的主要生产国和出口国为中国、日本、德国,主要消费地为日本、美国、欧洲、中国和东南亚等地。在化工、医药、农药行业的不断增长的背景下,全球硫脲市场也将快速增长,尤其是中国的硫脲市场发展潜力巨大,并成为全球快速增长的主力市场。随着全球经济的恢复和化工、农药、医药、纺织等行业的发展,以及工业技术的发展等,都将促使硫脲行业前景光明。
铁广锐是沈阳人,唐芸是杭州本地人。铁广锐大学毕业后就参了军,一直在消防一线工作,去年7月和妻子领了结婚证后,先后接受了汶川地震震后援助、奥运安保、建国60周年庆等任务,所有小长假都泡了汤。再加上唐芸平时工作也忙,两人聚少散多,生孩子的事就这样一直耽搁了下来。眼看两人都30岁了,前段时间,商量好要抓紧办这件家庭大事,刚刚调整好一切事宜,偏偏又遇上这样的情况。唐芸红着眼圈说:“听医生的。”
硫脲的用途很广泛,在我们的日常生活中我们常常都会见到硫脲,只是也许你还不知道什么是硫脲,下面小编就简单的为大家介绍一下硫脲的用途都有哪些?
硫脲是尿素中的氧被硫替代后形成的化合物,属于硫代酰胺(RC(S)NR2,R为烃基)。由于电负性差异,尽管结构类似,硫脲和尿素的性质很不相同。硫脲在有机合成中有广泛应用。
8月13日晚,杭州拱墅区祥符镇新文社区,杭州合祥精细化工有限公司厂区仓库发生有毒原料泄漏事故,1吨硫脲(音同“尿”)受热分解,产生了大量的二氧化硫、硫化氢等有毒气体。数百名群众被紧急疏散转移,多名消防战士因吸入过量有毒气体出现不同程度的中毒状况。
事故发生后,这家化工厂现状如何,周边居民的生活有没有恢复正常.
吸入过量有毒气体,医生建议缓生小孩
后来因中毒住院的7名消防员中,有一位是杭州消防祥符中队中队长铁广锐,他是冒着毒烟冲在最前面实施救援的消防员。他的妻子唐芸陪在病房,小声向医生询问着什么。医生则严肃回答:毒气肯定会对胎儿有影响,想要孩子,还得再等等!
表- 硫脲的理化性质及危险特性表

表- 硫脲的理化性质及危险特性表
稳固,避免碰撞、摩擦、倾倒等情况发生。
运输车辆应装备相应的消防器材和急救设备。
运输过程中应避免与氧化剂、酸类、食用化学品等混装混运。
禁止与热源、火种等接触。
运输过程中如发生泄漏,应立即采取应急处理措施。
硫脲是一种白色光亮苦味晶体,分子式为CH4N2S,分子量为76.12.它可以溶于冷水和乙醇,微溶于乙醚。
硫脲的燃烧
性能较好,但容易受热分解,放出氮、硫的氧化物等毒性气体,具有一定的爆炸危险性。
硫脲的危害主要表现在健康方面,长期接触会对人体造成一定的损害,如出现头痛、嗜睡、无力、面色苍白等症状。
在使用硫脲时,需要注意其危险特性和禁忌物。
硫脲遇明火、高热可燃,与氧化剂能发生强烈反应,应远离火源、热源和氧化剂等物品。
在储存和运输时,应注意防火、防潮、防晒,避免碰撞、摩擦、倾倒等情况发生。
在急救和泄漏处置时,应采取相应的措施,如用肥皂水和清水冲洗皮肤、提起眼睑用流动清水或生理盐水冲洗、迅速脱离现场至空气新鲜处等。
硫脲的结构简式

硫脲的结构简式硫脲是一种具有特殊结构的有机化合物,化学式为CS(NH2)2。
它是一种无色结晶,可溶于水,具有一定的毒性。
硫脲在工业生产中有着广泛的应用,尤其是在农业和医药领域。
硫脲的结构简式由一个硫原子(S)与两个氨基(NH2)团连接而成。
这种结构使得硫脲具有一些特殊的性质和用途。
首先,硫脲是一种良好的配体,可与许多金属离子形成稳定的络合物。
这些络合物在催化反应和有机合成中起着重要的作用。
其次,硫脲具有良好的还原性,可以用作还原剂,参与一些重要的化学反应。
此外,硫脲还可用于制备染料、药物和农药等化学品。
在农业领域,硫脲被广泛用作植物生长调节剂。
它可以促进植物的生长和发育,提高作物的产量和品质。
此外,硫脲还可以增强植物对逆境的抵抗能力,如干旱、高温和寒冷等。
因此,硫脲在现代农业中被广泛应用于种子处理、叶面喷雾和土壤施用等方面。
在医药领域,硫脲常用于合成药物和抗癌药物。
硫脲可以与某些药物分子结合,增强其生物活性和稳定性。
此外,硫脲还具有一定的抗氧化和抗炎作用,可以用于治疗一些炎症和慢性疾病。
近年来,研究人员还发现硫脲具有一定的抗菌活性,可以用于制备新型的抗菌药物。
除了在农业和医药领域,硫脲还在其他领域有着广泛的应用。
例如,硫脲可以用于制备染料和涂料,以及金属腐蚀抑制剂和防锈剂。
此外,硫脲还可以用于制备光敏材料和高分子材料,广泛应用于光电子、光伏和电子器件等领域。
总的来说,硫脲是一种重要的有机化合物,具有广泛的应用前景。
它在农业、医药和化工等领域发挥着重要作用,并为人类的生活和工业发展做出了重要贡献。
随着科学技术的不断进步,硫脲的应用领域还将不断拓展,为人类创造更多的福祉。
硫脲

硫脲白色而有光泽的晶体。
味苦。
密度1.405。
熔点180~182℃。
更热时分解。
溶于水,加热时能溶于乙醇,极微溶于乙醚。
熔融时部分地起异构化作用而形成硫氰比铵。
用于制造药物、染料、树脂、压塑粉等的原料,也用作橡胶的硫化促进剂、金属矿物的浮选剂等。
由硫化氢与石灰浆作用成硫氢化钙,再与氰氨(基)化钙作用而成。
也可将硫氰化铵熔融制取,或将氨基氰与硫化氢作用制得。
中文名硫脲外文名thiourea别名硫代尿素分子式CN2H4S相对分子质量76.12化学品类别有机物--硫化物管制类型不管制储存密封保存基本信息中文名称:硫脲中文别名:硫代尿素英文名称:Thiourea英文别名:2-Thiourea; Isothiourea; sulfocarbamide; sulfouren; sulourea;Thiocarbamide; Thiurea; THU; thio arbamid; sulphourea; carbamoylsulfamic acid CAS号:62-56-6EINECS号:200-543-5[1]1、理化性质物理性质外观与性状:白色光亮苦味晶体。
熔点(℃):176~178相对密度(水=1):1.41沸点(℃):分解分子式:CH4N2S分子量:76.12辛醇/水分配系数的对数值:2.5溶解性:溶于冷水、乙醇,微溶于乙醚。
[2]化学性质遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
[2]在空气中易潮解。
在150℃时转变成硫氰酸铵。
在真空下150-160℃时升华,180℃时分解。
具有还原性,能使游离态碘还原成碘离子。
本品富于反应性,用以制备各种化合物。
能与多种氧化剂反应生成脲、硫酸及其他有机化合物,也能与无机化合物制成易溶解的加成化合物。
本品一次作用时毒性小,反复作用时能经皮肤吸收,抑制甲状腺和造血器官的机能,引起中枢神经麻痹及呼吸和心脏功能降低等症状。
生产本品1~15年的工人,会出现头痛、嗜眠、全身无力、皮肤干燥、口臭、口苦、腹上部疼痛、便秘、尿频等症状。
硫脲平面结构

硫脲平面结构
硫脲是一种常见的有机化合物,其分子式为CH4N2S,具有平面结构。
在化学领域,硫脲常用作金属离子的络合剂或是有机合成中的中间体。
本文将探讨硫脲的平面结构及其在化学领域中的应用。
让我们来看看硫脲的结构。
硫脲分子由一个硫原子、一个碳原子、两个氮原子和四个氢原子组成。
硫原子和两个氮原子在平面上排列成一条直线,碳原子连接在两个氮原子之间,而四个氢原子则分别连接在碳原子上。
这种排列方式使得硫脲分子呈现出平面结构,具有一定的稳定性。
硫脲作为一种络合剂,在配位化学中具有重要的应用。
由于硫脲分子中含有硫原子和氮原子,这些原子可以与金属离子形成配位键,形成稳定的络合物。
硫脲可以与许多金属离子形成络合物,如铜、镍、铁等。
这些络合物在催化剂、生物活性分子的合成等方面发挥着重要作用。
硫脲还可以作为有机合成中的中间体。
硫脲分子中的两个氮原子可以参与亲核取代反应,从而形成新的有机化合物。
硫脲在有机合成中常用于合成氨基化合物或是含硫杂环化合物等。
通过合理设计反应条件和控制反应过程,可以高效地合成目标产物。
总的来说,硫脲作为一种常见的有机化合物,具有平面结构,并在化学领域中发挥着重要作用。
它既可以作为金属离子的络合剂,形
成稳定的络合物,也可以作为有机合成中的中间体,参与各种有机合成反应。
通过深入研究硫脲的结构和性质,可以更好地理解其在化学领域中的应用,为相关领域的研究和应用提供新的思路和方法。
硫脲
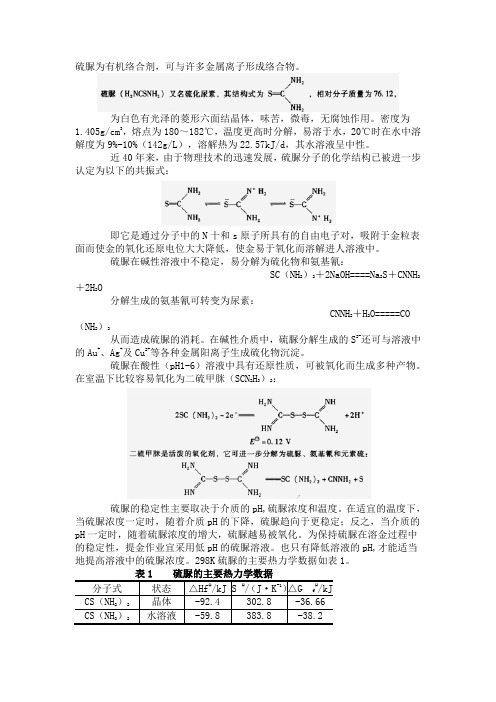
硫脲为有机络合剂,可与许多金属离子形成络合物。
为白色有光泽的菱形六面结晶体,味苦,微毒,无腐蚀作用。
密度为1.405g/cm3,熔点为180~182℃,温度更高时分解,易溶于水,20℃时在水中溶解度为9%-10%(142g/L),溶解热为22.57kJ/d,其水溶液呈中性。
近40年来,由于物理技术的迅速发展,硫脲分子的化学结构已被进一步认定为以下的共振式:即它是通过分子中的N十和s原子所具有的自由电子对,吸附于金粒表面而使金的氧化还原电位大大降低,使金易于氧化而溶解进人溶液中。
硫脲在碱性溶液中不稳定,易分解为硫化物和氨基氰:SC(NH2)2+2NaOH====Na2S+CNNH2+2H2O分解生成的氨基氰可转变为尿素:CNNH2+H2O=====CO(NH2)2从而造成硫脲的消耗。
在碱性介质中,硫脲分解生成的S2-还可与溶液中的Au+、Ag+及Cu2+等各种金属阳离子生成硫化物沉淀。
硫脲在酸性(pH1-6)溶液中具有还原性质,可被氧化而生成多种产物。
在室温下比较容易氧化为二硫甲脒(SCN2H3)2:硫脲的稳定性主要取决于介质的pH,硫脲浓度和温度。
在适宜的温度下,当硫脲浓度一定时,随着介质pH的下降,硫脲趋向于更稳定;反之,当介质的pH一定时,随着硫脲浓度的增大,硫脲越易被氧化。
为保持硫脲在溶金过程中的稳定性,提金作业宜采用低pH的硫脲溶液。
也只有降低溶液的pH,才能适当地提高溶液中的硫脲浓度。
298K硫脲的主要热力学数据如表1。
温度的提高虽能加快硫脲溶金的初始速度,但它会严重影响硫脲的稳定性,使得溶金才度随时间的延长而不断下降,甚至无效。
在多数文献中,选定的硫脲溶金介质温度不高了25℃,虽然它不一定是最佳的选择,但试验证明,随着介质(不论是酸性、中性或碱性)温度的升高硫脲的氧化速度会加快。
当硫脲在酸性或碱性溶液中,加热至60℃时,均会发生水解而生成氨、二氧化碳和液态H2S:SC(NH2)2+2H2O====CO2+2NH3+H2SH2S还可进一步分解成S。
硫脲分子式

硫脲分子式硫脲分子式CAS号87-43-1。
纯度99%。
无色或微带淡黄色,有刺激性气味的液体。
易溶于水,微溶于乙醇。
溶于盐酸、氨水。
可与硝酸银反应生成一种有机弱酸的银白色沉淀。
硫脲用途十分广泛,它是合成树脂、农药、染料、橡胶等的原料,也可用作防毒面具中吸收剂,还可以用来制备其他一些衍生物如一些缩合反应的催化剂、偶氮染料、医药等的中间体、也用于制造烟火、火柴、杀虫剂和触媒等。
硫脲分类硫脲根据其结构不同可分为:取代硫脲包括双硫脲、三硫脲、二甲基硫脲等,此类产品属国家管制产品;水杨酰胺类衍生物是合成抗疟药阿的平、扑疟母等的重要中间体。
【产品性状】硫脲白色针状结晶或粉末,具有特殊气味,易潮解。
【中文名称】硫脲【中文别名】脲;三氮苯磺酸钠;甲酰脲【英文名称】 Ketone【英文别名】 Triethylenesulfonate;Ketesalt;Toline salt【 CAS号】 87-43-1【分子式】 C9H8N3O3S【分子量】 189.19【 EINECS号】 209-921-4【化学性质】硫脲为白色针状结晶或粉末,有特殊气味,易潮解。
熔点50~53 ℃,沸点235 ℃,折光率1.497,比重1.67,水溶性90%。
硫脲在一般条件下稳定,低温时逐渐分解,可加热至150~170 ℃脱水成脲醛树脂,在强碱作用下进一步水解得到酚醛树脂和二氧化碳。
工业上将硫脲和其他含活泼氢的有机化合物混合加热,得到固体树脂或固体硫脲。
硫脲主要用于硝基纤维素、醋酸纤维素、聚酰亚胺、聚砜、聚丙烯腈、不饱和聚酯树脂等的合成原料,是醋酸纤维素、脲醛树脂的改性剂,是各种农药、杀虫剂、染料、涂料的原料,还用于防毒面具的生产中。
用途编辑1、合成树脂方面:用作环氧树脂、氯化橡胶、不饱和聚酯树脂等的合成原料。
2、农药方面:用于农药有机硫杀虫剂的合成。
3、橡胶方面:用于氯丁橡胶的生产。
4、印染助剂方面:可用作印染助剂、不饱和聚酯树脂、环氧树脂、增塑剂、表面活性剂、颜料及油漆、涂料的中间体。
硫脲 熔沸点

硫脲,化学名称为硫代尿素,英文名为Thiourea,化学式为CH4N2S,是一种白色结晶或粉末状的有机化合物,具有微弱的特殊气味。
它在常温下相对稳定,可溶于水、醇和醚等多种溶剂中。
硫脲(Thiourea)的熔点和沸点分别是:
熔点:170至172°C
沸点:335至340°C
请注意,这些数值是在标准大气压下测定的。
在不同的压力条件下,熔点和沸点可能会有所变化。
下面是关于硫脲的主要性质和用途包括:
1.化学性质:硫脲可以与重金属离子形成稳定的络合物,因此
在化学分析中有一定的应用;它还具有还原性,能参与氧化
还原反应。
2.工业用途:硫脲广泛应用于化工、制药、染料等行业,如用
于制造农药(如杀虫剂、除草剂)、橡胶助剂、照相材料、
皮革鞣制剂等;另外,硫脲还是某些药物和精细化学品的重
要中间体。
3.实验室用途:在实验室中,硫脲可用于合成其他含硫化合
物,例如磺酰胺类药物和其他有机硫化物。
4.环保领域:硫脲可用作重金属离子废水处理中的螯合剂,帮
助去除废水中的铜、镍、铅等重金属离子。
5.农业领域:作为肥料添加剂,硫脲可以提高作物对氮肥的吸
收利用率,并有助于改善土壤结构。
硫脲表活结合-概述说明以及解释

硫脲表活结合-概述说明以及解释1.引言1.1 概述概述硫脲表活结合是一种常用的有机合成反应,广泛应用于药物化学、有机化学以及生物化学等领域。
它通过硫脲反应活化使得有机分子能够进行特定的化学反应,从而合成出具有特定结构和性质的目标化合物。
在硫脲表活结合中,硫脲(也称为胺硫脒)起到了重要的作用。
硫脲是一类含有硫原子的化合物,其分子中有两个别相连的氨基和硫基团。
在该反应中,硫脲能够通过活化硫原子上的反应基团,从而与其他有机底物发生化学反应。
硫脲表活结合的原理是通过活化硫脲中的硫原子,使其成为亲电试剂或亲核试剂,并与底物进行反应。
这种反应机制可以产生新的化学键,并导致目标化合物的形成。
由于硫脲在反应中可以发生多种类型的反应,因此这一反应方法具有很大的灵活性,能够适应不同的化学需求。
硫脲表活结合在药物化学领域中的应用广泛,它可以用于药物分子的合成、改性和修饰,从而提高药物的活性、选择性和稳定性。
此外,硫脲表活结合还可以应用于有机合成反应的催化剂设计和合成工艺优化,从而提高反应的效率和产率。
然而,硫脲表活结合也存在一些限制。
首先,硫脲表活结合在反应条件的选择上较为苛刻,需要一定的温度、催化剂和反应时间等条件才能实现。
其次,硫脲中的硫原子容易与其他化学物质发生不需要的反应,导致产品的纯度和产率下降。
因此,在应用硫脲表活结合时,需要仔细选择反应条件以及对硫脲的结构进行优化。
总的来说,硫脲表活结合是一种重要的有机合成方法,具有广泛的应用前景。
通过理解其概念和原理以及解决其存在的限制,我们可以更好地应用硫脲表活结合来进行化学研究和药物开发,从而推动科学领域的进步。
1.2文章结构1.2 文章结构本文将按照以下结构来进行论述硫脲表活结合的相关内容:第一部分,引言。
首先,我们将简要介绍硫脲表活结合的概念和原理。
接着,我们将说明本文的目的,并给出本文的整体结构概述。
第二部分,正文。
2.1节将详细阐述硫脲表活结合的定义和原理。
生成硫脲的反应式

生成硫脲的反应式硫脲是一种含硫有机物,是制药工业的重要原料,用于制造药物、染料、树脂、压塑粉等原料,也作橡胶的硫化促进剂、金属矿物的浮选剂等。
接下来分别介绍硫脲化学性质、制备方式以及作用。
硫脲化学性质遇用火、高烧易燃。
受分解反应,释放氮、硫的金属氧化物等毒副作用汽体。
与还原剂能产生强烈反应。
在空气中易潮解。
在150℃时转化成硫氰酸铵。
在真空泵下150-160℃时提升,180℃时溶解。
具备氧化性,能使游离态碘转变成碘离子。
本产品富有反映性,用于制取各种各样化学物质。
能与多种多样还原剂反映转化成脲、盐酸以及他有机物,也可以与无机化合物做成易融解的加持化学物质。
硫脲制备方法其制取方式是以硫化钡与盐酸或硫酸反映,硫化氢气体经氯化铝空气压力消化吸收制取氯化氢钙水溶液,再与氰氨化钙反映,硫氢化钙与氰氨化钙的摩尔比为1∶5,在持续拌和下,反映溫度为(80±5)℃,反应速度为3h,经空气压力过虑,就可以转化成硫脲液體,再经挥发、过虑、制冷、结晶体,即得结晶硫脲,抽滤脱干干躁即得制成品。
反应方程式如:BaS+H2SO4→BaSO4↓+H2S↑2H2S+Ca(OH)2→Ca(SH)2+2H2O白色而有光泽度的结晶,味道微苦,相对密度 1.41。
溶点176~178℃。
更热时溶解。
溶解水,加温时要溶解酒精,特别少溶解医用乙醚。
熔化时一部分地起异构化功效而产生硫氰比铵。
用以生产制造药品、染剂、环氧树脂、压塑粉等的原材料,也作为硫化橡胶的硫化促进剂、金属材料矿物质的浮选剂等。
由氯化氢与石灰浆功效成硫氢化钙,再与氰氨(基)化钙功效而成。
也可将硫氰化铵熔化制得,或将羟基氰与氯化氢功效制取。
硫脲的作用用于生成磺胺噻唑、蛋氨酸和肉猪片等药品的原材料。
作为染剂及上色改性剂、环氧树脂及压塑粉的原材料。
也可作为硫化橡胶的硫化促进剂、金属材料矿物质的浮选剂、制邻苯二甲酸酐和富马酸的金属催化剂,及其作为金属材料防生锈剂。
在照相材料方面,可做为显影剂和色调剂。
硫脲执行标准

硫脲执行标准引言硫脲是一种常用的化学物质,广泛应用于农业、医药和工业领域。
为了保证硫脲的质量和安全性,各国都制定了相应的执行标准。
本文将深入探讨硫脲执行标准的相关内容。
一级标题硫脲的定义和用途硫脲是一种有机化合物,化学式为CS(NH2)2。
它具有较强的还原性和增塑性,并且可溶于水和多种有机溶剂。
硫脲广泛用于植物生长调节剂、染料、化肥等的制造过程中,具有重要的应用价值。
硫脲执行标准的意义制定硫脲执行标准的主要目的是保证硫脲产品的质量和安全性。
执行标准明确了硫脲产品的生产过程、质量指标、检测方法以及包装等要求,有助于提高产品质量、降低生产成本,同时减少对环境的污染。
二级标题国际硫脲执行标准概述目前,国际上常用的硫脲执行标准有ISO 6341-1989《硫脲化学品. 硫脲. 试验方法》、ISO 5725-19883《硫脲与硫脲中杂质的测定. 准确度》等。
这些标准规定了硫脲产品的化学性质、物理性质以及其他相关要求。
我国制定了一系列硫脲执行标准,主要包括GB/T 20894-2007《硫脲中游离硫的测定》、GB/T 14038-2005《硫脲水合物(硫脲酸)中游离硫脲与硫脲水合物的比色测定方法》等。
这些标准综合考虑了国内硫脲产品的特点和使用需求。
三级标题硫脲产品质量指标硫脲执行标准中规定了硫脲产品质量的各项指标。
主要包括外观、纯度、游离硫、溶解度、熔点等。
这些指标反映了硫脲产品的纯度、稳定性和适用性能。
硫脲产品检测方法硫脲执行标准中明确了硫脲产品的检测方法。
主要包括物理性质检测、化学性质检测以及其他辅助检测方法。
这些方法旨在确定硫脲产品是否满足执行标准中的各项指标要求。
硫脲执行标准的执行与监督硫脲执行标准的执行和监督是保证产品质量的重要环节。
生产企业应严格按照执行标准的要求组织生产,建立健全的质量控制体系,并定期进行内部质量评审和外部质量检测。
相关监管部门应加强对硫脲产品的监督检查,确保市场上的硫脲产品符合执行标准的要求。
硫脲中的化学键

硫脲中的化学键
硫脲是一种含有硫原子和脲基的有机化合物,化学式为CH4N2S。
它是一种无色结晶固体,在室温下稳定。
硫脲具有许多重要的化学键,这些化学键在硫脲的性质和应用中起着关键作用。
一、硫原子与氮原子之间的化学键:
硫脲分子中的硫原子与两个氮原子形成了硫氮双键。
这种化学键是硫脲分子中最重要的键之一,它赋予了硫脲分子一些特殊的性质。
硫氮双键的形成使硫脲具有了反应活性,可以与其他化合物发生化学反应。
此外,硫氮双键还赋予了硫脲分子一定的稳定性,使其在一定条件下可以长时间存在。
二、硫原子与碳原子之间的化学键:
硫脲中的硫原子与碳原子之间存在硫碳单键。
硫碳单键的存在使硫脲分子具有较好的溶解性和挥发性。
硫碳单键还赋予了硫脲一定的酸碱性,使其可以与酸或碱发生反应。
此外,硫碳单键还使硫脲分子具有一定的极性,使其可以与其他极性分子发生相互作用,从而影响硫脲的物理和化学性质。
三、氮原子之间的化学键:
硫脲分子中的两个氮原子之间存在氮氮单键。
氮氮单键的存在使硫脲分子具有较高的稳定性,并且可以通过这个化学键与其他分子发生相互作用。
氮氮单键还使硫脲分子具有一定的构象特性,可以存在不同的立体异构体。
硫脲中的化学键对其性质和应用起着重要的作用。
硫氮双键赋予了硫脲较好的反应活性和稳定性,硫碳单键使其具有溶解性和酸碱性,氮氮单键使其具有稳定性和构象特性。
通过对硫脲中的化学键的研究,我们可以更好地理解硫脲的性质和应用,为其在化学、医药等领域的应用提供理论基础。
硫脲生成硫磺的原理

硫脲生成硫磺的原理
硫脲是一种在有机合成和生物化学中常使用的重要化合物,它能够与空气中的氧气反应生成硫磺。
这种反应被广泛应用于金属表面处理、化学实验和医药领域。
硫脲生成硫磺的原理,主要涉及以下几个方面:
1. 硫脲的结构和性质
硫脲是一种碳氮硫杂环化合物,分子式为CH4N2S,具有两个互相映像的异构体,分别为1,2-硫脲(thiourea)和1,3-硫脲(thiuram)。
硫脲具有可溶于水和乙醇的性质,在不同的介质中具有不同的化学性质。
2. 硫脲与氧气的反应机理
硫脲可以与空气中的氧气反应生成硫磺,反应方程式为:
2CS(NH2)2 + O2 → 2S + 2CO2 + 2H2O
这种反应是一种氧化还原反应,其中硫脲被氧化形成硫磺,氧气则被还原形成二氧化碳和水。
硫脲的氧化能力主要来源于其中的两个互相维持的甲基和硫基。
3. 形成硫磺的条件
硫脲生成硫磺需要在一定的条件下进行。
首先,环境中必须存在适量的氧气,这是硫脲氧化反应的关键。
其次,反应需要在适当的温度范围内进行,通常在80-90℃之间获得较好的反应效果。
此外,反应中反应物与催化剂的比例也对反应效果产生重要的影响。
4. 应用领域
总之,硫脲生成硫磺是一种具有广泛应用价值的反应,它的原理主要涉及硫脲的结构和性质、硫脲与氧气的反应机理、形成硫磺的条件和应用领域等方面。
在未来的研究中,我们可以进一步探索硫脲生成硫磺的反应机理和优化反应条件,以提高反应效率和应用效果。
硫脲 还原三价铁

硫脲还原三价铁
硫脲的金属还原性质及应用
硫脲是一种有机硫化合物,其分子中的氧原子被硫原子取代,具有较强的还原性。
在高温下,硫脲与三价铁发生氧化还原反应,这是由于硫脲中硫元素的负二价特性。
一、硫脲的金属还原性质
硫脲在化学领域中具有重要的金属还原性质,主要体现在以下方面:
金属离子还原:硫脲作为强还原剂能够还原多种金属离子,包括铜离子、汞离子、镉离子、铁离子、钴离子等。
这种还原反应将二价离子还原为单价金属,同时也可将三价离子还原为二价金属。
二、硫脲还原金属的应用领域
硫脲的金属还原性质在化学应用中得到广泛应用,具体体现在以下几个方面:
金属离子污染物的去除:硫脲可用于水处理,通过其还原作用去除水中的重金属离子,如汞、铜、铅等,从而实现水质净化。
金属催化反应:硫脲作为有效的还原剂参与多种有机合成反应,包括氧化还原反应、酰基还原反应、缩醛反应等。
在金属催化的有机合成中,硫脲的还原性发挥着重要的作用。
电化学领域:硫脲可用作电化学反应中的还原剂,将金属离子还原成对应的金属。
在电化学领域,硫脲促进了电化学反应的进行。
三、总结
硫脲作为一种强还原剂,具有广泛的金属还原性质,其在水处理、有机合成和电化学等领域的应用,使其在化学领域中具有重要地位。
硫脲的独特性质为多个领域的研究和应用提供了有力的支持。
硫脲除钯剂原理

硫脲除钯剂原理硫脲除钯剂是一种常用的化学试剂,它可以用来去除溶液中的钯离子。
其原理是通过硫脲与钯离子发生反应,形成不溶性的硫脲配合物,从而使钯离子从溶液中沉淀出来。
本文将详细介绍硫脲除钯剂的原理及其应用。
我们来了解一下硫脲的性质。
硫脲,化学式为CH4N2S,是一种含有硫和氮元素的有机化合物。
它具有良好的配位能力,可以与金属离子形成稳定的配合物。
在溶液中,硫脲分子会与金属离子发生配位反应,形成金属-硫脲配合物。
这种配合物一般都具有较低的溶解度,会从溶液中沉淀出来。
接下来,我们来探讨硫脲除钯剂的原理。
当硫脲与钯离子反应时,它们会形成钯-硫脲配合物。
这种配合物通常是不溶于水的,会从溶液中析出。
这样,我们就可以通过过滤或离心等方法将其分离出来,从而实现去除钯离子的目的。
需要注意的是,由于硫脲可以与其他金属离子形成配合物,所以在使用硫脲除钯剂时,需要注意选择适当的条件,以避免其他金属离子的干扰。
硫脲除钯剂在实际应用中具有广泛的用途。
首先,它可以用于分离和测定钯离子。
由于钯是一种重要的贵金属,具有很高的经济价值,所以对于钯离子的分离和测定具有重要意义。
硫脲除钯剂可以通过与钯离子形成不溶性配合物,实现钯离子的富集和分离,从而方便后续的分析测定。
硫脲除钯剂还可以用于废水处理。
钯离子是一种常见的工业废水中的污染物,对环境和生态系统具有一定的危害。
通过使用硫脲除钯剂,可以将废水中的钯离子去除,从而达到净化废水的目的。
这种方法具有操作简便、效果显著的特点,因此在废水处理领域得到了广泛应用。
硫脲除钯剂还可以用于金属回收。
在一些废弃电子产品的处理过程中,常常含有大量的贵金属如钯。
通过使用硫脲除钯剂,可以将废弃电子产品中的钯离子富集和分离出来,从而实现钯的回收利用。
这不仅可以减少对自然资源的开采,还可以降低环境污染。
硫脲除钯剂是一种常用的化学试剂,可以通过与钯离子形成不溶性的配合物,实现钯离子的去除。
它具有广泛的应用领域,包括钯离子的分离测定、废水处理和金属回收等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫脲/309/
Keyword:硫脲硫脲价格硫脲作用硫脲性质硫脲类药物
中文名:硫脲
中文别名:硫代尿素
英文名称:Thiourea
英文别名:2-Thiourea; Isothiourea; sulfocarbamide; sulfouren; sulourea; Thiocarbamide; Thiurea; THU; thi o arbamid; sulphourea
CAS No.:62-56-6
EINECS号:200-543-5
分子式:CH4N2S
分子量:76.12
熔点:171-175℃
沸点:186.8 °C at 760 mmHg
折射率: 1.637 (30 C)
闪光点:66.8 °C
Inchi:InChI=1/CH4N2S/c2-1(3)4/h(H4,2,3,4)
密度: 1.405
水溶性:13.6 g/100 mL (20℃)
危险类别码:R22,R40,R51/53,R63,
危险品运输编号:UN 2877/2811
安全说明:S36/37,S61,
海关编码:29309070
包装等级:III
危险类别: 6.1
储存温度:Store at RT.
急性毒性:口服-大鼠LD50: 125 毫克/公斤; 腹腔-小鼠LD50: 100 毫克/公斤
灭火剂:水、二氧化碳、砂土、泡沫
火警危险:Slightly flammable.
毒性分级:高毒
刺激数据:眼睛-兔子14% 中度
储运特性:库房通风低温干燥; 与食品原料分开储运
可燃性危险特性:受热放出有毒氧化硫和氧化氮气体
健康危害:Poisonous inhaled or swallowed. Irritating to skin; may cause allergic skin eruptions.
危险品标志:
Xn:Harmful
分子结构式:
上游原料:硫化钡硫化氢硫酸氰氨化钙盐酸重晶石
下游产品:硫尿嘧啶苄硫醇反丁烯二酸巯基丙酸二氧化硫脲2-氨基噻唑2-氨基-5-甲基噻唑氨噻肟酸2-肟基-2-(2-氨基噻唑)-4-乙酸乙酯乙亚氨基-3-(α-羟基苯乙烯)噻唑啉盐酸盐2-氨基-5-硝基噻唑噻嗪酮灭多威拌种灵二硫氰基甲烷
硫脲/309/
物化性质
硫脲(62-56-6)的性状:无色或白色有光泽的斜方晶体或针状结晶。
味苦。
能溶于11份
水、乙醇,几乎不溶于乙醚。
在真空下,150~160℃升华。
熔点176~178℃;
d4201.405。
LD50野生挪威大鼠口服:1.83g/kg。
规格HG/T 3454-1999 分
析纯化学纯含量(H2NCSNH2)/%≥99.0 98.0 澄清度试验合
格合格水不溶物/%≤0.002 0.01 干燥失重/%≤0.5 灼烧残渣(以
硫酸盐计)/%≤0.005 0.02 硫氰酸盐(以CNS计)/%≤0.005 0.01 白色或浅黄色有
光泽的片状、柱状或针状结晶,有苦味。
能溶于水和乙醇,几乎不溶于乙醚。
白色或浅黄色
有光泽的片状、柱状或针状结晶,有苦味。
用途
用于制造磺胺药物、染料、树脂、压塑粉等,也用作橡胶的硫化促进剂、金属矿物的浮选剂等产品描述
硫脲(62-56-6)的制法:用石灰乳在负压、冷却下吸收硫化氢,生成硫氢化钙溶液。
将硫氢化
钙与氰氨化钙(石灰氮)按1:5摩尔比,于80℃左右反应3h,即得硫脲溶液。
经过滤、浓缩、冷
却结晶、甩滤干燥,得纯品硫脲。
泄漏应急处理:隔离泄漏污染区,周围设警告标志,建议
应急处理人员戴好防毒面具,穿化学防护服。
不要直接接触泄漏物。
用洁清的铲子收集于干燥
净洁有盖的容器中,运至废物处理场所。
也可以用大量水冲洗,经稀释的洗水放入废水系统。
如大量泄漏,收集回收或无害处理后废弃。
防护措施:呼吸系统防护:空气中浓度超标时,
佩带防毒口罩。
眼睛防护:一般不需要特殊防护。
必要时戴化学安全防护眼镜。
防护服:
穿相应的防护服。
手防护:戴防化学品手套。
其它:工作后,淋浴更衣。
单独存放被毒物
污染的衣服,洗后再用。
保持良好的卫生习惯。
急救措施:皮肤接触:脱去污染的衣着,用
流动清水冲洗。
眼睛接触:立即提起眼睑,用流动清水冲洗。
吸入:脱离现场至空气新鲜
处。
必要时进行人工呼吸。
就医。
食入:误服者给饮大量温水,催吐。
就医。
灭火方法:
雾状水、二氧化碳、砂土、泡沫。
健康危害:侵入途径:吸入、食入、经皮吸收。
健康危
害:本品反复作用时,可抑制甲状腺和造血器官。
有可能引起变态反应。
吸入本品粉尘对上呼
吸道有刺激性,出现胸部不适、咳嗽等。
对眼有刺激性。
口服刺激胃肠道。
慢性影响:长期
接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、白细胞减少等。
对皮肤有
损害,出现皮肤瘙痒、手掌出汗、皮炎及皲裂等。
毒理学资料及环境行为:毒性:毒性很低。
刺
激性:家兔经眼:2mg,重度刺激。
家兔经皮开放性刺激试验:10mg/(24小时),重度刺激。
致
突变性:微生物致突变:鼠伤寒沙门氏菌150ug/L;制酒酵母菌52600umol/L。
生殖毒性:大
鼠经口最低中毒剂量(TDL0):40mg/kg(孕后用药1天),对胎鼠中枢神经系统,肌肉、骨骼系统
有影响。
致癌性:IARC致癌性评论:动物阳性反应。
危险特性:遇明火、高热可燃。
与
氧化剂能发生强烈反应。
受热分解,放出氮、硫的氧化物等毒性气体。
燃烧(分解)产物:氧化
氮、氧化硫。
生成方法
用石灰乳在负压、冷却下吸收硫化氢,生成硫氢化钙溶液。
将硫氢化钙与氰氨化钙(石灰氮)按1:5摩尔比,于80℃左右反应3h,即得硫脲溶液,过滤、浓缩、冷却结晶、甩滤干燥,得成品硫脲。
此外,用硫氰酸铵法和重氮甲烷法也可制得。
;其制备方法是以硫化钡与硫酸或盐酸反应,硫化氢气体经石灰乳负压吸
收制得硫化氢钙溶液,再与氰氨化钙反应,硫氢化钙与氰氨化钙的摩尔比为1∶5,在不断搅拌下,反应温度为(80±5)℃,反应时间为3h,经负压过滤,即可生成硫脲液体,再经蒸发、过滤、冷却、结晶,即得晶体硫脲,离心脱水干燥即得成品。
反应方程式如:
BaS+H2SO4→BaSO4↓+H2S↑2H2S+Ca(OH)2→Ca(SH)2+2H2O;合成法用硫化钡与盐酸(或硫酸)反应,用石灰乳负压吸收,再与石灰氮反应,经过滤、冷却结晶、离心分离、干燥,制得硫脲成品。
其
BaS+2HCl→BaC12+H2S↑CaO+H2O→Ca(OH)2Ca(OH)2+2H2S→Ca(SH)2+2H2O2CaCN2+Ca(SH)2+6H2O→2(NH2)2CS+3Ca(OH)2;
本文由盖德化工网( )收集、整理!
盖德化工导航/ 化工人必备的化工导航工具!。
