2020年机能实验报告,休克
机能实验休克

昆明医科大学机能学实验报告呼吸调节、呼吸功能不全及治疗一、实验目的1.观察豚鼠的正常呼吸频率、幅度、膈肌放电、动脉血氧分压及呼吸运动的调节,2.复制豚鼠哮喘模型,观察呼吸衰竭时动物呼吸频率、幅度、动脉血氧分压及膈肌放电的变化;探讨呼吸衰竭的发生机制。
3.观察不同药物的治疗效果并分析其作用机制。
二、实验原理呼吸衰竭外呼吸功能严重障碍,导致PaO2降低伴有或不伴有PaCO2增高的病理过程。
诊断呼衰的主要血气标准是PaO2低于60mmHg,伴有或不伴有PaCO2高于50mmHg,其病因为:神经系统疾患,胸廓疾病,肺的病变。
本实验通过各种药物的对比,讨论豚鼠呼吸衰竭的机制。
三、实验仪器设备仪器:Medlab生物信号采集处理系统,血气分析仪,豚鼠手术台,手术器械一套,呼吸换能器,动静脉留置针(22~24G),小动物器官插管,超声雾化器一套试剂及药品:肝素钠注射液,25%乌拉坦,3ml/ml组胺,尼可刹米注射液(0.375/1.5ml),地塞米松(5mg/ml),氨茶碱注射液(2ml:0.25g),沙丁胺醇气雾剂(14g:28mg)四、实验方法与步骤1.称重、麻醉、固定动物称重、腹腔麻醉(25%乌拉坦5~6ml/kg),固定于手术台2.颈总动脉穿刺及气管插管分离颈总动脉放置留置针以备取血,颈部气管插管接呼吸换能器3.记录膈肌放电将两颗银针插入豚鼠任意一侧(右侧优先)肋间肌中,针柄与传导电极两红色支相连,黑色支夹于皮肤4.记录正常各项生理指标打开Medlab信号采集系统,记录正常呼吸频率、深度及膈肌放电等情况,取血测定气血指标(PaO2、PaCO2)5.观察呼吸调节分别吸入氮气和5%~10% 二氧化碳后观察呼吸运动的改变6.复制及性哮喘性呼吸衰竭病理模型吸入雾化组胺制作急性哮喘性呼吸衰竭病理模型,待豚鼠呼吸出现频率明显减慢、幅度降低、膈肌放电异常时,记录上述各项指标的变化,取血作血气分析结果记录7.治疗分组经豚鼠头静脉注射给药进行治疗:A组(空白对照组):5、10、15min后分别取血作血气分析结果记录五、实验结果正常:吸入CO₂和N2:吸入组胺:呼吸衰竭给地塞米松前:给地塞米松后:实验数据填入下表:8六、分析与讨论1、当缺氧和CO2浓度增高时呼吸运动有何变化?缺氧时:PaO2下降:I PaO2于60~100mmHg时,肺气量无明显变化II PaO2<60时,可刺激颈动脉体和颈动脉体的外周化学感受器,冲动传入延髓,反射性第引起呼吸加快加深III PaO2=30mmHg时,肺通气量最大IV PaO2<30mmHg时,缺氧对呼吸中枢的直接抑制作用超过PaO2降低对外周感受器的兴奋作用,反应中枢性呼吸衰竭,表现为呼吸抑制)CO2浓度增高时:PaCO2升高I PaCO2 >50mmHg,刺激中枢化学感受器,呼吸中枢兴奋,使呼吸加深加快II PaCO2>80mmHg,直接抑制呼吸中枢,此时呼吸运动主要靠动脉血低氧分压对血管化学感受器的刺激得以维持)2、呼吸衰竭诊断标准是什么?阻塞性呼吸功能不全的发生机制?呼吸衰竭指呼吸功能严重障碍,导致PaO2降低的伴有或不伴有PaCO2增高的病理过程,其诊断标准是:PaO2低于60mmHg,伴有或不伴有PaCO2高于50mmHg阻塞性通气不足指气道狭窄或阻塞所致的通气障碍,正常人气道阻力位0.1~0.3KPa·s/L。
休克机能实验报告

一、实验目的1. 建立失血性休克动物模型,观察休克过程中机体各系统机能变化。
2. 探讨不同治疗方案对失血性休克的治疗效果及机制。
3. 了解休克早期治疗原则及临床应用。
二、实验材料与方法1. 实验动物:健康成年SD大鼠30只,体重200-250g,雌雄不限。
2. 实验器材:手术显微镜、手术刀、手术剪、镊子、缝合针、缝合线、玻璃分针、股动脉插管、股静脉插管、尿道插管、体温计、生理盐水、肝素、阿拉明、多巴胺等。
3. 实验方法:(1)动物分组:将30只大鼠随机分为3组,每组10只。
分别为对照组、休克组、治疗组。
(2)建立失血性休克模型:对休克组大鼠进行麻醉,切开股动脉,用玻璃分针分离股动静脉与股神经,股静脉插管,结扎远心端,近心端插入静脉留置针,推注肝素。
然后快速放血,使大鼠失血量为自身血量的30%。
对照组大鼠仅进行麻醉和股动脉插管操作,不放血。
治疗组大鼠在休克发生后,立即给予阿拉明或多巴胺治疗。
(3)观察指标:1)血压:用压力换能器连续监测大鼠的血压变化。
2)心率:用听诊器听诊大鼠的心率变化。
3)呼吸频率:观察大鼠的呼吸频率变化。
4)血氧饱和度:用血氧饱和度仪监测大鼠的血氧饱和度。
5)体温:用体温计监测大鼠的体温变化。
6)动脉血气分析:检测动脉血pH、PaO2、PaCO2等指标。
三、实验结果1. 对照组大鼠血压、心率、呼吸频率、血氧饱和度、体温等指标均正常。
2. 休克组大鼠在失血后,血压、心率、呼吸频率、血氧饱和度、体温等指标均显著降低,与正常对照组相比差异具有统计学意义(P<0.05)。
3. 治疗组大鼠在给予阿拉明或多巴胺治疗后,血压、心率、呼吸频率、血氧饱和度、体温等指标逐渐恢复正常,与休克组相比差异具有统计学意义(P<0.05)。
四、讨论1. 本实验成功建立了失血性休克动物模型,观察了休克过程中机体各系统机能变化,为临床研究提供了实验基础。
2. 休克是机体对有效循环血量减少、组织灌注不足、细胞代谢紊乱的一种全身性应激反应。
机能综合实验报告失血性休克

实验报告失血性休克李国亮90905122实验名称——动脉血压调节和失血性休克(二)一、实验目的二、1.建立失血性休克的动物模型并观察失血性休克过程中心脏、肾及微循环的变化2.了解抢救失血性休克时扩容血容量的意义,在扩容基础上的应用不同的血管活性药物治疗失血性休克,并进行疗效比较。
3.观察肠系膜微循环,了解休克的机理。
三、合作同学朱骞、徐灵驰、陈霁云、胡蝶四、实验原理1.失血性休克的原理微循环障碍致微循环动脉血灌流不足,重要的生命器官因缺氧而发生功能和代谢障碍,是各型休克的共同规律。
休克时微循环的变化,大致可分为三期,即微循环缺血期、微循环淤血期和微循环凝血期。
1)正常情况⑴动静脉吻合支是关闭的。
⑵只有20%毛细血管轮流开放,有血液灌流。
⑶毛细血管开放与关闭受毛细血管前括约肌的舒张与收缩的调节。
2)微循环缺血期⑴交感神经兴奋和肾上腺素、去甲肾上腺素分泌增多,小动脉、微动脉、后微动脉,毛细血管前括约肌收缩。
⑵动静脉吻合支开放,血液由微动脉直接流入小静脉。
⑶毛细血管血液灌流不足,组织缺氧。
3)微循环淤血期⑴小动脉和微动脉收缩,动静脉吻合支仍处于开放状态,进入毛细血管的血液仍很少。
⑵由于组织缺氧,组织胺、缓激肽、氢离子等舒血管物质增多,后微动脉和毛细血管前括约肌舒张,毛细血管开放,血管容积扩大,进入毛细血管内的血液流动很慢。
⑶由于交感神经兴奋,肾上腺素和去甲肾上腺素分泌增多,使微静脉和小静脉收缩,毛细血管后阻力增加,结果毛细血管扩张淤血。
4)微循环凝血期⑴由于组织严重缺氧、酸中毒,毛细血管壁受损害和通透性升高,毛细血管内血液浓缩,血流淤滞;另外血凝固性升高,结果在微循环内产生播散性血管内凝血。
⑵由于微血栓形成,更加重组织缺氧和代谢障碍,细胞内溶酶体破裂,组织细胞坏死,引起各器官严重功能障碍。
⑶由于凝血,凝血因子和血小板大量被消耗,纤维蛋白降解产物增多,又使血液凝固性降低;血管壁又受损害,继而发生广泛性出血。
休克护理实验总结报告范文(3篇)

第1篇一、实验背景休克是一种危及生命的临床急症,是由于有效循环血量锐减、组织灌注不足而导致的微循环功能障碍和细胞代谢障碍,进而引起器官功能障碍。
休克的治疗关键是迅速恢复有效循环血量,改善组织灌注,防止多器官功能障碍综合征的发生。
本实验旨在通过模拟休克状态,探讨休克护理措施的效果,提高护理人员对休克患者的护理水平。
二、实验目的1. 了解休克的病因、病理生理变化及临床表现。
2. 掌握休克的诊断标准和治疗原则。
3. 熟悉休克患者的护理措施,包括病情观察、体位、液体复苏、药物应用等。
4. 提高护理人员对休克患者的护理技能和应急处理能力。
三、实验方法1. 实验对象:选择健康成年志愿者作为实验对象,模拟休克状态。
2. 实验分组:将志愿者随机分为休克组和非休克组。
3. 实验过程:- 休克组:通过放血、药物等方法模拟休克状态。
- 非休克组:作为对照组,不进行任何处理。
4. 护理措施:- 观察指标:血压、心率、呼吸、尿量、皮肤色泽等。
- 护理措施:包括体位、液体复苏、药物应用、生命体征监测等。
四、实验结果1. 休克组志愿者在放血后血压下降、心率加快、呼吸急促、尿量减少、皮肤色泽苍白等休克症状明显。
2. 通过及时有效的护理措施,休克组志愿者的血压逐渐恢复正常,心率、呼吸、尿量等指标逐渐稳定。
3. 非休克组志愿者各项指标均正常。
五、实验讨论1. 休克的病因:休克可由多种原因引起,如失血、感染、创伤、过敏等。
2. 休克的病理生理变化:休克时有效循环血量锐减,导致组织灌注不足,引起微循环功能障碍和细胞代谢障碍。
3. 休克的临床表现:休克患者表现为血压下降、心率加快、呼吸急促、尿量减少、皮肤色泽苍白等。
4. 休克的诊断标准:根据患者的病史、临床表现和辅助检查结果进行综合判断。
5. 休克的治疗原则:迅速恢复有效循环血量,改善组织灌注,防止多器官功能障碍综合征的发生。
6. 休克患者的护理措施:- 观察指标:密切观察患者的血压、心率、呼吸、尿量、皮肤色泽等指标,及时发现病情变化。
机能综合实验报告——失血性休克

机能综合实验报告——失血性休克失血性休克是指失血导致循环血量不足,导致心排血量下降,组织灌注不足,出现严重低血压和组织器官衰竭的一种疾病状态。
本次实验的目的主要是通过建立实验动物的失血性休克模型,观察动物体征变化并进行相应的生理指标测量,探究失血性休克的机制,为临床治疗提供一定的参考和指导。
一、实验方法1.1 实验动物选用成年雄性Wistar大鼠,体重250-300g。
1.2 实验设备和试剂心电图机、血流量测定仪、氧化还原酶计、血红蛋白测定仪、动脉粘滞度测定仪、无菌手术器械、路易斯溶液、大鼠丙泊酚、肌肉松弛剂、凝血酶纤维蛋白原复合物、氯化钠、生理盐水等。
1.3.1 麻醉和手术操作首先对大鼠进行预处理,让大鼠在实验环境下适应2-3天。
在实验当天,将大鼠移至操作台上,静脉内注射丙泊酚10mg/kg和肌肉松弛剂2mg/kg,用无菌手术器械对大鼠进行一定长度的剖腹手术,将管腔暴露。
随后使用针头伏特法将大鼠肝门中央静脉插入隆突下动脉,连接血流量测定仪。
1.3.2 失血处理分别抽取50ml的血液(Wistar大鼠血容量占体重的7-8%),使大鼠处于失血状态。
失血量控制在10ml左右,出现严重的低血压和心率下降的情况即停止失血。
1.3.3 观察和测量动物失血后,可以通过血流量的变化观察血管收缩和扩张的情况,心电图的变化观察心脏功能的变化。
同时,用氧化还原酶计、血红蛋白测定仪等仪器测量相应生理指标。
1、预处理:让大鼠在实验环境下适应2-3天。
2、麻醉和手术:将大鼠移至操作台上,静脉内注射丙泊酚10mg/kg和肌肉松弛剂2mg/kg。
对大鼠进行剖腹手术,将管腔暴露。
4、观察和测量:用血流量测定仪等仪器观察和测量相应生理指标。
二、实验结果2.1 生理指标变化实验结果显示,大鼠失血后,心率呈下降趋势,收缩压、舒张压和平均动脉压呈现显著的下降趋势,心排血量下降明显。
氧化还原酶计、血红蛋白测定仪等指标也均表现出异常变化。
机能综合实验报告失血性休克

机能综合实验报告失血性休克一、实验目的通过模拟失血性休克这种常见危重病情,了解休克的相关知识,熟悉休克时机体各系统生理功能变化,掌握休克的监测、抢救措施和护理技巧等基本知识和技能。
二、实验原理失血性休克是指因大量失血造成心脏无法维持血液循环所形成的一种危重急症,是失血后机体对风险因素的一种自保反应。
失血性休克的发生,必须存在某种形式的有效循环血量严重不足,主要表现为低血容量、低血压和组织缺氧等。
机体对失血休克的反应即是消化道道、皮肤脉管收缩、淋巴系统流速下降、交感神经系统生物反应降低,以利用有限的血容量为机体的重要器官供应足够的氧气和营养。
当出现失血休克时,必须尽快进行抢救,以保证机体各系统生理功能得以维持,及时防止危及生命的情况的发生。
三、实验器材及药品1. 实验仪器及设备:生命体征监护仪、氧气瓶及氧气面罩、Ⅲ 型汇流管等。
2. 实验药品及溶液:生理盐水、血液置换液及血液净化液等。
四、实验过程1. 了解实验仪器及设备的使用方法、药品及溶液的配制方法。
2. 请实验被试躺在床上,坚持卧床休息。
3. 用生命体征监护仪记录患者心率、呼吸频率、血压、体重等指标,并设置报警上下限。
4. 为患者取血检查,模拟患者失血量,测量本次失血量,并记录血红蛋白、血细胞比容等5. 开始进行失血性休克模拟实验。
通过静脉输液吊盐水和生理盐水来控制患者的血容量,进一步降低患者的血容量,使失血量达到实验设置的程度。
6. 在休克过程中,监测患者生命体征的变化,如心率、呼吸、血压等。
当患者发生失去反应时,应立即进行紧急抢救。
7. 进行抢救措施,包括输液、打氧气等,及时恢复患者的生命体征状态。
8. 护理措施,如保温、检查压疮等。
五、实验结果与分析1. 实验过程中,患者逐渐进入失血休克状态,生命体征逐渐变差,如心率增快并出现心律不齐,血压下降,呼吸困难等。
3. 实验结果还表明,在失血性休克中应该根据患者的情况及时采取抢救措施,如输液、打氧气,及时恢复患者的生命体征状态。
家兔失血性休克(95)

机能实验:家兔失血性休克及其实验性治疗(此作业得分95分仅供参考)一、实验目的1、复制家兔失血性休克模型。
2、观察失血性休克时和抢救过程中家兔各项观察指标变化并探讨发生机制。
二、实验原理失血会导致血容量减少,是休克的常见病因。
休克的发生与否取决于失血量和失血速度,当血量锐减超过总血量的25-30%,超出机体的代偿能力时,即可引起心排血量和平均动脉压下降而发生休克。
对于失血性休克的治疗,首先是强调止血和补充血容量,以提高有效循环血量和心排血量,改善组织灌流。
除此之外,可根据休克的不同发展阶段合理使用血管活性药物,改善微循环,必要时可给予抗炎等治疗。
三、实验材料1.实验动物:家兔(体重2.0kg以上)。
2.器材与药品:兔手术台,手术器械一套,注射器,动脉导管,静脉导管,三通管,气管插管,输液装置,丝线,体温计,木夹,压力换能器等。
25%乌拉坦,肝素生理盐水,生理盐水等。
四、实验方法与步骤(一)手术操作1.称重、麻醉、固定:取家兔一只,称重后按5ml/kg的剂量自耳缘静脉20%的乌拉坦溶液麻醉。
麻醉完成后将家兔固定于手术台上。
2.分离气管、血管并插管:切开颈部正中皮肤4-5cm,分离皮下组织和肌肉,游离气管,然后作一倒T形切口,插入气管插管,连接呼吸换能器,描记呼吸曲线;游离左侧颈总动脉,插入颈动脉导管,连接压力换能器,描记血压曲线;游离右侧颈外静脉,插入静脉导管,连接压力换能器,描记中心静脉压曲线。
3.心电的描记:分别将白色、红色、黑色心电电极放置在动物的左后肢、右前肢和右后肢皮下,描记心电波形。
4.预先按1ml/kg的剂量,经颈外静脉输入肝素钠对家兔给予肝素化处理。
(二)休克模型复制1.打开三通开关,使血液从颈总动脉流入含少量肝素抗凝的注射器内。
先缓慢放血20ml,观察血压变化情况;再次放血10ml,观察血压变化情况,直至平均动脉压降低至约40mmHg。
然后观察一段时间,若血压回升至45mmHg以上,则再次抽血,直至平均动脉压可维持在40mmHg达10min以上。
机能综合实验报告失血性休克

机能综合实验报告失血性休克一、实验目的1.了解失血性休克的机制和病理生理变化;2.掌握对失血性休克的处理方法;3.建立对实验动物失血性休克模型的制备方法。
二、实验原理失血性休克是由于大量失血导致有效循环血容量减少,心排血量降低而引起的一种严重的循环功能障碍综合征。
在休克发生过程中,机体会发生一系列病理生理变化,包括心排血量减少、心率加快、血压下降、组织缺血、代谢紊乱等。
失血性休克的处理方法主要包括保持呼吸道通畅、控制出血、输血及补充液体。
三、实验器材和试剂1.实验动物:健康成年小鼠;2. 失血性休克模型制备器材:手术刀、医用剪刀、无菌棉签、灭菌贴、100 ml注射器、1 ml注射器、生理盐水;3.计量仪器:注射器、电子天平;4.进行实验的环境:温度适宜的实验室。
四、实验步骤1.处理实验动物:按照实验伦理规定,将实验动物进行饲养,并训练适应环境;2.模型制备:使用手术刀和医用剪刀,在小鼠的背部对称剪切部分,大约剪除小鼠总血量的20%;3.观察指标记录:在实验过程中,记录实验动物的心率、血压、呼吸等指标。
五、实验结果分析在制备失血性休克模型后,我们对实验动物的生理指标进行了观察和记录。
结果显示,剪切失血后,实验动物的心率明显加快,血压迅速下降,呼吸急促。
这些指标的异常变化与失血性休克的病理生理改变相对应,证明了失血性休克模型制备成功。
六、实验讨论失血性休克是一种常见且危险的疾病,对其的处理方法非常重要。
在实验中,我们使用了剪切法制备了失血性休克模型,并记录了相关的生理指标。
实验结果表明,剪切失血后,实验动物出现了典型的失血性休克病理生理变化,验证了所制备的休克模型的可靠性。
然而,在实际应用中,剪切法制备失血性休克模型并不是最常用的方法。
通常,我们会选择钢针法或切割法来制备失血性休克模型,这些方法更加可控、准确,且操作简便。
因此,在下一步的实验中,我们将尝试其他更先进的制备方法,以提高实验结果的可靠性和准确性。
休克机能学实验实验报告

1. 复制失血性休克模型,观察休克早期大鼠的生理机能变化。
2. 探讨失血性休克的发病机制,包括微循环障碍、器官功能受损等方面。
3. 了解并学习休克早期的治疗原则,比较不同治疗方案的效果。
二、实验动物与材料1. 实验动物:300g左右SD大鼠,雌雄不限。
2. 实验材料:20%乌拉坦、利多卡因注射液、0.9%氯化钠注射液、125U/ml肝素溶液、1%普鲁卡因,7.5%高渗盐水、5%葡萄糖、去氧肾上腺素注射液,异丙肾上腺素注射液,重酒石酸去甲肾上腺素注射液,盐酸肾上腺素注射液,佩尔(乌拉地尔),硝酸甘油注射液。
3. 实验器材:手术器械、注射器(1ml、5ml、10ml)、动脉插管、压力换能器、生物信号采集处理系统、呼吸机、针头(9号、16号)、头皮针、动脉导管、气管插管、兔手术台、听诊器、压力换能器、HX200型呼吸流量换能器、RM6240多道生理信号采集处理系统。
三、实验方法1. 将大鼠称重后,腹腔注射40mg/kg 2%戊巴比妥钠溶液进行全麻,待麻醉成功后,将大鼠仰卧位固定于鼠恒温实验台上,减去股部手术野被毛。
2. 在大鼠的股动脉搏动处切开皮肤组织,止血钳分离股血管神经鞘,暴露神经血管后,用利多卡因擦拭。
用玻璃分针分离股动静脉与股神经,股静脉插管,结扎远心端,近心端插入静脉留置针,推注50U/ml肝素。
股动脉插管连接压力换能器。
3. 选取硬膜外导管前端约七厘米与尿液计滴器相连,碘伏消毒会阴处,将导管沿尿道插入约4cm。
4. 用液体石蜡涂抹动物肛温仪前端,插入肛门测量肛温。
5. 分别给予去氧肾上腺素、异丙肾上腺素、重酒石酸去甲肾上腺素、盐酸肾上腺素、佩尔(乌拉地尔)、硝酸甘油等药物,观察血压、心率、呼吸等生理指标的变化。
6. 在不同药物作用下,观察大鼠的生理机能变化,包括微循环、器官功能等方面。
1. 失血性休克模型复制成功,大鼠出现血压下降、心率加快、呼吸急促等症状。
2. 给予去氧肾上腺素、异丙肾上腺素、重酒石酸去甲肾上腺素、盐酸肾上腺素、佩尔(乌拉地尔)、硝酸甘油等药物后,大鼠的血压、心率、呼吸等生理指标均有明显改善。
机能学实验-失血性休克实验报告

机能学实验-失血性休克实验报告失血性休克是一种常见而且危险的情况。
它通常是由于出血或其他原因而导致体内血容量降低引起的,会使血压下降,血流量降低,导致组织缺氧等一系列生理反应。
本次实验旨在模拟失血性休克情况,观察猪肠的微循环变化,以探究失血性休克对生理状态的影响以及可能的治疗手段。
实验操作步骤:1. 杀猪,取出猪肠,清洗干净。
将猪肠放置于显微镜下,调节显微镜,观察猪肠微循环情况,记录基础状态下的血压和心率。
2. 将空气吸入注射器中,插入針头,注入猪肠中。
同时,监测猪肠微循环情况、血压和心率。
3. 在注射逐渐递增过程中,一旦猪肠微循环开始出现异常,即认定休克状态出现。
记录此时的血压和心率。
4. 将逐渐注入的空气清空,继续观察猪肠微循环情况,直到其恢复到基础状态。
实验结果分析:在注射空气逐渐递增过程中,随着空气的注入,血压和心率开始下降,且猪肠微循环出现明显的缺血情况。
出现休克状态后,血压和心率进一步下降,猪肠微循环更加严重缺氧,直到缺氧达到顶峰后,逐渐恢复到基础状态。
从实验结果可以看出,失血性休克对生理状态产生了很大的影响。
如果不及时处理,可能会导致生命危险。
因此,针对失血性休克的治疗非常重要。
在实验中,我们可以观察到猪肠微循环的变化,从而了解失血性休克对器官组织的影响。
同时,我们也可以尝试不同的治疗手段来缓解休克状态,以找到最佳的治疗方案。
例如,给予输液来恢复体液水平、输血来增加血容量、使用肾上腺素等药物来升高血压等等。
总结:失血性休克是一种危险的疾病,需要及时应对。
机能学实验可以有效的模拟失血性休克情况,通过观察器官微循环的变化,以探究失血性休克对生理状态的影响,为寻找治疗方案提供基础依据。
此外,通过实验,我们还可以更好地理解生理学知识,深入了解机体的运作机制。
机能综合实验报告失血性休克

一、实验名称——动脉血压调节与失血性休克(二)二、实验目得1.建立失血性休克得动物模型并观察失血性休克过程中心脏、肾及微循环得变化2.了解抢救失血性休克时扩容血容量得意义,在扩容基础上得应用不同得血管活性药物治疗失血性休克,并进行疗效比较。
3.观察肠系膜微循环,了解休克得机理。
三、合作同学朱骞、徐灵驰、陈霁云、胡蝶四、实验原理1.失血性休克得原理微循环障碍致微循环动脉血灌流不足,重要得生命器官因缺氧而发生功能与代谢障碍,就是各型休克得共同规律。
休克时微循环得变化,大致可分为三期,即微循环缺血期、微循环淤血期与微循环凝血期。
1)正常情况⑴动静脉吻合支就是关闭得。
⑵只有20%毛细血管轮流开放,有血液灌流。
⑶毛细血管开放与关闭受毛细血管前括约肌得舒张与收缩得调节。
2)微循环缺血期⑴交感神经兴奋与肾上腺素、去甲肾上腺素分泌增多,小动脉、微动脉、后微动脉,毛细血管前括约肌收缩。
⑵动静脉吻合支开放,血液由微动脉直接流入小静脉。
⑶毛细血管血液灌流不足,组织缺氧。
3)微循环淤血期⑴小动脉与微动脉收缩,动静脉吻合支仍处于开放状态,进入毛细血管得血液仍很少。
⑵由于组织缺氧,组织胺、缓激肽、氢离子等舒血管物质增多,后微动脉与毛细血管前括约肌舒张,毛细血管开放,血管容积扩大,进入毛细血管内得血液流动很慢。
⑶由于交感神经兴奋,肾上腺素与去甲肾上腺素分泌增多,使微静脉与小静脉收缩,毛细血管后阻力增加,结果毛细血管扩张淤血。
4)微循环凝血期⑴由于组织严重缺氧、酸中毒,毛细血管壁受损害与通透性升高,毛细血管内血液浓缩,血流淤滞;另外血凝固性升高,结果在微循环内产生播散性血管内凝血。
⑵由于微血栓形成,更加重组织缺氧与代谢障碍,细胞内溶酶体破裂,组织细胞坏死,引起各器官严重功能障碍。
⑶由于凝血,凝血因子与血小板大量被消耗,纤维蛋白降解产物增多,又使血液凝固性降低;血管壁又受损害,继而发生广泛性出血。
2.阿拉明与多巴胺治疗失血性休克得机理阿拉明就是α受体激动剂,具有显著地收缩血管得作用,能够快速升高血压;小剂量得多巴胺能够扩张血管。
休克的实训报告

一、实训目的本次休克实训旨在通过模拟休克状态,使学生了解休克的概念、分类、临床表现及急救处理方法,提高学生对休克的认识,增强急救意识和实际操作能力。
二、实训环境实训地点:模拟急救室实训器材:休克模拟人、血压计、听诊器、急救包、输液设备等实训时间:2023年X月X日三、实训原理休克是指由于有效循环血量锐减,导致组织灌流不足,引起以微循环障碍、细胞代谢紊乱及器官功能障碍为特征的病理生理过程。
休克可分为低血容量性休克、感染性休克、心源性休克等类型。
四、实训过程1. 休克模拟实训教师首先向学生介绍休克的定义、分类及临床表现,然后进行休克模拟。
模拟人表现出休克症状,如面色苍白、脉搏细速、血压下降、尿量减少等。
2. 病情评估学生分组进行病情评估,包括观察患者的意识、呼吸、血压、脉搏、皮肤色泽等指标,并使用血压计、听诊器等工具进行检测。
3. 急救处理根据病情评估结果,学生进行以下急救处理:(1)保持患者平卧,头部抬高15-30度,以利于呼吸。
(2)迅速建立静脉通道,进行快速补液。
(3)根据血压情况,调整输液速度。
(4)给予吸氧,保持呼吸道通畅。
(5)密切观察患者生命体征变化,及时调整急救措施。
4. 实训总结实训结束后,学生分组进行总结讨论,分享急救过程中的经验和教训。
五、实训结果通过本次实训,学生掌握了以下知识和技能:1. 休克的定义、分类及临床表现。
2. 休克急救的基本原则和操作流程。
3. 使用血压计、听诊器等工具进行病情评估。
4. 建立静脉通道、快速补液、吸氧等急救措施。
5. 团队协作和沟通能力。
六、实训总结本次休克实训取得了良好的效果,达到了预期目标。
学生在实训过程中,不仅掌握了休克急救的基本知识和技能,还提高了实际操作能力和团队协作精神。
以下是对本次实训的总结:1. 休克是一种严重的生命威胁,急救处理要及时、准确。
2. 休克急救需要团队合作,每个成员都要明确自己的职责。
3. 实训过程中,学生应注重观察、思考和实践,不断提高自己的急救能力。
失血性休克

南京大学医学院机能综合实验报告实验二题目失血性休克及抢救一、实验目的1.复制家兔失血性休克模型2.探讨失血性休克的发病机理。
3.分析失血性休克的抢救措施。
二、实验材料及药品材料:家兔,动物手术器械(包括手术刀、粗剪、组织剪、眼科剪、止血钳),动脉夹,动脉插管,血压换能器,HX200型呼吸流量换能器,气管插管,铁支架,玻璃分针,结扎线,注射器,烧杯,生物信号采集处理系统。
药品:生理盐水,20%乌拉坦,1%利多卡因,125U/ml肝素,地塞米松,7.5%氯化钠,低分子右旋糖酐。
三、实验方法及现象1.打开电脑实验软件,调节仪器参数。
2.将血压换能器固定于铁架台,并连接生物信号采集处理系统。
3.从动物房取家兔一只,称重。
本实验家兔体重为1.982kg。
4.用20%乌拉坦对家兔于耳缘静脉注射麻醉。
观察动物结膜反射、瞳孔大小、呼吸心跳等。
5.将家兔固定于手术台,颈前正中切开皮肤6—8cm,用止血钳钝性分离组织及颈部肌肉。
暴露气管、颈总动脉、颈静脉和迷走神经。
过程中,有轻微出血,可用棉球擦净。
分离两侧颈总动脉、颈静脉,气管。
各穿一线备用。
6.腹侧剪毛,观察肠系膜血管。
做气管插管、颈动脉插管、静脉插管。
7.记录一段正常血压、呼吸心电图波动曲线。
从颈总动脉放血(约40ml),直至血压降低并维持在40mmHg,观察并记录上述指标的变化。
8.做血气检查。
9.抢救药品及顺序如下:药品剂量(ml)高渗液 6全血 15右旋糖酐 15地塞米松 1四、实验结果(一)血压分析图1,为实验过程中记录下来的所有血压变化图图1由图1,我们可以大体看出家兔血压变化。
给家兔放血后,家兔血压快速下降,在抢救前,家兔血压有一定代偿性升高。
注射高渗液后,家兔血压明显上升。
注入全血、右旋糖酐、地塞米松后,家兔血液维持在正常水平。
以上是从图中直接反应出来的,下面进行统计分析通道收缩压舒张压平均压脉压差心率号(mmHg) (mmHg) (mmHg) (mmHg) (次/分)正常114.25 86.82 98.63 27.42 321抽血后65.33 34.76 47.01 30.57 282高渗后102.02 71.61 83.09 30.41 236全血111.68 80.36 94.61 31.31 275 右旋糖酐109.53 78.07 91.84 31.46 282地塞米松114 80.12 95.74 31.88 290表1动脉血压图2由统计分析可以看出,家兔失血后,血压降低。
休克机能实验报告

休克机能实验报告休克机能实验报告休克是一种严重的病理状态,常常由于血液循环不足导致身体器官无法得到足够的氧气和营养物质。
休克机能实验是一种常用的实验方法,可以帮助我们了解休克的发生机制,以及如何对其进行有效的治疗。
实验目的:通过模拟休克状态,观察动物的生理变化,了解休克的机能改变,并探索适当的治疗方法。
实验材料:1. 实验动物:小鼠2. 实验仪器:休克模拟器、生理记录仪等实验步骤:1. 实验前准备:将实验动物随机分为实验组和对照组,确保两组动物的基础生理状况相似。
2. 休克模拟器设置:根据实验设计,将休克模拟器设置为适当的参数,模拟不同程度的休克状态。
3. 动物处理:将实验组动物置于休克模拟器中,对照组动物不进行任何处理。
4. 生理记录:使用生理记录仪监测实验动物的血压、心率、呼吸等生理指标,并记录下来。
5. 实验观察:观察实验动物的行为变化,如活动力、食欲等。
6. 实验结束:根据实验设计的时间,结束实验并对实验结果进行统计和分析。
实验结果:通过对实验组和对照组动物的比较,我们可以得出以下结论:1. 休克状态下,实验动物的血压明显下降,心率加快,呼吸变浅。
2. 实验动物的活动力明显减弱,食欲明显下降。
3. 实验组动物的生理指标明显异常,与对照组相比有明显差异。
实验讨论:通过这个实验,我们可以更深入地了解休克的机能改变。
休克状态下,由于血液循环不足,身体器官无法得到足够的氧气和营养物质,导致生理指标的异常。
血压下降是由于血液循环不畅,心脏无法将血液有效地输送到全身各个器官,心率加快是身体的一种代偿机制。
呼吸变浅是由于呼吸中枢受到抑制,导致呼吸频率和深度减少。
针对休克的治疗方法有很多种,如补液、输血、升压药物等。
在实验中,我们可以进一步探索不同治疗方法对实验动物的影响。
例如,我们可以给实验组动物进行补液治疗,观察其生理指标的变化。
通过实验结果的比较,可以评估不同治疗方法的有效性和安全性。
实验结论:通过休克机能实验,我们可以更加深入地了解休克的机能改变,并探索适当的治疗方法。
机能学实验报告(失血性休克)

\失血性休克的实验治疗一、实验目的1.观察家兔失血性休克对机体的机能变化及微循环变化2.探讨不同治疗方案对失血性休克的作用及机制二、实验原理1.失血性休克的原理:微循环障碍致微循环动脉血灌流不足,重要的生命器官因缺氧而发生功能和代谢障碍,是各型休克的共同规律。
休克时微循环的变化大致可分为以下三期,即微循环缺氧期、微循环淤血期和微循环凝血期。
(1)正常情况:①动静脉吻合支是关闭的②只有20%毛细血管轮流开放,有血液灌流③毛细血管开放与关闭受毛细血管前括约肌的收缩和舒张调节;(2)微循环缺氧期:①交感神经兴奋和肾上腺素、去甲肾上腺素分泌增多,小动脉,微动脉,后微动脉,毛细血管前括约肌收缩②动静脉吻合支开放③毛细血管血液灌流不足;(3)微循环淤血期①进入毛细血管的血液仍很少②毛细血管开放,血管床容积扩大,进入毛细血管内的血液流动很慢③毛细血管扩张淤血;(4)微循环凝血期①血管内淤血②广泛血栓形成。
2.阿拉明和多巴胺治疗失血性休克原理:阿拉明是α受体激动剂,具有明显的收缩血管作用。
小计量的多巴胺能够扩血管。
三、实验仪器设备大动物手术器械,输血输液装置,呼吸血压描记装置,气管插管,动脉插管,静脉插管,注射器若干,生理盐水,肝素,多巴胺及阿拉明。
四、实验方法与步骤1.动物称重与固定:将麻醉好的兔子称重后,仰卧位固定于动物手术台上。
2.备皮:剪去颈部、腹股沟手术部位的毛。
3.颈部手术:①行气管插管并连接呼吸换能器,记录呼吸;②行颈总动脉插管并连接压力换能器,记录动脉血压;③行颈外静脉插管并连接输液装置,输液用。
4.股部手术:于右侧腹股沟动脉搏动明显处沿动脉走向切开皮肤4—5cm,分离股动脉,夹上动脉夹。
5.观察与记录实验过程中动态观察记录的指标包括:一般情况,皮肤黏膜颜色、血压、心率和呼吸。
(1)放血前:手术完毕,观察与记录上述指标作为实验作为对照。
在颈静脉注射肝素,1ml/kg;(2)放血造成休克:①松开股动脉夹,用注射器抽血并观察血压变化,直至血压维持在平均45mmHg,并维持15min②测量放血量;(3)抢救:根据放血量取等量生理盐水注射,注射完后再注射生理盐水15ml+0.5ml/kg阿拉明,注射完后即为抢救即刻,记录上述指标。
实验报告休克怎么写

实验报告休克怎么写1. 引言休克是一种严重的生理反应,通常由于身体无法维持足够的血液循环而导致。
休克是一种紧急情况,在急救中的准确、迅速的诊断和处理非常重要。
本实验的目的是研究休克的发生机制和急救处理方法。
2. 实验目标- 了解休克的发生机制和主要类型。
- 掌握休克的诊断方法和急救处理流程。
- 分析休克的实验数据,评估不同处理方法的效果。
3. 实验方法3.1 实验材料- 实验组:动物模型(小鼠);- 对照组:正常小鼠。
3.2 实验步骤1. 采集实验组小鼠的基础生理参数,如体温、血压、心率等;2. 对实验组小鼠进行休克诱导,采用血容量减少、血流动力学改变等操作;3. 在休克诱导后,根据设计,分别施行不同的急救处理方法;4. 观察实验组小鼠的生理参数变化,并记录;5. 采集对照组小鼠的生理参数作为参考。
3.3 数据处理1. 比较实验组和对照组的基础生理参数,分析差异;2. 根据不同的处理方法,比较实验组小鼠的生理参数变化;3. 进行统计学分析,评估不同处理方法的效果。
4. 实验结果4.1 实验组与对照组的基础生理参数比较在休克诱导前,实验组小鼠的体温、血压、心率等生理参数与对照组没有明显差异(表格1)。
参数实验组对照组-体温() 37.1 37.2血压(mmHg) 120 121心率(次/min) 300 2984.2 实验组急救处理的效果评估根据实验设计,实施了三种不同的急救处理方法:输液复苏、药物治疗和血液替代。
4.2.1 输液复苏对实验组小鼠进行液体输注,观察其生理参数变化。
结果显示,输液复苏可显著提高实验组小鼠的血压和心率,但体温变化不明显(表格2)。
处理方法血压(mmHg) 心率(次/min) 体温()-输液复苏150 330 37.24.2.2 药物治疗对实验组小鼠进行药物治疗,观察其生理参数变化。
结果显示,药物治疗可显著提高实验组小鼠的心率和体温,但对血压的改善有限(表格3)。
处理方法血压(mmHg) 心率(次/min) 体温()药物治疗130 340 37.54.2.3 血液替代对实验组小鼠进行血液替代,观察其生理参数变化。
机能实验休克与抗休克
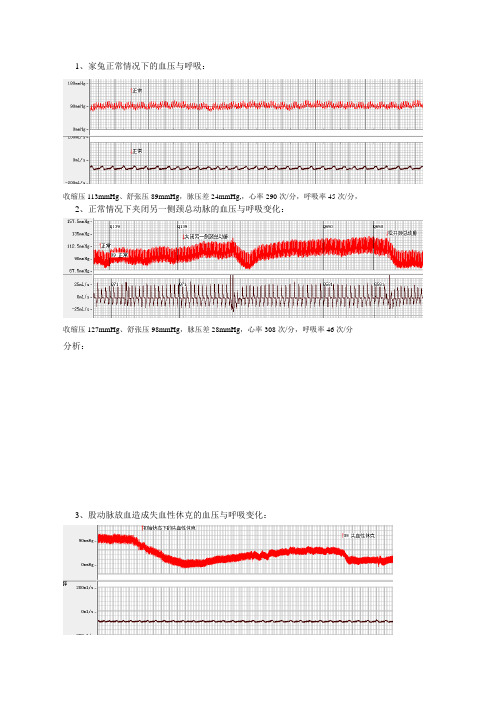
1、家兔正常情况下的血压与呼吸:
收缩压113mmHg、舒张压89mmHg,脉压差24mmHg,,心率290次/分,呼吸率45次/分,
2、正常情况下夹闭另一侧颈总动脉的血压与呼吸变化:
收缩压127mmHg、舒张压98mmHg,脉压差28mmHg,心率308次/分,呼吸率46次/分分析:
3、股动脉放血造成失血性休克的血压与呼吸变化:
收缩压40mmHg、舒张压16mmHg,脉压差24mmHg,心率231次/分,呼吸率53次/分分析:
4、失血性休克状态下夹闭另一侧颈总动脉的血压与呼吸变化:
收缩压42mmHg、舒张压14mmHg,脉压差28mmHg,心率217次/分,呼吸率74次/分分析:
5、回输50%血液后给予酚妥拉明试剂后的血压与呼吸变化:
输血给药前:收缩压43mmHg、舒张压15mmHg,脉压差28mmHg,心率217次/分,呼吸率74次/分输血给药后:收缩压82mmHg、舒张压44mmHg,脉压差28mmHg,心率236次/分,呼吸率86次/分分析:
6、抢救之后的血压与呼吸:
抢救后20min:收缩压82mmHg、舒张压50mmHg,脉压差32mmHg,心率240次/分,呼吸率82次/分分析:。
机能实验报告,休克

医科年夜学机能学实验陈述令狐采学实验日期:6月17日带教教师:小组成员:专业班级:预防医学一年夜班失血性休克的实验治疗(多巴胺组)Array一、实验目的1. 复制失血性休克的植物模型2. 观察失血性休克时和抢救过程中植物的功能代谢变更及微循环修改3.探讨不合治疗计划对失血性休克的作用及机制二、实验原理休克是多种原因引起的,包含年夜出血、创伤、中毒、烧伤、窒息、感染、过敏、心脏泵功能衰竭等,以机体微循环功能紊乱为主要特征,并可招致多器官功能衰竭等严重后果的全身性病理过程。
失血招致血容量减少,是休克罕见的病因。
休克的产生与否取决于失血量和失血速度,当血量锐减,如外伤引起的出血、消化性溃疡出血、食管曲张静脉破裂、妇产科疾病所引起的出血等,超出总血量的25%~30%,超出机体代偿的能力,即可引起心排血量和平均动脉压下降而产生休克。
根据失血性休克过程中微循环的修改,将休克分为三期:休克早期(休克代偿期或微循环缺血性缺氧期)、休克中期(可逆性失代偿期或微循环瘀血性缺氧期)、休克晚期(不成逆性失代偿期或微循环衰竭期)。
但依失血水平及速度的不合,各期继续时间、机体的功能代谢变更及临床表示均有所不合。
对失血性休克的治疗,首先强调的是止血和弥补血容量,以提高有效循环血量、心排血量,改良组织灌流;其次根据休克的不合成长阶段合理应用血管活性药物,改良微循环,需要是可予抗炎等治疗。
三、实验仪器设备兔手术台,生物信号收集处理系统,年夜植物手术器械,输血输液装置,呼吸血压描记装置,气管插管,静态脉插管,呼吸换能器,注射器(5ml,10ml,50ml),多巴胺,间羟胺,生理盐水,肝素钠注射液溶液呼吸换能器四、实验办法与步调(1)麻醉称重:家兔称重后自耳缘静脉缓慢注射25%乌拉坦溶液麻醉(4ml/kg)。
(2)气管插管:沿颈部正中线作一长5—7厘米的皮肤切口,用止血钳由颈部正中线将肌肉结缔组织别离,流露出气管。
在气管下方用镊子穿一线,在甲状软骨下12厘米处的气管上作一倒T形切口,将气管插管朝心脏标的目的拔出气管,用线结扎,并将过剩的线系在气管插管的分叉处固定,以免滑脱。
休克实验报告

家兔失血性休克及其抢救实验人员5人第2组班一、实验目的1. 复制家兔失血性休克模型,观察少量失血和大量失血对家兔动脉血压、心率、皮肤和粘膜颜色的影响。
探讨其发生机制。
2. 用颈外静脉输血和输液的方法抢救失血性休克,观察抢救过程中家兔动脉血压、心率、皮肤和粘膜颜色的变化。
二、实验材料和方法实验器械:兔手术台,常规手术器械,注射器,动脉夹,动脉插管,电刺激连线,血压换能器,三通管,铁架台,棉线,纱布实验仪器:电脑,RM6240生物信号采集系统实验药品:20%氨基甲酸乙酯,肝素,生理盐水0.1ml/10g三、实验对象家兔1只由浙江中医药大学动物实验中心提供四、实验步骤1、仪器调试:首先打开电脑,选择MedLab生物信号处理系统;从第1、2、3通道中选择1个通道,记录动脉血压(记录平均动脉血压、收缩压、舒张压和脉压)。
其次将血压换能器连接线与相应的通道相连,检查换能器是否正常,加肝素溶液排除空泡,先清零,血压0mmH2、家兔称重、麻醉和固定取家兔一只,称重:2.8Kg ,用20%氨基甲酸乙酯以5ml /Kg(体重), 耳缘静脉缓慢注射麻醉, 共注射14ml, 至呼吸深而慢、反射迟钝(角膜反射、夹肢反射)为止。
把兔子以背位固定法固定。
3、麻醉起效后手术颈部手术——左颈总动脉、右颈外静脉、右颈总动脉插管(1)颈部备皮,作颈部,正中3~5cm切口,左右颈总动脉分离,穿线标记,备用。
(2)左颈总动脉插管术---测血压动脉插管及换能器肝素化,左颈总动脉远心端结扎,近心端动脉夹夹闭,动脉前壁倒“V”切口动脉插管插入,结扎固定。
放开动脉夹记录正常动脉血压(平均血压、脉压差、心率)。
(3)右颈外静脉插管术—输血输液排掉输液管中的空气。
右颈静脉近心端动脉夹夹闭,远心端结扎,静脉前壁倒“V”切口,输液管插入,固定。
缓慢输液,保持通畅。
(4). 右颈总动脉插管术——失血造模用肝素抗凝剂排掉50ml注射器(其中保留少许肝素液)和动脉插管中空气,右颈总动脉远心端结扎,近心端动脉夹夹闭,动脉前壁倒“V”切口动脉插管插入,结扎固定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作者:旧在几作品编号:2254487796631145587263GF24000022时间:2020.12.13医科大学机能学实验报告实验日期:2015年6月17日带教教师:小组成员:专业班级:预防医学一大班失血性休克的实验治疗(多巴胺组)一、实验目的1. 复制失血性休克的动物模型2. 观察失血性休克时和抢救过程中动物的功能代谢变化及微循环改变3.探讨不同治疗方案对失血性休克的作用及机制二、实验原理休克是多种原因引起的,包括大出血、创伤、中毒、烧伤、窒息、感染、过敏、心脏泵功能衰竭等,以机体微循环功能紊乱为主要特征,并可导致多器官功能衰竭等严重后果的全身性病理过程。
失血导致血容量减少,是休克常见的病因。
休克的发生与否取决于失血量和失血速度,当血量锐减,如外伤引起的出血、消化性溃疡出血、食管曲张静脉破裂、妇产科疾病所引起的出血等,超过总血量的25%~30%,超出机体代偿的能力,即可引起心排血量和平均动脉压下降而发生休克。
根据失血性休克过程中微循环的改变,将休克分为三期:休克早期(休克代偿期或微循环缺血性缺氧期)、休克中期(可逆性失代偿期或微循环瘀血性缺氧期)、休克晚期(不可逆性失代偿期或微循环衰竭期)。
但依失血程度及速度的不同,各期持续时间、机体的功能代谢变化及临床表现均有所不同。
对失血性休克的治疗,首先强调的是止血和补充血容量,以提高有效循环血量、心排血量,改善组织灌流;其次根据休克的不同发展阶段合理应用血管活性药物,改善微循环,必要是可予抗炎等治疗。
三、实验仪器设备兔手术台,生物信号采集处理系统,大动物手术器械,输血输液装置,呼吸血压描记装置,气管插管,动静脉插管,呼吸换能器,注射器(5ml,10ml,50ml),多巴胺,间羟胺,生理盐水,肝素钠注射液溶液呼吸换能器四、实验方法与步骤(1)麻醉称重:家兔称重后自耳缘静脉缓慢注射25%乌拉坦溶液麻醉(4ml/kg)。
(2)气管插管:沿颈部正中线作一长5—7厘米的皮肤切口,用止血钳由颈部正中线将肌肉结缔组织分离,暴露出气管。
在气管下方用镊子穿一线,在甲状软骨下1-2厘米处的气管上作一倒T形切口,将气管插管朝心脏方向插入气管,用线结扎,并将多余的线系在气管插管的分叉处固定,以免滑脱。
(3)颈总动脉插管:颈总动脉插管的目的在于监测血压。
先将已分离的颈总动脉远心段用线结扎,再用动脉夹夹住近心端。
于两者之间另穿一线备用。
在两线之间靠近心端上1/3处,用眼科剪在动脉上作一斜形切口,向心脏方向插入动脉插管,用备用线将插管尖端固定于动脉管内,并结扎固定以防插管脱落。
注意插管与血管方向一致,防止扭转或插管尖端刺破动脉管壁。
(4)颈静脉插管:方法与颈总动脉插管类似,先用动脉夹阻断近心端,再结扎远心端,在靠近远心端剪一个“V”形缺口。
目的在于后面抢救时需从颈静脉给药。
(5)耳缘静脉注射肝素:剂量1ml/kg,目的是为了抗凝。
(6)股动脉插管:股动脉插管的目的在于放血、复制休克的动物模型。
右侧股三角区剪毛,在触及股动脉搏动处沿动脉走向做长约3cm的切口;游离股动脉,经动脉插入导管(插管前管内充满肝素钠溶液),将血管导管连接到三通管上以备作取血用。
(7)观察动物复制休克模型前动物的各项生理指标:包括一般情况,皮肤黏膜颜色、血压、心率和呼吸。
(8)复制休克的动物模型:于复制动物模型前先确认拟给药的静脉通路是否畅通。
打开股动脉插管与注射器相连的侧管,使血液从股动脉流入注射器内,一直放血到平均动脉压为45mmHg时,调节注射器内放出的血量及速度,是血压稳定在低水平(MAP为45mmHg)。
停止放血,如果血压回升,就再放血;血压到达45mmHg时开始计时,使血压恒定维持在45mmHg左右15min。
(9)观察休克时机体各生理指标的变化:血压恒定维持在45mmHg左右15min后,观察失血期间动物各项生理指标以及动物的肠系膜微循环的变化。
(10)抢救:血压维持的时间到15min后,停止放血。
首先将与失血量相等量的生理盐水倒入输液瓶中,快速经静脉回输,再输入含有多巴胺(0.2mg/kg)的生理盐水15ml,滴速:90-120滴/min。
于所有抢救用生理盐水和药物输入完毕后,即刻、15min和30min分别记录各项指标。
30min后复查动物一般情况以及各项生理指标是否恢复正常。
五、实验结果(电子版实验结果粘贴)家兔失血性休克对机体的影响组别MAP脉压差HR(次/分)R(次/分、深度)皮肤粘膜颜色休克前98 20 254 66 0.49 粉红色休克46. 11 252 70 0.18 苍白治疗组(即刻) A组9944.539.2242.3181.17205.0175.76、0.2563.31、0.65青紫青紫D组治疗组(15min) A组D组9676.83827.63180211.0167 、0.2569.77 、0.99青紫发绀青紫发绀治疗组(30min) A组D组6787.14428.11180211.2875.11 、0.3356.22 、0.86粉红色六、分析与讨论1、家兔失血性休克时机体各器官系统变化的机制?答:家兔失血性休克时主要涉及到循环系统、呼吸系统和皮肤黏膜颜色的变化。
(1)循环系统的变化:①平均动脉压的变化(98mmHg→46mmHg):从正常情况转变到休克状态,平均动脉压降低。
机制如下:机体从正常状态转变为休克状态,回心血量减少,心排出量减少,每搏输出量降低,导致平均动脉压降低;②脉压差下降(20mmHg→11mmHg ):机体从正常状态转变为休克状态,回心血量减少,心排出量减少,每搏输出量降低,收缩压下降,舒张压变化不明显,而脉压差=收缩压-舒张压,进而导致脉压差下降;③心率加快(254次∕分→252次∕分):机体从正常状态转变为休克状态,心脏尚有足够的血液供应,在回心血量增加的基础上,交感神经兴奋和儿茶酚胺的增多可使心率加快;由于心率变化为先快后慢,实验中测得心率为252次∕分。
(2)呼吸系统的变化:机体从正常状态转变为休克状态,呼吸频率加快(66次∕分→70次∕分),呼吸深度变浅(0.49mV→0.18mV)。
机制如下:①休克早期,由于失血,刺激交感神经释放去甲肾上腺素,肺部微循环微动脉、后微动脉和毛细血管前括约肌收缩比微静脉强度更大,使肺毛细血管处于“少灌多流”状态,使得血液与肺泡氧交换不充分,血氧分压降低,二氧化碳潴留,刺激外周化学感受器,使呼吸加深加快,呼吸深度变浅。
②大量失血,交感神经兴奋,毛细血管收缩,外周组织缺血缺氧,毛细血管内气体交换加强,血氧分压降低,使颈动脉体缺氧性兴奋,呼吸频率加快,呼吸深度变浅。
大量失血后,肺动脉压降低,通气血流比值降低,肺泡无效腔增大,使肺代偿性通气减弱。
综合考虑:大量失血时,神经—体液调节较为敏感,主要是交感神经起作用,引起呼吸的加深加快。
(3)皮肤、黏膜颜色变化:皮肤黏膜由粉红色变为苍白色。
原因如下:由于交感肾上腺髓质系统兴奋,外周血管收缩,作用于汗腺,汗腺分泌增多,导致皮肤灌流减少,皮肤变为苍白色。
2、抢救后家兔机体各器官系统变化的机制?(1)循环系统的变化:①平均动脉压的变化(46mmHg→87.1mmHg):平均动脉压升高。
机制如下:抢救后,交感肾上腺髓质系统兴奋性下降,回心血量增多,心排出量增加,每搏输出量增加,导致平均动脉压升高;②脉压差增高(11mmHg→28.11mmHg):抢救后,回心血量增加,心排出量增加,每搏输出量增加,收缩压升高,舒张压变化不明显,而脉压差=收缩压-舒张压,进而导致脉压差升高;③心率减慢(252次∕分→211.28次∕分):抢救后,交感肾上腺髓质系统兴奋性下降,儿茶酚胺的分泌减少,可使心率减慢;(2)呼吸系统的变化:抢救后,呼吸频率减慢(70次∕分→56.22次∕分),呼吸深度变深(0.18mV→0.86mV)。
机制如下:①交感神经释放去甲肾上腺素减少,肺部微循环微动脉、后微动脉和毛细血管前括约肌收缩比微静脉强度小,使得血液与肺泡氧交换频繁,血氧分压升高,刺激外周化学感受器减弱,使呼吸频率减慢,呼吸深度变深。
②交感神经兴奋性降低,毛细血管扩张,毛细血管内气体交换减慢,血氧分压升高,使颈动脉体缺氧性兴奋降低,呼吸频率减慢,呼吸深度变深。
(3)皮肤、黏膜颜色变化:抢救后,皮肤黏膜由苍白色变为青紫色、发绀。
原因如下:抢救后,交感肾上腺髓质兴奋性降低,外周血管扩张,外周循环血液流速缓慢,流经毛细血管时间延长,淤滞,使毛细血管内血液与组织气体交换减慢,血液含氧降低,还原血红蛋白增多,皮肤变为青紫色,甚至会出现发绀的现象。
治疗30分钟后,皮肤粘膜渐渐开始恢复为正常,粉红色。
3、比较多巴胺与阿拉明的抢救效果,并分析其原因?答:多巴胺和阿拉明对失血性休克都有不错的抢救效果,根据心电图的分析可以看出阿拉明在抢救后,血压快速升高后迅速降低,多巴胺在抢救时,虽然血压升高不如阿拉明抢救明显,但是药效后血压下降将较慢,所以多巴胺的抢救效果更加明显,两种药物均属于神经递质类药物,根据两种药物作用的受体类型、受体作用部位和受体分布的不同导致效果不同,具体分析如下:(1)多巴胺作用于D1-R、β1—R、α—R受体,主要作用于D1-R受体,该受体主要分布于肾血管上,使得尿量增加,作用于冠状动脉,使得冠状动脉扩张,增加血流量;作用于β1—R受体,该受体主要分布器官是心,使得心肌收缩力增加,心率加快,作用于α—R受体,该受体分布于血管平滑肌上,使得血管平滑肌收缩血压升高。
(2)阿拉明作用于β1—R、α—R受体,主要作用于α—R受体,使得血管收缩、外周阻力升高,使得血压升高,作用于β1—R受体,使得儿茶酚胺分泌增多,收缩血管升高血压,但是其作用一般较弱。
综上所述,多巴胺的抢救效果更加明显。
七、结论1. 家兔快速(15min)大量失血超过机体总血量的25%~30%后,可造成失血性休克,但通过代偿反应可以在短时间内使血压适当回升。
2.休克是一种非常严重的病理过程,对机体循环系统、呼吸系统等多种系统有严重影响,易导致机体死亡。
3.阿拉明和多巴胺都可治疗休克,但多巴胺的治疗效果更佳。
作者:旧在几作品编号:2254487796631145587263GF24000022时间:2020.12.13。
