第十三章 取代羧酸
第十三章 取代羧酸

B. Hell-Volhard-Zelinsky反应
RCH2COOH + Br2
PBr3 -HBr
RCHCOOH Br
13-4
卤代酸
羧酸碳链上的氢被卤素原子取代得到的取代酸 卤代酸的合成
CH3-CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -COOH e b a
4-甲基-5-羰基己酸
13-3
卤代酸
羧酸碳链或碳环上的氢被卤素原子取代得到的取代酸 卤代酸的合成
CH3-CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -COOH e b a
1 a-卤代酸的合成 A . 羧酸直接卤化
CH3CH2COOH
Br2
CH3CHCOOH Br
+ [(CH3)2CH]2NLi 二异丙基氨锂 (LDA)
O (CH3)2CCH2COEt OLi 烯醇盐
CH2
C
OLi OEt
Байду номын сангаас
烯醇盐
H2O
OH
O
(CH3)2CCH2COEt
3-羟基-3-甲基丁酸乙酯
13-18
羟基酸的合成
3 -羟基酸的合成——内酯的水解
O CH3 O CF3COOH O O CH3 (1) NaOH , C2H5OH (2) H3O 2 -甲基环己酮 OH 6 -羟基庚酸 O CH3CH(CH2)4COH
(CH2)10
O
85% 大环内酯 在极稀的溶液中进行
13-10
卤代酸的化学性质
II.Reformatsky反应——制备β-羟基酸酯 a-卤代酸酯和锌在无水的惰性有机溶剂 (乙醚或芳烃等) 中 形成类似于格氏试剂的有机锌化合物(锌试剂),但是其稳定 性稍好一些,可以保留酯中的羰基不受破坏。与羰基化合物 ( 醛、酮、酯) 反应,得到b-羟基酸酯 (与醛、酮反应) 或b-酮 酸酯 (与酯反应),
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
《羧酸及取代羧酸》课件

取代羧酸可通过取代基的亲核作用与其他分子发 生反应。
Hale Waihona Puke 羧酸的脱羧反应羧酸可脱去羧基,生成相应的 醛或酮化合物。
羧酸的应用
1 食品工业
羧酸可用作食品酸味剂和抗氧化剂。
2 药物工业
羧酸是制备药物的重要原料,可调控药物的性质和稳定性。
3 洗涤品工业
羧酸可用作洗涤剂的表面活性剂,改善洗涤效果。
什么是取代羧酸?
取代羧酸是指羧酸分子中的一个或多个氢被其他原子或基团取代的化合物,具有类似羧酸的化学性质,但性质 和用途也有所不同。
不同的取代基赋予取代羧酸不同的功能,影响其在化学和生物领域的应用。
取代羧酸的物性质
溶解性
取代羧酸的溶解性依赖于取 代基的性质和溶剂的性质。
熔点和沸点
取代羧酸的熔点和沸点受取 代基和羧酸的影响。
分子构型
取代羧酸的立体构型由取代 基的空间位阻决定。
取代羧酸的化学性质
酸性 还原性
亲核性
取代羧酸可通过脱质子反应表现出酸的性质。
羧酸的物理性质
• 羧酸通常呈液体或固体,具有特定的熔点和沸点。 • 具有酸性,可以与碱发生中和反应。 • 一些羧酸具有特殊的气味,例如柠檬酸和醋酸。
羧酸的化学性质
羧酸的酯化反应
羧酸与醇反应生成酯,常用于 有机合成和食品调味中。
羧酸的酰氯化反应
羧酸与酰氯反应生成酰氯,用 作有机合成中的重要中间体。
取代羧酸的命名方式
取代羧酸的命名方式与羧酸类似,根据取代基的种类和位置进行命名。例如,“氨基乙酸”代表乙酸的一个氨基 取代物。
取代羧酸的化学特性
1
取代基的电子效应
有机化学第十三章 取代羧酸

稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
-OH、-COOH均可形成氢键。 二、 物理性质 1、 比羧酸更易溶于水
2 、 熔点比羧酸高 三 、化学性质
1、 酸性: -OH吸电子,酸性增强,且-位大于-位
CH3-CH2-COOH Ka=1.34×10-5
CH2 CH2 COOH Ka=3.10×10-5 OH
CH3 CH OH COOH Ka=1.38×10-4
HO
HO
COOCH 3
尼泊金M
COOC 2H5 尼泊金A
HO
COOC 3H7
尼泊索 Nipasol
COOH
没食子酸
HO
OH
OH 没食子酸又名五倍子酸,3,4,5-三羟基苯甲酸,无色结晶, 以游离形式存在于茶叶中,以鞣质(丹宁)存在于五倍子等 植物中。是自然界中广泛存在的一种有机酸。
没食子酸用途:照像中用作显影剂,遇三氯化铁显蓝 黑色,作蓝黑墨水。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( ―醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
第13章-取代羧酸

生物体内,丙酮酸在缺氧时,在酶的作用下发生脱羧反应生成乙
醛,然后加氢还原为乙醇。水果开始腐烂或饲料开始发酵时,常有酒
味,就是由此引起的。
稀 H2SO4 CH3COCOOH
CH3CHO + CO2
微热 CH3COCH2COOH
CH3COCH3 + CO2
酮和羧酸不易被氧化,但丙酮酸在脱羧的同时可被弱氧化剂如两 价铁与过氧化氢氧化,生成二氧化碳和乙酸。
3. 脱水反应 (1) a-羟基酸在酸存在下加热脱水形成交酯
(2) b-羟基酸在酸存在下加热脱水形成a,b -不饱和酸
(3) g-羟基酸在室温下会自动脱水形成 五元环内酯
g-丁内酯
(4) d-羟基酸须在加热下脱水形成六元环内酯
△ d-戊内酯
(5) w-羟基酸:(C > 9)在极稀溶液内,可形成大环内酯
• 等电点时氨基酸溶解度 最小,易结晶析出。
中性氨基酸:pI < 7 (5.0 ~ 6.3) 酸性氨基酸:pI ≈ (2.8 ~ 3.2) 碱性氨基酸:pI > 7 (7.6 ~ 10.8)
当pH >pI 时,氨基酸带负电,在电场中向正极移动。 当pH<pI 时,氨基酸带正电,在电场中向负极移动。 当pH=pI 时,氨基酸呈电中性,在电场中不移动;等电点时,氨基酸 的溶解度最小,易结晶出来,可用此性质分离提纯氨基酸。
R CH COO NH3
(内盐,zwitterion)
氨基酸在固态时主要以内盐(偶极离子)形式存在
➢ 水溶液中为两性离解
R CH COOH
NH3 (I) 正离子
+
OH
H2O R CH COO
NH3 两性离子 内盐 (偶 极 离子)
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
取代羧酸

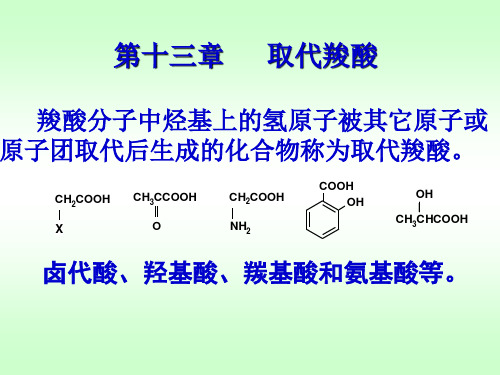
第十三章 取代羧酸碳链或碳环上的氢被其他原子或基团取代所生成的化合物,称为取代羧酸。
常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等,它们无论在有机合成或生物代谢中,都是十分重要的。
第一节 羟基酸的分类、命名和来源定义:分子中同时含有羟基和羧基得化合物叫做羟基酸。
一、 分类羟基酸可以分为醇酸和酚酸两类,羟基连接在碳链上的叫做醇酸;羟基连接在芳环上的叫做酚酸。
二、 命名羟基酸的命名常根据它的来源而采用俗名,也可以把它们看成是羧酸的羟基取代物来命名。
根据分子中羟基和羰基的相对位置,有α、β、γ……等羟基酸,或按系统命名编号,羧基碳原子编号为1,选择含羟基和羧基的最长碳链为主链。
如:COOH CH 2CH COOHCOOH CH CH COOHOH OH OH CH 3CH OHCOOHCOOHOH2-羟基丙酸(乳酸)羟基丁二酸(苹果酸)2,3-二羟基丁二酸 (洒石酸)2,3-二羟基丁二酸 (洒石酸)三、 来源羟基酸有的可用生物化学法制备,如乳酸。
化学合成法可从含羟基的化合物中引入羧基或含羧基的化合物中引入含羟基,或同时引入羟基或羧基。
1、卤代酸水解:ClCH 2COOHH 2OHOCH 2CH 2COOHH +2、氰醇水解:HOCH 2CH 2ClNaCNHOCH 2CH 2HOCH 2CH 2COOH3、Reformatsky 反应:R CHO +BrCH 2COOC 2H Zn R CHCH 2COOC 2H 5R CHCH 2COOC 2H 5OHR CHCH 2COOH OHH 2O H +4、LDA 法:CH 3C O H 2OH+LDA COOC 2H 5C OCOOC 2H 53)2C C OCOOC 2H 5(CH 3)2C第二节 羟基酸的性质羟基分子中含有羟基和羧基,两者都能和水形成氢键,所以羟基酸一般比相应的酸易溶于水。
羟基酸具有醇与酸的典型反应性能,并且由于羟基和羧基的相互影响,又表现出一些为羟基酸特有的性质。
有机化学:13 取代羧酸

2. 乙酰乙酸乙酯的互变异构
两种或以上异构体互相转变,并以动态平衡而 存在——互变异构现象(tautomerism)
O O CH3 C H 7% O CH C OC2H5
CH3CCH2COOC2H5 93%
O
COOH O OH
γ -丁内酯(1,4-丁内酯)
38
+ H2O
3.脱水反应
γ -,δ -醇酸:分子内脱水 内酯
O COOH OH O + H2O
Δ
δ -戊内酯(1,5-戊内酯)
39
3.脱水反应
γ-内酯是稳定的中性化合物 与热碱溶液作用能水解
O COONa O NaOH / H2O OH
COOH
45
(一)制备
其他酚酸:
OH +CO 2 OH NaHCO 3 OH COOH OH
46
(二)性 质
OH COOH OH 200~220℃ OH
酚酸为结晶固体,具 有酚和芳酸的性质 羧基处于羟基邻对位 时,受热易脱酸:
COOH 200℃ HO OH OH
COOH
+CO 2 HO OH
56
(二)乙酰乙酸乙酯的酸性和互变异 构
α-H的活泼性 思考:
O O CCH3
CH3C CH2
的酸性大小?
O C2H5OC CH2
O COC2H5
57
2. 乙酰乙酸乙酯的互变异构
O O CH3 C CH2 C OC 2H5
+2,4-二硝基苯肼橙色苯腙 ——羰基 +Br2-CCl4 褪色 ——不饱和键 +Na H2 ↑ ——活泼氢 +CH3COCl 酯 ——醇羟基 +FeCl3水溶液 紫红色——烯醇式结构
第十三章羧酸及取代羧酸

CH2COOH
CH2COOH
O C OH C OH O
△
H2O
△
=
O=
O + CO2
O
O C CO O
CH2COOH O O
CH3COCCH3
COOH
△
O O O
上页
下页
回主目录
返回
羧酸
CH2COOH △
CO=arboxylic Acid
O + CO2
=
C1H,26C-O、OH1,7-二元羧酸O则脱羧兼脱水生成酮
上页
下页
回主目录
返回
羧 酸 Carboxylic Acid
6 5 43 2 1
BrCH2CH=CCH2CH2COOH 4-乙基-6-溴-4-己烯酸
CH2CH3
2
1 COOH
2-环己烯基甲酸
2 OH 1 COOH
5
O2N
5-硝基-2-羟基苯甲酸
上页
下页
回主目录
返回
羧 酸 Carboxylic Acid
多元酸
(HOOC)2CH CH(COOH)2
2,3-二羧基-1,4-丁二酸
上页
下页
回主目录
返回
羧 酸 Carboxylic Acid
13.1.1.2 命名
1.俗名:由来源命名 如:蚁酸,醋酸,软脂酸,硬脂酸。 2.系统命名法: A.选择含有羧基的最长碳链为主链,按
主链碳原子数称为某酸 B.编号从羧基碳开始
13.1.2 羧酸的重要化学性质
O RC
OH
sp2 R
O C
OH
O
R R C C pO-π共轭 O OHH
暨南大学生物化学第十三章·取 代 羧 酸

OH CH
酒石酸
柠檬酸
羟基酸
二、羟基酸的反应:具有醇和酸的一般性质,有互相影响 1、酸性: CH3CH2COOH HOCH2CH2COOH CH3CH(OH)COOH pKa: 4.88
COOH OH pKa 3.00 4.12
4.51
COOH OH OH 4.54
3.86
COOH COOH
4.17
C 6H 5C H O N aC N N aH C O 3
H2O
HOCபைடு நூலகம்2COONa
C 6H 5
CH OH
C 6H 5 CN 50-52%
HCl
CH OH
COOH
3、reformatsky反应:
BrCH2COOC2H5 Zn BrZnCH2COOC2H5 RCHO OH RCHCH2COOC2H5
羟基酸的制备:
4、由Kolbe——Schmidt反应制酚酸:
ONa
CO2 180-200。C
ONa COONa
OH
COOH OH
CO2 NaHCO3
OH
煮沸
OH
羰基酸
α,β—羰酸不稳定:
CH3 O C CH2 COOH CO2 酯化 O C CH3 O C CH3
CH3
CH2 COOC2H5
羰基酸的制备: 羰基酸的制备:
O RX(卤代烃) O XCH2 C O XCH2 C O X C R OR' CH3 R CH3 CH3 C
R CH2 (甲基酮) O C O C O O CH2 CH2 C O CH2 CH2 C O CH2 C R ( β --二酮) O OR' R (γ --二酮)
O
(中国药科大学有机化学课件)取代羧酸

R C O+BrZnCH2COOR
(R')H
R O ZnBr
R O H
C
H3O +
C
(R')H CH2CO O R (R')H CH2CO O R
比较容易出错的是把起始的卤代物在哪一头记混, 需要特别注意下,卤素在酯上。
三 酚酸
水杨酸
COOH OH
四 氨基酸
氨基酸蛋白质内容一章不单独讲,要求的内 容全部合并到本章。
L-Phenylalanine
取代羧酸
Substituted Carboxylic Acids
1
氨基酸 OI HO COOH HOC OHC3羰CC N基CH HCO22酸COOOOHOOHHH
卤代酸
羟基酸
酚酸
命名
C l
5-氯戊酸
C O O H
ω -氯戊酸 (ω -末位)
OH
COOH 2-羟基环己烷羧酸
氨基酸分为酸性氨基酸,中性氨基酸和碱性 氨基酸。这种分类是根据氨基酸中酸碱基团 的数目来划分的。
HOOCCH2CHCOOH
NH2 天冬氨酸
H2N(CH2)4CHCOOH NH2
赖氨酸
不同的氨基酸等电点不同:
酸性氨基酸,PI:2.7~3.2 < 7 其水溶液呈酸性
碱性氨基酸,PI:9.5~10.7 > 7 其水溶液呈碱性
α C O O H
用于制备 NH3
O H
C O O H NH2
COOH
β-卤代酸
β
O H -
R C H C H 2C O O H
B r
γ, δ -卤代酸
Cl
COOH O OHH--
有机化学讲义--第十三章羧酸和取代羧酸

羧酸和取代羧酸
羧酸(carboxylic acids):分子中含有羧基 (carboxyl)(-COOH)的有机化合物。羧酸 的官能团是羧基,除甲酸( HCOOH)外,都 可以看作烃中的氢被羧基取代的烃衍生物。
取代羧酸(substituted carboxylic acids): 羧酸分子中的烃基上的氢被其他原子或原子 团取代后的化合物。
一、分类和命名
羧酸是由烃基和羧基两部分构成。
1 、按照与羧基相连的烃基不同:脂肪酸、脂环酸和 芳香酸
2 、按照羧基数目不同:一元酸、二元酸和多元酸
3 、按照烃基饱和程度不同:饱和酸和不饱和酸;不 饱和酸又可分为烯酸和炔酸。 4 、取代羧酸包括卤代酸、羟基酸、氧代酸(羰基酸) 和氨基酸等。各类取代羧酸又可根据取代基和羧基的 相对位置,分为α-,β-,γ-,δ-等取代羧酸。
多官能团化合物的优先次序为: (优先,作母体)羧酸 > 磺酸 > 酸酐 > 酯 > 酰卤 > 酰胺 > 腈 > 醛>酮>醇>酚>胺>醚>烃 (后者作取代基)。
二、羧酸的制备
1、醇、醛的氧化:KMnO4, CrO3, 子中其他不饱和键没有影响) Ag2O(用于醛且对分
( O ) R C H O H R C O O H 2 ( O ) R C H O R C O O H
+ ( O H )
O R C O H+H L
H R C N R C O O H H O 2
三、物理性质
溶解性:丁酸以下与水混溶,5-11碳部分溶解;羧酸盐 溶解性好(表面活性剂)。 熔点呈锯齿状上升,偶数碳原子的熔点比它前后相邻两 个奇数碳原子同系物的熔点高,
第十三章羧酸(不饱和,取代羧酸)

H O
O H
O
3-hydroxypentanoic acid
H 3C
2、醇酸的性质 the properties of hydroycarboxylic acid • 每一类醇酸都有自己特殊的化学性质。 • 1)醇酸的酸性:羟基吸电子,酸性较对应羧 酸酸性强。随羟基与羧基距离增加迅速减弱。 • 醇酸的酸性变化规律如下:
5)氟代乙酸的性质 the properties of fluoroacetic acid
• 氟乙酸钠或其酰胺做杀鼠剂有剧毒(现已禁止)。 • 三氟乙酸可以与水、全氟代烃和多数有机溶剂混 容,可以溶解蛋白质、聚酯树脂。 • 它由乙酰氯、氟化钠、氟化氢电解产生三氟乙酰 氯再水解而得。 • 三氟乙酸稳定,四氢铝锂只还原羧基成醛基与羟 基,不还原三氟乙基。 • 三氟乙酸可以用作合成甾体化合物的催化剂。
H C 2 CH 2 COOH H N CH 2 CH 2 COOH CH 2
CH 2 COOH COOH CH 2 CH
N
2 COOH
CH 2 CH 2 COOH CH 2
• 2-丁烯酸与下列试剂反应得到什么产物?
HOOC
HBr CH
3
HOOC
HCN CH
3
HOOC
H 3O CH
3
+
COOH
HOOC
Br CH3
OH
O
AgO H 2O
O
CH3
O CH3
δ-hexanoic lactone
ε-庚内酯 ε-heptanoic lactone
O O AgO H 2O OH
Br
卤代酸性质歌诀 the song of chemical properties of halocarboxylic acid • • • • 烃基带卤属羧酸,取代消除都一般。 羟酸氰酸氨基酸,选择试剂来转变。 2,3-卤代醇强碱,消除生成共轭酸。 4-位、5-位卤原子,碱热生成环生内酯。
有机化学之取代羧酸

系统命名法:选择含有羧基和羟基的最长碳链为主链,编号 从距离羟基最近的羧基开始。
一般以希腊字母α,β,γ,δ表明羟基的位置。
一个无分支的直链直接与两个以上羧基相连,则以直接连 接羧基最多的链烃名称加后缀“某羧酸”来命名。
OH
水杨酸:
OCOCH3 COOH
乙酰水杨酸 (阿司匹林)
COOCH3
水杨酸甲酯:
COOH
五倍子酸:
HO OH OH
无色结晶,常以鞣质的形式存在
3 羰基酸: 命名
⒈分子中同时含有羰基和羧基的化合物 ⒉包含醛酸和酮酸
取含羰基和羧基的最长碳链,叫某醛酸或某酮酸
命名羰基酸时,须注明羰基的位置,用氧代或羰基表示酮 基,醛基以甲酰基表示 O O
影响的特性反应。
1、酸性:比相应的羧酸强: 羟基的吸电子诱导效应 2、-羟基酸的氧化
CH3 CH OH
乳酸 丙酮酸
O
氧化
COOH
CH3
土伦试剂
CH
COOH
3、-羟基酸的分解反应
R CH OH COOH 稀硫酸 RCHO
+
HCOOH
4、失水反应
-羟基酸 受热发生分子间失水生成交酯。
H3C CH C O OH OH HO + C CH OH CH3 O H3C O O O O
CH3
CH OH
COOH
HO CH CH2
COOH COOH
乳酸 (2-羟基丙酸或α羟基丙酸)
苹果酸 (羟基丁二酸)
羧酸及其衍生物和取代羧酸

第13章 羧酸及其衍生物和取代羧酸一、学习基本要求·掌握羧酸及其衍生物、取代羧酸的分类和命名。
·了解羧酸及其衍生物的结构特点,熟悉结构对羧酸及其衍生物的物理性质影响;掌握羧酸及其衍生物的化学性质。
·了解取代酸的结构特点,熟悉取代酸化学性质。
二、重点和难点·重点:羧酸及其衍生物的重要性质,如酯缩合反应、Hoffmann 降解反应等。
·难点:结构对羧酸及其衍生物性质的影响,以及各类羧酸酸性强弱的比较。
13.1 羧酸(一)基本概念1.羧酸:羧基与烃基或氢原子连接而成的化合物叫做羧酸。
2. 酰基:羧酸分子中去掉羟基留下的部分称为酰基,羧酸中羧基去掉氢留下的部分称为酰氧基,羧酸电离出氢离子留下的部分称为羧酸根。
(二)基本知识1、羧酸的结构羧基是羧酸的官能团,一元羧酸的通式为R -COOH 。
羧基中的碳原子是sp 2杂化,羧基中羟基氧原子上的未共用电子对与羰基的π键形成 p-π共轭体系。
羧基不是羰基和羟基的简单加合,所以羧基中不存在典型的羰基和羟基的性质,而是两者互相影响的统一体。
羧酸分子间可以形成氢键,缔合成较稳定的二聚体和多聚体,羧酸的沸点比分子量相近的醇还高。
2、羧酸的命名羧酸的系统命名与醛的命名相似,选择包括羧基碳原子在内的最长碳链为主链,根据主链碳原子数目称为某酸,由羧基碳原子开始给主链编号,或用希腊字母α、β等从与羧基相邻碳原子开始编号。
二元脂肪酸的命名,主链两端必须是羧基。
许多羧酸都根据其来源或生理功能有俗名。
3.羧酸化学性质 (1)羧酸的酸性羧基p-π共轭体系的存在,使羟基氧原子的电子云密度降低,增强了O -H 键的极性,有利于离解H +;而酸根的p-π共轭更为显著,实验证明在酸根离子中2个C -O 键长是完全相等的,这说明羧基碳与2个氧间的电子密度是完全平均化的,其负电荷分散在两个氧与一个碳上,故酸根负离子比较稳定,易生成。
因此羧酸的酸性比水和醇要强得多。
13第十三章 取代羧酸.

氰醇水解
Reformatsky反应
2019/4/26
5
LDA法:
二异丙基氨基锂,有机强碱
2019/4/26
6
13.2
一、物理性质:
于分子中同时含羟基和羧基两个极性基团,可形成氢 键,水溶性较大。
二、化学性质:
1. 酸性:由于羟基的吸电子性,其酸性比羧酸强。
三、酒石酸
结构 :
存在: 未成熟的果实内;植物的叶子中;自然界中存在的是 左旋体。 用途: 制药和食品工业。
2019/4/26 13
四、柠檬酸
结构 :
存在: 多种植物的果实中;动物组织与体液中,为无色 晶体。
用途:
食品工业的调味品(有酸味),也用于制药业。
2019/4/26
14
五、水杨酸(邻羟基苯甲酸)
γ-丁内酯
δ-戊内酯
从二十四碳烯酸合成十五内酯----一种名贵香料
2019/4/26
10
3. 氧化: α- 羟基酸中的羟基比醇羟基容易氧化。土伦试剂
与醇不发生反应,但能把α-羟基酸氧化为α-羰基酸。
4.脱羧: 可用于从高级羧酸合成减少一个碳原子的醛酮:
2019/4/26
11
13.3 重要的羟基酸
• 酚 酸:-OH直接连在芳香环上
醇 酸
2019/4/26
醇 酸
酚 酸
3
命名
• 根据分子中羟基和羰基的相对位置,有 α 、 β 、 γ…… 等 羟基酸,或按系统命名编号,羧基碳原子编号为 1 ,选 择含羟基和羧基的最长碳链作主链。更常用的是俗名。
乳酸
酒石酸
苹果酸
柠檬酸
水杨酸
2019/4/26
4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章 取代羧酸
1. 写出下列反应的主要产物:
(1) 2CH 3CH 2CH COOH ?
(2) CH 3CH 2CH CH 2CH 2?COOH Δ (3) CH 3CH CH 2?COOH
Δ (4) CH 3CH 2C ?
Δ稀H SO O (5) CH 3COCH
?COOC 2H ②H+,Δ①稀NaOH CH 3 (6) CH 3COCH ?
COOC 2H 浓NaOH CH 2COOC 2H 5
(7) CH 3CHCOCOOC 2H 5
?COOC 2H 5
(8) CH 3CHCOOH
?OH (9)COOC 2H 5CH 3O ?
NaOC 2H 5
2. 用简单的化学方法鉴别:
(1) CH 3CCH 2COOC 2H 5, CH 2(COOC 2H 5)2,COOH OH
及CH 3CHCOOH
OH
(2) CH 3C
CH 2C CH 3 与 CH 3C CH 3O O O
3. 解释阿斯匹林(Aspirin )的鉴别方法:
(1) 加蒸馏水煮沸后放冷,加三氯化铁试液呈紫色。
(2) 加碳酸钠溶液煮沸2分钟,加过量稀硫酸析出白色沉淀,并发生醋酸味。
4. 写出下列各对化合物的酮式与烯醇式的互变平衡体系,并指出哪一个烯醇化程度较大: (1)
O O 和O O (2)O 和O
(3) CH3COCH2COCH3和CH3COC(CH3)2COCH3
5.由乙酰乙酸乙酯或丙二酸二乙酯及其他原料合成下列化合物:(1)3-甲基-2-戊酮(2)2-甲基丁酸
(3)α,β-二甲基丁二酸(4)环戊烷-1,2-二羧酸6.由指定原料合成下列化合物:
(2)由环戊酮合成
(i)OH
COOH(ii)
OH
CH2COOH
(2)由CH3(CH2)3COOC2H5合成CH3(CH2)3COCOOH
(3)由环己酮合成O
COOC2H5
7.提出一个反应历程以解释下列反应的结果:
8.化合物A(C5H8O3)的IR谱在3400cm-1~2400cm-1和1760cm-1,1710cm-1有强吸收峰。
A与NaOH+I2进行反应得化合物B(C4H6O4),B的1H-NMR谱:δH=2.3 X 10-6(单峰,4H),δH=12 X 10-6(单峰,2H)。
A在HCI气催化下与过理CH3OH反应得化合物C(C8H16O4),C经LiAIH4还原得化合物D(C7H16O3),D的IR谱在3400cm-1和1100cm-1,1050cm-1有吸收峰。
D经HCI气催化得化合物E和甲醇,E的IR谱在1120cm-1,1070cm-1有吸收峰,MS:m/z=116(M+.),主要碎片离子m/z=101。
推测化合物A、B、C、D、E的结构。
