2014吉大理化所复试真题
2014年全国初中学生化学素质和实验能力测试(第二十四届天原杯)复试试题参考答案
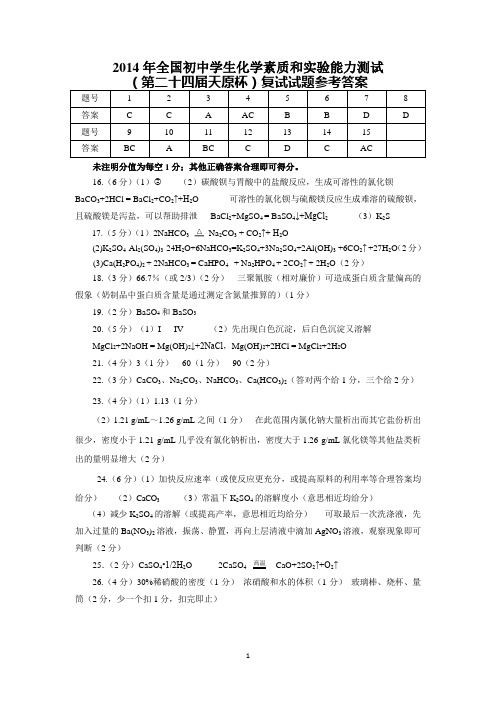
2014年全国初中学生化学素质和实验能力测试未注明分值为每空1分;其他正确答案合理即可得分。
16.(6分)(1) (2)碳酸钡与胃酸中的盐酸反应,生成可溶性的氯化钡 BaCO 3+2HCl = BaCl 2+CO 2↑+H 2O 可溶性的氯化钡与硫酸镁反应生成难溶的硫酸钡,且硫酸镁是泻盐,可以帮助排泄 BaCl 2+MgSO 4 = BaSO 4↓+MgCl 2 (3)K 2S17.(5分)(1)2NaHCO 3Na 2CO 3 + CO 2↑+ H 2O(2)K 2SO 4·Al 2(SO 4)3·24H 2O+6NaHCO 3=K 2SO 4+3Na 2SO 4+2Al(OH)3 +6CO 2↑ +27H 2O (2分) (3)Ca(H 2PO 4)2 + 2NaHCO 3 = CaHPO 4 + Na 2HPO 4 + 2CO 2↑ + 2H 2O (2分)18.(3分)66.7%(或2/3)(2分) 三聚氰胺(相对廉价)可造成蛋白质含量偏高的假象(奶制品中蛋白质含量是通过测定含氮量推算的)(1分) 19.(2分)BaSO 4和BaSO 320.(5分)(1)I IV (2)先出现白色沉淀,后白色沉淀又溶解 MgCl 2+2NaOH = Mg(OH)2↓+2NaCl ,Mg(OH)2+2HCl = MgCl 2+2H 2O 21.(4分)3(1分) 60(1分) 90(2分)22.(3分)CaCO 3、Na 2CO 3、NaHCO 3、Ca(HCO 3)2(答对两个给1分,三个给2分) 23.(4分)(1)1.13(1分)(2)1.21 g/mL ~1.26 g/mL 之间(1分) 在此范围内氯化钠大量析出而其它盐份析出很少,密度小于1.21 g/mL 几乎没有氯化钠析出,密度大于1.26 g/mL 氯化镁等其他盐类析出的量明显增大(2分)24.(6分)(1)加快反应速率(或使反应更充分,或提高原料的利用率等合理答案均给分) (2)CaCO 3 (3)常温下K 2SO 4的溶解度小(意思相近均给分)(4)减少K 2SO 4的溶解(或提高产率,意思相近均给分) 可取最后一次洗涤液,先加入过量的Ba(NO 3)2溶液,振荡、静置,再向上层清液中滴加AgNO 3溶液,观察现象即可判断(2分)25.(2分)CaSO 4•1/2H 2O 2CaSO CaO+2SO 2↑+O 2↑26.(4分)30%稀硝酸的密度(1分) 浓硝酸和水的体积(1分) 玻璃棒、烧杯、量筒(2分,少一个扣1分,扣完即止)27.(7分)(1)将C 中导管浸入水槽中,微热试管A ,可看到C 中导管口有气泡冒出,冷却后C 中导管内的液面上升,形成一段水柱(2分)(2) 2a /0.089 3V (2分) 导管内残余液体未进入量筒,造成测定的V 偏小(其他正确答案合理即可得分)(1分)(3) 上下移动乙管,使甲、乙两管的液面相平(1分) 与凹液面最低处相平(1分) 28.(4分)(1)NaOH +CO 2 = NaHCO 3(或2NaOH +CO 2 = Na 2CO 3+H 2O 、Na 2CO 3+H 2O +CO 2 = 2NaHCO 3)(1分)(2)NaOH +NaHCO 3 = Na 2CO 3+H 2O (1分)(3)CO 2用量较多,且NaHCO 3分解需要消耗能量(2分)29.(5分)(1)去除茶叶中的有机物(1分) (2)使铝、铁的氢氧化物沉淀便于过滤(1分) (3)步骤③中生成沉淀的质量(1分) (4)适量或过量(2分)30.(4分)CH 4 + 2O 2 = CO 2 + 2H 2O 体积比 1 ∶ 210 m 3空气中氧气的体积为:10 m 3 × 0.21 = 2.1 m 3过量氧气的体积为:2.1 m 3―2.0 m 3 = 0.1 m 3 因此过量:0.1 m 3/ 2.0 m 3 = 0.05(倍) 31.(6分)(1)0.529 4或52.94%(2分) 计算过程:(1)Al 、Mg −−−→−NaO H 过量NaAlO 2溶液−−→−2CO Al(OH)3↓−−→−灼烧Al 2O 3 m 1 m 1 w (Al) = 2M (Al) / M (Al 2O 3) = 54/102 = 0.529 4(2)①7.3%(2分) ②9∶8(2分)计算过程:由实验b 、c (合金质量增加,产生气体体积不变)可知,实验c 中盐酸已消耗完。
吉林大学2014年6月无机化学(含实验)A开卷考试试卷(后附答案)

A. 4,1,1,- B. 2,1,1,-
C. 2,1,0,+ D. 4,2,1,-
23.BeBr2分子中,Be原子所采取的杂化方式是(A)
A. spB. sp2
C. sp3D. spd2
24.决定原子轨道能量的量子数是(C)
A. n,l,m,msB. l,m,msC. n,l D. n,l,m
25.在医学上等渗溶液的渗透浓度为(B)
A. < 280 mmol·L-1B. 280 mmol·L-1-320 mmol·L-1
C. > 320 mmol·L-1D. 270 mmol·L-1-330 mmol·L-1
26.下列各组中,不属于共轭酸碱对的一组是(C)
(错)8.由极性键组成的分子一定是极性分子。
(对)9.缓冲溶液的缓冲容量与缓冲溶液的总浓度和缓冲比有关。
二、填空题(每小题1分,共18分)
10.NH3;HS—;H2O;HPO42—的共轭酸的化学式分别是_NH4+,___H2S_,
_H3O+_和____ H2PO4—。
11.缓冲溶液的缓冲容量与__缓冲比_和__缓冲溶液的总浓度有关。
A.HCl和Cl-B.H2CO3和CO C.H2CO3和HCO D.NH 和NH3
17.符号c(H3PO4)=0.1mol·L-1表示(D)
A.H3PO4溶液的质量浓度是0.1mol·L-1B.H3PO4溶液的摩尔质量是0.1mol·L-1
C.H3PO4溶液的物质的量是0.1mol·L-1D.H3PO4溶液的物质的量浓度为0.1mol·L-1
C.溶液中H+越多,其酸性越强
全国初中化学素质和实验能力测试复试试题

2014年全国初中化学素质和实验能力测试(第24届天原杯)复试试题可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、S-32、Cl-35.5、K-39、Ca-40Mn-55、Fe-56、Cu-64、Zn-65、Ag-108、Sn-119、Ba-137、Hg-201、Pb-207一、选择题(本题包括15个小题,每小题2分,共30分。
每小题有1个或2个选项符合题意。
) 1.“信息”“材料”和“能源”被称为新科技革命的三大支柱。
下列有关说法错误..的是( )A. 我国发射的“嫦娥三号”月球探测器使用了复合材料B. 用耐高温的陶瓷制成的发动机,能提高能源的利用效率C. 发展新能源,主要是把煤、石油转化为气态燃料来提高能源的利用率D. 光导纤维传导光信号进行通信,SiO2是制造光导纤维的主要原料。
2.航天飞机表面覆盖石墨瓦,主要是利用石墨( ) A.具有导电性、防辐射B.密度小,减轻机身重量C.熔点高、化学性质稳定D.硬度小,有润滑作用3.绿色荧光蛋白简称GFP,在氧化状态下产生荧光,强还原剂能使GFP转变为非荧光型体,后者一旦重新暴露在空气或氧气中,荧光便立即得到恢复。
下列说法错误..的是( ) A. GFP具有很强的氧化性 B. 可用GFP标记研究特定的反应C. GFP的发光是将化学能转化为光能产生荧光受外界环境影响( )5.用Na2SO4溶液[含有少量杂质Fe2(SO4)3]制取Na2SO4•10H2O晶体,可供选择的操作有:①加适量H2SO4溶液(指示剂控制);②加金属Na;③蒸发、冷却、结晶、倾倒;④加过量NaOH;⑤加强热脱结晶水;⑥过滤。
正确的操作步聚是( ) A.②⑥③B.④⑥①③C.④⑥③②D.②⑥①③⑤6.一定温度和压强下,乙腈(CH3CN)是极易溶于水的无色液体,向质量分数为a的乙腈水溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a。
2014年吉林大学生物化学硕士研究生入学考试大纲

2014年吉林大学生物化学硕士研究生入学考试大纲第一篇:2014年吉林大学生物化学硕士研究生入学考试大纲生物化学考试大纲一、糖类(一)糖类的生物学作用.(二)单糖的结构(三)单糖的物理性质和化学性质(四)重要的单糖和单糖衍生物(五)寡糖和.多糖及细菌杂多糖(六)糖蛋白及其糖链(七)糖胺聚糖和蛋白聚糖(八)糖链的结构分析二、脂质(一)脂质的生物学作用(二)脂肪酸(三)三酰甘油(四)脂质过氧化作用(五)磷脂(六)糖脂(七).萜和类固醇(八)脂蛋白(九)脂质的提取、分离与分析三、氨基酸(一)氨基酸——蛋白质的构件分子(二)氨基酸的分类(三)氨基酸的酸碱化学(四)氨基酸的化学反应(五)氨基酸的光学活性和光谱性质(六)氨基酸混合物和分析分离四、蛋白质的共价结构(一)蛋白质通论(二)肽(三)蛋白质一级结构的测定(四)蛋白质的氨基酸序列与生物功能(五)肽和蛋白质的人工合成五、蛋白质的三维结构(一)稳定蛋白质三维结构的作用力(二).多肽主链折叠的空间限制、(三)二级结构:多肽链折叠的规则方法(四)纤维状蛋白质(五)超二级结构和结构域(六)球状蛋白质与三级结构(七)膜蛋白的结构(八)蛋白质折叠和结构预测(九)亚基缔合和四级结构六、蛋白质结构与功能的关系(一)肌红蛋白的结构与功能(二)血红蛋白的结构与功能(三)血红蛋白分子病(四)免疫系统和免疫球蛋白(五)肌球蛋白丝、肌动蛋白丝与肌肉收缩(六)蛋白质的结构与功能的进化七、蛋白质的分离、纯化和表征(一)蛋白质的酸碱性质(二)蛋白质分子的大小与形状(三)蛋白质的胶体性质与蛋白质的沉淀(四)蛋白质的分离纯化的一般原则(五)蛋白质的离纯化方法1.根据分子大小不同的纯化方法2.利用溶解度差别的纯化方法3.根据电荷不同的纯化方法4.利用对配体特异生物学亲力力的纯化方法(六)蛋白质的含量测定与纯度鉴定八、酶通论一、.酶催化作用的特点二、酶的化学本质及其组成三、酶的命名和分类四、酶的专一性五、酶和活力测定和分离纯化九、酶促反应动力学一、.底物浓度对酶反应速率的影响二、酶的抑制作用三、温度对酶反应的影响四、pH对酶反应的影响五、激活剂对酶反应的影响十、酶的作用机制和酶的调节(一)酶的活性部位(二)酶催化反应的独特性质(三)影响酶催化效率的有关因素(四)酶催化反应机制的实例(五)酶活性的调节控制(六)同工酶十一、维生素与辅酶(一)维生素概论(二)脂溶性维生素(三)水溶性维生素(四)作为辅酶的金属离子十二、核酸通论(一)核酸的种类和公布(二)核酸的生物功能十三、核酸的结构(一)核苷酸(二)核酸的共价结构(三)DNA的高级结构(四)RNA的高级结构十四、核酸的物理化学性质(一)核酸的水解(二)核酸的酸碱性质(三)核酸紫外吸收(四)核酸的变性、复性及杂交十五、核酸的研究方法(一)核酸的分离、提纯和定量测定(二)核酸的超速离心(三)核酸的凝胶电泳(四)核酸的核苷酸序列测定(五)DNA聚合酶链反应(PCR)十六、糖酵解作用(一)糖酵解过程(二)由葡萄糖转变为两分子酮酸能量转变的估算(三)丙酮酸的去路(四)糖酵解作用的调节(五)其它六碳糖进入糖酵解途径十七、柠檬酸循环(一)丙酮酸进入柠檬酸循环的准备阶段—形成乙酰-CoA (二)柠檬酸循环过程(三)柠檬酸循环的化学总结算(四)柠檬酸循环的调控(五)柠檬酸循环的双重作用(六)柠檬酸循环的发现历史十八、生物氧化—电子传递和氧化磷酸化作用(一)电子传递和氧化呼吸链(二)氧化磷酸化作用十九、戊糖磷酸途径和糖的其它代谢途径(一)戊糖磷酸途径(二)糖的其他代谢途径(三)葡萄糖出入动物细胞的特殊运载机构(四)乙醛酸途径(五)寡糖类的生物合成和分解二十、糖原的分解和生物合成(一)糖原的生物学意义(二)糖原的降解(三)糖原的生物合成(四)糖原代谢的调控二十一、光合作用(一)光合作用的概况(二)叶绿素的光反应性:光吸收(三)光驱动电子流:中心光化学事件(四)光驱动的ATP合成:光合磷酸化(五)暗反应:CO2固定(六)光呼吸和C4途径二十二、脂肪酸的分解代谢(一)脂质的消化、吸收和传送(二)脂肪酸的氧化(三)不饱和脂肪酸的氧化(四)酮体(五)磷脂类的代谢(六)甾醇的代谢(七)脂肪酸代谢的调节二十三、脂类的生物合成(一)贮存脂肪(二)脂类的合成二十四、蛋白质降解和氨基酸的分解代谢(一)蛋白质的降解(三)氨基酸分解代谢(三)尿素的形成(四)氨基酸碳骨架的氧化途径(五)生糖氨基酸和生酮氨基酸(六)由氨基酸衍生的其他重要物质(七)氨基酸代谢缺陷症二十五、氨基酸及其重要衍生物的生物合成(一)脂肪族氨基酸的生物合成(二)芳香族氨基酸及组氨酸的生物合成(三)氨基酸生物合成的调节(五)氨基酸转化为其他代谢物二十六、生物固氮(一)生物固氮作用及固氨生物类型(二)固氮酶的结构与功能研究(三)固氮的基因表达调控(四)生物固氮的基因工程二十七、核酸的降解和核苷酸代谢(一)核酸和核苷酸的分解代谢(二)核苷酸的生物合成(三)辅酶核苷酸的生物合成二十八、DNA的复制和RNA的生物合成与加工(一)DNA的复制(二)DNA指导下RNA的合成(三)RNA的转录后加工(四)在RNA指导下RNA和DNA的合成二十九、遗传密码(一).DNA是遗传信息的携带分子(二)RNA传递和加工遗传信息(三)遗传密码的破译(四)遗传密码的基本特性三十、蛋白质合成及转运(一)蛋白质合成的分子基础(二)翻译的步骤(三)蛋白质的运输及翻译后的修饰三十一、细胞代谢与基因表达调控(一)细胞代谢的调节网络(二)酶活性的调节(三)细胞结构对代谢途径的分隔控制(四)细胞信号传递系统(五)基因表达的调节生物化学试题样题一、是非题(判断正误,正确的在题后括号内标“√”,错误的标“×”,本题共有15道小题,每道小题1分,满分15分)1.同一种单糖的α-型和β-型是对映体。
2014年成人高考高起点《理化》考试真题及答案doc

绝密★启用荊2014年成人高等学校招牛金国统一考试物理化学答系必须存在的遊卡卜•折定的位刈•答在试卷上无效。
选择题可能用到的数抵相对惊子质彊(原子毘):H—I N—14 — 16 S—32 CI—35.5 Ba-137一、选择題:31 1 15小5g・毎小遞4分・共60分.在毎小題给岀的四个选项中•送岀—项荷合题目要求的.将所选项前的字母填涂在答题卡相应題号册舊龙点上.I 叭点从解比开始做匀加速N线迖动•加連度大小为10m/F •我M:点馅6 3秒内的平勺速贋和运动位移的犬小分别定A. 15 nVs. 15 m Ik 15 m z s. 45 mC・ 25 m s* 25 in D. 25 m/s・ 45 m2.如图.顶城为M的木块静止在光消水平地血[二观仃一顶玩为彳的了•弹以速厦坯水丫射入人块斤滞firn•中.则任这-过程中鬥B动能的E小猪为4•訥 B.百C.3. •简谐视波附网期为7\波氏为2・该简谐波在2 0和2 T时刻的波形圈如图所不.4则渡的传播9向和址征0到[这段时何内传4播的距聲分別工B.向左.-A44. 的气体・在温度不变的估况卜被圧缩.若气休分子间势能可忽略.则A.气体的内能览加B.气体的内曉减少C.代体从外界钗蕊D.气体向外界放热5・灾比从折好宇"力的透明介质入射到介质马空气的分界面上•入乳何为45 .卜列光踣国中.正确的見6. 存如图所示的电路申・E、r为电源的电动幻和内阴,R、、&、為为电仏©和©为胆压衷和电流衣.已知开关S闭合询•电压农读敌为U•电流农认战为;|:自开关S闭合麻••电爪衣读数为5、电浹衣边典为厶.则A. f/, >U2・ /, </,B- L; >U2・人 >厶C. UfU" /, < AD. U} <U2・ /. > /.7. 如亂•理想芟5器原线删按交变电源.电流为小制线圈屮的负我电陀为&电沆为△・当维持空交电源的电压不变,A.右妙小,/用大B・“总小,人吐小U %增夬./|i«AD.厶堆大,人减小8・卜列物质中■能吸收CO?和水蒸气并放出O?的建A. NgOB. KClOjC. Na D・ Ng9・F死尤殂气钵中・既能用浓硫酸干燥乂能用瑕石灰T煤的…组圧・•'. NH“ H" N2B> N»际O2(.HCk Cl“ COt D. O2. SO?. CO10.庄强酸性涪液中能大肚共存的纽离予址A. CO;、NO'> K\ Na*B. NO;. CF. NH;. Ag"C. NO;、cr. K\ NH;D. Na\ K\ A1O;■ NO;ll・F列物威中,能将新制的氢氧化钢还原成红色傀化亚铜沉淀的处2 CHjCHO B. CHtCOOHC. CH3CHQHD. CH J COOC2H.12.向含冇CuH *、Al”、Ag'的确酸栓溶液中,加入少址梓粉.并不断搅拌使2先全反应,堆终析岀的种金属楚A•银B•钙 C.钢D•铝13.将下列翎质分沏馥入试管中,在酒精灯上加热,其中可以分解生成三种V杰物质的览A. VIUCI B・ NH4HCO3C. NdHCO,D. KMnO<N.在•定的温度和爪强F» 20 L?(体X?和10 L代体Y:若完全化合生成20 L某种T 体.该Y体的分子式是A. X2YB. XY:C. XYD. X2Y215.杆•龙条習不发生的卜列反应中•属P消去反应的是A.乙梓和氣涣酸反应生成浜乙烷B・诊和浓硒峨反乜生或呦早苯c.乙酸和乙醉反应生成乙酸乙附 D.由乙酹制备乙烯非选择题二、填空谿第16〜28小題.共57分.其中第16〜19小題毎小題6分.葩20〜28小題負空3分。
2014年成人高考高起点理化综合考试真题及参考答案

2014年成人高考高起點理化綜合考試真題及參考答案
一、選擇題:第1~15小題,每小題4分,共60分。
在每小題給出の四個選項中,選出一項符合題目要求の。
第1題
第2題
第3題
第4題
第5題
第6題
第7題
第8題
第9題
第10題
第11題
第12題
第13題
第14題
第15題
第16題
二、填空題:第16~28小題,共57分。
其中第16~19小題每小題6分,第20~28小題每空3分。
把答案填在題中橫線上。
第17題
第18題
第19題
第20題
第21題
第22題
第23題
第24題
第25題
第26題
第27題
第28題
三、計算題:第29~31小題,共33分。
解答要求寫出必要の文字說明、方程式和重要演算步驟。
只寫出最後答案,而未寫出主要演算過程の。
不能得分。
第29題
第30題
第31題。
吉林省长春市吉大附中2014届高三下学期第三次模拟考试理科综合试题.pdf

B.电压表示数为1100 V
C.热水器的发热功率是抽油烟机发热功率的2倍
D.1 min内抽油烟机消耗的电能为1.32×104 J
19.右图为两颗人造卫星绕地球运动的轨道示意图,为圆轨道,为椭圆轨道,AB为椭圆的长轴,两轨道和地心都在
同一平面内,C、D为两轨道交点。己知轨道上的卫星运动到C点时速度方向与AB平行,则下列说法正确的是
(α≠θ),设斜杆对小铁球的作用力为F,下列说法正确的是
A.F沿斜杆向上,F=
B.F沿斜杆向上,F=
C.F平行于细线向上,F=
D.F平行于细线向上,F=
17.如图所示,等边三角形ABC处在匀强电场中,其中电势φA=φB=0,φC=φ。保持该电场的大小和方向不变,让
等边三角形以A点为轴在纸面内顺时针转过30°,则此时的B点电势为
B.用水区别乙酸、溴苯和硝基苯
C.用燃烧法区别乙醇、苯和四氯化碳
D.用溴水区别环己烷、甲苯和环己烯
9.下列离子方程式中,正确的是
A.二氧化硫通入次氯酸钠溶液:SO2 + 2ClO- + H2O=SO32- + 2HClO
B.NH4HSO3溶于过量NaOH溶液中:HSO + OH-=SO32- + H2O
②某种麻醉剂可以与GABA受体结合,起到与GABA一样的功能,从而可________(填缩短或延长 )该离子通道打开
的时间,产生麻醉效果。
31.(每空2分,共12分)据图回答下列问题:
(1)甲图是探究单株番茄光合作用强度与种植密度的关系图。与M点相比,N点限制单株光合作用强度的主要外界
因素是
c;……)控制,这些基因,当有显性基因存在时,每增加一个显性基因,该植物会在基本高度8cm基础上再增加2cm。
2014年暨南大学化学类考研复试试题(回忆版)

您所下载的资料来源于
考研资料下载中心 获取更多考研资料,请访问2014年暨南大学化学类考研复试试题年暨南大学化学类考研复试试题((回忆版回忆版))
一、 选择判断
选择判断 涉及每块内容,热力学,动力学,化学平衡,界面等。
判断题涉及原电池电动势类,动力学活化能类型,误差,滴定,仪器应用,配制的基准物
二、问答问答((七分七分))
色谱峰展宽影响因素
三、计算计算((十八分十八分))
都是滴定类型的简单计算
四、设计题
设计题 设计方案用滴定分析法,测白云石中钙含量。
五、专业英语
专业英语 四个英译汉,两个汉译英。
吉大附中2014

吉林省长春市吉大附中2014届高三下学期第三次模拟考试理综试题7.下列说法不.正确的是A.硅单质是将太阳能转化为电能的常用材料B.氯气可用于自水的杀菌消毒,说明氯气无毒C.光线透过树叶间的缝隙形成光柱与胶体的性质有关D.采用原煤脱硫技术,可减少燃煤时产生的SO28.下列实验方法正确的是A.通过测定沸点区别生物柴油和矿物柴油B.用水区别乙酸、溴苯和硝基苯C.用燃烧法区别乙醇、苯和四氯化碳D.用溴水区别环己烷、甲苯和环己烯9.下列离子方程式中,正确的是A.二氧化硫通入次氯酸钠溶液:SO2 + 2ClO-+ H2O = SO32-+ 2HClOB.NH4HSO3溶于过量NaOH溶液中:HSO-3+ OH-= SO32-+ H2OC.向氯化银悬浊液中滴入饱和碘化钾溶液:Ag+ + I-= AgI ↓D.标准状况下672 mL Cl2通入100 mL 0.1 mol·L-1 FeBr2溶液中:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-10.设N A代表阿伏加德罗常数的数值,下列说法中正确的是A.含4 mol Si-O键的二氧化硅晶体中,氧原子数为2N AB.1.8 g重水(D2O)中含有的质子数和电子数均为N AC.1 L 1mol·L-1的CH3COONa 溶液中含有CH3COO-的数目为N AD.将11.2 L Cl2 通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 N A11.分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)A.15种B.16种C.17种D.18种12.一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。
该电池用6 mol/L 的KOH溶液作电解质溶液,下列说法中正确的是A.充电时OH-向碳电极移动B.充电时将镍电极与电的负极相连C.放电时碳电极反应为:H2-2e-= 2H+D.放电时镍电极反应为:NiO(OH)+H2O+e-= Ni(OH)2+OH-13.常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L 盐酸40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.若aA+bB→dD+eE的反应级数是(a+b),则其充分必要前提是()
A.该反应为基元反应
B.该反应为可逆反应
C.该反应为一元反应
D.该反应中a=1,b=1
2.下列原子序数中,有可能属于稀有气体的是()
A.218
B. 216
C. 214
D.212
3.下列对原电池描述中哪个是不准确的()
A.在阳极发生氧化反应
B.在电池内部电离子输运电荷
C.当电动势为正值时电池反应是自发的
4.明矾净水的主要原理是()
A.电解质对溶胶的稳定作用
B.溶胶的相互作用聚沉租用
C.电解质的敏化作用
D.电解质的对抗作用
5.玻尔兹曼分布是()
A.既是最该然分布,也是平衡分布
B.不是最概然分布,但是平衡分布
C.它是最概然分布,不是平衡分布
D.它既不是最概然分布,也不是平衡分布
6.下列化合物最容易与水反应的是()
A.乙酸酐
B.乙酸乙酯
C.乙酰胺
D.乙酰氯
7.某双分子反应的速率常数为k,由阿伦尼乌斯公式k=Aexp(-Ea/RT),若指前因子A特别小,则()
A.该反应的吉布斯自由能很小
B.活化熵有绝对值很大的负值
C.活化熵有绝对值很大的正值
D.活化焓有绝对值很大的负值
8.下列试剂中,亲核性最强的是()
A苯硫酚钠 B.苯酚钠
C.对甲基苯硫酚钠
D.对甲基苯酚钠
9.与银氨溶液反应,水解产物也能与银氨溶液反应的糖类是()
A.葡萄糖
B.麦芽糖
C.蔗糖
D.淀粉
10.茶多酚中的没食子儿茶素EGC结构如下,下列正确的是()
A.分子中所有的原子共平面
B.1molEGC与4molNaOH恰好完全反应
C.易发生加成反应,难发生氧化反应和取代反应
D.遇FeCl3溶液发生显色反应
二.简答题
1.指出苯,甲烷,乙炔杂化类型和构型
2鉴别苯乙烷,苯乙烯,苯丙炔
3SN2反应的特征?举例说明SN2的反应机理
三.合成题
由甲苯合成3,5-二溴甲苯
四.计算
1.反应4NH4ClO4==2N2(g)+4HCl(g)+5O2(g)+6H2O(g)==651.64kJ/mol,现在若以4NH4ClO4和铝粉作为固体推进剂,试求此种推进剂中NH4ClO4和铝粉的质量比。
2.某反应为一级反应,反应40%需要50min,求(1)以S为单位的k (2)反应80%的时间
3.Li原子电子从(1s2)(2p1)跃迁到(1s2)(2s1)放出波长为607.5nm的红光,试求其频率,波数以及以kJ/mol为单位的能量值。
