水化学 天然水体化学平衡导论思维导图
(人教版)化学选修四思维导图:2-3化学平衡(含答案)

(人教版)化学选修四思维导图:2-3化学平衡(含答案)work Information Technology Company.2020YEAR第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】21.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点3C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D454.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应: 2NO 2(g )+NaCl (s )NaNO 3(s )+ClNO (g ) K 1 ∆H < 0 (I ) 2NO (g )+Cl 2(g )2ClNO (g ) K 2 ∆H < 0 (II )(1)4NO 2(g )+2NaCl (s )2NaNO 3(s )+2NO (g )+Cl 2(g )的平衡常数K= (用K 1、K 2表示)。
(人教版)化学选修四思维导图:2-3化学平衡(含答案)
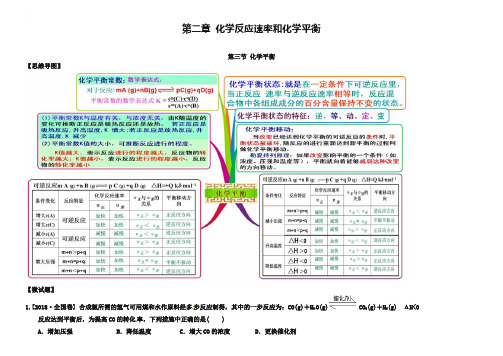
第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s )NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl2(g )2ClNO(g) K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。
化学选修四思维导图:2-3化学平衡

第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl2(g)2ClNO(g) K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 NO和 Cl2,10min时反应(II)达到平衡。
「人教九年级化学」全册单元思维导图

第七单元:燃料及其利用
第八单元:金属和金属材料
第九单元:溶液
第十单元:酸和碱
第十一单元:盐 化肥
第十二单元:化学与生活
三年级下册第四单元思维导图七年级下第八Байду номын сангаас元阅读思维导图九年级化学上册每单元的思维导图帮你们弄
「人教九年级化学」全册单元思维导图
03/09 14:53 武汉梵行刺青処
第一单元:走进化学世界
第二单元:我们周围的空气
第三单元:物质构成的奥秘1
第三单元:物质构成的奥秘2
第四单元:自然界的水
第五单元:化学方程式
「人教九年级化学」全册单元思维导图,初三学生请收藏
第八单元:金属和金属材料
第九单元பைடு நூலகம்溶液
第十单元:酸和碱
第十一单元:盐 化肥
第十二单元:化学与生活
初中化学有哪些知识点看了此图就知道了各位考生请收藏
「人教九年级化学」全册单元思维导图,初三学生请收藏
初中化学有哪些知识点,看了此图就知道了,各位考生请收藏。
第一单元:走进化学世界
第二单元:我们周围的空气
第三单元:物质构成的奥秘1
第三单元:物质构成的奥秘2
第四单元:自然界的水
第五单元:化学方程式
第六单元:碳和碳的氧化物
化学平衡思维导图

化学平衡思维导图统特点不做非膨胀功参与反应各物质的量不再随时间改变而改变正向反应速率等于逆向动态平衡定条件下反应能否进行大转化率计算应条件改变对反应影响何控制反应条件等温等压下,反应方向判据适参与反应各物质的化学势不变定条件下反应方向热力学定律><>=<=反应限度R 点,D 和未混合时吉布斯自由能之和P点,D 和混合后但尚未进行反应时系统的吉布斯自由能之和T点,反应达平衡时,所有物质的吉布斯自由能之总和,包括混合吉布斯自由能;点,纯产物的吉布斯自由能防止反应物之间或反应物与产物之间的任何形式的混合,使反应进行到底亲和势A >0,反应正向进行A <0,反应逆向进行A =0,反应达平衡温方程式理想气体混合系统非理想气体混合物反应系统理想液态混合物反应系统非理想液态混合物反应系统相反应热力学平衡常数适用于任意相态的化学反应与标准态化学势有关,故与各物的性质和标准态的选择有关仅是温度的函数,压力已指定为标准压力它是量纲一的量,单位为通过标准状态下反应吉布斯自由能变化求得与理论上所能获得的最大转化率有关,可计算反应的最大转化率例题用等温方程式判断反应方向判断方向(理想气体)即反应限度,可通过标准平衡常数计算最大转化率平衡常数与等温方程式应用例题例题相反应标准平衡常数理想稀溶液中enry 定律发生偏差平衡常数与化学反应方程式的关系标准平衡常数经验平衡常数理想气体标准平衡常数只取决于温度和物质本性的量纲一的数值者关系准吉布斯自由能、标准平衡常数、经验平衡常的联系与应用对于溶液同理例题个反应系统中,有不同相态的物质参与的反有凝聚相(纯态液相或固相)参单个理想气体或是理想气体混合物只与气体反应物有关多个气体解离压力某固体物质发生解离反应时,所产生气体的压力,称为解离压力,定温下有定值究意义断反应方向当环境中的CO2分压小于离解压力,反应正向进行当CO2分压大于离解压力,反应逆向进行例题准平衡常数测定方法测定反应系统达到平衡时的压力或浓度物理方法直接测定与浓度或压力呈线性关系的物理量化学方法用骤冷、抽去催化剂或冲稀等方法使反应停留在原来的平衡状态,然后用合适的化学分析方法分析平衡的组成衡转化率及平衡组成的计算理论转化率实际转化率准平衡常数与平衡转化率的计算与应用温度an’t Hoff 公式微分式an’t Hoff 公式的定积分式应用压力只影响有气体物质参与并反应前后气体分子数不等的反应的平衡组成惰性气体惰性气体只影响有气体物质参与的反应的平衡组成例题在一个反应体系中,如果同时发生几个反应,当到达平衡态时,这种情况称为同时平衡设体系中发生两个化学反应,若一个反应的产物在另一个反应中是反应物之一,则这两个反应称为耦合反应例子估算估计反应的有利温度转折温度时的温度题。
第四章化学平衡 大学无机化学上册思维导图
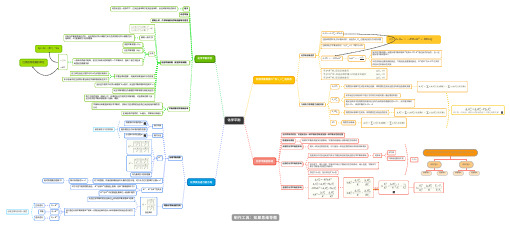
化学平衡标准平衡常数与的关系K θ∆G r m θ化学反应等温式=+RTlnQ∆G r m ∆G r m θ当各种物质不处于标准状态时,反应的正是反应进行方向的判据∆G r m 当体系处于平衡状态时,=0,同时Q=∆G r m K θ∆G =r m θ−RTlnKθlnK =θ−RT ∆G r mθ其中的平衡常数一定是标准平衡常数利用通过前式求出的,也一定是标准平衡常数K θ∆G r m θK θK θ不论实际反应是溶液相反应、气相反应还是复相反应,或与之间不存在此式所表示的关系K p K c ∆G r m θ几种热力学数据之间的关系∆G f mθ物质的标准摩尔生成吉布斯自由能,即物质的生成反应的吉布斯自由能改变量∆G r mθ化学反应在标准状态下进行方式和方向的判据(最合理的判据)是反应体系中各物质的浓度和分压均为标准状态数值时的,而不是平衡时的,体系平衡时=0∆G r m ∆G r m ∆G r m ∆H r mθ物质的标准摩尔生成热,即物质的生成反应的焓变S mθ物质的标准熵对于同一个反应,利用公式求出的这三个量之间的关系化学平衡的移动当外界条件改变,可逆反应从一种平衡状态转变到另一种平衡状态的过程勒夏特列原理如果对平衡体系施加外部影响,平衡将向着减小该影响的方向移动浓度对化学平衡的影响增大一种反应物的浓度,可以使另一种反应物的转化率和利用率增大压强对化学平衡的影响压强变化只对反应前后气体分子数目有变化的反应的化学平衡有影响无影响无气体气体前后数目不变在恒温下,增大压强,平衡向气体分子数减少的方向移动;减小压强,平衡向气体分子数增大加的方向移动总压扩大n倍,各分呀也扩大n倍温度对化学平衡的影响改变Q化学平衡状态定义可逆反应在一定条件下,正反应速率等于逆反应速率时,反应体系所处的状态动态平衡原则上讲,几乎所有的化学反应都有可逆性经验平衡常数(实验平衡常数)量纲一般不为1只有当平衡常数表达式中,反应物的化学计量数之和与生成物的化学计量数之和相等时,K才是量纲为1的物理量分类浓度平衡常数(Kc)分压平衡常数(Kp)一般来说两者不相等,但它们所表示的却是同一个平衡状态,因此二者之间应该有固定的数量关系=cRT不要出现纯固体、纯液体及稀溶液中水的浓度这三种在反应过程中可以认为浓度没有变化非水溶液中的生成物水要出现在平衡常数的表达式中当反应方程式中化学计量数扩大n倍时,反应的平衡常数K将变成K^n反应平衡常数互为倒数的平衡常数与其逆反应的两个方程式相加(相减)时,所得的反应方程式的平衡常数,可由原来的两个反应方程式的平衡常数相乘(相除)得到。
初中化学 第四单元自然界的水思维导图之欧阳生创编

初中化学总复习第四单元自然界的水思维导图双城区兰棱镇第一中学孙淑荣地球表面71%被水覆盖,但供人类利用的淡不足1% 水资源海水占地球总水量的96.5%;海水中含有80多种元素。
海水中含量最多的物质是H2O最多的金属元素是Na ,最多的元素是O 。
为什么水资源匮乏?①用水量增加②水污染严重生活中一水多用案例:淘米水浇花节约用水:农业上:改大水漫灌为喷灌或滴灌爱护水资源工业上:利用新技术新工艺工业“三废”(废渣、废液、废气);水污染物农业:农药、化肥的不合理施用生活:生活污水的任意排放工业:工业三废要经处理达标排放、提倡零排放;防止水污染:农业:合理施用农药、化肥,提倡使用农家肥;欧阳生创编2021.02.08欧阳生创编 2021.02.08 生活:生活污水要集中处理达标排放、提倡零排放;效果由低到高的是 静置、吸附、过滤、蒸馏(均为 物理 方法)其中净化效果最好的操作是蒸馏水的净化 净化方法 既有过滤作用又有吸附作用的净水剂是活性炭。
作用是:既能过滤又能吸附一些溶解性的杂质,出去臭味硬水与软水 A.定义 硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含较少可溶性钙、镁化合物的水。
B .鉴别方法:取样加入用肥皂水,搅拌 。
有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水C .硬水软化的方法:实验室:蒸馏 生活中:加热煮沸D .长期使用硬水的坏处:浪费肥皂,洗不干净衣服;锅炉容易结成水垢,不仅浪费燃料,使管道变形甚至引起锅炉爆炸。
A.装置―――水电解器 电源种类---直流电B.加入硫酸钠或氢氧化钠的目的----增强水的导电性,电解水的实验欧阳生创编 2021.02.08 加快水的电解速度C. 化学反应: 2H2O 通电2H2↑+ O2↑D. 产生位置 负极 正极体积比: 2 :1 (为什么体积比有时大于2:1氧气?)质量比: 1 : 8氧气比氢气更易溶于水,电极消耗氧气)E 水通电分解的微观实质是:水F 结论: ①水是由氢、氧元素组成的。
2020年初中化学 第四单元自然界的水思维导图

作者:非成败作品编号:92032155GZ5702241547853215475102时间:2020.12.13初中化学总复习第四单元自然界的水思维导图双城区兰棱镇第一中学孙淑荣地球表面71%被水覆盖,但供人类利用的淡不足1%水资源海水占地球总水量的96.5%;海水中含有80多种元素。
海水中含量最多的物质是H2O最多的金属元素是Na ,最多的元素是O 。
为什么水资源匮乏?①用水量增加②水污染严重生活中一水多用案例:淘米水浇花节约用水:农业上:改大水漫灌为喷灌或滴灌爱护水资源工业上:利用新技术新工艺工业“三废”(废渣、废液、废气);水污染物农业:农药、化肥的不合理施用生活:生活污水的任意排放工业:工业三废要经处理达标排放、提倡零排放;防止水污染:农业:合理施用农药、化肥,提倡使用农家肥;生活:生活污水要集中处理达标排放、提倡零排放;效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方其中净化效果最好的操作是蒸馏水的净化净化方法既有过滤作用又有吸附作用的净水剂是活性炭。
作用是:既能过滤又能吸附一些溶解性的杂质,出去臭味硬水与软水 A.定义硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含较少可溶性钙、镁化合物的水。
B.鉴别方法:取样加入用肥皂水,搅拌。
有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水C.硬水软化的方法:实验室:蒸馏生活中:加热煮沸D.长期使用硬水的坏处:浪费肥皂,洗不干净衣服;锅炉容易结成水垢,不仅浪费燃料,使管道变形甚至引起锅炉爆炸。
A.装置―――水电解器电源种类---直流电电解水的实验B.加入硫酸钠或氢氧化钠的目的----增强水的导电性,加快水的电解速度C. 化学反应:2H2O通电2H2↑+ O2↑D. 产生位置负极正极体积比: 2 :1 (为什么体积比有时大于2:1氧气?)质量比: 1 : 8 氧气比氢气更易溶于水,电极消耗氧气)E水通电分解的微观实质是:水F结论:①水是由氢、氧元素组成的。
初中化学各单元知识框架图
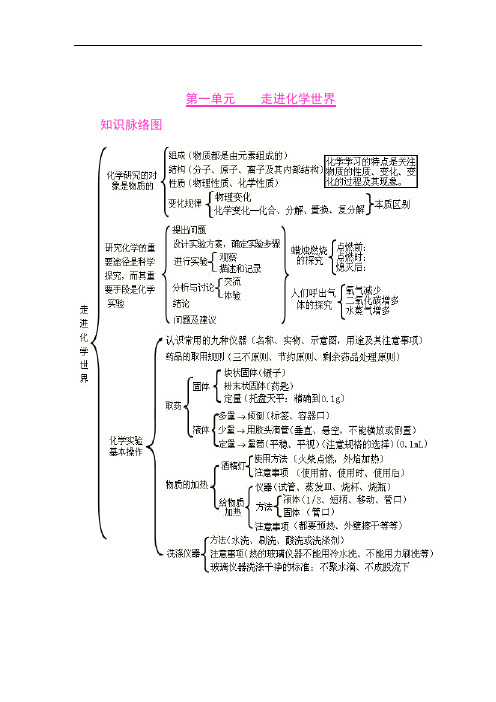
第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰??CaO 熟石灰、消石灰、石灰水的主要成分??Ca(OH)2石灰石、大理石??CaCO3食盐的主要成分??NaCl 纯碱、口碱??Na2CO3烧碱、火碱、苛性钠??NaOH 胆矾、蓝矾??CuSO4.5H2O 碳酸钠晶体??Na2CO3.10H2O 氨水??NH3.H2O二、化合物的分类三、金属活动性1、金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
化学平衡、化学反应速率知识结构图
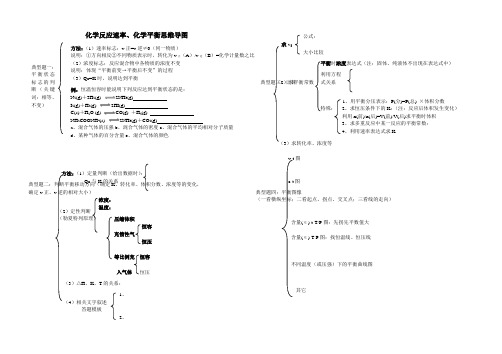
化学反应速率、化学平衡思维导图典型题一:平衡状态标志的判断(关键词:相等、不变) 方法:(1)速率标志:v 正=v 逆≠0(同一物质)说明:①方向相反②不同物质表示时,转化为v 正(A )/v 逆(B )=化学计量数之比 (2)浓度标志:反应混合物中各物质的浓度不变 说明:体现“平衡前变→平衡后不变”的过程(3)Qc=K 时,说明达到平衡例:恒温恒容时能说明下列反应达到平衡状态的是: N 2(g)+3H 2(g) 2NH 3(g) I 2(g)+H 2(g) 2HI(g) C(s)+H 2O (g) CO(g) +H 2(g) NH 2COONH 4(s) 2NH 3(g)+CO 2(g) a 、混合气体的压强b 、混合气体的密度c 、混合气体的平均相对分子质量 d 、某种气体的百分含量e 、混合气体的颜色 压缩体积 恒容 充惰性气 恒压 等比例充 恒容 入气体 恒压 (2)定性判断 (勒夏特列原理) 求v : 典型题二:判断平衡移动方向(确定K 、转化率、体积分数、浓度等的变化,确定v 正、v 逆的相对大小) 方法:(1)定量判断(给出数据时): Qc 与K 的关系 浓度: 温度: (3)△H 、K 、T 的关系:典型题三:计算(2)求平衡常数 公式: 大小比较 平衡时浓度表达式(注:固体、纯液体不出现在表达式中)利用方程 式关系 特殊: 1、用平衡分压表示:P(分)=P(总) ×体积分数2、求恒压条件下的K :(注:反应后体积发生变化) 利用n(前)/n(后)=V(前)/V(后)求平衡时体积3、求多重反应中某一反应的平衡常数:4、利用速率表达式求K (3)求转化率、浓度等 典型题四:平衡图像(一看横纵坐标;二看起点、拐点、交叉点;三看线的走向)v-t 图 c-t 图 含量(α)-t-T/P 图:先拐先平数值大含量(α)-T-P 图:找恒温线、恒压线其它(4)相关文字叙述 答题模板 1、 2、 不同温度(或压强)下的平衡曲线图。
