人教版高中化学必修二1.3《化学键-离子键及离子化合物》课件精品课件PPT
合集下载
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
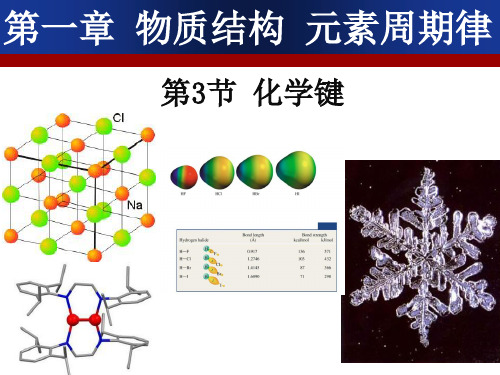
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
人教版高中化学必修二1.3《化学键(一)》课件优秀课件PPT
中间用
连接。
右侧写离子化合物的电子式,相同的不能合并
课堂练习
1.溴化钾的形成过程
2.氧化镁的形成过程
3.溴化钙的形成过程
课堂练习
练习1.下列用电子式表示化合物的形成过程正确的是:( A )
A K O K K [ O ]2 K B Cl Ba Cl [ Cl ] [ Ba ]2 [ Cl ]
C F Mg D H Cl
硫原子, 溴离子, 钾离子
·S····· [ :B··r··:]-
K+
三、电子式
(3)离子化合物的电子式
AB型 NaCl
A2B型
2-
Na2S Na S Na
AB2型 MgCl2
注意:离子化合物的电子式:由阴、阳离子的 电子式组成,但相同离子不能放一起
练习:离子结合在一起,彼此的 电荷是否会中和呢?
不会!因为阴、阳离子接近到某一 定距离时,吸引力和排斥力达到平衡, 阴、阳离子间形成稳定的化学键。
一、离子键
1、定义: 带相反电荷离子之间的相互作用 2、微粒: 阴、阳离子 3、作用力: 静电作用(吸引与排斥)
4、成键过程(一般情况)
活泼的金属元素(IA,IIA)和活泼的非金属 元 素(VIA,VIIA)之间通过得失电子形成。
标“[ ]”、 标电荷数
②阳离子
复杂的阴离子
OH
简单的阳离子: 用离子符号表示
如Mg2
Na
复杂的阳离子: 注明最外层电子数及
H
电荷数 +
如NH4+ H N .H
H
思考: 1.下列电子式是否正确
:: :: ::
× × :O:
[:Na:]+
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)

人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
Q4:哪些元素倾向于形成离子键?
活泼 失电子 活泼
金属元素
非金属元素
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
《化学键——离 子键》
Q1:能把球形砖垒起来吗?
方砖
球形砖
Funny Game 试着把老师提供的两组乒乓球垒起来
Replace
Analogy
球形砖
乒乓球
原子
连接作用
Chemical Bond
直接相邻的原
键:
子或离子之间存在 《词典》 使轴与齿轮连接并
固定在一起的零件。
的强烈相互作用叫 《电学》 电键,即控制电路
Ionic Compound
1.定义: 由离子键构成的化合物叫做离子化合物。 2.类别:(1)大多数盐
(2)强碱 (3)金属氧化物、金属过氧化物 (4)金属氢化物
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT) 人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
形成离子键 形成???
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
Homework
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
高中化学必修二1.3《化学键-离子键及离子化合物》课件

第三层级 技能应用与拓展 基础智能检测
1 下列叙述中错误的是( A )。 A.任何离子键在形成的过程中必定有电子的得与失 B.离子化合物中不一定含金属元素 C.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 D.NaCl中除Na+和Cl-静电吸引作用外,还存在电子与电子、 原子核与原子核之间的排斥作用
不正确;同种原子的电子式不能同时用“•”和 “×”表示。
第二层级 思维探究与创新 重难点探究
离子化合物电子式的书写
互动探究
(1)举例说明如何书写原子的电子式。
..
探究拓展
(2)阳离子的电子式怎样书写?阴离子的电子式又如何书写?
书写离子的电子式时,简单阳离子是原子失去最外层
电子后形成的,只写其元素符号,并在右上角注明所带
..
x. .. .. .. .. .
。 。
(4)书写离子化合物的电子式时,阴阳离子的排列应遵循
什么原则?
遵循阴阳离子交替出现的原则。
互动探究
1
2 由非金属元素组成的化合物可能是离子化合物吗? 可能,如NH4Cl由非金属元素组成,它是离子化合物。
名师点拔
一、电子式的书写
1 阳离子电子式:主族元素的简单离子中,阳离子的电子 式就是离子符号,如Na+既是离子符号,又是钠离子的电 子式。
N: _______ O: ________F: ________
基础学习交流
1 “离子键就是阴阳离子之间的吸引力”,这种说法正 确吗?说明理由。 不正确;离子键是阴阳离子之间的静电作用,该作 用力不仅只是阴阳离子之间的吸引力,还包括电子 与电子、原子核与原子核之间的排斥力。
2 镁原子的电子式:•Mg×,这种书写方式是否正确?说明理 由。
高中化学必修二课件-1.3化学键14-人教版

如何用电子式表示MgCl2、Na2O?
注意
1、相同离子不能合并 2、尽可能对称
4、用电子式表示离子化合物的形成过程
例:Na K
Cl SK
Na Cl
2-
KS K
Br Mg Br
Br Mg2 Br
练习:写出Na2O的形成过程
小结
本节课我们主要学习了化学键中的离子键及电 子式的有关知识。知道离子键是阴、阳离子之 间的静电作用,电子式不仅可以用来表示原子 、离子,还可以用来表示物质分子及化合物的 形成过程。
思考·交流
哪些元素原子能形成离子键呢?
4、成键元素:
活泼的金属元素(第ⅠA、ⅡA族)和活泼的非 金属元素(第ⅥA、ⅦA族)
思考·交流
(1)所有金属和非金属化合都能形成离
子键吗?举例说明。 AlCl3
(2)所有非金属化合都不能形成离子键 吗?举例说明。
NH4Cl
(二)离子化合物
1、定义:由离子键构成的化合物 2、类型:
第三节 化学键
离子键
(第1课时)
实验1—2:钠在氯气中燃烧 播放
现象 化学方程式
Na在Cl2中剧烈燃烧,产生 黄色火焰,生成的物质在 空气中呈白烟状。
点燃
2Na + Cl2 ==== 2NaCl
思考与交流: 试解释NaCl是怎样形成的。
不稳定
将最外层1个 电子转移给氯
电失 子去
原子
电得 子到
稳定
金属氧化物,强碱和绝大部分的盐。
1、表示原子
O
练习:Al S
Cl Mg Na
2、表示简单离子
阳离子:Na+ Mg2+
阴离子:
S
Байду номын сангаас
注意
1、相同离子不能合并 2、尽可能对称
4、用电子式表示离子化合物的形成过程
例:Na K
Cl SK
Na Cl
2-
KS K
Br Mg Br
Br Mg2 Br
练习:写出Na2O的形成过程
小结
本节课我们主要学习了化学键中的离子键及电 子式的有关知识。知道离子键是阴、阳离子之 间的静电作用,电子式不仅可以用来表示原子 、离子,还可以用来表示物质分子及化合物的 形成过程。
思考·交流
哪些元素原子能形成离子键呢?
4、成键元素:
活泼的金属元素(第ⅠA、ⅡA族)和活泼的非 金属元素(第ⅥA、ⅦA族)
思考·交流
(1)所有金属和非金属化合都能形成离
子键吗?举例说明。 AlCl3
(2)所有非金属化合都不能形成离子键 吗?举例说明。
NH4Cl
(二)离子化合物
1、定义:由离子键构成的化合物 2、类型:
第三节 化学键
离子键
(第1课时)
实验1—2:钠在氯气中燃烧 播放
现象 化学方程式
Na在Cl2中剧烈燃烧,产生 黄色火焰,生成的物质在 空气中呈白烟状。
点燃
2Na + Cl2 ==== 2NaCl
思考与交流: 试解释NaCl是怎样形成的。
不稳定
将最外层1个 电子转移给氯
电失 子去
原子
电得 子到
稳定
金属氧化物,强碱和绝大部分的盐。
1、表示原子
O
练习:Al S
Cl Mg Na
2、表示简单离子
阳离子:Na+ Mg2+
阴离子:
S
Байду номын сангаас
人教版高中化学必修二1.3《化学键(第一课时)》课件最新课件

2.箭号右方写离子化合物的电子式。写时要注意二标: 标正负电荷、阴离子标[]。
3.箭号左方相同的微粒可以合并写,箭号右方相同的 微粒不可以合并写。
4.在标正负电荷时,特别要注意正负电荷总数相等。
5.不能把 “→” 写成 “ = ”
6.用箭头表明电子转移方向
一、离子键
小结
使阴阳离子结合成化合物的静电作用,叫做 离子键。 含有离子键的化合物一定是离子化合物 区分: 用电子式表示微粒或物质
一、离子键
[ 练习] 写出下列微粒的电子式:
硫原子、硫离子、溴原子、溴离子
·S····· [:S····:]2-
··
·· B·r··
[:B··r:]··
用电子式可以直观地
看到原子结构特点与键之间的关系。 也可以表示出原子或离子之间是怎样结合的
一、离子键
电子式书写注意:
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
元素(VIA,VIIA)之间的化合物。 2、 活泼的金属元素和酸根离子形成的盐
酸根离子:SO42-、NO3-、Cl-等
3、铵盐子和酸根离子(或活泼非金属元素) 形成的盐。
把NH4+看作是活泼的金属阳离子
5、离子化合物:含有离子键的化合物。
H
元素周期表
Li Be
NOF
Na Mg
P S Cl
K Ca ……
Mg2+[:O··:]2··
(2)用电子式表示硫化钾的形成过程
·· 2K·+ ·S··· →
K+ [:S····:]2- K+
注 箭头左方相同的原子可以合并, 意 箭头右方相同的微粒不可以合并。
一、离子键
3.箭号左方相同的微粒可以合并写,箭号右方相同的 微粒不可以合并写。
4.在标正负电荷时,特别要注意正负电荷总数相等。
5.不能把 “→” 写成 “ = ”
6.用箭头表明电子转移方向
一、离子键
小结
使阴阳离子结合成化合物的静电作用,叫做 离子键。 含有离子键的化合物一定是离子化合物 区分: 用电子式表示微粒或物质
一、离子键
[ 练习] 写出下列微粒的电子式:
硫原子、硫离子、溴原子、溴离子
·S····· [:S····:]2-
··
·· B·r··
[:B··r:]··
用电子式可以直观地
看到原子结构特点与键之间的关系。 也可以表示出原子或离子之间是怎样结合的
一、离子键
电子式书写注意:
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
元素(VIA,VIIA)之间的化合物。 2、 活泼的金属元素和酸根离子形成的盐
酸根离子:SO42-、NO3-、Cl-等
3、铵盐子和酸根离子(或活泼非金属元素) 形成的盐。
把NH4+看作是活泼的金属阳离子
5、离子化合物:含有离子键的化合物。
H
元素周期表
Li Be
NOF
Na Mg
P S Cl
K Ca ……
Mg2+[:O··:]2··
(2)用电子式表示硫化钾的形成过程
·· 2K·+ ·S··· →
K+ [:S····:]2- K+
注 箭头左方相同的原子可以合并, 意 箭头右方相同的微粒不可以合并。
一、离子键
人教版高中化学必修二1.3《化学键》讲课课件

如:KCl、Na2O、Na2S、MgCl2等
强碱、大部分金属氧化物 、大 部分盐:
如:NaOH、KOH、MgO、Na2O2、 K2SO4、Na2CO3、Mg(NO3)2 NH4Cl [NH4]2SO4 [NH4]2S等
电子式:在元素符号周围用小黑点“.”(或 “×”)来表示原子的最外层电子(价电子),
表示出原子之间是怎样结合的
看到原子结构特点与键之间的关系。
用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程
Na ·+
··
·· C··l · →
Na+ [:C··l :]··
用电子式表示溴化钙的形成过程
:B····r ·+·Ca·+:B··r···→ [:B··r··:]-Ca2+[:B··r··:]-
第3节
学习目标:
1、 通过对NaCl形成过程的分析,理 解离子键和离子化合物的涵义。
2、学会用电子式表示原子、离子、离 子化合物以及离子化合物的形成过程。 重点:
离子键和离子化合物的涵义 难点:
用电子式表示原子、离子、离子化 合物以及离子化合物的形成过程。
观察实验1-2 金属钠在氯气中燃烧
在氯化钠晶体中,Na+和 Cl- 间存在哪些作用力?
这种式子叫做电子式。如:
原子: H O Cl Mg Na
离子: Cl
2-
O
Mg2
Na
离子化合物: Na Cl
2-
Na O Na
Cl Mg2 Cl
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·····
··
·· B·r··
[ :S····:]2-
强碱、大部分金属氧化物 、大 部分盐:
如:NaOH、KOH、MgO、Na2O2、 K2SO4、Na2CO3、Mg(NO3)2 NH4Cl [NH4]2SO4 [NH4]2S等
电子式:在元素符号周围用小黑点“.”(或 “×”)来表示原子的最外层电子(价电子),
表示出原子之间是怎样结合的
看到原子结构特点与键之间的关系。
用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程
Na ·+
··
·· C··l · →
Na+ [:C··l :]··
用电子式表示溴化钙的形成过程
:B····r ·+·Ca·+:B··r···→ [:B··r··:]-Ca2+[:B··r··:]-
第3节
学习目标:
1、 通过对NaCl形成过程的分析,理 解离子键和离子化合物的涵义。
2、学会用电子式表示原子、离子、离 子化合物以及离子化合物的形成过程。 重点:
离子键和离子化合物的涵义 难点:
用电子式表示原子、离子、离子化 合物以及离子化合物的形成过程。
观察实验1-2 金属钠在氯气中燃烧
在氯化钠晶体中,Na+和 Cl- 间存在哪些作用力?
这种式子叫做电子式。如:
原子: H O Cl Mg Na
离子: Cl
2-
O
Mg2
Na
离子化合物: Na Cl
2-
Na O Na
Cl Mg2 Cl
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·····
··
·· B·r··
[ :S····:]2-
人教版高中化学必修二1.3《化学键》同步课件品质课件PPT

*含有离子键的化合物就是离子化合物。
2. 离子键的形成:
活泼金属元素的原子 失 e- 阳离子
离
。
。 。
子
键 活泼非金属元素的原子
得 e-
。
阴。离子
(原子团)
思考
3.哪些物质能形成离子键?(成键条件)
(1)活泼的金属元素(IA,IIA)和活泼的非 金属元素(VIA,VIIA)之间通过得失电子
如:K2S、MgCl2等 (2)NH4+、CO32—、SO42—等原子团之间或 与活泼的非金属、金属元素之间
如:(NH4)2S、(NH4)2CO3、MgSO4等 (3)强碱与大多数盐都存在离子键
如:NaOH、KOH、BaCO3等
4. (离子键的表示方法)-电子式
在元素符号周围用“ ·”或 “×”来表示原子最外层电子的 式子,叫电子式。
··
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
判断非极性键和极性键的依据:
①同种原子形成共价键,电子对不偏移,
H2
HCl
组成
同种原子 不同种原子
特 原子吸引电子对能力
相同
不相同
征 共用电子对位置
不偏向任何 偏向吸引电子能 一个原子 力强的原子一方
成键原子电性 结论
不显电性
非极性键 A-A
显电性
极性键 A-B
5、非极性键和极性键
非极性键:两同种原子间形成的共价 键是非极性共价键,简称非极性键。
极性键:两种不同的原子间形成的共 价键是极性共价键,简称极性键。
[ :O····:]2-
[:C·l·:]··
(4)离子化合物的电子式:由阴、阳离子 的电子式组成,但相同离子不能合并
2. 离子键的形成:
活泼金属元素的原子 失 e- 阳离子
离
。
。 。
子
键 活泼非金属元素的原子
得 e-
。
阴。离子
(原子团)
思考
3.哪些物质能形成离子键?(成键条件)
(1)活泼的金属元素(IA,IIA)和活泼的非 金属元素(VIA,VIIA)之间通过得失电子
如:K2S、MgCl2等 (2)NH4+、CO32—、SO42—等原子团之间或 与活泼的非金属、金属元素之间
如:(NH4)2S、(NH4)2CO3、MgSO4等 (3)强碱与大多数盐都存在离子键
如:NaOH、KOH、BaCO3等
4. (离子键的表示方法)-电子式
在元素符号周围用“ ·”或 “×”来表示原子最外层电子的 式子,叫电子式。
··
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
判断非极性键和极性键的依据:
①同种原子形成共价键,电子对不偏移,
H2
HCl
组成
同种原子 不同种原子
特 原子吸引电子对能力
相同
不相同
征 共用电子对位置
不偏向任何 偏向吸引电子能 一个原子 力强的原子一方
成键原子电性 结论
不显电性
非极性键 A-A
显电性
极性键 A-B
5、非极性键和极性键
非极性键:两同种原子间形成的共价 键是非极性共价键,简称非极性键。
极性键:两种不同的原子间形成的共 价键是极性共价键,简称极性键。
[ :O····:]2-
[:C·l·:]··
(4)离子化合物的电子式:由阴、阳离子 的电子式组成,但相同离子不能合并
人教版高中化学必修二1.3《化学键》实用授课课件

①电子式
HCl的电子式
H Cl ××
×× ×× ××
Cl2的电子式
②结构式:
×× ××
Cl Cl
×× ××
用一根短线表示一对共用电子。其他电子一律省去
如:H-Cl
Cl-Cl
分子
H2 N2 H2O CO2 CH4
电子式
3、成键的本质和条件
①成键元素: 一般是同种或不同种非金属元素 如:H2 HCl 特例:AlCl3
例如:H2O2 HCl CO2
学与问
NH4+ NaOH
你能用电子式表示H2O的形成过程吗?
H ×+ O + ×H → H × O × H
【学与问】
含含有有离共价子键键的的化化合合物物一一定是定共是价离化子合化物合物 含全有部共由错非价,金如键属:的元N化a素O合组H物成N不的a2S化一O合定4 物是一共定价是化共合价化物合, 物
Na+ [··O ··H ]-
2.过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠离 子以离子键结合;在过氧根离子中,两个氧原 子以共价键结合。请用电子式表示过氧化钠。
Na + [··O · ·] 2- Na+
::
·O ·
5、共价键的存在:广泛存在于非金属单质, 共价化合物以及复杂离子或离子化合物中
2.主族元素A和B可形成AB2型离子化合物,用电 子式表示AB2的形成过程。
。
氢分子的形成: H ·+ ·H → H H
··
氯氯化氢分子的形成: 化 氢 分 子 的 形 成:
·· ··
H ·+
·C····l: →
H
C··l ··
氢分子的形成:
人教版高中化学必修二课件-1.3 化学键29

小结
概念 (静电作用)
离子键
形成条件
含离子键 离子化合物
电子式书写
种类
课堂练习
1、判断下列化合物哪些为离子化合物?
①④⑦ ⑧ ⑨
①NaOH ②H2
③CO2
④CaO ⑤H2O2 ⑥NH3
⑦KI
⑧NH4Cl ⑨CaCO3
பைடு நூலகம்
2:写出下列离子化合物的电子式 CaCl2、K2S、Na2S、KBr
3.下列电子式是否正确
②含氧酸盐:Na2SO4、KNO3 ③氨盐:NH4Cl、NH4NO3
二、离子化合物
1、定义:由离子键构成的化合物 2、存在:金属氧化物,活泼金属氢化物,强碱和绝
大部分的盐。
三、离子化合物形成过程的表示法——电子式法
3.简单阴离子的电子式:
例题:写出下列离子的电子式 氯离子 氧离子
练习:氟离子、硫离子、溴离子、 氢负离子
▪ 我来到学校的时候已经是7时35分了。进入校门的时候,有一位老师摸了摸我的头,微笑着说:“ 跳跳,你真厉害,考了个全班第一!”我腼腆的笑了笑。
▪ “老师,同学们,早上好!”一个声音从广播里传出来,“现作文在公布全级期末考试成绩排名 前二十名同学的名单……”顿时,大家都安静了下来,心里既紧张又充满了期待。“第四名,202 ,王跳跳。第五名……”这时全班同学都尖叫了起来,纷纷看着我,眼里充满了羡慕。我也开心 得差点就跳起来了。
▪ 这次期末,我得了好多好多奖:年级第四名、文明生、三好学生……
▪ 放学后,我跟着思颐去她家。她家很好看,很精致。我们一起当老师,很好玩,很开心。
三、离子化合物形成过程的表示法——电子式法
4、离子化合物的电子式 由阴、阳离子的电子式组成,
高中化学必修二课件-1.3化学键11-人教版

离子化合物 含有离子键
共价化合物(单质) 只含有共价键
布置作业
1.课后认真体会本节内容。 2.完成课时训练40分钟。
谢谢
那么非金属元素之间是靠什么作用力结 合在一起的呢?
氢气在氯气中燃烧
点燃
H2+Cl2===2HCl
H2 气体分子
Cl2气体分子
分开后,她们为什么不高兴?让我们听听她们 说些什么?
我只有一个电 子,太少了
我也少一 个电子
e
+1 1
H 原子
7 8 2 +17
Cl 原子
二位好!我有一个好办法.你们每人 拿出一个电子共用,就象共同分享快 乐一样共同拥有.行吗?
第三节 化学键
知识回顾
1、什么是离子键 ? 2、离子键的作用力是什么? 3、形成离子键的微粒是什么? 4、什么元素化合容易形成离子键 ? 5、什么是离子化合物?
思考与讨论
活泼的金属元素和活泼非金属元素化合 时形成离子键。请思考,非金属元素之间化 合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子 的倾向,难以形成阴阳离子。
2.作用力: 共用电子对 3.成键粒子: 原子 4.成键元素: 同种或不同种非金属元素之间
;部分金属元素原子与非金属 元素原子之间,如AlCl3
例如:H2 N2 H2O HF 等均以共价键形成分子
5、共价键的表示方法:电子式 ★氢分子的形成:
H ·+ ·H → H H H﹣H(结构式)
··
★氯化氢分子的形成
1、判断下列物质是离子化合物还是共价化合物 :HCl 、CO2 、 N2 、KCl、NaOH
2、下列说法中正确的是( AD)
A.含有离子键的化合物必是离子化合物 B.具有共价键的化合物就是共价化合物 C.共价化合物可能含离子键 D.离子化合物中可能含有共价键 E.有金属和非金属元素组成的化合物一定是离子 化合物
人教版高中化学必修二1.3《化学键(第2课时)》课件最新课件PPT

二氧化碳
﹕﹕
::
·O ·
::
由离子键构成的化合物叫做离子化合物, 含有共价键的化合物一定是共价化合物吗?
Na+ [··O ··H -] Na+ [··O · ·]2- Na+
含有共价键的化合物不一定是共价化合物; 含有离子键的化合物一定是离子化合物;
HCl中,为什么H显+1价,Cl显-1价?
HCl..
第一章 物质结构 元素周期律
*第三节 化学键 (第2课时)
* 学习目标
Ø知识与技能: 1 理解共价键的概念,初步掌握共价键的形成 2 通过学生对离子键和共价键的认识与理解,培养
抽象思维能力; 3 通过电子式的书写,培养归纳比较能力
Ø过程与方法: 培养学生从宏观到微观,从现象到本质的认识事物
的科学方法 Ø情感态度与价值观:
成键微粒:原子 成键实质:共用电子对 成键元素:同种或不同种非金属元素原子之间
某些金属元素原子与非金属元素原子间 (如:AlCl3等)
2、表示:
电子式
HCl H2 N2 H2S CO2
结构式 H—Cl H—H NN H—S—H
3.用电子式表示共价键的形成过程
用电子式表示形成过程: H2O、NH3、CO2 水 氨
H .C..l:
共用电子对偏向对其吸引力更强的一方 共用电子对偏向一方原子的共价键称为极性键
H2中共用电子对又如何??
H.H
共用电子对因受到的吸引力大小相等 而居于两原子的正中央,(不偏移)
共用电子对不偏向一方原子的共价键称为 非极性键
非极性键
极性键
同种原子
不同种原子
* 4.共价键的分类
极性键:不同种元素的原子 非极性键: 同种元素的原子
﹕﹕
::
·O ·
::
由离子键构成的化合物叫做离子化合物, 含有共价键的化合物一定是共价化合物吗?
Na+ [··O ··H -] Na+ [··O · ·]2- Na+
含有共价键的化合物不一定是共价化合物; 含有离子键的化合物一定是离子化合物;
HCl中,为什么H显+1价,Cl显-1价?
HCl..
第一章 物质结构 元素周期律
*第三节 化学键 (第2课时)
* 学习目标
Ø知识与技能: 1 理解共价键的概念,初步掌握共价键的形成 2 通过学生对离子键和共价键的认识与理解,培养
抽象思维能力; 3 通过电子式的书写,培养归纳比较能力
Ø过程与方法: 培养学生从宏观到微观,从现象到本质的认识事物
的科学方法 Ø情感态度与价值观:
成键微粒:原子 成键实质:共用电子对 成键元素:同种或不同种非金属元素原子之间
某些金属元素原子与非金属元素原子间 (如:AlCl3等)
2、表示:
电子式
HCl H2 N2 H2S CO2
结构式 H—Cl H—H NN H—S—H
3.用电子式表示共价键的形成过程
用电子式表示形成过程: H2O、NH3、CO2 水 氨
H .C..l:
共用电子对偏向对其吸引力更强的一方 共用电子对偏向一方原子的共价键称为极性键
H2中共用电子对又如何??
H.H
共用电子对因受到的吸引力大小相等 而居于两原子的正中央,(不偏移)
共用电子对不偏向一方原子的共价键称为 非极性键
非极性键
极性键
同种原子
不同种原子
* 4.共价键的分类
极性键:不同种元素的原子 非极性键: 同种元素的原子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三层级 技能应用与拓展 基础智能检测
1 下列叙述中错误的是( A )。 A.任何离子键在形成的过程中必定有电子的得与失 B.离子化合物中不一定含金属元素 C.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 D.NaCl中除Na+和Cl-静电吸引作用外,还存在电子与电子、 原子核与原子核之间的排斥作用
..
x. .. .. .. .. .
。 。
(4)书写离子化合物的电子式时,阴阳离子的排列应遵循
什么原则?
遵循阴阳离子交替出现的原则。
互动探究
1
2 由非金属元素组成的化合物可能是离子化合物吗? 可能,如NH4Cl由非金属元素组成,它是离子化合物。
名师点拔
一、电子式的书写
1 阳离子电子式:主族元素的简单离子中,阳离子的电子 式就是离子符号,如Na+既是离子符号,又是钠离子的电 子式。
化学键
离子键及离子化合物
化学
想让花开得更鲜艳,在花盆里浇一点盐水即可。
为防止洗衣服时衣服褪色,可在水中加点盐。
用油炸食物时,将一点盐放入油锅里,油就不会 外溅了。
将胡萝卜捣碎再拌点盐,可以将衣服上的血迹擦 掉。
用食盐涂抹鱼身,再用水冲洗,可去掉身上的黏 液。
钠在氯气中燃烧 氯化钠的形成
]-
Mg2+
[
.. C.l.
]-
。
.. x.
.. x . .. x . x .
x. .. .
..
.
全新视角拓展
4(((123)))用NMNaga电BF2Sr2__子______式_N..F__N_a..__表a___x_x__示_++__+___下_x..S___.M..__列.B_g.__.r_+__物_x___x__质+___N___的a_.__.F___.形.N___a___成[______过_N..B___a..r__程[_+__][___:_-..F___...S.___..]___]__-_2___M-__;Ng__a2__++[______..F__..__]__;-。
电荷数即可,如Na+、Mg2+等;书写简单阴离子时,要在
元素符号周围标出最外层电子,用“[ ]”括起来,并
..
..
.. ..
.. ..
在右上角注明所带电荷数,如[ C.l. ]-、[ .O. ]2-等。
(3)用电子式表示下列化合物的形成过程。
..
..
CaCl2: K2S:
..
[ ..
..
K+[ .S. ] 2-K+
成键微粒:⑥_阴__离__子__和⑦_阳__离__子___。 成键性质:⑧_静__电__作__用___。
成键原因: ①原子间相互得失电子形成稳定的阴阳离子; ②离子间引力与斥力处于平衡状态。 (3)由离子键构成的化合物叫作⑨_离__子__化合物。通常,⑩ _活__泼__金__属__和 _活___泼__非__金__属__之间易形成离子化合物。
2 阴离子电子式:阴离子的最外层大多为8电子结构,在 阴离子符号的周围标出其最外层的8个电子(H-为2个电
子数)及,外符加号方。括如号Cl,-的再电在子方式括为号[外的.C..l.右] -上。角标明所带电荷
.. ..
3
[..Leabharlann .. C.l...
]
-
[
..
.. .S.
..
]2-
[
.. ..
.. .S.
N: _______ O: ________F: ________
基础学习交流
1 “离子键就是阴阳离子之间的吸引力”,这种说法正 确吗?说明理由。 不正确;离子键是阴阳离子之间的静电作用,该作 用力不仅只是阴阳离子之间的吸引力,还包括电子 与电子、原子核与原子核之间的排斥力。
2 镁原子的电子式:•Mg×,这种书写方式是否正确?说明理 由。
.
..
.
.
总体评价与反思 思维导图构建
谢谢!
化学
每个人都会有自己的特长。一个人做某些事 其他事做的更好。但许多人从未找到最适合 的事情,其根本原因往往是他们没有进行足 思考。如果你对一切都随遇而安,那总是会 天你会后悔莫及的。心,只有一颗,不要装 多。人,只有一生,不要追逐的太累。心灵 悦,来自精神的富有;简单的快乐,来自心 知足。家,很平淡,只要每天都能看见亲人 脸,就是幸福的展现。爱,很简单,只要每 会彼此挂念,就是踏实的温暖。幸福并不缥 在于心的感受。爱并不遥远,在于两心知的
2 下表中元素的原子间相互作用可以形成离子键的是( A )。
元素
abcdefg
原子的M层电子数 1 2 3 4 5 6 7
A.b和g B.a和c C.d和g D.e和f
3 书写下列化合物的电子式:
.. .. .. .. .. ..
(1)CaO
Ca2+ [
.. .O.
]2-
;
(2)MgCl2
[
.. C.l.
不正确;同种原子的电子式不能同时用“•”和 “×”表示。
第二层级 思维探究与创新 重难点探究
离子化合物电子式的书写
互动探究
(1)举例说明如何书写原子的电子式。
..
探究拓展
(2)阳离子的电子式怎样书写?阴离子的电子式又如何书写?
书写离子的电子式时,简单阳离子是原子失去最外层
电子后形成的,只写其元素符号,并在右上角注明所带
第一层级 知识记忆与理解
知识体系梳理
1 离子键及离子化合物
(1)钠与氯气反应时,钠原子最外层的①_1_个电子转移到 氯原子的最外电子层上,钠原子变成钠离子,钠离子最外 层有②_8_个电子,氯原子变成氯离子,氯离子最外层有③ _8_个电子, 钠离子与氯离子之间通过静电作用,形成稳定 的化合物——氯化钠。 (2)带相反电荷的④_阴__阳__离__子__之间,通过⑤_静__电___作用结 合在一起,这种作用力称之为离子键。
]2-
4 用电子式表示离子化合物的形成过程: ①用“ ”不用“ ”; ②“ ”左边是反应物原子的电子式,相同的原子可以 合并;右边是生成的离子化合物的电子式。 二、离子键的三个“一定”和两个“不一定” 三个“一定”:①离子化合物中一定含有离子键;②含有离 子键的物质一定是离子化合物;③离子化合物中一定有阴离 子和阳离子。 两个“不一定”:①离子化合物中不一定含有金属元素,如 氯化铵、硝酸铵等;②含有金属元素的化合物不一定是离子 化合物,如氯化铝等。
2 电子式 (1)在元素符号周围用“·”或“×”来表示原子的 __最__外__层__电__子__,这种式子叫作电子式。 电子排布的形式一般在元素符号的上、下、左、右四 个方位,每个方位不超过2个电子。 (2)写出下列原子的电子式:
Na: _N_a_·_ Mg: ·__M_g_·_ Al: _____ C: _____
