电解原理优质课精品PPT课件
合集下载
电解原理课件(30张)

电解原理课件(30张)
电解原理课件(30张)
2
电解原理课件(30张)
考点突破
电解原理课件(30张)
电极反应式、电解总反应式的书写★★★★
• 1. (2019·四川成都质检)用右图所示装置除去含CN-、Cl-废水中的CN- 时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的 气体,下列说法不正确的是( )
通HCl
加CuO
电解原理课件(30张)
电解原理课件(30张)
【思维深化】
• 1.判断正误(正确的画“√”,错误的画“×”)。 • (1)任何化学反应都可以设计成电解池反应( ) • (2)电解质溶液的导电过程就是电解质溶液被电解的过程( ) • (3)某些不能自发进行的氧化还原反应,通过电解可以实现( ) • ((4)电解) CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝 • (5)电解盐酸、硫酸等溶液,H+放电,溶液的pH均逐渐增大( ) • (6)电解时,电解液中阳离子移向阳极,发生还原反应( )
(如Na2SO4)
电解质 浓度 增大
增大
增大
pH
电解质溶 液复原
增大 加水
减小 加水
不变 加水
电解原理课件(30张)
电解原理课件(30张)
类型
电解 电解 质型
放H2 生碱型 放O2 生酸型
电极反应特点
电解质电离出的阴、 阳离子分别在两极放 电
阴极:H2O放H2生成 碱;阳极:电解质阴 离子放电 阴极:电解质阳离子 放电;阳极:H2O放 O2生成酸
电解原理课件(30张)
电解原理课件(30张)
阳极反应
阴极反应
• 2.写出下列相关的电极反应方方程式程式或总反方应程方式程式。
电解原理课件(30张)
2
电解原理课件(30张)
考点突破
电解原理课件(30张)
电极反应式、电解总反应式的书写★★★★
• 1. (2019·四川成都质检)用右图所示装置除去含CN-、Cl-废水中的CN- 时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的 气体,下列说法不正确的是( )
通HCl
加CuO
电解原理课件(30张)
电解原理课件(30张)
【思维深化】
• 1.判断正误(正确的画“√”,错误的画“×”)。 • (1)任何化学反应都可以设计成电解池反应( ) • (2)电解质溶液的导电过程就是电解质溶液被电解的过程( ) • (3)某些不能自发进行的氧化还原反应,通过电解可以实现( ) • ((4)电解) CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝 • (5)电解盐酸、硫酸等溶液,H+放电,溶液的pH均逐渐增大( ) • (6)电解时,电解液中阳离子移向阳极,发生还原反应( )
(如Na2SO4)
电解质 浓度 增大
增大
增大
pH
电解质溶 液复原
增大 加水
减小 加水
不变 加水
电解原理课件(30张)
电解原理课件(30张)
类型
电解 电解 质型
放H2 生碱型 放O2 生酸型
电极反应特点
电解质电离出的阴、 阳离子分别在两极放 电
阴极:H2O放H2生成 碱;阳极:电解质阴 离子放电 阴极:电解质阳离子 放电;阳极:H2O放 O2生成酸
电解原理课件(30张)
电解原理课件(30张)
阳极反应
阴极反应
• 2.写出下列相关的电极反应方方程式程式或总反方应程方式程式。
人教教材《电解原理》完美课件1

化锰重新被利用,提高原料的利用率;
④比色分光光度计可以用于测量化学反应速率
d.选择高效催化剂只能改变化学反应速率,但不影响化学平衡;
故答案为B。
D.向含氯化铝的氯化镁溶液中加入氧化镁,离子方程式为2Al3++3MgO+3H2O═2Al(OH)3↓+3Mg2+,故D错误;
A. 4种
B. 8种
C. 16种
失电子能力:(还原性) Cl- > OH得电子能力:(氧化性) Cu2+ > H+
当溶液中有多种离子时,哪种离子先放电? 离子得失电子的能力强的先放电
三、放电顺序
阴极:阴极上放电的总是溶液中的阳离子,与电极材料无关。 得电子能力(氧化性)强的离子先放电。
Ag+>Fe3+>Cu2+>H+酸>Pb2+>Sn2+ >Fe2+>Zn2+>H+水>Al3+>Mg2+>…>K+
阳极: 2Cl--2e-===C;l2↑ 阴极: Mg2++2e-===M。g
电解方程式:
。
【解析】 B.置换反应有单质参与,元素的化合价一定发生变化,属于氧化还原反应,故B错误; 答案选B。 B. C + O2 = CO2 ΔH=-393kJ·molˉ1 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 A.冰醋酸和水银都是纯净物 D.NH3极易溶于水,若溶液中含有少量的NH4+,滴加稀NaOH溶液不会放出NH3,检验NH4+的正确操作:向原溶液中滴加几滴浓NaOH溶液,加热,将湿润的红色石蕊试纸置 于试管口,若试纸变蓝则证明存在NH4+,故D错误; B.Cu2+为有色离子,不满足溶液无色的条件,故B错误; C.砖瓦、陶瓷、渣土、普通一次性电池、鱼骨等属于其他垃圾 ②A2++C═C2++A,反应中A元素化合价+2价变化为0价,化合价降低做氧化剂被还原得到还原产物A,C元素化合价0价变化为+2价,化合价升高做还原剂被氧化生成氧化产物C2+ ,得到氧化性A2+>C2+;还原性C>A; B. 向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓ 故选C。
【人教版】电解原理PPT优秀课件1

思考
例.6以惰性电极电解NaCl溶液
电极方程式
阳离子:
添加标题
点击文本框即可进行编辑输入相
阴离子: 关内容点击文本框即可进行编辑
输入相关内容
阴极: 阳极:
总方程式:
添加标题
点关击内1文容.本点电框击即文解可本进框行即一编可辑进段输行入编时相辑 间,溶液的PH发生了什么变化?
输入相关内容
2.若要恢复原来的状态,应加入适量的什么物质?
阳极:2Cl--2e-=Cl2
参考文献
电解 Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean
总方程式:CuCl2 commodo ligula eget dolor. Lorem ipsum dolor sit amet, Lorem ipsum
阴极: 2H++2e-=H2 或:
2NH4++2H2O+2e-=H2+2NH3·H2O
阳极: 2Cl--2e-=Cl2
NH4Cl溶液
KEY WORD
总方程式:2NH4ClKE+Y2WHO2ROD 电解 H2+ 2NH3·H2O+Cl2
1.电解一段时间,溶液的PH发生了什么变化?
变大
2.若要恢复原来的状态,应加入适量的什么物质? HCl
【人教版】电解原理PPT优秀课件1
【人教版】电解原理PPT优秀课件1
例.6以惰性电极电解NaCl溶液
电极方程式
阳离子:Na+KEYHW + ORD 阴离子:Cl- OH-
阳阴极极::或22C2HlH+-+2-O22+ee2--=e=-C=HlH222+2OH-
高一化学电解原理PPT优秀课件

CuCl2 HgCl2 电解质
HCl HBr
NaCl KBr CuSO4 AgNO3
H2O+电解 质
不定
增大 HCl、HBr
HCl、HBr CuO、Ag2O
⑵电极参加反应(金属做阳极(除 Pt 外)):
例:金属作阳极时,金属失电子,而不
是阴离子失电子。
在阳极,Cu 失电子能力大于 SO42-、OH-, Cu
C
因此电极 Cu 首先失电子: 阳极反应:Cu-2e-=Cu2+
OH—H+
阴极反应:2H++2e-=H2, 总反应:Cu+2H+ 电解 Cu2++H2,
从总反应看出不活泼的 Cu 将较活泼 H
SO42—
H2SO4
置换出来,
不符合金属活动顺序表,因此化学反应能不能发生没有严格界
限,不能自发进行的反应,提供能量(如电解)也能进行。
2. 电解:
使直流电通过电解质溶液而在阴、阳两 极引起氧化还原反应的过程,叫做电解。
3. 构成电解池的条件:
①直流电源;
是电能转变为化 学能的装置!
与电源负极相连的电极为阴极 ②阴、阳电极
与电源正极相连的电极为阳极
③电解质溶液或熔融电解质;
电解原理工作示意图
阳离子得 电子发生 还原反应
阴极
-+
e
负极
正极
得到电 子还原 反应
阳离子得 电子发生 还原反应
电解质溶液
阴极
-+ e
阳极
电极材料或阴 离子失电子发
生氧化反应
电解质溶液
氯碱工业
一、电解饱和食盐水反应原理: 装置
现象:
【人教版】电解原理优质ppt课件

举一反三 若在铜片上镀银时,又该如何设计?
?
铜片
-+
? 纯银
硝酸银
?溶液
应用3:粗铜的精炼 已知粗铜 含杂质(Zn Fe Ni Ag Au 等),分别写出阴、阳极可能发生的电极方程式
纯Cu
粗Cu
硫酸铜溶液
阳极:
Zn Zn - 2e- = Zn2+ Fe Fe - 2e- = Fe2+ Ni Ni - 2e- = Ni2+ Cu Cu - 2e- = Cu2+ Ag
阳极(纯铜)溶解, 阴极铁棒表面有红色物质生成 思考:溶液中的Cu2+浓度如何变化?
应用2、电镀
概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。 主要目的:使金属增强抗腐蚀能力,增加美观和表面硬度。
待镀 金属
-+
镀层 金属
含镀层金属离子的盐溶液 电镀的特点:阳极金属本身参加电极反应;电解质溶液的浓度保持不变
冰晶石 B.小苏打溶液呈碱性的原因: +H2O⇌H3O++
C.氯化铵、次氯酸都属于强电解质
2.一种新型的二次电池锌—空气燃料电池,以KOH溶液为电解液,放电时的总反应为:2Zn+O2+4OH-+2H2O=2Zn(OH) 。关于该装置的说法正确的是
A.Na2SO4 B.H2SO4 C.KOH
D.NaCl
5
5
2
2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
NaCl (高温熔融)-->Na+ + Cl-
阳极:2 Na++2e- = 2Na 阴极:2 Cl--2e- = Cl2↑
电解的原理-PPT课件

极
发生什么变化?
ClNa+
熔融氯化钠
3
(-)铁电极 (阴极) Na++e- →Na 还原反应
(+)石墨电极(阳极)2Cl-→ Cl2↑+2e- 氧化反应
通电
石
墨 电
Cl2
极
极铁 电
2NaCl = 2Na+Cl2↑
电解池的组成
直流电源
Cl
Cl
固体电极材料
Na
熔融电解质或电解质溶液
Na
发生氧化反应的电极叫阳极,发
10
小结
1.电解---在直流电的作用下,电解质在两个电 极上分别发生氧化反应和还原反应的过程
2.电极反应---半反应
3.正极---阳极---氧化反应
阴离子
阳离子
负极---阴极---还原反应
4.电解池---将电能转化为化学能的装置 5.电离与电解的区别与联系
11
作业
结合电解的原理预习电解原理的应用
电通离电过前程 NaCl= Na+ + ClH2O H+ + OH-
电源负极相连--- 阴极
阳极---电源正极相连
电通解电过后程
2H++2e-→H2↑ 2Cl-→Cl2↑+2e-
还原反应 氧化反应
8
大家学习辛苦了,还是要坚持
继续保持安静
9
通电
2NaCl+2H2O = 2NaOH+H2↑+Cl2↑
电解的原理
1
钠和氯气的反应
热化方程式:
2Na(s)+Cl2(g)=2NaCl(s)
△H(298K)=-822.3KJ.mol-1
课件1:4.3.1 电解原理PPT20张

阴极: 2H ++ 2e- ===H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
阴极
氢 气
浓度
pH值
复原
减小
增
加
大
HCl
课件1:4.3.1 电解原理PPT20张
4.放氧生酸型
阳极
阴极
实例
氧 气
CuSO4溶液
电极反应
CuSO4
阳极: 4OH- - 4e- === 2H2O+O2↑
A.X是正极,Y是负极
B.X是负极,Y是正极
AC
C.CuSO4溶液的pH值 逐渐减小
D.CuSO4溶液的pH值 不变
•X Y •
Pt
Cu
a
b
CuSO4溶液
NaCl和酚酞溶液
课件1:4.3.1 电解原理PPT20张
Office
Type : Image
Type : Image
Type : Image
Type : Image
总式:
2NaCl
电解 2Na+Cl2 ↑
课件1:4.3.1 电解原理PPT20张
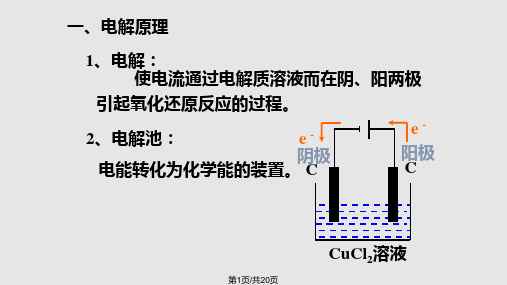
电解:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。
电解池:借助氧化还原反应,把电能转化为化学能的装置。
★构成条件: (1)外加直流电源 (2)与电源相连的两个电极: 接电源正极的为阳极,发生氧化反应 接电源负极的为阴极,发生还原反应 (3)电解质溶液或熔化的电解质
课件1:4.3.1 电解原理PPT20张
ቤተ መጻሕፍቲ ባይዱ
2.用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
电解原理PPT课件
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= 总反应:2HCl=电=解
H2 ↑ Cl2↑
+
H2↑
第7页/共20页
7、电解规律(用惰性电极电解时) ⑶、电解不活泼金属的含氧酸盐时,电解质和水都 有一部分被电解,如电解CuSO4溶液、AgNO3溶液 等。 电解CuSO4溶液
阳极 : 4OH--4e-=2H2O +O2↑ 阴极: 2Cu2+ +4e-=2Cu 总反应: 2CuSO4 +2H2O电=解 2Cu+O2↑ +2H2SO4
阴极区
PH值变化 电极反应式
有H+生成, PH值减小
①
有OH-减少, PH减小
②
有H+生成, PH值减小
②
/
②
有H+生成, PH值减小
Cu2++2e=Cu
PH值变化
有H+减少, PH值增大 有OH-生成, PH值增大 有OH-生成, PH值增大 有OH-生成, PH值增大
/
第11页/共20页
电解过程中会出现两极区的PH值差异,某些原电 池工作时也会出现两极PH值的不平衡性,当然这 与H2与O2参加电极反应有关:
阴极上的电极反应式是 Cu2+ +2e-=Cu
。
第19页/共20页
感谢观看!
第20页/共20页
第9页/共20页
8.电解后溶液PH值的变化
H+只可能在阴极放电,OH-只可能在阳极放电,对于非酸、 非碱溶液来说,放电的H+来自于阴极区的水的电离,放电 的OH-来自于阳极区水的电离。所以有:
⑴H+总是在阴极放电,OH-总是在阴极上生成 ① 2 H++2e-=H2↑ ② 2H2O+2e-= H2↑+2 OH- 电解过程中,阴极区PH值会因H+减少或OH-生成而增大; ⑵OH-总是在阳极上放电,H+总是在阳极上生成 ③ 4 OH--4e-=2H2O+O2↑ ④ 2H2O-4e-=4H++O2↑ 电解过程中,阳极区的PH值会因OH-减少或H+的生成而减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.电解规律(用惰性电极电解时)
b、电解无氧酸溶液(氢氟酸除外)、不活泼金属 的无氧酸盐溶液时,实质上是电解质本身被 电解。如电解盐酸、CuCl2溶液等。电解后 溶液中溶质的质量分数减小,若要恢复原来 的组成和浓度,需加入一定量的溶质(通入一 定量的HCl气体)
c、电解不活泼金属的含氧酸盐时,实质是电 解质和水都有一部分被电解。如电解CuSO4 溶液、AgNO3溶液等。电解后原溶液中溶质 的质量分数减小,若要恢复原来的组成和浓 度,需加入一定量金属氧化物。
负极: 较活泼金属
正极: 较不活泼金属或非金属
4、原电池电极反应式
负极 (Zn):Zn-2e-=Zn2+
(氧化反应)
e-
Zn
e- C
正极 (C): Cu2+ +2e-=Cu (还原反应)
CuSO4溶液
电解氯化铜溶液微观模拟
一、电解原理 1、电解:
使电流通过电解质溶液而在阴、阳两极 引起氧化还原反应的过程。
2、电解池(电解槽):
将电能转化为化学能的装置
电解氯化铜溶液微观模拟
3、电解池中的电子的移动方向
• 电源负极→电解池阴极→电解液中的阳 离子得到电子被还原
电解池中阴离子失去电子被氧化→电解 池阳极→电源正极
由上面分析可知:电解质溶液的导电过程必 须有阴阳离子的参与,如果溶液中的离子不参 加反应,电路就不能形成通路,所以电解质溶 液的导电过程实质上就是电解质溶液的电解过 程。
4、离子的放电顺序:(放电是指阴阳离子得失电 子的过程)
(1)在惰性电极的阴极上,阳离子放电顺序:
Au3+、Ag+、Hg2+、Cu2+、H+、Fe2+、Zn2+、Al3+、Mg2+
放电由易到难 (2)在惰性电极的阳极上,阴离子放电顺序:
S2—、I—、Br—、Cl—、OH—、NO3—、SO42—、F—
放电由易到难
电解氯化铜溶液的电极方程式
阳极:2Cl— - 2e— = Cl2↑ 阴极:Cu2+ + 2e— = Cu 总反应: CuCl2 =电=解 Cu + Cl2↑
二、电解规律的讨论:(用惰性电极电解时)
C或Pt
C或Pt
⑴、电解含氧酸、强碱溶液、活泼金属的含氧酸盐 溶液时,实质上是电解水。如电解H2SO4、HNO3 NaOH、Na2SO4等溶液时,其电极反应式为:
电解CuSO4溶液:
阳极 : 4OH--4e-=2H2O +O2↑ 阴极: 2Cu2+ +4e-=2Cu 总反应: 2CuSO4 +2H2O电=解 2Cu+O2↑ +2H2SO4
电解后原溶液中溶质的质量分数减小,若要恢 复原来的组成和浓度,需加入一定量金属氧化物。
⑷、电解活泼金属的无氧酸盐溶液时,实质上就 是电解质和水都有一部分被电解,如电解NaCl溶 液等。
小结二:电解原理
1.电解原理:将电能转化为化学能的装置。
2.电解池中电子的移动方向
电源负极→电解池阴极→电解液中的阳离 子(被还原)
电解池中阴离子(被氧化)→电解池阳极 →电源正极
3.电解规律(用惰性电极电解时)
a、电解含氧酸、强碱溶液、活泼金属的含氧酸 盐溶液时,实质上是电解水。如电解H2SO4、 HNO3、NaOH、Na2SO4等溶液等。电解后溶 液中溶质的质量分数增大,若要恢复原来的 浓度,只需加入一定量的水即可。
电解盐酸
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= 总反应:2HCl=电=解
H2 ↑ Cl2↑
+
H2↑
电解后溶液中溶质的质量分数减小,若要恢复 原来的组成和浓度,需加入一定量的溶质(通入一 定量的HCl气体)
⑶、电解不活泼金属的含氧酸盐时,实质上就是 电解质和水都有一部分被电解,如电解CuSO4溶 液、AgNO3溶液等。
实例
电极反应
含氧酸
电
强碱
解 水
活泼金属的 含氧酸盐
电解 电解 质
无氧酸
不活泼金属 的无氧酸盐
H2SO4 NaOH
Na2SO4
阳极:4OH—-4e— =O2↑+2H2O
阴极:4H++4e—=2H2↑
HCl
阳极:2Cl—-2e—=Cl2↑ 阴极:2H++2e—=H2↑
CuCl2
阳极:2Cl—-2e—=Cl2↑ 阴极:Cu2++2e—=Cu
阳极 : 4OH--4e-=2H2O +O2↑ 阴极: 4H+ +4e-=2H2 ↑ 总反应:2H2O=电=解 O2↑ +2H2↑
电解后溶液中溶质的质量分数增大,若要恢复 原来的浓度,只需加入一定量的水即可。
⑵、电解无氧酸溶液(氢氟酸除外)、不活泼金属的 无氧酸盐溶液时,实质上是电解质本身被电解。 如电解盐酸、CuCl2溶液等时
AgNO3
小结一:原电池与电解池的比较:
电解池
原电池
能量转换 电能转化为化学能
化学能转化为电能
离子的迁移方 阴离子向阳极迁移
向
阳离子向阴极迁移
阴离子向负极迁移 阳离子向正极迁移
发生氧化反应 的电极
阳极(接电源正极)
负极
发生还原反应 的电极
阴极(接电源负极)
正极
相同点 (从原理分析) 都氧化还原反应
阳极 (C): 2Cl -- 2e-=Cl2↑ 阴极 (C): 2H+ +2e-= H2 ↑ 总反应:2NaCl+2H2O=电=解 2NaOH+ Cl2↑ + H2↑
电解后原溶液中溶质的质量分数减小,若要恢 复原来的组成和浓度,需通入一定量的HCl。
电解质溶液用惰性电极电解的规律
电解 类型
举例
物质类别
变 小
增大 放出H2生
成碱
变 小
减小 放出O2生
成酸
变 小
CuCl2 HCl CuO
四、活性电极电解时电极反应的书写
活性电极:除铂、金、石墨以外的电极。 若活性电极为阴极也只起导体的作用 若为阳极,则发生氧化反应的往往是电极本身。
例:
阳极: Ag - e- = Ag+
阴极: Ag+ + e- = Ag
第四单元 电解原理及应用
第一节 电解原理
新校区景观
复习:
1、原电池
想一想:下图装置 的名称是什么?
将化学能转变为电能的装置。
e-
e-
Zn
C
CuSO4溶液
2、构成原电池的条件: e-
e-
⑴、具有活性不同两电极 Zn
C
⑵、具有电解质溶液
⑶、形成闭合回路 (4)能自发进行氧化还原反应 CuSO4溶液
3、原电池电极的判断
溶质
和水 同时 电解
活泼金属的 无氧酸盐
不活泼金属的 含氧酸盐
NaCl CuSO4
阳极:2Cl—-2e—=Cl2↑ 阴极:2H++2e—=H2↑
阳极:4OH—-4e— =O2↑+2H2O
阴极:2Cu2++4e—=2Cu
溶液变化
PH
C浓度
减小 增大
增大 增大
不变
增大
溶液 复原
H2O
增大
减小 HCl
增大
